Лекция 22_2014 (карбанионы).ppt
- Количество слайдов: 26
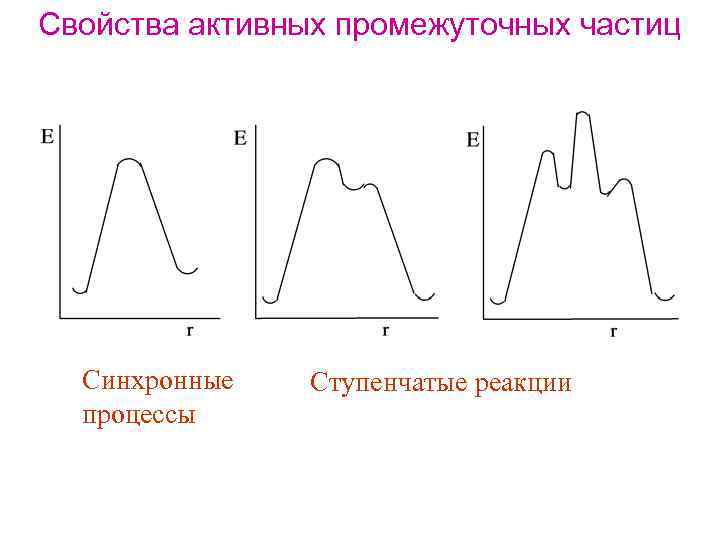 Свойства активных промежуточных частиц Синхронные процессы Ступенчатые реакции
Свойства активных промежуточных частиц Синхронные процессы Ступенчатые реакции
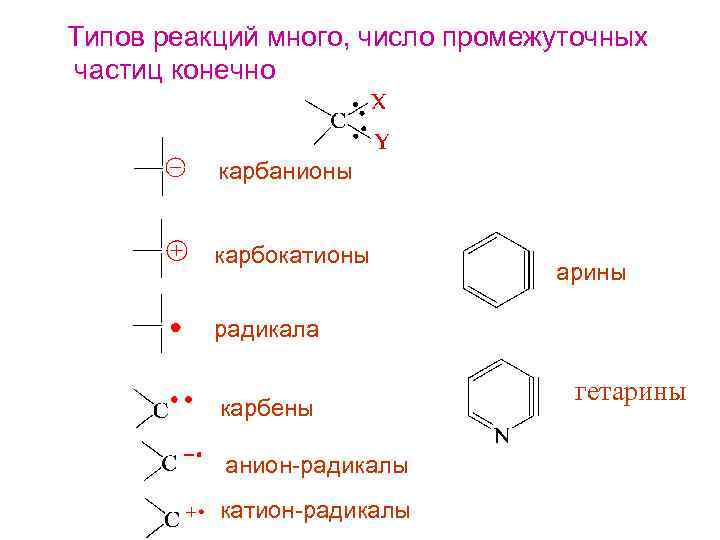 Типов реакций много, число промежуточных частиц конечно карбанионы карбокатионы арины радикала карбены анион-радикалы катион-радикалы гетарины
Типов реакций много, число промежуточных частиц конечно карбанионы карбокатионы арины радикала карбены анион-радикалы катион-радикалы гетарины
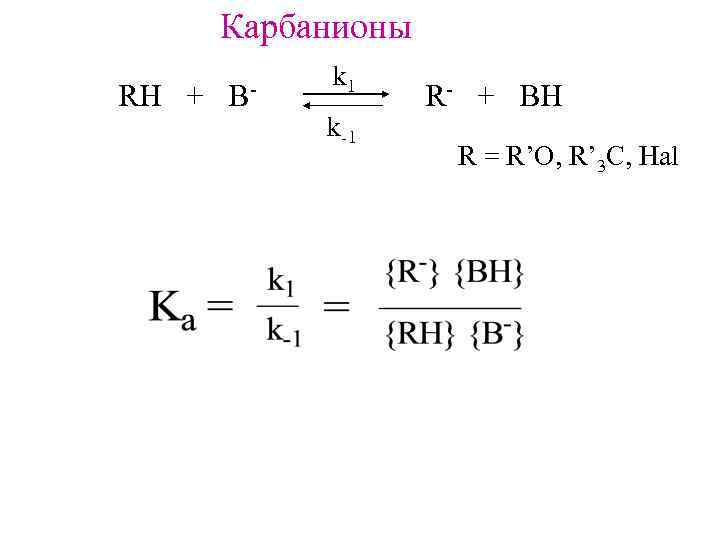 Карбанионы RH + B- k 1 k-1 R- + BH R = R’O, R’ 3 C, Hal
Карбанионы RH + B- k 1 k-1 R- + BH R = R’O, R’ 3 C, Hal
 Кислотность в газовой фазе Кебарле, 1976 г. (ион-циклотронный резонанс) = мера кислотности энергия связи R-H cродство к электрону радикала R.
Кислотность в газовой фазе Кебарле, 1976 г. (ион-циклотронный резонанс) = мера кислотности энергия связи R-H cродство к электрону радикала R.
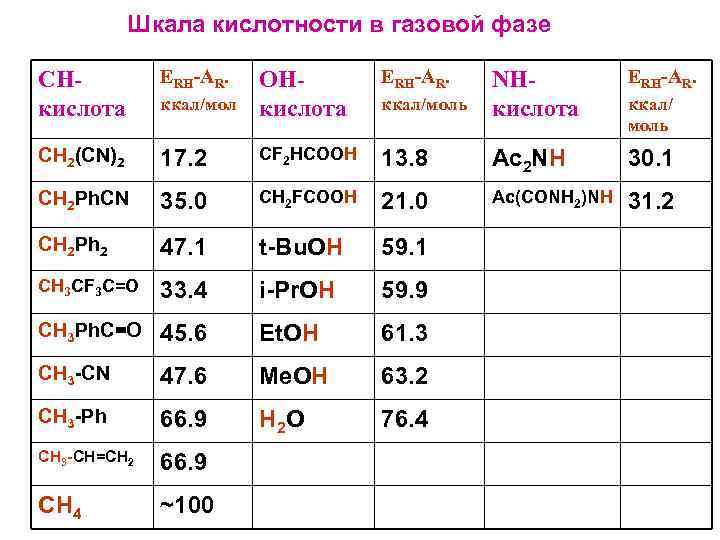 Шкала кислотности в газовой фазе CНкислота ERH-AR. ккал/мол ОНкислота ERH-AR. ккал/моль NНкислота CH 2(CN)2 17. 2 CF 2 HCOOH 13. 8 Ac 2 NH 30. 1 CH 2 Ph. CN 35. 0 CH 2 FCOOH 21. 0 Ac(CONH 2)NH 31. 2 CH 2 Ph 2 47. 1 t-Bu. OH 59. 1 CH 3 CF 3 C=O 33. 4 i-Pr. OH 59. 9 CH 3 Ph. C=O 45. 6 Et. OH 61. 3 CH 3 -CN 47. 6 Me. OH 63. 2 CH 3 -Ph 66. 9 H 2 O 76. 4 CH 3 -CH=CH 2 66. 9 CH 4 ~100 ккал/ моль
Шкала кислотности в газовой фазе CНкислота ERH-AR. ккал/мол ОНкислота ERH-AR. ккал/моль NНкислота CH 2(CN)2 17. 2 CF 2 HCOOH 13. 8 Ac 2 NH 30. 1 CH 2 Ph. CN 35. 0 CH 2 FCOOH 21. 0 Ac(CONH 2)NH 31. 2 CH 2 Ph 2 47. 1 t-Bu. OH 59. 1 CH 3 CF 3 C=O 33. 4 i-Pr. OH 59. 9 CH 3 Ph. C=O 45. 6 Et. OH 61. 3 CH 3 -CN 47. 6 Me. OH 63. 2 CH 3 -Ph 66. 9 H 2 O 76. 4 CH 3 -CH=CH 2 66. 9 CH 4 ~100 ккал/ моль
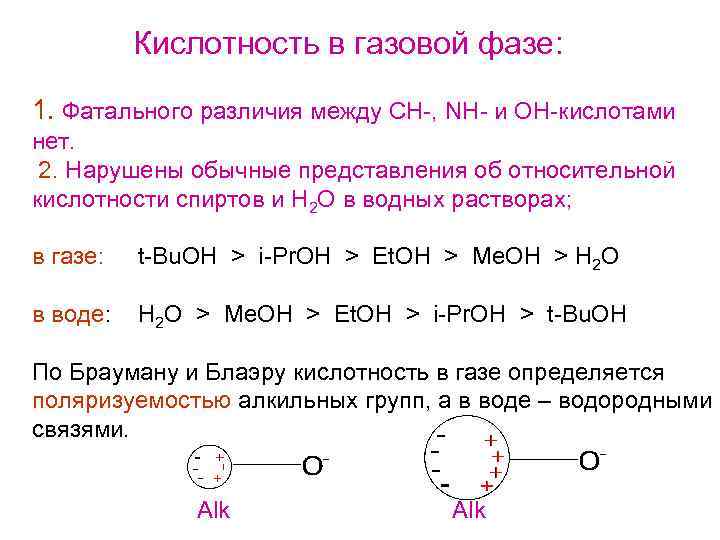 Кислотность в газовой фазе: 1. Фатального различия между СН-, NH- и OH-кислотами нет. 2. Нарушены обычные представления об относительной кислотности спиртов и H 2 O в водных растворах; в газе: t-Bu. OH > i-Pr. OH > Et. OH > Me. OH > H 2 O в воде: H 2 O > Me. OH > Et. OH > i-Pr. OH > t-Bu. OH По Брауману и Блаэру кислотность в газе определяется поляризуемостью алкильных групп, а в воде – водородными связями. Alk
Кислотность в газовой фазе: 1. Фатального различия между СН-, NH- и OH-кислотами нет. 2. Нарушены обычные представления об относительной кислотности спиртов и H 2 O в водных растворах; в газе: t-Bu. OH > i-Pr. OH > Et. OH > Me. OH > H 2 O в воде: H 2 O > Me. OH > Et. OH > i-Pr. OH > t-Bu. OH По Брауману и Блаэру кислотность в газе определяется поляризуемостью алкильных групп, а в воде – водородными связями. Alk
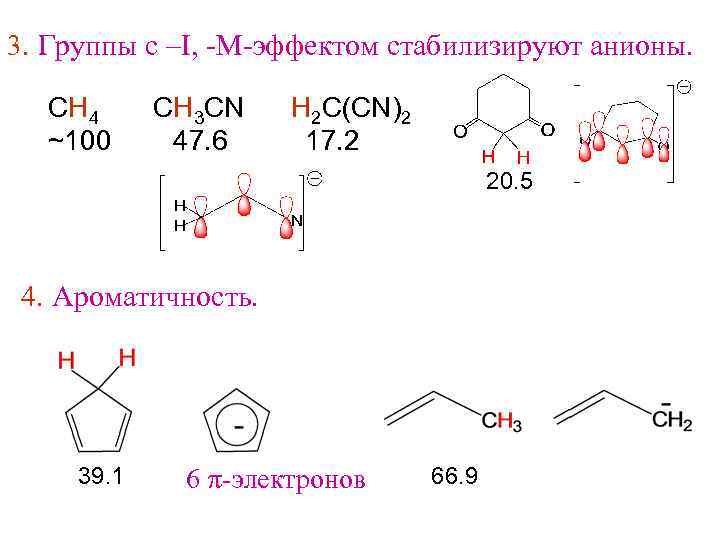 3. Группы с –I, -M-эффектом стабилизируют анионы. СН 4 ~100 СH 3 CN 47. 6 H 2 C(CN)2 17. 2 20. 5 4. Ароматичность. 39. 1 6 p-электронов 66. 9
3. Группы с –I, -M-эффектом стабилизируют анионы. СН 4 ~100 СH 3 CN 47. 6 H 2 C(CN)2 17. 2 20. 5 4. Ароматичность. 39. 1 6 p-электронов 66. 9
 Расчет QCISDT/6– 31 G∗ энергии cтабилизации XCH 2 - (ккал/моль) X Eстаб. F 10. 2 SH 20. 5 Cl 19. 4 PH 2 22. 2 OH 5. 7 NH 2 0. 5 Me 3. 0 Si. H 3 24. 8 Эффект поляризуемости и электроотрицательности (J. Comput. Chem. 1994, 596)
Расчет QCISDT/6– 31 G∗ энергии cтабилизации XCH 2 - (ккал/моль) X Eстаб. F 10. 2 SH 20. 5 Cl 19. 4 PH 2 22. 2 OH 5. 7 NH 2 0. 5 Me 3. 0 Si. H 3 24. 8 Эффект поляризуемости и электроотрицательности (J. Comput. Chem. 1994, 596)
 Кислотность в растворах Равновесная кислотность: RH R - + H+ Методы: спектрофотометрия, ЯМР, ИКС и др. Предел чувствительности: ? PKa < 20
Кислотность в растворах Равновесная кислотность: RH R - + H+ Методы: спектрофотометрия, ЯМР, ИКС и др. Предел чувствительности: ? PKa < 20
 Ступенчатый метод Мак-Ивен, 1936 г. DPKa < 2
Ступенчатый метод Мак-Ивен, 1936 г. DPKa < 2
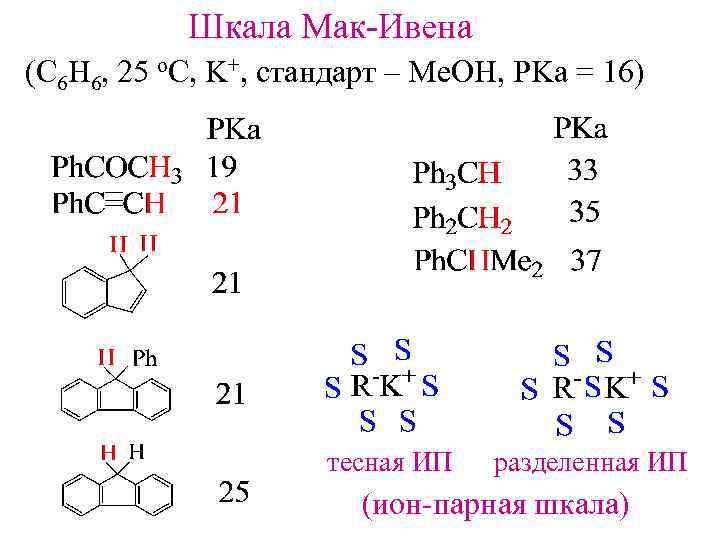 Шкала Мак-Ивена (C 6 H 6, 25 o. C, K+, стандарт – Me. OH, PKa = 16) тесная ИП разделенная ИП (ион-парная шкала)
Шкала Мак-Ивена (C 6 H 6, 25 o. C, K+, стандарт – Me. OH, PKa = 16) тесная ИП разделенная ИП (ион-парная шкала)
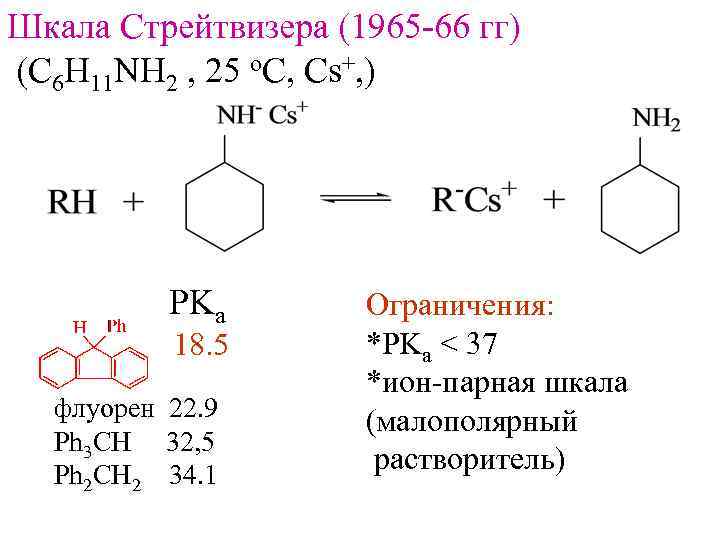 Шкала Стрейтвизера (1965 -66 гг) (C 6 H 11 NH 2 , 25 o. C, Cs+, ) PKa 18. 5 флуорен 22. 9 Ph 3 CH 32, 5 Ph 2 CH 2 34. 1 Ограничения: *PKa < 37 *ион-парная шкала (малополярный растворитель)
Шкала Стрейтвизера (1965 -66 гг) (C 6 H 11 NH 2 , 25 o. C, Cs+, ) PKa 18. 5 флуорен 22. 9 Ph 3 CH 32, 5 Ph 2 CH 2 34. 1 Ограничения: *PKa < 37 *ион-парная шкала (малополярный растворитель)
 Соотношение Бренстеда lgka = a lg. Ka + b ka – константа скорости Ka – константа равновесия Кинетическая шкала кислотности – не прямые измерения
Соотношение Бренстеда lgka = a lg. Ka + b ka – константа скорости Ka – константа равновесия Кинетическая шкала кислотности – не прямые измерения
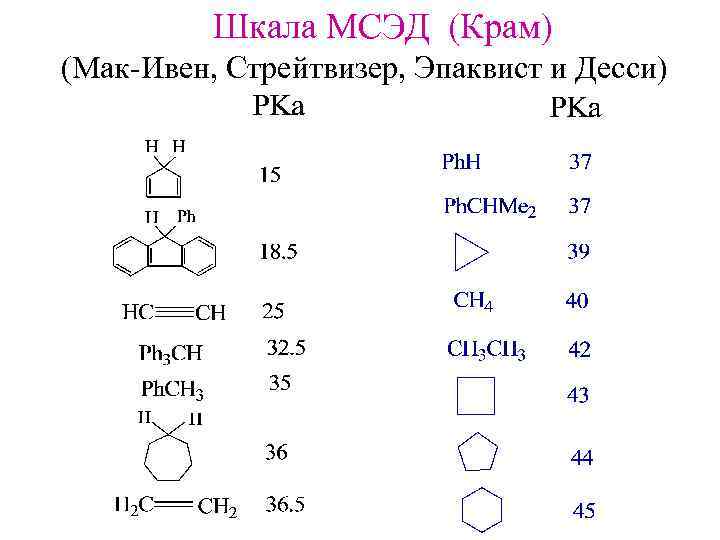 Шкала МСЭД (Крам) (Мак-Ивен, Стрейтвизер, Эпаквист и Десси)
Шкала МСЭД (Крам) (Мак-Ивен, Стрейтвизер, Эпаквист и Десси)
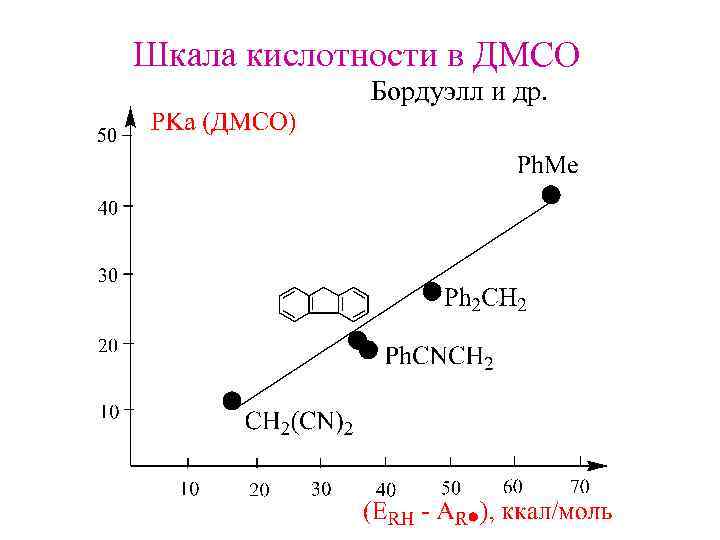 Шкала кислотности в ДМСО Бордуэлл и др.
Шкала кислотности в ДМСО Бордуэлл и др.
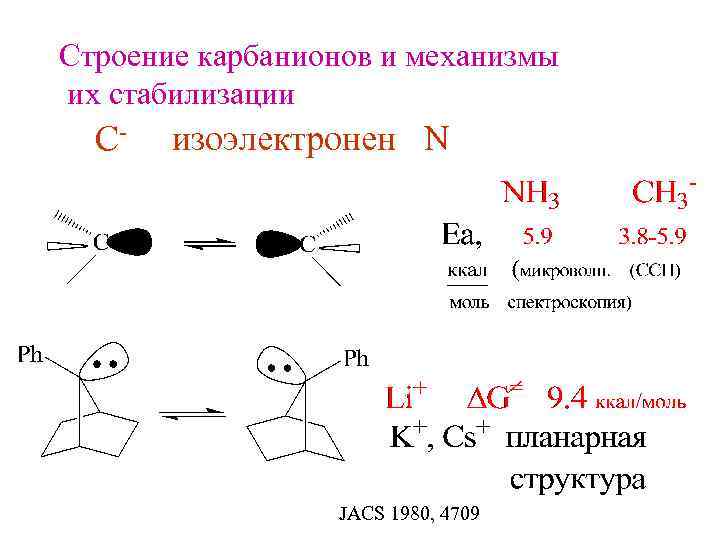 Строение карбанионов и механизмы их стабилизации С- изоэлектронен N JACS 1980, 4709
Строение карбанионов и механизмы их стабилизации С- изоэлектронен N JACS 1980, 4709
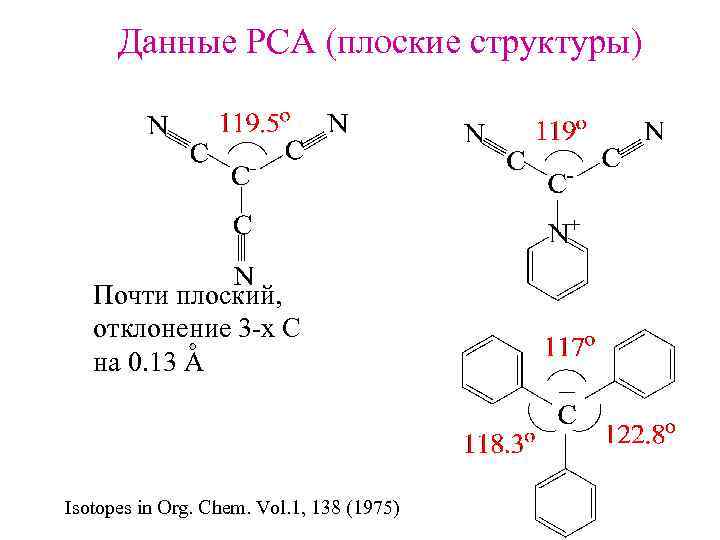 Данные РСА (плоские структуры) Почти плоский, отклонение 3 -х С на 0. 13 А Isotopes in Org. Chem. Vol. 1, 138 (1975)
Данные РСА (плоские структуры) Почти плоский, отклонение 3 -х С на 0. 13 А Isotopes in Org. Chem. Vol. 1, 138 (1975)
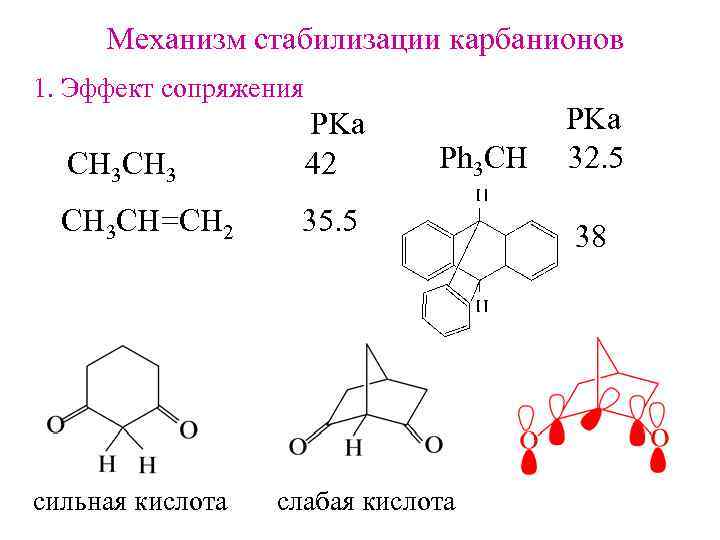 Механизм стабилизации карбанионов 1. Эффект сопряжения СH 3 CH 3 PKa 42 CH 3 CH=CH 2 35. 5 сильная кислота Ph 3 CH слабая кислота PKa 32. 5 38
Механизм стабилизации карбанионов 1. Эффект сопряжения СH 3 CH 3 PKa 42 CH 3 CH=CH 2 35. 5 сильная кислота Ph 3 CH слабая кислота PKa 32. 5 38
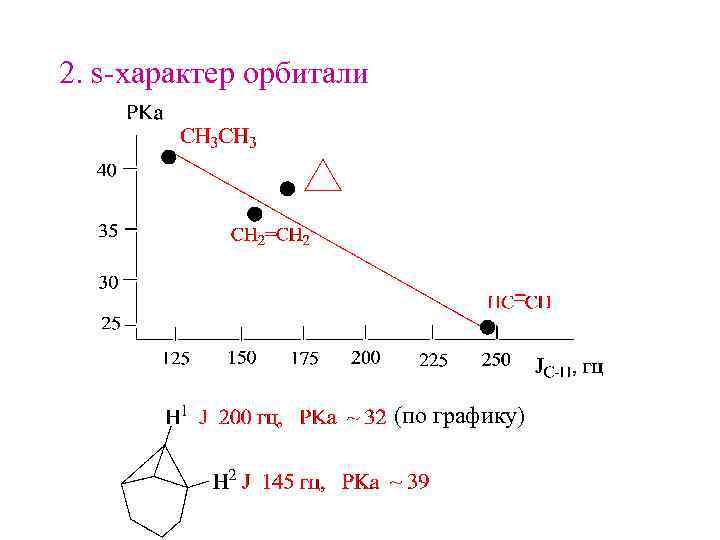 2. s-характер орбитали (по графику)
2. s-характер орбитали (по графику)
 Proton affinity (kcal/mol) MP 4/6 -31+G∗ R − + H+ → R−H CH 4 H 2 C=CH 2 419. 4 408. 7 HC≡CH 375. 1 W. H. Saunders, Jr. , and J. E. Van Verth, J. Org. Chem. , 60, 3452 (1995).
Proton affinity (kcal/mol) MP 4/6 -31+G∗ R − + H+ → R−H CH 4 H 2 C=CH 2 419. 4 408. 7 HC≡CH 375. 1 W. H. Saunders, Jr. , and J. E. Van Verth, J. Org. Chem. , 60, 3452 (1995).
 Газовая фаза CH 4 = CH=CH Chem. Rev. 2013, 113, 6986
Газовая фаза CH 4 = CH=CH Chem. Rev. 2013, 113, 6986
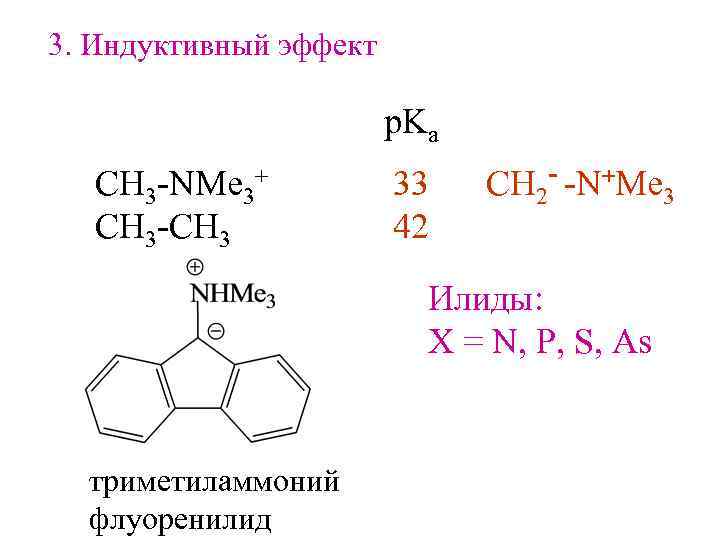 3. Индуктивный эффект p. Ka СH 3 -NMe 3+ CH 3 -CH 3 33 42 CH 2 - -N+Me 3 Илиды: X = N, P, S, As триметиламмоний флуоренилид
3. Индуктивный эффект p. Ka СH 3 -NMe 3+ CH 3 -CH 3 33 42 CH 2 - -N+Me 3 Илиды: X = N, P, S, As триметиламмоний флуоренилид
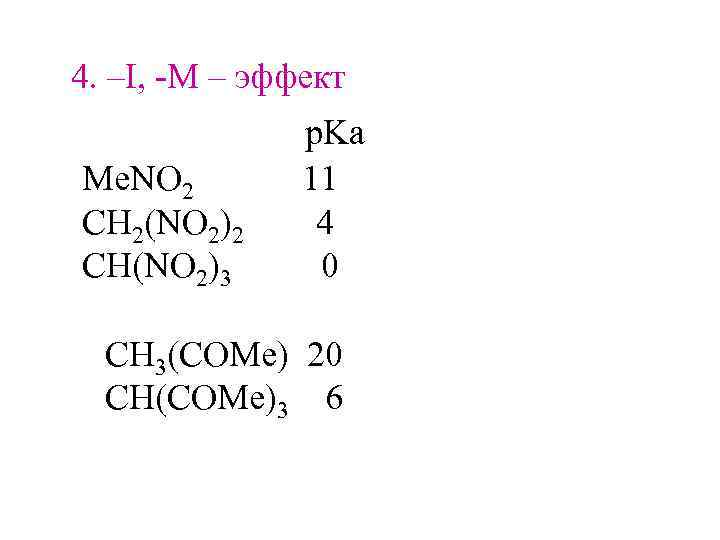 4. –I, -M – эффект Me. NO 2 CH 2(NO 2)2 CH(NO 2)3 p. Ka 11 4 0 CH 3(COMe) 20 CH(COMe)3 6
4. –I, -M – эффект Me. NO 2 CH 2(NO 2)2 CH(NO 2)3 p. Ka 11 4 0 CH 3(COMe) 20 CH(COMe)3 6
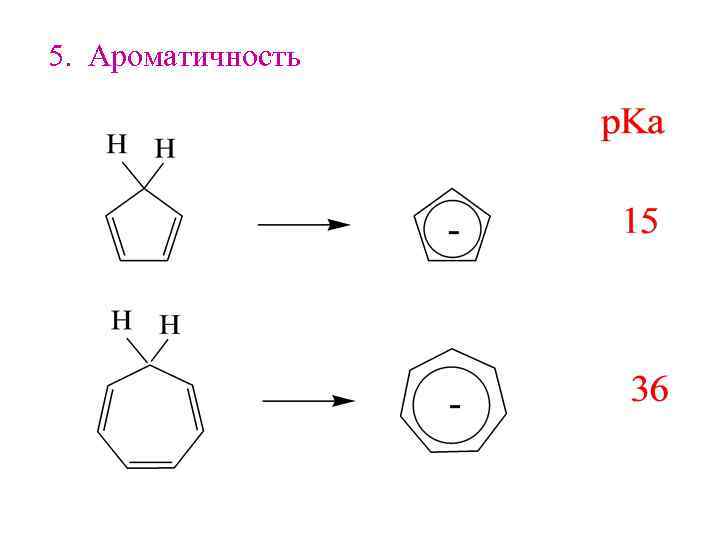 5. Ароматичность
5. Ароматичность
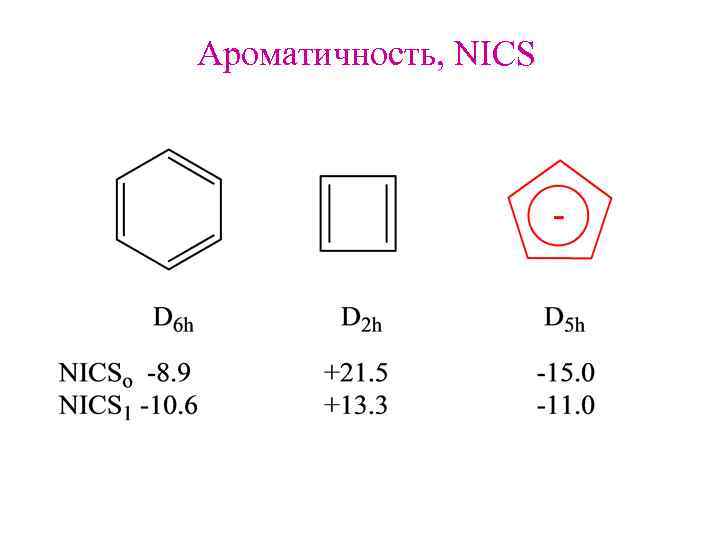 Ароматичность, NICS
Ароматичность, NICS
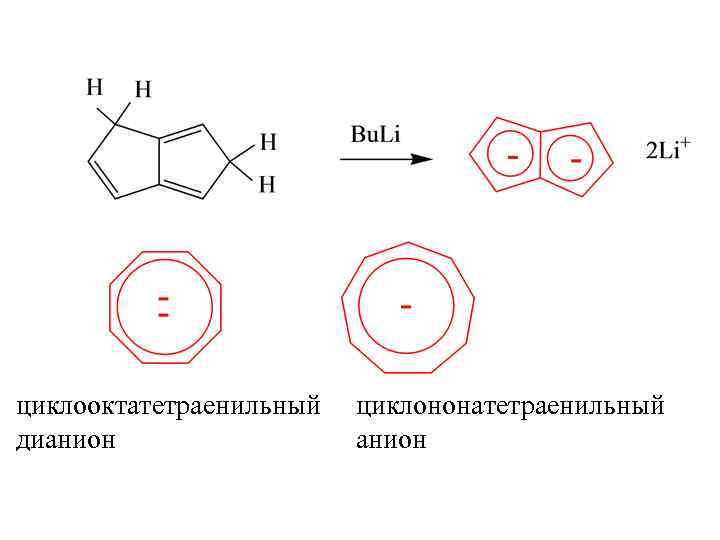 циклооктатетраенильный дианион циклононатетраенильный анион
циклооктатетраенильный дианион циклононатетраенильный анион


