
Свинец

История Свинец (англ. Lead, франц. Plomb, нем. Blei) известен с III - II тысячелетия до н. э в Месопотамии, Египте и других древних странах, где из него изготавливали большие кирпичи, статуи богов и царей, печати и различные предметы быта. Из свинца делали бронзу, в более позднее время римляне стали изготавливать из свинца трубы для водопровода. Происхождение слова «свинец» не ясно. В старину свинец не всегда чётко отличали от олова.
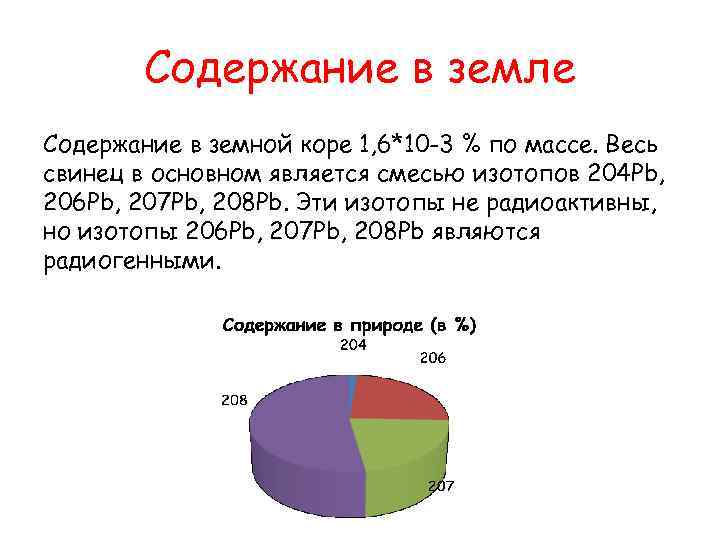
Содержание в земле Содержание в земной коре 1, 6*10 -3 % по массе. Весь свинец в основном является смесью изотопов 204 Pb, 206 Pb, 207 Pb, 208 Pb. Эти изотопы не радиоактивны, но изотопы 206 Pb, 207 Pb, 208 Pb являются радиогенными.

Химические свойства Конфигурация внешних электронных оболочек атома Pb 6 s 26 р2, в соответствии с чем он проявляет степени окисления -4, +2, +4. Свинец сравнительно мало активен химически. Металлический блеск свежего разреза свинца постепенно исчезает на воздухе вследствие образования тончайшей пленки Рb. О, предохраняющей от дальнейшего окисления.

Взаимодействие с кислородом и водой Pb 2 O 3 соответствует Pb 2+(Pb. O 3)2 - (метаплюмбат свинца) Pb 3 O 4 соответствует. Pb 2+2(Pb. O 4)4 - (ортоплюмбат свинца) Pb + O 2 → Pb. O Взаимодействие свинца с кислородом, при нагревании. Pb + O 2 → Pb. O 2 Pb 3 O 4 ↔ 3 Pb. O + 0, 5 O 2 Разложение оксидов свинца при 3 Pb. O 2 ↔ Pb 3 O 4 + O 2 нагревании. Pb. O ↔ Pb + 0, 5 O 2 Pb + 2 H 2 O → Pb(OH)2↓ + H 2↑ Взаимодействие с водой при нагревании.

Взаимодействие с халькогенами Халькогениды получают взаимодействием расплава или пара свинца с халькогенами. Pb + S → Pb. S↓ Pb + Se → Pb. Se↓ Pb + Te → Pb. Te↓ Все халькогениды имеют вид тёмно коричневых кристалов.

Взаимодействие с галогенами Свинец реагирует с галогенами при вакууме и при температуре большей чем температура плавления Pb + Cl 2 → Pb. Cl 2↓ Pb +F 2 → Pb. F 2↓ Pb + I 2 →Pb. I 2↓ Pb + Br 2 → Pb. Br 2↓

Взаимодействие с кислотами Свинец на прямую реагирует лишь с некоторыми кислотами. Например: Pb + 2 CH 3 COOH → (CH 3 COO)2 Pb + H 2↑ Pb + 2 H 2 SO 4(К) → Pb(HSO 4)2 + H 2 ↑ Pb + HCl(К) → H 2[Pb. Cl 4] – тетрохлорсвинцовая кислота Pb + 4 HNO 3(к) → Pb(NO 3)2 + 2 NO 2↑ +H 2 O Pb + HNO 3(р) → Pb(NO 3)2 + NO↑ + H 2 O С серной и соляной кислотой реакция не идёт из-за образования нерастворимых солей, которые мешают дальнейшему окислению.

Амфотерные свойства Свинец проявляет амфотерные свойства при взаимодействии со щелочами: С раствором гидроксида натрия Pb + 2 Na. OH + 2 H 2 O → Na 2[Pb(OH)4] + H 2↑ С сухим гидроксидом натрия Pb + 2 Na. OH → Na 2 Pb. O 2 + H 2↑ И не стоит забывать про соляную кислоту Pb + HCl(К) → H 2[Pb. Cl 4]

Способы получения 1. 2 Pb. S + 2 O 2 → 2 Pb. O + SO 2↑ восстановление коксом и угарным газом 2. Pb. S + 2 Pb. O → 3 Pb + SO 2 (Pb. O образуется при частичном обжиге Pb. S)

Физические свойства Чистый свинец - серебристо-белый, но на воздухе быстро покрывается синевато-серым налетом. Это мягкий, плотный, легкоплавкий металл, он пластичен выше 300° C, что используют для изготовления оболочек кабелей, выдавливания проволоки и трубок, а также в запорных устройствах водопроводных сетей. Свинец иногда формуют, но из -за низкой прочности на разрыв он плохо поддается ковке. На воздухе свинец образует компактную адгезионную пленку оксидов, защищающую его от дальнейшего окисления. Хотя Pb нерастворим в чистой воде при обычной температуре, он растворяется в воде, насыщенной кислородом. Поэтому свинец непригоден для трубопроводов с

Применение Наибольшее количество свинца расходуется на изготовление пластин свинцовых аккумуляторов, затем на оболочку электрических кабелей, внутреннее покрытие резервуаров, покрытие медных листов кровельного материала и особенно в химической промышленности, где он почти незаменим в производстве и хранении серной кислоты. Значительное применение находят сплавы свинца. Пьютер (сплав олова со свинцом), содержащий 8590% Sn и 10 -15% Pb, формуется, недорог и используется в производстве домашней утвари. Припой, содержащий 67% Pb и 33% Sn, применяют в электротехнике. Сплавы свинца с сурьмой используют в производстве пуль и типографского