Сульфанил амиды.ppt
- Количество слайдов: 56
 Сульфаниламид и его производные с алифатическими, пятичленными и шестичленными гетероциклическими субституентами. Бисептол.
Сульфаниламид и его производные с алифатическими, пятичленными и шестичленными гетероциклическими субституентами. Бисептол.
 План 1. История развития химиотерапии. 2. Связь между химическим строением и физиологическим действием. 3. Механизм действия сульфаниламидных препаратов. 4. Общие методы синтеза сульфаниламидов. 5. Классификация сульфаниламидов и химическое строение отдельных представителей. 6. Общие и специфические методы идентификации сульфаниламидов. 7. Испытания сульфаниламидов на чистоту. Выявление специфических и недопустимых примесей. 8. Методы количественного определения сульфаниламидов. 9. Применение сульфаниламидных препаратов в медицинской практике.
План 1. История развития химиотерапии. 2. Связь между химическим строением и физиологическим действием. 3. Механизм действия сульфаниламидных препаратов. 4. Общие методы синтеза сульфаниламидов. 5. Классификация сульфаниламидов и химическое строение отдельных представителей. 6. Общие и специфические методы идентификации сульфаниламидов. 7. Испытания сульфаниламидов на чистоту. Выявление специфических и недопустимых примесей. 8. Методы количественного определения сульфаниламидов. 9. Применение сульфаниламидных препаратов в медицинской практике.
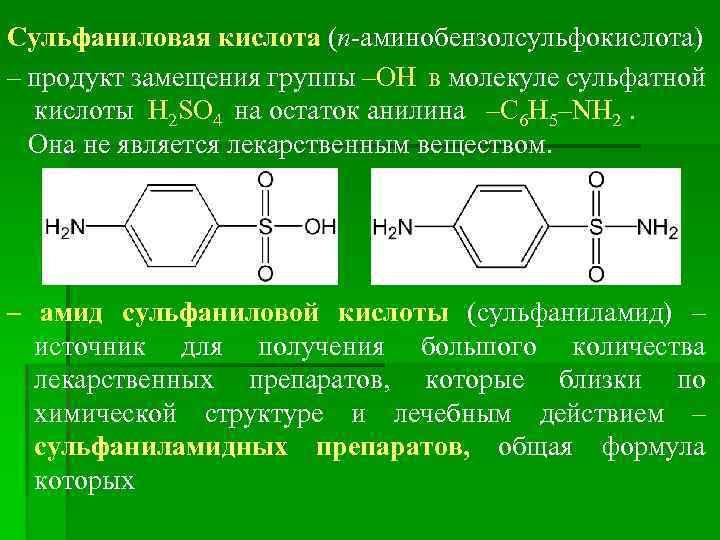 Сульфаниловая кислота (п-аминобензолсульфокислота) – продукт замещения группы –ОН в молекуле сульфатной кислоты H 2 SO 4 на остаток анилина –C 6 H 5–NH 2. Она не является лекарственным веществом. – амид сульфаниловой кислоты (сульфаниламид) – источник для получения большого количества лекарственных препаратов, которые близки по химической структуре и лечебным действием – сульфаниламидных препаратов, общая формула которых
Сульфаниловая кислота (п-аминобензолсульфокислота) – продукт замещения группы –ОН в молекуле сульфатной кислоты H 2 SO 4 на остаток анилина –C 6 H 5–NH 2. Она не является лекарственным веществом. – амид сульфаниловой кислоты (сульфаниламид) – источник для получения большого количества лекарственных препаратов, которые близки по химической структуре и лечебным действием – сульфаниламидных препаратов, общая формула которых
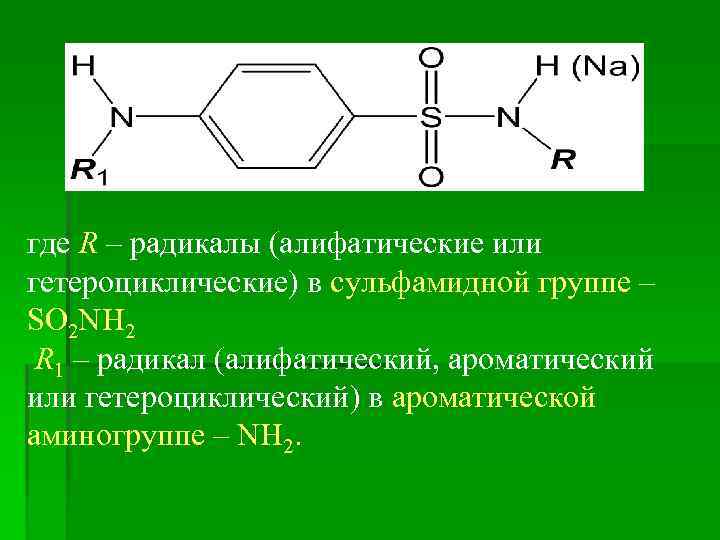 где R – радикалы (алифатические или гетероциклические) в сульфамидной группе – SO 2 NH 2 R 1 – радикал (алифатический, ароматический или гетероциклический) в ароматической аминогруппе – NH 2.
где R – радикалы (алифатические или гетероциклические) в сульфамидной группе – SO 2 NH 2 R 1 – радикал (алифатический, ароматический или гетероциклический) в ароматической аминогруппе – NH 2.
 История развития химиотерапии Появление сульфаниламидов относится к 30 -х годам XX ст. в связи с поиском красителей для текстильной промышленности. В 1908 г. Гельмо синтезировал паминобензолсульфамид H 2 N–C 6 H 4–SO 2–NH 2 (вошел потом в медицинскую практику под названием белый стрептоцид) и на его основе получали азокрасители для текстильной промышленности, не подозревая его биологической активности. В 1909 г. был получен краситель хризоидин (очень устойчив), а в 1913 г. было доказано его бактерицидное действие и предложен лекарственный препарат под названием пиридиум. Лечебный эффект таких красителей дал толчок для развития работ в этом направлении. Этому содействовало и то, что в 30 -х годах ХХ ст. была сильная пандемия крупозного воспаления легких, особенно в странах Азии (Индия, Индонезия и др. ).
История развития химиотерапии Появление сульфаниламидов относится к 30 -х годам XX ст. в связи с поиском красителей для текстильной промышленности. В 1908 г. Гельмо синтезировал паминобензолсульфамид H 2 N–C 6 H 4–SO 2–NH 2 (вошел потом в медицинскую практику под названием белый стрептоцид) и на его основе получали азокрасители для текстильной промышленности, не подозревая его биологической активности. В 1909 г. был получен краситель хризоидин (очень устойчив), а в 1913 г. было доказано его бактерицидное действие и предложен лекарственный препарат под названием пиридиум. Лечебный эффект таких красителей дал толчок для развития работ в этом направлении. Этому содействовало и то, что в 30 -х годах ХХ ст. была сильная пандемия крупозного воспаления легких, особенно в странах Азии (Индия, Индонезия и др. ).
 Сильным лекарственным средством для борьбы с стрепкокковой инфекцией оказался азокраситель пронтозил, синтезированный в 1932 г. венгерским ученым Домагком: Это стало началом развития химиотерапии – поиска таких веществ, которые выборочно действуют на патогенные микроорганизмы, вызывающие инфекционные заболевания, и в таких дозах практически не действуют на макроорганизм. Термин “химиотерапия” впервые ввел П. Эрлих и он в 1891 г. использовал метиленовую синьку для лечения малярии (краситель не только фиксируется возбудителями, а и убивает их, т. е. проявляет бактерицидное действие). Основные положения химиотерапии сформулировал в 1891 году русский ученый Романовский.
Сильным лекарственным средством для борьбы с стрепкокковой инфекцией оказался азокраситель пронтозил, синтезированный в 1932 г. венгерским ученым Домагком: Это стало началом развития химиотерапии – поиска таких веществ, которые выборочно действуют на патогенные микроорганизмы, вызывающие инфекционные заболевания, и в таких дозах практически не действуют на макроорганизм. Термин “химиотерапия” впервые ввел П. Эрлих и он в 1891 г. использовал метиленовую синьку для лечения малярии (краситель не только фиксируется возбудителями, а и убивает их, т. е. проявляет бактерицидное действие). Основные положения химиотерапии сформулировал в 1891 году русский ученый Романовский.
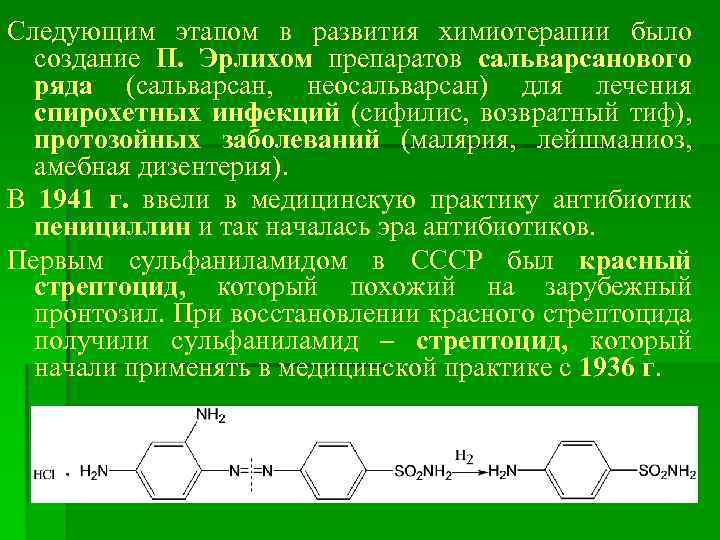 Следующим этапом в развития химиотерапии было создание П. Эрлихом препаратов сальварсанового ряда (сальварсан, неосальварсан) для лечения спирохетных инфекций (сифилис, возвратный тиф), протозойных заболеваний (малярия, лейшманиоз, амебная дизентерия). В 1941 г. ввели в медицинскую практику антибиотик пенициллин и так началась эра антибиотиков. Первым сульфаниламидом в СССР был красный стрептоцид, который похожий на зарубежный пронтозил. При восстановлении красного стрептоцида получили сульфаниламид – стрептоцид, который начали применять в медицинской практике с 1936 г.
Следующим этапом в развития химиотерапии было создание П. Эрлихом препаратов сальварсанового ряда (сальварсан, неосальварсан) для лечения спирохетных инфекций (сифилис, возвратный тиф), протозойных заболеваний (малярия, лейшманиоз, амебная дизентерия). В 1941 г. ввели в медицинскую практику антибиотик пенициллин и так началась эра антибиотиков. Первым сульфаниламидом в СССР был красный стрептоцид, который похожий на зарубежный пронтозил. При восстановлении красного стрептоцида получили сульфаниламид – стрептоцид, который начали применять в медицинской практике с 1936 г.
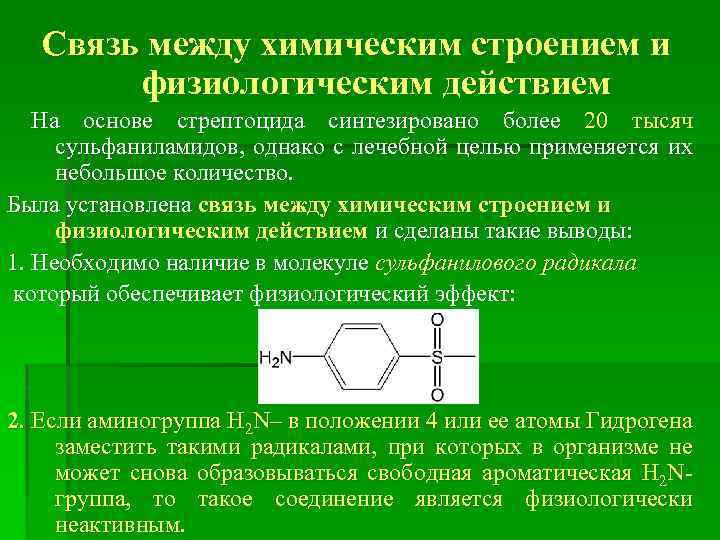 Связь между химическим строением и физиологическим действием На основе стрептоцида синтезировано более 20 тысяч сульфаниламидов, однако с лечебной целью применяется их небольшое количество. Была установлена связь между химическим строением и физиологическим действием и сделаны такие выводы: 1. Необходимо наличие в молекуле сульфанилового радикала который обеспечивает физиологический эффект: 2. Если аминогруппа H 2 N– в положении 4 или ее атомы Гидрогена заместить такими радикалами, при которых в организме не может снова образовываться свободная ароматическая H 2 Nгруппа, то такое соединение является физиологически неактивным.
Связь между химическим строением и физиологическим действием На основе стрептоцида синтезировано более 20 тысяч сульфаниламидов, однако с лечебной целью применяется их небольшое количество. Была установлена связь между химическим строением и физиологическим действием и сделаны такие выводы: 1. Необходимо наличие в молекуле сульфанилового радикала который обеспечивает физиологический эффект: 2. Если аминогруппа H 2 N– в положении 4 или ее атомы Гидрогена заместить такими радикалами, при которых в организме не может снова образовываться свободная ароматическая H 2 Nгруппа, то такое соединение является физиологически неактивным.
 3. Перемещение H 2 N-группы из положения 4 в положения 2 или 3 бензольного ядра приводит к полной потере активности. 4. Введение в бензольное ядро дополнительных заместителей разрушает или значительно уменьшает активность соединения. 5. При замещении Гидрогена сульфамидной группы – SO 2–NH 2 различными радикалами физиологическое действие увеличивается или уменьшается в зависимости от характера радикала. Лучшие препараты по активности можно получить, если эти субституенты имитируют некоторые составные части витаминов. Так, в состав витамина В 1 (тиамина) входят тиазоловый и пиримидиновый циклы, поэтому такие сульфаниламиды (норсульфазол, сульфазин) более активны по сравнению с незамещенным сульфаниламидом.
3. Перемещение H 2 N-группы из положения 4 в положения 2 или 3 бензольного ядра приводит к полной потере активности. 4. Введение в бензольное ядро дополнительных заместителей разрушает или значительно уменьшает активность соединения. 5. При замещении Гидрогена сульфамидной группы – SO 2–NH 2 различными радикалами физиологическое действие увеличивается или уменьшается в зависимости от характера радикала. Лучшие препараты по активности можно получить, если эти субституенты имитируют некоторые составные части витаминов. Так, в состав витамина В 1 (тиамина) входят тиазоловый и пиримидиновый циклы, поэтому такие сульфаниламиды (норсульфазол, сульфазин) более активны по сравнению с незамещенным сульфаниламидом.
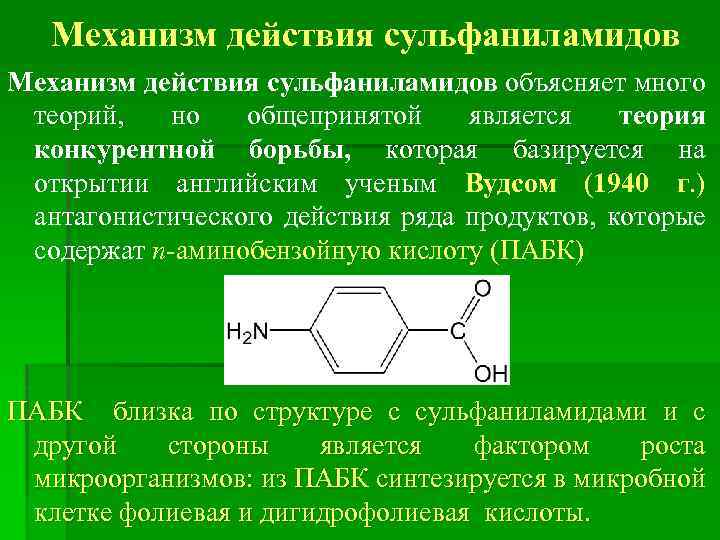 Механизм действия сульфаниламидов объясняет много теорий, но общепринятой является теория конкурентной борьбы, которая базируется на открытии английским ученым Вудсом (1940 г. ) антагонистического действия ряда продуктов, которые содержат п-аминобензойную кислоту (ПАБК) ПАБК близка по структуре с сульфаниламидами и с другой стороны является фактором роста микроорганизмов: из ПАБК синтезируется в микробной клетке фолиевая и дигидрофолиевая кислоты.
Механизм действия сульфаниламидов объясняет много теорий, но общепринятой является теория конкурентной борьбы, которая базируется на открытии английским ученым Вудсом (1940 г. ) антагонистического действия ряда продуктов, которые содержат п-аминобензойную кислоту (ПАБК) ПАБК близка по структуре с сульфаниламидами и с другой стороны является фактором роста микроорганизмов: из ПАБК синтезируется в микробной клетке фолиевая и дигидрофолиевая кислоты.
 При введении сульфаниламидов нарушается биосинтез дигидрофолиевой кислоты, так как сульфаниламидная молекула является биохимическим имитатором ПАБК. При этом для вытеснения 1 молекулы ПАБК необходимо 23 тысяч молекул сульфаниламида. Поэтому используют ударные дозы этих препаратов Недостаточные дозы сульфаниламидов при лечении не способны прервать инфекционный процесс, причем микробы могут адаптироваться к частичному нарушению обмена в клетке. Значение сульфаниламидных препаратов для развития химиотерапии очень большое. Они открыли эру в создании лекарственных препаратов, которые действуют на стрепто-, пневмо-, стафило- и менингококки, кишечную палочку и поэтому широко применяются для лечения инфекционных заболеваний, вызванных этими возбудителями.
При введении сульфаниламидов нарушается биосинтез дигидрофолиевой кислоты, так как сульфаниламидная молекула является биохимическим имитатором ПАБК. При этом для вытеснения 1 молекулы ПАБК необходимо 23 тысяч молекул сульфаниламида. Поэтому используют ударные дозы этих препаратов Недостаточные дозы сульфаниламидов при лечении не способны прервать инфекционный процесс, причем микробы могут адаптироваться к частичному нарушению обмена в клетке. Значение сульфаниламидных препаратов для развития химиотерапии очень большое. Они открыли эру в создании лекарственных препаратов, которые действуют на стрепто-, пневмо-, стафило- и менингококки, кишечную палочку и поэтому широко применяются для лечения инфекционных заболеваний, вызванных этими возбудителями.
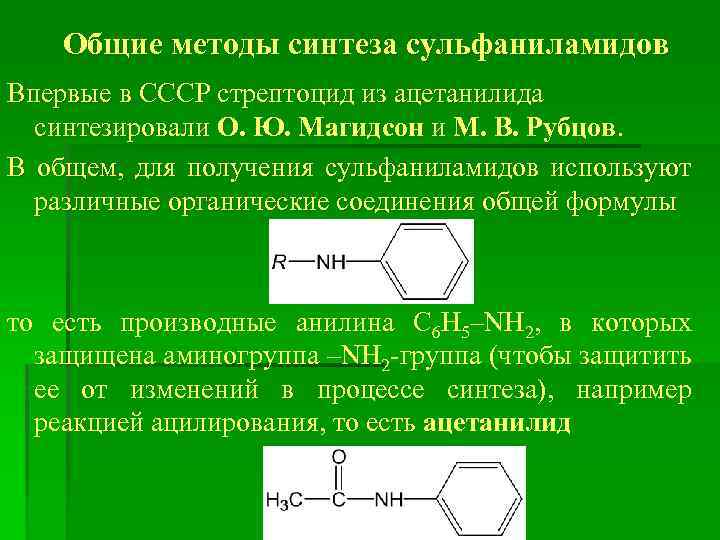 Общие методы синтеза сульфаниламидов Впервые в СССР стрептоцид из ацетанилида синтезировали О. Ю. Магидсон и М. В. Рубцов. В общем, для получения сульфаниламидов используют различные органические соединения общей формулы то есть производные анилина C 6 H 5–NH 2, в которых защищена аминогруппа –NH 2 -группа (чтобы защитить ее от изменений в процессе синтеза), например реакцией ацилирования, то есть ацетанилид
Общие методы синтеза сульфаниламидов Впервые в СССР стрептоцид из ацетанилида синтезировали О. Ю. Магидсон и М. В. Рубцов. В общем, для получения сульфаниламидов используют различные органические соединения общей формулы то есть производные анилина C 6 H 5–NH 2, в которых защищена аминогруппа –NH 2 -группа (чтобы защитить ее от изменений в процессе синтеза), например реакцией ацилирования, то есть ацетанилид
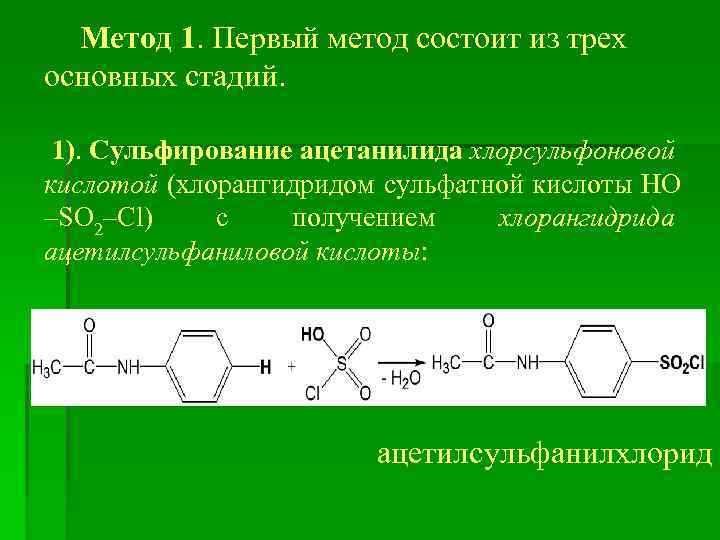 Метод 1. Первый метод состоит из трех основных стадий. 1). Сульфирование ацетанилида хлорсульфоновой кислотой (хлорангидридом сульфатной кислоты HO –SO 2–Cl) с получением хлорангидрида ацетилсульфаниловой кислоты: ацетилсульфанилхлорид
Метод 1. Первый метод состоит из трех основных стадий. 1). Сульфирование ацетанилида хлорсульфоновой кислотой (хлорангидридом сульфатной кислоты HO –SO 2–Cl) с получением хлорангидрида ацетилсульфаниловой кислоты: ацетилсульфанилхлорид
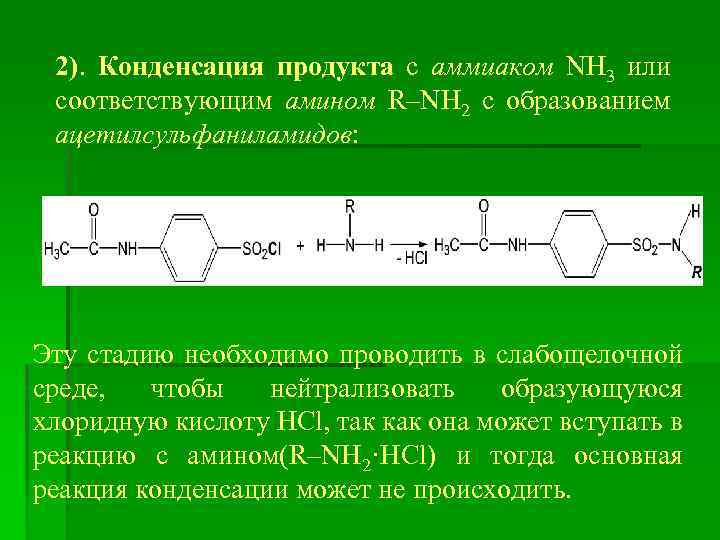 2). Конденсация продукта с аммиаком NH 3 или соответствующим амином R–NH 2 с образованием ацетилсульфаниламидов: Эту стадию необходимо проводить в слабощелочной среде, чтобы нейтрализовать образующуюся хлоридную кислоту HCl, так как она может вступать в реакцию с амином(R–NH 2·HCl) и тогда основная реакция конденсации может не происходить.
2). Конденсация продукта с аммиаком NH 3 или соответствующим амином R–NH 2 с образованием ацетилсульфаниламидов: Эту стадию необходимо проводить в слабощелочной среде, чтобы нейтрализовать образующуюся хлоридную кислоту HCl, так как она может вступать в реакцию с амином(R–NH 2·HCl) и тогда основная реакция конденсации может не происходить.
 3). Омыление ацильной группы (так как ацелированные сульфаниламиды терапевтического эффекта не имеют) путем кипячения с минеральными кислотами (HCl, H 2 SO 4 – кислотный гидролиз) или щелочью (получают Na–соль сульфаниламида).
3). Омыление ацильной группы (так как ацелированные сульфаниламиды терапевтического эффекта не имеют) путем кипячения с минеральными кислотами (HCl, H 2 SO 4 – кислотный гидролиз) или щелочью (получают Na–соль сульфаниламида).
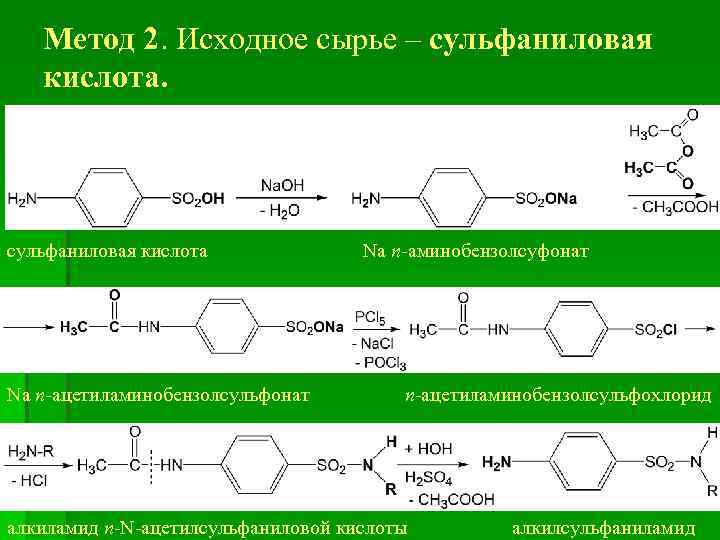 Метод 2. Исходное сырье – сульфаниловая кислота Na п-ацетиламинобензолсульфонат Na п-аминобензолсуфонат п-ацетиламинобензолсульфохлорид алкиламид п-N-ацетилсульфаниловой кислоты алкилсульфаниламид
Метод 2. Исходное сырье – сульфаниловая кислота Na п-ацетиламинобензолсульфонат Na п-аминобензолсуфонат п-ацетиламинобензолсульфохлорид алкиламид п-N-ацетилсульфаниловой кислоты алкилсульфаниламид
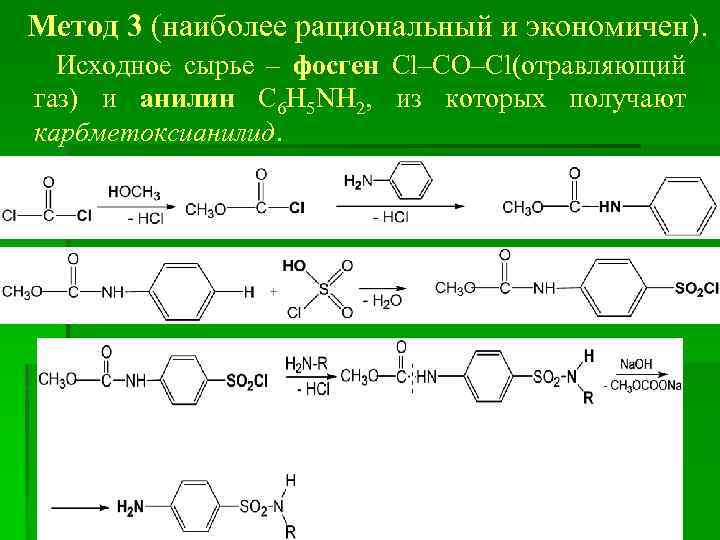 Метод 3 (наиболее рациональный и экономичен). Исходное сырье – фосген Cl–CO–Cl(отравляющий газ) и анилин C 6 H 5 NH 2, из которых получают карбметоксианилид.
Метод 3 (наиболее рациональный и экономичен). Исходное сырье – фосген Cl–CO–Cl(отравляющий газ) и анилин C 6 H 5 NH 2, из которых получают карбметоксианилид.
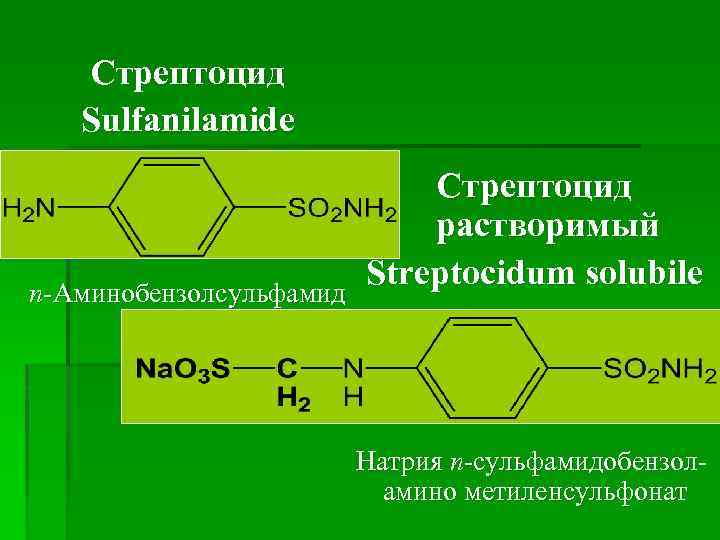 Стрептоцид Sulfanilamide п-Аминобензолсульфамид Стрептоцид растворимый Streptocidum solubile Натрия п-сульфамидобензоламино метиленсульфонат
Стрептоцид Sulfanilamide п-Аминобензолсульфамид Стрептоцид растворимый Streptocidum solubile Натрия п-сульфамидобензоламино метиленсульфонат
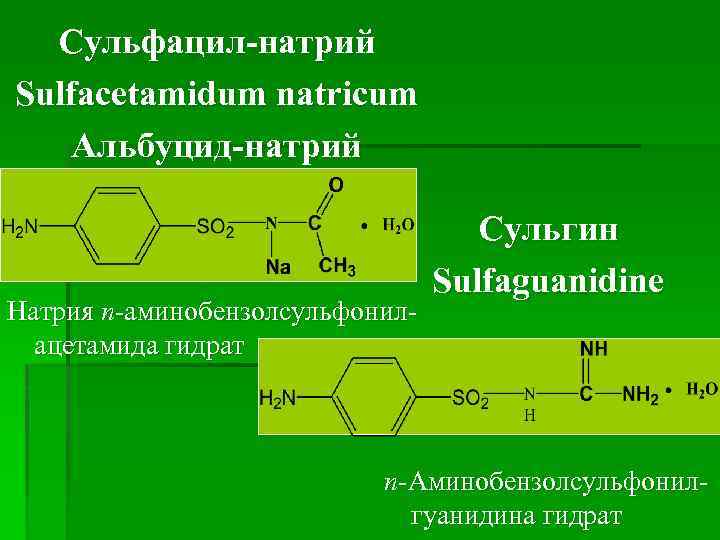 Сульфацил-натрий Sulfacetamidum natricum Aльбуцид-натрий Натрия п-аминобензолсульфонилацетамида гидрат Сульгин Sulfaguanidine п-Аминобензолсульфонилгуанидина гидрат
Сульфацил-натрий Sulfacetamidum natricum Aльбуцид-натрий Натрия п-аминобензолсульфонилацетамида гидрат Сульгин Sulfaguanidine п-Аминобензолсульфонилгуанидина гидрат
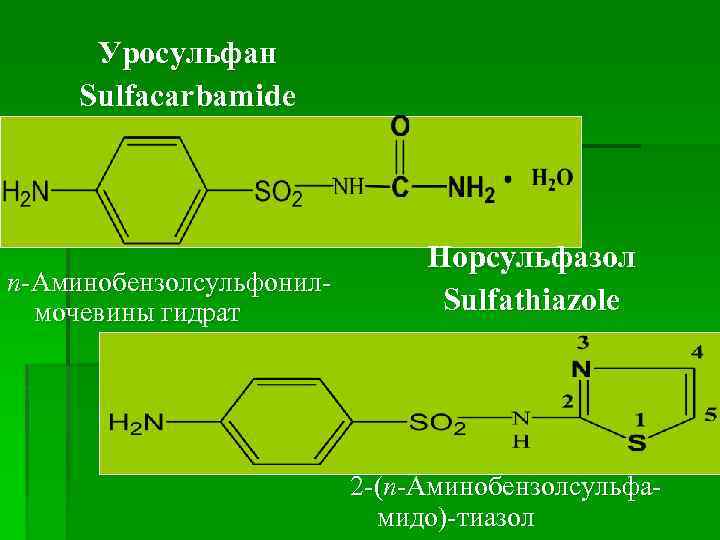 Уросульфан Sulfacarbamide п-Аминобензолсульфонилмочевины гидрат Норсульфазол Sulfathiazole 2 -(п-Аминобензолсульфамидо)-тиазол
Уросульфан Sulfacarbamide п-Аминобензолсульфонилмочевины гидрат Норсульфазол Sulfathiazole 2 -(п-Аминобензолсульфамидо)-тиазол
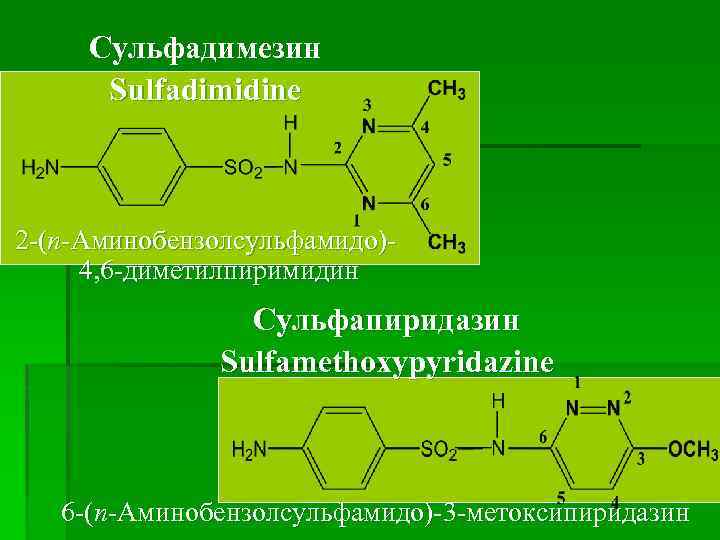 Сульфадимезин Sulfadimidine 2 -(п-Аминобензолсульфамидо)4, 6 -диметилпиримидин Сульфапиридазин Sulfamethoxypyridazine 6 -(п-Аминобензолсульфамидо)-3 -метоксипиридазин
Сульфадимезин Sulfadimidine 2 -(п-Аминобензолсульфамидо)4, 6 -диметилпиримидин Сульфапиридазин Sulfamethoxypyridazine 6 -(п-Аминобензолсульфамидо)-3 -метоксипиридазин
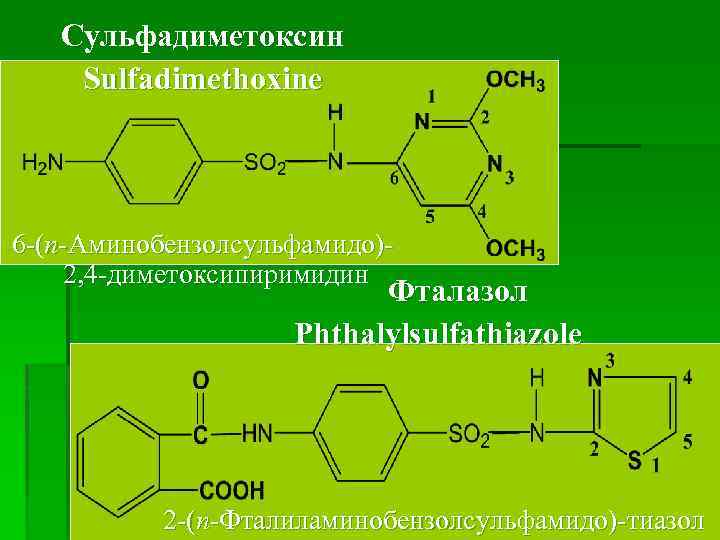 Сульфадиметоксин Sulfadimethoxine 6 -(п-Аминобензолсульфамидо)2, 4 -диметоксипиримидин Фталазол Phthalylsulfathiazole 2 -(п-Фталиламинобензолсульфамидо)-тиазол
Сульфадиметоксин Sulfadimethoxine 6 -(п-Аминобензолсульфамидо)2, 4 -диметоксипиримидин Фталазол Phthalylsulfathiazole 2 -(п-Фталиламинобензолсульфамидо)-тиазол
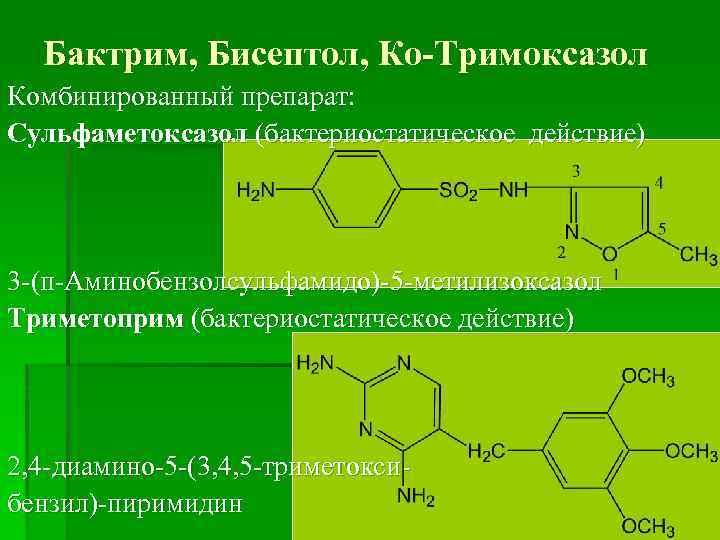 Бактрим, Бисептол, Ко-Тримоксазол Комбинированный препарат: Сульфаметоксазол (бактериостатическое действие) 3 -(п-Аминобензолсульфамидо)-5 -метилизоксазол Триметоприм (бактериостатическое действие) 2, 4 -диамино-5 -(3, 4, 5 -триметоксибензил)-пиримидин
Бактрим, Бисептол, Ко-Тримоксазол Комбинированный препарат: Сульфаметоксазол (бактериостатическое действие) 3 -(п-Аминобензолсульфамидо)-5 -метилизоксазол Триметоприм (бактериостатическое действие) 2, 4 -диамино-5 -(3, 4, 5 -триметоксибензил)-пиримидин
 Химические свойства и реакции идентификации І. Амфотерность сульфаниламидов и их растворимость в кислотах и щелочах Общая формула большинства сульфаниламидов они содержат в молекуле аминогруппу –NH 2, проявляющую основные свойства и замещенную сульфамидную группу , проявляющую кислотные свойства. Поэтому большинство сульфаниламидов являются амфотерными соединениями.
Химические свойства и реакции идентификации І. Амфотерность сульфаниламидов и их растворимость в кислотах и щелочах Общая формула большинства сульфаниламидов они содержат в молекуле аминогруппу –NH 2, проявляющую основные свойства и замещенную сульфамидную группу , проявляющую кислотные свойства. Поэтому большинство сульфаниламидов являются амфотерными соединениями.
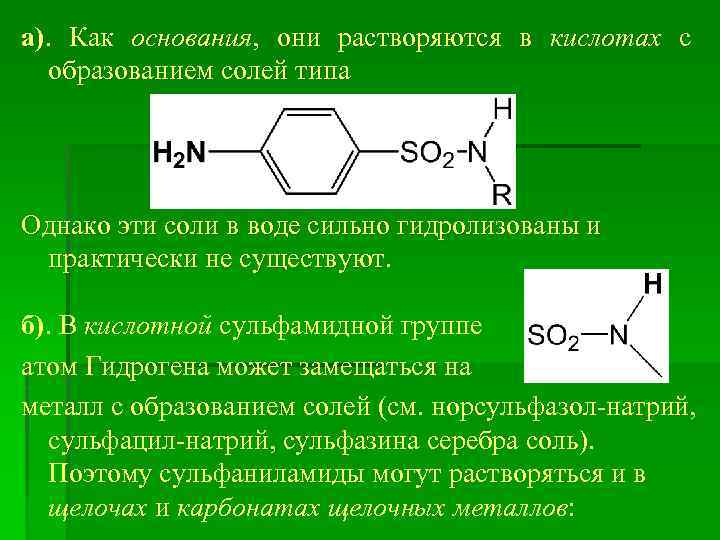 а). Как основания, они растворяются в кислотах с образованием солей типа Однако эти соли в воде сильно гидролизованы и практически не существуют. б). В кислотной сульфамидной группе атом Гидрогена может замещаться на металл с образованием солей (см. норсульфазол-натрий, сульфацил-натрий, сульфазина серебра соль). Поэтому сульфаниламиды могут растворяться и в щелочах и карбонатах щелочных металлов:
а). Как основания, они растворяются в кислотах с образованием солей типа Однако эти соли в воде сильно гидролизованы и практически не существуют. б). В кислотной сульфамидной группе атом Гидрогена может замещаться на металл с образованием солей (см. норсульфазол-натрий, сульфацил-натрий, сульфазина серебра соль). Поэтому сульфаниламиды могут растворяться и в щелочах и карбонатах щелочных металлов:
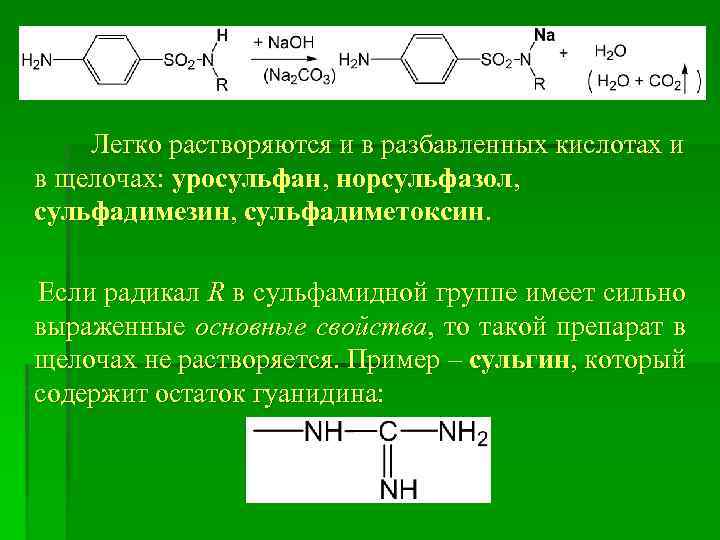 Легко растворяются и в разбавленных кислотах и в щелочах: уросульфан, норсульфазол, сульфадимезин, сульфадиметоксин. Если радикал R в сульфамидной группе имеет сильно выраженные основные свойства, то такой препарат в щелочах не растворяется. Пример – сульгин, который содержит остаток гуанидина:
Легко растворяются и в разбавленных кислотах и в щелочах: уросульфан, норсульфазол, сульфадимезин, сульфадиметоксин. Если радикал R в сульфамидной группе имеет сильно выраженные основные свойства, то такой препарат в щелочах не растворяется. Пример – сульгин, который содержит остаток гуанидина:
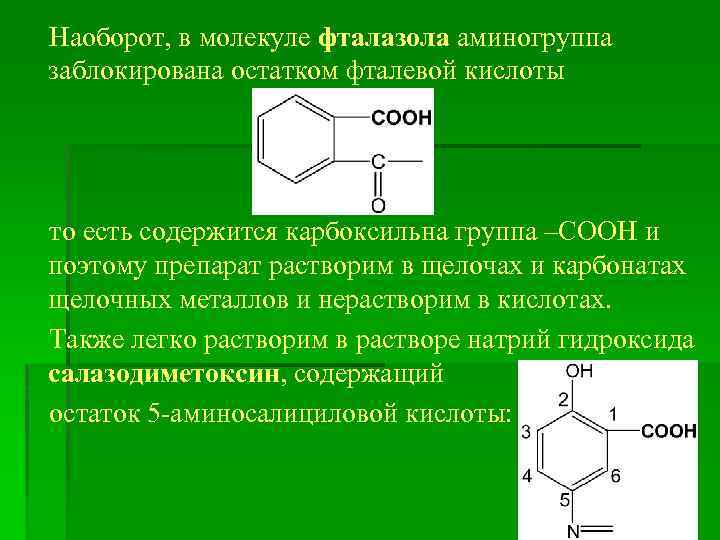 Наоборот, в молекуле фталазола аминогруппа заблокирована остатком фталевой кислоты то есть содержится карбоксильна группа –СООН и поэтому препарат растворим в щелочах и карбонатах щелочных металлов и нерастворим в кислотах. Также легко растворим в растворе натрий гидроксида салазодиметоксин, содержащий остаток 5 -аминосалициловой кислоты:
Наоборот, в молекуле фталазола аминогруппа заблокирована остатком фталевой кислоты то есть содержится карбоксильна группа –СООН и поэтому препарат растворим в щелочах и карбонатах щелочных металлов и нерастворим в кислотах. Также легко растворим в растворе натрий гидроксида салазодиметоксин, содержащий остаток 5 -аминосалициловой кислоты:
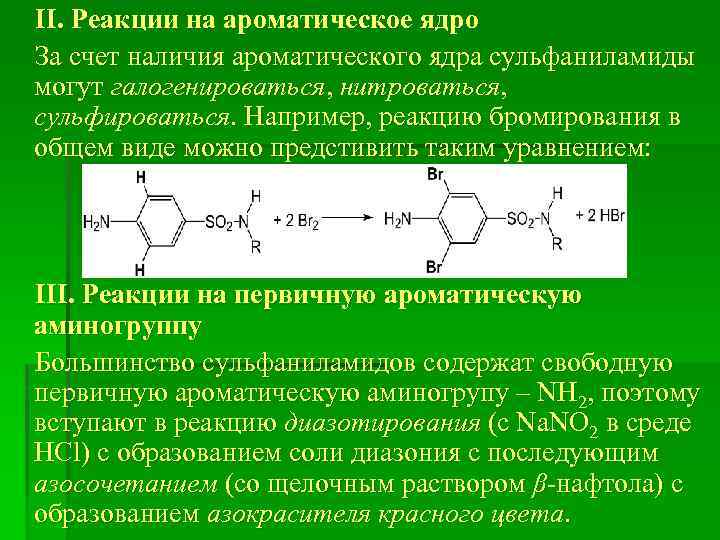 ІІ. Реакции на ароматическое ядро За счет наличия ароматического ядра сульфаниламиды могут галогенироваться, нитроваться, сульфироваться. Например, реакцию бромирования в общем виде можно предстивить таким уравнением: ІІІ. Реакции на первичную ароматическую аминогруппу Большинство сульфаниламидов содержат свободную первичную ароматическую аминогрупу – NH 2, поэтому вступают в реакцию диазотирования (с Na. NO 2 в среде НСl) с образованием соли диазония с последующим азосочетанием (со щелочным раствором β-нафтола) с образованием азокрасителя красного цвета.
ІІ. Реакции на ароматическое ядро За счет наличия ароматического ядра сульфаниламиды могут галогенироваться, нитроваться, сульфироваться. Например, реакцию бромирования в общем виде можно предстивить таким уравнением: ІІІ. Реакции на первичную ароматическую аминогруппу Большинство сульфаниламидов содержат свободную первичную ароматическую аминогрупу – NH 2, поэтому вступают в реакцию диазотирования (с Na. NO 2 в среде НСl) с образованием соли диазония с последующим азосочетанием (со щелочным раствором β-нафтола) с образованием азокрасителя красного цвета.
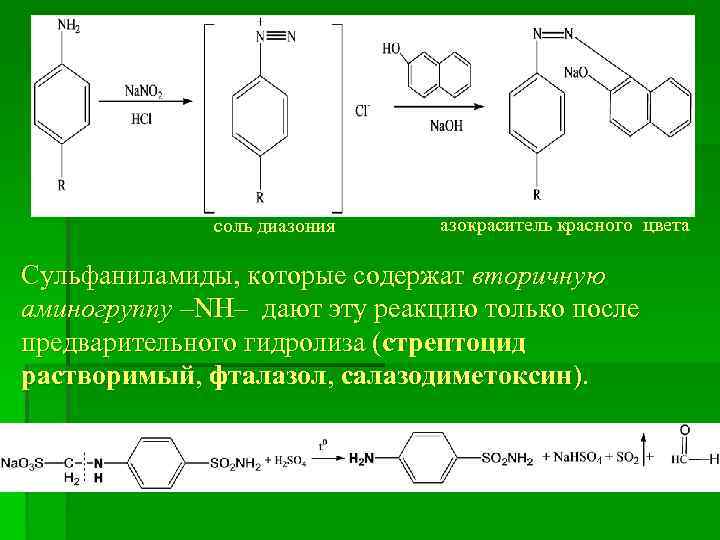 соль диазония азокраситель красного цвета Сульфаниламиды, которые содержат вторичную аминогруппу –NH– дают эту реакцию только после предварительного гидролиза (стрептоцид растворимый, фталазол, салазодиметоксин).
соль диазония азокраситель красного цвета Сульфаниламиды, которые содержат вторичную аминогруппу –NH– дают эту реакцию только после предварительного гидролиза (стрептоцид растворимый, фталазол, салазодиметоксин).
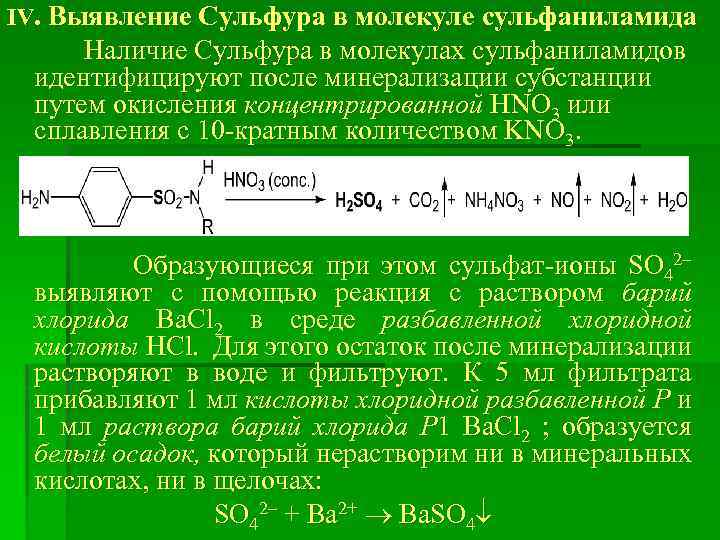 IV. Выявление Сульфура в молекуле сульфаниламида Наличие Сульфура в молекулах сульфаниламидов идентифицируют после минерализации субстанции путем окисления концентрированной HNO 3 или сплавления с 10 -кратным количеством KNO 3. Образующиеся при этом сульфат-ионы SO 42– выявляют с помощью реакция с раствором барий хлорида Ba. Cl 2 в среде разбавленной хлоридной кислоты HCl. Для этого остаток после минерализации растворяют в воде и фильтруют. К 5 мл фильтрата прибавляют 1 мл кислоты хлоридной разбавленной Р и 1 мл раствора барий хлорида Р 1 Ba. Cl 2 ; образуется белый осадок, который нерастворим ни в минеральных кислотах, ни в щелочах: SO 42– + Ba 2+ Ba. SO 4
IV. Выявление Сульфура в молекуле сульфаниламида Наличие Сульфура в молекулах сульфаниламидов идентифицируют после минерализации субстанции путем окисления концентрированной HNO 3 или сплавления с 10 -кратным количеством KNO 3. Образующиеся при этом сульфат-ионы SO 42– выявляют с помощью реакция с раствором барий хлорида Ba. Cl 2 в среде разбавленной хлоридной кислоты HCl. Для этого остаток после минерализации растворяют в воде и фильтруют. К 5 мл фильтрата прибавляют 1 мл кислоты хлоридной разбавленной Р и 1 мл раствора барий хлорида Р 1 Ba. Cl 2 ; образуется белый осадок, который нерастворим ни в минеральных кислотах, ни в щелочах: SO 42– + Ba 2+ Ba. SO 4
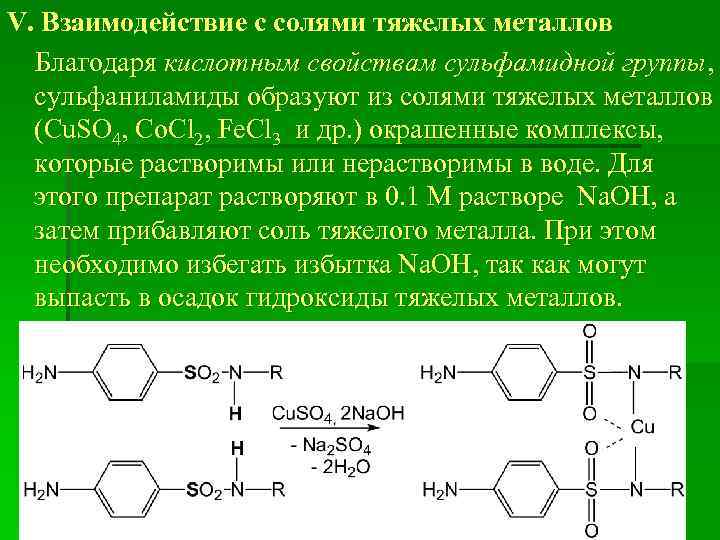 V. Взаимодействие с солями тяжелых металлов Благодаря кислотным свойствам сульфамидной группы, сульфаниламиды образуют из солями тяжелых металлов (Cu. SO 4, Co. Cl 2, Fe. Cl 3 и др. ) окрашенные комплексы, которые растворимы или нерастворимы в воде. Для этого препарат растворяют в 0. 1 М растворе Na. OH, а затем прибавляют соль тяжелого металла. При этом необходимо избегать избытка Na. OH, так как могут выпасть в осадок гидроксиды тяжелых металлов.
V. Взаимодействие с солями тяжелых металлов Благодаря кислотным свойствам сульфамидной группы, сульфаниламиды образуют из солями тяжелых металлов (Cu. SO 4, Co. Cl 2, Fe. Cl 3 и др. ) окрашенные комплексы, которые растворимы или нерастворимы в воде. Для этого препарат растворяют в 0. 1 М растворе Na. OH, а затем прибавляют соль тяжелого металла. При этом необходимо избегать избытка Na. OH, так как могут выпасть в осадок гидроксиды тяжелых металлов.
 VI. Реакция с реактивом Легаля При добавлении реактива Легаля – раствора натрия нитропруссида Na 2[Fe(CN)5 NO] в присутствии Na. OH с последующим подкислением образуются красные или красно-коричневые растворы или осадки. Сульфадимезин в этой реакции образует фиолетовое окрашивание. VII. Пиролиз субстанций сульфаниламидов При нагревании субстанций сульфаниламидов в сухой пробирке образуются плавы различного цвета и разные летучие продукты. VIIІ. Лигниновая проба (для экспресс-анализа) Реакция на первичную ароматическую аминогруппу: на кусочек газетной неотбеленной бумаги наносят несколько кристаллов испытуемой субстанции и смачивают несколькими каплями хлоридной кислоты HCl; появляется оранжево-желтое окрашивание азометиновых красителей (Шиффовых оснований).
VI. Реакция с реактивом Легаля При добавлении реактива Легаля – раствора натрия нитропруссида Na 2[Fe(CN)5 NO] в присутствии Na. OH с последующим подкислением образуются красные или красно-коричневые растворы или осадки. Сульфадимезин в этой реакции образует фиолетовое окрашивание. VII. Пиролиз субстанций сульфаниламидов При нагревании субстанций сульфаниламидов в сухой пробирке образуются плавы различного цвета и разные летучие продукты. VIIІ. Лигниновая проба (для экспресс-анализа) Реакция на первичную ароматическую аминогруппу: на кусочек газетной неотбеленной бумаги наносят несколько кристаллов испытуемой субстанции и смачивают несколькими каплями хлоридной кислоты HCl; появляется оранжево-желтое окрашивание азометиновых красителей (Шиффовых оснований).
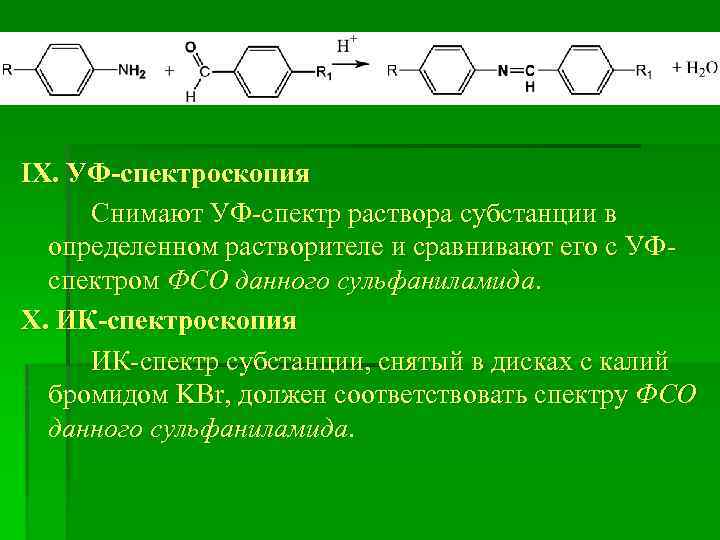 IX. УФ-спектроскопия Снимают УФ-спектр раствора субстанции в определенном растворителе и сравнивают его с УФспектром ФСО данного сульфаниламида. X. ИК-спектроскопия ИК-спектр субстанции, снятый в дисках с калий бромидом KBr, должен соответствовать спектру ФСО данного сульфаниламида.
IX. УФ-спектроскопия Снимают УФ-спектр раствора субстанции в определенном растворителе и сравнивают его с УФспектром ФСО данного сульфаниламида. X. ИК-спектроскопия ИК-спектр субстанции, снятый в дисках с калий бромидом KBr, должен соответствовать спектру ФСО данного сульфаниламида.
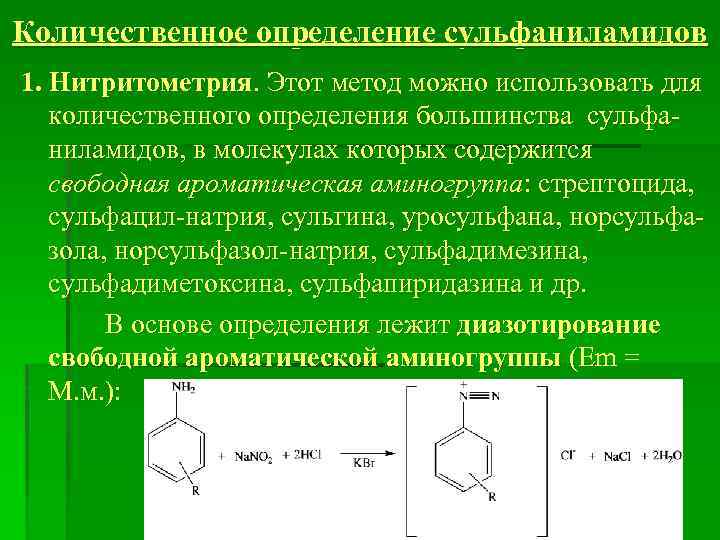 Количественное определение сульфаниламидов 1. Нитритометрия. Этот метод можно использовать для количественного определения большинства сульфаниламидов, в молекулах которых содержится свободная ароматическая аминогруппа: стрептоцида, сульфацил-натрия, сульгина, уросульфана, норсульфазол-натрия, сульфадимезина, сульфадиметоксина, сульфапиридазина и др. В основе определения лежит диазотирование свободной ароматической аминогруппы (Em = M. м. ):
Количественное определение сульфаниламидов 1. Нитритометрия. Этот метод можно использовать для количественного определения большинства сульфаниламидов, в молекулах которых содержится свободная ароматическая аминогруппа: стрептоцида, сульфацил-натрия, сульгина, уросульфана, норсульфазол-натрия, сульфадимезина, сульфадиметоксина, сульфапиридазина и др. В основе определения лежит диазотирование свободной ароматической аминогруппы (Em = M. м. ):
 Для количественного определения стрептоцида растворимого, фталазола, салазодиметоксина и др. , в молекулах которых нет свободной ароматической аминогруппы, метод нитритометрии можно применить только после предварительного гидролиза Сущность методики. К раствору субстанции прибавляют 10 мл разбавленной HCl, 1 г KBr и при постоянном перемешивании титруют 0, 1 М раствором Na. NO 2, прибавляя его вначале со скоростью 2 мл/мин, а в конце титрования (за 0, 5 мл до точки эквивалентности) по 0, 05 мл через минуту. Титрование проводят при температуре не выше 18 – 20 С, а в некоторых случаях требуется охлаждение до 0– 10 С.
Для количественного определения стрептоцида растворимого, фталазола, салазодиметоксина и др. , в молекулах которых нет свободной ароматической аминогруппы, метод нитритометрии можно применить только после предварительного гидролиза Сущность методики. К раствору субстанции прибавляют 10 мл разбавленной HCl, 1 г KBr и при постоянном перемешивании титруют 0, 1 М раствором Na. NO 2, прибавляя его вначале со скоростью 2 мл/мин, а в конце титрования (за 0, 5 мл до точки эквивалентности) по 0, 05 мл через минуту. Титрование проводят при температуре не выше 18 – 20 С, а в некоторых случаях требуется охлаждение до 0– 10 С.
 Точку эквивалентности определяют с помощью внутренних индикаторов (тропеолина 00 – до желтого окрашивания, смеси тропеолина 00 и метиленового синего (4 капли и 2 капли) – переход красно-фиолетового окрашивания до голубого, нейтрального красного – до синего окрашивания), наружных индикаторов (йодкрахмальной бумаги – до синего окрашивания) или потенциометрически (без применения мндикаторов). Параллельно проводят контрольный опыт. Избыточная капля титранта Na. NO 2 реагирует с КI йодкрахмальной (йодидкрахмальной) бумаги в среде HCl с образованием йода I 2 и потому йодкрахмальная бумага синеет. 2 Na. NO 2 + 2 KI + 4 HCl I 2 + 2 NO + 2 KCl + 2 Na. Cl + 2 H 2 O При использовании индикаторов титрование обычно проводят 3 раза первое титрование – пробное второе – медленное прибавление титранта Na. NO 2, особенно вблизи точки эквивалентности третье – “слепая” проба.
Точку эквивалентности определяют с помощью внутренних индикаторов (тропеолина 00 – до желтого окрашивания, смеси тропеолина 00 и метиленового синего (4 капли и 2 капли) – переход красно-фиолетового окрашивания до голубого, нейтрального красного – до синего окрашивания), наружных индикаторов (йодкрахмальной бумаги – до синего окрашивания) или потенциометрически (без применения мндикаторов). Параллельно проводят контрольный опыт. Избыточная капля титранта Na. NO 2 реагирует с КI йодкрахмальной (йодидкрахмальной) бумаги в среде HCl с образованием йода I 2 и потому йодкрахмальная бумага синеет. 2 Na. NO 2 + 2 KI + 4 HCl I 2 + 2 NO + 2 KCl + 2 Na. Cl + 2 H 2 O При использовании индикаторов титрование обычно проводят 3 раза первое титрование – пробное второе – медленное прибавление титранта Na. NO 2, особенно вблизи точки эквивалентности третье – “слепая” проба.
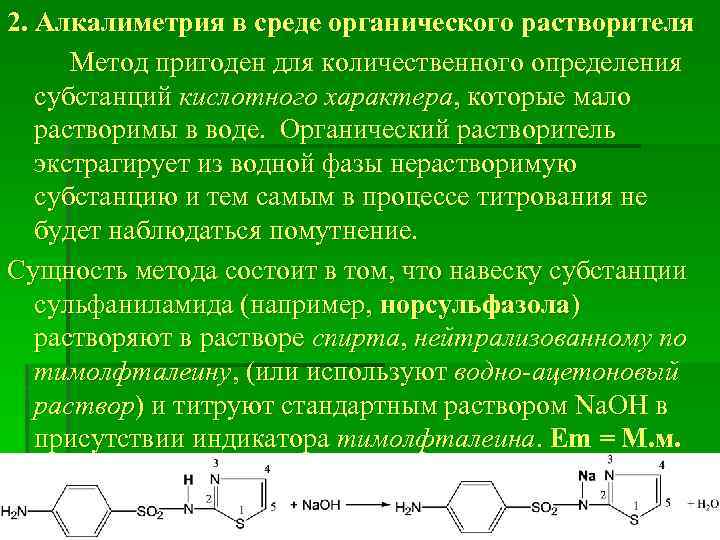 2. Алкалиметрия в среде органического растворителя Метод пригоден для количественного определения субстанций кислотного характера, которые мало растворимы в воде. Органический растворитель экстрагирует из водной фазы нерастворимую субстанцию и тем самым в процессе титрования не будет наблюдаться помутнение. Сущность метода состоит в том, что навеску субстанции сульфаниламида (например, норсульфазола) растворяют в растворе спирта, нейтрализованному по тимолфталеину, (или используют водно-ацетоновый раствор) и титруют стандартным раствором Na. OH в присутствии индикатора тимолфталеина. Em = M. м.
2. Алкалиметрия в среде органического растворителя Метод пригоден для количественного определения субстанций кислотного характера, которые мало растворимы в воде. Органический растворитель экстрагирует из водной фазы нерастворимую субстанцию и тем самым в процессе титрования не будет наблюдаться помутнение. Сущность метода состоит в том, что навеску субстанции сульфаниламида (например, норсульфазола) растворяют в растворе спирта, нейтрализованному по тимолфталеину, (или используют водно-ацетоновый раствор) и титруют стандартным раствором Na. OH в присутствии индикатора тимолфталеина. Em = M. м.
 3. Алкалиметрия, неводное титрование Этот метод используется для количественного определения фталазола, фтазина, салазопиридазина и др. Сущность методики (ГФ Х). Навеску субстанции фталазола (проявляет слабокислотные свойства) помещают в сухую коническую колбу, растворяют в диметилформамиде (ДМФА, основный растворитель), нейтрализованному непосредственно перед титрованием по тимоловому синему. С этой целью к ДМФА прибавляют 2– 3 капли тимолового синего (раствор тимолового синего в ДМФА имеет красновишневое окрашивание) и по каплям титрант – 0, 1 М раствор Na. OH в смеси метанола СН 3 ОН и бензена С 6 Н 6 до синего окрашивания. При прибавлении субстанции сульфаниламида окрашивание становится желтым.
3. Алкалиметрия, неводное титрование Этот метод используется для количественного определения фталазола, фтазина, салазопиридазина и др. Сущность методики (ГФ Х). Навеску субстанции фталазола (проявляет слабокислотные свойства) помещают в сухую коническую колбу, растворяют в диметилформамиде (ДМФА, основный растворитель), нейтрализованному непосредственно перед титрованием по тимоловому синему. С этой целью к ДМФА прибавляют 2– 3 капли тимолового синего (раствор тимолового синего в ДМФА имеет красновишневое окрашивание) и по каплям титрант – 0, 1 М раствор Na. OH в смеси метанола СН 3 ОН и бензена С 6 Н 6 до синего окрашивания. При прибавлении субстанции сульфаниламида окрашивание становится желтым.
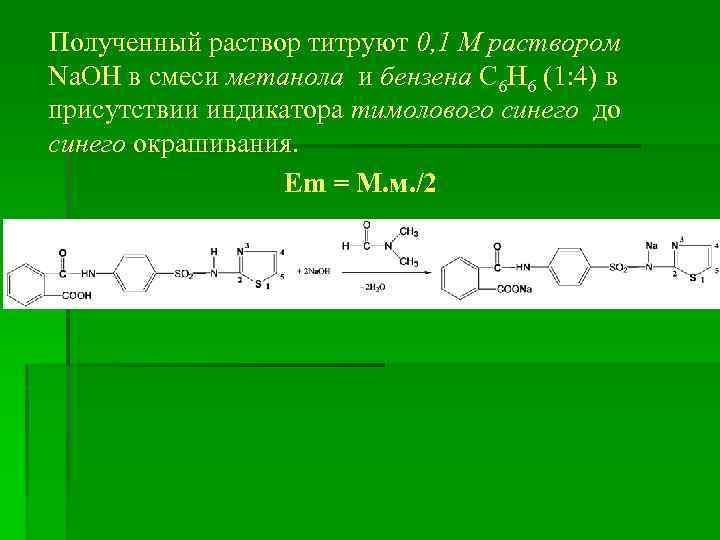 Полученный раствор титруют 0, 1 М раствором Na. OH в смеси метанола и бензена С 6 Н 6 (1: 4) в присутствии индикатора тимолового синего до синего окрашивания. Em = M. м. /2
Полученный раствор титруют 0, 1 М раствором Na. OH в смеси метанола и бензена С 6 Н 6 (1: 4) в присутствии индикатора тимолового синего до синего окрашивания. Em = M. м. /2
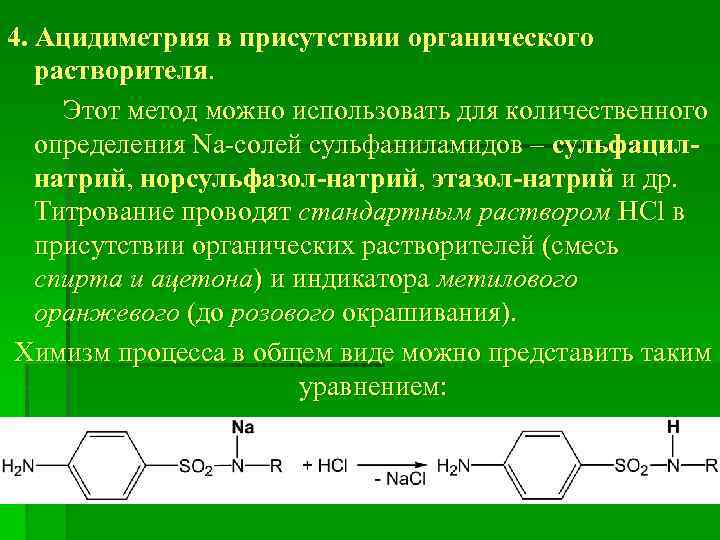 4. Ацидиметрия в присутствии органического растворителя. Этот метод можно использовать для количественного определения Na-солей сульфаниламидов – сульфацилнатрий, норсульфазол-натрий, этазол-натрий и др. Титрование проводят стандартным раствором HCl в присутствии органических растворителей (смесь спирта и ацетона) и индикатора метилового оранжевого (до розового окрашивания). Химизм процесса в общем виде можно представить таким уравнением:
4. Ацидиметрия в присутствии органического растворителя. Этот метод можно использовать для количественного определения Na-солей сульфаниламидов – сульфацилнатрий, норсульфазол-натрий, этазол-натрий и др. Титрование проводят стандартным раствором HCl в присутствии органических растворителей (смесь спирта и ацетона) и индикатора метилового оранжевого (до розового окрашивания). Химизм процесса в общем виде можно представить таким уравнением:
 5. Броматометрия, обратное титрование, с йодометрическим окончанием Определенный обьем аликвоты исследуемого раствора субстанции помещают в колбу с притертой стеклянной пробкой, прибавляют избыток стандартного раствора калий бромата КBr. O 3, кристаллический калий бромид KBr, подкисляют кислотой хлоридной Р HCl (или сульфатной H 2 SO 4), закрывают пробкой и оставляют на 15 мин, периодически перемешивая. KBr. O 3 + 5 KBr + 6 HCl = 3 Br 2 + 6 KCl + 3 H 2 O Выделившийся бром Br 2 реагирует с субстанцией сульфаниламида (реакция на бензеновое кольцо) с образованием дибромпроизводного:
5. Броматометрия, обратное титрование, с йодометрическим окончанием Определенный обьем аликвоты исследуемого раствора субстанции помещают в колбу с притертой стеклянной пробкой, прибавляют избыток стандартного раствора калий бромата КBr. O 3, кристаллический калий бромид KBr, подкисляют кислотой хлоридной Р HCl (или сульфатной H 2 SO 4), закрывают пробкой и оставляют на 15 мин, периодически перемешивая. KBr. O 3 + 5 KBr + 6 HCl = 3 Br 2 + 6 KCl + 3 H 2 O Выделившийся бром Br 2 реагирует с субстанцией сульфаниламида (реакция на бензеновое кольцо) с образованием дибромпроизводного:
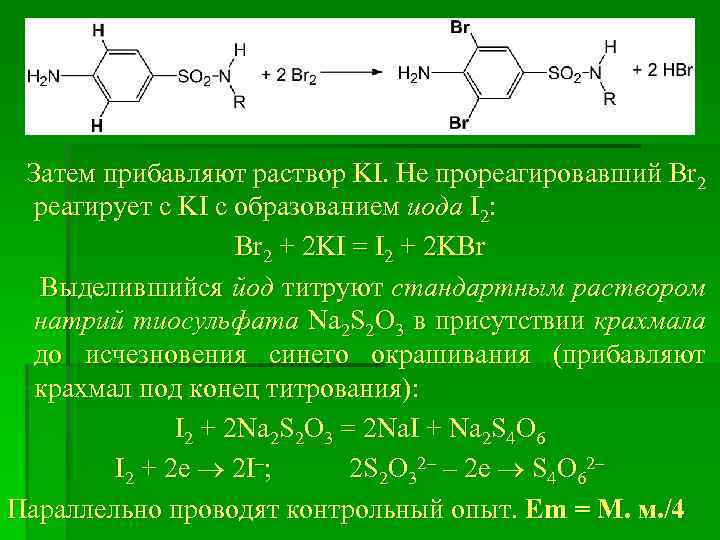 Затем прибавляют раствор KI. Не прореагировавший Br 2 реагирует с KI с образованием иода I 2: Br 2 + 2 KI = I 2 + 2 KBr Выделившийся йод титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 в присутствии крахмала до исчезновения синего окрашивания (прибавляют крахмал под конец титрования): I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 I 2 + 2 е 2 I–; 2 S 2 O 32– – 2 е S 4 O 62– Параллельно проводят контрольный опыт. Еm = М. м. /4
Затем прибавляют раствор KI. Не прореагировавший Br 2 реагирует с KI с образованием иода I 2: Br 2 + 2 KI = I 2 + 2 KBr Выделившийся йод титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 в присутствии крахмала до исчезновения синего окрашивания (прибавляют крахмал под конец титрования): I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 I 2 + 2 е 2 I–; 2 S 2 O 32– – 2 е S 4 O 62– Параллельно проводят контрольный опыт. Еm = М. м. /4
 6. Йодохлорометрия, обратное титрование К определенному объему исследуемого раствора сульфаниламида прибавляют избыток стандартного раствора йодомонохлорида ICl, который реагирует с субстанцией согласно уравнению: Не прореагировавший йодомонохлорид ICl реагирует с KI с образованием йода I 2, который титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 (индикатор – крахмал). ICl + KI = I 2 + KCl I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 Параллельно проводят контрольный опыт. Еm = М. м. /4
6. Йодохлорометрия, обратное титрование К определенному объему исследуемого раствора сульфаниламида прибавляют избыток стандартного раствора йодомонохлорида ICl, который реагирует с субстанцией согласно уравнению: Не прореагировавший йодомонохлорид ICl реагирует с KI с образованием йода I 2, который титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 (индикатор – крахмал). ICl + KI = I 2 + KCl I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 Параллельно проводят контрольный опыт. Еm = М. м. /4
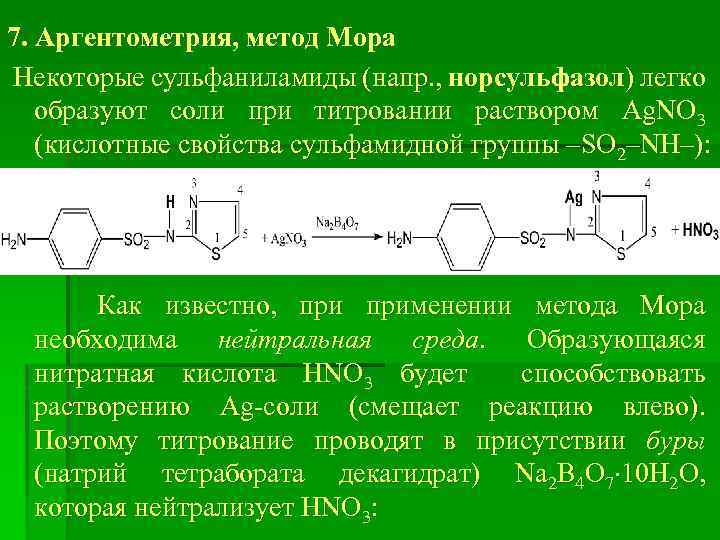 7. Аргентометрия, метод Мора Некоторые сульфаниламиды (напр. , норсульфазол) легко образуют соли при титровании раствором Ag. NO 3 (кислотные свойства сульфамидной группы –SO 2–NH–): Как известно, применении метода Мора необходима нейтральная среда. Образующаяся нитратная кислота HNO 3 будет способствовать растворению Ag-соли (смещает реакцию влево). Поэтому титрование проводят в присутствии буры (натрий тетрабората декагидрат) Na 2 B 4 O 7 10 Н 2 О, которая нейтрализует HNO 3:
7. Аргентометрия, метод Мора Некоторые сульфаниламиды (напр. , норсульфазол) легко образуют соли при титровании раствором Ag. NO 3 (кислотные свойства сульфамидной группы –SO 2–NH–): Как известно, применении метода Мора необходима нейтральная среда. Образующаяся нитратная кислота HNO 3 будет способствовать растворению Ag-соли (смещает реакцию влево). Поэтому титрование проводят в присутствии буры (натрий тетрабората декагидрат) Na 2 B 4 O 7 10 Н 2 О, которая нейтрализует HNO 3:
 Na 2 B 4 O 7 + 2 HNO 3 + 5 Н 2 О = 4 H 3 BO 3 + 2 Na. NO 3 В качестве индикатора используют раствор калий хромата K 2 Cr. О 4. Титрование проводят до оранжевокрасного осадка: избыточная капля титранта Ag. NO 3 реагирует с индикатором K 2 Cr. О 4 с образованием осадка Ag 2 Cr. О 4 оранжево-красного цвета: 2 Ag. NO 3 + K 2 Cr. О 4 Ag 2 Cr. О 4 + 2 КNO 3 Еm = М. м.
Na 2 B 4 O 7 + 2 HNO 3 + 5 Н 2 О = 4 H 3 BO 3 + 2 Na. NO 3 В качестве индикатора используют раствор калий хромата K 2 Cr. О 4. Титрование проводят до оранжевокрасного осадка: избыточная капля титранта Ag. NO 3 реагирует с индикатором K 2 Cr. О 4 с образованием осадка Ag 2 Cr. О 4 оранжево-красного цвета: 2 Ag. NO 3 + K 2 Cr. О 4 Ag 2 Cr. О 4 + 2 КNO 3 Еm = М. м.
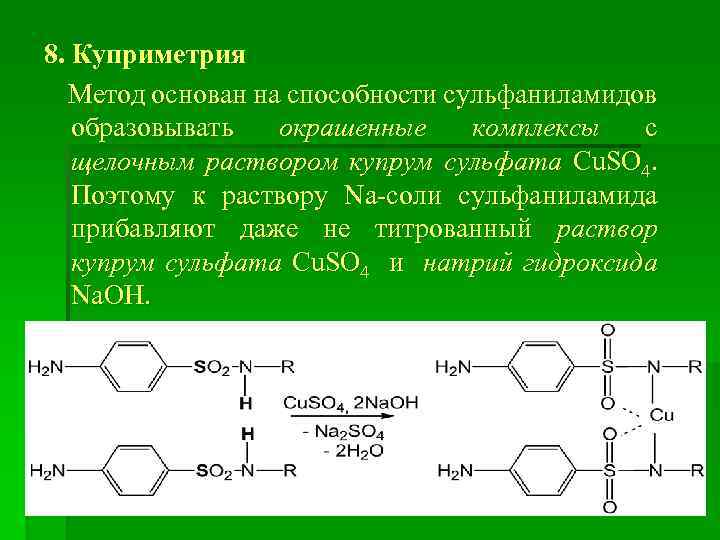 8. Куприметрия Метод основан на способности сульфаниламидов образовывать окрашенные комплексы с щелочным раствором купрум сульфата Cu. SO 4. Поэтому к раствору Na-соли сульфаниламида прибавляют даже не титрованный раствор купрум сульфата Cu. SO 4 и натрий гидроксида Na. OH.
8. Куприметрия Метод основан на способности сульфаниламидов образовывать окрашенные комплексы с щелочным раствором купрум сульфата Cu. SO 4. Поэтому к раствору Na-соли сульфаниламида прибавляют даже не титрованный раствор купрум сульфата Cu. SO 4 и натрий гидроксида Na. OH.
 Затем прибавляют раствор сульфатной кислоты H 2 SO 4, которая приводит к разрушению комплекса и освобождению эквивалентного количества Cu. SO 4. Потом прибавляют раствор калий йодида KI: 2 Cu. SO 4 + 4 KI Cu 2 I 2 + 2 K 2 SO 4 Выделившийся йод I 2 титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 в присутствии крахмала (прибавляют под конец титрования, до обесцвечивания раствора) : I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 Em = 2 М. м.
Затем прибавляют раствор сульфатной кислоты H 2 SO 4, которая приводит к разрушению комплекса и освобождению эквивалентного количества Cu. SO 4. Потом прибавляют раствор калий йодида KI: 2 Cu. SO 4 + 4 KI Cu 2 I 2 + 2 K 2 SO 4 Выделившийся йод I 2 титруют стандартным раствором натрий тиосульфата Na 2 S 2 O 3 в присутствии крахмала (прибавляют под конец титрования, до обесцвечивания раствора) : I 2 + 2 Na 2 S 2 O 3 = 2 Na. I + Na 2 S 4 O 6 Em = 2 М. м.
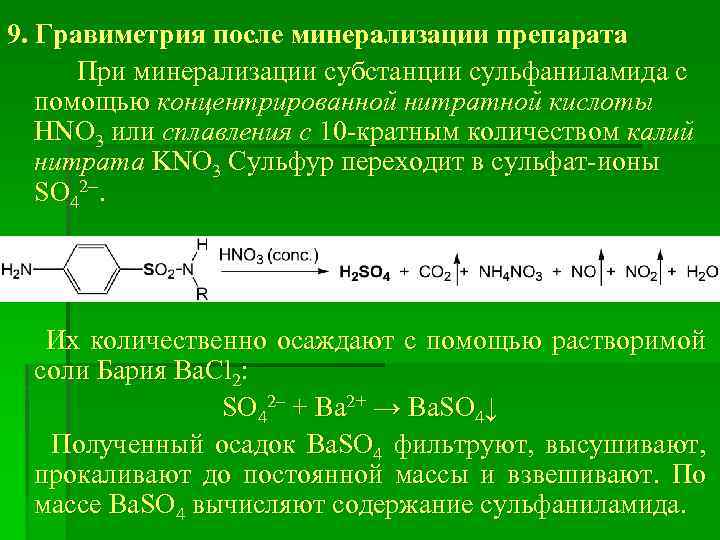 9. Гравиметрия после минерализации препарата При минерализации субстанции сульфаниламида с помощью концентрированной нитратной кислоты HNO 3 или сплавления с 10 -кратным количеством калий нитрата KNO 3 Cульфур переходит в сульфат-ионы SO 42. Их количественно осаждают с помощью растворимой соли Бария Ва. Cl 2: SO 42– + Ba 2+ → Ba. SO 4↓ Полученный осадок Ba. SO 4 фильтруют, высушивают, прокаливают до постоянной массы и взвешивают. По массе Ba. SO 4 вычисляют содержание сульфаниламида.
9. Гравиметрия после минерализации препарата При минерализации субстанции сульфаниламида с помощью концентрированной нитратной кислоты HNO 3 или сплавления с 10 -кратным количеством калий нитрата KNO 3 Cульфур переходит в сульфат-ионы SO 42. Их количественно осаждают с помощью растворимой соли Бария Ва. Cl 2: SO 42– + Ba 2+ → Ba. SO 4↓ Полученный осадок Ba. SO 4 фильтруют, высушивают, прокаливают до постоянной массы и взвешивают. По массе Ba. SO 4 вычисляют содержание сульфаниламида.
 10. Метод Кьельдаля (классический) – определение Нитрогена в препарате. С этой целью субстанцию минерализуют кипячением в специальном приборе в присутствии K 2 SO 4, Cu. SO 4 и концентрированной сульфатной кислоты H 2 SO 4. При этом Нитроген переходит в аммоний гидрогенсульфат NH 4 HSO 4, который при взаимодействии со щелочью Na. OH образует аммиак NH 3: NH 4 HSO 4 + 2 Na. OH NH 3 + Na 2 SO 4 + 2 H 2 O Полученный аммиак NH 3 отгоняют в колбу-приемник с ортоборатной (борной) кислотой H 3 BO 3: NH 3 + H 3 BO 3 NH 4 BO 2 + H 2 O 2 NH 3 + 4 H 3 BO 3 (NH 4)2 B 4 O 7 + 5 H 2 O Образовавшиеся соли (метаборат NH 4 BO 2 и тетраборат аммония (NH 4)2 B 4 O 7) титруют стандартным раствором хлоридной кислоты HCl в присутствии смешанного индикатора (смесь метилового красного и метиленового синего (2: 1):
10. Метод Кьельдаля (классический) – определение Нитрогена в препарате. С этой целью субстанцию минерализуют кипячением в специальном приборе в присутствии K 2 SO 4, Cu. SO 4 и концентрированной сульфатной кислоты H 2 SO 4. При этом Нитроген переходит в аммоний гидрогенсульфат NH 4 HSO 4, который при взаимодействии со щелочью Na. OH образует аммиак NH 3: NH 4 HSO 4 + 2 Na. OH NH 3 + Na 2 SO 4 + 2 H 2 O Полученный аммиак NH 3 отгоняют в колбу-приемник с ортоборатной (борной) кислотой H 3 BO 3: NH 3 + H 3 BO 3 NH 4 BO 2 + H 2 O 2 NH 3 + 4 H 3 BO 3 (NH 4)2 B 4 O 7 + 5 H 2 O Образовавшиеся соли (метаборат NH 4 BO 2 и тетраборат аммония (NH 4)2 B 4 O 7) титруют стандартным раствором хлоридной кислоты HCl в присутствии смешанного индикатора (смесь метилового красного и метиленового синего (2: 1):
 NH 4 BO 2 + HCl + H 2 O NH 4 Cl + H 3 BO 3 (NH 4)2 B 4 O 7 + 2 HCl + 5 H 2 O 2 NH 4 Cl + 4 H 3 BO 3 Эквивалентная масса препарата зависит от числа атомов Нитрогена в молекуле субстанции. 11. Колориметрия Метод основан на получении окрашенных продуктов различных реакций (азокрасителей, комплексов с тяжелыми металлами и др. ). 12. Спектрофотометрия в УФ- или видимой области спектра. Хранение. Список сильнодействующих веществ. В плотно укопоренном контейнере, в сухом, прохладном, защищенном от света месте. В. р. д. для взрослых внутрь 2 г. В. с. д. для взрослых внутрь 7 г.
NH 4 BO 2 + HCl + H 2 O NH 4 Cl + H 3 BO 3 (NH 4)2 B 4 O 7 + 2 HCl + 5 H 2 O 2 NH 4 Cl + 4 H 3 BO 3 Эквивалентная масса препарата зависит от числа атомов Нитрогена в молекуле субстанции. 11. Колориметрия Метод основан на получении окрашенных продуктов различных реакций (азокрасителей, комплексов с тяжелыми металлами и др. ). 12. Спектрофотометрия в УФ- или видимой области спектра. Хранение. Список сильнодействующих веществ. В плотно укопоренном контейнере, в сухом, прохладном, защищенном от света месте. В. р. д. для взрослых внутрь 2 г. В. с. д. для взрослых внутрь 7 г.
 Применение. Химиотерапевтические антибактериальные средства. Сульфаниламиды оказывают бактериостатическое действие, которое связано с нарушением образования микроорганизмами необходимых для их развития ростовых факторов – фолиевой и дигидрофолиевой кислот и других веществ, в молекулу которых входит п -аминобензойная кислота (ПАБК). Сульфаниламиды, которые по строению напоминают ПАБК, являются ее имитаторами, то есть используются микробной клеткой вместо ПАБК и тем самым нарушают в ней обменные процессы. Действуют на стрепто-, пневмо-, стафило- и менингококки, кишечную палочку и поэтому широко применяются для лечения инфекционных заболеваний, вызванных этими возбудителями.
Применение. Химиотерапевтические антибактериальные средства. Сульфаниламиды оказывают бактериостатическое действие, которое связано с нарушением образования микроорганизмами необходимых для их развития ростовых факторов – фолиевой и дигидрофолиевой кислот и других веществ, в молекулу которых входит п -аминобензойная кислота (ПАБК). Сульфаниламиды, которые по строению напоминают ПАБК, являются ее имитаторами, то есть используются микробной клеткой вместо ПАБК и тем самым нарушают в ней обменные процессы. Действуют на стрепто-, пневмо-, стафило- и менингококки, кишечную палочку и поэтому широко применяются для лечения инфекционных заболеваний, вызванных этими возбудителями.
 Для достижения терапевтического эффекта сульфаниламиды необходимо принимать в дозах, достаточных для предупреждения использования микроорганизмами ПАБК, содержащейся в таканях. При недостаточных дозах или слишком раннем прекращении лечения возможно появление устойчивых штаммов возбудителей, не поддающихся в дальнейшем действию сульфаниламидов. Необходимо учитывать, что некоторые препараты, в молекулу которых входит остаток ПАБК (например, новокаин), могут оказывать выраженное антисульфаниламидное действие. Многие сульфаниламидные препараты (стрептоцид, норсульфазол, сульфазин, сульфадимезин, сульфапиридазин, сульфадиметоксин и др. ) относительно легко всасываются и быстро накапливаются в крови и органах в бактериостатических концентрациях и поэтому применяются для лечения различных инфекционных болезней.
Для достижения терапевтического эффекта сульфаниламиды необходимо принимать в дозах, достаточных для предупреждения использования микроорганизмами ПАБК, содержащейся в таканях. При недостаточных дозах или слишком раннем прекращении лечения возможно появление устойчивых штаммов возбудителей, не поддающихся в дальнейшем действию сульфаниламидов. Необходимо учитывать, что некоторые препараты, в молекулу которых входит остаток ПАБК (например, новокаин), могут оказывать выраженное антисульфаниламидное действие. Многие сульфаниламидные препараты (стрептоцид, норсульфазол, сульфазин, сульфадимезин, сульфапиридазин, сульфадиметоксин и др. ) относительно легко всасываются и быстро накапливаются в крови и органах в бактериостатических концентрациях и поэтому применяются для лечения различных инфекционных болезней.
 Другие сульфаниламиды (фталазол, фтазин, сульгин) трудно всасываются, относительно долго находятся в кишечнике в высоких концентрациях, выделяются преимущественно с калом, и поэтому применяются при инфекционных заболеваниях желудочно-кишечного тракта. Уросульфан выделяется в значительных количествах почками и поэтому применяется преимущественно при инфекциях мочевых путей. К сульфаниламидам короткого действия (концентрация в крови уменьшается на 50 % менее чем за 8 часов) относятся: стрептоцид, норсульфазол, этазол, сульфадимезин. Сульфазин – сульфаниламид среднего действия (концентрация в крови уменьшается на 50 % за 8– 16 часов). К препаратам длительного действия (“депосульфаниламиды”, концентрация в крови уменьшается на 50 % менее чем за 24– 48 часов) относятся: сульфапиридазин, сульфадиметоксин, сульфамонометоксин. Концентрация сульфалена – препарата сверхдлителного действия, сохраняется в крови до 7 дней.
Другие сульфаниламиды (фталазол, фтазин, сульгин) трудно всасываются, относительно долго находятся в кишечнике в высоких концентрациях, выделяются преимущественно с калом, и поэтому применяются при инфекционных заболеваниях желудочно-кишечного тракта. Уросульфан выделяется в значительных количествах почками и поэтому применяется преимущественно при инфекциях мочевых путей. К сульфаниламидам короткого действия (концентрация в крови уменьшается на 50 % менее чем за 8 часов) относятся: стрептоцид, норсульфазол, этазол, сульфадимезин. Сульфазин – сульфаниламид среднего действия (концентрация в крови уменьшается на 50 % за 8– 16 часов). К препаратам длительного действия (“депосульфаниламиды”, концентрация в крови уменьшается на 50 % менее чем за 24– 48 часов) относятся: сульфапиридазин, сульфадиметоксин, сульфамонометоксин. Концентрация сульфалена – препарата сверхдлителного действия, сохраняется в крови до 7 дней.
 Скорость выведения из организма в значительной мере определяет величину дозы и частоту приема препарата. Плохо всасывающиеся препараты можно назначать одновременно с хорошо всасывающимися. Сульфаниламиды можно комбинировать с антибиотиками. При приеме сульфаниламидов могут наблюдаться аллергические реакции и побочные явления: тошнота, рвота, дерматиты, нарушения функции почек. Вследствие плохой растворимости сульфаниламидов и их ацетильных производных (особенно в кислой моче), могут образовываться в почках кристаллы, которые могут закупорить мочевые пути. В связи с медленным выделением из организма возможно кумулирование побочных явлений (диспепсические явления, изменения крови, аллергические реакции). Поэтому рекомендуется принимать эти препараты только по предписанию врача. Для предупреждения указанных осложнений приеме сульфаниламидов больные должны получать обильное щелочное питье.
Скорость выведения из организма в значительной мере определяет величину дозы и частоту приема препарата. Плохо всасывающиеся препараты можно назначать одновременно с хорошо всасывающимися. Сульфаниламиды можно комбинировать с антибиотиками. При приеме сульфаниламидов могут наблюдаться аллергические реакции и побочные явления: тошнота, рвота, дерматиты, нарушения функции почек. Вследствие плохой растворимости сульфаниламидов и их ацетильных производных (особенно в кислой моче), могут образовываться в почках кристаллы, которые могут закупорить мочевые пути. В связи с медленным выделением из организма возможно кумулирование побочных явлений (диспепсические явления, изменения крови, аллергические реакции). Поэтому рекомендуется принимать эти препараты только по предписанию врача. Для предупреждения указанных осложнений приеме сульфаниламидов больные должны получать обильное щелочное питье.
 Противопоказано применение указанных препаратов больным с токсико-аллергическими реакциями, возникающими приеме какого-либо сульфаниламида. Формы выпуска: порошок, таблетки по 0, 3 г и 0, 5 г (стертоцид), 0, 2 г и 0, 5 г (сульфадиметоксим), 0, 25 г и 0, 5 г (норсульфазол, сульфадимезин, этазол), 0, 5 г (сульфазин, уросульфан, сульфапиридазин, сульфамонометоксин), 0, 2 г (сульфален), 0, 35 г (бисептол); мазь и линимент стрептоцида и стрептоцида растворимого 5 %, сульфазина серебряной соли 1 %; ампульный раствор этазолнатрия 10 % и 20 % в/в и в/м и сульфацил-натрия 30 % для инъекций, 20 % (очные капли); очные пленки с сульфапиридазин-натрием и др.
Противопоказано применение указанных препаратов больным с токсико-аллергическими реакциями, возникающими приеме какого-либо сульфаниламида. Формы выпуска: порошок, таблетки по 0, 3 г и 0, 5 г (стертоцид), 0, 2 г и 0, 5 г (сульфадиметоксим), 0, 25 г и 0, 5 г (норсульфазол, сульфадимезин, этазол), 0, 5 г (сульфазин, уросульфан, сульфапиридазин, сульфамонометоксин), 0, 2 г (сульфален), 0, 35 г (бисептол); мазь и линимент стрептоцида и стрептоцида растворимого 5 %, сульфазина серебряной соли 1 %; ампульный раствор этазолнатрия 10 % и 20 % в/в и в/м и сульфацил-натрия 30 % для инъекций, 20 % (очные капли); очные пленки с сульфапиридазин-натрием и др.
 Спасибо за внимание !
Спасибо за внимание !


