Lect_3_.PPT
- Количество слайдов: 51
 Структуры элементов кристаллических материалов Для определения фактической структуры веществ часто используют понятие структурного типа, например: «фторид магния кристаллизуется в структурном типе рутила» . Это означает, что для Mg. F 2 пространственное расположение, а также распределение атомов магния и фтора соответствует аналогичной характеристике атомов титана и кислорода в рутиле Ti. O 2. Каждый структурный тип обозначен произвольно выбранным наиболее характерным представителем. Рассмотрим некоторые структурные типы элементов кристаллических материалов. 1
Структуры элементов кристаллических материалов Для определения фактической структуры веществ часто используют понятие структурного типа, например: «фторид магния кристаллизуется в структурном типе рутила» . Это означает, что для Mg. F 2 пространственное расположение, а также распределение атомов магния и фтора соответствует аналогичной характеристике атомов титана и кислорода в рутиле Ti. O 2. Каждый структурный тип обозначен произвольно выбранным наиболее характерным представителем. Рассмотрим некоторые структурные типы элементов кристаллических материалов. 1
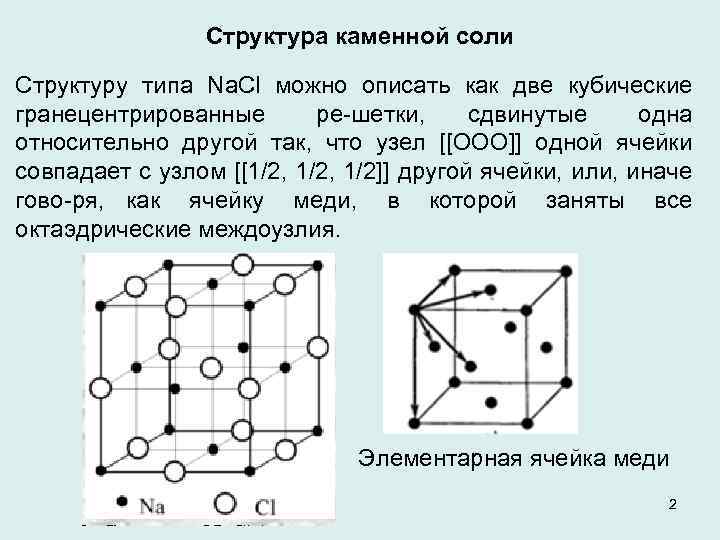 Структура каменной соли Структуру типа Na. Cl можно описать как две кубические гранецентрированные ре шетки, сдвинутые одна относительно другой так, что узел [[ООО]] одной ячейки совпадает с узлом [[1/2, 1/2]] другой ячейки, или, иначе гово ря, как ячейку меди, в которой заняты все октаэдрические междоузлия. Элементарная ячейка меди 2
Структура каменной соли Структуру типа Na. Cl можно описать как две кубические гранецентрированные ре шетки, сдвинутые одна относительно другой так, что узел [[ООО]] одной ячейки совпадает с узлом [[1/2, 1/2]] другой ячейки, или, иначе гово ря, как ячейку меди, в которой заняты все октаэдрические междоузлия. Элементарная ячейка меди 2
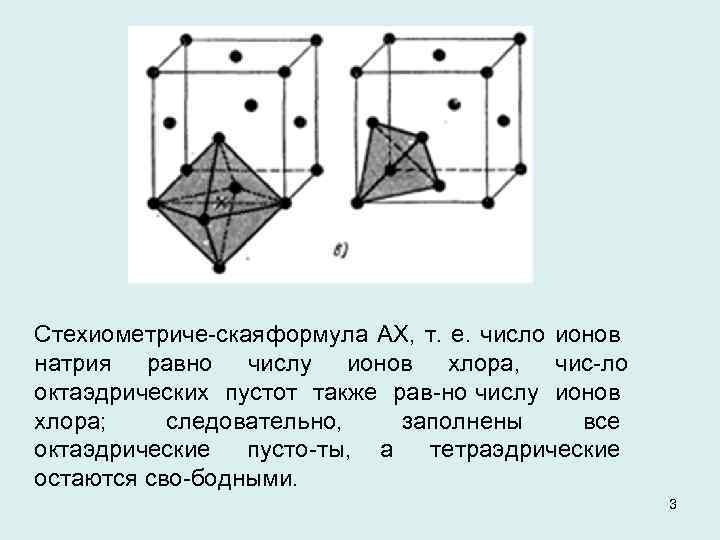 Стехиометриче ская формула АХ, т. е. число ионов натрия равно числу ионов хлора, чис ло октаэдрических пустот также рав но числу ионов хлора; следовательно, заполнены все октаэдрические пусто ты, а тетраэдрические остаются сво бодными. 3
Стехиометриче ская формула АХ, т. е. число ионов натрия равно числу ионов хлора, чис ло октаэдрических пустот также рав но числу ионов хлора; следовательно, заполнены все октаэдрические пусто ты, а тетраэдрические остаются сво бодными. 3
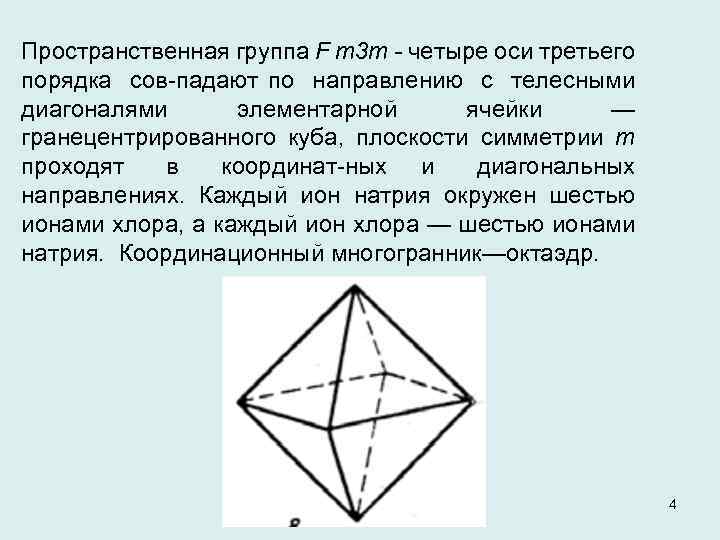 Пространственная группа F m 3 m - четыре оси третьего порядка сов падают по направлению с телесными диагоналями элементарной ячейки — гранецентрированного куба, плоскости симметрии m проходят в координат ных и диагональных направлениях. Каждый ион натрия окружен шестью ионами хлора, а каждый ион хлора — шестью ионами натрия. Координационный многогранник—октаэдр. 4
Пространственная группа F m 3 m - четыре оси третьего порядка сов падают по направлению с телесными диагоналями элементарной ячейки — гранецентрированного куба, плоскости симметрии m проходят в координат ных и диагональных направлениях. Каждый ион натрия окружен шестью ионами хлора, а каждый ион хлора — шестью ионами натрия. Координационный многогранник—октаэдр. 4
 Две взаимо проникающие плотнейшие упаковки: одна — из атомов Cl, другая — из атомов Na. Анионы хлора занимают узлы куби ческой гранецентрированной ячейки и образуют кубическую плотнейшую упаковку. Упаковка трехслойная. . . АВСАВС. . . Катионы натрия заполняют все ок таэдрические пустоты. Структурный тип Na. Cl хорошо подходит для очень полярных соединений, поскольку каждый атом тесно соседствует только с атомами другого элемента. Такую структуру имеют другие галогениды щелочных металлов (кроме галогенидов цезия), оксиды переходных элементов Ti. O, Мn. О, Fe. O, Ni. O, нитриды и карбиды переход ных подгрупп Ti и V, галоиды серебра, сульфиды и селениды свинца и теллура. 5
Две взаимо проникающие плотнейшие упаковки: одна — из атомов Cl, другая — из атомов Na. Анионы хлора занимают узлы куби ческой гранецентрированной ячейки и образуют кубическую плотнейшую упаковку. Упаковка трехслойная. . . АВСАВС. . . Катионы натрия заполняют все ок таэдрические пустоты. Структурный тип Na. Cl хорошо подходит для очень полярных соединений, поскольку каждый атом тесно соседствует только с атомами другого элемента. Такую структуру имеют другие галогениды щелочных металлов (кроме галогенидов цезия), оксиды переходных элементов Ti. O, Мn. О, Fe. O, Ni. O, нитриды и карбиды переход ных подгрупп Ti и V, галоиды серебра, сульфиды и селениды свинца и теллура. 5
 Кристалл Na. Cl является ионным. Кулоновские силы между ионами (ионная связь) с большой степенью приближения можно считать центральными силами. Однако отличие случая ионной связи от задачи о плотных шаровых упаковках заключается в том, что ионы имеют различные ионные радиусы и электрические заряды разного знака. Образование катионов и анионов из нейтральных атомов происходит путем отдачи и присоединения внешних электронов. Поэтому, как правило, радиусы анионов больше радиусов катионов. Понятие о радиусе иона является не чисто геометрическим, а характеризует радиус «сферы действия» данного иона. Анионы − основные по объему «кирпичи» в структуре ионного кристалла. 6
Кристалл Na. Cl является ионным. Кулоновские силы между ионами (ионная связь) с большой степенью приближения можно считать центральными силами. Однако отличие случая ионной связи от задачи о плотных шаровых упаковках заключается в том, что ионы имеют различные ионные радиусы и электрические заряды разного знака. Образование катионов и анионов из нейтральных атомов происходит путем отдачи и присоединения внешних электронов. Поэтому, как правило, радиусы анионов больше радиусов катионов. Понятие о радиусе иона является не чисто геометрическим, а характеризует радиус «сферы действия» данного иона. Анионы − основные по объему «кирпичи» в структуре ионного кристалла. 6
 Потенциальная энергия связи в ионном кристалле в основном определяется энергией кулоновского взаимодействия ионов. Минимум кулоновской энергии требует осуществления конфигурации с чередованием ионов разного знака, что проявляется в шахматном законе чередования ионов в кристалле хлористого натрия. 7
Потенциальная энергия связи в ионном кристалле в основном определяется энергией кулоновского взаимодействия ионов. Минимум кулоновской энергии требует осуществления конфигурации с чередованием ионов разного знака, что проявляется в шахматном законе чередования ионов в кристалле хлористого натрия. 7
 Каждый катион стремится окружить себя возможно большим числом анионов. Число анионов, которым может окружить себя данный катион, зависит от отношения их ионных радиусов rk/ ra. Чем меньше это отношение, тем меньше координационное число иона. Предельные отношения ионных радиусов определяют границы устойчивости соответствующих конфигураций и тем самым последовательность смены структурных типов. Щелочно галоидные соли, например Na. Cl, KCl, Na. Br, имеющие отношение ионных радиусов меньше, чем 0, 73, но больше, чем 0, 414, кристаллизуются в решетках типа Na. Cl с координационным числом 6. 8
Каждый катион стремится окружить себя возможно большим числом анионов. Число анионов, которым может окружить себя данный катион, зависит от отношения их ионных радиусов rk/ ra. Чем меньше это отношение, тем меньше координационное число иона. Предельные отношения ионных радиусов определяют границы устойчивости соответствующих конфигураций и тем самым последовательность смены структурных типов. Щелочно галоидные соли, например Na. Cl, KCl, Na. Br, имеющие отношение ионных радиусов меньше, чем 0, 73, но больше, чем 0, 414, кристаллизуются в решетках типа Na. Cl с координационным числом 6. 8
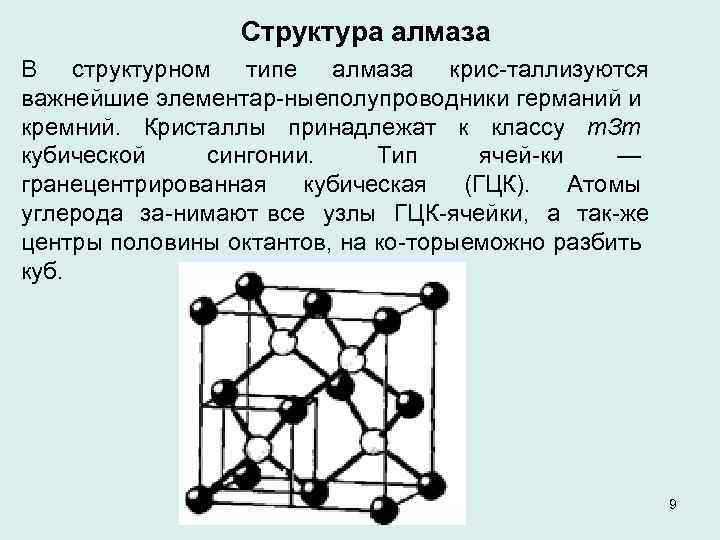 Структура алмаза В структурном типе алмаза крис таллизуются важнейшие элементар ныеполупроводники германий и кремний. Кристаллы принадлежат к классу т. Зт кубической сингонии. Тип ячей ки — гранецентрированная кубическая (ГЦК). Атомы углерода за нимают все узлы ГЦК ячейки, а так же центры половины октантов, на ко торыеможно разбить куб. 9
Структура алмаза В структурном типе алмаза крис таллизуются важнейшие элементар ныеполупроводники германий и кремний. Кристаллы принадлежат к классу т. Зт кубической сингонии. Тип ячей ки — гранецентрированная кубическая (ГЦК). Атомы углерода за нимают все узлы ГЦК ячейки, а так же центры половины октантов, на ко торыеможно разбить куб. 9
 Поскольку каждый октант также является кубом, у которого четыре из его восьми вершин заняты атомами С, в результате реализуется идеаль ная тетраэдрическая координация атома в центре октанта. Заполненные и незапол ненныеоктанты чередуются в шахмат ном порядке: рядом с заполненным октантом — незаполненный, под неза полненным— заполненный и т. д. Это выглядит так, как если бы в эле ментарную ГЦК ячейку вдвинули вто рую такую же ячейку, так что атом [[ООО]] одной из ячеек совпадает с атомом [[1/4, 1/4]] второй ячейки. 10
Поскольку каждый октант также является кубом, у которого четыре из его восьми вершин заняты атомами С, в результате реализуется идеаль ная тетраэдрическая координация атома в центре октанта. Заполненные и незапол ненныеоктанты чередуются в шахмат ном порядке: рядом с заполненным октантом — незаполненный, под неза полненным— заполненный и т. д. Это выглядит так, как если бы в эле ментарную ГЦК ячейку вдвинули вто рую такую же ячейку, так что атом [[ООО]] одной из ячеек совпадает с атомом [[1/4, 1/4]] второй ячейки. 10
 Пространственная группа структуры алмаза F d 3 m; в координатных направ лениях проходят плоскости скользя щего отражения типа d ( «алмазные» ), в диагональных — плоскости типа т. На их пересечениях порождаются винтовые оси 41. Углы между связями 109° 28'. Есть центр симметрии. Каждый атом окружен четырьмя такими же атомами, располагающимися по вер шинам тетраэдра, к. ч. = 4, координационный многогранник — тетраэдр. На одну элементарную ячейку при ходится 8 атомов. Плотнейшей упаковки в структуре нет. 11
Пространственная группа структуры алмаза F d 3 m; в координатных направ лениях проходят плоскости скользя щего отражения типа d ( «алмазные» ), в диагональных — плоскости типа т. На их пересечениях порождаются винтовые оси 41. Углы между связями 109° 28'. Есть центр симметрии. Каждый атом окружен четырьмя такими же атомами, располагающимися по вер шинам тетраэдра, к. ч. = 4, координационный многогранник — тетраэдр. На одну элементарную ячейку при ходится 8 атомов. Плотнейшей упаковки в структуре нет. 11
 Алмаз состоит из сеток углеродных атомов с четырьмя ковалентными связями на атом. Есть плоскости (слои), упакованные плотнее, чем любые дру гие плоскости. Слои двойные, как бы состоящие из двух подслоев: один подслой состоит из атомов, у ко торых вертикально расположенные связи направлены вверх, второй — из атомов, у которых такие же связи на правлены вниз. 12
Алмаз состоит из сеток углеродных атомов с четырьмя ковалентными связями на атом. Есть плоскости (слои), упакованные плотнее, чем любые дру гие плоскости. Слои двойные, как бы состоящие из двух подслоев: один подслой состоит из атомов, у ко торых вертикально расположенные связи направлены вверх, второй — из атомов, у которых такие же связи на правлены вниз. 12
 Подслои двойного слоя соединены между собой тремя связями на атом, а с двумя соседними двойными слоями одной связью на атом. Такое расположение играет су щественную роль в анизотропии ме ханических свойств кристаллов со структурой алмаза. В струк туре существуют шестисторонние «ка налы» , прохо дящиенасквозь. По этим каналам осо бенно легко идет диффузия примесей в кристалле. 13
Подслои двойного слоя соединены между собой тремя связями на атом, а с двумя соседними двойными слоями одной связью на атом. Такое расположение играет су щественную роль в анизотропии ме ханических свойств кристаллов со структурой алмаза. В струк туре существуют шестисторонние «ка налы» , прохо дящиенасквозь. По этим каналам осо бенно легко идет диффузия примесей в кристалле. 13
 Алмаз является ковалентным кристаллом. Ковалентная связь существенно отличается от металлической и ионной тем, что обладает направленностью и, как следствие этого, насыщенностью. Структуры, образованные ковалентно связанными атомами, имеют координационные числа, равные валентности атома. Выполнение этого условия обеспечивает минимум потенциальной энергии. Попытка присоединения дополнительных атомов ведет к повышению потенциальной энергии вследствие отталкивания атомов. Ковалентная химическая связь очень прочна, о чем можно судить на примере типично ковалентного кристалла алмаза, обладающего наибольшей твердостью среди всех твердых тел. 14
Алмаз является ковалентным кристаллом. Ковалентная связь существенно отличается от металлической и ионной тем, что обладает направленностью и, как следствие этого, насыщенностью. Структуры, образованные ковалентно связанными атомами, имеют координационные числа, равные валентности атома. Выполнение этого условия обеспечивает минимум потенциальной энергии. Попытка присоединения дополнительных атомов ведет к повышению потенциальной энергии вследствие отталкивания атомов. Ковалентная химическая связь очень прочна, о чем можно судить на примере типично ковалентного кристалла алмаза, обладающего наибольшей твердостью среди всех твердых тел. 14
 Структура сфалерита Сульфид цинка Zn. S кристаллизуется в виде кубического сфалерита (цинко вой обманки). В сфалерите каждый ион цинка тетраэдрически окружен иона ми серы, а каждый ион серы — иона ми цинка, расположенными по верши нам тетраэдра. Эти структуры рассматриваются как плотнейшая упаковка ионов серы, в которой ионы цинка занимают полови ну тетраэдрических пустот. Структура соответствует плотнейшей кубической упаковке. . . АВСАВС. . . Центра симметрии нет. Полупроводники с такими структурами могут принадле жать к важному классу — пьезоэлектрикам. 15
Структура сфалерита Сульфид цинка Zn. S кристаллизуется в виде кубического сфалерита (цинко вой обманки). В сфалерите каждый ион цинка тетраэдрически окружен иона ми серы, а каждый ион серы — иона ми цинка, расположенными по верши нам тетраэдра. Эти структуры рассматриваются как плотнейшая упаковка ионов серы, в которой ионы цинка занимают полови ну тетраэдрических пустот. Структура соответствует плотнейшей кубической упаковке. . . АВСАВС. . . Центра симметрии нет. Полупроводники с такими структурами могут принадле жать к важному классу — пьезоэлектрикам. 15
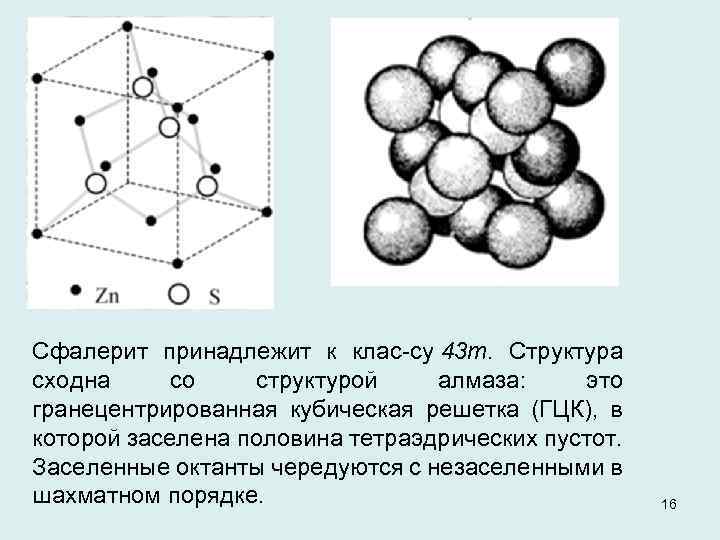 Сфалерит принадлежит к клас су 43 т. Структура сходна со структурой алмаза: это гранецентрированная кубическая решетка (ГЦК), в которой заселена половина тетраэдрических пустот. Заселенные октанты чередуются с незаселенными в шахматном порядке. 16
Сфалерит принадлежит к клас су 43 т. Структура сходна со структурой алмаза: это гранецентрированная кубическая решетка (ГЦК), в которой заселена половина тетраэдрических пустот. Заселенные октанты чередуются с незаселенными в шахматном порядке. 16
 Отличие от структуры алмаза заключается в том, что в алмазе все атомы одинаковы, а в сфалерите атомы одного сорта (на пример, серы) занимают узлы ГЦК ячейки, а атомы другого (например, цинка) — центры четырех октантов. Двойные слои в сфалерите со стоят как бы из двух подслоев разных ионов — подслой цинка и подслой се ры. Поэтому эти слои различны по своим физическим свой ствам. Структуры алмаза и сфалерита име ютодну и ту же ГЦК решетку, но алмаз относится к классу т. Зт, а сфалерит — к 43 т. У алмаза большее богат ство наборов симметрично эквивалент ныхплоскостей и направлений, чем у сфалерита, но значительно меньшая анизотропия фи зических свойств. Пространственная группа сфалерита F 43 m (F d 3 m - алмаз). В отличие от алмаза у 17 сфале рита нет центра симметрии.
Отличие от структуры алмаза заключается в том, что в алмазе все атомы одинаковы, а в сфалерите атомы одного сорта (на пример, серы) занимают узлы ГЦК ячейки, а атомы другого (например, цинка) — центры четырех октантов. Двойные слои в сфалерите со стоят как бы из двух подслоев разных ионов — подслой цинка и подслой се ры. Поэтому эти слои различны по своим физическим свой ствам. Структуры алмаза и сфалерита име ютодну и ту же ГЦК решетку, но алмаз относится к классу т. Зт, а сфалерит — к 43 т. У алмаза большее богат ство наборов симметрично эквивалент ныхплоскостей и направлений, чем у сфалерита, но значительно меньшая анизотропия фи зических свойств. Пространственная группа сфалерита F 43 m (F d 3 m - алмаз). В отличие от алмаза у 17 сфале рита нет центра симметрии.
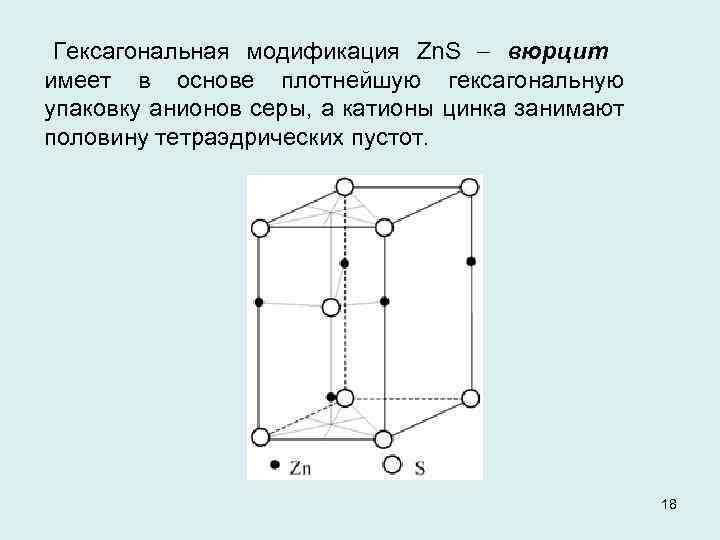 Гексагональная модификация Zn. S вюрцит имеет в основе плотнейшую гексагональную упаковку анионов серы, а катионы цинка занимают половину тетраэдрических пустот. 18
Гексагональная модификация Zn. S вюрцит имеет в основе плотнейшую гексагональную упаковку анионов серы, а катионы цинка занимают половину тетраэдрических пустот. 18
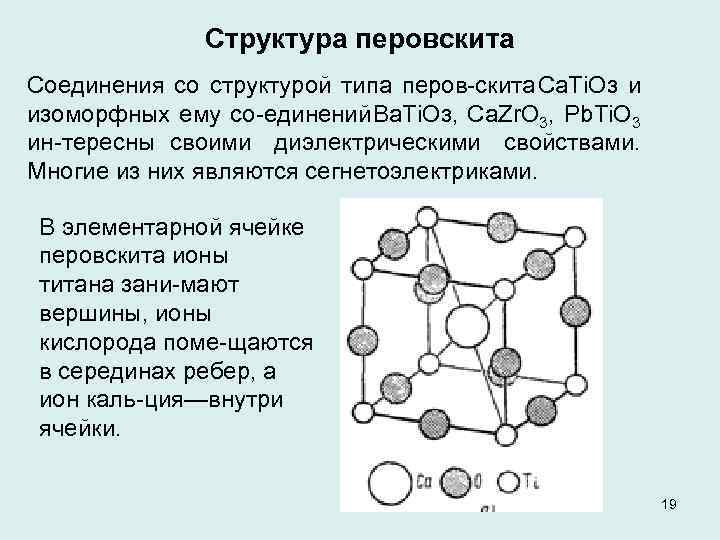 Структура перовскита Соединения со структурой типа перов скита Са. Тi. Oз и изоморфных ему со единений Ва. Тi. Oз, Ca. Zr. O 3, Pb. Ti. O 3 ин тересны своими диэлектрическими свойствами. Многие из них являются сегнетоэлектриками. В элементарной ячейке перовскита ионы титана зани мают вершины, ионы кислорода поме щаются в серединах ребер, а ион каль ция—внутри ячейки. 19
Структура перовскита Соединения со структурой типа перов скита Са. Тi. Oз и изоморфных ему со единений Ва. Тi. Oз, Ca. Zr. O 3, Pb. Ti. O 3 ин тересны своими диэлектрическими свойствами. Многие из них являются сегнетоэлектриками. В элементарной ячейке перовскита ионы титана зани мают вершины, ионы кислорода поме щаются в серединах ребер, а ион каль ция—внутри ячейки. 19
 Ион кальция принадлежит ячейке целиком. Ионы титана, находящиеся в вершинах, дают вклад 8 х 1/8=1; ионы кислорода — 12 х 1/4 = 3. Стехиометрическое отношение Са : Ti: O= 1 : 3, т. е. Са. Тi. Oз, число структурных еди ниц равно 1. Пространственная группа Р т. Зт. По реб ру элементарной ячейки и вдоль диагонали грани, проходят плоскости зеркального отражения т. КЧ Са по О = КЧ О по Са и О=12 ионы кальция и кислоро дасообща образуют плотнейшую упа ковку. Такие случаи, когда катион (в данном случае кальций) имеет к. ч. = 12, встречаются у катионов большо го размера. Такие катионы зани мают положения шаров плотнейшей упаковки. 20
Ион кальция принадлежит ячейке целиком. Ионы титана, находящиеся в вершинах, дают вклад 8 х 1/8=1; ионы кислорода — 12 х 1/4 = 3. Стехиометрическое отношение Са : Ti: O= 1 : 3, т. е. Са. Тi. Oз, число структурных еди ниц равно 1. Пространственная группа Р т. Зт. По реб ру элементарной ячейки и вдоль диагонали грани, проходят плоскости зеркального отражения т. КЧ Са по О = КЧ О по Са и О=12 ионы кальция и кислоро дасообща образуют плотнейшую упа ковку. Такие случаи, когда катион (в данном случае кальций) имеет к. ч. = 12, встречаются у катионов большо го размера. Такие катионы зани мают положения шаров плотнейшей упаковки. 20
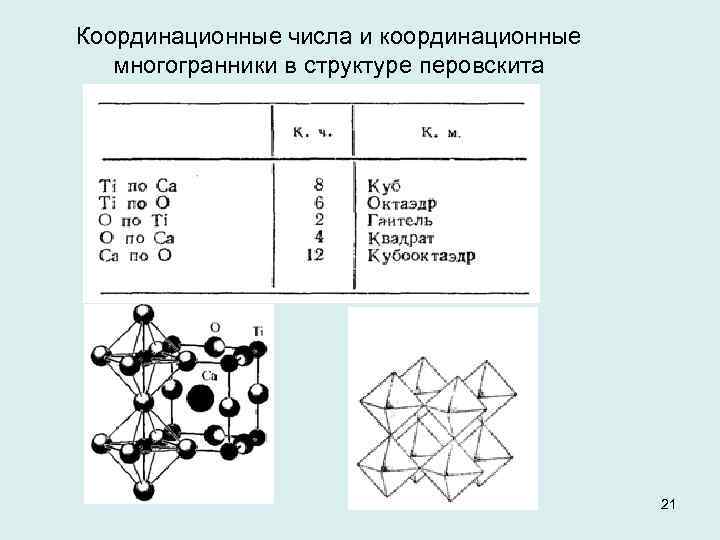 Координационные числа и координационные многогранники в структуре перовскита 21
Координационные числа и координационные многогранники в структуре перовскита 21
 На 4 N шаров плотнейшей упаковки (1 ион кальция и 3 иона кислорода) приходится всего N катионов титана, которые располагаются в октаэдриче ских пустотах между кислородно тита новыми октаэдрами. Иона ми Ti занята всего '/4 октаэдрических пустот, все тетраэдрические пустоты свободны. Кислородно титановые ок таэдры соединяются друг с другом вершинами. Структурный тип перовскита харак терен для соединений АВХз в тех слу чаях, когда размеры иона В позволя ют ему разместиться в октаэдрах из ионов X, а большой катион А по сво имразмерам близок к ионам X. Многие соединения семейства перовскита яв ляются сегнето или антисегнетоэлектриками, пиро и пьезоэлектриками, сегнетомагнетиками, антисег нетомагнетиками, полупроводниками сегнетоэлек 22 триками и очень широко приме няются в технике.
На 4 N шаров плотнейшей упаковки (1 ион кальция и 3 иона кислорода) приходится всего N катионов титана, которые располагаются в октаэдриче ских пустотах между кислородно тита новыми октаэдрами. Иона ми Ti занята всего '/4 октаэдрических пустот, все тетраэдрические пустоты свободны. Кислородно титановые ок таэдры соединяются друг с другом вершинами. Структурный тип перовскита харак терен для соединений АВХз в тех слу чаях, когда размеры иона В позволя ют ему разместиться в октаэдрах из ионов X, а большой катион А по сво имразмерам близок к ионам X. Многие соединения семейства перовскита яв ляются сегнето или антисегнетоэлектриками, пиро и пьезоэлектриками, сегнетомагнетиками, антисег нетомагнетиками, полупроводниками сегнетоэлек 22 триками и очень широко приме няются в технике.
 Структура корунда Структуру корунда а Аl 20 з можно описать как ромбоэдрически деформи рованную структуру Na. Cl в которой ион Na или ион Сl заменен группой Аl 2 Oз. Двухвалентные ионы кислорода образуют приблизительно гексагональную плотнейшую упаковку. . . АВАВАВ. . . , а трехвалентные ионы 2/з алюминия заполняют октаэдриче скихпустот. Корунд кристаллизуется в классе Зт тригональной сингонии. Простран ственная группа. R 3 c. 23
Структура корунда Структуру корунда а Аl 20 з можно описать как ромбоэдрически деформи рованную структуру Na. Cl в которой ион Na или ион Сl заменен группой Аl 2 Oз. Двухвалентные ионы кислорода образуют приблизительно гексагональную плотнейшую упаковку. . . АВАВАВ. . . , а трехвалентные ионы 2/з алюминия заполняют октаэдриче скихпустот. Корунд кристаллизуется в классе Зт тригональной сингонии. Простран ственная группа. R 3 c. 23
 Из за большого электростатического притяжения между катионами алюми ния и анионами кислорода слои кис лороданесколько сближены по срав нениюс их расположением в идеаль ной гексагональной плотнейшей упа ковке. Ионы алюминия поочередно занимают места приблизительно на высотах, равных '/з и 2/з расстояния между слоями ионов кис лорода. Группы из трех ионов кислорода образуют общую плоскость из двух смежных октаэдров, и каждый из этих октаэдров связан с одной и той же парой ионов алюми ния. 24
Из за большого электростатического притяжения между катионами алюми ния и анионами кислорода слои кис лороданесколько сближены по срав нениюс их расположением в идеаль ной гексагональной плотнейшей упа ковке. Ионы алюминия поочередно занимают места приблизительно на высотах, равных '/з и 2/з расстояния между слоями ионов кис лорода. Группы из трех ионов кислорода образуют общую плоскость из двух смежных октаэдров, и каждый из этих октаэдров связан с одной и той же парой ионов алюми ния. 24
 Пары заселенных октаэдров, че редуясь с одним незаселенным, созда ют винтовые оси 31, характеризующие так называемый корундовый мотив упаковки вдоль оси с. Расположение структурных единиц вдоль оси с по вторяетсячерез шесть слоев ионов кислорода с шестью промежуточными слоями ионов алюминия. 25
Пары заселенных октаэдров, че редуясь с одним незаселенным, созда ют винтовые оси 31, характеризующие так называемый корундовый мотив упаковки вдоль оси с. Расположение структурных единиц вдоль оси с по вторяетсячерез шесть слоев ионов кислорода с шестью промежуточными слоями ионов алюминия. 25
 Сильное электростатическое притя жениенаряду с плотной упаковкой обусловливает также высокую твер дость корунда: корунд — один из са мых твердых минералов, по твердости он уступает только алмазу. Чистые кристаллы корунда прозра чныи бесцветны. Примеси, которые легко входят в структуру, окрашива юткорунд в разные цвета: примесь хрома — в красный (рубин), титана— в синий (сапфир), кобальта, урана — в зеленый, железа, никеля, титана — в желтый. 26
Сильное электростатическое притя жениенаряду с плотной упаковкой обусловливает также высокую твер дость корунда: корунд — один из са мых твердых минералов, по твердости он уступает только алмазу. Чистые кристаллы корунда прозра чныи бесцветны. Примеси, которые легко входят в структуру, окрашива юткорунд в разные цвета: примесь хрома — в красный (рубин), титана— в синий (сапфир), кобальта, урана — в зеленый, железа, никеля, титана — в желтый. 26
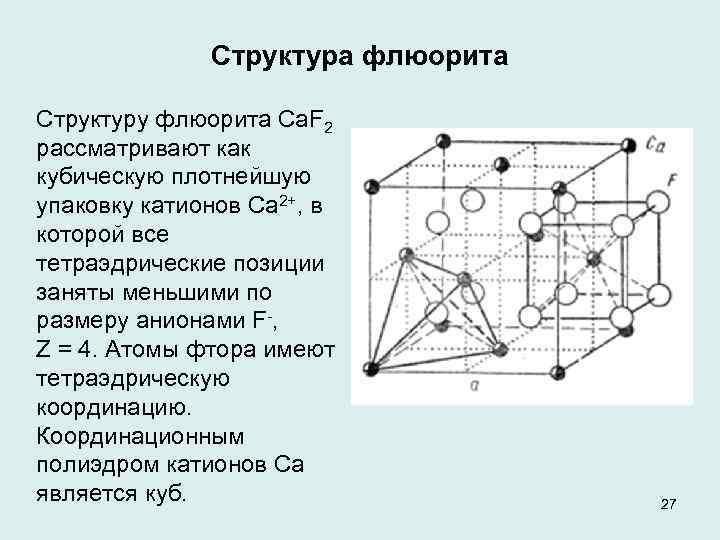 Структура флюорита Структуру флюорита Ca. F 2 рассматривают как кубическую плотнейшую упаковку катионов Ca 2+, в которой все тетраэдрические позиции заняты меньшими по размеру анионами F , Z = 4. Атомы фтора имеют тетраэдрическую координацию. Координационным полиэдром катионов Ca является куб. 27
Структура флюорита Структуру флюорита Ca. F 2 рассматривают как кубическую плотнейшую упаковку катионов Ca 2+, в которой все тетраэдрические позиции заняты меньшими по размеру анионами F , Z = 4. Атомы фтора имеют тетраэдрическую координацию. Координационным полиэдром катионов Ca является куб. 27
![Элементарная ячейка флюорита может состоять либо из четырех кубов [Ca. F 8] либо из Элементарная ячейка флюорита может состоять либо из четырех кубов [Ca. F 8] либо из](https://present5.com/presentation/1015967_132154897/image-28.jpg) Элементарная ячейка флюорита может состоять либо из четырех кубов [Ca. F 8] либо из восьми тетраэдров [FCa 4]. В структуре флюорита катионы и анионы занимают неравноценные позиции в отличие от структур типа каменной соли и сфалерита. В случае структур типа каменной соли и сфалерита безразлично, какой атом поместить в вершину кубической элементарной ячейки. Изображение структуры при этом остается неизменным. 28
Элементарная ячейка флюорита может состоять либо из четырех кубов [Ca. F 8] либо из восьми тетраэдров [FCa 4]. В структуре флюорита катионы и анионы занимают неравноценные позиции в отличие от структур типа каменной соли и сфалерита. В случае структур типа каменной соли и сфалерита безразлично, какой атом поместить в вершину кубической элементарной ячейки. Изображение структуры при этом остается неизменным. 28
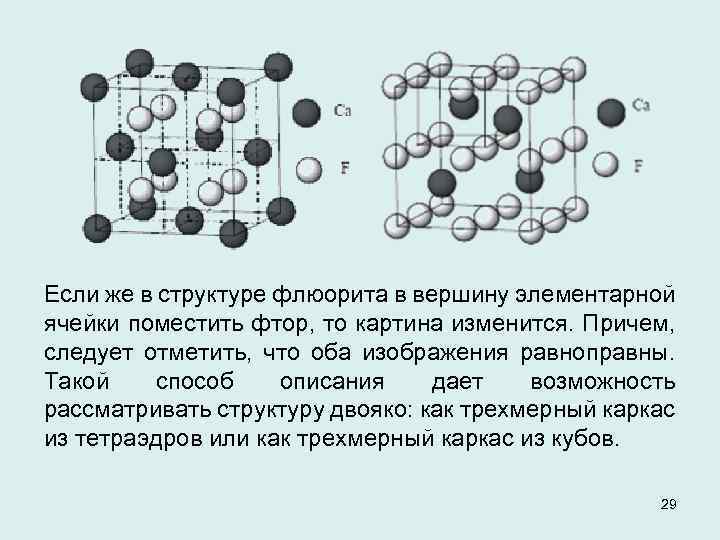 Если же в структуре флюорита в вершину элементарной ячейки поместить фтор, то картина изменится. Причем, следует отметить, что оба изображения равноправны. Такой способ описания дает возможность рассматривать структуру двояко: как трехмерный каркас из тетраэдров или как трехмерный каркас из кубов. 29
Если же в структуре флюорита в вершину элементарной ячейки поместить фтор, то картина изменится. Причем, следует отметить, что оба изображения равноправны. Такой способ описания дает возможность рассматривать структуру двояко: как трехмерный каркас из тетраэдров или как трехмерный каркас из кубов. 29
 Структура Mg. B 2 Диборид магния Mg. B 2 переходит в сверхпроводящее состояние при рекордно высокой для такого класса соединений температуре 40 K. Интерес к этому соединению вызван тем, что оно очень простое, как по кристаллографической, так и по электронной структуре. Из всех двухэлементных соединений у Mg. B 2 самая высокая температура перехода в сверхпроводящее состояние (Tc). Это связано с тех, что атомы бора очень легкие, а чем легче атомы, тем дольше сохраняется сверхпроводимость. Получение его, в отличие от керамик, также не представляет трудностей. 30
Структура Mg. B 2 Диборид магния Mg. B 2 переходит в сверхпроводящее состояние при рекордно высокой для такого класса соединений температуре 40 K. Интерес к этому соединению вызван тем, что оно очень простое, как по кристаллографической, так и по электронной структуре. Из всех двухэлементных соединений у Mg. B 2 самая высокая температура перехода в сверхпроводящее состояние (Tc). Это связано с тех, что атомы бора очень легкие, а чем легче атомы, тем дольше сохраняется сверхпроводимость. Получение его, в отличие от керамик, также не представляет трудностей. 30
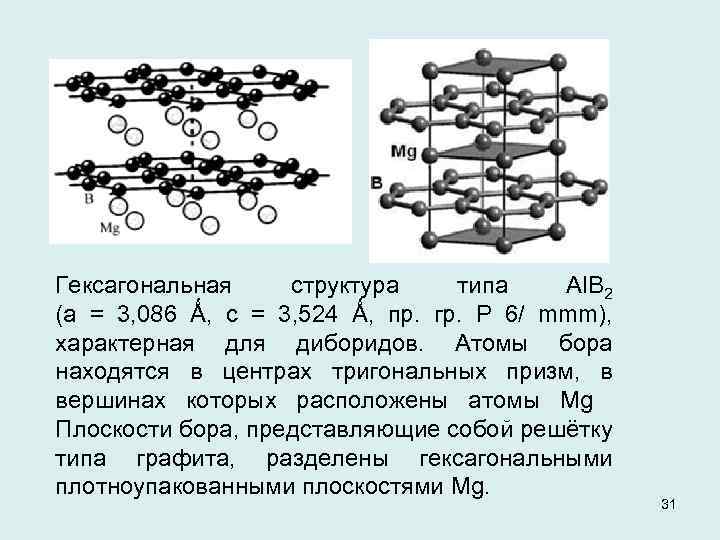 Гексагональная структура типа Al. B 2 (a = 3, 086 Ǻ, c = 3, 524 Ǻ, пр. гр. P 6/ mmm), характерная для диборидов. Атомы бора находятся в центрах тригональных призм, в вершинах которых расположены атомы Mg Плоскости бора, представляющие собой решётку типа графита, разделены гексагональными плотноупакованными плоскостями Mg. 31
Гексагональная структура типа Al. B 2 (a = 3, 086 Ǻ, c = 3, 524 Ǻ, пр. гр. P 6/ mmm), характерная для диборидов. Атомы бора находятся в центрах тригональных призм, в вершинах которых расположены атомы Mg Плоскости бора, представляющие собой решётку типа графита, разделены гексагональными плотноупакованными плоскостями Mg. 31
 Реальные кристаллы Атомные нарушения структуры кристалла В идеальном кристалле при термодинамическом рав новесии расположение материальных частиц характеризуется строгой трех мерной периодичностью. Геометриче ской схемой периодичности является пространственная решетка. Физические свойства идеального кристалла определяются его химичес кимсоставом, силами связи между частицами и симметрией кристалла, т. е. категорией, сингонией, классом симметрии. Все реальные твердые тела (монокристаллические и поликристаллические) содержат дефекты структуры, являющиеся нарушениями периодичности пространственного расположения атомов. 32
Реальные кристаллы Атомные нарушения структуры кристалла В идеальном кристалле при термодинамическом рав новесии расположение материальных частиц характеризуется строгой трех мерной периодичностью. Геометриче ской схемой периодичности является пространственная решетка. Физические свойства идеального кристалла определяются его химичес кимсоставом, силами связи между частицами и симметрией кристалла, т. е. категорией, сингонией, классом симметрии. Все реальные твердые тела (монокристаллические и поликристаллические) содержат дефекты структуры, являющиеся нарушениями периодичности пространственного расположения атомов. 32
 Влияние дефектов на свойства кристаллов определяется характером сил связи в кристаллах, их энергетической структурой (металлы, полупроводники или диэлектрики). Изменения физических свойств и придание новых оптических, электронных, механических и других характеристик можно осуществить введением или изменением концентрации дефектов в них. Таким образом, в реальных кристаллах многие свойства существенно зависят не толь ко от типа равновесной кристалличе ской структуры, но и от дефектов этой структуры 33
Влияние дефектов на свойства кристаллов определяется характером сил связи в кристаллах, их энергетической структурой (металлы, полупроводники или диэлектрики). Изменения физических свойств и придание новых оптических, электронных, механических и других характеристик можно осуществить введением или изменением концентрации дефектов в них. Таким образом, в реальных кристаллах многие свойства существенно зависят не толь ко от типа равновесной кристалличе ской структуры, но и от дефектов этой структуры 33
 По своей природе дефекты решетки идеального кристалла разделяют на собственные (или структурные) и примесные (химические). Под химическими дефектами понимают связанные с наличием примесей отклонения от правильной решетки идеального кристалла. К структурным, собственным, дефектам относят геометрические отклонения от регулярного расположения атомов в идеальном кристалле. Геометрическая классификация структурных дефектов основывается на их пространственной протяженности, по отношению к числу направлений в которых нарушено периодическое расположение атомов в решетке. 34
По своей природе дефекты решетки идеального кристалла разделяют на собственные (или структурные) и примесные (химические). Под химическими дефектами понимают связанные с наличием примесей отклонения от правильной решетки идеального кристалла. К структурным, собственным, дефектам относят геометрические отклонения от регулярного расположения атомов в идеальном кристалле. Геометрическая классификация структурных дефектов основывается на их пространственной протяженности, по отношению к числу направлений в которых нарушено периодическое расположение атомов в решетке. 34
 Выделяют следующие типы атомных дефектов решетки. Точечные, или нульмерные дефекты нарушения периодичности в изолированных друг от друга точ ках решетки. Во всех трех измерениях они не превышают одного или не скольких параметров решетки. Точечные де фекты это вакансии, атомы в меж доузлиях, атомы в узлах «чужой» подрешетки, примесные атомы в узлах или междоузлиях. Линейные дефекты — одномер ные, т. е. протяженные в одном изме рении. Нарушения периодичности в од ном измерении простираются на рас стояния, сравнимые с размером крис талла, а в двух других измерениях не превышают нескольких параметров решетки. Специфические линейные дефекты – дислокации. Неустой чивые линейные дефекты могут возни кать из цепочек точечных дефектов. Дефекты возникают при росте кристалла или в результате раз личных воздействий на кристалл и су щественно влияют 35 на свойства крис талла.
Выделяют следующие типы атомных дефектов решетки. Точечные, или нульмерные дефекты нарушения периодичности в изолированных друг от друга точ ках решетки. Во всех трех измерениях они не превышают одного или не скольких параметров решетки. Точечные де фекты это вакансии, атомы в меж доузлиях, атомы в узлах «чужой» подрешетки, примесные атомы в узлах или междоузлиях. Линейные дефекты — одномер ные, т. е. протяженные в одном изме рении. Нарушения периодичности в од ном измерении простираются на рас стояния, сравнимые с размером крис талла, а в двух других измерениях не превышают нескольких параметров решетки. Специфические линейные дефекты – дислокации. Неустой чивые линейные дефекты могут возни кать из цепочек точечных дефектов. Дефекты возникают при росте кристалла или в результате раз личных воздействий на кристалл и су щественно влияют 35 на свойства крис талла.
 Точечные дефекты Точечный дефект − локальное нарушение кристаллической структуры, размеры которого во всех трех измерениях сравнимы с одним или несколькими (немногими) межатомными расстояниями. Простейшие точечные дефекты кристалла: вакансии отсутствие атома или иона в узле кристаллической решетки; внедренные, или междоузельные, атомы или ионы располагающиеся между узлами. Внедренными могут быть как собственные, так и примесные атомы или ионы, отличающиеся от основных атомов по размеру или валентности. Примеси замещения заменяют частицы основного вещества в узлах решетки. Они внедряются в решетку тем легче, чем ближе атомные (ионные) радиусы примесного и 36 основного вещества.
Точечные дефекты Точечный дефект − локальное нарушение кристаллической структуры, размеры которого во всех трех измерениях сравнимы с одним или несколькими (немногими) межатомными расстояниями. Простейшие точечные дефекты кристалла: вакансии отсутствие атома или иона в узле кристаллической решетки; внедренные, или междоузельные, атомы или ионы располагающиеся между узлами. Внедренными могут быть как собственные, так и примесные атомы или ионы, отличающиеся от основных атомов по размеру или валентности. Примеси замещения заменяют частицы основного вещества в узлах решетки. Они внедряются в решетку тем легче, чем ближе атомные (ионные) радиусы примесного и 36 основного вещества.
 Примеси внедрения занимают междоузлия и при том тем легче, чем больше объем пространства между атомами. В плотно упакованных ГЦК металлах меньшие по размерам примесные атомы В, С, Si, N, О внедряются в тетраэдрические или октаэдрические междоузлия или же вытесняют из узла атом и образуют с ним пару типа гантели. В полупроводниковых кристаллах со структурой типа алмаза или сфалерита атомы примеси внедряются в четыре незанятые тетраэдрические пустоты или в пустоту в центре ГЦК ячейки. 37
Примеси внедрения занимают междоузлия и при том тем легче, чем больше объем пространства между атомами. В плотно упакованных ГЦК металлах меньшие по размерам примесные атомы В, С, Si, N, О внедряются в тетраэдрические или октаэдрические междоузлия или же вытесняют из узла атом и образуют с ним пару типа гантели. В полупроводниковых кристаллах со структурой типа алмаза или сфалерита атомы примеси внедряются в четыре незанятые тетраэдрические пустоты или в пустоту в центре ГЦК ячейки. 37
 Основные типы точечных дефектов в кристаллической решетке: А атом примеси замещения; В вакансия; С атом в междоузлии; D атом примеси внедрения; Е дивакансия. 38
Основные типы точечных дефектов в кристаллической решетке: А атом примеси замещения; В вакансия; С атом в междоузлии; D атом примеси внедрения; Е дивакансия. 38
 Точечные дефекты могут двигаться через кристалл, взаимодействовать друг с другом и с другими дефектами. Встречаясь друг с другом, вакансия и междоузельный атом могут аннигилировать. Вакансии и внедренные атомы су ществуют в кристаллах любой струк туры и при любой температуре. Концентрация точеч ных дефектов равна нулю при темпе ратуре 0 К и быстро растет с повыше нием температуры. Даже в кристалле, находящемся в состоянии термодина мического равновесия, всегда есть не которое количество точечных дефектов. Важнейшей особенностью точечных дефектов в ионных и ковалентных кристаллах является то, что они могут быть как электрически нейтральны, так и иметь заряд. Однако в целом кристалл остается электрически нейтральным. 39
Точечные дефекты могут двигаться через кристалл, взаимодействовать друг с другом и с другими дефектами. Встречаясь друг с другом, вакансия и междоузельный атом могут аннигилировать. Вакансии и внедренные атомы су ществуют в кристаллах любой струк туры и при любой температуре. Концентрация точеч ных дефектов равна нулю при темпе ратуре 0 К и быстро растет с повыше нием температуры. Даже в кристалле, находящемся в состоянии термодина мического равновесия, всегда есть не которое количество точечных дефектов. Важнейшей особенностью точечных дефектов в ионных и ковалентных кристаллах является то, что они могут быть как электрически нейтральны, так и иметь заряд. Однако в целом кристалл остается электрически нейтральным. 39
 Условие электронейтральности обеспечивается образованием равного количества положительно и отрицательно заряженных дефектов, либо образованием сложных дефектов, либо же образованием свободных электронов и «дырок» . Точечные дефекты могут взаимодействовать друг с другом, образуя различные нейтральные сочетания. Нейтрализация дефектов решетки с помощью электронов и дырок тем более вероятна, чем больше электронов и дырок в зоне проводимости кристалла, т. е. чем уже запрещенная зона. Дефекты такого типа имеются в полупроводниках. В кристаллах с широкой запрещенной зоной, т. е. в диэлектриках, более вероятна нейтрализация точечных дефектов друг с другом путем образования парных дефектов Френкеля или дефектов Шоттки. 40
Условие электронейтральности обеспечивается образованием равного количества положительно и отрицательно заряженных дефектов, либо образованием сложных дефектов, либо же образованием свободных электронов и «дырок» . Точечные дефекты могут взаимодействовать друг с другом, образуя различные нейтральные сочетания. Нейтрализация дефектов решетки с помощью электронов и дырок тем более вероятна, чем больше электронов и дырок в зоне проводимости кристалла, т. е. чем уже запрещенная зона. Дефекты такого типа имеются в полупроводниках. В кристаллах с широкой запрещенной зоной, т. е. в диэлектриках, более вероятна нейтрализация точечных дефектов друг с другом путем образования парных дефектов Френкеля или дефектов Шоттки. 40
 Дефекты по Френкелю В кристалле всегда найдется некоторое количество атомов с энергией, достаточной для выхода атома из узла кристаллической решетки. Перемещаясь по кристаллу и отдавая часть своей энергии другим атомам, такой атом может разместиться в междоузлиях. Совокупность атома в междоузлии и противоположно заряженной вакансии называется дефектом по Френкелю. Дефекты по Френкелю легко возникают в кристаллах, содержащих значительные межатомные пустоты, например, алмазе или каменной соли. В кристаллической решетке металлов с плотной упаковкой это могут быть примесные атомы с меньшими радиусами. 41
Дефекты по Френкелю В кристалле всегда найдется некоторое количество атомов с энергией, достаточной для выхода атома из узла кристаллической решетки. Перемещаясь по кристаллу и отдавая часть своей энергии другим атомам, такой атом может разместиться в междоузлиях. Совокупность атома в междоузлии и противоположно заряженной вакансии называется дефектом по Френкелю. Дефекты по Френкелю легко возникают в кристаллах, содержащих значительные межатомные пустоты, например, алмазе или каменной соли. В кристаллической решетке металлов с плотной упаковкой это могут быть примесные атомы с меньшими радиусами. 41
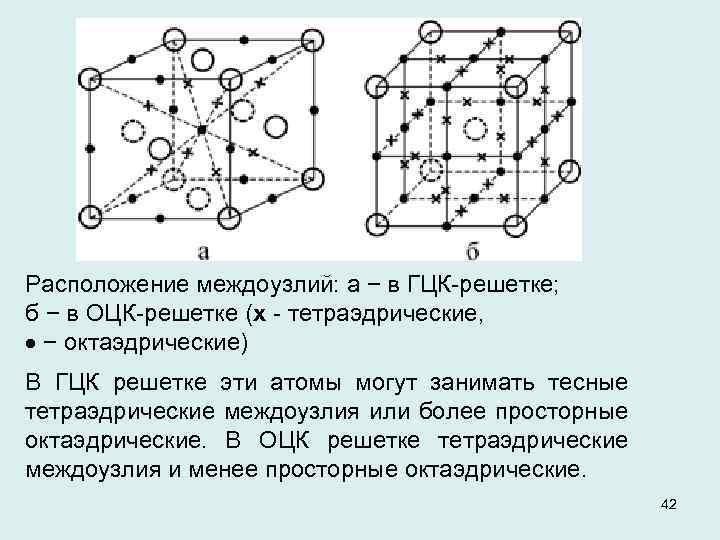 Расположение междоузлий: а − в ГЦК решетке; б − в ОЦК решетке (х тетраэдрические, − октаэдрические) В ГЦК решетке эти атомы могут занимать тесные тетраэдрические междоузлия или более просторные октаэдрические. В ОЦК решетке тетраэдрические междоузлия и менее просторные октаэдрические. 42
Расположение междоузлий: а − в ГЦК решетке; б − в ОЦК решетке (х тетраэдрические, − октаэдрические) В ГЦК решетке эти атомы могут занимать тесные тетраэдрические междоузлия или более просторные октаэдрические. В ОЦК решетке тетраэдрические междоузлия и менее просторные октаэдрические. 42
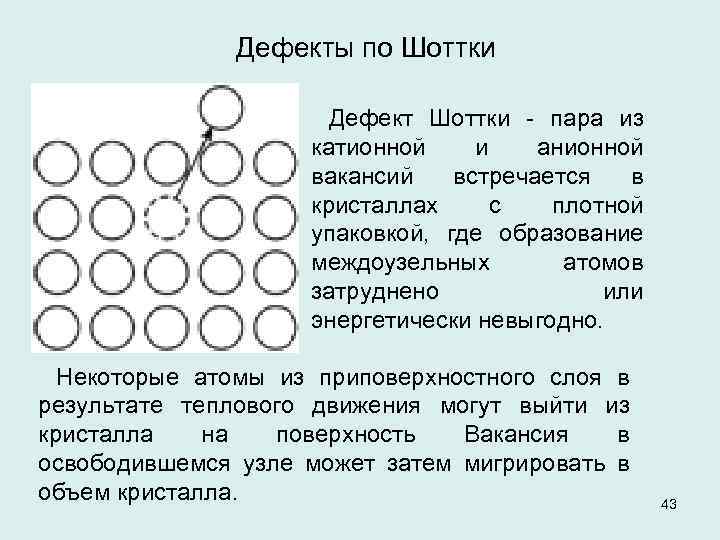 Дефекты по Шоттки Дефект Шоттки пара из катионной и анионной вакансий встречается в кристаллах с плотной упаковкой, где образование междоузельных атомов затруднено или энергетически невыгодно. Некоторые атомы из приповерхностного слоя в результате теплового движения могут выйти из кристалла на поверхность Вакансия в освободившемся узле может затем мигрировать в объем кристалла. 43
Дефекты по Шоттки Дефект Шоттки пара из катионной и анионной вакансий встречается в кристаллах с плотной упаковкой, где образование междоузельных атомов затруднено или энергетически невыгодно. Некоторые атомы из приповерхностного слоя в результате теплового движения могут выйти из кристалла на поверхность Вакансия в освободившемся узле может затем мигрировать в объем кристалла. 43
 Образование дефектов по Шоттки, уменьшает плотность кристалла, т. к. растет его объем при постоянной массе, тогда как при образовании дефектов Френкеля плотность остается неизменной, поскольку объем тела не меняется. Измерения плотности показывают, что, например, в чистых щелочно галоидных кристаллах преобладают дефекты по Шоттки, тогда как для чистых кристаллов галогенидов серебра характерны дефекты Френкеля. 44
Образование дефектов по Шоттки, уменьшает плотность кристалла, т. к. растет его объем при постоянной массе, тогда как при образовании дефектов Френкеля плотность остается неизменной, поскольку объем тела не меняется. Измерения плотности показывают, что, например, в чистых щелочно галоидных кристаллах преобладают дефекты по Шоттки, тогда как для чистых кристаллов галогенидов серебра характерны дефекты Френкеля. 44
 Дефект Шоттки пара из катионной и анионной вакансий, часто встречается в щелочно галоидных кристаллах. Наличие дефектов Шоттки уменьшает плотность кристалла, поскольку атом, образовавший вакансию, диффундирует на поверхность кристалла. Дефект Френкеля вакансия и противоположно заряженный атом в междоузлии — преобладает в кристаллах типа галоидов серебра (Ag. Cl, Ag. Br). Эти дефекты не влияют на плотность кристалла. 45
Дефект Шоттки пара из катионной и анионной вакансий, часто встречается в щелочно галоидных кристаллах. Наличие дефектов Шоттки уменьшает плотность кристалла, поскольку атом, образовавший вакансию, диффундирует на поверхность кристалла. Дефект Френкеля вакансия и противоположно заряженный атом в междоузлии — преобладает в кристаллах типа галоидов серебра (Ag. Cl, Ag. Br). Эти дефекты не влияют на плотность кристалла. 45
 Дислокации Линейные искажения типа обрыва или сдвига атомных слоев, нарушающие правильность их чередования в решетке. Они представляют собой границу между областью, в которой уже прошла пластическая деформация (пластический сдвиг), и областью, где деформации еще нет. Краевую дислокацию в кристалле можно представить как границу неполной атомной плоскости. Она возникает при сдвиге на одно межатомное расстояние одной части кристалла относительно другой, вдоль какой либо плоскости. Сдвиг, создавший краевую дислокацию, имеет направление вектор сдвига b. 46
Дислокации Линейные искажения типа обрыва или сдвига атомных слоев, нарушающие правильность их чередования в решетке. Они представляют собой границу между областью, в которой уже прошла пластическая деформация (пластический сдвиг), и областью, где деформации еще нет. Краевую дислокацию в кристалле можно представить как границу неполной атомной плоскости. Она возникает при сдвиге на одно межатомное расстояние одной части кристалла относительно другой, вдоль какой либо плоскости. Сдвиг, создавший краевую дислокацию, имеет направление вектор сдвига b. 46
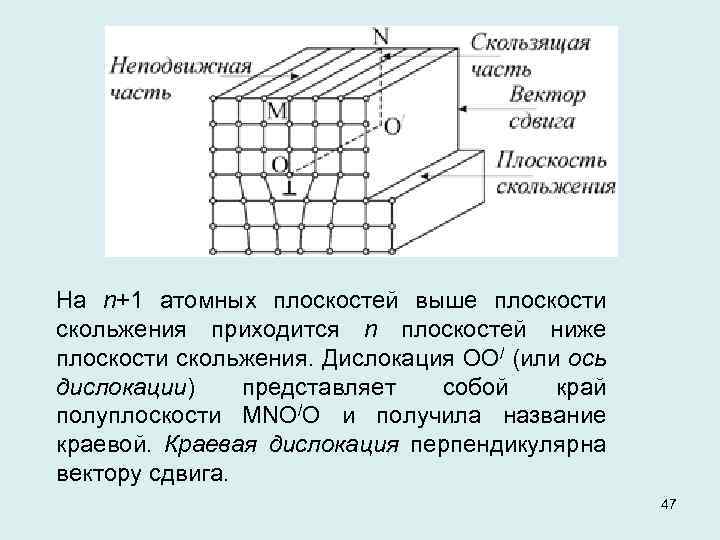 На n+1 атомных плоскостей выше плоскости скольжения приходится n плоскостей ниже плоскости скольжения. Дислокация ОО/ (или ось дислокации) представляет собой край полуплоскости MNO/O и получила название краевой. Краевая дислокация перпендикулярна вектору сдвига. 47
На n+1 атомных плоскостей выше плоскости скольжения приходится n плоскостей ниже плоскости скольжения. Дислокация ОО/ (или ось дислокации) представляет собой край полуплоскости MNO/O и получила название краевой. Краевая дислокация перпендикулярна вектору сдвига. 47
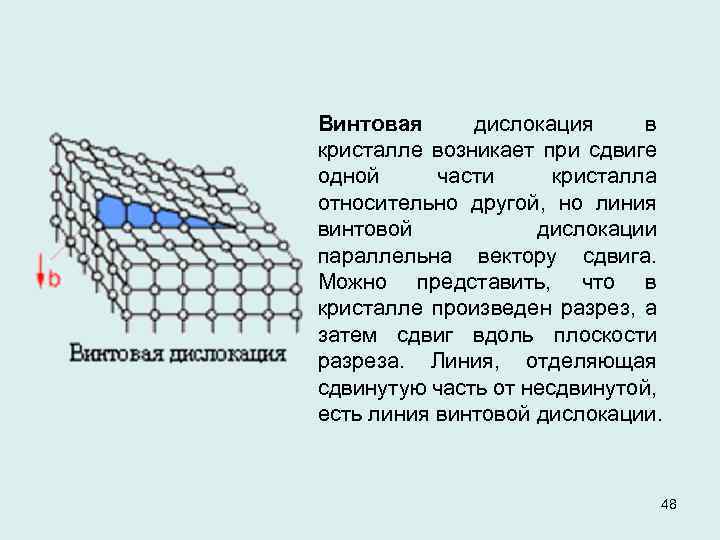 Винтовая дислокация в кристалле возникает при сдвиге одной части кристалла относительно другой, но линия винтовой дислокации параллельна вектору сдвига. Можно представить, что в кристалле произведен разрез, а затем сдвиг вдоль плоскости разреза. Линия, отделяющая сдвинутую часть от несдвинутой, есть линия винтовой дислокации. 48
Винтовая дислокация в кристалле возникает при сдвиге одной части кристалла относительно другой, но линия винтовой дислокации параллельна вектору сдвига. Можно представить, что в кристалле произведен разрез, а затем сдвиг вдоль плоскости разреза. Линия, отделяющая сдвинутую часть от несдвинутой, есть линия винтовой дислокации. 48
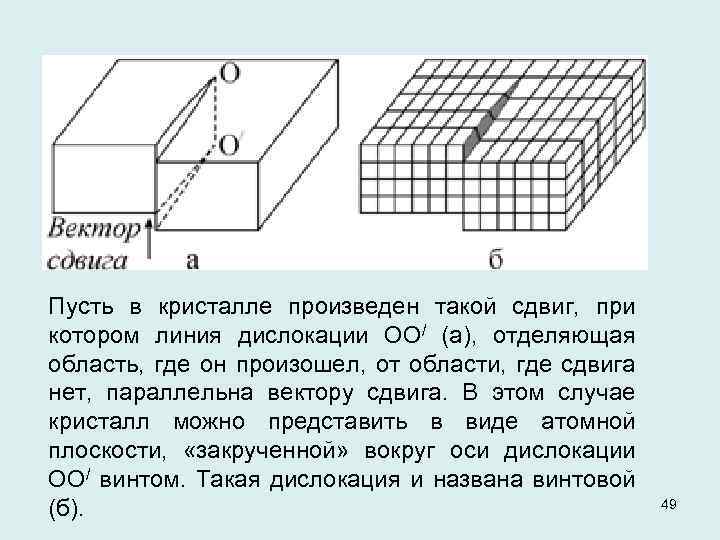 Пусть в кристалле произведен такой сдвиг, при котором линия дислокации ОО/ (а), отделяющая область, где он произошел, от области, где сдвига нет, параллельна вектору сдвига. В этом случае кристалл можно представить в виде атомной плоскости, «закрученной» вокруг оси дислокации ОО/ винтом. Такая дислокация и названа винтовой (б). 49
Пусть в кристалле произведен такой сдвиг, при котором линия дислокации ОО/ (а), отделяющая область, где он произошел, от области, где сдвига нет, параллельна вектору сдвига. В этом случае кристалл можно представить в виде атомной плоскости, «закрученной» вокруг оси дислокации ОО/ винтом. Такая дислокация и названа винтовой (б). 49
 Итак, дислокация это граница области незавершенного сдвига или нарушение правильности структуры вдоль некоторой линии, которая не может оборваться внутри кристалла. Чтобы в идеальном кристалле образовалась дислокация, необходимо произвести сдвиг в некоторой части плоскости скольжения. Для этого нужно приложить силу. Cдвиг в кристаллах происходит не путем смещения одних атомных плоскостей относительно других, а путем скольжения дислокаций, имеющихся в кристалле. Часто дислокации в кристалле появляются уже на стадии его роста. Получить кристаллы, не содержащие дислокации, очень сложно. Даже в совершенных кристаллах их плотность (число дислокаций, пересекающих единичную площадку внутри кристалла) достигает сотен тысяч на кв. см. 50
Итак, дислокация это граница области незавершенного сдвига или нарушение правильности структуры вдоль некоторой линии, которая не может оборваться внутри кристалла. Чтобы в идеальном кристалле образовалась дислокация, необходимо произвести сдвиг в некоторой части плоскости скольжения. Для этого нужно приложить силу. Cдвиг в кристаллах происходит не путем смещения одних атомных плоскостей относительно других, а путем скольжения дислокаций, имеющихся в кристалле. Часто дислокации в кристалле появляются уже на стадии его роста. Получить кристаллы, не содержащие дислокации, очень сложно. Даже в совершенных кристаллах их плотность (число дислокаций, пересекающих единичную площадку внутри кристалла) достигает сотен тысяч на кв. см. 50
 Влияние дислокаций на свойства твердых тел Дислокация «слабое место» структуры, в котором создается локальная концентрация напряжений. Их наличие влияет на механические свойства твердых тел (упругость, пластичность, прочность, внутреннее трение), для которых их присутствие часто является определяющим В прозрачных кристаллах, например, это приводит к изменению оптических свойств, которое выражается в «декорировании» кристалла, т. е. изменении его прозрачности из за коагуляции примесей на дислокации. Наличие дислокаций повышает электросопротивление проводников и изменяет концентрацию свободных электронов в полупроводниках. Значительную роль играют дислокации в магнитных кристаллах, существенно влияя на различные релаксационные явления. 51
Влияние дислокаций на свойства твердых тел Дислокация «слабое место» структуры, в котором создается локальная концентрация напряжений. Их наличие влияет на механические свойства твердых тел (упругость, пластичность, прочность, внутреннее трение), для которых их присутствие часто является определяющим В прозрачных кристаллах, например, это приводит к изменению оптических свойств, которое выражается в «декорировании» кристалла, т. е. изменении его прозрачности из за коагуляции примесей на дислокации. Наличие дислокаций повышает электросопротивление проводников и изменяет концентрацию свободных электронов в полупроводниках. Значительную роль играют дислокации в магнитных кристаллах, существенно влияя на различные релаксационные явления. 51


