Моя клетка_годовой_ч1.pptx
- Количество слайдов: 86

Структура и функции растительной клетки Брейгина Мария Александровна
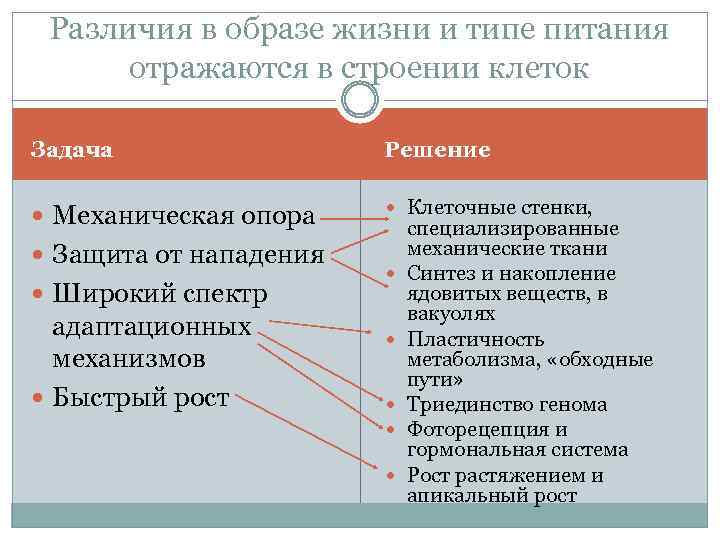
Различия в образе жизни и типе питания отражаются в строении клеток Задача Решение Механическая опора Клеточные стенки, Защита от нападения Широкий спектр адаптационных механизмов Быстрый рост специализированные механические ткани Синтез и накопление ядовитых веществ, в вакуолях Пластичность метаболизма, «обходные пути» Триединство генома Фоторецепция и гормональная система Рост растяжением и апикальный рост
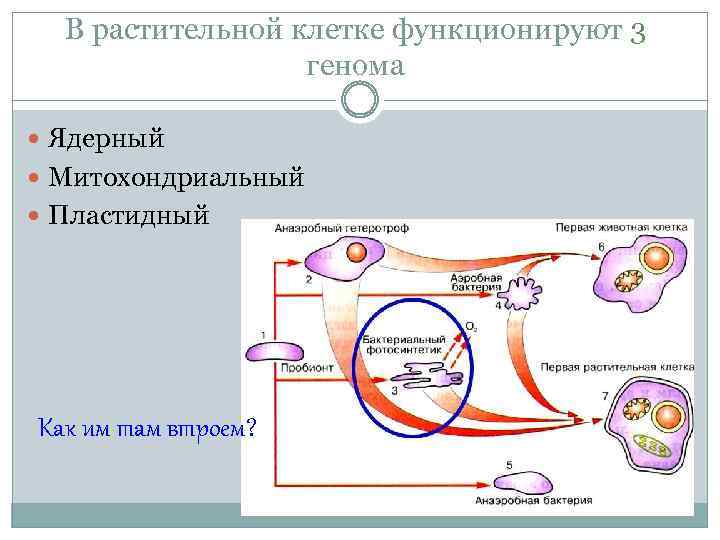
В растительной клетке функционируют 3 генома Ядерный Митохондриальный Пластидный Как им там втроем?

Ядерный геном растений может сильно различаться по величине Arabidopsis thaliana 2 n=10 115 million base pairs Allium cepa 2 n=16 15300 million base pairs Различия за счет повторов. Количество генов у Арабидопсиса и у Лука практически одинаковое.

Покрытосеменные Голосеменные Млекопитающие Рептилии Птицы Рыбы Членистоногие Кольчатые черви Нематоды Моллюски Иглокожие Кищечнополостные Одноклеточные Водоросли Грибы Грам+ Бактерии Грам- Бактерии Микоплазма
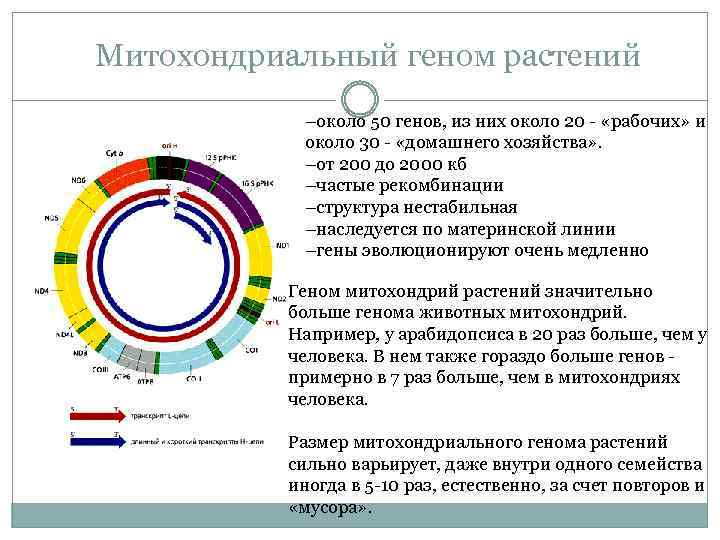
Митохондриальный геном растений –около 50 генов, из них около 20 - «рабочих» и около 30 - «домашнего хозяйства» . –от 200 до 2000 кб –частые рекомбинации –структура нестабильная –наследуется по материнской линии –гены эволюционируют очень медленно Геном митохондрий растений значительно больше генома животных митохондрий. Например, у арабидопсиса в 20 раз больше, чем у человека. В нем также гораздо больше генов примерно в 7 раз больше, чем в митохондриях человека. Размер митохондриального генома растений сильно варьирует, даже внутри одного семейства иногда в 5 -10 раз, естественно, за счет повторов и «мусора» .
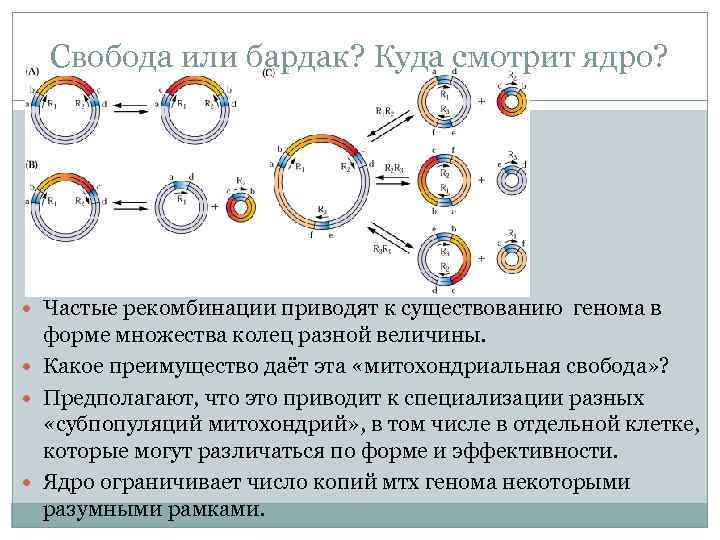
Свобода или бардак? Куда смотрит ядро? Частые рекомбинации приводят к существованию генома в форме множества колец разной величины. Какое преимущество даёт эта «митохондриальная свобода» ? Предполагают, что это приводит к специализации разных «субпопуляций митохондрий» , в том числе в отдельной клетке, которые могут различаться по форме и эффективности. Ядро ограничивает число копий мтх генома некоторыми разумными рамками.
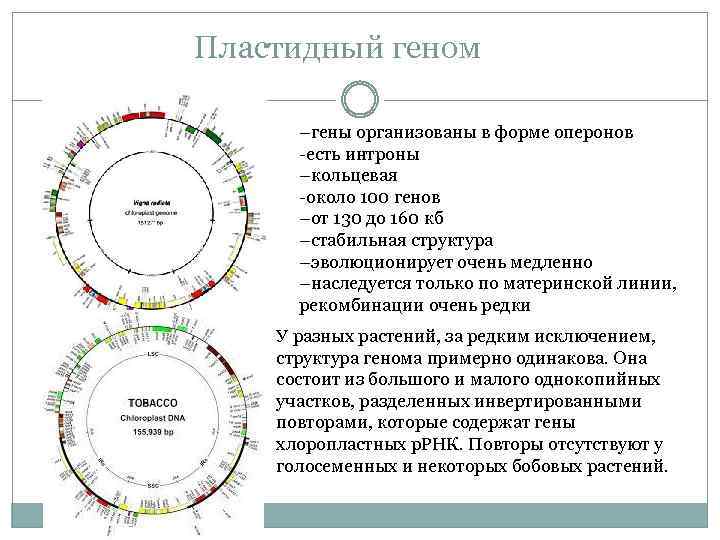
Пластидный геном –гены организованы в форме оперонов -есть интроны –кольцевая -около 100 генов –от 130 до 160 кб –стабильная структура –эволюционирует очень медленно –наследуется только по материнской линии, рекомбинации очень редки У разных растений, за редким исключением, структура генома примерно одинакова. Она состоит из большого и малого однокопийных участков, разделенных инвертированными повторами, которые содержат гены хлоропластных р. РНК. Повторы отсутствуют у голосеменных и некоторых бобовых растений.
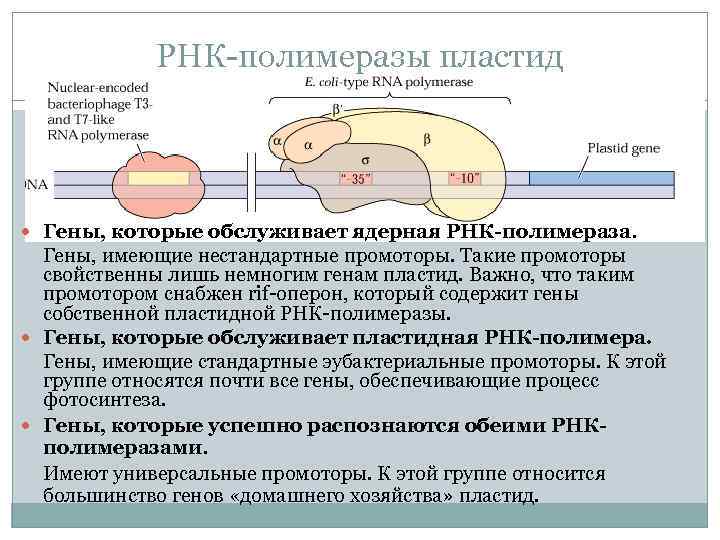
РНК-полимеразы пластид Гены, которые обслуживает ядерная РНК-полимераза. Гены, имеющие нестандартные промоторы. Такие промоторы свойственны лишь немногим генам пластид. Важно, что таким промотором снабжен rif-оперон, который содержит гены собственной пластидной РНК-полимеразы. Гены, которые обслуживает пластидная РНК-полимера. Гены, имеющие стандартные эубактериальные промоторы. К этой группе относятся почти все гены, обеспечивающие процесс фотосинтеза. Гены, которые успешно распознаются обеими РНКполимеразами. Имеют универсальные промоторы. К этой группе относится большинство генов «домашнего хозяйства» пластид.
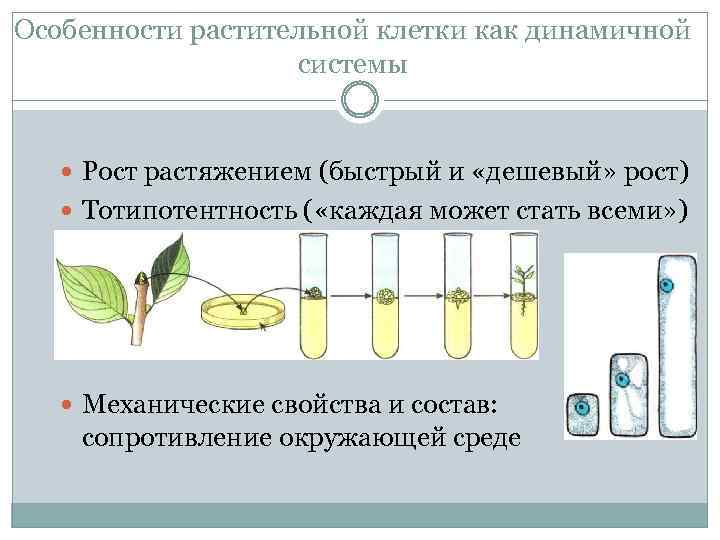
Особенности растительной клетки как динамичной системы Рост растяжением (быстрый и «дешевый» рост) Тотипотентность ( «каждая может стать всеми» ) Механические свойства и состав: сопротивление окружающей среде

Тотипотентность Каждая живая растительная клетка (кроме клеток ситовидных трубок, не имеющих ядер) потенциально может дать начало целому растительному организму. Это свойство называется тотипотентностью. Пример из природы – раневая меристема. На практике, чтобы добиться этого, клетку необходимо обрабатывать различными факторами, в первую очередь – фитогормонами, которые «перепрограммируют» ее, т. е. запустят процесс дедифференцировки.

А что на практике? Свойство тотипотентности широко используется в биотехнологии для выращивания биомассы и клонального микроразмножения. По желанию можно получить как определенную ткань (гистогенез) или орган (органогенез), так и целое растение (эмбриоидогенез). За счет пластичности генома клетки растений легко трансформировать (ГМО) За счет тотипотентности из трансформированных клеток можно легко получать эмбриоиды, а затем взрослые ГМО-растения

КЛЕТОЧНАЯ СТЕНКА Клеточная стенка – вовсе не стена… … она живая!

Именно стенке мы обязаны термином «клетка» Who: Robert C. Hooke When: January 01, 1653 Consignment from the King, Personal curiosity Methods: Looked at a thin slice of cork through a microscope at 50 x Institution: The Royal Society Where: London, England Funding: King Charles II Technology: Microscope
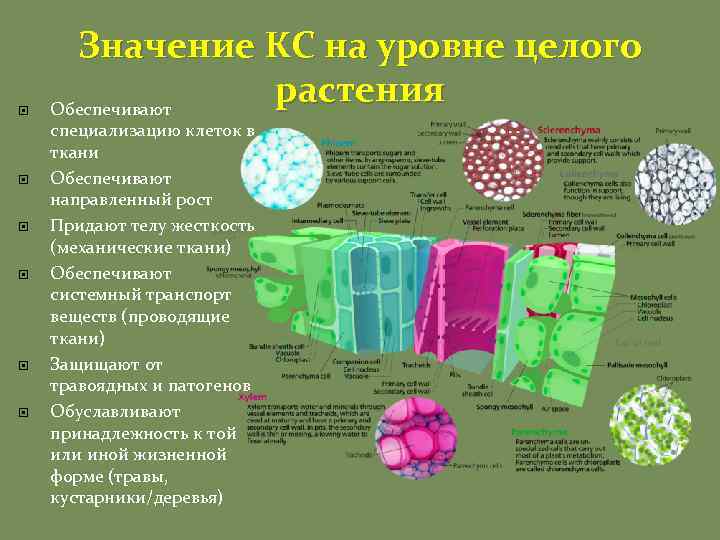
Значение КС на уровне целого растения Обеспечивают специализацию клеток в ткани Обеспечивают направленный рост Придают телу жесткость (механические ткани) Обеспечивают системный транспорт веществ (проводящие ткани) Защищают от травоядных и патогенов Обуславливают принадлежность к той или иной жизненной форме (травы, кустарники/деревья)

Значение КС в экосистемах и в быту человека Наиболее распространенный резервуар органического углерода Компонент цикла углерода в экосистемах Источник углерода в составе биогенных полезных ископаемых (каменный уголь) Основа древесины, бумаги, текстиля Важнейший компонент пищи: клетчатка (салат, отруби), пектины (желе, пюре) Компоненты для химической/косметической промышленности

Функции КС в КЛЕТКЕ • Придавать клетке форму • Поддерживать её объем • Защищать ее от внешних воздействий (механических и химических) • Контролировать и направлять рост растяжением • Фильтровать и накапливать вещества на подходе к клетке • Служить «каналом» для апопластного транспорта • Передавать сигналы, в том числе о патогенах

Форма vs функция: многообразие возможностей Губчатая паренхима листьев Zinnia: контакт клеток минимальный, поверхность – максимадьная для интенсивного газообмена Вторичные утолщения КС трахеид противостоит отрицательному давлению в сосудах, создаваемому транспирацией Эпедермальные клетки лепестков львиного зева: отражение света максимально для насыщения цвета цветка Трихома Arabidopsis максимально выступает поверхности эпидермиса
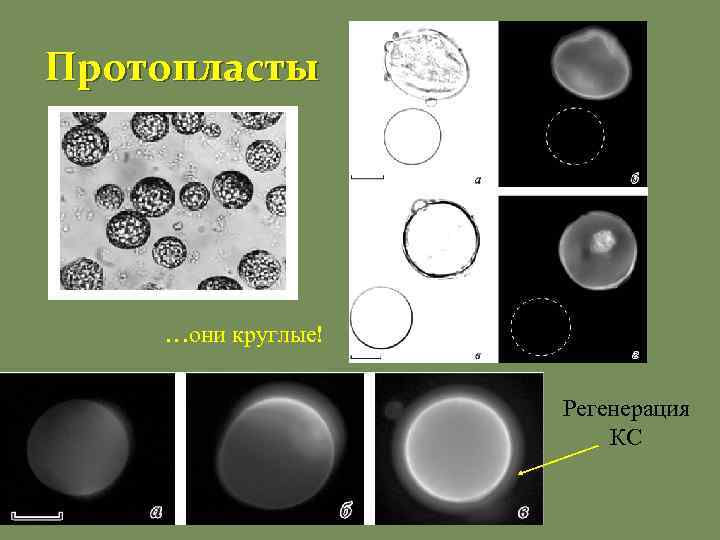
Протопласты …они круглые! Регенерация КС
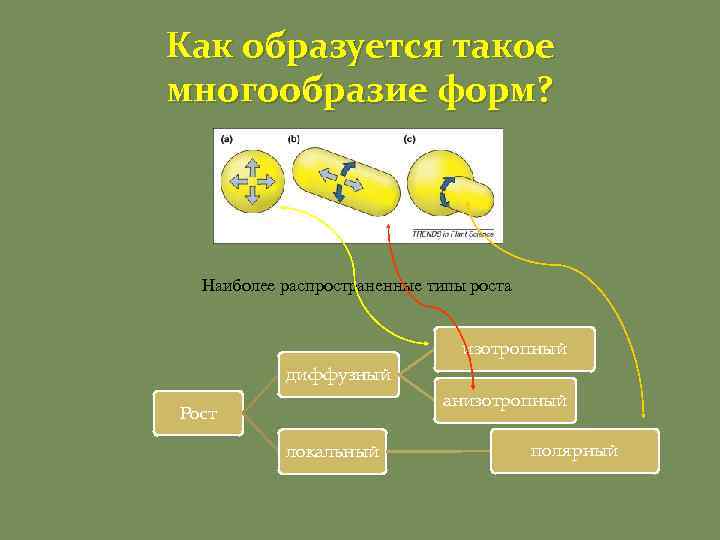
Как образуется такое многообразие форм? Наиболее распространенные типы роста изотропный диффузный анизотропный Рост локальный полярный
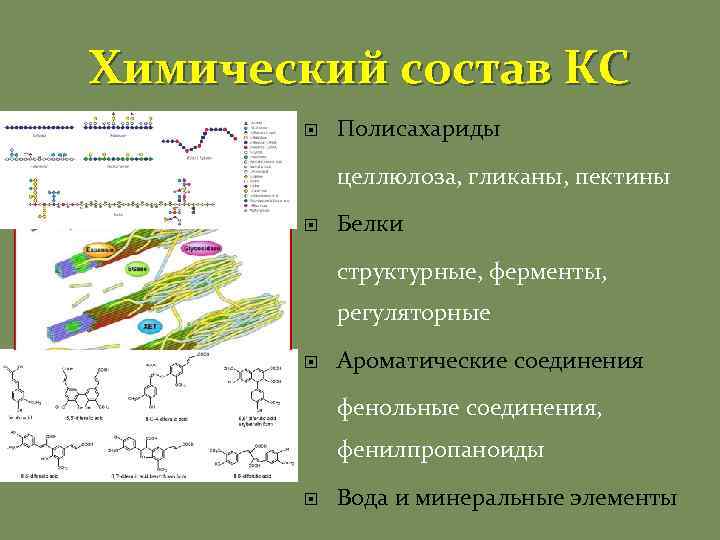
Химический состав КС Полисахариды целлюлоза, гликаны, пектины Белки структурные, ферменты, регуляторные Ароматические соединения фенольные соединения, фенилпропаноиды Вода и минеральные элементы
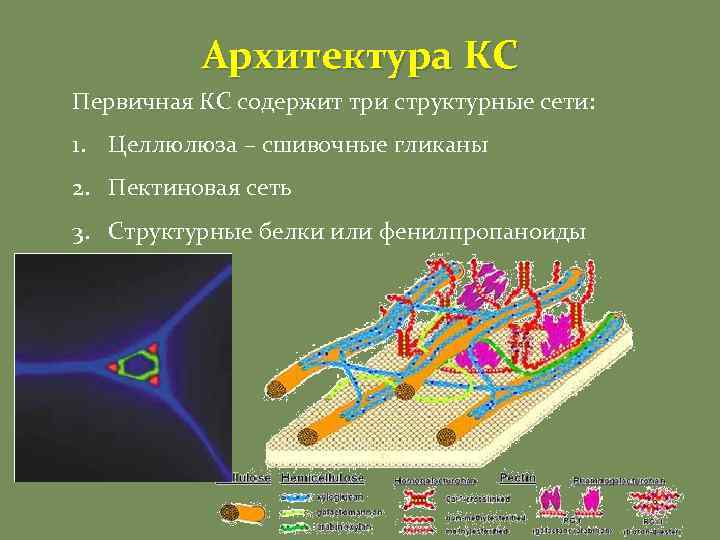
Архитектура КС Первичная КС содержит три структурные сети: 1. Целлюлюза – сшивочные гликаны 2. Пектиновая сеть 3. Структурные белки или фенилпропаноиды
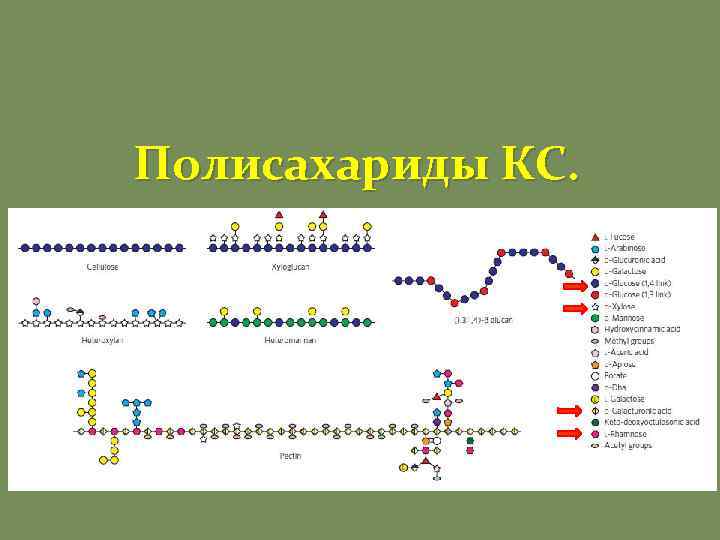
Полисахариды КС.
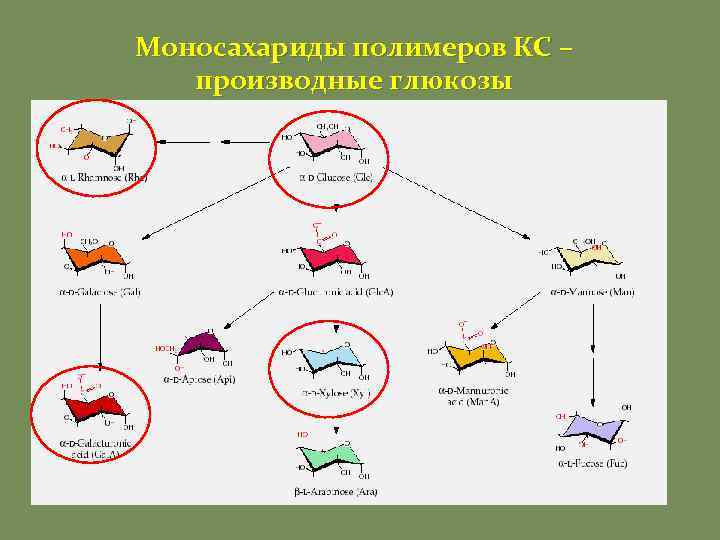
Моносахариды полимеров КС – производные глюкозы
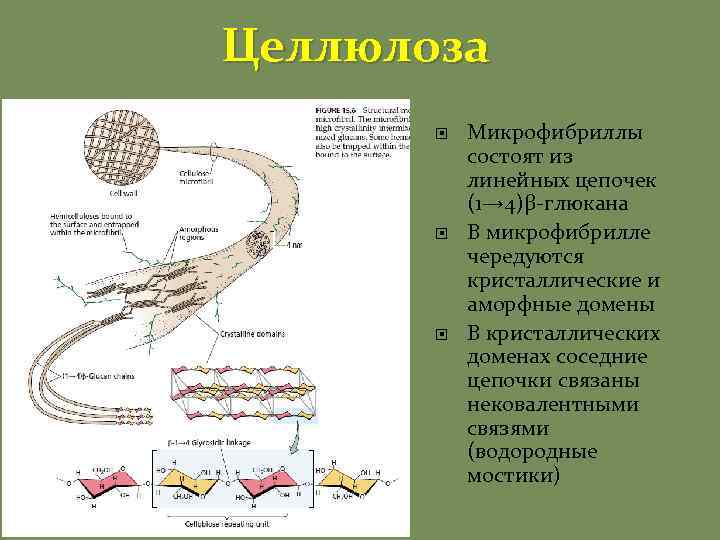
Целлюлоза Микрофибриллы состоят из линейных цепочек (1→ 4)β-глюкана В микрофибрилле чередуются кристаллические и аморфные домены В кристаллических доменах соседние цепочки связаны нековалентными связями (водородные мостики)

Целлюлоза – инертный и прочный материал За счет псевдокристаллической структуры целлюлоза является весьма прочной Она также с трудом поддается ферментативному разрушению (устойчивость к патогенам), оно начинается в аморфных зонах Целлюлозная микрофибрилла иногда может включать в себя «застрявшие» цепочки сшивочных гликанов, которые уменьшают ее структурированность в аморфных областях
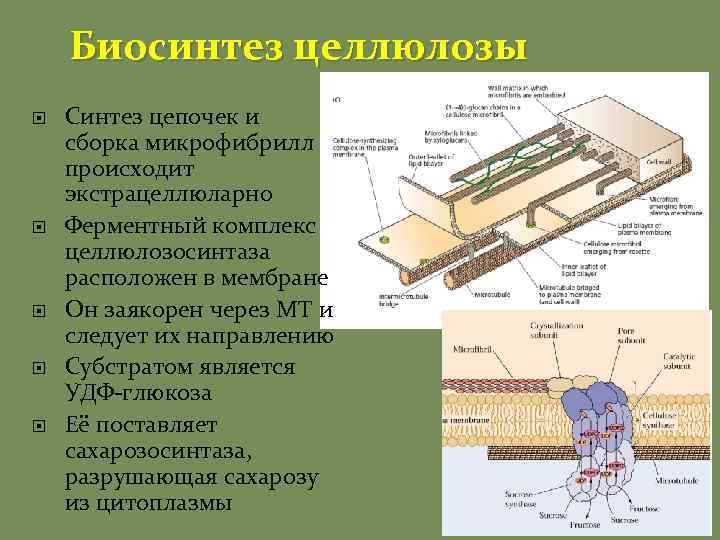
Биосинтез целлюлозы Синтез цепочек и сборка микрофибрилл происходит экстрацеллюларно Ферментный комплекс целлюлозосинтаза расположен в мембране Он заякорен через МТ и следует их направлению Субстратом является УДФ-глюкоза Её поставляет сахарозосинтаза, разрушающая сахарозу из цитоплазмы

Сшивочные гликаны Разветвленные полимеры, тесно взаимодействующие с целлюлозой ( «гемицеллюлозы» ) Сшивают между собой микрофибриллы, связывают соседние, внедряются в них, определяют расстояние между ними В основном нейтральные молекулы
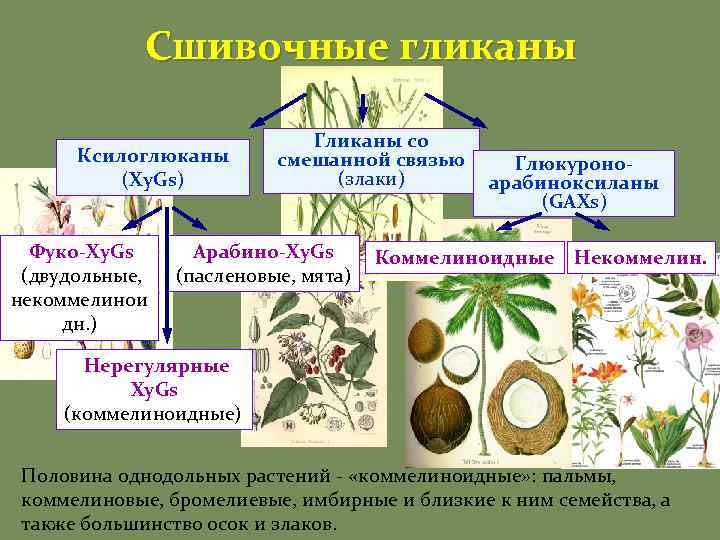
Сшивочные гликаны Ксилоглюканы (Xy. Gs) Фуко-Xy. Gs (двудольные, некоммелинои дн. ) Гликаны со смешанной связью (злаки) Арабино-Xy. Gs (пасленовые, мята) Глюкуроноарабиноксиланы (GAXs) Коммелиноидные Некоммелин. Нерегулярные Xy. Gs (коммелиноидные) Половина однодольных растений - «коммелиноидные» : пальмы, коммелиновые, бромелиевые, имбирные и близкие к ним семейства, а также большинство осок и злаков.
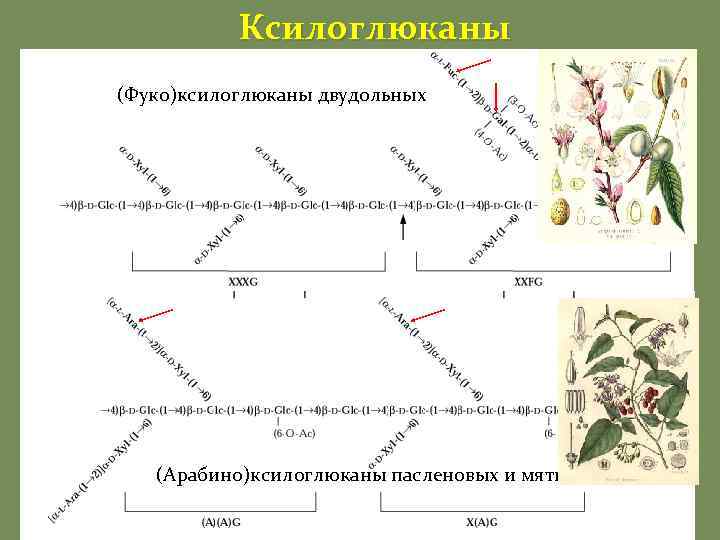
Ксилоглюканы (Фуко)ксилоглюканы двудольных (Арабино)ксилоглюканы пасленовых и мяты

Глюкуроноарабиноксиланы Некоммелиноидные Коммелиноидные
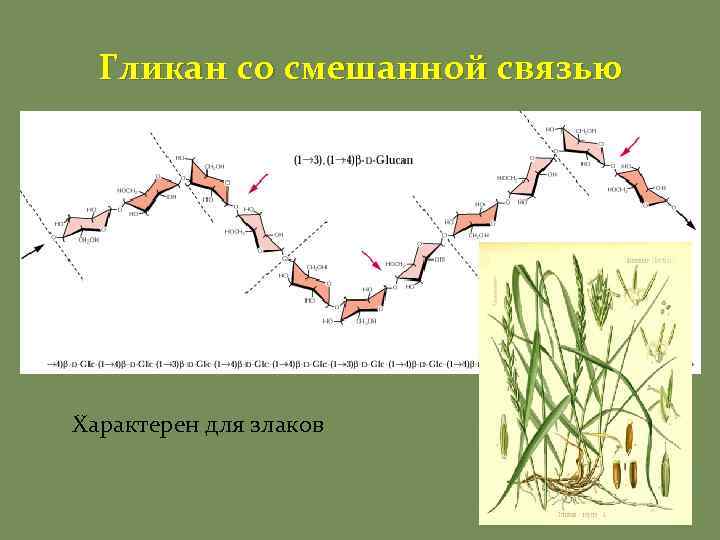
Гликан со смешанной связью Характерен для злаков
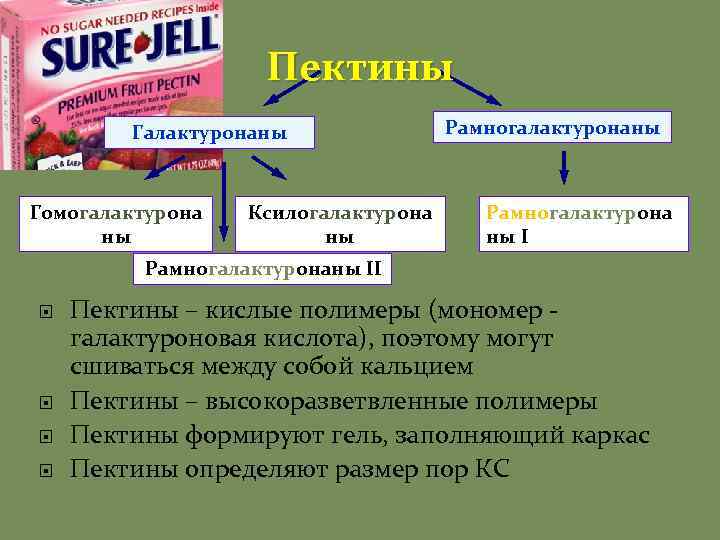
Пектины Галактуронаны Гомогалактурона ны Ксилогалактурона ны Рамногалактурона ны I Рамногалактуронаны II Пектины – кислые полимеры (мономер галактуроновая кислота), поэтому могут сшиваться между собой кальцием Пектины – высокоразветвленные полимеры Пектины формируют гель, заполняющий каркас Пектины определяют размер пор КС
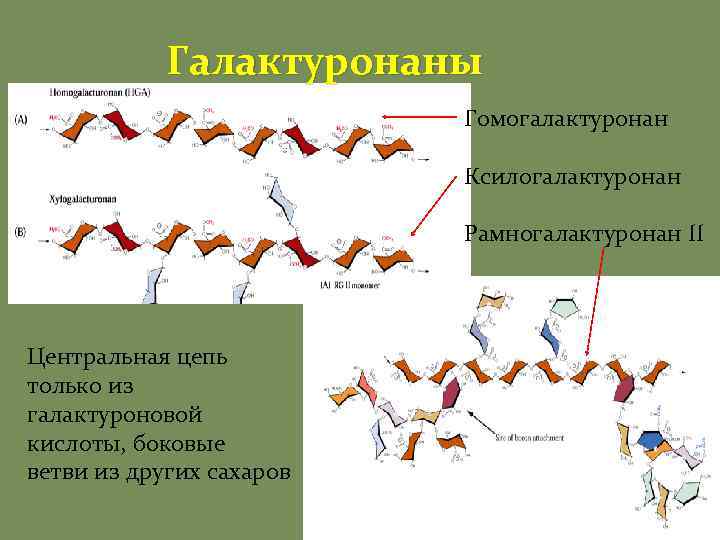
Галактуронаны Гомогалактуронан Ксилогалактуронан Рамногалактуронан II Центральная цепь только из галактуроновой кислоты, боковые ветви из других сахаров

Рамногалактуронан I Линейная цепь из чередующихся остатков рамнозы и галактуроновой кислоты, многочисленные боковые цепи
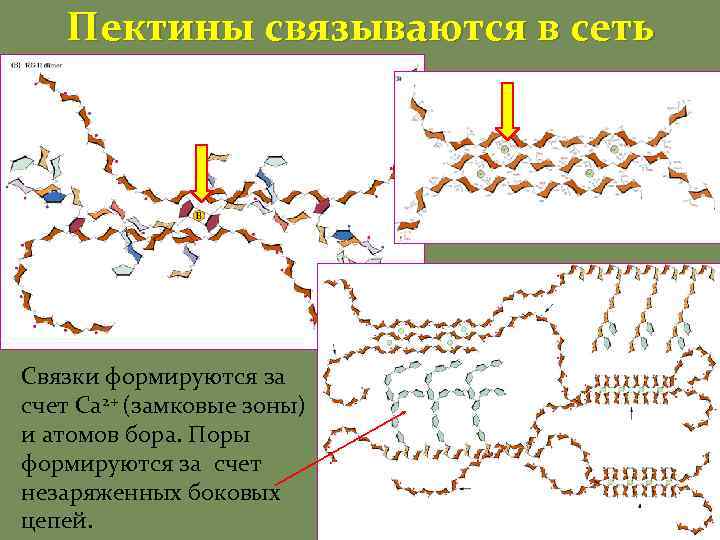
Пектины связываются в сеть Связки формируются за счет Са 2+ (замковые зоны) и атомов бора. Поры формируются за счет незаряженных боковых цепей.
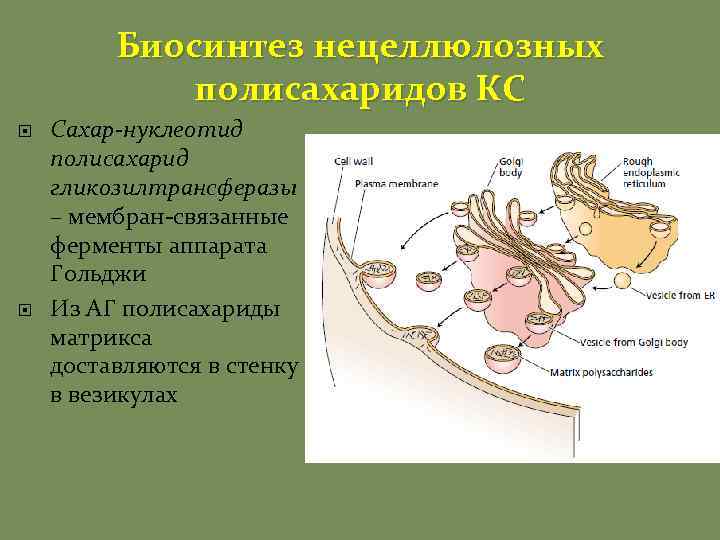
Биосинтез нецеллюлозных полисахаридов КС Сахар-нуклеотид полисахарид гликозилтрансферазы – мембран-связанные ферменты аппарата Гольджи Из АГ полисахариды матрикса доставляются в стенку в везикулах
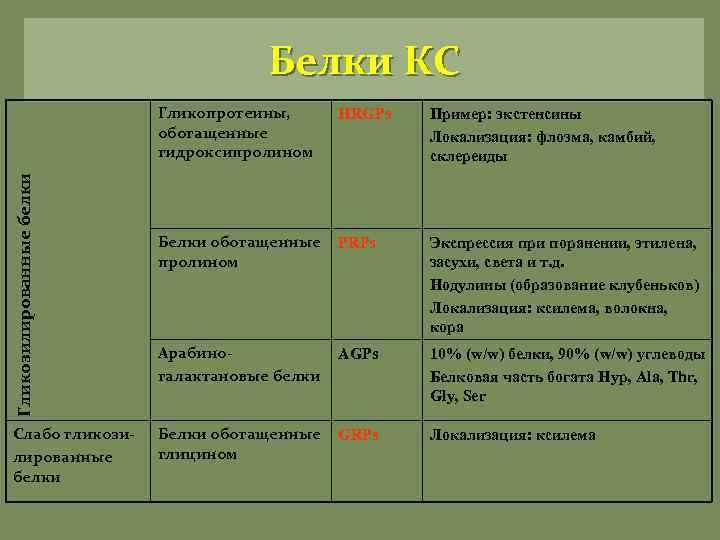
Белки КС Гликозилированные белки Гликопротеины, обогащенные гидроксипролином Слабо гликозилированные белки HRGPs Пример: экстенсины Локализация: флоэма, камбий, склереиды Белки обогащенные пролином PRPs Экспрессия при поранении, этилена, засухи, света и т. д. Нодулины (образование клубеньков) Локализация: ксилема, волокна, кора Арабиногалактановые белки AGPs 10% (w/w) белки, 90% (w/w) углеводы Белковая часть богата Hyp, Ala, Thr, Gly, Ser Белки обогащенные глицином GRPs Локализация: ксилема
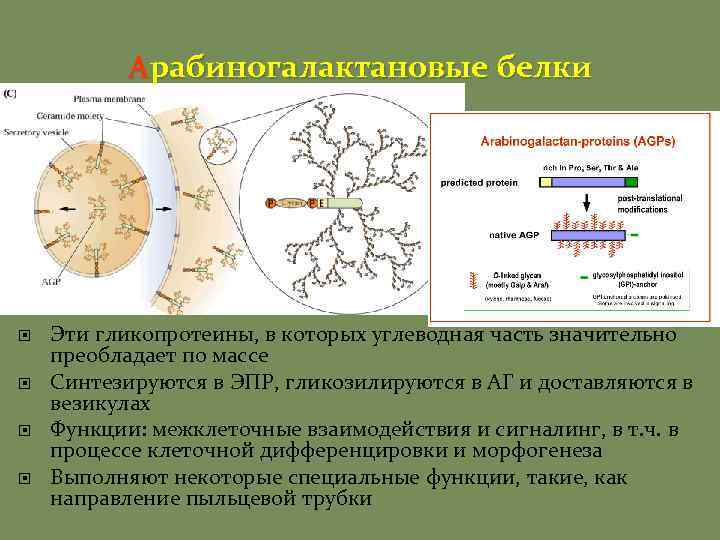
Арабиногалактановые белки Эти гликопротеины, в которых углеводная часть значительно преобладает по массе Синтезируются в ЭПР, гликозилируются в АГ и доставляются в везикулах Функции: межклеточные взаимодействия и сигналинг, в т. ч. в процессе клеточной дифференцировки и морфогенеза Выполняют некоторые специальные функции, такие, как направление пыльцевой трубки
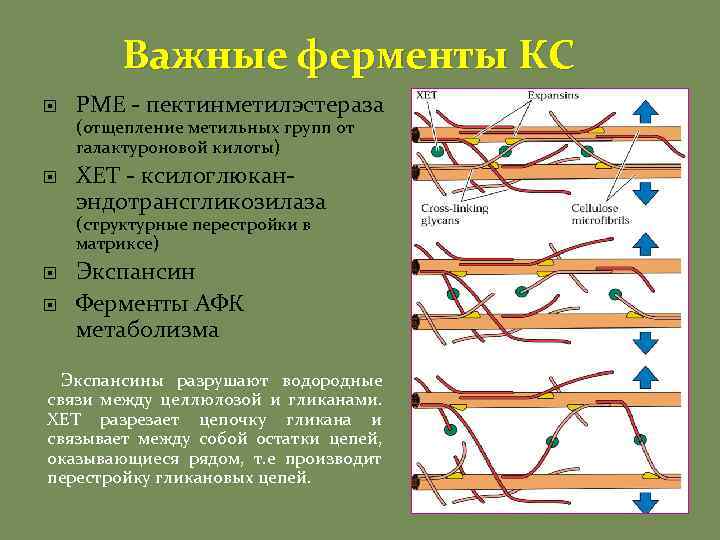
Важные ферменты КС PME - пектинметилэстераза (отщепление метильных групп от галактуроновой килоты) ХЕТ - ксилоглюканэндотрансгликозилаза (структурные перестройки в матриксе) Экспансин Ферменты АФК метаболизма Экспансины разрушают водородные связи между целлюлозой и гликанами. XET разрезает цепочку гликана и связывает между собой остатки цепей, оказывающиеся рядом, т. е производит перестройку гликановых цепей.
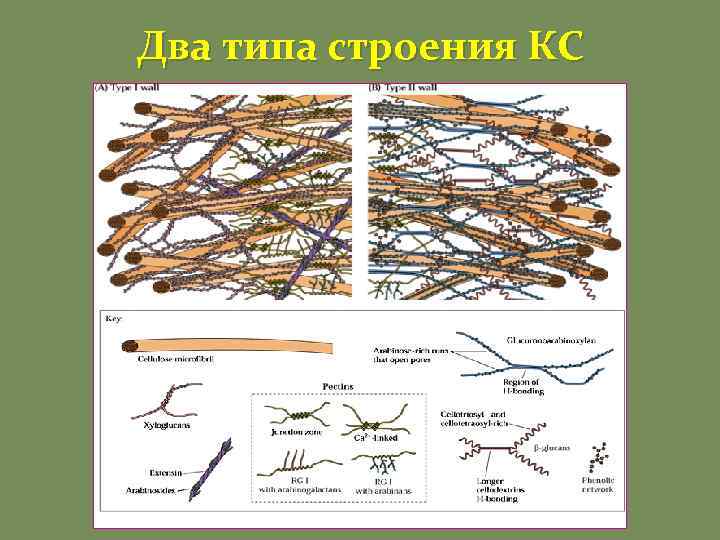
Два типа строения КС

Два типа строения КС Тип I • Характерен для большинства двудольных и «некоммелиноидных» однодольных. • Клеточные стенки этого типа содержат относительно равные количества целлюлозы и ксилоглюканов (около 30%). • Содержат значительные количества структурных белков и пектинов • Содержат мало фенольных соединений Тип II • Характерен для «коммелиноидных» однодольных. • Клеточные стенки этого типа содержат примерно такое же количество целлюлозы, однако микрофибриллы соединяются между собой глюкуроноарабиноксиланами. • Бедны пектинами, содержат мало структурных белков. • Формируются обширные фенилпропаноидные сети
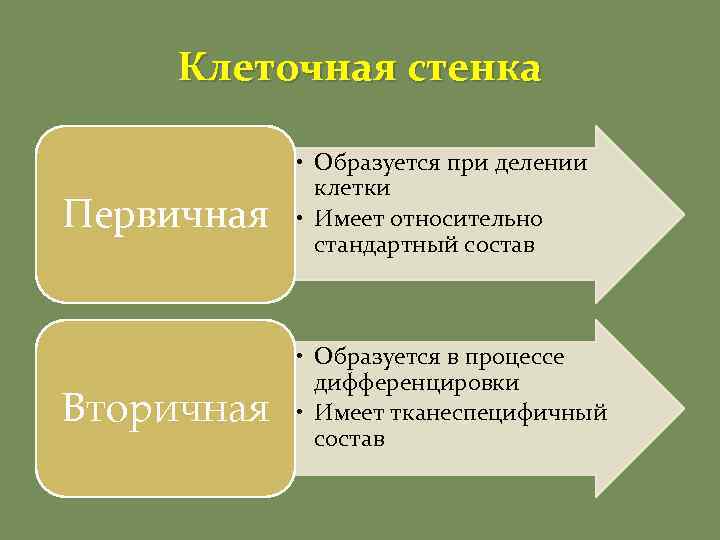
Клеточная стенка Первичная • Образуется при делении клетки • Имеет относительно стандартный состав Вторичная • Образуется в процессе дифференцировки • Имеет тканеспецифичный состав
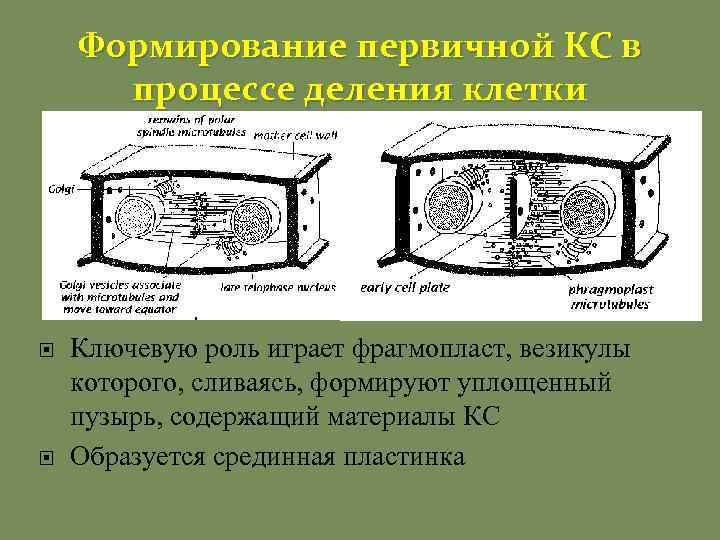
Формирование первичной КС в процессе деления клетки Ключевую роль играет фрагмопласт, везикулы которого, сливаясь, формируют уплощенный пузырь, содержащий материалы КС Образуется срединная пластинка

Срединная пластинка Образуется при делении Пролегает между первичными КС соседних клеток Состоит из пектинов, синтезированных с участием фрагмопласта, которые постепенно деэтерифицируются и связываются между собой кальцием, формируя гель. Сразу после деления «досинтезируются» остальные компоненты первичной КС: целлюлоза и гликаны.
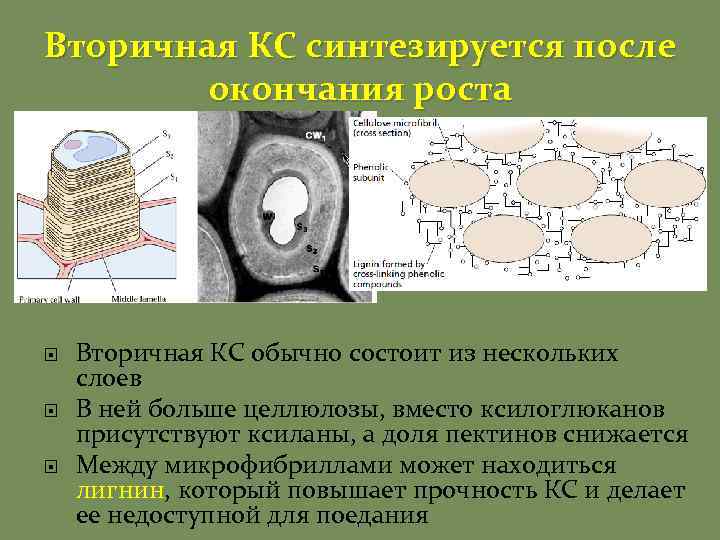
Вторичная КС синтезируется после окончания роста Вторичная КС обычно состоит из нескольких слоев В ней больше целлюлозы, вместо ксилоглюканов присутствуют ксиланы, а доля пектинов снижается Между микрофибриллами может находиться лигнин, который повышает прочность КС и делает ее недоступной для поедания
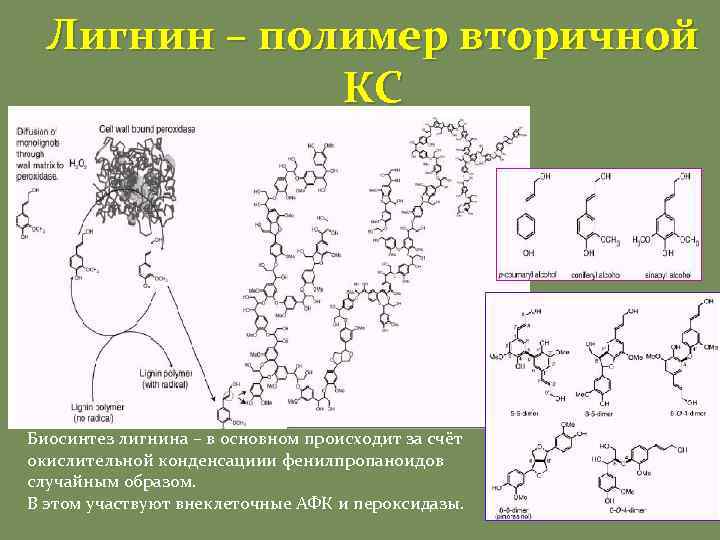
Лигнин – полимер вторичной КС Биосинтез лигнина – в основном происходит за счёт окислительной конденсациии фенилпропаноидов случайным образом. В этом участвуют внеклеточные АФК и пероксидазы.
МИТОХОНДРИИ И ПЛАСТИДЫ РАСТЕНИЙ

Митохондрии… что интересно? Нестабильный геном вследствие постоянных рекомбинаций Постоянное взаимодействие с ядром: импорт и… экспорт? Цитоплазматическая мужская стерильность Биохимические отличия: фотодыхание, ярко выраженная синтетическая функция (поставка углеродных скелетов), альтернативные компоненты ЭТЦ. Обмен метаболитами с пластидами (в т. ч. НАДФН) РНК-полимераза фагового типа кодируется в ядре

Про мембраны Проницаема для веществ с молекулярной массой до 10 000 через порины (наспецифичные каналы) Внешняя мембрана. Преобладают насыщенные жирные кислоты. Мало белков. Разрушается при набухании митохондрий. Внутренняя мембрана. Непроницаема для ионов. Транспорт контролируется белками переносчиками. Преобладают ненасыщенные жирные кислоты (90%), в том числе кардиолипин. Высокое содержание белка.
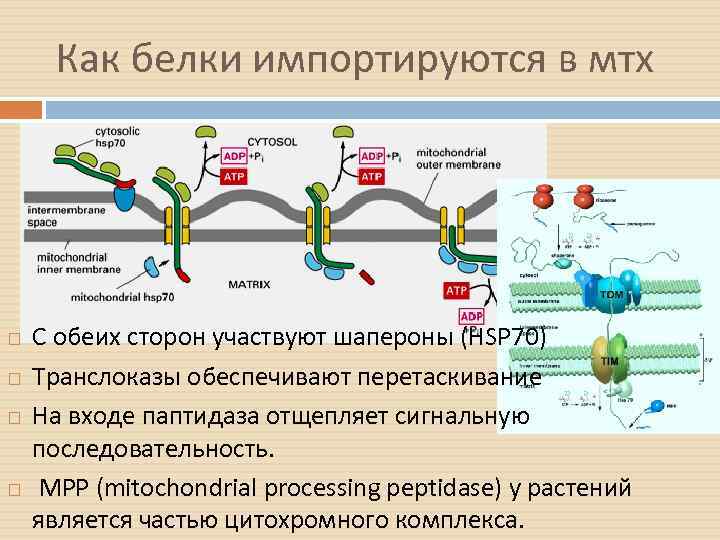
Как белки импортируются в мтх С обеих сторон участвуют шапероны (HSP 70) Транслоказы обеспечивают перетаскивание На входе паптидаза отщепляет сигнальную последовательность. MPP (mitochondrial processing peptidase) у растений является частью цитохромного комплекса.

Митохондрии динамичны и «общительны» Считается, что «нестехиометричность» генома (т. е. его неравномерное распределение между митохондриями) может служить причиной их слияний и делений А для слияний и делений необходима подвижность, которая обеспечивается взаимодействием с цитоскелетом.
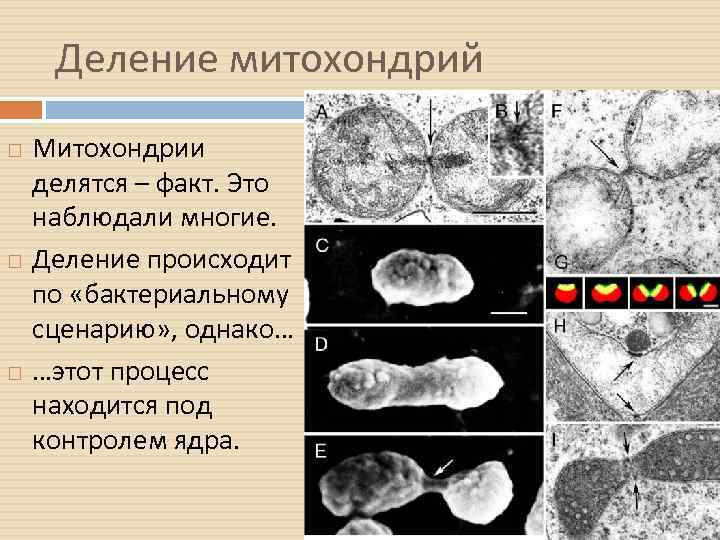
Деление митохондрий Митохондрии делятся – факт. Это наблюдали многие. Деление происходит по «бактериальному сценарию» , однако… …этот процесс находится под контролем ядра.
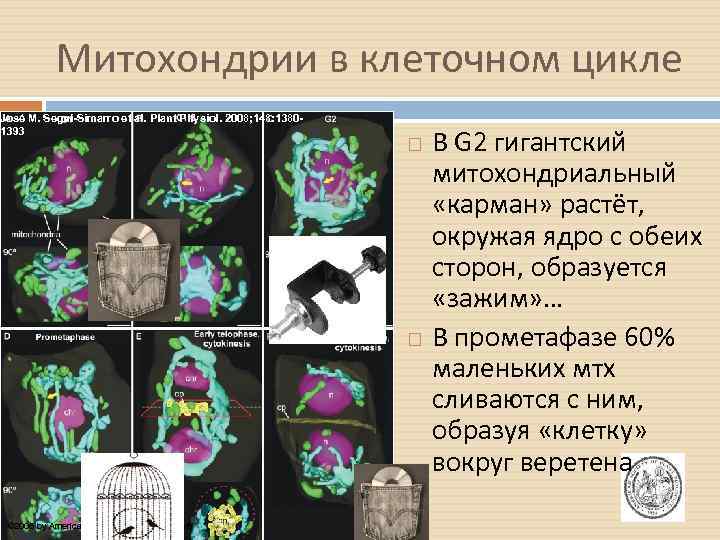
Митохондрии в клеточном цикле José M. Seguí-Simarro et al. Plant Physiol. 2008; 148: 13801393 © 2008 by American Society of Plant Biologists В G 2 гигантский митохондриальный «карман» растёт, окружая ядро с обеих сторон, образуется «зажим» … В прометафазе 60% маленьких мтх сливаются с ним, образуя «клетку» вокруг веретена
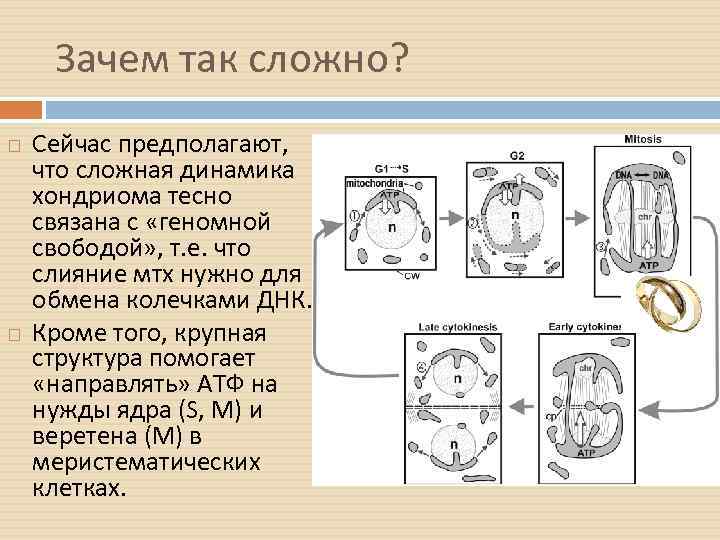
Зачем так сложно? Сейчас предполагают, что сложная динамика хондриома тесно связана с «геномной свободой» , т. е. что слияние мтх нужно для обмена колечками ДНК. Кроме того, крупная структура помогает «направлять» АТФ на нужды ядра (S, M) и веретена (M) в меристематических клетках.
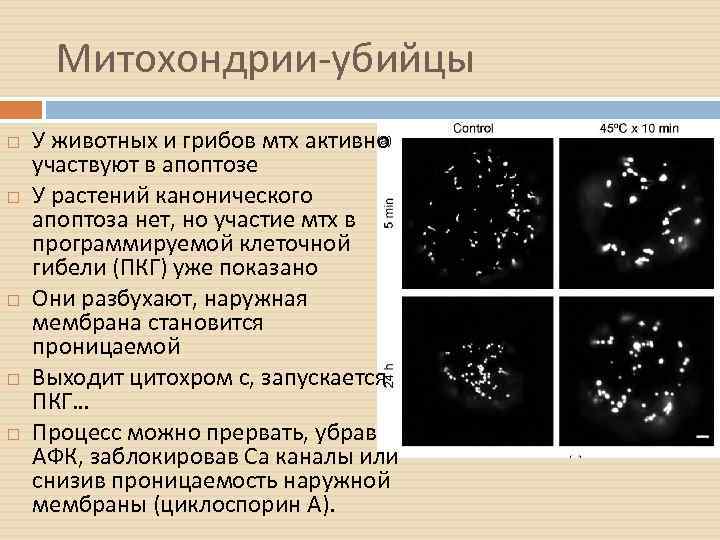
Митохондрии-убийцы У животных и грибов мтх активно участвуют в апоптозе У растений канонического апоптоза нет, но участие мтх в программируемой клеточной гибели (ПКГ) уже показано Они разбухают, наружная мембрана становится проницаемой Выходит цитохром с, запускается ПКГ… Процесс можно прервать, убрав АФК, заблокировав Са каналы или снизив проницаемость наружной мембраны (циклоспорин А).

Пероксисомы – загадочные и отважные q q q Пероксисомы – одномембранные органеллы с диаметром 0, 1 -1 µм. Основные функции: vлипидный метаболизм (β-окисление ЖК) vэлиминация АФК (в основном Н 2 О 2). Дополнительные функции: v. Фотодыхание (взаимод-е с мтх и пластидами) v. Глиоксилатный цикл v. Биосинтез гормона жасмоновой к-ты v. Сигналинг в патоген-индуцированном ответе Около 130 ядерных генов связаны с работой пероксисом (для сравнения, у человека и дрожжей – 85 и 61, соответственно) Это указывает на особое значение этих органелл у растений
Маленькие и сложные
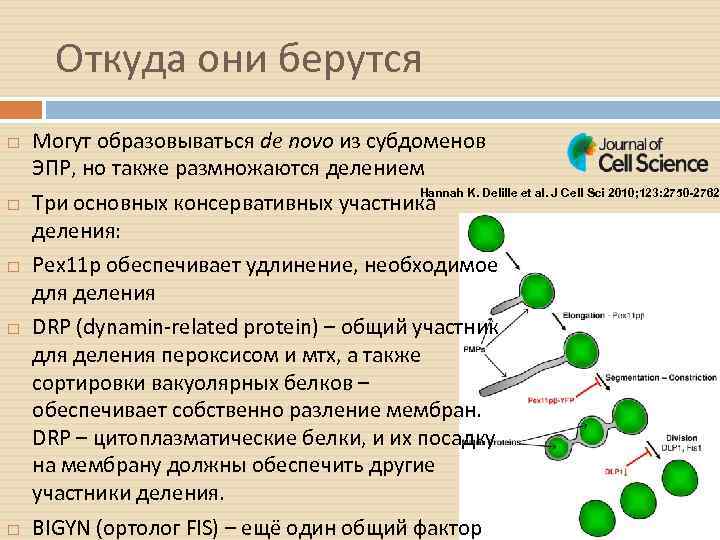
Откуда они берутся Могут образовываться de novo из субдоменов ЭПР, но также размножаются делением Hannah K. Delille et al. J Cell Sci 2010; 123: 2750 -2762 Три основных консервативных участника деления: Pex 11 p обеспечивает удлинение, необходимое для деления DRP (dynamin-related protein) – общий участник для деления пероксисом и мтх, а также сортировки вакуолярных белков – обеспечивает собственно разление мембран. DRP – цитоплазматические белки, и их посадку на мембрану должны обеспечить другие участники деления. BIGYN (ортолог FIS) – ещё один общий фактор
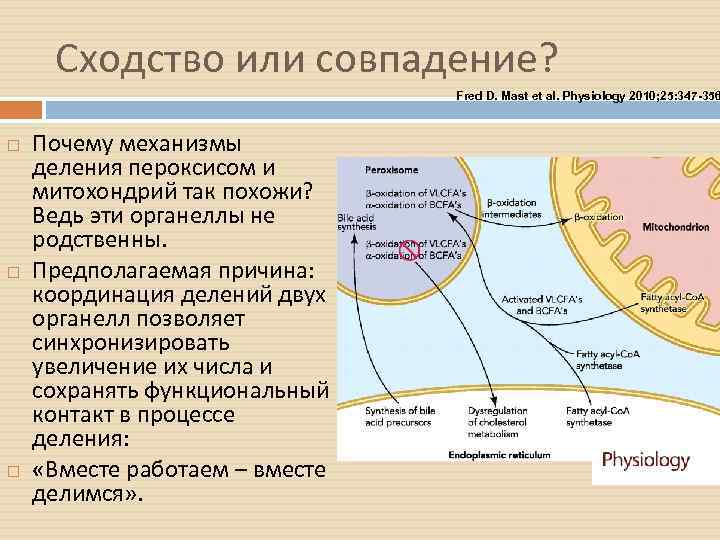
Сходство или совпадение? Fred D. Mast et al. Physiology 2010; 25: 347 -356 Почему механизмы деления пероксисом и митохондрий так похожи? Ведь эти органеллы не родственны. Предполагаемая причина: координация делений двух органелл позволяет синхронизировать увеличение их числа и сохранять функциональный контакт в процессе деления: «Вместе работаем – вместе делимся» .
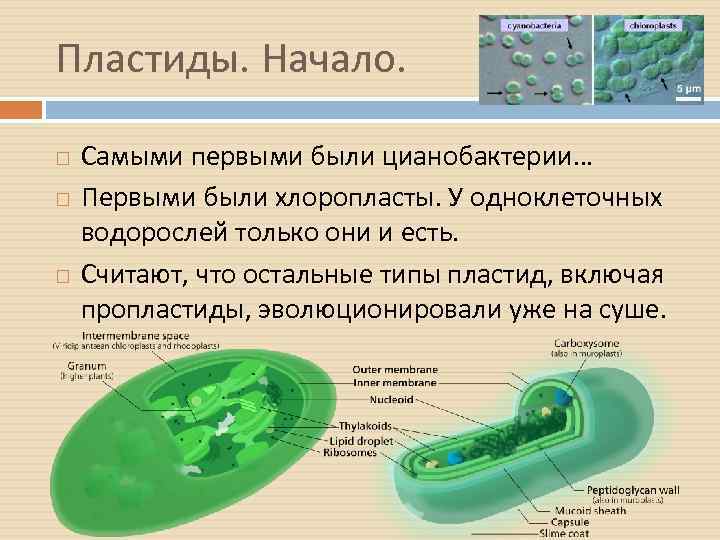
Пластиды. Начало. Самыми первыми были цианобактерии… Первыми были хлоропласты. У одноклеточных водорослей только они и есть. Считают, что остальные типы пластид, включая пропластиды, эволюционировали уже на суше.
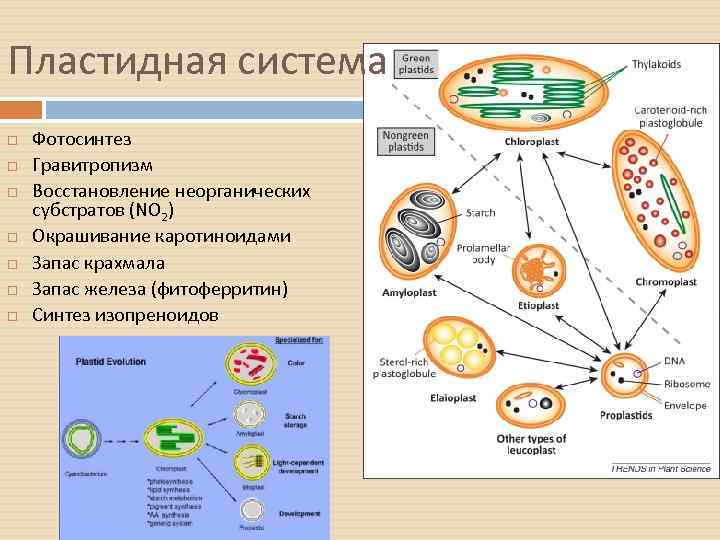
Пластидная система Фотосинтез Гравитропизм Восстановление неорганических субстратов (NO 2) Окрашивание каротиноидами Запас крахмала Запас железа (фитоферритин) Синтез изопреноидов
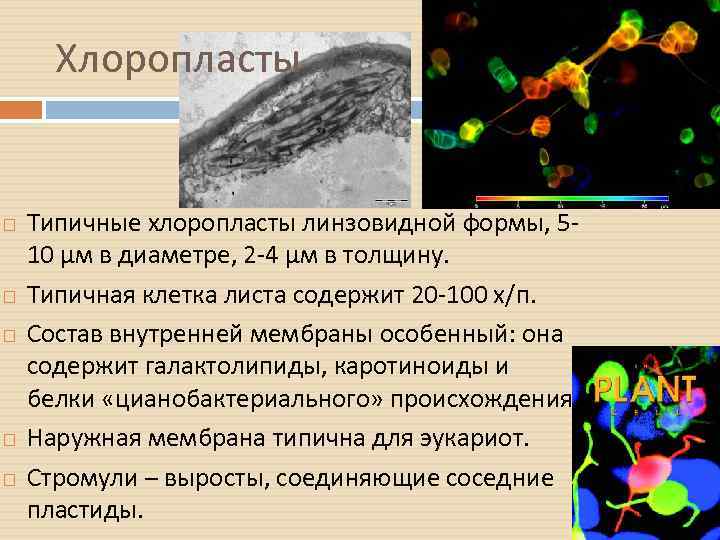
Хлоропласты Типичные хлоропласты линзовидной формы, 510 µм в диаметре, 2 -4 µм в толщину. Типичная клетка листа содержит 20 -100 х/п. Состав внутренней мембраны особенный: она содержит галактолипиды, каротиноиды и белки «цианобактериального» происхождения Наружная мембрана типична для эукариот. Стромули – выросты, соединяющие соседние пластиды.

Хлоропласты Строма содержит примерно 50% хлоропластных белков, а также пластоглобулы, ДНК и рибосомы Люмен тилакоидов образует единое пространство, топологически эквивалентное ММП Тилакоиды собираются в граны ФС II локализуется в местах стэкинга, ФС I – на краях тилакоидов, обращённых к строме Пластоглобулы – запасы липидов и белков
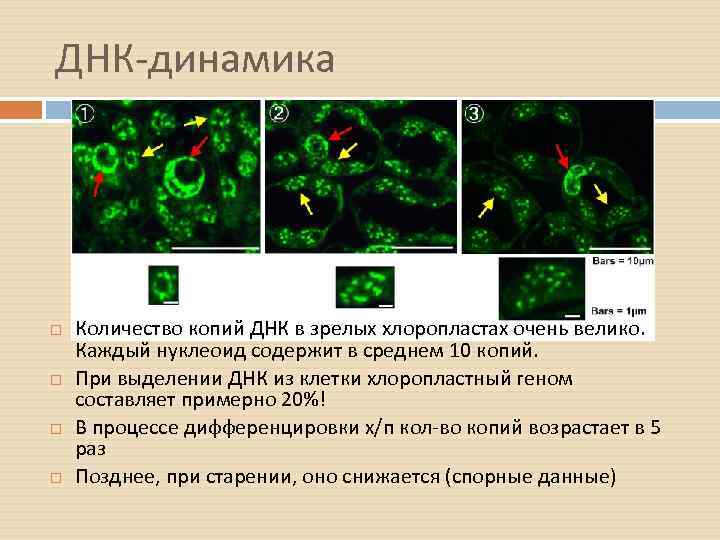
ДНК-динамика Количество копий ДНК в зрелых хлоропластах очень велико. Каждый нуклеоид содержит в среднем 10 копий. При выделении ДНК из клетки хлоропластный геном составляет примерно 20%! В процессе дифференцировки х/п кол-во копий возрастает в 5 раз Позднее, при старении, оно снижается (спорные данные)

Ещё немного о РНК-полимеразах Начало дифференцировки пропластиды в хлоропласт сопровождается активацией ядерной РНК-полимеразы (NEP) Она запускает транскрипцию генов пластидной РНКполимеразы (PEP), а также генов домашнего хозяйства Таким образом, машина белкового синтеза в х/п готова Далее на свету при максимальной активности PEP синтезируются белки фотосистем и идёт сборка комплексов. После того, как за дело взялась PEP, регуляция транскрипции осуществляется с участием сигма-факторов (SIG). Их как минимум 6, и без них дифференцировка пластид не завершается, листья остаются бледными.
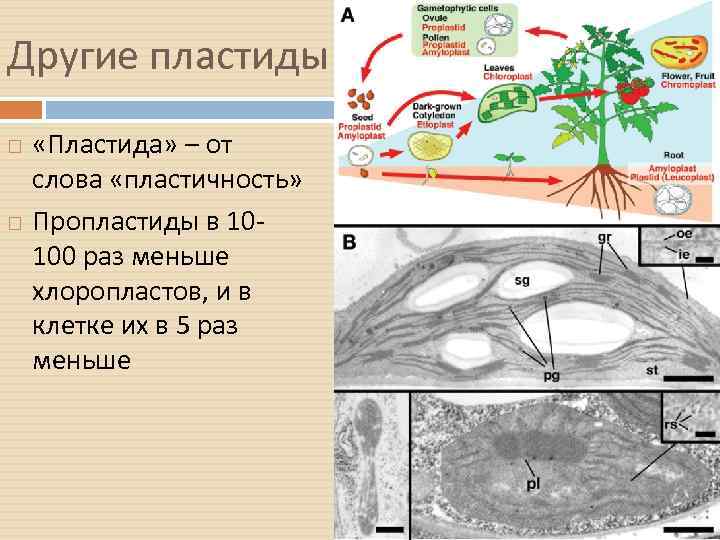
Другие пластиды «Пластида» – от слова «пластичность» Пропластиды в 10100 раз меньше хлоропластов, и в клетке их в 5 раз меньше
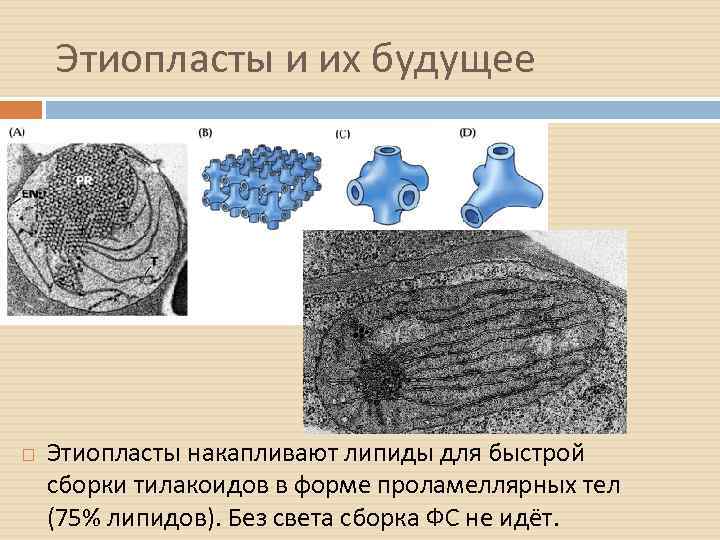
Этиопласты и их будущее Этиопласты накапливают липиды для быстрой сборки тилакоидов в форме проламеллярных тел (75% липидов). Без света сборка ФС не идёт.
Портретная галерея
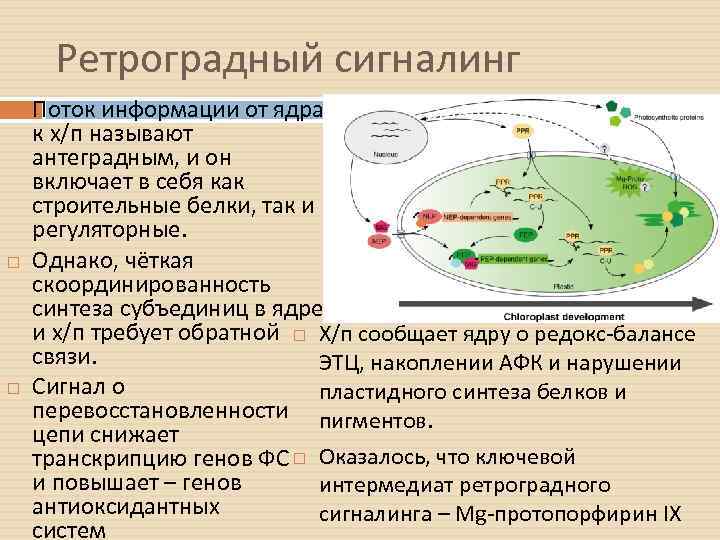
Ретроградный сигналинг Поток информации от ядра к х/п называют антеградным, и он включает в себя как строительные белки, так и регуляторные. Однако, чёткая скоординированность синтеза субъединиц в ядре и х/п требует обратной Х/п сообщает ядру о редокс-балансе связи. ЭТЦ, накоплении АФК и нарушении Сигнал о пластидного синтеза белков и перевосстановленности пигментов. цепи снижает транскрипцию генов ФС Оказалось, что ключевой и повышает – генов интермедиат ретроградного антиоксидантных сигналинга – Mg-протопорфирин IX систем
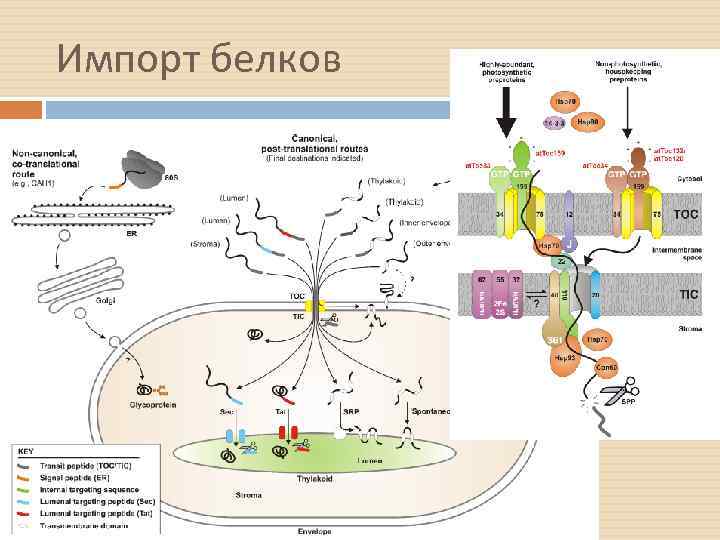
Импорт белков
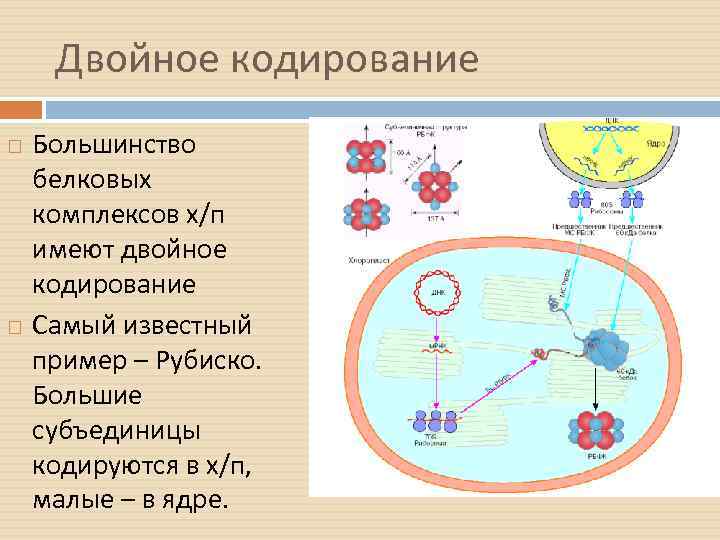
Двойное кодирование Большинство белковых комплексов х/п имеют двойное кодирование Самый известный пример – Рубиско. Большие субъединицы кодируются в х/п, малые – в ядре.
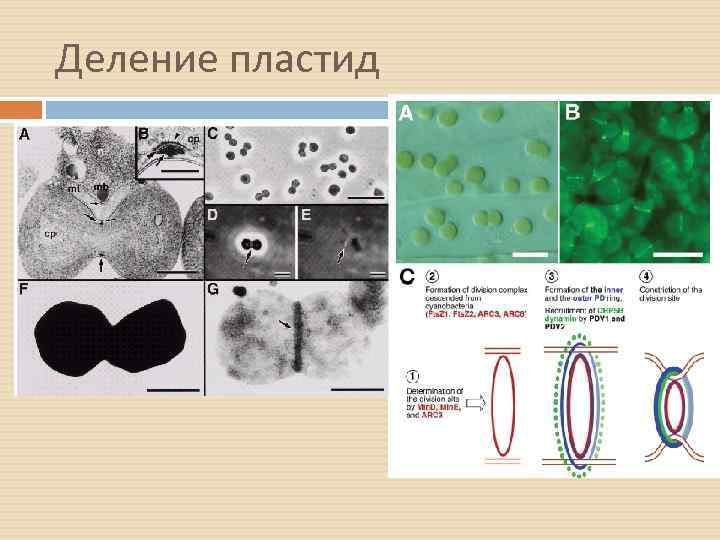
Деление пластид

Эндоплазматический ретикулюм и секреторный путь

Принцип компартментации. Элементарный компартмент. Примитивная прокариотическая клетка представляет собой простейшую однокомпартментную систему. Одна оболочка, одна ДНК, одна цитоплазма – один «котёл»
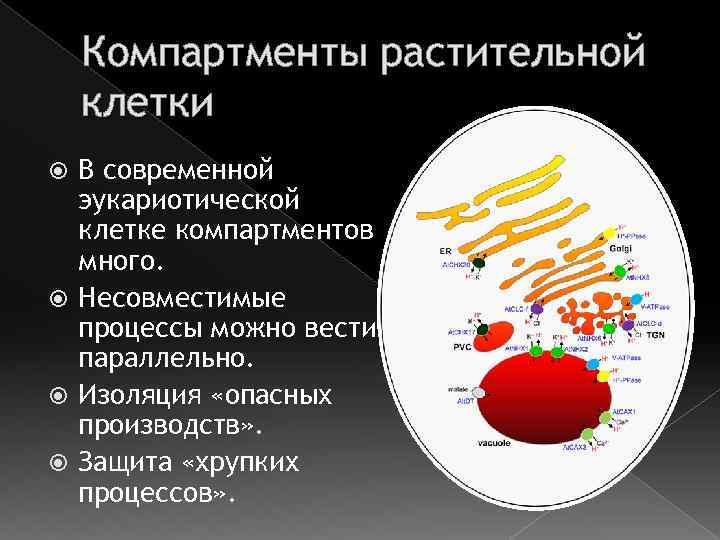
Компартменты растительной клетки В современной эукариотической клетке компартментов много. Несовместимые процессы можно вести параллельно. Изоляция «опасных производств» . Защита «хрупких процессов» .
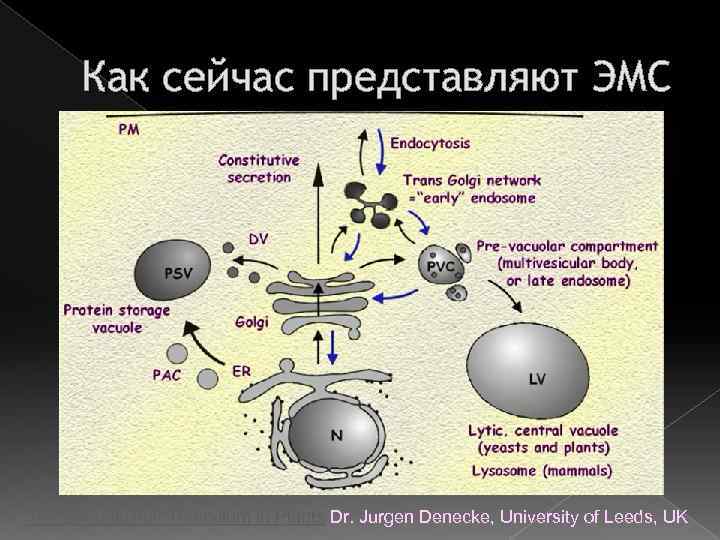
Как сейчас представляют ЭМС The Endoplasmic Reticulum in Plants Dr. Jurgen Denecke, University of Leeds, UK
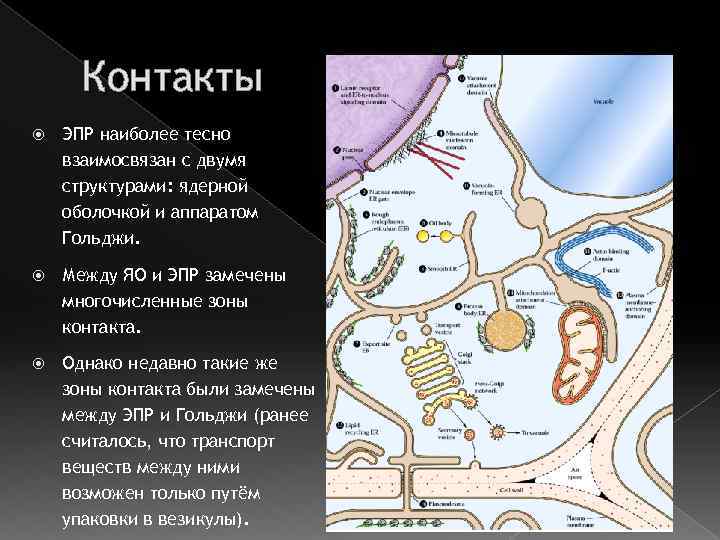
Контакты ЭПР наиболее тесно взаимосвязан с двумя структурами: ядерной оболочкой и аппаратом Гольджи. Между ЯО и ЭПР замечены многочисленные зоны контакта. Однако недавно такие же зоны контакта были замечены между ЭПР и Гольджи (ранее считалось, что транспорт веществ между ними возможен только путём упаковки в везикулы).
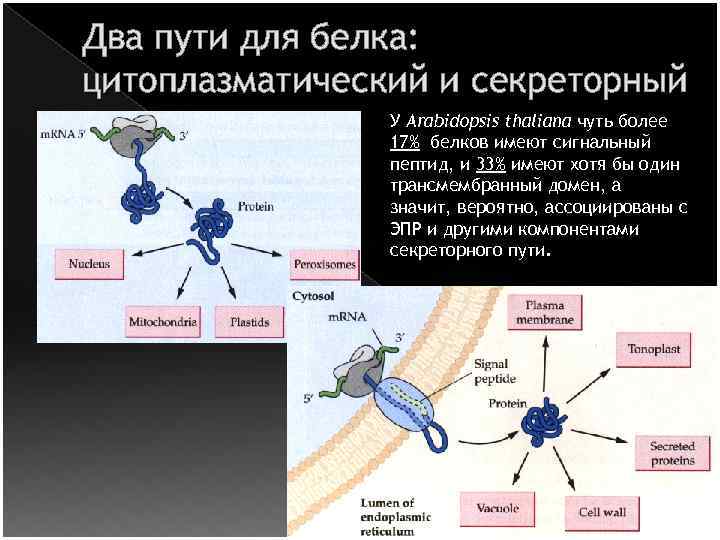
Два пути для белка: цитоплазматический и секреторный У Arabidopsis thaliana чуть более 17% белков имеют сигнальный пептид, и 33% имеют хотя бы один трансмембранный домен, а значит, вероятно, ассоциированы с ЭПР и другими компонентами секреторного пути.
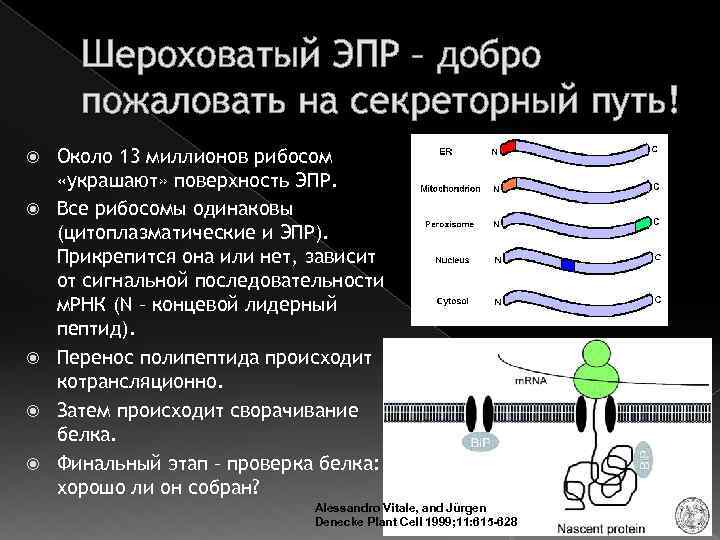
Шероховатый ЭПР – добро пожаловать на секреторный путь! Около 13 миллионов рибосом «украшают» поверхность ЭПР. Все рибосомы одинаковы (цитоплазматические и ЭПР). Прикрепится она или нет, зависит от сигнальной последовательности м. РНК (N – концевой лидерный пептид). Перенос полипептида происходит котрансляционно. Затем происходит сворачивание белка. Финальный этап – проверка белка: хорошо ли он собран? Alessandro Vitale, and Jürgen Denecke Plant Cell 1999; 11: 615 -628
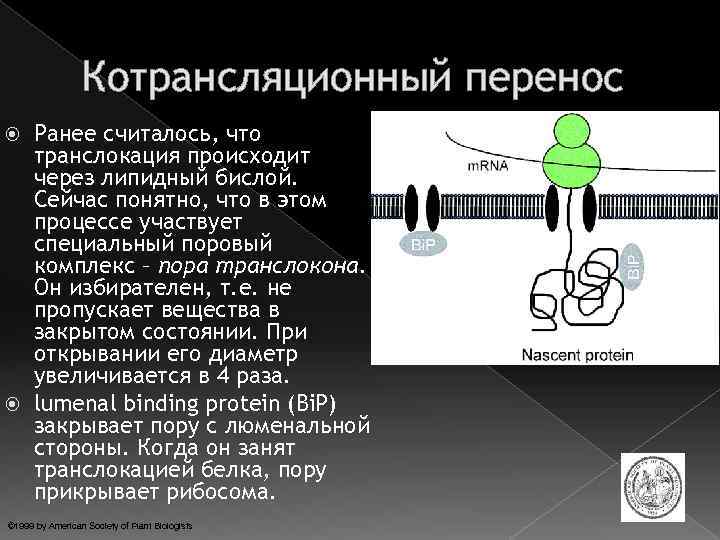
Котрансляционный перенос Ранее считалось, что транслокация происходит через липидный бислой. Сейчас понятно, что в этом процессе участвует специальный поровый комплекс – пора транслокона. Он избирателен, т. е. не пропускает вещества в закрытом состоянии. При открывании его диаметр увеличивается в 4 раза. lumenal binding protein (Bi. P) закрывает пору с люменальной стороны. Когда он занят транслокацией белка, пору прикрывает рибосома. © 1999 by American Society of Plant Biologists

Сворачивание белков Фолдинг белков происходит не самопроизвольно, а с участием шаперонов. Шапероны ЭПР – ретикулоплазмины. Правильный фолдинг имеет большое значение, потому что неправильно свернутые белки формируют агрегаты, слипаясь гидрофобными частями, и могут повредить компартмент. Шапероны не ускоряют фолдинг, а лишь стабилизируют правильную конформацию. Возможна корректировка неправильной конформации.

Как там в ЭПР? В люмене ЭПР р. Н близок к нейтральному, в этом смысле он похож на цитозоль. Однако, в люмене царит окисление: отношение окисленного глутатиона к восстановленному там высоко, что способствует формированию дисульфидных связей. Правильно их выстраивать помогает PDI (protein disulfide isomerase). Также в люмене много АТФ: сворачивание требует энергии. Bi. P является АТФазой.
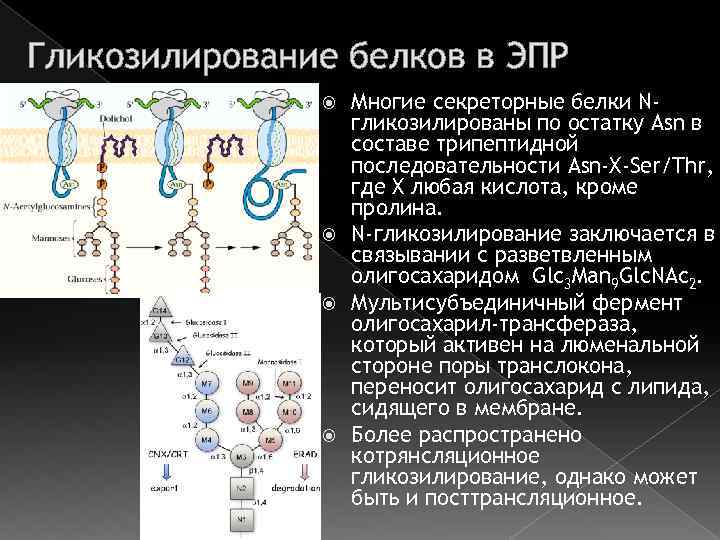
Гликозилирование белков в ЭПР Многие секреторные белки Nгликозилированы по остатку Asn в составе трипептидной последовательности Asn-X-Ser/Thr, где X любая кислота, кроме пролина. N-гликозилирование заключается в связывании с разветвленным олигосахаридом Glc 3 Man 9 Glc. NAc 2. Мультисубъединичный фермент олигосахарил-трансфераза, который активен на люменальной стороне поры транслокона, переносит олигосахарид с липида, сидящего в мембране. Более распространено котрянсляционное гликозилирование, однако может быть и посттрансляционное.

Резюме. Так рождаются белки. Калнексин/ Калретикулин – лектиновая система «поддержки» нормальных структур. Она ориентируется по глюкозным остаткам. Если их убрали – значит, белок готов. ER degradation-enhancing αmannosidase-like protein Endoplasmic-reticulumassociated protein degradation © 2010 by American Society of Plant Biologists Jian-Xiang Liu, and Stephen H. Howell Plant Cell 2010; 22: 2930 -2942

Итак… Функции ЭПР в процессинге белков Ø Модификация определенных аминокислот, например, превращение пролина в гидроксипролин. Ø N-гликозилирование и отщепление глюкозы у N-связанных гликанов. Ø Образование правильных S-S связей (глутатион и дисульфидизомераза). Ø Правильное сворачивание белковой молекулы (шапероны, например, пептидилпролилизомераза и Bi. P). Ø Сборка олигомерных комплексов. Ø Деградация неправильных белков или их транспорт для разрушения в цитозоль.
Моя клетка_годовой_ч1.pptx