Структура белков1.pptx
- Количество слайдов: 52

Структура Белка

Структурная организация пептидов и белков 1. Первичная, вторичная структура белка 2. Третичная и четвертичная структура белка 3. Классификация белков: протеины и протеиды 4. Химия простых и сложных белков
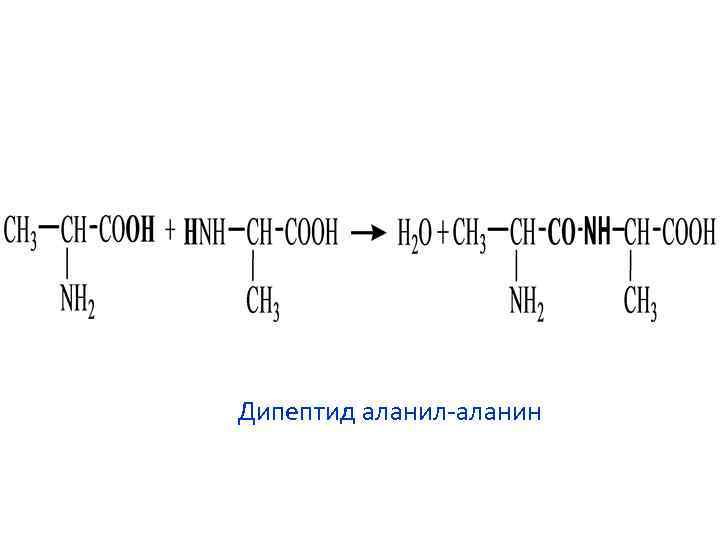
Дипептид аланил-аланин

Пептиды - имеют Мм до 5000 дальтон (50 аминокислотных остатка)
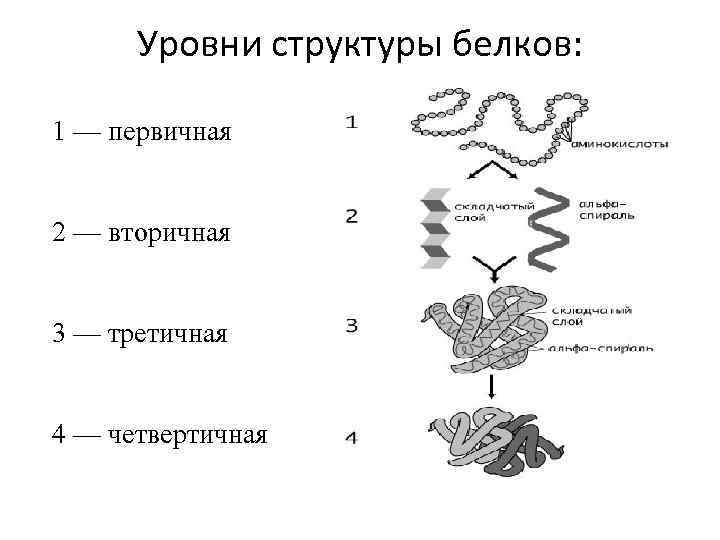
Уровни структуры белков: 1 — первичная 2 — вторичная 3 — третичная 4 — четвертичная

Первичная структура белка – это последовательность аминокислот в пептидной цепи. Аминокислоты соединяются пептидной связью
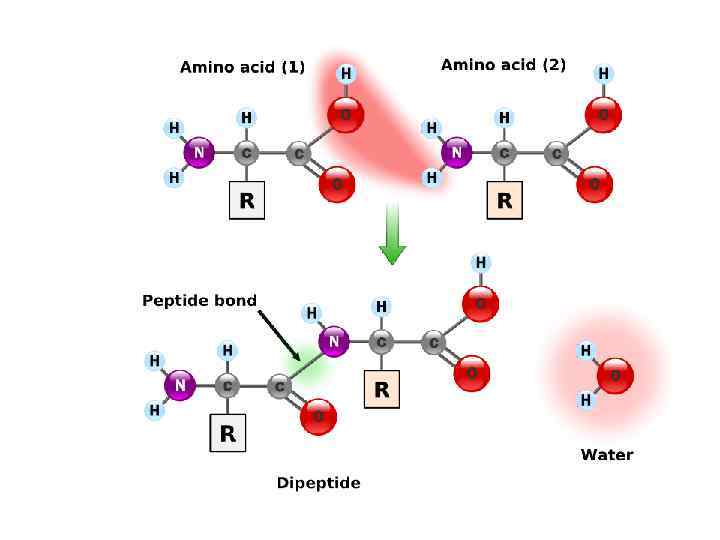

Пептиды • Соединение из двух аминокислот называют дипептидом, из трех – трипептидом и т. д. • Цепочка из менее чем 50 аминокислот называется пептидом • Белки состоят из 50 и более аминокислот

Пептиды • Пептиды-гормоны: вазопрессин, окситоцин, кортикотропин, глюкагон, кальцитонин, меланостимулирующий гормон. • Пептиды, принимающие участие в пищеварении, – гастрин, секретин – всего 12 пептидов. • Ангиотензин (сосудосуживающий), брадикинин. • Нейропептиды. • Пролинсодержащие ди- и трипептиды, образующиеся из коллагена и эластина путем гидролиза, обладающие антикоагулянтным действием, защищающие слизистую оболочку желудка. • Низкомолекулярные (Мм 4 к. Да) пептиды, обуславливающие устойчивость животных к разным инфекциям, обладающие широким спектром антимикробной активности.
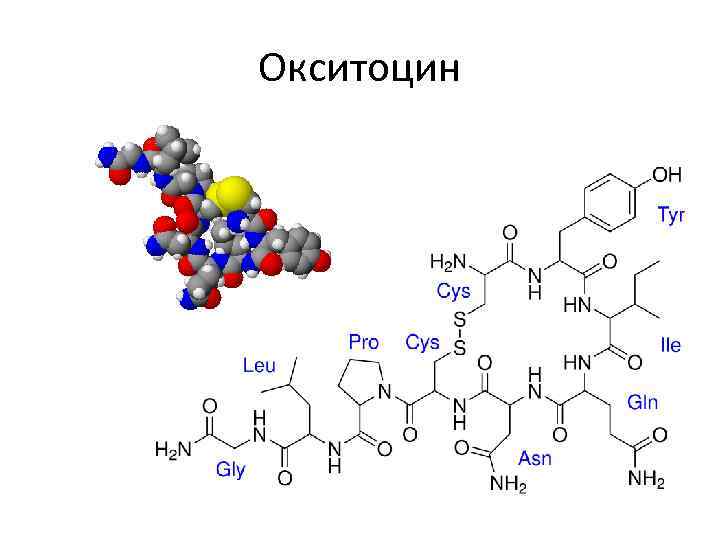
Окситоцин
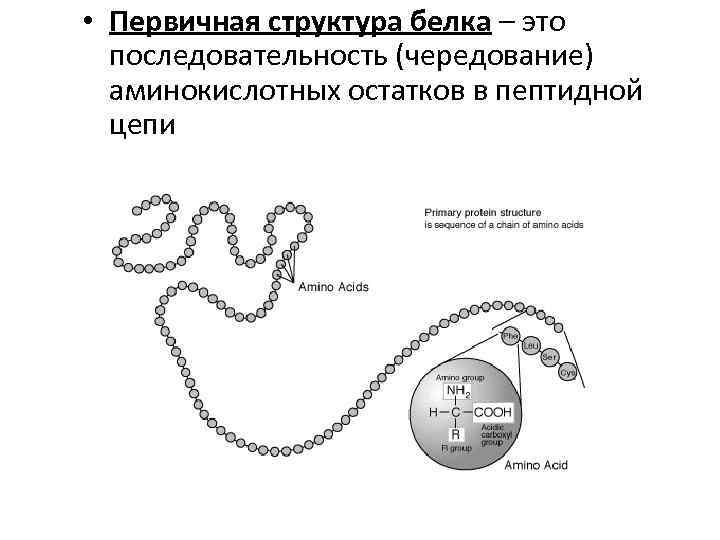
• Первичная структура белка – это последовательность (чередование) аминокислотных остатков в пептидной цепи
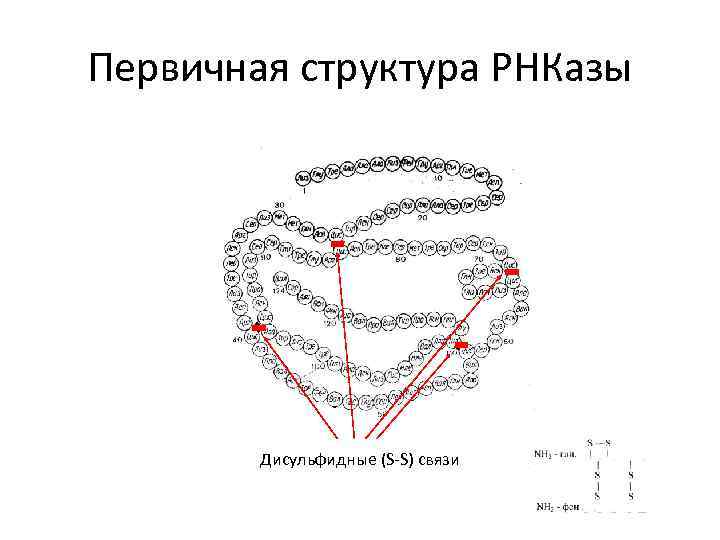
Первичная структура РНКазы Дисульфидные (S-S) связи
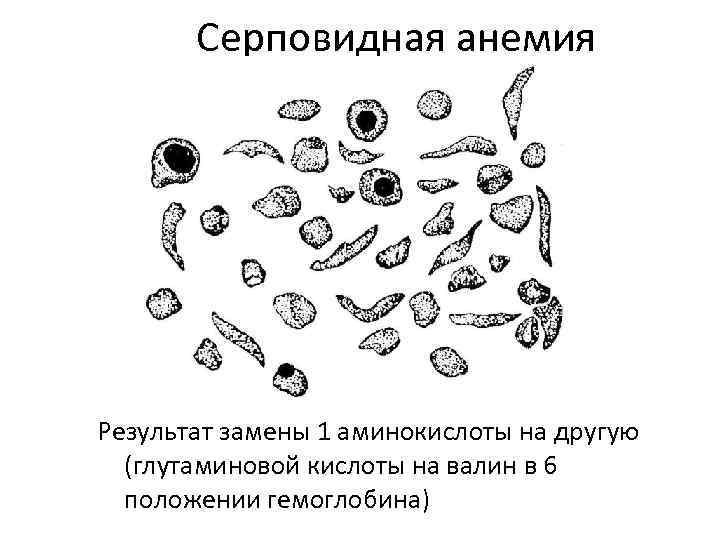
Серповидная анемия Результат замены 1 аминокислоты на другую (глутаминовой кислоты на валин в 6 положении гемоглобина)

Вторичная структура белка – это способ укладки полипептидной цепи в спиральную конфигурацию, стабилизированный водородными связями и гидрофобными взаимодействиями

α-спираль
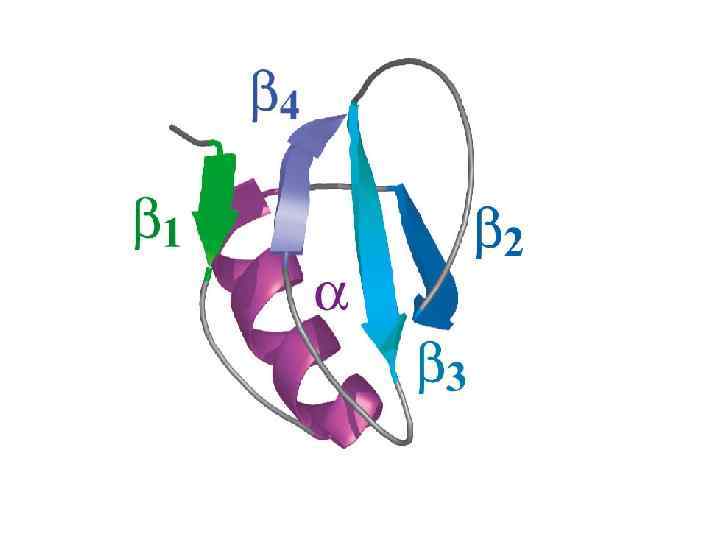

α-спираль
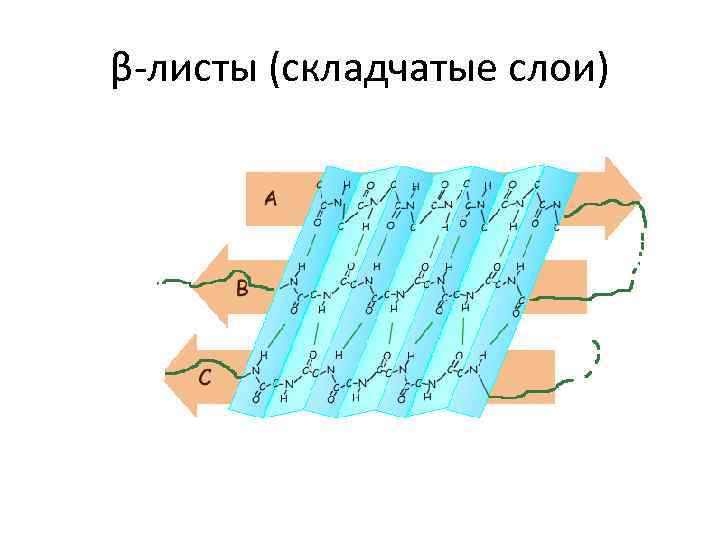
β-листы (складчатые слои)
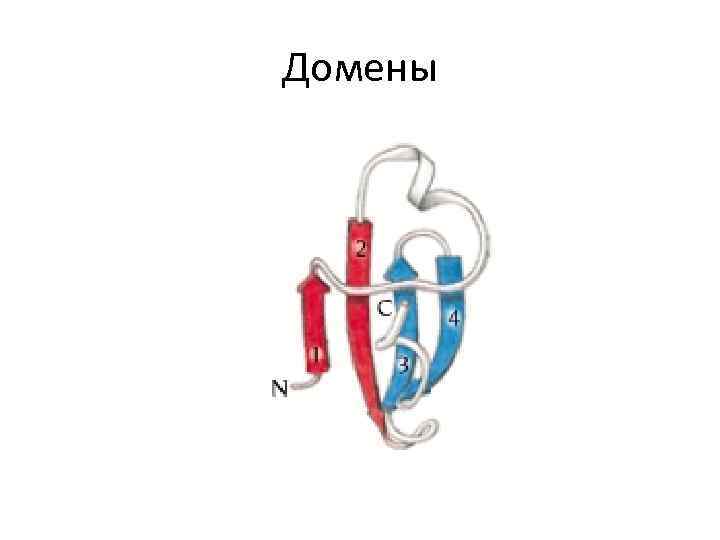
Домены
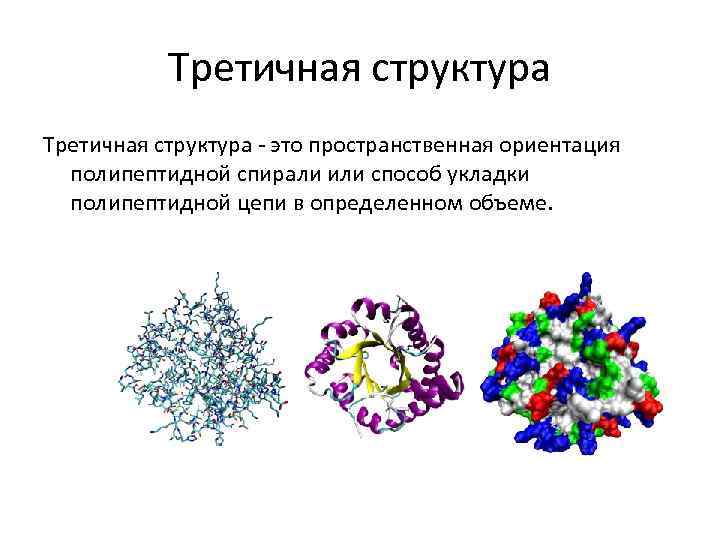
Третичная структура - это пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
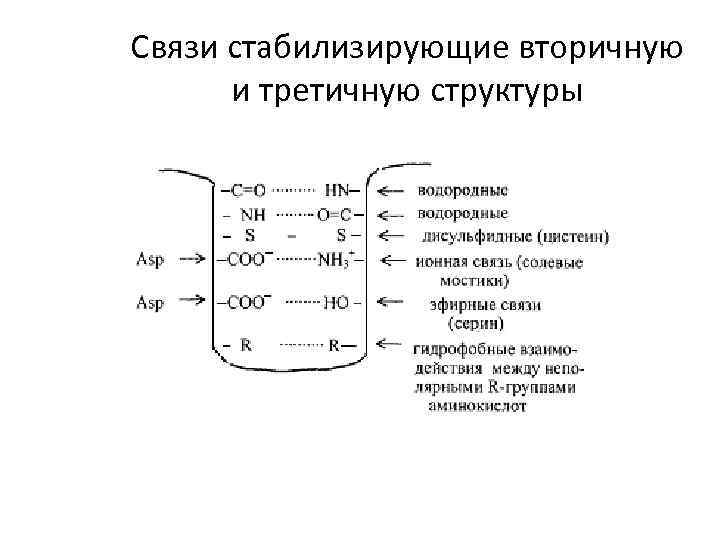
Связи стабилизирующие вторичную и третичную структуры
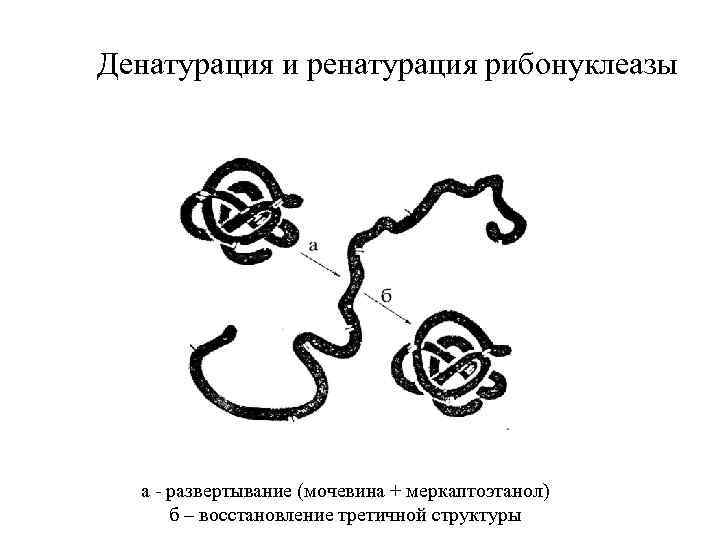
Денатурация и ренатурация рибонуклеазы а - развертывание (мочевина + меркаптоэтанол) б – восстановление третичной структуры
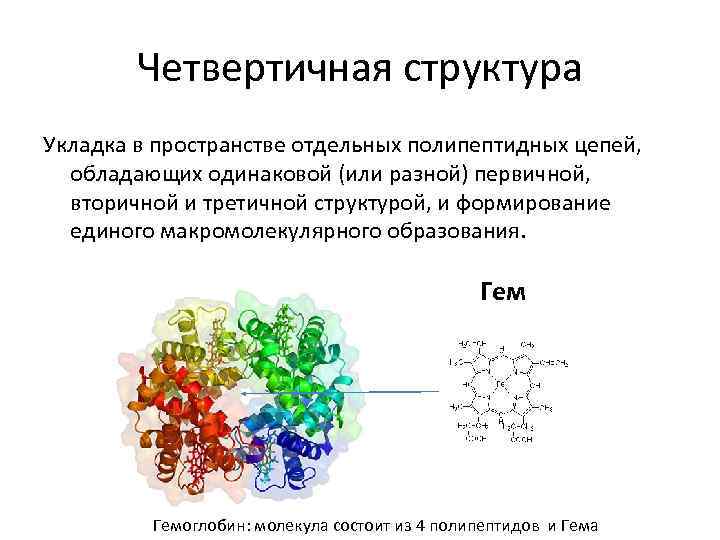
Четвертичная структура Укладка в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной и третичной структурой, и формирование единого макромолекулярного образования. Гемоглобин: молекула состоит из 4 полипептидов и Гема
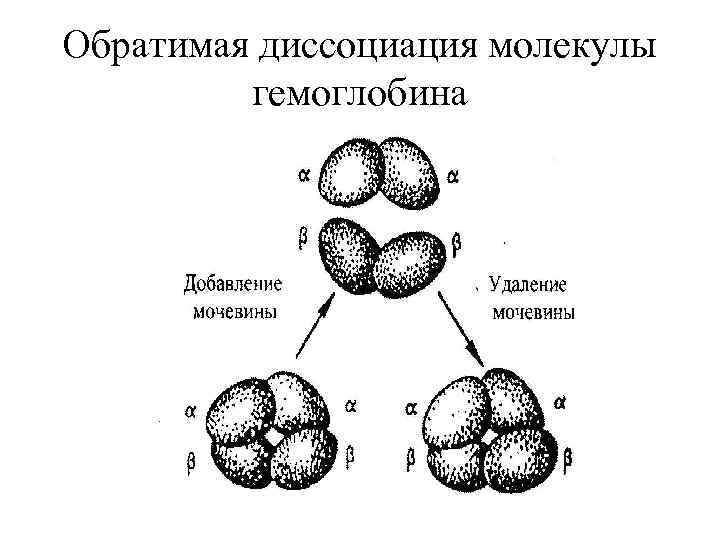
Обратимая диссоциация молекулы гемоглобина
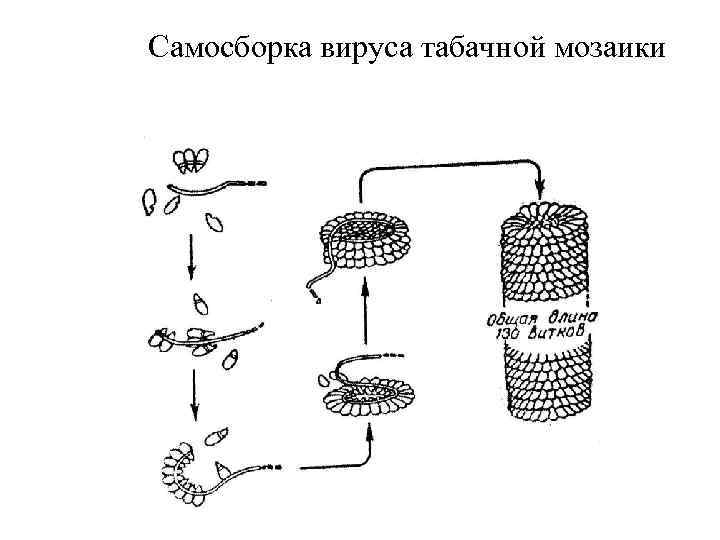
Самосборка вируса табачной мозаики

Классификация белков • Протеины - простые белки, построены только из аминокислот • Протеиды - сложные белки состоят из белка и небелкового компонента, который называется простетической группой

Класс протеины (простые белки) Гистоны Протамины Проламины Глутелины Протеиноиды Коллаген, кератин • Альбумины и глобулины • • •

Кератины

Коллаген • Электронная микрофотография коллагеновых фибрилл соединительной ткани.

Класс протеиды (сложные белки) • Хромопротеиды белок + окрашенный небелковый компонент. гемопротеиды, магний-порфирины, флавопротеиды. Фотосинтез, дыхание, транспорт кислорода и углекислоты, окислительновостановительные реакции
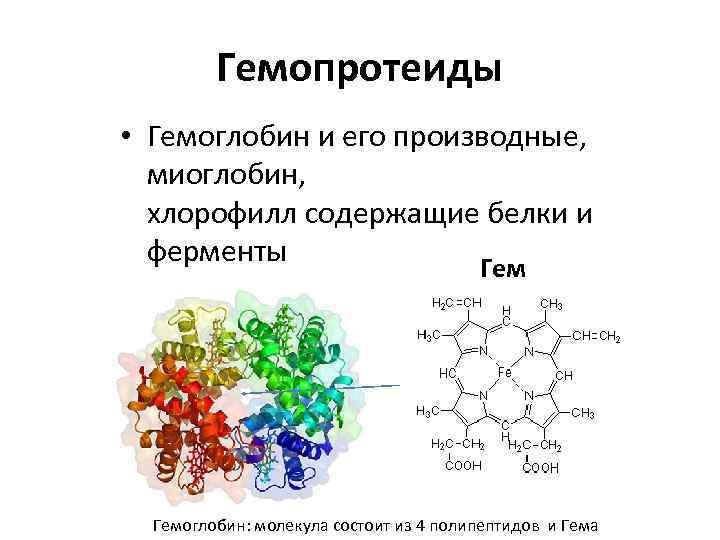
Гемопротеиды • Гемоглобин и его производные, миоглобин, хлорофилл содержащие белки и ферменты Гемоглобин: молекула состоит из 4 полипептидов и Гема

Нуклеопротеиды • состоят из белков и нуклеиновых кислот. ДНП (дезоксинуклеопротеид): ДНК+белок РНП (рибонуклеопротеид): РНК+белок

Липопротеиды • Белок + Липиды входят в состав клеточной мембраны, внутриклеточных мембран ядра, митохондрий, микросом, миелиновых оболочек нервных волокон Ионные каналы, рецепторы гормонов

Фосфопротеиды Казеиноген молока , вителлин, фосфовитин, выделенные из желтка куриного я овальбумин , фосфопротеиды в тканях нервной

Гликопротеиды • Белок + углеводы и их производные гексозамины (глюкозамин, галактозамин), глюкозу, маннозу, галактозу, ксилозу, арабинозу, глюкуроновую, уксусную и серные кислоты, нейраминовую и сиаловую кислоты, Гиалуроновая и Хондроитинсерная кислоты– входят в состав внеклеточного вещества соединительной ткани, содержится в клеточной оболочке, в стекловидном теле, синовиальной жидкости.

Металлопротеиды • Белок + металл (ион) 1) Железо-содержащие: - Ферритин (депо железа в клетке) - Трансферрин (перенос железа) - Гемосидерин 2) Ферменты, у которых ионы металлов выполняют каталитическую роль Zn 2+, Mg 2+, Fe 3+, Mn 2+, Cu 2+, K+, Na+, Ca 2+
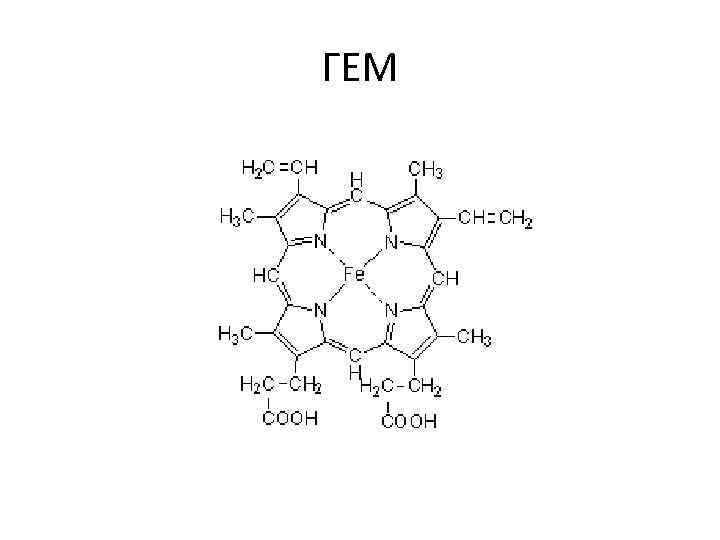
ГЕМ

Производные гемоглобина • Оксигемоглобин Hb. O 2, где кислород соединен координационной связью с атомом железа, что обеспечивает оксигенизацию - насыщение кислородом, это не химическая связь. • Карбоксигемоглобин Hb. CO – гемоглобин связан с оксидом углерода (угарным газом). При этом Hb теряет способность связывать кислород. • Метгемоглобин Hb. OH – окисленный гемоглобин. Образуется при отравлении оксидом азота, парами нитробензола и другими соединениями, железо трехвалентное; не способен к оксигенизации. • Карбгемоглобин Hb. CO 2 – гемоглобин, насыщенный углекислым газом CO 2.

• Миоглобин имеет Мм 17000 Да, имеет гем и одну полипептидную цепь, содержится в мышечной ткани. • Каталаза – гемсодержащий фермент, имеет Мм 225000 Да, катализирует разрушение перекиси водорода: 2 H 2 O 2 → 2 H 2 O +O 2

Липопротеиды – состоят из белка и липида. Они входят в состав клеточной мембраны, мембран ядра, митохондрий, микросом, миелиновых оболочек нервных волокон. В плазме крови: α-ЛПВП – липопротеиды высокой плотности, содержание белка - 50%, . β-ЛПНП – липопротеиды низкой плотности, содержание белка 21%, богаты холестерином. Пре-β-ЛПОНП – липопротеиды особо низкой плотности, содержание белка 9%; . Хиломикроны, содержание белка 1% (жиры). .

• Фосфопротеиды. К ним относятся казеиноген молока, вителлин, фосфовитин, выделенные из желтка куриного яйца, овальбумин, . • Гликопротеиды. В гидролизате обнаруживают гексозамины (глюкозамин, галактозамин), глюкозу, маннозу, галактозу, ксилозу, арабинозу, глюкуроновую, уксусную и серные кислоты, нейраминовую и сиаловую кислоты • Гиалуроновая кислота – входит в состав внеклеточного вещества соединительной ткани, содержится в клеточной оболочке, в стекловидном теле, синовиальной жидкости.

• . • , • Металлопротеиды. содержат кроме белка, ионы какого-либо металла. • Ферритин – белок с Мм 400000, содержание железа 17 -23% является депо железа в организме. • Трансферрин – с Мм 90000 содержание железа 0, 13%. физиологический переносчик железа. • Гемосидерин – содержится в клетках РЭС, печени, селезенки. • Ко второй группе относятся ферменты, у которых металл выполняет каталитическую функцию. ( Zn 2+, Mg 2+, Fe 3+, Mn 2+, Cu 2+, K+, Na+, Ca 2)

Гистоны – белки основного характера, содержат от 10 до 30% лизина, аргинина, гистидина. . Молекулярная масса 5000 -37000. Входят в состав ядерных белков – ДНК-протеидов, играют важную роль в регуляции метаболической активности генома.

• Протамины – белки основного характера. Молекулярная масса около 5000 Содержание аргинина составляет 60 -65%. Входит в состав ДНП-нуклеопротеидов

• Проламины – белки, нерастворимые в воде, не свертываются при кипячении. Входят в состав белков злаков: • глиадин – содержится в зерне пшеницы, ржи, • гордеин – содержится в семенах ячменя, зеин - содержится в семенах кукурузы, содержат до 30% глутаминовой кислоты, 10 -15% пролина

• Глютелины – растительные белки, нерастворимые в воде, содержатся в семенах злаков (фр. gluten -клейковина). Определяют хлебопекарные качества муки (зерна

• Протеиноиды (коллагены, кератины) – опорные белки

• Коллаген и эластин – главные фибриллярные белки соединительной ткани сухожилий, связок. • На долю коллагена приходится почти 1/3 всей массы белков позвоночных. проволоку равного поперечного

• Альбумины и глобулины относятся к белкам широко распространенным в органах и тканях животных • сыворотка крови, молоко, яичный белок, мышцы и т. д. • В плазме крови содержится 7% белков, из которых на долю альбуминов приходится больше половины, остальные на долю глобулинов

• Альбумины принимают участие в создании осмотического давления крови транспортируют жирные кислоты, гормоны, Ca 2+

• Глобулины – по форме молекул относятся к глобулярным белкам. • Различают • сывороточные, • молочные, • яичные глобулины. • Глобулины имеют несколько фракций: α, β, γ. Гамма-глобулины являются носителями иммунитета
Структура белков1.pptx