Строение ядер атомов.ppt
- Количество слайдов: 14
 Строение ядер атомов. Изотопы. Ядерные реакции. Радиоактивность.
Строение ядер атомов. Изотопы. Ядерные реакции. Радиоактивность.
 Изображение атомов углерода на поверхности графита, полученное с помощью туннельного микроскопа. Оранжевые линии - изображение электронных орбит, черные области - положение ядер атомов графита.
Изображение атомов углерода на поверхности графита, полученное с помощью туннельного микроскопа. Оранжевые линии - изображение электронных орбит, черные области - положение ядер атомов графита.
 Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атома. Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A. Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N. Например, в ядре атома кислорода 1680 содержится 8 протонов и 16 - 8 = 8 нейтронов, что кратко записывается так: (8 р, 8 n); в ядре атома курчатовия 260104 Ku 104 протона и 260 -104=156 нейтронов, краткая запись состава ядра: (104 р, 156 n) и т. д. Исследования показали, что в природе существуют атомы одного и того же элемента с разной массой. Так, встречаются атомы хлора с массой 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Разновидности атомов одного элемента, обладающие одинаковыми заряда ми ядер, но разными массовыми числами, называются изотопами.
Атомное ядро - центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атома. Заряд ядра - положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе. Сумма протонов и нейтронов атомного ядра называется массовым числом A. Массовое число A равно числу протонов Z и числу нейтронов N в атомном ядре; A = Z + N. Например, в ядре атома кислорода 1680 содержится 8 протонов и 16 - 8 = 8 нейтронов, что кратко записывается так: (8 р, 8 n); в ядре атома курчатовия 260104 Ku 104 протона и 260 -104=156 нейтронов, краткая запись состава ядра: (104 р, 156 n) и т. д. Исследования показали, что в природе существуют атомы одного и того же элемента с разной массой. Так, встречаются атомы хлора с массой 35 и 37. Ядра этих атомов содержат одинаковое число протонов, но разное число нейтронов. Разновидности атомов одного элемента, обладающие одинаковыми заряда ми ядер, но разными массовыми числами, называются изотопами.
 Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, изотоп углерода с массовым числом 12 записывается так: 126 С, или 12 С, или словами: «углерод-12» . Эта форма записи распространена и на элементарные частицы: электрон 01 е, нейтрон 01 n, протон 11 р или 11 Н. Изотопы известны для всех химических элементов. Так, кислород имеет изотопы с массовыми числами 16, 17, 18: 168 O, 178 O, 188 O. Изотопы аргона: 3718 Ar, 3818 Ar, 4018 Ar. Изотопы калия: 3919 K, 4019 K, 4119 K. Изотопы водорода имеют специальные символы и названия: 1 H - протий; 2 D - дейтерий; 3 T - тритий. 1 1 1 Относительные атомные массы элементов, приводимые в периодической системе - есть средние массовые числа природных смесей изотопов. Поэтому они и отличаются от целочисленных значений. Пример. Природный таллий (ат. н. 81, ат. масса 204, 383) состоит из двух изотопов: 29, 5 % таллия– 203 и 70, 5 % таллия-205. Средняя атомная масса таллия равна: Aср. (Tl) = (0, 295 • 203 + 0, 705 • 205) / 2 = 204, 383
Каждый изотоп характеризуется двумя величинами: массовым числом (проставляется вверху слева от химического знака) и порядковым номером (проставляется внизу слева от химического знака) и обозначается символом соответствующего элемента. Например, изотоп углерода с массовым числом 12 записывается так: 126 С, или 12 С, или словами: «углерод-12» . Эта форма записи распространена и на элементарные частицы: электрон 01 е, нейтрон 01 n, протон 11 р или 11 Н. Изотопы известны для всех химических элементов. Так, кислород имеет изотопы с массовыми числами 16, 17, 18: 168 O, 178 O, 188 O. Изотопы аргона: 3718 Ar, 3818 Ar, 4018 Ar. Изотопы калия: 3919 K, 4019 K, 4119 K. Изотопы водорода имеют специальные символы и названия: 1 H - протий; 2 D - дейтерий; 3 T - тритий. 1 1 1 Относительные атомные массы элементов, приводимые в периодической системе - есть средние массовые числа природных смесей изотопов. Поэтому они и отличаются от целочисленных значений. Пример. Природный таллий (ат. н. 81, ат. масса 204, 383) состоит из двух изотопов: 29, 5 % таллия– 203 и 70, 5 % таллия-205. Средняя атомная масса таллия равна: Aср. (Tl) = (0, 295 • 203 + 0, 705 • 205) / 2 = 204, 383
 Изобары - атомы различных химических элементов с одинаковым массовым числом А. Ядра изобар содержат равное число нуклонов, но различные числа протонов Z и нейтронов N. Например, атомы 104 Be, 105 B, 106 C представляют собой три изобары с A = 10, 40 Ar, 40 K, 40 Ca изобары с А=40. Наиболее распространенными в природе элементами являются (% мас. земной коры): кислород (47), кремний (29, 5), алюминий (8, 05), железо (4, 65), кальций (2, 96), натрий (2, 5), калий (2, 5) и магний (1, 87). Их суммарное содержание более 99%. Следовательно, на долю остальных приходится менее 1%. Из этой «восьмерки» алюминий и натрий представлены единственным видом атомов (27 Аl и 23 Na); у других – один из изотопов имеет резко преобладающее содержание (16 О, 28 Si, 56 Fe, 40 Ca, 39 K, 24 Mg). Таким образом, перечисленные изотопы являются тем материалом, из которого фактически построена вся «земная твердь» . Главные «компоненты» атмосферы – 14 N и 16 O. Наконец, водное пространство – сочетания того же изотопа кислорода с легким изотопом водорода ( 1 Н). Таким образом получается, что всего десять стабильных изотопов в решающей степени обусловливают бесконечное разнообразие неорганической и органической природы.
Изобары - атомы различных химических элементов с одинаковым массовым числом А. Ядра изобар содержат равное число нуклонов, но различные числа протонов Z и нейтронов N. Например, атомы 104 Be, 105 B, 106 C представляют собой три изобары с A = 10, 40 Ar, 40 K, 40 Ca изобары с А=40. Наиболее распространенными в природе элементами являются (% мас. земной коры): кислород (47), кремний (29, 5), алюминий (8, 05), железо (4, 65), кальций (2, 96), натрий (2, 5), калий (2, 5) и магний (1, 87). Их суммарное содержание более 99%. Следовательно, на долю остальных приходится менее 1%. Из этой «восьмерки» алюминий и натрий представлены единственным видом атомов (27 Аl и 23 Na); у других – один из изотопов имеет резко преобладающее содержание (16 О, 28 Si, 56 Fe, 40 Ca, 39 K, 24 Mg). Таким образом, перечисленные изотопы являются тем материалом, из которого фактически построена вся «земная твердь» . Главные «компоненты» атмосферы – 14 N и 16 O. Наконец, водное пространство – сочетания того же изотопа кислорода с легким изотопом водорода ( 1 Н). Таким образом получается, что всего десять стабильных изотопов в решающей степени обусловливают бесконечное разнообразие неорганической и органической природы.
 Наиболее распространенными в природе элементами являются (% мас. земной коры): кислород (47), кремний (29, 5), алюминий (8, 05), железо (4, 65), кальций (2, 96), натрий (2, 5), калий (2, 5) и магний (1, 87). Их суммарное содержание более 99%. Следовательно, на долю остальных приходится менее 1%. Из этой «восьмерки» алюминий и натрий представлены единственным видом атомов (27 Аl и 23 Na); у других – один из изотопов имеет резко преобладающее содержание (16 О, 28 Si, 56 Fe, 40 Ca, 39 K, 24 Mg). Таким образом, перечисленные изотопы являются тем материалом, из которого фактически построена вся «земная твердь» . Главные «компоненты» атмосферы – 14 N и 16 O. Наконец, водное пространство – сочетания того же изотопа кислорода с легким изотопом водорода (1 Н). Таким образом получается, что всего десять стабильных изотопов в решающей степени обусловливают бесконечное разнообразие неорганической и органической природы.
Наиболее распространенными в природе элементами являются (% мас. земной коры): кислород (47), кремний (29, 5), алюминий (8, 05), железо (4, 65), кальций (2, 96), натрий (2, 5), калий (2, 5) и магний (1, 87). Их суммарное содержание более 99%. Следовательно, на долю остальных приходится менее 1%. Из этой «восьмерки» алюминий и натрий представлены единственным видом атомов (27 Аl и 23 Na); у других – один из изотопов имеет резко преобладающее содержание (16 О, 28 Si, 56 Fe, 40 Ca, 39 K, 24 Mg). Таким образом, перечисленные изотопы являются тем материалом, из которого фактически построена вся «земная твердь» . Главные «компоненты» атмосферы – 14 N и 16 O. Наконец, водное пространство – сочетания того же изотопа кислорода с легким изотопом водорода (1 Н). Таким образом получается, что всего десять стабильных изотопов в решающей степени обусловливают бесконечное разнообразие неорганической и органической природы.

 Впервые искусственно ядерная реакция была осуществлена Резерфордом в 1919 г. бомбардировкой ядер атомов азота α-частицами. В результате ядерной реакции произошло превращение азота в кислород с выделением протона. Более употребительна краткая запись ядерных реакций. Вначале записывают химический знак исходного ядра, затем (в скобках) кратко обозначают частицу, вызвавшую реакцию, и частицу, образовавшуюся в результате реакции, после чего ставят химический знак конечного ядра. При этом у символов исходного и конечного ядер обычно проставляются только массовые числа, так как заряды ядер легко определять по периодической системе элементов Д. И. Менделеева. Сокращенная запись рассмотренных ранее ядерных реакций следующая: 27 А 1(α, p)30 Si; 14 N (α, р)17 О; 226 Ra ( -, α)222 Rn, где α — обозначение α-частицы (42 He); p — протона (11 H); черточка означает отсутствие действующей частицы в случае радиоактивного распада.
Впервые искусственно ядерная реакция была осуществлена Резерфордом в 1919 г. бомбардировкой ядер атомов азота α-частицами. В результате ядерной реакции произошло превращение азота в кислород с выделением протона. Более употребительна краткая запись ядерных реакций. Вначале записывают химический знак исходного ядра, затем (в скобках) кратко обозначают частицу, вызвавшую реакцию, и частицу, образовавшуюся в результате реакции, после чего ставят химический знак конечного ядра. При этом у символов исходного и конечного ядер обычно проставляются только массовые числа, так как заряды ядер легко определять по периодической системе элементов Д. И. Менделеева. Сокращенная запись рассмотренных ранее ядерных реакций следующая: 27 А 1(α, p)30 Si; 14 N (α, р)17 О; 226 Ra ( -, α)222 Rn, где α — обозначение α-частицы (42 He); p — протона (11 H); черточка означает отсутствие действующей частицы в случае радиоактивного распада.

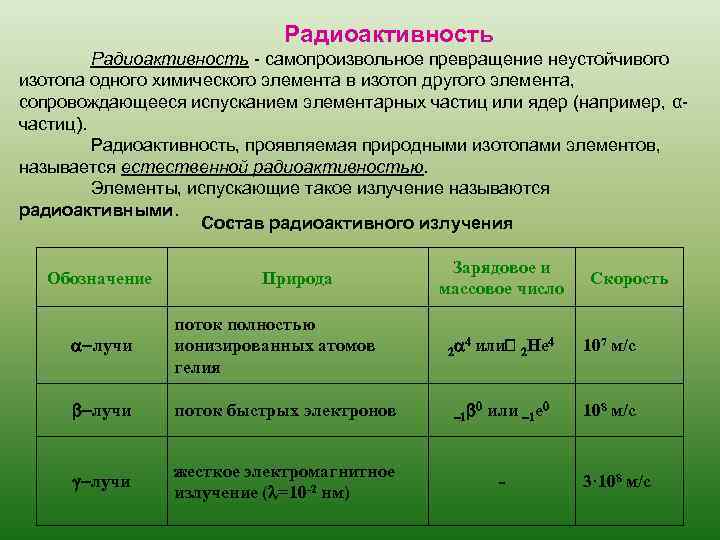 Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (например, αчастиц). Радиоактивность, проявляемая природными изотопами элементов, называется естественной радиоактивностью. Элементы, испускающие такое излучение называются радиоактивными. Состав радиоактивного излучения Обозначение Природа a-лучи поток полностью ионизированных атомов гелия b-лучи поток быстрых электронов g-лучи жесткое электромагнитное излучение (l=10 -2 нм) Зарядовое и массовое число 2 a 4 или -1 b 0 2 He 4 или -1 е 0 - Скорость 107 м/с 108 м/с 3· 108 м/с
Радиоактивность - самопроизвольное превращение неустойчивого изотопа одного химического элемента в изотоп другого элемента, сопровождающееся испусканием элементарных частиц или ядер (например, αчастиц). Радиоактивность, проявляемая природными изотопами элементов, называется естественной радиоактивностью. Элементы, испускающие такое излучение называются радиоактивными. Состав радиоактивного излучения Обозначение Природа a-лучи поток полностью ионизированных атомов гелия b-лучи поток быстрых электронов g-лучи жесткое электромагнитное излучение (l=10 -2 нм) Зарядовое и массовое число 2 a 4 или -1 b 0 2 He 4 или -1 е 0 - Скорость 107 м/с 108 м/с 3· 108 м/с
 Типы радиоактивных распадов Наблюдения показали, что одновременно a- и b-излучения испускаются только веществами, содержащими несколько различных радиоактивных элементов. Чистые радиоактивные элементы испускают или aизлучение или b-излучение, каждому их которых сопутствует g-излучение. Радиоактивность возникает вследствие самопроизвольного распада ядер одних элементов и превращения их в ядра других. Превращения ядер бывают двух типов: a-распад и b-распад. Они подчиняются определенным закономерностям, называемым правилами радиоактивного смещения. тип распада a-распад b-распад реакция ZX A => ZX Z-2 Y A => правило смещения 2 a при распаде образуется ядро элемента Y находящегося в таблице Менделеева на две клетки раньше исходного элемента X. -1 e при распаде образуется ядро элемента Y, находящегося на одну клетку вправо от исходного элемента X A-4 + Z+1 Y A + 4 0
Типы радиоактивных распадов Наблюдения показали, что одновременно a- и b-излучения испускаются только веществами, содержащими несколько различных радиоактивных элементов. Чистые радиоактивные элементы испускают или aизлучение или b-излучение, каждому их которых сопутствует g-излучение. Радиоактивность возникает вследствие самопроизвольного распада ядер одних элементов и превращения их в ядра других. Превращения ядер бывают двух типов: a-распад и b-распад. Они подчиняются определенным закономерностям, называемым правилами радиоактивного смещения. тип распада a-распад b-распад реакция ZX A => ZX Z-2 Y A => правило смещения 2 a при распаде образуется ядро элемента Y находящегося в таблице Менделеева на две клетки раньше исходного элемента X. -1 e при распаде образуется ядро элемента Y, находящегося на одну клетку вправо от исходного элемента X A-4 + Z+1 Y A + 4 0

 При реакциях самопроизвольного радиоактивного распада, также как и при искусственных ядерных реакциях выполняются следующие законы сохранения: сохранение зарядового числа сохранение массового числа сохранение энергии Закон радиоактивного распада Каждый радиоактивный элемент можно охарактеризовать промежутком времени Т, в течение которого распадается половина ядер, имевшихся в момент начала отсчета времени. Период полураспада - основная константа радиоактивного элемента. Период полураспада характеризует скорость распада. Например: радий 88 Ra 226 имеет период полураспада Т=1600 лет; торий 90 Th 231 - 25. 64 часа; полоний 84 Po 212 - 3· 10 -7 сек.
При реакциях самопроизвольного радиоактивного распада, также как и при искусственных ядерных реакциях выполняются следующие законы сохранения: сохранение зарядового числа сохранение массового числа сохранение энергии Закон радиоактивного распада Каждый радиоактивный элемент можно охарактеризовать промежутком времени Т, в течение которого распадается половина ядер, имевшихся в момент начала отсчета времени. Период полураспада - основная константа радиоактивного элемента. Период полураспада характеризует скорость распада. Например: радий 88 Ra 226 имеет период полураспада Т=1600 лет; торий 90 Th 231 - 25. 64 часа; полоний 84 Po 212 - 3· 10 -7 сек.
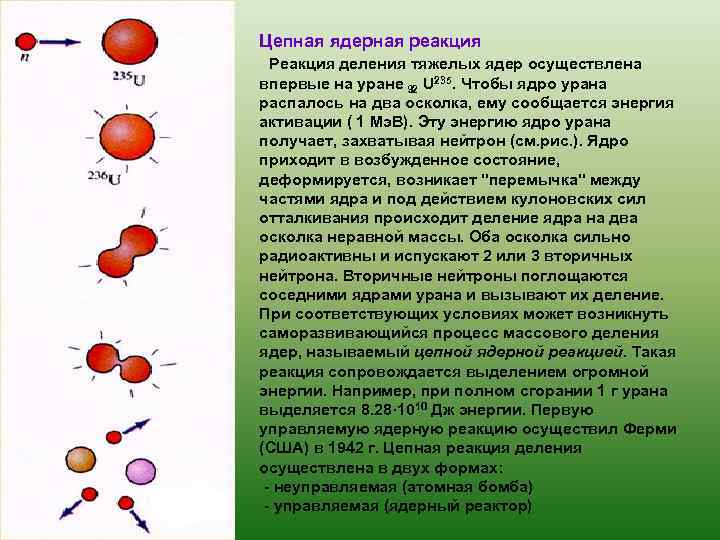 Цепная ядерная реакция Реакция деления тяжелых ядер осуществлена впервые на уране 92 U 235. Чтобы ядро урана распалось на два осколка, ему сообщается энергия активации ( 1 Мэ. В). Эту энергию ядро урана получает, захватывая нейтрон (см. рис. ). Ядро приходит в возбужденное состояние, деформируется, возникает "перемычка" между частями ядра и под действием кулоновских сил отталкивания происходит деление ядра на два осколка неравной массы. Оба осколка сильно радиоактивны и испускают 2 или 3 вторичных нейтрона. Вторичные нейтроны поглощаются соседними ядрами урана и вызывают их деление. При соответствующих условиях может возникнуть саморазвивающийся процесс массового деления ядер, называемый цепной ядерной реакцией. Такая реакция сопровождается выделением огромной энергии. Например, при полном сгорании 1 г урана выделяется 8. 28· 1010 Дж энергии. Первую управляемую ядерную реакцию осуществил Ферми (США) в 1942 г. Цепная реакция деления осуществлена в двух формах: - неуправляемая (атомная бомба) - управляемая (ядерный реактор)
Цепная ядерная реакция Реакция деления тяжелых ядер осуществлена впервые на уране 92 U 235. Чтобы ядро урана распалось на два осколка, ему сообщается энергия активации ( 1 Мэ. В). Эту энергию ядро урана получает, захватывая нейтрон (см. рис. ). Ядро приходит в возбужденное состояние, деформируется, возникает "перемычка" между частями ядра и под действием кулоновских сил отталкивания происходит деление ядра на два осколка неравной массы. Оба осколка сильно радиоактивны и испускают 2 или 3 вторичных нейтрона. Вторичные нейтроны поглощаются соседними ядрами урана и вызывают их деление. При соответствующих условиях может возникнуть саморазвивающийся процесс массового деления ядер, называемый цепной ядерной реакцией. Такая реакция сопровождается выделением огромной энергии. Например, при полном сгорании 1 г урана выделяется 8. 28· 1010 Дж энергии. Первую управляемую ядерную реакцию осуществил Ферми (США) в 1942 г. Цепная реакция деления осуществлена в двух формах: - неуправляемая (атомная бомба) - управляемая (ядерный реактор)


