Строение мицеллы.ppt
- Количество слайдов: 30
 Строение мицеллы Коллоидный раствор состоит из мицелл и интермицеллярной жидкости Мицелла (крупинка) – частица дисперсной фазы (ДФ), окруженная двойным электрическим слоем (ДЭС) Интермицеллярная жидкость – дисперсионная среда (ДС), содержащая электролиты, неэлектролиты, ПАВ.
Строение мицеллы Коллоидный раствор состоит из мицелл и интермицеллярной жидкости Мицелла (крупинка) – частица дисперсной фазы (ДФ), окруженная двойным электрическим слоем (ДЭС) Интермицеллярная жидкость – дисперсионная среда (ДС), содержащая электролиты, неэлектролиты, ПАВ.
 Строение мицеллы Аg. Cl Условия : 1. Наличие твердой фазы (Аg. Cl) 2. Разбавленные растворы исходных веществ (Аg. NO 3 и КCL) 3. Избыток одного из компонентов (например, КСl) Аg. NO 3 + КСl = Аg. Cl (т) + КNO 3 (изб) КСl <=> К+ + Сl–
Строение мицеллы Аg. Cl Условия : 1. Наличие твердой фазы (Аg. Cl) 2. Разбавленные растворы исходных веществ (Аg. NO 3 и КCL) 3. Избыток одного из компонентов (например, КСl) Аg. NO 3 + КСl = Аg. Cl (т) + КNO 3 (изб) КСl <=> К+ + Сl–
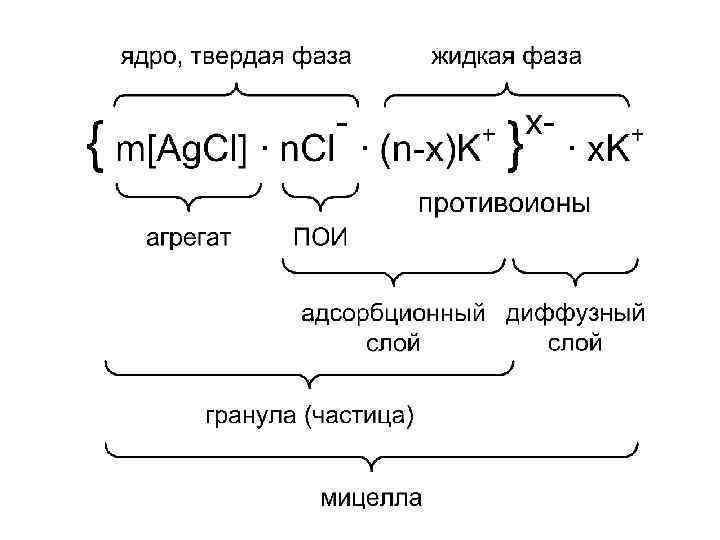
 • Агрегат: сотни молекул твердой фазы, нейтрален, имеет аморфное или кристаллическое строение. • Потенциалопределяющие ионы (ПОИ) – ионы стабилизатора, которые адсорбируются полностью по правилу Панета – Фаянса на поверхности агрегата и сообщают ему заряд. • Ядро : агрегат + ПОИ- твердая фаза. • Противоионы: ионы стабилизатора, противоположные по знаку ПОИ располагаются в дисперсионной среде – жидкая фаза.
• Агрегат: сотни молекул твердой фазы, нейтрален, имеет аморфное или кристаллическое строение. • Потенциалопределяющие ионы (ПОИ) – ионы стабилизатора, которые адсорбируются полностью по правилу Панета – Фаянса на поверхности агрегата и сообщают ему заряд. • Ядро : агрегат + ПОИ- твердая фаза. • Противоионы: ионы стабилизатора, противоположные по знаку ПОИ располагаются в дисперсионной среде – жидкая фаза.
 • (n – x) – часть противоионов стабилизатора связаны с ядром силами адсорбции и электростатического притяжения. • Адсорбционный слой: ПОИ + (n-x) противоионов. • Диффузный слой: остальная часть противоионов слабо связаны с ядром (только электростатически) под влиянием диффузии располагаются в жидкой дисперсионной среде. • Гранула: агрегат + адсорбционный слой.
• (n – x) – часть противоионов стабилизатора связаны с ядром силами адсорбции и электростатического притяжения. • Адсорбционный слой: ПОИ + (n-x) противоионов. • Диффузный слой: остальная часть противоионов слабо связаны с ядром (только электростатически) под влиянием диффузии располагаются в жидкой дисперсионной среде. • Гранула: агрегат + адсорбционный слой.
 • Заряд гранулы равен по величине , но противоположен по знаку заряду ионов диффузного слоя. • Мицелла: гранула + диффузный слой электронейтральна.
• Заряд гранулы равен по величине , но противоположен по знаку заряду ионов диффузного слоя. • Мицелла: гранула + диффузный слой электронейтральна.
 Мицелла Аg. Cl в избытке Аg. NO 3 <=> Аg+ + NO 3– {m[Ag. Cl] · n. Ag+ · (n-x)NO 3–}x+ · x. NO 3– Знак заряда золя определяется по знаку заряда гранулы и ПОИ.
Мицелла Аg. Cl в избытке Аg. NO 3 <=> Аg+ + NO 3– {m[Ag. Cl] · n. Ag+ · (n-x)NO 3–}x+ · x. NO 3– Знак заряда золя определяется по знаку заряда гранулы и ПОИ.
 Двойной электрический слой
Двойной электрический слой
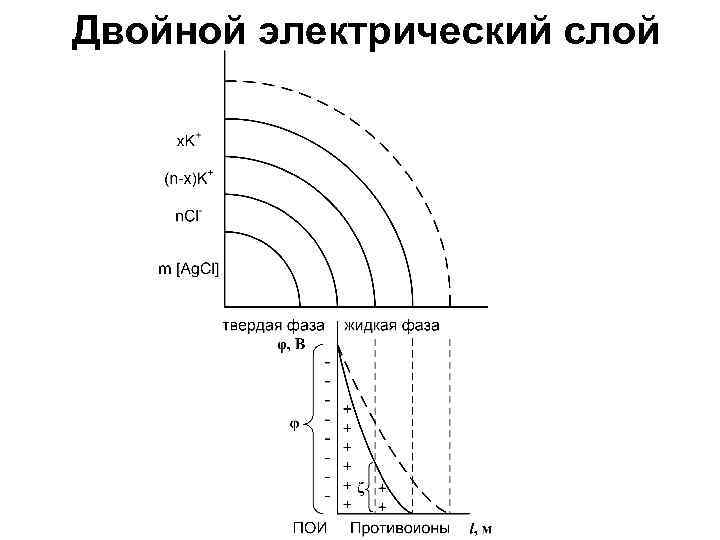
 Электрокинетические свойства Электротермодинамический потенциал На границе твердой и жидкой фаз (между ПОИ и противоионами) возникает ДЭС = разность потенциалов – электротермодинамический потенциал (φ). Знак и величина его зависит от ПОИ. По мере удаления от межфазной границы его значение уменьшается.
Электрокинетические свойства Электротермодинамический потенциал На границе твердой и жидкой фаз (между ПОИ и противоионами) возникает ДЭС = разность потенциалов – электротермодинамический потенциал (φ). Знак и величина его зависит от ПОИ. По мере удаления от межфазной границы его значение уменьшается.
 Электрокинетический потенциал В электрическом поле гранула и диффузный слой движутся в противоположных направлениях, поэтому границу между ними называют поверхностью скольжения. На поверхности скольжения возникает ДЭС и электрокинетический потенциал или ζ потенциал (дзета – потенциал).
Электрокинетический потенциал В электрическом поле гранула и диффузный слой движутся в противоположных направлениях, поэтому границу между ними называют поверхностью скольжения. На поверхности скольжения возникает ДЭС и электрокинетический потенциал или ζ потенциал (дзета – потенциал).
 ζ - потенциал это часть термодинамического потенциала φ, имеет одинаковый с ним знак, но всегда меньше его. ζ -потенциал зависит: 1. От толщины диффузного слоя (l): чем ↑l, тем ↑ζ. При коагуляции ζ - потенциал ↓. 2. От температуры. ζ - потенциал – мера устойчивости коллоидного раствора. Чем ↑ζ, тем ↑ устойчивость системы. Если ζ = 0, то система находится в изоэлектрическом состоянии (ИЭС).
ζ - потенциал это часть термодинамического потенциала φ, имеет одинаковый с ним знак, но всегда меньше его. ζ -потенциал зависит: 1. От толщины диффузного слоя (l): чем ↑l, тем ↑ζ. При коагуляции ζ - потенциал ↓. 2. От температуры. ζ - потенциал – мера устойчивости коллоидного раствора. Чем ↑ζ, тем ↑ устойчивость системы. Если ζ = 0, то система находится в изоэлектрическом состоянии (ИЭС).
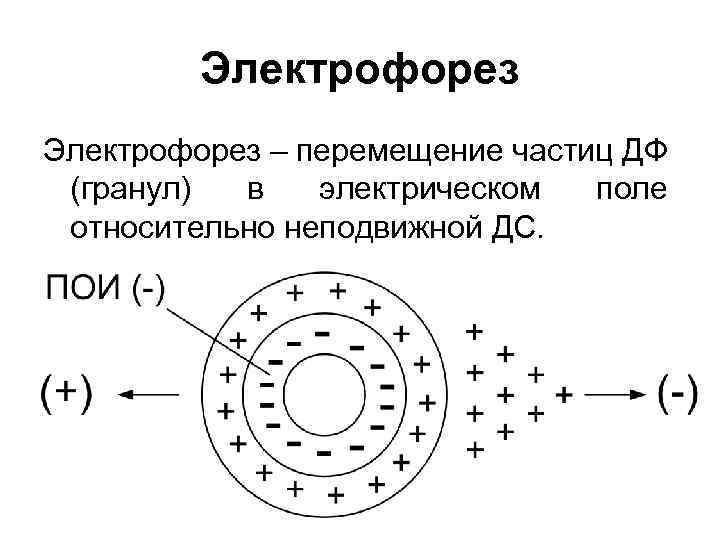 Электрофорез – перемещение частиц ДФ (гранул) в электрическом поле относительно неподвижной ДС.
Электрофорез – перемещение частиц ДФ (гранул) в электрическом поле относительно неподвижной ДС.
 Уравнение Гельмгольца – Смолуховского Uэф – скорость электрофореза , м/с ε - диэлектрическая проницаемость среды ε 0 - электрическая постоянная 8, 9 *10 -12 А *c / (В*м) Δφ - разность потенциалов от внешнего источника тока, В ζ - дзета-потенциал, В KФ - коэффициент, зависящий от формы коллоидной частицы η - вязкость среды, Н*с/ м 2 l - расстояние между электродами, м
Уравнение Гельмгольца – Смолуховского Uэф – скорость электрофореза , м/с ε - диэлектрическая проницаемость среды ε 0 - электрическая постоянная 8, 9 *10 -12 А *c / (В*м) Δφ - разность потенциалов от внешнего источника тока, В ζ - дзета-потенциал, В KФ - коэффициент, зависящий от формы коллоидной частицы η - вязкость среды, Н*с/ м 2 l - расстояние между электродами, м
 Применение электрофореза Электрофорез применяется для • определения дзета-потенциала, • разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, форменных элементов крови, • определения чистоты фармпрепаратов, • введения лекарств через кожу, • проведения диагностики заболеваний по электрофореграммам биожидкостей
Применение электрофореза Электрофорез применяется для • определения дзета-потенциала, • разделения аминокислот, нуклеиновых кислот, антибиотиков, ферментов, форменных элементов крови, • определения чистоты фармпрепаратов, • введения лекарств через кожу, • проведения диагностики заболеваний по электрофореграммам биожидкостей
 Электроосмос – перемещение дисперсионной среды (диффузного слоя и растворителя) в электрическом поле относительно неподвижной ДФ. Электроосмос применяют для очистки воды, сывороток, для осушения или пропитки пористых материалов.
Электроосмос – перемещение дисперсионной среды (диффузного слоя и растворителя) в электрическом поле относительно неподвижной ДФ. Электроосмос применяют для очистки воды, сывороток, для осушения или пропитки пористых материалов.
 Виды устойчивости коллоидных систем Кинетическая (седиментационная) – способность частиц ДФ оставаться во взвешенном состоянии. Условия кинетической устойчивости: - размер частиц , чем ↓ r , тем устойчивей система - броуновское движение (Vседиментации = Vдиффузии) - вязкость среды. При нарушении кинетической устойчивости происходит отделение ДФ от ДС.
Виды устойчивости коллоидных систем Кинетическая (седиментационная) – способность частиц ДФ оставаться во взвешенном состоянии. Условия кинетической устойчивости: - размер частиц , чем ↓ r , тем устойчивей система - броуновское движение (Vседиментации = Vдиффузии) - вязкость среды. При нарушении кинетической устойчивости происходит отделение ДФ от ДС.
 Агрегативная устойчивость – способность частиц ДФ противостоять их агрегации (слипанию) Условия агрегативной устойчивости: - наличие ζ потенциала - гидратная оболочка вокруг частиц (толщина диффузного слоя)
Агрегативная устойчивость – способность частиц ДФ противостоять их агрегации (слипанию) Условия агрегативной устойчивости: - наличие ζ потенциала - гидратная оболочка вокруг частиц (толщина диффузного слоя)
 Коагуляция – процесс объединения (укрупнения, слипания) частиц ДФ при потере системой агрегативной устойчивости. Признаки коагуляции: изменение окраски, помутнение, ↑вязкости. Факторы, вызывающие коагуляцию: - механическое воздействие (встряхивание, перемешивание) - изменение t 0 - различные виды излучений - повышение С - добавление электролитов
Коагуляция – процесс объединения (укрупнения, слипания) частиц ДФ при потере системой агрегативной устойчивости. Признаки коагуляции: изменение окраски, помутнение, ↑вязкости. Факторы, вызывающие коагуляцию: - механическое воздействие (встряхивание, перемешивание) - изменение t 0 - различные виды излучений - повышение С - добавление электролитов
 Порог коагуляции (Сп) – минимальная концентрация электролита, которая вызывает быструю коагуляцию 1 л золя (ммоль/л). Коагулирующая способность – величина, обратная порогу коагуляции Vкс = 1/Сп
Порог коагуляции (Сп) – минимальная концентрация электролита, которая вызывает быструю коагуляцию 1 л золя (ммоль/л). Коагулирующая способность – величина, обратная порогу коагуляции Vкс = 1/Сп
 Правило Шульце – Гарди Коагуляцию вызывает ион электролита, имеющий заряд, противоположный заряду гранулы (Гарди). Коагулирующая способность тем больше, чем больше заряд коагулирующего иона (Шульце) { }– Na. Cl, Мg. Сl 2, Аl. Cl 3 Коагуляцию вызывают катионы Vкс Аl 3+ > Мg 2+ > Na+ Сп Аl 3+ < Мg 2+ < Na+ { }+ Na. Cl, Na 2 SO 4, Na 3 РО 4 коагуляцию вызывают анионы Vкс РО 43 - > SO 42 - > Cl. Сп РО 43 - < SO 42 - < Cl-
Правило Шульце – Гарди Коагуляцию вызывает ион электролита, имеющий заряд, противоположный заряду гранулы (Гарди). Коагулирующая способность тем больше, чем больше заряд коагулирующего иона (Шульце) { }– Na. Cl, Мg. Сl 2, Аl. Cl 3 Коагуляцию вызывают катионы Vкс Аl 3+ > Мg 2+ > Na+ Сп Аl 3+ < Мg 2+ < Na+ { }+ Na. Cl, Na 2 SO 4, Na 3 РО 4 коагуляцию вызывают анионы Vкс РО 43 - > SO 42 - > Cl. Сп РО 43 - < SO 42 - < Cl-
 Коагулирующая способность 2 х зарядных ионов в десятки раз, а 3 х зарядных в сотни раз выше, чем у однозарядных. Пример: Vкс : Na+=1, Мg 2+=70, Al 3+=550 Физиологический раствор готовят из Na. Cl, а не Са. Сl 2 , почему?
Коагулирующая способность 2 х зарядных ионов в десятки раз, а 3 х зарядных в сотни раз выше, чем у однозарядных. Пример: Vкс : Na+=1, Мg 2+=70, Al 3+=550 Физиологический раствор готовят из Na. Cl, а не Са. Сl 2 , почему?
 Механизм коагулирующего действия электролитов Под действием электролита происходит сжатие диффузного слоя, переход ионов диффузного слоя в адсорбционный, ↓ζ - потенциала => потеря агрегативной, а затем и кинетической устойчивости.
Механизм коагулирующего действия электролитов Под действием электролита происходит сжатие диффузного слоя, переход ионов диффузного слоя в адсорбционный, ↓ζ - потенциала => потеря агрегативной, а затем и кинетической устойчивости.
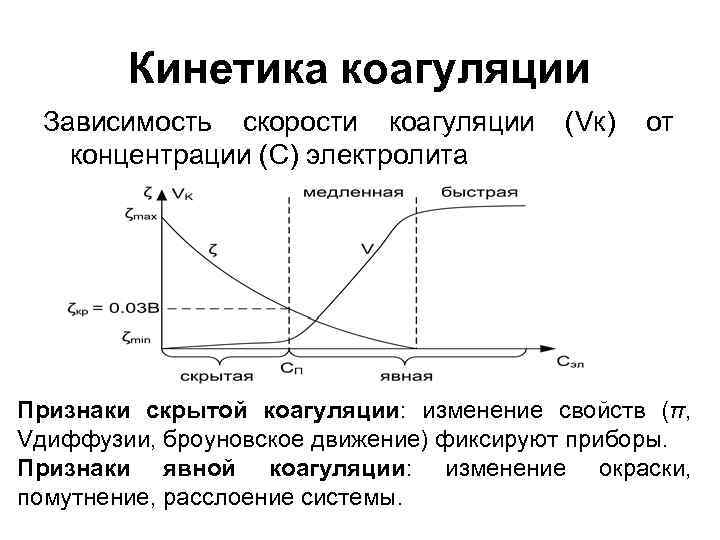 Кинетика коагуляции Зависимость скорости коагуляции концентрации (С) электролита (Vк) от Признаки скрытой коагуляции: изменение свойств (π, Vдиффузии, броуновское движение) фиксируют приборы. Признаки явной коагуляции: изменение окраски, помутнение, расслоение системы.
Кинетика коагуляции Зависимость скорости коагуляции концентрации (С) электролита (Vк) от Признаки скрытой коагуляции: изменение свойств (π, Vдиффузии, броуновское движение) фиксируют приборы. Признаки явной коагуляции: изменение окраски, помутнение, расслоение системы.
![Взаимная коагуляция Коагуляция при смешивании двух золей с противоположно заряженными гранулами. {m[Ag. Cl] · Взаимная коагуляция Коагуляция при смешивании двух золей с противоположно заряженными гранулами. {m[Ag. Cl] ·](https://present5.com/presentation/-42879204_133985551/image-24.jpg) Взаимная коагуляция Коагуляция при смешивании двух золей с противоположно заряженными гранулами. {m[Ag. Cl] · n. Ag+ · (n-x)NO 3–}x+ · x. NO 3– {m[Ag. Cl]·n. Cl-·n. K+}0 {m[Ag. Cl]·n. Ag+·n. No 3 -}0
Взаимная коагуляция Коагуляция при смешивании двух золей с противоположно заряженными гранулами. {m[Ag. Cl] · n. Ag+ · (n-x)NO 3–}x+ · x. NO 3– {m[Ag. Cl]·n. Cl-·n. K+}0 {m[Ag. Cl]·n. Ag+·n. No 3 -}0
 Примеры - при смешивании морской и речной воды образуются дельты рек - для очистки питьевой воды добавляют соли Аl 3+ или Fе 3+ {m[Fe(OH)3]·n. Fe. O+·(n-x)Cl-}x+·x. Cl -
Примеры - при смешивании морской и речной воды образуются дельты рек - для очистки питьевой воды добавляют соли Аl 3+ или Fе 3+ {m[Fe(OH)3]·n. Fe. O+·(n-x)Cl-}x+·x. Cl -
 Роль коагуляции в организме Под влиянием ионов Са 2+ кровь коагулирует, свертывается => к min потерям при ранениях, операциях. При консервации крови Са 2+ удаляют трилоном Б или цитратом Nа. Цитратная кровь хранится 30 суток. - При ↓ свертываемости крови применяют витамин К (викасол). - При ↑ свертываемости появляются тромбы. Антикоагулянт – гепарин у здоровых людей вырабатывается в печени. Действие лекарств – антикоагулянтов при тромбозе основано на явлении пептизации, при этом тромб => в золь.
Роль коагуляции в организме Под влиянием ионов Са 2+ кровь коагулирует, свертывается => к min потерям при ранениях, операциях. При консервации крови Са 2+ удаляют трилоном Б или цитратом Nа. Цитратная кровь хранится 30 суток. - При ↓ свертываемости крови применяют витамин К (викасол). - При ↑ свертываемости появляются тромбы. Антикоагулянт – гепарин у здоровых людей вырабатывается в печени. Действие лекарств – антикоагулянтов при тромбозе основано на явлении пептизации, при этом тромб => в золь.
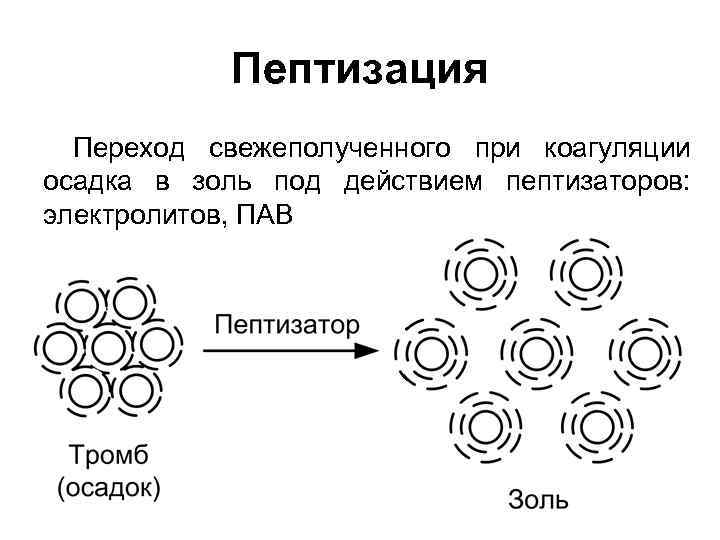 Пептизация Переход свежеполученного при коагуляции осадка в золь под действием пептизаторов: электролитов, ПАВ
Пептизация Переход свежеполученного при коагуляции осадка в золь под действием пептизаторов: электролитов, ПАВ
 Коллоидная защита коллоидного раствора от коагуляции при помощи ВМС. Защитными свойствами обладают: белки (желатин, альбумины, казеин), полисахариды (крахмал), ПАВ. Механизм коллоидной защиты На поверхности частиц ДФ адсорбируются молекулы ВМС и Н 20 (гидратная оболочка), которые препятствуют слипанию.
Коллоидная защита коллоидного раствора от коагуляции при помощи ВМС. Защитными свойствами обладают: белки (желатин, альбумины, казеин), полисахариды (крахмал), ПАВ. Механизм коллоидной защиты На поверхности частиц ДФ адсорбируются молекулы ВМС и Н 20 (гидратная оболочка), которые препятствуют слипанию.
 Мера защитного действия –“золотое” число – min количество сухого ВМС, которое надо добавить к 10 мл золя Аu, чтобы предотвратить его коагуляцию при введении в систему 1 мл 10% Na. Cl. Аналогично – “рубиновое”, “железное”, “серебряное” и др. “Золотое” число спинно-мозговой жидкости используется для диагностики менингита.
Мера защитного действия –“золотое” число – min количество сухого ВМС, которое надо добавить к 10 мл золя Аu, чтобы предотвратить его коагуляцию при введении в систему 1 мл 10% Na. Cl. Аналогично – “рубиновое”, “железное”, “серебряное” и др. “Золотое” число спинно-мозговой жидкости используется для диагностики менингита.
 Биороль коллоидной защиты - Белки крови защищают холестерин, карбонаты, фосфаты Са, ураты от коагуляции. - При ↓ защитной функции белков => атеросклероз, кальциноз, подагра. - Белки удерживают О 2, СО 2 в растворенном состоянии - В фармакологии: колларгол (70%) , протаргол (8%) – коллоидные растворы Аg, защищенные белками. - В пищевой промышленности: маргарин, майонез, мороженое стабилизированы яичным белком, желатином. - Белок казеин защищает Са 2+ в молоке.
Биороль коллоидной защиты - Белки крови защищают холестерин, карбонаты, фосфаты Са, ураты от коагуляции. - При ↓ защитной функции белков => атеросклероз, кальциноз, подагра. - Белки удерживают О 2, СО 2 в растворенном состоянии - В фармакологии: колларгол (70%) , протаргол (8%) – коллоидные растворы Аg, защищенные белками. - В пищевой промышленности: маргарин, майонез, мороженое стабилизированы яичным белком, желатином. - Белок казеин защищает Са 2+ в молоке.


