СемОбщХим15-34.ppt
- Количество слайдов: 20
 Строение кислотных гидроксидов Э(ОН)n – m H 2 O Э(ОН)x. Oy x = n – 2 m = 1 3 Для некоторых элементов, образующих кислотные гидроксиды, возможно при одной и той же степени окисления образование гидроксидов с различным содержанием групп ОН +5 +5 Например: Н 3 РО 4 и НРО 3 или Р(ОН)3 О и Р(ОН)О 2 Н О Н О Р О О max число - ОН групп: орто кислота min число - ОН групп: мета кислота О Следует помнить, что все кислотные гидроксиды являются кислотами, но не все кислоты - гидроксиды К классу кислот относятся водные растворы элементводородных соединений: HCl, HBr, HCN и другие…
Строение кислотных гидроксидов Э(ОН)n – m H 2 O Э(ОН)x. Oy x = n – 2 m = 1 3 Для некоторых элементов, образующих кислотные гидроксиды, возможно при одной и той же степени окисления образование гидроксидов с различным содержанием групп ОН +5 +5 Например: Н 3 РО 4 и НРО 3 или Р(ОН)3 О и Р(ОН)О 2 Н О Н О Р О О max число - ОН групп: орто кислота min число - ОН групп: мета кислота О Следует помнить, что все кислотные гидроксиды являются кислотами, но не все кислоты - гидроксиды К классу кислот относятся водные растворы элементводородных соединений: HCl, HBr, HCN и другие…
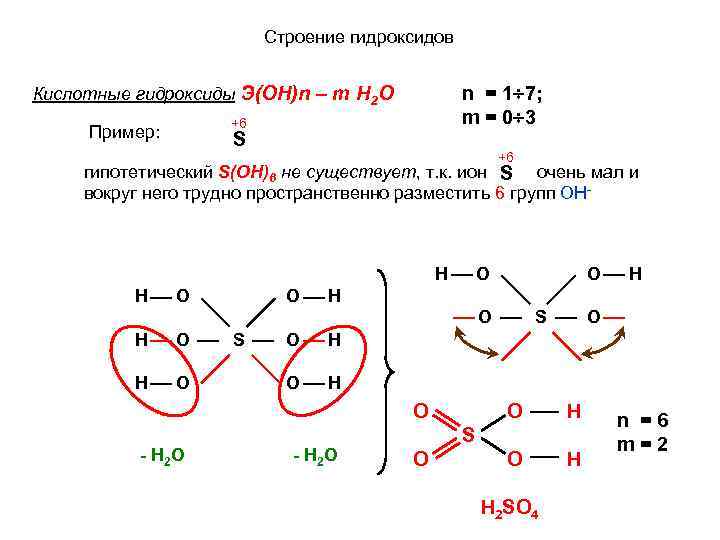 Строение гидроксидов n = 1 7; m = 0 3 Кислотные гидроксиды Э(ОН)n – m H 2 O Пример: +6 S +6 гипотетический S(ОН)6 не существует, т. к. ион S очень мал и вокруг него трудно пространственно разместить 6 групп ОН H O O H O S O H O S O H H O O H O - H 2 O O H S O Н 2 SO 4 n =6 m=2
Строение гидроксидов n = 1 7; m = 0 3 Кислотные гидроксиды Э(ОН)n – m H 2 O Пример: +6 S +6 гипотетический S(ОН)6 не существует, т. к. ион S очень мал и вокруг него трудно пространственно разместить 6 групп ОН H O O H O S O H O S O H H O O H O - H 2 O O H S O Н 2 SO 4 n =6 m=2
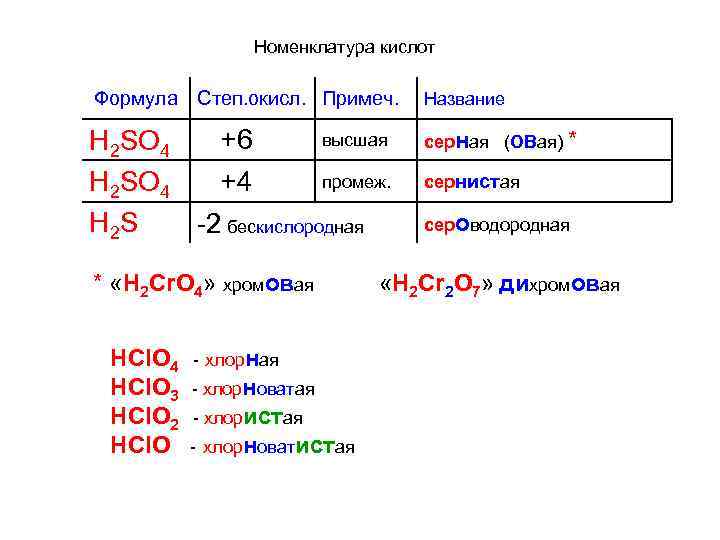 Номенклатура кислот Формула Степ. окисл. Примеч. Название высшая +6 H 2 SO 4 промеж. +4 H 2 SO 4 H 2 S 2 бескислородная серная (ОВая) * * «H 2 Cr. O 4» хромовая HCl. O 4 HCl. O 3 HCl. O 2 HCl. O хлорная хлорноватая хлористая хлорноватистая сернистая сероводородная «H 2 Cr 2 O 7» дихромовая
Номенклатура кислот Формула Степ. окисл. Примеч. Название высшая +6 H 2 SO 4 промеж. +4 H 2 SO 4 H 2 S 2 бескислородная серная (ОВая) * * «H 2 Cr. O 4» хромовая HCl. O 4 HCl. O 3 HCl. O 2 HCl. O хлорная хлорноватая хлористая хлорноватистая сернистая сероводородная «H 2 Cr 2 O 7» дихромовая
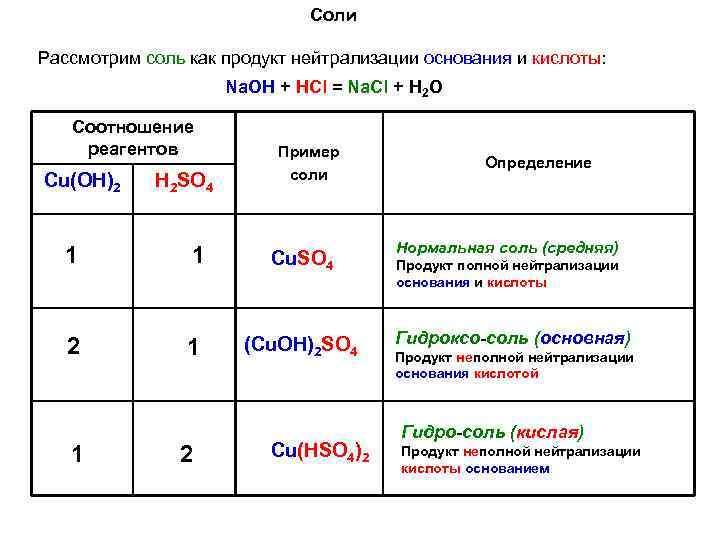 Соли Рассмотрим соль как продукт нейтрализации основания и кислоты: Na. OH + HCl = Na. Cl + H 2 O Соотношение реагентов Cu(OH)2 H 2 SO 4 Пример соли 1 1 Cu. SO 4 2 1 (Cu. ОН)2 SO 4 1 2 Cu(НSO 4)2 Определение Нормальная соль (средняя) Продукт полной нейтрализации основания и кислоты Гидроксо-соль (основная) Продукт неполной нейтрализации основания кислотой Гидро-соль (кислая) Продукт неполной нейтрализации кислоты основанием
Соли Рассмотрим соль как продукт нейтрализации основания и кислоты: Na. OH + HCl = Na. Cl + H 2 O Соотношение реагентов Cu(OH)2 H 2 SO 4 Пример соли 1 1 Cu. SO 4 2 1 (Cu. ОН)2 SO 4 1 2 Cu(НSO 4)2 Определение Нормальная соль (средняя) Продукт полной нейтрализации основания и кислоты Гидроксо-соль (основная) Продукт неполной нейтрализации основания кислотой Гидро-соль (кислая) Продукт неполной нейтрализации кислоты основанием
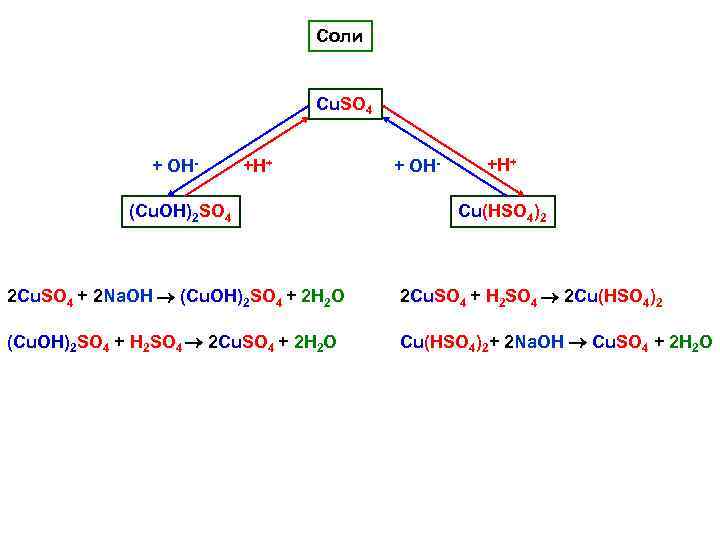 Соли Cu. SO 4 + ОН- +H+ (Cu. ОН)2 SO 4 + ОН- +H+ Cu(НSO 4)2 2 Cu. SO 4 + 2 Na. OH (Cu. ОН)2 SO 4 + 2 H 2 O 2 Cu. SO 4 + Н 2 SO 4 2 Cu(НSO 4)2 (Cu. ОН)2 SO 4 + Н 2 SO 4 2 Cu. SO 4 + 2 H 2 O Cu(НSO 4)2+ 2 Na. OH Cu. SO 4 + 2 H 2 O
Соли Cu. SO 4 + ОН- +H+ (Cu. ОН)2 SO 4 + ОН- +H+ Cu(НSO 4)2 2 Cu. SO 4 + 2 Na. OH (Cu. ОН)2 SO 4 + 2 H 2 O 2 Cu. SO 4 + Н 2 SO 4 2 Cu(НSO 4)2 (Cu. ОН)2 SO 4 + Н 2 SO 4 2 Cu. SO 4 + 2 H 2 O Cu(НSO 4)2+ 2 Na. OH Cu. SO 4 + 2 H 2 O
 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Все химические реакции можно разделить на несколько видов – соединения, замещения, обмена, разложения и т. д. Окислительно восстановительные реакции лежат в основе горения топлив, получения металлов и неметаллов, коррозии металлов, процессов электро лиза, брожения, гниения, фотосинтеза, дыхания, обмена веществ и нервной деятельности живых организмов. Общим признаком этих реакций является изменение степеней окисления элементов, входящих в состав реагирующих веществ. Окислительно-восстановительными реакциями (ОВР) называются реакци в ходе которых изменяются степени окисления элементов, входящих в состав реагирующих веществ.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Все химические реакции можно разделить на несколько видов – соединения, замещения, обмена, разложения и т. д. Окислительно восстановительные реакции лежат в основе горения топлив, получения металлов и неметаллов, коррозии металлов, процессов электро лиза, брожения, гниения, фотосинтеза, дыхания, обмена веществ и нервной деятельности живых организмов. Общим признаком этих реакций является изменение степеней окисления элементов, входящих в состав реагирующих веществ. Окислительно-восстановительными реакциями (ОВР) называются реакци в ходе которых изменяются степени окисления элементов, входящих в состав реагирующих веществ.
 Окислительно восстановительные реакции с изменением степени окисления атомов входящих в состав реагентов, в результате перераспределения электронов Пример окисление восстановитель Al 0 - 3ē = Al+3 2 окислитель S 0 - 2ē = S-2 3 восстановление Законы сохранения: - вещества - зарядов
Окислительно восстановительные реакции с изменением степени окисления атомов входящих в состав реагентов, в результате перераспределения электронов Пример окисление восстановитель Al 0 - 3ē = Al+3 2 окислитель S 0 - 2ē = S-2 3 восстановление Законы сохранения: - вещества - зарядов
 Окислительно-восстановительные реакции (ОВР) В ОВР следует различать два типа реагентов: 1). Окислители это такие вещества (атомы, молекулы, ионы), которые в ОВР принимают электроны (+ n e ) и понижают Ст. Ок. Ox + n e- Red 2). Восстановители это такие вещества (атомы, молекулы, ионы), которые в ОВР отдают электроны ( n e ) и повышают Ст. Ок. Red – n e- Ox
Окислительно-восстановительные реакции (ОВР) В ОВР следует различать два типа реагентов: 1). Окислители это такие вещества (атомы, молекулы, ионы), которые в ОВР принимают электроны (+ n e ) и понижают Ст. Ок. Ox + n e- Red 2). Восстановители это такие вещества (атомы, молекулы, ионы), которые в ОВР отдают электроны ( n e ) и повышают Ст. Ок. Red – n e- Ox
 ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ 1. Простые вещества, образованные атомами элементов с высокой электроотрицательностью F 2 +2 е 2 F Cl 2 +2 е 2 Cl Br 2 +2 е 2 Br I 2 +2 е 2 I O 2 +4 е 2 O 2 (в водных растворах обычно H 2 O или OH ионы) 2. «Высшие» кислородсодержащие кислоты и их соли. а) H 2 SO 4(конц. ) + 2 е SO 2 + 6 е S + 8 е H 2 S б) HNO 3(конц. ) + е NO 2 HNO 3(разб. ) +3 е NO HNO 3(оч. разб. ) +8 е NH 4 К высшим кислородсодержащим кислотам относят кислоты высших степеней окисления элемента.
ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ 1. Простые вещества, образованные атомами элементов с высокой электроотрицательностью F 2 +2 е 2 F Cl 2 +2 е 2 Cl Br 2 +2 е 2 Br I 2 +2 е 2 I O 2 +4 е 2 O 2 (в водных растворах обычно H 2 O или OH ионы) 2. «Высшие» кислородсодержащие кислоты и их соли. а) H 2 SO 4(конц. ) + 2 е SO 2 + 6 е S + 8 е H 2 S б) HNO 3(конц. ) + е NO 2 HNO 3(разб. ) +3 е NO HNO 3(оч. разб. ) +8 е NH 4 К высшим кислородсодержащим кислотам относят кислоты высших степеней окисления элемента.
 ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ в) Mn. O 4 +5 е Mn 2+ (в кислой среде) +3 е Mn. O 2 (в нейтральной или щелочной среде) + е Mn. O 42 (в сильнощелочной среде и недостатке восстановителя) г) Cr 2 O 72 (Cr. O 42 +6 е +3 е ) Cr 3+ (в кислой среде) Cr(OH)3 (в нейтральной среде) Cr. O 2 (в щелочной среде) +2 е Bi 3+ Вi(OH)3 д) Na. Bi. O 3 (в кислой среде) (в щелочной среде) е) Соли галогенкислородных кислот Cl. O , Cl. O 3 , Br. O 3 , IO 4 + n е Cl , Br , I ( в кислых средах возможно образование – Cl 2, Br 2, I 2)
ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ в) Mn. O 4 +5 е Mn 2+ (в кислой среде) +3 е Mn. O 2 (в нейтральной или щелочной среде) + е Mn. O 42 (в сильнощелочной среде и недостатке восстановителя) г) Cr 2 O 72 (Cr. O 42 +6 е +3 е ) Cr 3+ (в кислой среде) Cr(OH)3 (в нейтральной среде) Cr. O 2 (в щелочной среде) +2 е Bi 3+ Вi(OH)3 д) Na. Bi. O 3 (в кислой среде) (в щелочной среде) е) Соли галогенкислородных кислот Cl. O , Cl. O 3 , Br. O 3 , IO 4 + n е Cl , Br , I ( в кислых средах возможно образование – Cl 2, Br 2, I 2)
 ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ 3. Ионы и оксиды металлов, содержащие элементы в высоких степенях окисления. Fe 3+ Bi 3+ Ce 4+ Pb. O 2 + е +3 е + е +2 е Mn. O 2 +2 е Fe 2+ (в кислой среде) Bi 0 Ce 3+ Pb 2+ (в кислой среде) Pb. O 2 (в щелочной среде) Mn 2+ (в кислой среде) 4. Протон кислоты (за исключением H 2 SO 4 конц и HNO 3 любой концентрации) или воды. 2 H+ (H 2 O) + 2 е H 2
ТИПИЧНЫЕ ОКИСЛИТЕЛИ И ПРОДУКТЫ ИХ ВОССТАНОВЛЕНИЯ 3. Ионы и оксиды металлов, содержащие элементы в высоких степенях окисления. Fe 3+ Bi 3+ Ce 4+ Pb. O 2 + е +3 е + е +2 е Mn. O 2 +2 е Fe 2+ (в кислой среде) Bi 0 Ce 3+ Pb 2+ (в кислой среде) Pb. O 2 (в щелочной среде) Mn 2+ (в кислой среде) 4. Протон кислоты (за исключением H 2 SO 4 конц и HNO 3 любой концентрации) или воды. 2 H+ (H 2 O) + 2 е H 2
 ТИПИЧНЫЕ ВОССТАНОВИТЕЛИ И ПРОДУКТЫ ИХ ОКИСЛЕНИЯ 1. Простые вещества, образованные атомами элементов с низкой электроотрицательностью а) Большинство металлов (см. ряд напряжений металлов): Mo n е Мn+ б) Неметаллы H 2 2 е 2 H+ С 2 е CO (углерод проявляет восстановительные свойства при высоких температурах) S 6 е SO 42 (SO 2) 2. «Низшие» кислородные кислоты, их оксиды и соли H 2 SO 3, SO 2, SO 32 SO 42 К низшим кислородсодержащим кислотам относят кислоты элемента в низших положительных степенях окисления.
ТИПИЧНЫЕ ВОССТАНОВИТЕЛИ И ПРОДУКТЫ ИХ ОКИСЛЕНИЯ 1. Простые вещества, образованные атомами элементов с низкой электроотрицательностью а) Большинство металлов (см. ряд напряжений металлов): Mo n е Мn+ б) Неметаллы H 2 2 е 2 H+ С 2 е CO (углерод проявляет восстановительные свойства при высоких температурах) S 6 е SO 42 (SO 2) 2. «Низшие» кислородные кислоты, их оксиды и соли H 2 SO 3, SO 2, SO 32 SO 42 К низшим кислородсодержащим кислотам относят кислоты элемента в низших положительных степенях окисления.
 ТИПИЧНЫЕ ВОССТАНОВИТЕЛИ И ПРОДУКТЫ ИХ ОКИСЛЕНИЯ 3. Ионы металлов в низких степенях окисления. Fe 2+ Sn. O 22 Cu+ е Fe 3+ Fe(OH)3 2 е Sn 4+ или H 2 Sn. O 32 е Cu 2+ (в кислой среде) (в щелочной среде) (в кислой среде) 4. Анионы бескислородных кислот. 2 Cl 2 Br 2 I H 2 S, (S 2 ) 2 е Cl 2 (HClконц с сильными окислителями) 2 е Br 2 2 е I 2 (при избытке сильного окислителя – IO 3 ) 2 е S 8 е SO 42 ) (при избытке окислителя, или в щелочной среде)
ТИПИЧНЫЕ ВОССТАНОВИТЕЛИ И ПРОДУКТЫ ИХ ОКИСЛЕНИЯ 3. Ионы металлов в низких степенях окисления. Fe 2+ Sn. O 22 Cu+ е Fe 3+ Fe(OH)3 2 е Sn 4+ или H 2 Sn. O 32 е Cu 2+ (в кислой среде) (в щелочной среде) (в кислой среде) 4. Анионы бескислородных кислот. 2 Cl 2 Br 2 I H 2 S, (S 2 ) 2 е Cl 2 (HClконц с сильными окислителями) 2 е Br 2 2 е I 2 (при избытке сильного окислителя – IO 3 ) 2 е S 8 е SO 42 ) (при избытке окислителя, или в щелочной среде)
 ВЕЩЕСТВА С ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ ДВОЙСТВЕННОСТЬЮ Ряд веществ, имеющих элементы в промежуточных степенях окисления, могут участвовать в реакции и как окислители и как восстановители. H 2 O 2 + восстановитель H 2 O 2 + окислитель H 2 O или OH O 2 (окислитель должен быть сильным) NO 2 + восстановитель NO NH 3 NO 2 + окислитель NO 3 (в кислой среде) (с активными металлами в щелочной среде) ( в кислой среде) ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ межмолекулярные реакции SO 2 + O 2 SO 3 red ox внутримолекулярные реакции 3 +6 (NH 4)2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O red ox и +6 2 H 2 SO 3 S S 0 + SO 2 + H 2 O ox red
ВЕЩЕСТВА С ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЙ ДВОЙСТВЕННОСТЬЮ Ряд веществ, имеющих элементы в промежуточных степенях окисления, могут участвовать в реакции и как окислители и как восстановители. H 2 O 2 + восстановитель H 2 O 2 + окислитель H 2 O или OH O 2 (окислитель должен быть сильным) NO 2 + восстановитель NO NH 3 NO 2 + окислитель NO 3 (в кислой среде) (с активными металлами в щелочной среде) ( в кислой среде) ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ межмолекулярные реакции SO 2 + O 2 SO 3 red ox внутримолекулярные реакции 3 +6 (NH 4)2 Cr 2 O 7 N 2 + Cr 2 O 3 + 4 H 2 O red ox и +6 2 H 2 SO 3 S S 0 + SO 2 + H 2 O ox red
 ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ реакциями сопропорционирования +5 1 HCl. O 3 + 5 HCl 3 Cl 2 + 3 H 2 O ox red и 3 +5 NH 4 NO 3 N 2 O + 2 H 2 O red ox реакциями диспропорционирования Cl 2 Br 2 I 2 S P Mn. O 42 NO 2 2 H 2 O 2 + щёлочь Cl + Cl. O (на холоду) + щёлочь Cl + Cl. O 3 (при нагревании) + щёлочь Br + Br. O 3 + щёлочь I + IO 3 + щёлочь S 2 + SO 32 (при нагревании) + щёлочь PH 3 + H 2 PO 2 + кислота Mn 2+ + Mn. O 4 + щёлочь NO 2 + NO 3 2 H 2 O + O 2
ТИПЫ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ реакциями сопропорционирования +5 1 HCl. O 3 + 5 HCl 3 Cl 2 + 3 H 2 O ox red и 3 +5 NH 4 NO 3 N 2 O + 2 H 2 O red ox реакциями диспропорционирования Cl 2 Br 2 I 2 S P Mn. O 42 NO 2 2 H 2 O 2 + щёлочь Cl + Cl. O (на холоду) + щёлочь Cl + Cl. O 3 (при нагревании) + щёлочь Br + Br. O 3 + щёлочь I + IO 3 + щёлочь S 2 + SO 32 (при нагревании) + щёлочь PH 3 + H 2 PO 2 + кислота Mn 2+ + Mn. O 4 + щёлочь NO 2 + NO 3 2 H 2 O + O 2
 Метод ионно-электронного баланса Метод применим для ОВР в водных растворах и учитывает существующие в них молекулы и ионы (для сильных, хорошо растворимых электролитов). Также следует иметь ввиду, что «вода» есть всегда! Алгоритм определения стехиометрических коэффициентов 1. Определение элементов (атомы, ионы), степени окисления которых изменяются в ходе реакции. 2. Определение продуктов реакции с учетом возможного изменения степеней окисления и форм нахождения частиц в растворах данного характера (кисл. , щелочн. , нейтральный)
Метод ионно-электронного баланса Метод применим для ОВР в водных растворах и учитывает существующие в них молекулы и ионы (для сильных, хорошо растворимых электролитов). Также следует иметь ввиду, что «вода» есть всегда! Алгоритм определения стехиометрических коэффициентов 1. Определение элементов (атомы, ионы), степени окисления которых изменяются в ходе реакции. 2. Определение продуктов реакции с учетом возможного изменения степеней окисления и форм нахождения частиц в растворах данного характера (кисл. , щелочн. , нейтральный)
 Метод ионно электронного баланса Алгоритм определения стехиометрических коэффициентов 1. Определение элементов (атомы, ионы), степени окисления которых изменяются в ходе реакции. 2. Составление полуреакций а) материальный баланс Н+ , H 2 O «О» + 2 Н+ = H 2 O = «О» + 2 Н+ = «О» ОН-, H 2 O H 2 O «О» = «О» + H 2 O = 2 ОН- = «О» + H 2 O = «О» + 2 Н+ = «О» б) зарядовый баланс 3. Баланс электронов. 4. Сложение полуреакций с учетом всех коэффициентов. 5. Стехиометрические коэффициенты в уравнении реакции. 6. Проверка: баланс атомов кислорода.
Метод ионно электронного баланса Алгоритм определения стехиометрических коэффициентов 1. Определение элементов (атомы, ионы), степени окисления которых изменяются в ходе реакции. 2. Составление полуреакций а) материальный баланс Н+ , H 2 O «О» + 2 Н+ = H 2 O = «О» + 2 Н+ = «О» ОН-, H 2 O H 2 O «О» = «О» + H 2 O = 2 ОН- = «О» + H 2 O = «О» + 2 Н+ = «О» б) зарядовый баланс 3. Баланс электронов. 4. Сложение полуреакций с учетом всех коэффициентов. 5. Стехиометрические коэффициенты в уравнении реакции. 6. Проверка: баланс атомов кислорода.
 Примеры 5. Стехиометрические коэффициенты в уравнении 6. а) материальный электронов. 4. Сложение. Проверка: баланс кислорода. полуреакций с учетом всех 1. Определение элементов (атомы, ионы), коэффициентов. 2. Составление полуреакций атомов 3. Баланс б) зарядовый баланс реакции. степени окисления которых изменяются 40 ходе = 40 «О» в «О» реакции. +6 +4 K 2 Cr 2 O 7 + 3 Na 2 SO 3 + +3 +6 8 HNO 3 = 2 Cr(NO 3)3 + 3 Na 2 SO 4 +2 KNO 3 + 4 H 2 O 1 Cr 2 O 72 - +14 Н+ +6 ē 2 Cr 3+ + 7 H 2 O 3 SO 32 - + H 2 O − 2 ē SO 42 - + 2 Н+ «О» + 2 Н+ = H 2 O = «О» + 2 Н+ Cr 2 O 72 - + 14 H+ + 3 SO 32 - + 3 H 2 O 2 Cr 3+ + 74 H 22 O + 3 SO 42 - + 6 H+ HO 8 H+ +>2 +3 2 KCr. O 2 + 3 Pb 3 O 4 +20 KOH = 2 +6 K 2 Cr. O 4 + +2 K 2 Pb. O 2 9 2 Cr. O 2 - Cr. O 42 - + 2 H 2 O 3 Pb 3 O 4 + 4 ОН- +2 ē 3 Pb. O 22 - + +10 H 2 O 2 H 2 O + 4 ОН- − 3 ē 236 «О» + H 2 O ОН- = = 36 «О» 2 Cr. O 2 - + 8 ОН- + 3 Pb 3 O 4 + 12 ОН- 2 Cr. O 42 - + 4 H 2 O +9 Pb. O 22 - + 6 H 2 O 20 ОН- 10 Н 2 O
Примеры 5. Стехиометрические коэффициенты в уравнении 6. а) материальный электронов. 4. Сложение. Проверка: баланс кислорода. полуреакций с учетом всех 1. Определение элементов (атомы, ионы), коэффициентов. 2. Составление полуреакций атомов 3. Баланс б) зарядовый баланс реакции. степени окисления которых изменяются 40 ходе = 40 «О» в «О» реакции. +6 +4 K 2 Cr 2 O 7 + 3 Na 2 SO 3 + +3 +6 8 HNO 3 = 2 Cr(NO 3)3 + 3 Na 2 SO 4 +2 KNO 3 + 4 H 2 O 1 Cr 2 O 72 - +14 Н+ +6 ē 2 Cr 3+ + 7 H 2 O 3 SO 32 - + H 2 O − 2 ē SO 42 - + 2 Н+ «О» + 2 Н+ = H 2 O = «О» + 2 Н+ Cr 2 O 72 - + 14 H+ + 3 SO 32 - + 3 H 2 O 2 Cr 3+ + 74 H 22 O + 3 SO 42 - + 6 H+ HO 8 H+ +>2 +3 2 KCr. O 2 + 3 Pb 3 O 4 +20 KOH = 2 +6 K 2 Cr. O 4 + +2 K 2 Pb. O 2 9 2 Cr. O 2 - Cr. O 42 - + 2 H 2 O 3 Pb 3 O 4 + 4 ОН- +2 ē 3 Pb. O 22 - + +10 H 2 O 2 H 2 O + 4 ОН- − 3 ē 236 «О» + H 2 O ОН- = = 36 «О» 2 Cr. O 2 - + 8 ОН- + 3 Pb 3 O 4 + 12 ОН- 2 Cr. O 42 - + 4 H 2 O +9 Pb. O 22 - + 6 H 2 O 20 ОН- 10 Н 2 O
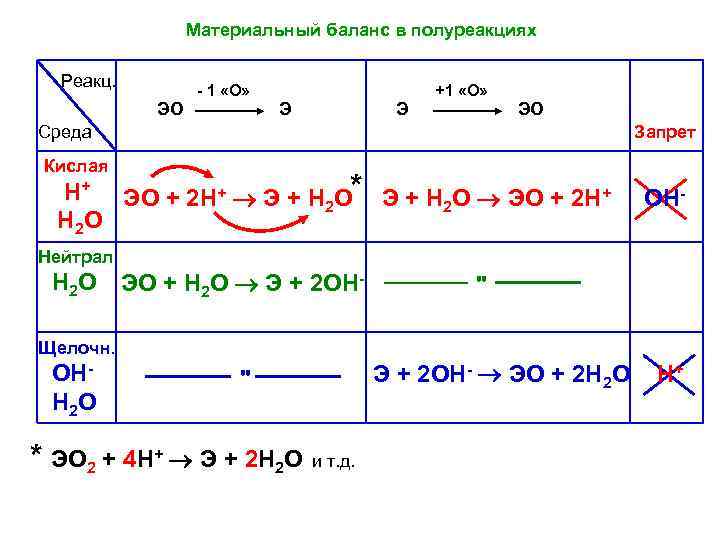 Материальный баланс в полуреакциях Реакц. ЭО - 1 «О» Э Э +1 «О» ЭО Среда Запрет Кислая Н+ ЭО + 2 Н+ Э + Н О* Э + Н О ЭО + 2 Н+ 2 2 Н 2 О Нейтрал Н 2 О Щелочн. ОНН 2 О ЭО + Н 2 О Э + 2 ОН- " * ЭО 2 + 4 Н+ Э + 2 Н 2 О и т. д. ОН- " Э + 2 ОН- ЭО + 2 Н 2 О Н+
Материальный баланс в полуреакциях Реакц. ЭО - 1 «О» Э Э +1 «О» ЭО Среда Запрет Кислая Н+ ЭО + 2 Н+ Э + Н О* Э + Н О ЭО + 2 Н+ 2 2 Н 2 О Нейтрал Н 2 О Щелочн. ОНН 2 О ЭО + Н 2 О Э + 2 ОН- " * ЭО 2 + 4 Н+ Э + 2 Н 2 О и т. д. ОН- " Э + 2 ОН- ЭО + 2 Н 2 О Н+
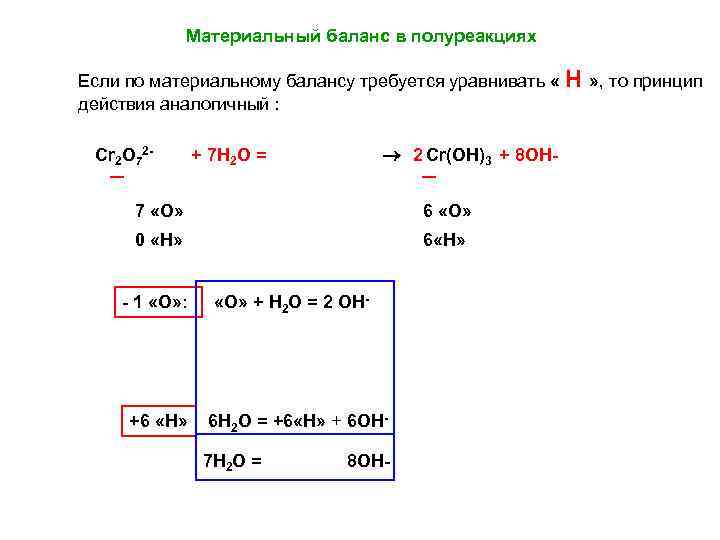 Материальный баланс в полуреакциях Если по материальному балансу требуется уравнивать « Н » , то принцип действия аналогичный : Cr 2 O 72 - 2 Cr(OH)3 + 8 ОН- + 7 H 2 O = 7 «О» 6 «О» 0 «H» 6 «H» - 1 «О» : +6 «H» «О» + H 2 O = 2 ОН- 6 H 2 O = +6 «H» + 6 ОН 7 H 2 O = 8 ОН-
Материальный баланс в полуреакциях Если по материальному балансу требуется уравнивать « Н » , то принцип действия аналогичный : Cr 2 O 72 - 2 Cr(OH)3 + 8 ОН- + 7 H 2 O = 7 «О» 6 «О» 0 «H» 6 «H» - 1 «О» : +6 «H» «О» + H 2 O = 2 ОН- 6 H 2 O = +6 «H» + 6 ОН 7 H 2 O = 8 ОН-


