2.3 Строение электронных оболочек атомов.pptx
- Количество слайдов: 15

«Строение электронных оболочек атомов химических элементов»

Запомните! • Электроны, расположенные на последней электронной оболочке, называются внешними • Число внешних электронов для химических элементов главных подгрупп равно номеру группы , в которой находится элемент
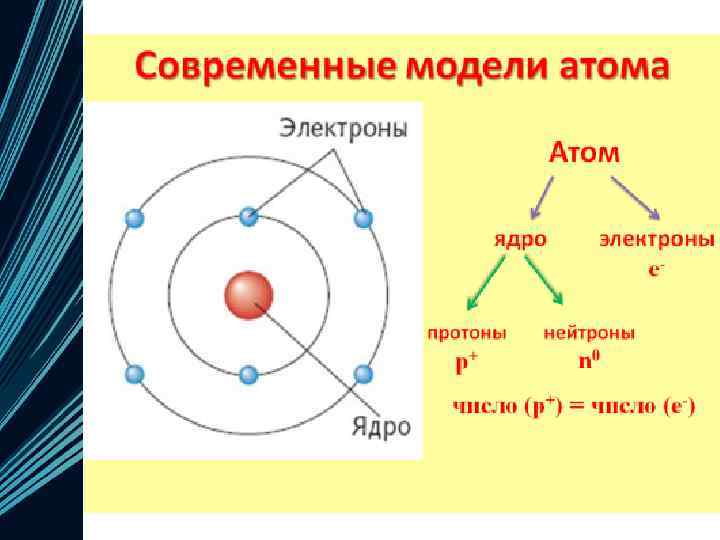

Электронная оболочка • Совокупность всех электронов в атоме, окружающих ядро Каждый электрон имеет свою траекторию движения и запас энергии Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем он прочнее с ним связан, его труднее вырвать из электронной оболочки По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее

Форма электронных облаков (орбиталей) Орбиталь– это область наиболее вероятного местонахождения электрона в пространстве
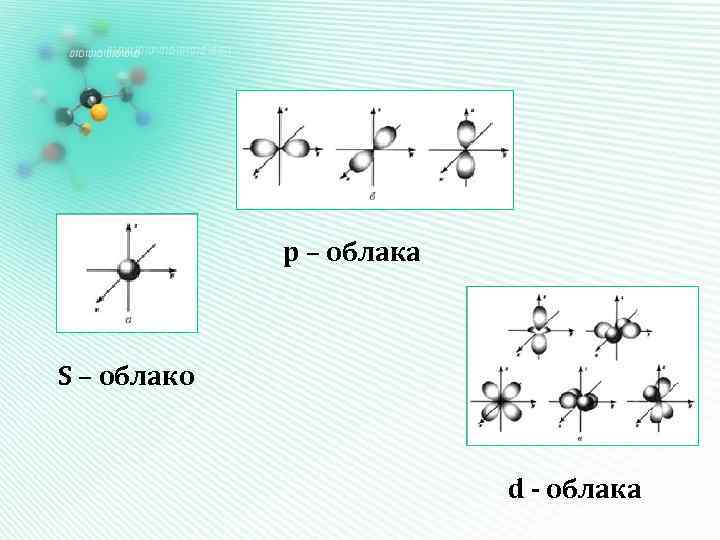
р – облака S – облако d - облака

s-элементы – I - II A группы p-элементы – III – VIII А группы d-элементы – I-VIII B группы f-элементы – La и Ac

Алгоритм составления электронных формул • Записываем знак химического элемента и заряд ядра его атома – он равен порядковому номеру элемента. • Определяем количество энергетических уровней (оно равно номеру периода) и количество электронов на каждом уровне. • Составляем электронную схему и
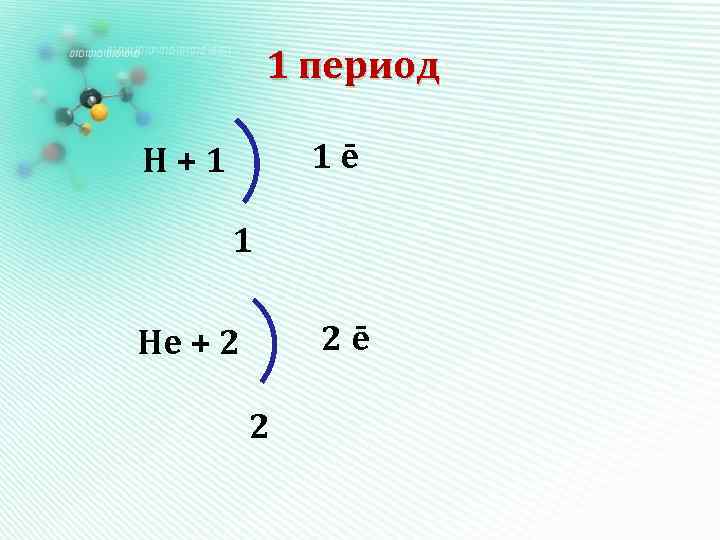
1 период 1ē Н+1 1 2ē Нe + 2 2
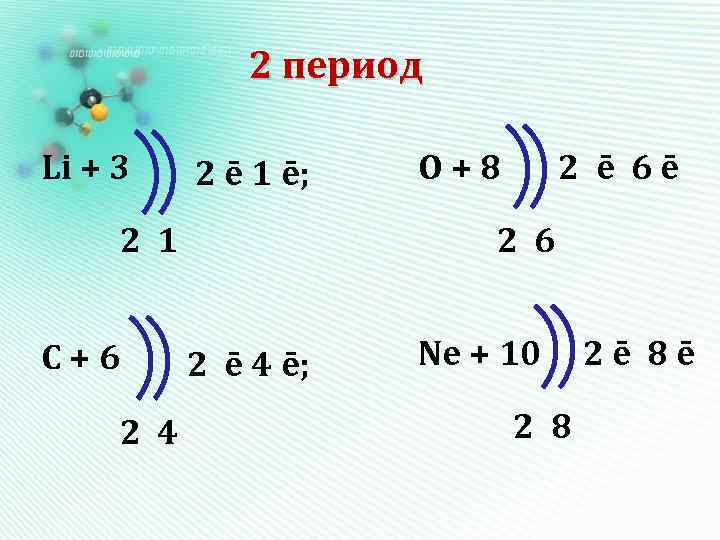
2 период Li + 3 2 ē 1 ē; 2 1 С+6 2 4 O+8 2 ē 6ē 2 6 2 ē 4 ē; Ne + 10 2 8 2ē 8ē
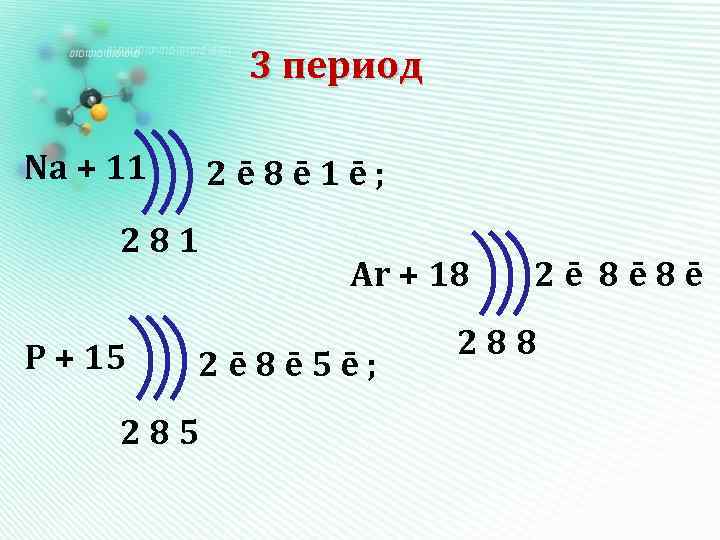
3 период Na + 11 2ē 8ē 1ē; 281 P + 15 Ar + 18 2ē 8ē 5ē; 285 2ē 8ē 8ē 288
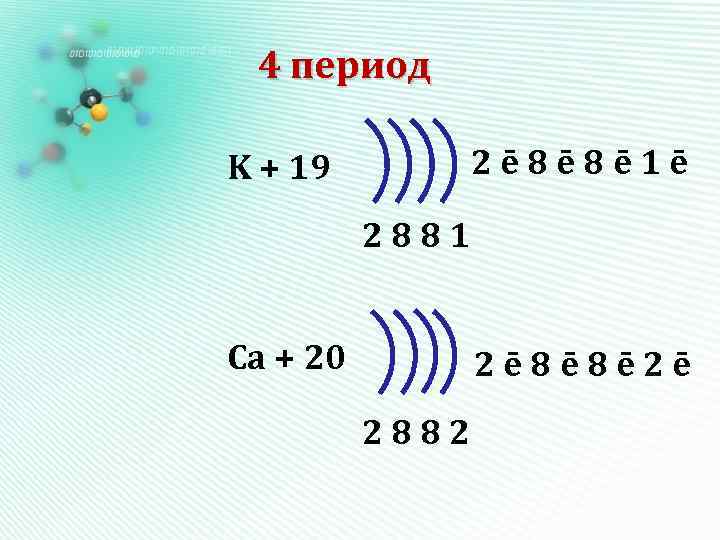
4 период 2ē 8ē 8ē 1ē K + 19 2881 Ca + 20 2ē 8ē 8ē 2ē 2882

Игра «Крестики- нолики» выигрышный путь составляют : а) элементы одного периода 2ē 2ē 2ē 1ē 2ē 8ē 1ē 2ē 4ē 2ē 8ē 2ē 2ē 6ē 2ē 7ē 2ē 5ē 2ē
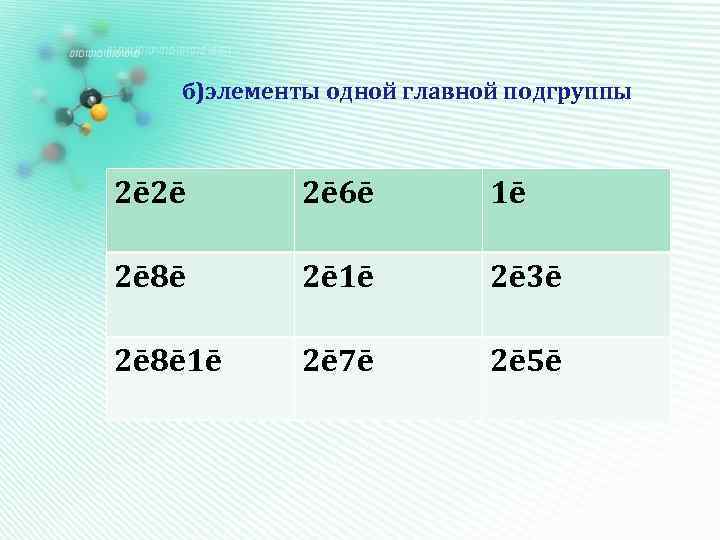
б)элементы одной главной подгруппы 2ē 2ē 2ē 6ē 1ē 2ē 8ē 2ē 1ē 2ē 3ē 2ē 8ē 1ē 2ē 7ē 2ē 5ē
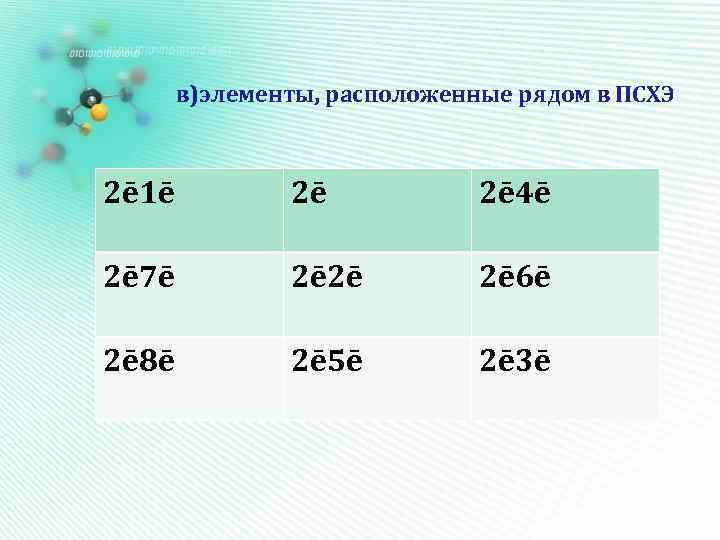
в)элементы, расположенные рядом в ПСХЭ 2ē 1ē 2ē 2ē 4ē 2ē 7ē 2ē 2ē 2ē 6ē 2ē 8ē 2ē 5ē 2ē 3ē
2.3 Строение электронных оболочек атомов.pptx