 Строение атома
Строение атома
 Сложная структура атомов l l М. Фарадей – электролиз - элементарный электрический заряд открытие линейчатых спектров атомов А. Беккерель явление радиоактивности Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе
Сложная структура атомов l l М. Фарадей – электролиз - элементарный электрический заряд открытие линейчатых спектров атомов А. Беккерель явление радиоактивности Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе
 Модель атома Томсона l l Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри и на поверхности шара находятся электроны. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю. Электроны могут совершать колебательные движения около своего положения равновесия. Томсон (Thomson) Джозеф Джон (18. XII. 1856– 30. VIII. 1940)
Модель атома Томсона l l Атом – шар, по всему объёму которого равномерно распределён положительный заряд. Внутри и на поверхности шара находятся электроны. Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю. Электроны могут совершать колебательные движения около своего положения равновесия. Томсон (Thomson) Джозеф Джон (18. XII. 1856– 30. VIII. 1940)
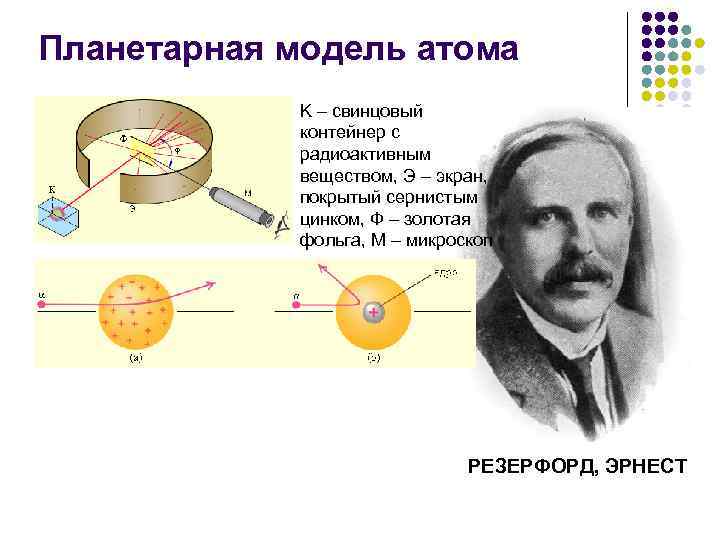 Планетарная модель атома K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп РЕЗЕРФОРД, ЭРНЕСТ
Планетарная модель атома K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп РЕЗЕРФОРД, ЭРНЕСТ
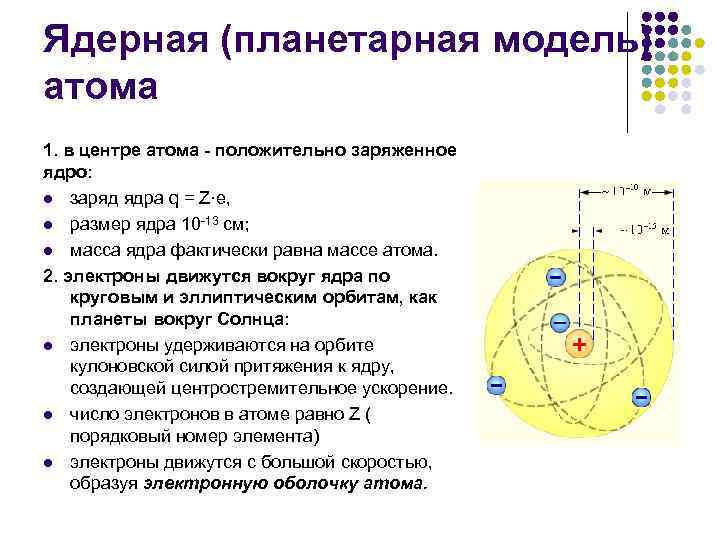 Ядерная (планетарная модель) атома 1. в центре атома - положительно заряженное ядро: l заряд ядра q = Z·e, l размер ядра 10 -13 см; l масса ядра фактически равна массе атома. 2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца: l электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение. l число электронов в атоме равно Z ( порядковый номер элемента) l электроны движутся с большой скоростью, образуя электронную оболочку атома.
Ядерная (планетарная модель) атома 1. в центре атома - положительно заряженное ядро: l заряд ядра q = Z·e, l размер ядра 10 -13 см; l масса ядра фактически равна массе атома. 2. электроны движутся вокруг ядра по круговым и эллиптическим орбитам, как планеты вокруг Солнца: l электроны удерживаются на орбите кулоновской силой притяжения к ядру, создающей центростремительное ускорение. l число электронов в атоме равно Z ( порядковый номер элемента) l электроны движутся с большой скоростью, образуя электронную оболочку атома.
 Атом водорода по Бору Первый постулат Бора (постулат стационарных состояний) : атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает Правило квантования орбит Бора утверждает: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию (n = 1, 2, 3, …). БОР, НИЛЬС ХЕНРИК ДАВИД датский физик, (1922 - Нобелевская премия по физике,
Атом водорода по Бору Первый постулат Бора (постулат стационарных состояний) : атомная система может находиться только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает Правило квантования орбит Бора утверждает: в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь квантованные значения момента импульса, удовлетворяющие условию (n = 1, 2, 3, …). БОР, НИЛЬС ХЕНРИК ДАВИД датский физик, (1922 - Нобелевская премия по физике,
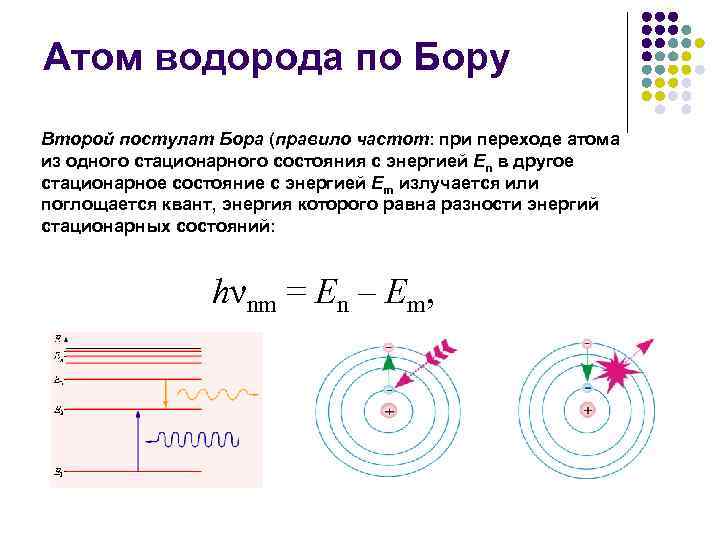 Атом водорода по Бору Второй постулат Бора (правило частот: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний: hνnm = En – Em,
Атом водорода по Бору Второй постулат Бора (правило частот: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна разности энергий стационарных состояний: hνnm = En – Em,
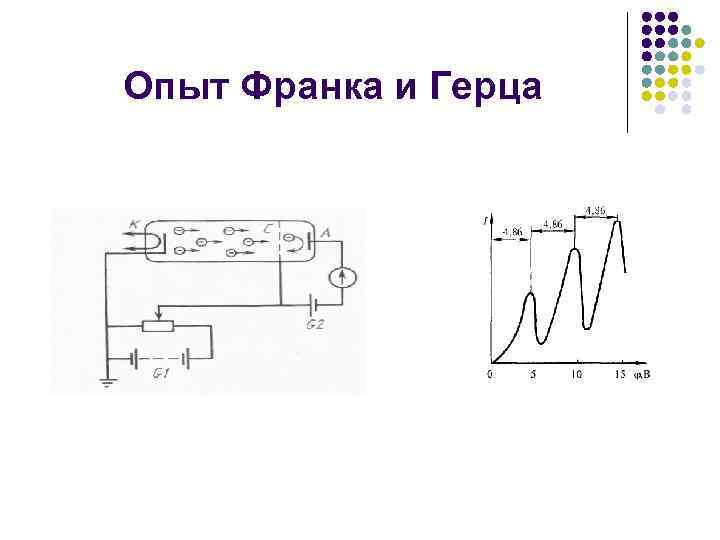 Опыт Франка и Герца
Опыт Франка и Герца
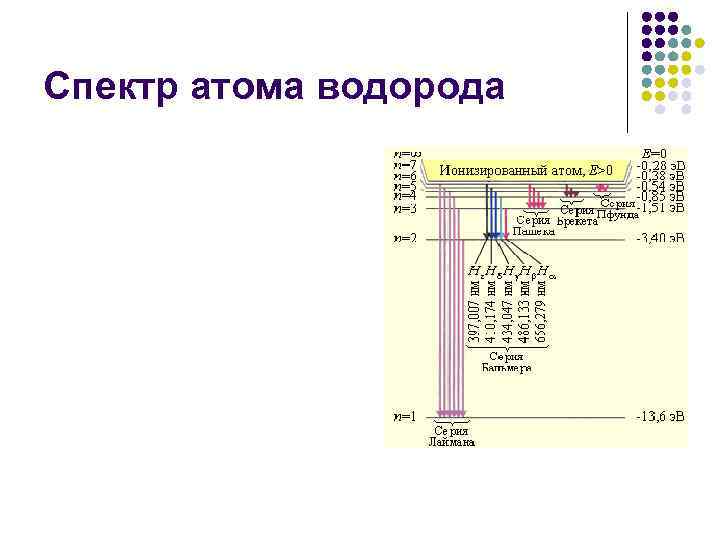 Спектр атома водорода
Спектр атома водорода