Лекция 13 - атом Бора и квант теор.pptx
- Количество слайдов: 48
 Строение атома
Строение атома
 Первая попытка создания модели атома принадлежит Дж. Томсону (1903 г. ). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 1010 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся 2
Первая попытка создания модели атома принадлежит Дж. Томсону (1903 г. ). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 1010 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся 2
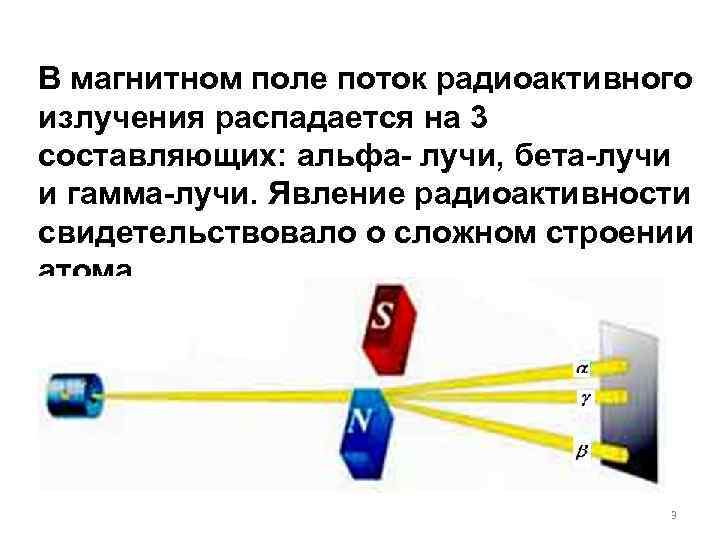 В магнитном поле поток радиоактивного излучения распадается на 3 составляющих: альфа- лучи, бета-лучи и гамма-лучи. Явление радиоактивности свидетельствовало о сложном строении атома. 3
В магнитном поле поток радиоактивного излучения распадается на 3 составляющих: альфа- лучи, бета-лучи и гамма-лучи. Явление радиоактивности свидетельствовало о сложном строении атома. 3
 Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909– 1911 годах. Резерфорд предложил применить зондирование атома с помощью αчастиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. 4
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909– 1911 годах. Резерфорд предложил применить зондирование атома с помощью αчастиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. 4
 Эрне ст Ре зерфорд (Ernest Rutherford; 1871 - 1937, Спринг Грув ) — британский физик и новозеландского происхождения. Создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 г. Открыл альфа- и бета-излучение и множество изотопов. Открыл и объяснил радиоактивное превращение химических элементов, создал теорию радиоактивного распада, Доказал, что расщепил атом азота, обнаружил протон. альфа-частица — ядро гелия. Первым открыл образование новых химических элементов при распаде тяжелых химических радиоактивных элементов. Уточнил на 30 % отношение заряда к массе электрона. 12 учеников Резерфорда стали лауреатами Нобелевской премии по физике и химии. 5
Эрне ст Ре зерфорд (Ernest Rutherford; 1871 - 1937, Спринг Грув ) — британский физик и новозеландского происхождения. Создал планетарную модель атома. Лауреат Нобелевской премии по химии 1908 г. Открыл альфа- и бета-излучение и множество изотопов. Открыл и объяснил радиоактивное превращение химических элементов, создал теорию радиоактивного распада, Доказал, что расщепил атом азота, обнаружил протон. альфа-частица — ядро гелия. Первым открыл образование новых химических элементов при распаде тяжелых химических радиоактивных элементов. Уточнил на 30 % отношение заряда к массе электрона. 12 учеников Резерфорда стали лауреатами Нобелевской премии по физике и химии. 5
 Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 Мэ. В (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это 6
Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 Мэ. В (скорость таких частиц очень велика – порядка 107 м/с, но она все же значительно меньше скорости света). α-частицы – это 6
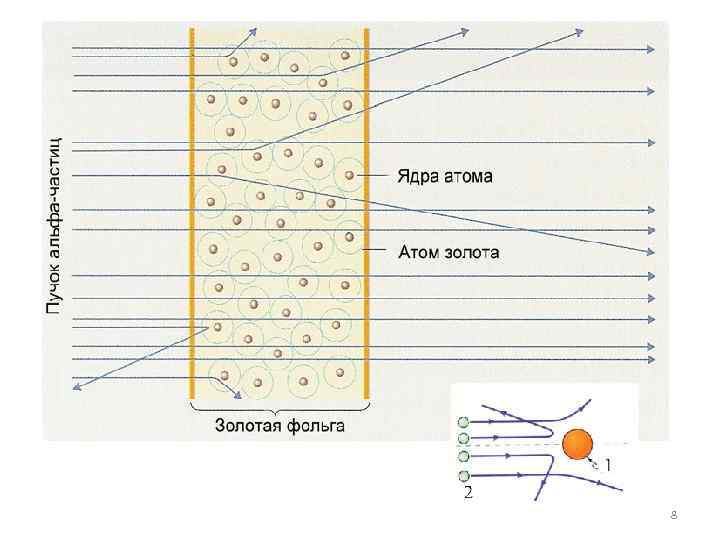
 Пучок aльфа-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Некоторые альфа-частицы проходили сквозь фольгу, образуя на экране размытое пятно, а следы от других альфа-частиц были зафиксированы на боковых 7
Пучок aльфа-частиц пропускался через тонкую золотую фольгу. Золото было выбрано как очень пластичный материал, из которого можно получить фольгу толщиной практически в один атомный слой. Некоторые альфа-частицы проходили сквозь фольгу, образуя на экране размытое пятно, а следы от других альфа-частиц были зафиксированы на боковых 7
 8
8
 Опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10– 14– 10– 15 м. Это ядро занимает только 10– 12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Веществу, составляющему ядро атома, следовало приписать плотность порядка ρ ≈ 1015 г/см 3. Заряд ядра должен быть равен суммарному заряду всех электронов, 9
Опыты Резерфорда и его сотрудников привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10– 14– 10– 15 м. Это ядро занимает только 10– 12 часть полного объема атома, но содержит весь положительный заряд и не менее 99, 95 % его массы. Веществу, составляющему ядро атома, следовало приписать плотность порядка ρ ≈ 1015 г/см 3. Заряд ядра должен быть равен суммарному заряду всех электронов, 9
 Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. 10
Опираясь на классические представления о движении микрочастиц, Резерфорд предложил планетарную модель атома. 10
 Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году датский физик Н. Бор. Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не 11
Следующий шаг в развитии представлений об устройстве атома сделал в 1913 году датский физик Н. Бор. Первый постулат Бора (постулат стационарных состояний) гласит: атомная система может находится только в особых стационарных или квантовых состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не 11
 Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна h – разности энергий постоянная стационарных состояний: Планка, равная 6. 626 10 -34 Дж с 12
Второй постулат Бора (правило частот) формулируется следующим образом: при переходе атома из одного стационарного состояния с энергией En в другое стационарное состояние с энергией Em излучается или поглощается квант, энергия которого равна h – разности энергий постоянная стационарных состояний: Планка, равная 6. 626 10 -34 Дж с 12
 Третий постулат (Правило квантования). Бор предположил, что из всех возможных орбит электрона осуществляются только те для которых момент импульса равен целому кратному постоянной планка h, деленной на 2π: Число n – называется квантовым числом. главным 13
Третий постулат (Правило квантования). Бор предположил, что из всех возможных орбит электрона осуществляются только те для которых момент импульса равен целому кратному постоянной планка h, деленной на 2π: Число n – называется квантовым числом. главным 13
 n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 14
n принимает значения от 1 до ∞. Чем меньше n, тем больше энергия взаимодействия электрона с ядром. При n = 1 атом водорода находится в основном состоянии, при n > 1 – в возбужденном. В многоэлектронных атомах электроны с одинаковыми значениями n образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 14
 Нильс Хе нрик Дави д Бор (Niels Henrik David Bohr 1885 - 1962 , Копенгаген) — датский физик-теоретик и общественный деятель, один из создателей современной физики. Лауреат нобелевской премии по физике (1922) Бор известен как создатель активный участник разработки основ квантовой первой квантовой теории механики. Также он внёс значительный вклад в атома и развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой. 15
Нильс Хе нрик Дави д Бор (Niels Henrik David Bohr 1885 - 1962 , Копенгаген) — датский физик-теоретик и общественный деятель, один из создателей современной физики. Лауреат нобелевской премии по физике (1922) Бор известен как создатель активный участник разработки основ квантовой первой квантовой теории механики. Также он внёс значительный вклад в атома и развитие теории атомного ядра и ядерных реакций, процессов взаимодействия элементарных частиц со средой. 15
 Применим полуклассический подход Бора к описанию движения электрона в поле ядра с зарядом Ze. При Z=1 такая система соответствует атому водорода. Произведение массы электрона на его центростремительное ускорение должно равняться силе Кулона, действующей на электрон: 16
Применим полуклассический подход Бора к описанию движения электрона в поле ядра с зарядом Ze. При Z=1 такая система соответствует атому водорода. Произведение массы электрона на его центростремительное ускорение должно равняться силе Кулона, действующей на электрон: 16
 Радиус может принимать только дискретные значения. Внутренняя энергия атома складывается из энергии взаимодействия электрона с ядром и кинетической электрона: Кинетическую энергию находим следующим образом: 17
Радиус может принимать только дискретные значения. Внутренняя энергия атома складывается из энергии взаимодействия электрона с ядром и кинетической электрона: Кинетическую энергию находим следующим образом: 17
 Тогда внутренняя энергия атома Окончательно 18
Тогда внутренняя энергия атома Окончательно 18
 При переходе атома водорода (Z=1) из состояния n в состояние m излучается квант Частота испущенного свет равна: 19
При переходе атома водорода (Z=1) из состояния n в состояние m излучается квант Частота испущенного свет равна: 19
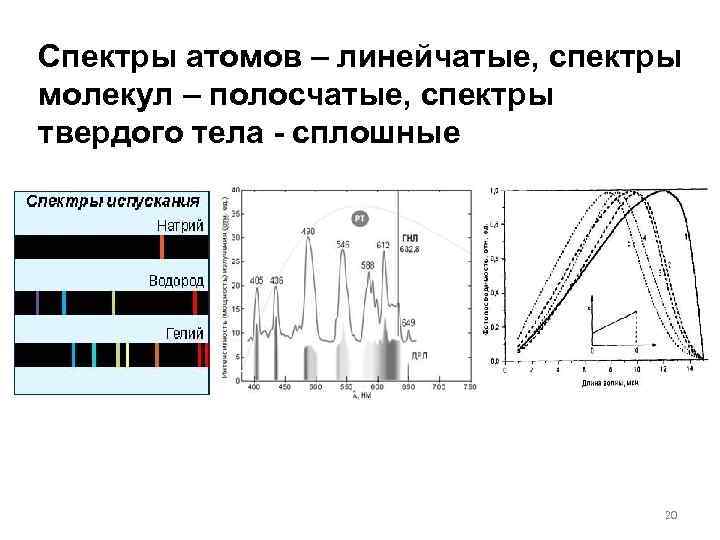 Спектры атомов – линейчатые, спектры молекул – полосчатые, спектры твердого тела - сплошные 20
Спектры атомов – линейчатые, спектры молекул – полосчатые, спектры твердого тела - сплошные 20
 Элементы квантовой теории
Элементы квантовой теории
 В 1923 году французский физик Л. де Бройль выдвинул гипотезу об универсальности корпускулярно-волнового дуализма: не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также и волновыми свойствами. Согласно де Бройлю, с каждым микрообъектом связаны, с одной стороны, корпускулярные характеристики – энергия E и импульс p, а с другой стороны, 22
В 1923 году французский физик Л. де Бройль выдвинул гипотезу об универсальности корпускулярно-волнового дуализма: не только фотоны, но и электроны и любые другие частицы материи наряду с корпускулярными обладают также и волновыми свойствами. Согласно де Бройлю, с каждым микрообъектом связаны, с одной стороны, корпускулярные характеристики – энергия E и импульс p, а с другой стороны, 22
 Луи де Бройль ( 1892 -1987) — французский физик-теоретик, один из основоположников квантовой механики, лауреат Нобелевской премии по физике за 1929 год. Ему принадлежит гипотеза о свойствах материальных частиц, положившая волновых начало развитию волновой механики. Он предложил оригинальную интерпретацию квантовой механики, развивал релятивистскую теорию частиц, занимался вопросами радиофизики, классической и квантовой теориями поля, и других разделов физики.
Луи де Бройль ( 1892 -1987) — французский физик-теоретик, один из основоположников квантовой механики, лауреат Нобелевской премии по физике за 1929 год. Ему принадлежит гипотеза о свойствах материальных частиц, положившая волновых начало развитию волновой механики. Он предложил оригинальную интерпретацию квантовой механики, развивал релятивистскую теорию частиц, занимался вопросами радиофизики, классической и квантовой теориями поля, и других разделов физики.
 Корпускулярные и волновые характеристики микрообъектов связаны такими же количественными соотношениями, как и у фотона: 24
Корпускулярные и волновые характеристики микрообъектов связаны такими же количественными соотношениями, как и у фотона: 24
 Любой частице, обладающей импульсом, сопоставлялся волновой процесс с длиной волны λ = h / p. Для частиц, имеющих массу, 25
Любой частице, обладающей импульсом, сопоставлялся волновой процесс с длиной волны λ = h / p. Для частиц, имеющих массу, 25
 Электрону, движущемуся со скоростью 1000000 м/с = 106 м/с, соответствует волна де Бройля 10 -9 м Пылинке массой 1 мг = 10 -6 кг, движущейся со скоростью 1 м/с. соответствует волна де Бройля 10 -28 м
Электрону, движущемуся со скоростью 1000000 м/с = 106 м/с, соответствует волна де Бройля 10 -9 м Пылинке массой 1 мг = 10 -6 кг, движущейся со скоростью 1 м/с. соответствует волна де Бройля 10 -28 м
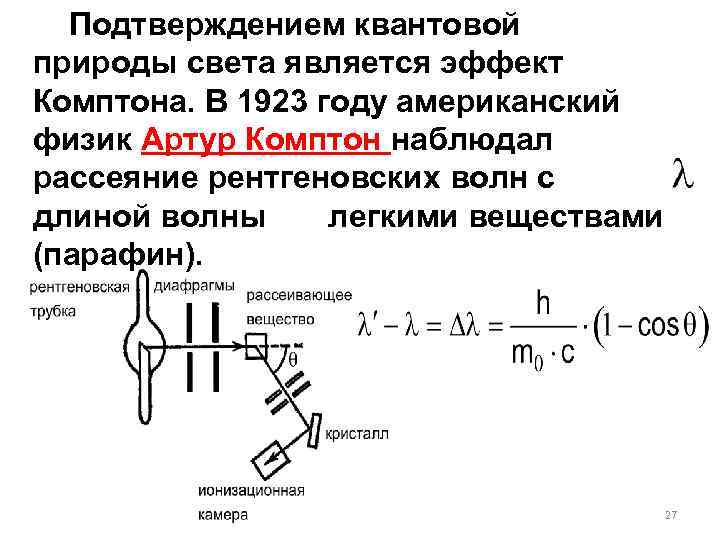 Подтверждением квантовой природы света является эффект Комптона. В 1923 году американский физик Артур Комптон наблюдал рассеяние рентгеновских волн с длиной волны легкими веществами (парафин). 27
Подтверждением квантовой природы света является эффект Комптона. В 1923 году американский физик Артур Комптон наблюдал рассеяние рентгеновских волн с длиной волны легкими веществами (парафин). 27
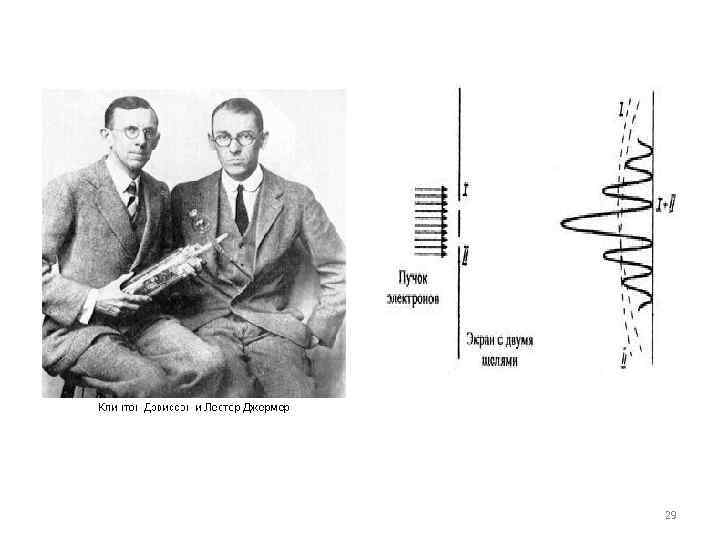
 Первое экспериментальное подтверждение гипотезы де Бройля было получено в 1927 году американскими физиками К. Девиссоном и Л. Джермером. Они обнаружили, что пучок электронов, рассеивающийся на кристалле никеля, дает отчетливую дифракционную картину, подобную той, которая возникает при рассеянии на кристалле коротковолнового рентгеновского излучения. В этих экспериментах кристалл играл роль естественной дифракционной решетки. По положению дифракционных максимумов была определена длина волны электронного 28
Первое экспериментальное подтверждение гипотезы де Бройля было получено в 1927 году американскими физиками К. Девиссоном и Л. Джермером. Они обнаружили, что пучок электронов, рассеивающийся на кристалле никеля, дает отчетливую дифракционную картину, подобную той, которая возникает при рассеянии на кристалле коротковолнового рентгеновского излучения. В этих экспериментах кристалл играл роль естественной дифракционной решетки. По положению дифракционных максимумов была определена длина волны электронного 28
 29
29
 В 1928 году английский физик Дж. Томсон получил новое подтверждение гипотезы де Бройля. Томсон наблюдал дифракционную картину, возникающую при прохождении пучка электронов через тонкую поликристаллическую фольгу из золота. На фотопластинке отчетливо наблюдались концентрические светлые и темные кольца, радиусы которых изменялись с изменением скорости 30
В 1928 году английский физик Дж. Томсон получил новое подтверждение гипотезы де Бройля. Томсон наблюдал дифракционную картину, возникающую при прохождении пучка электронов через тонкую поликристаллическую фольгу из золота. На фотопластинке отчетливо наблюдались концентрические светлые и темные кольца, радиусы которых изменялись с изменением скорости 30
 Микрочастица – это образование особого рода: частица+волна. Все это привело к необходимости построения непротиворечивой теории, объясняющей процессы, происходящие в микромире. За короткий период с июня 1925 го года и по июнь 1926 -го года, были опубликованы сразу три оригинальных и независимо сделанных варианта полной квантовой теории. Первая – матричная квантовая механика – Вернером Гейзенбергом (1901 -76). Вторая – волновая механика – Эрвином Шредингером (1887 -1961). Третья – квантовая алгебра – Паулем Дираком (1902 - 1984). 31
Микрочастица – это образование особого рода: частица+волна. Все это привело к необходимости построения непротиворечивой теории, объясняющей процессы, происходящие в микромире. За короткий период с июня 1925 го года и по июнь 1926 -го года, были опубликованы сразу три оригинальных и независимо сделанных варианта полной квантовой теории. Первая – матричная квантовая механика – Вернером Гейзенбергом (1901 -76). Вторая – волновая механика – Эрвином Шредингером (1887 -1961). Третья – квантовая алгебра – Паулем Дираком (1902 - 1984). 31
 Состояние микрочастицы описывается в квантовой механике волновой функцией Ψ. Она является функцией координат и времени и может быть найдена путем решения уравнения: Это уравнение было установлено Шредингером в 1926 г. И называется общим уравнением Шредингера. i – мнимая единица, m – масса частицы, - оператор Лапласа, U – потенциальная 32
Состояние микрочастицы описывается в квантовой механике волновой функцией Ψ. Она является функцией координат и времени и может быть найдена путем решения уравнения: Это уравнение было установлено Шредингером в 1926 г. И называется общим уравнением Шредингера. i – мнимая единица, m – масса частицы, - оператор Лапласа, U – потенциальная 32
 - оператор Лаплас Это соотношение называется уравнением Шредингера для стационарных состояний. 33
- оператор Лаплас Это соотношение называется уравнением Шредингера для стационарных состояний. 33
 Физический смысл Ψ функции состоит в следующем: квадрат модуля Ψ определяет вероятность d. P того, что частица будет обнаружена в пределах объема d. V: Волновые функции должны всегда быть нормированы таким образом, чтобы: 34
Физический смысл Ψ функции состоит в следующем: квадрат модуля Ψ определяет вероятность d. P того, что частица будет обнаружена в пределах объема d. V: Волновые функции должны всегда быть нормированы таким образом, чтобы: 34
 Волновые функции, получаемые из решений уравнения Шредингера должны удовлетворять следующим условиям: 1) однозначность; 2) конечность; 3) непрерывность. Эти условия должны выполняться во всей области изменения переменных x, y, z. Они являются следствием того факта, что волновая функция по своему физическому смыслу 35
Волновые функции, получаемые из решений уравнения Шредингера должны удовлетворять следующим условиям: 1) однозначность; 2) конечность; 3) непрерывность. Эти условия должны выполняться во всей области изменения переменных x, y, z. Они являются следствием того факта, что волновая функция по своему физическому смыслу 35
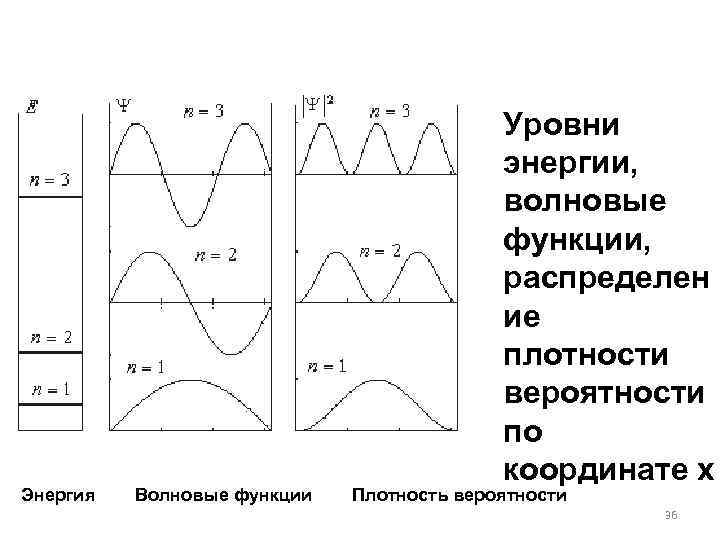 Уровни энергии, волновые функции, распределен ие плотности вероятности по координате х Энергия Волновые функции Плотность вероятности 36
Уровни энергии, волновые функции, распределен ие плотности вероятности по координате х Энергия Волновые функции Плотность вероятности 36
 Соотношения неопределенностей, установлены В. Гейзенбергом. Первое из них ограничивает точности одновременного измерения координат и соответствующих проекций импульса частицы. Для проекции, например на ось Х оно выглядит следующим образом: Второе соотношение устанавливает неопределенность измерения энергии, ΔЕ, за данный промежуток времени Δt: 37
Соотношения неопределенностей, установлены В. Гейзенбергом. Первое из них ограничивает точности одновременного измерения координат и соответствующих проекций импульса частицы. Для проекции, например на ось Х оно выглядит следующим образом: Второе соотношение устанавливает неопределенность измерения энергии, ΔЕ, за данный промежуток времени Δt: 37
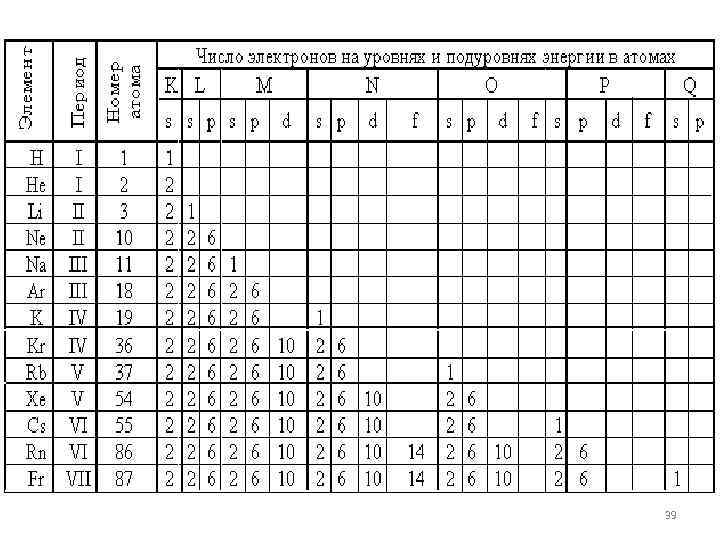
 Многоэлектронные атомы В многоэлектронных атомах электроны с одинаковыми значениями n (n – главное квантовое число)образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 38
Многоэлектронные атомы В многоэлектронных атомах электроны с одинаковыми значениями n (n – главное квантовое число)образуют слой или оболочку, обозначаемый буквами K, L, M, N, O, P и Q. Буква K соответствует первому уровню, L – второму и т. д. 38
 39
39
 Орбитальное (азимутальное) квантовое число — в квантовой физике квантовое число ℓ, определяющее форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным квантовым числом n и может принимать значения. l = 0, 1, 2, …; n-1 40
Орбитальное (азимутальное) квантовое число — в квантовой физике квантовое число ℓ, определяющее форму электронного облака. Определяет подуровень энергетического уровня, задаваемого главным квантовым числом n и может принимать значения. l = 0, 1, 2, …; n-1 40
 Кроме числовых ℓ имеет буквенные обозначения. Электроны с одинаковым значением ℓ образуют подуровень. Квантовое число ℓ определяет квантование орбитального момента количества движения электрона в сферически симметричном кулоновском поле ядра. ℓ = 0 1 2 3 4 … ℓ = s p d f g … 41
Кроме числовых ℓ имеет буквенные обозначения. Электроны с одинаковым значением ℓ образуют подуровень. Квантовое число ℓ определяет квантование орбитального момента количества движения электрона в сферически симметричном кулоновском поле ядра. ℓ = 0 1 2 3 4 … ℓ = s p d f g … 41
 42
42
 Орбитальное квантовое число Магнитное квантовое число ℓ Число орбиталей с данным значением l 2ℓ + 1 0 (s) 0 1 1 (p) – 1, 0, +1 3 2 (d) 3 (f) – 2, – 1, 0, +1, +2 – 3, – 2, – 1, 0, 5 7 43
Орбитальное квантовое число Магнитное квантовое число ℓ Число орбиталей с данным значением l 2ℓ + 1 0 (s) 0 1 1 (p) – 1, 0, +1 3 2 (d) 3 (f) – 2, – 1, 0, +1, +2 – 3, – 2, – 1, 0, 5 7 43
 44
44
 1907) - русский химик, педагог, разносторонний ученый. Оставил свыше 500 печатных трудов, среди которых классические "Основы химии" — первое стройное изложение неорганической химии. Автор фундаментальных исследований по химии, химической технологии, физике, метеорологии, воздухоплаванию, сельскому 6 марта 1869 хозяйству, народному просвещению и года на заседании Русского физикохимического общества профессор Н. А. Меншуткин др. прочитал доклад Менделеева "Опыт системы элементов, основанной на их атомном весе и химическом сродстве". Это была самая первая формулировка всемирно известного Периодического закона, окончательная редакция которого вышла в 1869 -1870 годах и является одним из фундаментальных 45
1907) - русский химик, педагог, разносторонний ученый. Оставил свыше 500 печатных трудов, среди которых классические "Основы химии" — первое стройное изложение неорганической химии. Автор фундаментальных исследований по химии, химической технологии, физике, метеорологии, воздухоплаванию, сельскому 6 марта 1869 хозяйству, народному просвещению и года на заседании Русского физикохимического общества профессор Н. А. Меншуткин др. прочитал доклад Менделеева "Опыт системы элементов, основанной на их атомном весе и химическом сродстве". Это была самая первая формулировка всемирно известного Периодического закона, окончательная редакция которого вышла в 1869 -1870 годах и является одним из фундаментальных 45
 Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико -химические свойства, а строки представляют 46 собой периоды, в определённой мере
Периодическая система химических элементов (таблица Менделеева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. В современном варианте системы предполагается сведение элементов в двумерную таблицу, в которой каждый столбец (группа) определяет основные физико -химические свойства, а строки представляют 46 собой периоды, в определённой мере
 47
47
 Контрольные вопросы 1. Модели атома 2. Опыт Резерфорда по строению атома 3. Постулаты Бора 4. Квантовые числа 5. Волна де Бройля и ее корпускулярные и волновые характеристики 6. Стационарное уравнение Шредингера
Контрольные вопросы 1. Модели атома 2. Опыт Резерфорда по строению атома 3. Постулаты Бора 4. Квантовые числа 5. Волна де Бройля и ее корпускулярные и волновые характеристики 6. Стационарное уравнение Шредингера


