Строение атома.pptx
- Количество слайдов: 29
 Строение атома Периодический закон Д. И. Менделеева Периодическая система элементов и ее связь со строением атома
Строение атома Периодический закон Д. И. Менделеева Периодическая система элементов и ее связь со строением атома
 Модели строения атома Модель Томсона Модель Резерфорда
Модели строения атома Модель Томсона Модель Резерфорда
 Строение атома Атом (от греческого atomos - неделимый) — одноядерная, химически неделимая частица химического элемента, носитель свойств вещества. Атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален.
Строение атома Атом (от греческого atomos - неделимый) — одноядерная, химически неделимая частица химического элемента, носитель свойств вещества. Атом состоит из положительно заряженного ядра и отрицательно заряженного электронного облака. В целом атом электронейтрален.
 Состав ядра атома • Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда. Заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. • Масса атома определятся массой его ядра: А = Z + N. А – массовое число
Состав ядра атома • Ядро состоит из Z положительно заряженных протонов (заряд протона соответствует +1 в условных единицах) и N нейтронов, которые не несут на себе заряда. Заряд ядра определятся только количеством протонов и равен порядковому номеру элемента в таблице Менделеева. • Масса атома определятся массой его ядра: А = Z + N. А – массовое число
 Строение атома Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов, т. е. равно порядковому номеру химического элемента в периодической системе.
Строение атома Положительный заряд ядра компенсируется отрицательно заряженными электронами (заряд электрона -1 в условных единицах), которые формируют электронное облако. Количество электронов равно количеству протонов, т. е. равно порядковому номеру химического элемента в периодической системе.
 Свойства электрона • Заряд электрона (ē) -1, 6· 10 -19 Кл • Масса ē 9, 1· 10 -28 г (в 1850 раз меньше массы р+) • Электрон является частицей, проявляющей корпускулярно-волновой дуализм. Он одновременно является и частицей (корпускулой) и волной. • К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам - способность к дифракции и интерференции.
Свойства электрона • Заряд электрона (ē) -1, 6· 10 -19 Кл • Масса ē 9, 1· 10 -28 г (в 1850 раз меньше массы р+) • Электрон является частицей, проявляющей корпускулярно-волновой дуализм. Он одновременно является и частицей (корпускулой) и волной. • К свойствам частицы можно отнести массу электрона и его заряд, а к волновым свойствам - способность к дифракции и интерференции.
 Уравнение де Бройля • Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля: где λ - длина волны, m— масса частицы, v— скорость частицы, h— постоянная Планка h= 6, 63· 10 -34 Дж·с
Уравнение де Бройля • Связь между волновыми и корпускулярными свойствами электрона отражены в уравнении де Бройля: где λ - длина волны, m— масса частицы, v— скорость частицы, h— постоянная Планка h= 6, 63· 10 -34 Дж·с
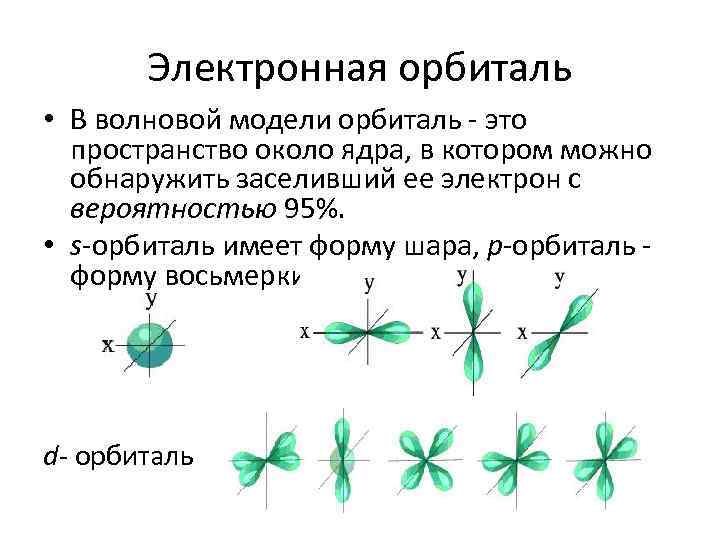 Электронная орбиталь • В волновой модели орбиталь - это пространство около ядра, в котором можно обнаружить заселивший ее электрон с вероятностью 95%. • s-орбиталь имеет форму шара, p-орбиталь - форму восьмерки. d- орбиталь
Электронная орбиталь • В волновой модели орбиталь - это пространство около ядра, в котором можно обнаружить заселивший ее электрон с вероятностью 95%. • s-орбиталь имеет форму шара, p-орбиталь - форму восьмерки. d- орбиталь
 Принцип неопределенности Гейзенберга • Для электрона невозможно одновременно точно измерить координату и скорость: • ∆Х -неопределенность координаты электрона, ∆V -погрешность измерения скорости, ħ=h/2π=1. 05· 10 -34 Дж·с
Принцип неопределенности Гейзенберга • Для электрона невозможно одновременно точно измерить координату и скорость: • ∆Х -неопределенность координаты электрона, ∆V -погрешность измерения скорости, ħ=h/2π=1. 05· 10 -34 Дж·с
 Электронное строение атома Число электронных уровней в атоме равно номеру периода, в котором находится химический элемент. Уровни расщепляются на подуровни, отличающиеся энергией и формой орбиталей. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни. Число подуровней равно номеру уровня. Электронный уровень содержит строго определенное число электронов - максимально 2 n 2, где n – номер уровня
Электронное строение атома Число электронных уровней в атоме равно номеру периода, в котором находится химический элемент. Уровни расщепляются на подуровни, отличающиеся энергией и формой орбиталей. Энергетические уровни подразделяются на s-, p-, d- и f- подуровни. Число подуровней равно номеру уровня. Электронный уровень содержит строго определенное число электронов - максимально 2 n 2, где n – номер уровня
 Квантовые числа электронов Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел. 1. Главное квантовое число n - определяет запас энергии электрона. n= N энергетического уровня электрона Принимает целые значения (n = 1, 2, 3. . . ). Чем больше n, тем дальше электрон от ядра, тем выше энергия ē.
Квантовые числа электронов Состояние каждого электрона в атоме обычно описывают с помощью четырех квантовых чисел. 1. Главное квантовое число n - определяет запас энергии электрона. n= N энергетического уровня электрона Принимает целые значения (n = 1, 2, 3. . . ). Чем больше n, тем дальше электрон от ядра, тем выше энергия ē.
 Квантовые числа электронов 2. Орбитальное квантовое число l -характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь определенного подуровня. l=0 для s-подуровня, s-орбиталь –сфера l=1 для p- подуровня, p- орбиталь –гантель l=2 d-подуровень, d-орбиталь – сложной формы l=3 f-подуровень, f-орбиталь – орбиталь еще более сложной формы.
Квантовые числа электронов 2. Орбитальное квантовое число l -характеризует геометрическую форму орбитали. Принимает значение целых чисел от 0 до (n - 1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь определенного подуровня. l=0 для s-подуровня, s-орбиталь –сфера l=1 для p- подуровня, p- орбиталь –гантель l=2 d-подуровень, d-орбиталь – сложной формы l=3 f-подуровень, f-орбиталь – орбиталь еще более сложной формы.
 Квантовые числа электронов 3. Магнитное квантовое число m -характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Для каждой формы орбитали существует (2 l + 1) энергетически равноценных ориентаций в пространстве. На s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей.
Квантовые числа электронов 3. Магнитное квантовое число m -характеризует положение электронной орбитали в пространстве и принимает целочисленные значения от -I до +I, включая 0. Для каждой формы орбитали существует (2 l + 1) энергетически равноценных ориентаций в пространстве. На s- подуровне - одна, на p- подуровне - три, на d- подуровне - пять, на f- подуровне - 7 орбиталей.
 Квантовые числа электронов 4. Спиновое квантовое число s характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и – 1/2 соответствующие противоположным направлениям вращения. На одной орбитали не может быть более 2 -х электронов, которые отличаются значением спинового квантового числа.
Квантовые числа электронов 4. Спиновое квантовое число s характеризует магнитный момент, возникающий при вращении электрона вокруг своей оси. Принимает только два значения +1/2 и – 1/2 соответствующие противоположным направлениям вращения. На одной орбитали не может быть более 2 -х электронов, которые отличаются значением спинового квантового числа.
 Принципы заполнения орбиталей 1) Принцип наименьшей энергии. Электроны заполняют подуровни в порядке увеличения энергии подуровней. Энергия орбиталей возрастает в ряду: 1 s < 2 p : < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 5 d » 4 f < 6 p < 7 s. Правило Клечковского: заполнение электронных оболочек в атомах элементов происходит в порядке возрастания суммы квантовых чисел n+l; при равенстве этих сумм для двух оболочек сначала заполняется оболочка с меньшим значением n.
Принципы заполнения орбиталей 1) Принцип наименьшей энергии. Электроны заполняют подуровни в порядке увеличения энергии подуровней. Энергия орбиталей возрастает в ряду: 1 s < 2 p : < 3 s < 3 p < 4 s < 3 d < 4 p < 5 s < 4 d < 5 p < 6 s < 5 d » 4 f < 6 p < 7 s. Правило Клечковского: заполнение электронных оболочек в атомах элементов происходит в порядке возрастания суммы квантовых чисел n+l; при равенстве этих сумм для двух оболочек сначала заполняется оболочка с меньшим значением n.
 Принципы заполнения орбиталей 2)Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы. На каждой орбитали может находиться не более двух электронов (c противоположными спинами).
Принципы заполнения орбиталей 2)Принцип Паули. В атоме не может быть двух электронов, у которых значения всех квантовых чисел (n, l, m, s) были бы одинаковы. На каждой орбитали может находиться не более двух электронов (c противоположными спинами).
 Принципы заполнения орбиталей 3) Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня. По правилу Хунда при заполнении электронами одинаковых по энергии орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами.
Принципы заполнения орбиталей 3) Правило Хунда. Атом в основном состоянии должен иметь максимально возможное число неспаренных электронов в пределах определенного подуровня. По правилу Хунда при заполнении электронами одинаковых по энергии орбиталей электроны располагаются в первую очередь по одиночке на каждой орбитали, и лишь потом начинается заселение этих орбиталей вторыми электронами.
 Электронные и электронно-структурные формулы Пример. Изобразите электронно-структурную и электронную формулы атома азота. Азот (N), № 7 – элемент второго периода, VА-подгруппы. Следовательно, в атоме азота 7 электронов расположены на 2 -х электронных уровнях, на внешнем уровне размещаются 5 ē. Электронная формула атома азота: 1 s 22 p 3. Последний ē в атоме находится на р-подуровне, следовательно, азот относится к р-элементам. Электронно-структурная формула:
Электронные и электронно-структурные формулы Пример. Изобразите электронно-структурную и электронную формулы атома азота. Азот (N), № 7 – элемент второго периода, VА-подгруппы. Следовательно, в атоме азота 7 электронов расположены на 2 -х электронных уровнях, на внешнем уровне размещаются 5 ē. Электронная формула атома азота: 1 s 22 p 3. Последний ē в атоме находится на р-подуровне, следовательно, азот относится к р-элементам. Электронно-структурная формула:
 Электронный остов атома • Заполненные электронные подуровни, соответствующие электронным структурам атомов благородных газов, называют электронным остовом. • Валентность определяется числом неспаренных электронов на внешнем уровне. Пример. Для атома натрия, имеющего электронную формулу 1 s 22 p 63 s 1, электронным остовом является конфигурация благородного газа неона 1 s 22 p 6, поэтому электронную формулу атома натрия можно записать [Ne] 3 s 1. На внешнем уровне атома натрия 1 ē, поэтому у натрия во всех соединениях степень окисления +1. Na – 1 ē = Na+
Электронный остов атома • Заполненные электронные подуровни, соответствующие электронным структурам атомов благородных газов, называют электронным остовом. • Валентность определяется числом неспаренных электронов на внешнем уровне. Пример. Для атома натрия, имеющего электронную формулу 1 s 22 p 63 s 1, электронным остовом является конфигурация благородного газа неона 1 s 22 p 6, поэтому электронную формулу атома натрия можно записать [Ne] 3 s 1. На внешнем уровне атома натрия 1 ē, поэтому у натрия во всех соединениях степень окисления +1. Na – 1 ē = Na+
 Периодический закон Д. И. Менделеева Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание заряда ядра от 1 до 110 приводит к периодическому повторению строения электронных оболочек. А поскольку от них зависят химические свойства элементов, то они периодически повторяются. В этом физический смысл периодического закона.
Периодический закон Д. И. Менделеева Свойства химических элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов. Теория строения атомов объясняет периодическое изменение свойств элементов. Возрастание заряда ядра от 1 до 110 приводит к периодическому повторению строения электронных оболочек. А поскольку от них зависят химические свойства элементов, то они периодически повторяются. В этом физический смысл периодического закона.
 Периодическая система химических элементов Период – это горизонтальный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных уровней. • 1, 2, 3 – малые периоды, 4, 5, 6, 7 – большие, 7 – незавершенный. • Элементы 2 и 3 периодов Д. И. Менделеев назвал типическими.
Периодическая система химических элементов Период – это горизонтальный ряд элементов, в атомах которых происходит заполнение одинакового числа электронных уровней. • 1, 2, 3 – малые периоды, 4, 5, 6, 7 – большие, 7 – незавершенный. • Элементы 2 и 3 периодов Д. И. Менделеев назвал типическими.
 Периодическая система • Группы – вертикальные ряды, которые объединяют элементы с одинаковым числом электронов на внешнем уровне. Номер группы определяет валентность элемента, а также высшую степень окисления элемента. • В главную подгруппу входят s- и р-элементы больших и малых периодов. • Побочные подгруппы включают d-элементы. Лантаноиды и актиноиды – f-элементы – вынесены отдельно вниз.
Периодическая система • Группы – вертикальные ряды, которые объединяют элементы с одинаковым числом электронов на внешнем уровне. Номер группы определяет валентность элемента, а также высшую степень окисления элемента. • В главную подгруппу входят s- и р-элементы больших и малых периодов. • Побочные подгруппы включают d-элементы. Лантаноиды и актиноиды – f-элементы – вынесены отдельно вниз.
 Характеристики химического элемента • Атомный номер равен заряду ядра, то есть количеству протонов в составе ядра, а также числу электронов в атоме. • Номер периода равен числу электронных уровней в атоме. • Номер группы – числу электронов на внешнем энергетическом уровне. Пример. Атом хлора (хим. элемент № 17) содержит в ядре 17 протонов, а также 17 ē в атоме. Поскольку Cl – элемент 3 -го периода VIIA-подгруппы, его 17 электронов расположены на 3 электронных уровнях. 1 s 22 p 63 s 23 p 5 или [Ne] 3 s 23 p 5 При этом на внешнем уровне атом хлора имеет 7 ē. Максимальная валентность Сl равна VII, максимальная степень окисления + 7.
Характеристики химического элемента • Атомный номер равен заряду ядра, то есть количеству протонов в составе ядра, а также числу электронов в атоме. • Номер периода равен числу электронных уровней в атоме. • Номер группы – числу электронов на внешнем энергетическом уровне. Пример. Атом хлора (хим. элемент № 17) содержит в ядре 17 протонов, а также 17 ē в атоме. Поскольку Cl – элемент 3 -го периода VIIA-подгруппы, его 17 электронов расположены на 3 электронных уровнях. 1 s 22 p 63 s 23 p 5 или [Ne] 3 s 23 p 5 При этом на внешнем уровне атом хлора имеет 7 ē. Максимальная валентность Сl равна VII, максимальная степень окисления + 7.
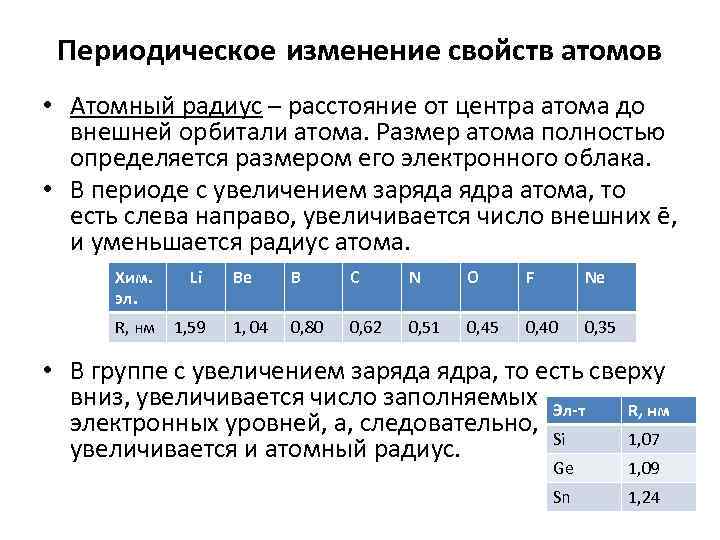 Периодическое изменение свойств атомов • Атомный радиус – расстояние от центра атома до внешней орбитали атома. Размер атома полностью определяется размером его электронного облака. • В периоде с увеличением заряда ядра атома, то есть слева направо, увеличивается число внешних ē, и уменьшается радиус атома. Хим. эл. Li R, нм 1, 59 Be B C N O F Ne 1, 04 0, 80 0, 62 0, 51 0, 45 0, 40 0, 35 • В группе с увеличением заряда ядра, то есть сверху вниз, увеличивается число заполняемых Эл-т R, нм электронных уровней, а, следовательно, Si 1, 07 увеличивается и атомный радиус. Ge 1, 09 Sn 1, 24
Периодическое изменение свойств атомов • Атомный радиус – расстояние от центра атома до внешней орбитали атома. Размер атома полностью определяется размером его электронного облака. • В периоде с увеличением заряда ядра атома, то есть слева направо, увеличивается число внешних ē, и уменьшается радиус атома. Хим. эл. Li R, нм 1, 59 Be B C N O F Ne 1, 04 0, 80 0, 62 0, 51 0, 45 0, 40 0, 35 • В группе с увеличением заряда ядра, то есть сверху вниз, увеличивается число заполняемых Эл-т R, нм электронных уровней, а, следовательно, Si 1, 07 увеличивается и атомный радиус. Ge 1, 09 Sn 1, 24
 Периодическое изменение свойств атомов • Энергия ионизации (I, э. В) – это энергия, необходимая для отрывания электрона от невозбуждённого атома. В результате ионизации атомы превращаются в положительно заряженные ионы (катионы). Эта энергия характеризует восстановительную способность элемента. • Она возрастает в периоде слева направо (Li – 5. 39 э. В, Be – 9. 32 э. В, B – 8. 30 э. В, C – 11. 26 э. В, N – 14. 53 э. В, 0 – 13. 6 э. В, F – 17. 2 э. В) и в группе снизу вверх (Li – 5. 39 э. В, Na – 5. 14 э. В, K – 4. 34 э. В, Rb – 4. 18 э. В).
Периодическое изменение свойств атомов • Энергия ионизации (I, э. В) – это энергия, необходимая для отрывания электрона от невозбуждённого атома. В результате ионизации атомы превращаются в положительно заряженные ионы (катионы). Эта энергия характеризует восстановительную способность элемента. • Она возрастает в периоде слева направо (Li – 5. 39 э. В, Be – 9. 32 э. В, B – 8. 30 э. В, C – 11. 26 э. В, N – 14. 53 э. В, 0 – 13. 6 э. В, F – 17. 2 э. В) и в группе снизу вверх (Li – 5. 39 э. В, Na – 5. 14 э. В, K – 4. 34 э. В, Rb – 4. 18 э. В).
 Периодическое изменение свойств атомов • Сродство к электрону (Е, э. В)– это энергия, выделяющаяся присоединении ē к нейтральному атому. В результате атомы превращаются в отрицательно заряженные ионы. • В периоде слева направо она увеличивается, а в группе снизу вверх уменьшается. Хим. эл-т F Cl Br I Е. э. В 3. 45 3. 61 3. 36 3. 06
Периодическое изменение свойств атомов • Сродство к электрону (Е, э. В)– это энергия, выделяющаяся присоединении ē к нейтральному атому. В результате атомы превращаются в отрицательно заряженные ионы. • В периоде слева направо она увеличивается, а в группе снизу вверх уменьшается. Хим. эл-т F Cl Br I Е. э. В 3. 45 3. 61 3. 36 3. 06
 Периодическое изменение свойств атомов • Электроотрицательность (Х, э. В) – способность атомов притягивать к себе валентные электроны при образовании химической связи. Х = ½(I+E) • В периоде слева направо ЭО увеличивается, а в группе сверху вниз уменьшается. Li Be B C N O F 1, 0 1, 5 2, 0 2. 5 3. 1 3. 5 4. 1
Периодическое изменение свойств атомов • Электроотрицательность (Х, э. В) – способность атомов притягивать к себе валентные электроны при образовании химической связи. Х = ½(I+E) • В периоде слева направо ЭО увеличивается, а в группе сверху вниз уменьшается. Li Be B C N O F 1, 0 1, 5 2, 0 2. 5 3. 1 3. 5 4. 1
 Металлические свойства • характеризуют способность отдавать валентные электроны, то есть восстановительную способность атомов. • Металлические и восстановительные свойства убывают в периоде слева направо и возрастают в группе сверху вниз. Диагональ, проходящая по элементам В, Si, As, Te, At делит элементы главных подгрупп на металлы и неметаллы. Неметаллы находятся в правом верхнем углу (их 22 элемента). Металлы – в левом нижнем углу. К металлам также относятся все d- и f-элементы.
Металлические свойства • характеризуют способность отдавать валентные электроны, то есть восстановительную способность атомов. • Металлические и восстановительные свойства убывают в периоде слева направо и возрастают в группе сверху вниз. Диагональ, проходящая по элементам В, Si, As, Te, At делит элементы главных подгрупп на металлы и неметаллы. Неметаллы находятся в правом верхнем углу (их 22 элемента). Металлы – в левом нижнем углу. К металлам также относятся все d- и f-элементы.
 Неметаллические свойства • характеризуют способность присоединять электроны до завершения внешнего уровня до устойчивой конфигурации инертного газа, то есть характеризуют окислительную способность атомов. • Неметаллические и окислительные свойства элементов усиливаются в периодах слева направо и уменьшаются в группах сверху вниз.
Неметаллические свойства • характеризуют способность присоединять электроны до завершения внешнего уровня до устойчивой конфигурации инертного газа, то есть характеризуют окислительную способность атомов. • Неметаллические и окислительные свойства элементов усиливаются в периодах слева направо и уменьшаются в группах сверху вниз.


