Строение атома.pptx
- Количество слайдов: 39
 Строение атома
Строение атома
 Историческая справка
Историческая справка
 Ученые древности о строении вещества • Древнегреческий ученый Демокрит 2500 лет назад считал, что любое вещество состоит из мельчайших частиц, которые впоследствии были названы «атомами» , что в переводе на русский язык означает «неделимый» • Долгое время считалось, что атом является неделимой частицей.
Ученые древности о строении вещества • Древнегреческий ученый Демокрит 2500 лет назад считал, что любое вещество состоит из мельчайших частиц, которые впоследствии были названы «атомами» , что в переводе на русский язык означает «неделимый» • Долгое время считалось, что атом является неделимой частицей.
 Атомисты Демокрит 460 -370 до н. э. М. В. Ломоносов 1711 -1765
Атомисты Демокрит 460 -370 до н. э. М. В. Ломоносов 1711 -1765
 Экспериментальные основы • Спектральный анализ, спектры (Г. Кирхгоф, 1859; Дж. Бальмер, 1885, И. Ридберг) • Периодический закон (Д. Менделеев 1869) • Фотоэффект (А. Столетов, 1888) • Катодные лучи (Ж. Перрен, 1895) • Рентгеновские лучи (В. Рентген 1895) • Радиоактивность (А. Беккерель, 1896) • Открытие электрона (Дж. Томпсон, 1897)
Экспериментальные основы • Спектральный анализ, спектры (Г. Кирхгоф, 1859; Дж. Бальмер, 1885, И. Ридберг) • Периодический закон (Д. Менделеев 1869) • Фотоэффект (А. Столетов, 1888) • Катодные лучи (Ж. Перрен, 1895) • Рентгеновские лучи (В. Рентген 1895) • Радиоактивность (А. Беккерель, 1896) • Открытие электрона (Дж. Томпсон, 1897)
 Модели строения атома
Модели строения атома
 Джозеф Томсон (1903) «Пудинг с изюмом» - первая модель атома • Джозеф Джон Томсон
Джозеф Томсон (1903) «Пудинг с изюмом» - первая модель атома • Джозеф Джон Томсон
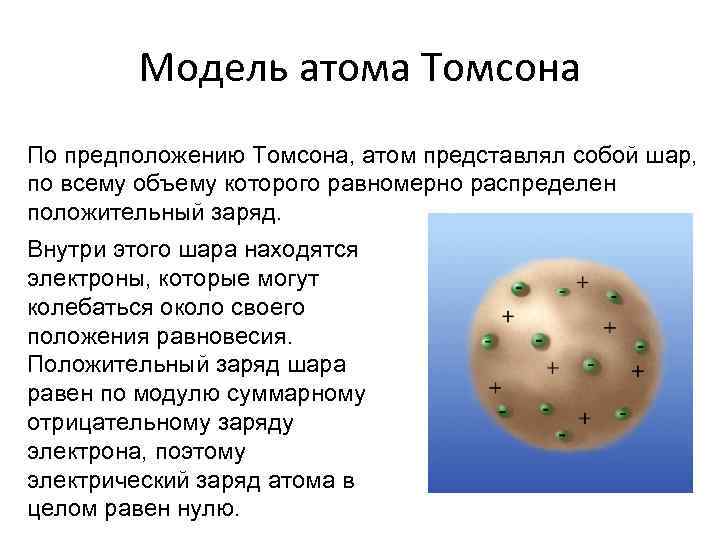 Модель атома Томсона По предположению Томсона, атом представлял собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны, которые могут колебаться около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электрона, поэтому электрический заряд атома в целом равен нулю.
Модель атома Томсона По предположению Томсона, атом представлял собой шар, по всему объему которого равномерно распределен положительный заряд. Внутри этого шара находятся электроны, которые могут колебаться около своего положения равновесия. Положительный заряд шара равен по модулю суммарному отрицательному заряду электрона, поэтому электрический заряд атома в целом равен нулю.
 Эрнест Резерфорд( 1871 -1937) • Эрнест Резерфорд • (1871— 1937) • Планетарная модель атома (1911)
Эрнест Резерфорд( 1871 -1937) • Эрнест Резерфорд • (1871— 1937) • Планетарная модель атома (1911)
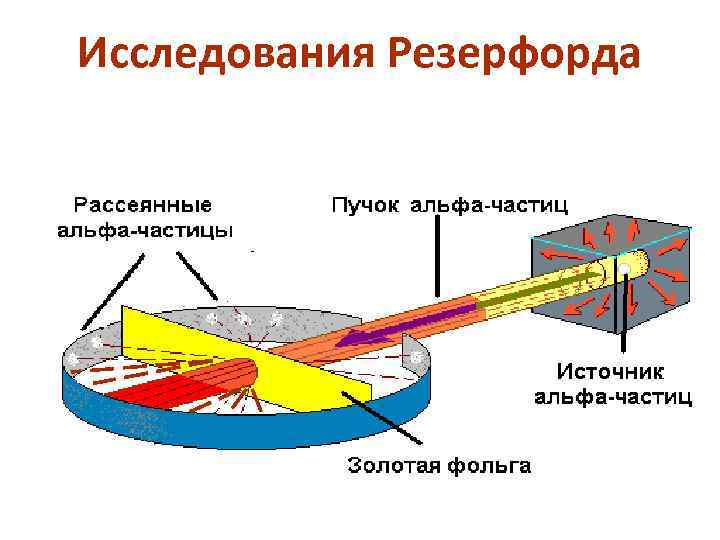 Исследования Резерфорда
Исследования Резерфорда
 Опыт Резерфорда Наибольшее количество вспышек расположено в центре экрана. Значит, основная часть всех αчастиц прошла сквозь фольгу, почти не изменив начального направления (рассеялось на малые углы). При удалении от центра экрана количество вспышек становится все меньше и меньше. Следовательно, с увеличением угла рассеяния β количество рассеянных на эти углы частиц резко уменьшается. Также некоторое число частиц рассеялось на углы, близкие к 90°, а некоторые – на углы порядка 180°
Опыт Резерфорда Наибольшее количество вспышек расположено в центре экрана. Значит, основная часть всех αчастиц прошла сквозь фольгу, почти не изменив начального направления (рассеялось на малые углы). При удалении от центра экрана количество вспышек становится все меньше и меньше. Следовательно, с увеличением угла рассеяния β количество рассеянных на эти углы частиц резко уменьшается. Также некоторое число частиц рассеялось на углы, близкие к 90°, а некоторые – на углы порядка 180°
 Результаты опыта Резенфорда
Результаты опыта Резенфорда
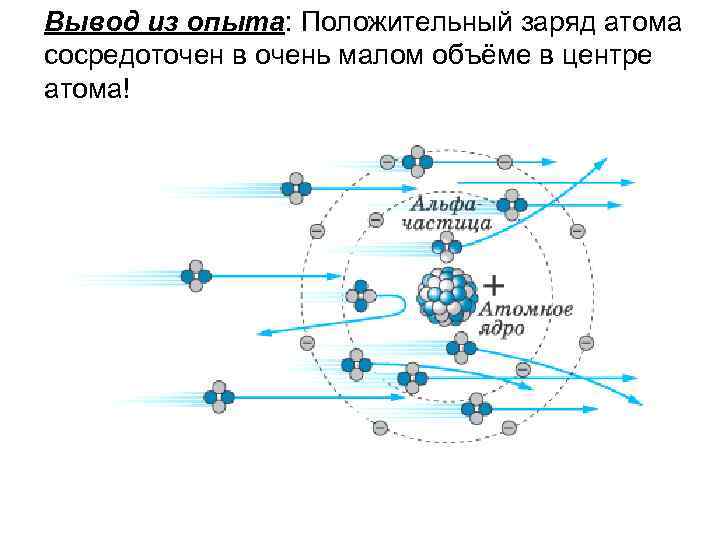 Вывод из опыта: Положительный заряд атома сосредоточен в очень малом объёме в центре атома!
Вывод из опыта: Положительный заряд атома сосредоточен в очень малом объёме в центре атома!
 Квантовые постулаты Бора. 1913 г. Атомная система может находиться только в особых стационарных , или квантовых, состояниях, каждому из которых соответствует определенная энергия En; в стационарном состоянии атом не излучает. Излучение света происходит при переходе атома из стационарного состояния с большой энергией EK в стационарное состояние с меньшей энергией En. Энергия излучения фотона равна разнице энергий стационарных состояний
Квантовые постулаты Бора. 1913 г. Атомная система может находиться только в особых стационарных , или квантовых, состояниях, каждому из которых соответствует определенная энергия En; в стационарном состоянии атом не излучает. Излучение света происходит при переходе атома из стационарного состояния с большой энергией EK в стационарное состояние с меньшей энергией En. Энергия излучения фотона равна разнице энергий стационарных состояний
 Трудности теории Бора Построена на основе законов Ньютона и Кулона. Вводились квантовые постулаты, не согласованные с классической механикой и электродинамикой Максвелла. (Квантовая механика сформировалась в середине 20 века) Правила квантования применимы не всегда. Построена только модель атома водорода
Трудности теории Бора Построена на основе законов Ньютона и Кулона. Вводились квантовые постулаты, не согласованные с классической механикой и электродинамикой Максвелла. (Квантовая механика сформировалась в середине 20 века) Правила квантования применимы не всегда. Построена только модель атома водорода
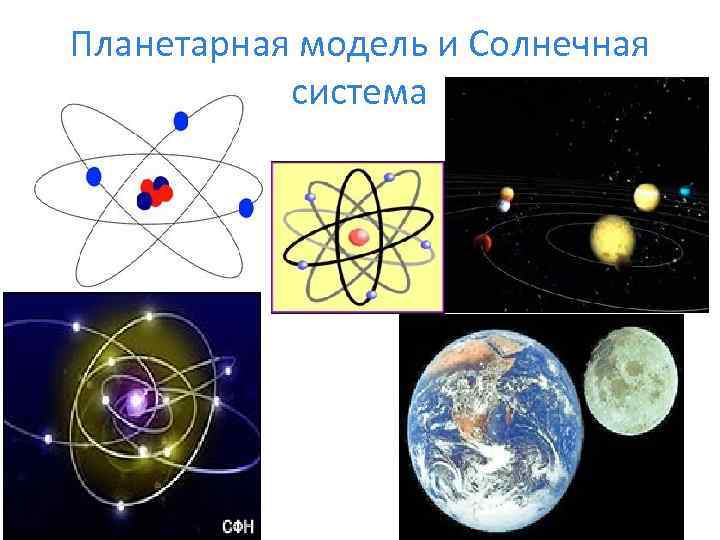 Планетарная модель и Солнечная система
Планетарная модель и Солнечная система
 Квантовые представления • Положение электрона характеризуется вероятностью пребывания частицы в конкретной области пространства • Область наиболее вероятного пребывания электрона в атоме называют атомной орбиталью - АО • Вероятность обнаружения электрона определяется квадратом волновой функцией - 2
Квантовые представления • Положение электрона характеризуется вероятностью пребывания частицы в конкретной области пространства • Область наиболее вероятного пребывания электрона в атоме называют атомной орбиталью - АО • Вероятность обнаружения электрона определяется квадратом волновой функцией - 2
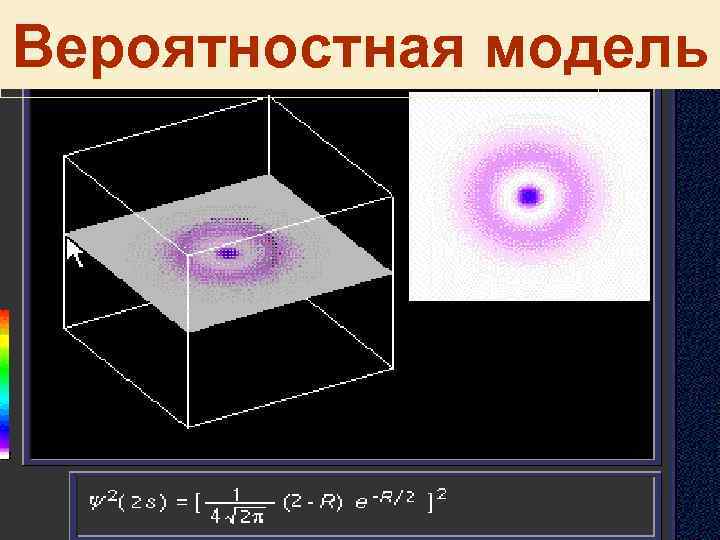 Вероятностная модель
Вероятностная модель
 Орбиталь d 2 z
Орбиталь d 2 z
 Уравнение Шредингера уравнение трехмерной волны НΨ = Е·Ψ • В волновой теории движение эл-на представ-ся в виде стоячей волны, для которой характерен набор колебаний с длинами волн: , /2, /3, . . . . /n; т. е движение характеризуется квант. числом - n
Уравнение Шредингера уравнение трехмерной волны НΨ = Е·Ψ • В волновой теории движение эл-на представ-ся в виде стоячей волны, для которой характерен набор колебаний с длинами волн: , /2, /3, . . . . /n; т. е движение характеризуется квант. числом - n
 Квантовые числа • Уравнение Шредингера - трехмерно. Соответственно - три набора квантовых чисел. Каждой координате свое квантовое число. • Размер, энергия, форма и ориентация электронного облака изменяются в атоме скачками (квантами)
Квантовые числа • Уравнение Шредингера - трехмерно. Соответственно - три набора квантовых чисел. Каждой координате свое квантовое число. • Размер, энергия, форма и ориентация электронного облака изменяются в атоме скачками (квантами)
 Главное квантовое число(n) • n - 1, 2, 3, … , определяет энергию электрона в атоме • Энергетический уровень - состояние электронов в атоме с тем или иным значением n • Основное состояние атома - min энергия электронов • Возбужденное состояние – более высокие значения энергии электронов
Главное квантовое число(n) • n - 1, 2, 3, … , определяет энергию электрона в атоме • Энергетический уровень - состояние электронов в атоме с тем или иным значением n • Основное состояние атома - min энергия электронов • Возбужденное состояние – более высокие значения энергии электронов
 Орбитальное квантовое число (l) харак -ет форму электронного облака l = 0, 1, 2, 3…. n-1 Подуровень: s, p, d, f, g, h Т. е. энерг-кий уровень (n) содержит совокупность энерг-ких подуровней, отличающихся по энергиям (в многоэлектронном атоме)
Орбитальное квантовое число (l) харак -ет форму электронного облака l = 0, 1, 2, 3…. n-1 Подуровень: s, p, d, f, g, h Т. е. энерг-кий уровень (n) содержит совокупность энерг-ких подуровней, отличающихся по энергиям (в многоэлектронном атоме)
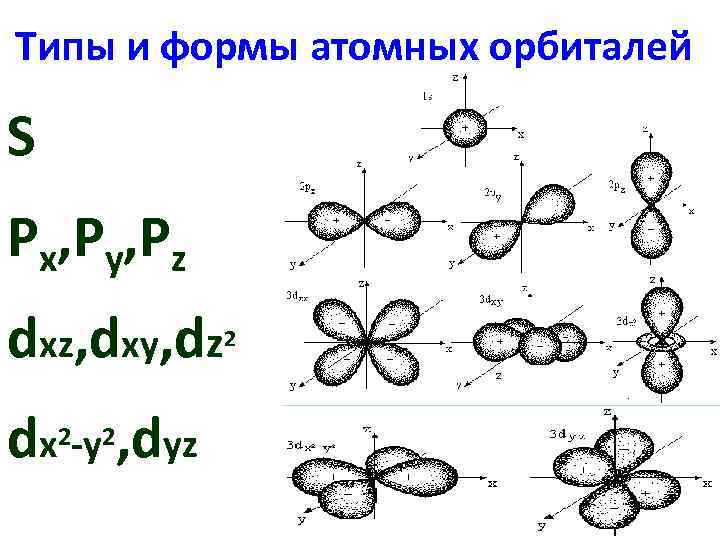 Типы и формы атомных орбиталей S Px, Py, Pz dxz, dxy, dz dx 2 -y 2, dyz 2
Типы и формы атомных орбиталей S Px, Py, Pz dxz, dxy, dz dx 2 -y 2, dyz 2
 Свойство атома
Свойство атома
 Атом • атом – наименьшая частица химического элемента, являющаяся носителем его свойств. • ( «атом» - в переводе неделимый)
Атом • атом – наименьшая частица химического элемента, являющаяся носителем его свойств. • ( «атом» - в переводе неделимый)
 В ядре находятся Протоны p + Нейтроны n не имеют заряда
В ядре находятся Протоны p + Нейтроны n не имеют заряда
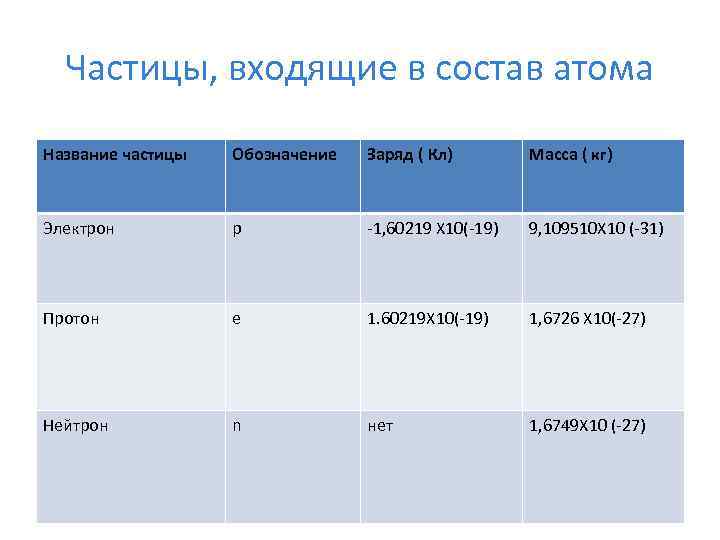 Частицы, входящие в состав атома Название частицы Обозначение Заряд ( Кл) Масса ( кг) Электрон р -1, 60219 Х 10(-19) 9, 109510 Х 10 (-31) Протон е 1. 60219 Х 10(-19) 1, 6726 Х 10(-27) Нейтрон n нет 1, 6749 Х 10 (-27)
Частицы, входящие в состав атома Название частицы Обозначение Заряд ( Кл) Масса ( кг) Электрон р -1, 60219 Х 10(-19) 9, 109510 Х 10 (-31) Протон е 1. 60219 Х 10(-19) 1, 6726 Х 10(-27) Нейтрон n нет 1, 6749 Х 10 (-27)
 В нормальном состоянии атом нейтрален. ∑ +p = ∑ -e Если атом теряет один электрон, то он становится положительным ионом Если атом присоединяет электрон, то он становится отрицательным ионом.
В нормальном состоянии атом нейтрален. ∑ +p = ∑ -e Если атом теряет один электрон, то он становится положительным ионом Если атом присоединяет электрон, то он становится отрицательным ионом.
 A=Z+N A – массовое число атома Z – заряд ядра (число протонов) N – число нейтронов А Z Э
A=Z+N A – массовое число атома Z – заряд ядра (число протонов) N – число нейтронов А Z Э
 Строение атомов Характеристика атома углерод алюминий железо медь серебро Порядковый номер в системе элементов 6 13 26 29 47 Атомная масса 12 27 56 64 108 Число электронов 6 13 26 29 47 Число протонов 6 13 26 29 47 Число нейтронов 6 14 30 35 61
Строение атомов Характеристика атома углерод алюминий железо медь серебро Порядковый номер в системе элементов 6 13 26 29 47 Атомная масса 12 27 56 64 108 Число электронов 6 13 26 29 47 Число протонов 6 13 26 29 47 Число нейтронов 6 14 30 35 61
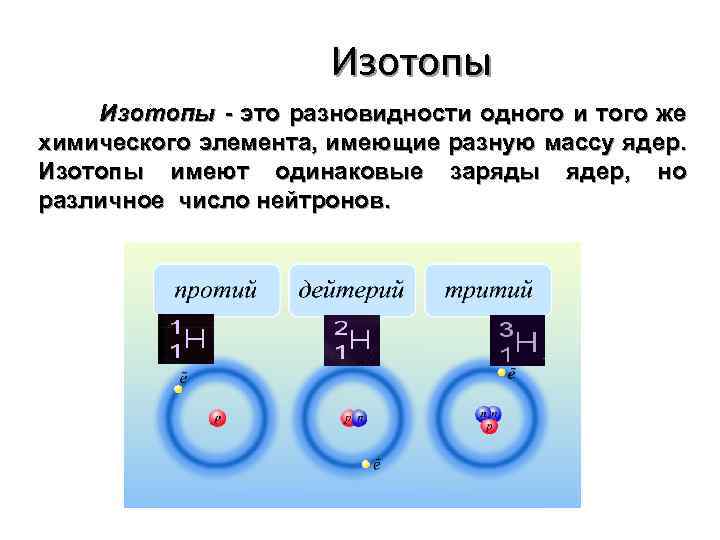 Изотопы - это разновидности одного и того же химического элемента, имеющие разную массу ядер. Изотопы имеют одинаковые заряды ядер, но различное число нейтронов.
Изотопы - это разновидности одного и того же химического элемента, имеющие разную массу ядер. Изотопы имеют одинаковые заряды ядер, но различное число нейтронов.
 Применение
Применение
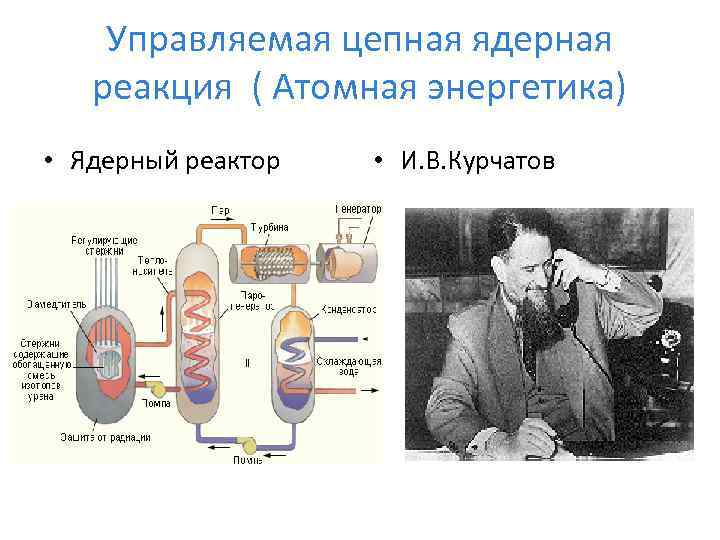 Управляемая цепная ядерная реакция ( Атомная энергетика) • Ядерный реактор • И. В. Курчатов
Управляемая цепная ядерная реакция ( Атомная энергетика) • Ядерный реактор • И. В. Курчатов
 Неуправляемая цепная ядерная реакция(водородная и атомная бомба)
Неуправляемая цепная ядерная реакция(водородная и атомная бомба)
 Ядерный взрыв
Ядерный взрыв
 Атом покорен, НО цивилизация под угрозой. Прав ли был Прометей, давший людям огонь? Мир рванулся вперед, мир сорвался с пружин, Из прекрасного лебедя вырос дракон, Из запретной бутылки был выпущен джин.
Атом покорен, НО цивилизация под угрозой. Прав ли был Прометей, давший людям огонь? Мир рванулся вперед, мир сорвался с пружин, Из прекрасного лебедя вырос дракон, Из запретной бутылки был выпущен джин.
 Можно погибнуть от невидимого Основные источники радиации: • Космические тела • Недра Земли • Рентгеновские препараты • Телевизор и т. п. • Тело человека содержит 0, 01 г радиоактивного калия период распада 4000 делений в секунду Обозначение радиации
Можно погибнуть от невидимого Основные источники радиации: • Космические тела • Недра Земли • Рентгеновские препараты • Телевизор и т. п. • Тело человека содержит 0, 01 г радиоактивного калия период распада 4000 делений в секунду Обозначение радиации
 Применение радиоактивного излучения. Биологическое действие на организм. А. Д. Сахаров Установка для радиотерапии
Применение радиоактивного излучения. Биологическое действие на организм. А. Д. Сахаров Установка для радиотерапии


