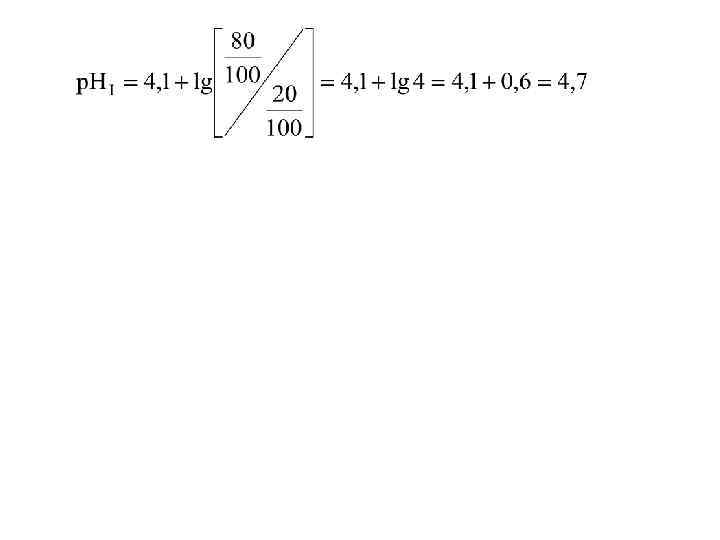Презентация.2. степень раств., потенц. титр..ppt
- Количество слайдов: 25
 Степень растворимости ЧСА имеет высокую степень растворимости в водных растворах. Это объясняется наличием на поверхности белковой молекулы большого числа ионизированных групп. Для определения количества и состояния заряженных групп на поверхности белковой молекулы, а также природы зарядов и их окружения достаточно давно используется метод кислотноосновного, или потенциометрического, титрования. Этот метод используется также для определения одной из важнейших физико-химических характеристик вещества – константы диссоциации ионогенных групп.
Степень растворимости ЧСА имеет высокую степень растворимости в водных растворах. Это объясняется наличием на поверхности белковой молекулы большого числа ионизированных групп. Для определения количества и состояния заряженных групп на поверхности белковой молекулы, а также природы зарядов и их окружения достаточно давно используется метод кислотноосновного, или потенциометрического, титрования. Этот метод используется также для определения одной из важнейших физико-химических характеристик вещества – константы диссоциации ионогенных групп.
 Метод потенциометрического титрования белков Принцип метода. Метод кислотно-основного, или потенциометрического титрования биологических молкул достаточно стар: еще в 1921 году были сняты кривые титрования белков. Этот метод позволяет исследовать количество и состояние заряженных групп на поверхности мембран, белков, вирусов, природу зарядов и их окружение. Он используется также для определения одной из важнейших физтко-химических характеристик – констаты ионизации ионогенных групп. С его помощью изучают электростатические взаимодействия между субстратами и ферментами,
Метод потенциометрического титрования белков Принцип метода. Метод кислотно-основного, или потенциометрического титрования биологических молкул достаточно стар: еще в 1921 году были сняты кривые титрования белков. Этот метод позволяет исследовать количество и состояние заряженных групп на поверхности мембран, белков, вирусов, природу зарядов и их окружение. Он используется также для определения одной из важнейших физтко-химических характеристик – констаты ионизации ионогенных групп. С его помощью изучают электростатические взаимодействия между субстратами и ферментами,
 активаторами и рецепторами, между белками и нуклеиновыми кислотами и т. д. Метод реагирует только на те химические группы, которые обладают способностью при определенных условиях присоединять или отдавать протон. Иначе говоря, некая молекула может диссоциировать на анион и протон: АН ↔ А– + Н+ (1) Константа диссоциации будет равна (2), при условии того, что коэффициенты активности А–, Н+ и АН равны 1. Логарифмируя (2), получим: (3)
активаторами и рецепторами, между белками и нуклеиновыми кислотами и т. д. Метод реагирует только на те химические группы, которые обладают способностью при определенных условиях присоединять или отдавать протон. Иначе говоря, некая молекула может диссоциировать на анион и протон: АН ↔ А– + Н+ (1) Константа диссоциации будет равна (2), при условии того, что коэффициенты активности А–, Н+ и АН равны 1. Логарифмируя (2), получим: (3)
 Величина р. Ка характеризует сродство данной химической группы к протону. Соответственно она определяется свободной энергией связи между протоном и данной группой: (4), где R – универсальная газовая постоянная (R = 8, 314 Дж Mоль-1 · K-1); Т – температура (Кельвин). При Т = 293 K, уравнение принимает вид , (кал моль-1) = = 5, 6 ·р. Ка Дж/кмоль (5)
Величина р. Ка характеризует сродство данной химической группы к протону. Соответственно она определяется свободной энергией связи между протоном и данной группой: (4), где R – универсальная газовая постоянная (R = 8, 314 Дж Mоль-1 · K-1); Т – температура (Кельвин). При Т = 293 K, уравнение принимает вид , (кал моль-1) = = 5, 6 ·р. Ка Дж/кмоль (5)
 В частности, вода диссоциирует по уравнению НОН = Н+ + ОН–. Поскольку степень диссоциации воды слабая , тогда . Эту величину называют ионным произведением воды. Ее значения приведены в табл. 1. Таблица 1. Значение ионного произведения воды при различных температурах Температура, С КН О 0 0, 13 10 -14 22 1, 00 10 -14 50 5, 60 10 -14 100 74 10 -14 2
В частности, вода диссоциирует по уравнению НОН = Н+ + ОН–. Поскольку степень диссоциации воды слабая , тогда . Эту величину называют ионным произведением воды. Ее значения приведены в табл. 1. Таблица 1. Значение ионного произведения воды при различных температурах Температура, С КН О 0 0, 13 10 -14 22 1, 00 10 -14 50 5, 60 10 -14 100 74 10 -14 2
 Из этой таблицы следует, в частности, что р. Н воды зависит от температуры. При 22 С =10 -14; =(10 -14)1/2 = 10 -7; р. Н = 7. Как видно из уравнения (3), при р. Ка = р. Н и . Таким образом, величина р. Ка равна тому значению р. Н, при котором 50% данных групп находится в диссоциированной форме.
Из этой таблицы следует, в частности, что р. Н воды зависит от температуры. При 22 С =10 -14; =(10 -14)1/2 = 10 -7; р. Н = 7. Как видно из уравнения (3), при р. Ка = р. Н и . Таким образом, величина р. Ка равна тому значению р. Н, при котором 50% данных групп находится в диссоциированной форме.
 При увеличении р. Н кислоты теряют протон и переходят в заряженную форму; основания тоже теряют протон, но переходят при этом в незаряженную форму. Для оснований часто используют величину р. Кв: В + Н+ ВН+, р. Кв ‑lg. Кв. Величины р. Ка и р. Кв связаны друг с другом простым соотношением, вытекающим из ионного произведения воды: р. Ка = 14 – р. Кв. (6)
При увеличении р. Н кислоты теряют протон и переходят в заряженную форму; основания тоже теряют протон, но переходят при этом в незаряженную форму. Для оснований часто используют величину р. Кв: В + Н+ ВН+, р. Кв ‑lg. Кв. Величины р. Ка и р. Кв связаны друг с другом простым соотношением, вытекающим из ионного произведения воды: р. Ка = 14 – р. Кв. (6)
 Кислоты, имеющие низкую величину р. Ка и поэтому сильно диссоциированные, называют сильными. Сильные кислоты слабо связывают протон (согласно (4)). Слабые кислоты сильно связывают протон. Ионогенные группы белков Аминокислоты, которые используются при синтезе белков, содержат 2 или более ионогенные группы: -карбоксильную, -аминогруппу и в некоторых аминокислотах – боковую ионогенную группу. При образовании полипептидной белковой цепи -группы исчезают и остаются только боковые. Эти группы, а также значения величины их р. Ка перечислены в табл. 2.
Кислоты, имеющие низкую величину р. Ка и поэтому сильно диссоциированные, называют сильными. Сильные кислоты слабо связывают протон (согласно (4)). Слабые кислоты сильно связывают протон. Ионогенные группы белков Аминокислоты, которые используются при синтезе белков, содержат 2 или более ионогенные группы: -карбоксильную, -аминогруппу и в некоторых аминокислотах – боковую ионогенную группу. При образовании полипептидной белковой цепи -группы исчезают и остаются только боковые. Эти группы, а также значения величины их р. Ка перечислены в табл. 2.
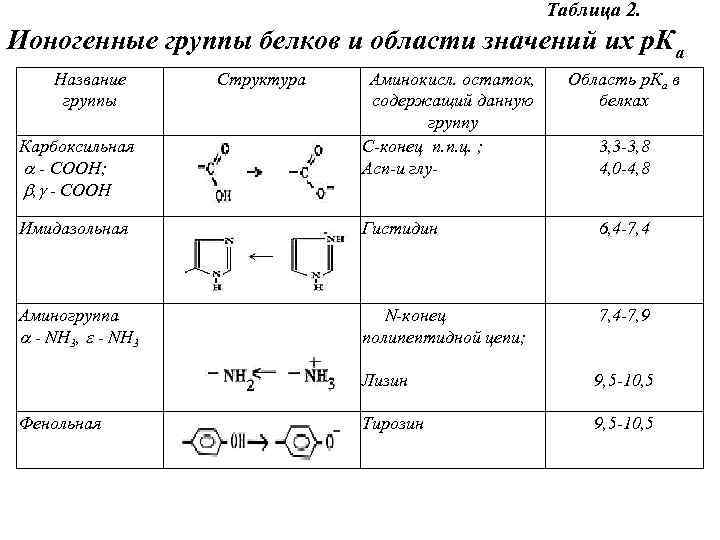 Таблица 2. Ионогенные группы белков и области значений их р. Ка Название группы Карбоксильная - СООН; , - СООН Структура Аминокисл. остаток, содержащий данную группу С-конец п. п. ц. ; Асп-и глу- Область р. Ка в белках 3, 3 -3, 8 4, 0 -4, 8 Имидазольная Гистидин 6, 4 -7, 4 Аминогруппа - NH 3, - NH 3 N-конец полипептидной цепи; 7, 4 -7, 9 Лизин 9, 5 -10, 5 Тирозин 9, 5 -10, 5 Фенольная
Таблица 2. Ионогенные группы белков и области значений их р. Ка Название группы Карбоксильная - СООН; , - СООН Структура Аминокисл. остаток, содержащий данную группу С-конец п. п. ц. ; Асп-и глу- Область р. Ка в белках 3, 3 -3, 8 4, 0 -4, 8 Имидазольная Гистидин 6, 4 -7, 4 Аминогруппа - NH 3, - NH 3 N-конец полипептидной цепи; 7, 4 -7, 9 Лизин 9, 5 -10, 5 Тирозин 9, 5 -10, 5 Фенольная
 Сульфгидриль- ная Цистеин 9, 0 -10, 0 Гуанидиновая Аргинин 12, 0 Фосфатная Фосфотреонин р. К 1 = 2 Фосфосерин р. К 2 = 7, 2 Нуклеиновые кислоты содержат фосфатные группы, липиды – фосфатные и аминогруппы, жирные кислоты – карбоксильные, мукополисахариды – фосфатные, амино- и сульфогруппы.
Сульфгидриль- ная Цистеин 9, 0 -10, 0 Гуанидиновая Аргинин 12, 0 Фосфатная Фосфотреонин р. К 1 = 2 Фосфосерин р. К 2 = 7, 2 Нуклеиновые кислоты содержат фосфатные группы, липиды – фосфатные и аминогруппы, жирные кислоты – карбоксильные, мукополисахариды – фосфатные, амино- и сульфогруппы.
 Как видно, все ионогенные группы содержат атомы азота или кислорода (серы), причем азот входит в основные группы, а кислород (сера) – в кислотные. Атом кислорода – сильный акцептор электрона, тогда как атом азота и водорода – доноры электрона. В результате сильного смещения электронов водорода к атому кислорода в молекуле воды ковалентные связи ослабляются, и вода диссоциирует с образованием Н+ (точнее, Н 2 ОН+). По той же причине диссоциируют карбоксильные и фенольные группы. Атом азота может отдать один из электронов на образование ковалентной связи с протоном Н+:
Как видно, все ионогенные группы содержат атомы азота или кислорода (серы), причем азот входит в основные группы, а кислород (сера) – в кислотные. Атом кислорода – сильный акцептор электрона, тогда как атом азота и водорода – доноры электрона. В результате сильного смещения электронов водорода к атому кислорода в молекуле воды ковалентные связи ослабляются, и вода диссоциирует с образованием Н+ (точнее, Н 2 ОН+). По той же причине диссоциируют карбоксильные и фенольные группы. Атом азота может отдать один из электронов на образование ковалентной связи с протоном Н+:
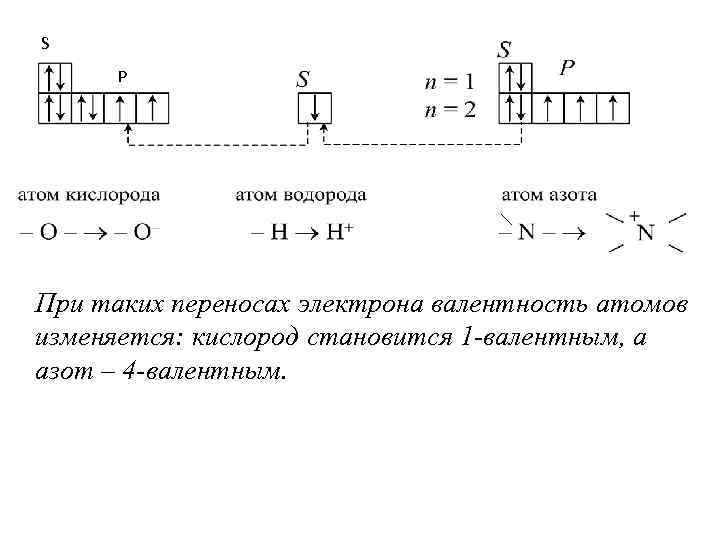 S P При таких переносах электрона валентность атомов изменяется: кислород становится 1 -валентным, а азот – 4 -валентным.
S P При таких переносах электрона валентность атомов изменяется: кислород становится 1 -валентным, а азот – 4 -валентным.
 Влияние окружения на величину р. К Присоединение или отдача Н+ зависит но только от сродства к нему данной химической группы, но и от ее окружения, которое тоже может взаимодействовать с протонами. Например, если вокруг данной группы находятся положительные заряды, то присоединение протона будет затруднено, а величина р. Ка снизится. В общем случае свободная энергия диссоциации данной группы – F = 2, 3 R T р. Кa = 2, 3 R Т(р. К 0) + w, где р. Кa – измеренная величина р. Кa в данном окружении, р. К 0 – величина р. Ка изолированной группы (в отсутствии окружения), а w – энергия взаимодействия окружения с протоном.
Влияние окружения на величину р. К Присоединение или отдача Н+ зависит но только от сродства к нему данной химической группы, но и от ее окружения, которое тоже может взаимодействовать с протонами. Например, если вокруг данной группы находятся положительные заряды, то присоединение протона будет затруднено, а величина р. Ка снизится. В общем случае свободная энергия диссоциации данной группы – F = 2, 3 R T р. Кa = 2, 3 R Т(р. К 0) + w, где р. Кa – измеренная величина р. Кa в данном окружении, р. К 0 – величина р. Ка изолированной группы (в отсутствии окружения), а w – энергия взаимодействия окружения с протоном.
 На величину р. К могут влиять заряды вблизи данной группы: ионная сила раствора; упаковка этой группы в молекуле, скрывающая ее от растворителя, и т. д. Благодаря этим факторам величины р. К для групп данного типа отличаются как в разных белках, так и в разных участках одной и той же белковой молекулы (в табл. 2 указаны обычные пределы этих вариаций). Кривые потенциометрического титрования На рис. 3 представлены идеализированные кривые кислотно-основного титрования кислоты и основания, т. е. показана зависимость степени ионизации (диссоциации) данной группы при различных р. Н раствора.
На величину р. К могут влиять заряды вблизи данной группы: ионная сила раствора; упаковка этой группы в молекуле, скрывающая ее от растворителя, и т. д. Благодаря этим факторам величины р. К для групп данного типа отличаются как в разных белках, так и в разных участках одной и той же белковой молекулы (в табл. 2 указаны обычные пределы этих вариаций). Кривые потенциометрического титрования На рис. 3 представлены идеализированные кривые кислотно-основного титрования кислоты и основания, т. е. показана зависимость степени ионизации (диссоциации) данной группы при различных р. Н раствора.
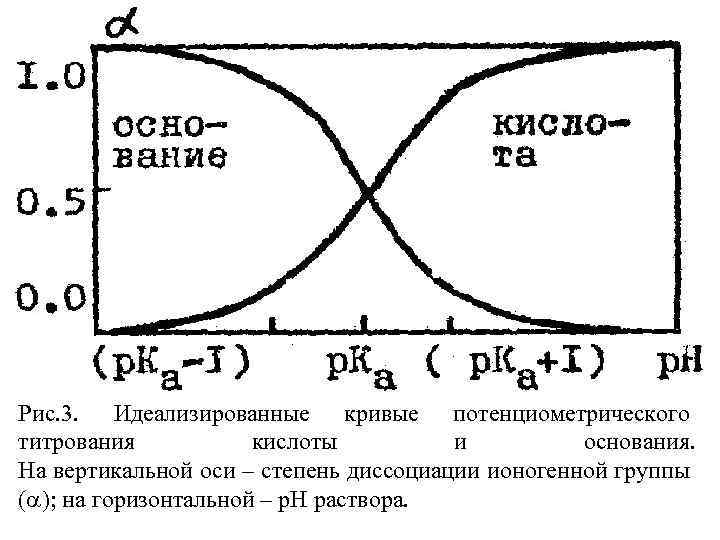 Рис. 3. Идеализированные кривые потенциометрического титрования кислоты и основания. На вертикальной оси – степень диссоциации ионогенной группы ( ); на горизонтальной – р. Н раствора.
Рис. 3. Идеализированные кривые потенциометрического титрования кислоты и основания. На вертикальной оси – степень диссоциации ионогенной группы ( ); на горизонтальной – р. Н раствора.
 Согласно уравнению (3), специфика каждого типа групп не влияет на форму кривой, но определяет только ее положение на шкале р. Н. Титрование белков Если к раствору белка добавить сильную кислоту, то часть появившихся ионов Н+ останется в растворе, а часть присоединится к иогенным белковым группам. Поэтому для того, чтобы изменить р. Н на одну и ту же величину в случае белкового раствора, нужно добавить больше кислоты, чем в отсутствии белка. Разница в количестве добавленной кислоты, отложенная против соответствующего р. Н, и называется кривой титрования белка.
Согласно уравнению (3), специфика каждого типа групп не влияет на форму кривой, но определяет только ее положение на шкале р. Н. Титрование белков Если к раствору белка добавить сильную кислоту, то часть появившихся ионов Н+ останется в растворе, а часть присоединится к иогенным белковым группам. Поэтому для того, чтобы изменить р. Н на одну и ту же величину в случае белкового раствора, нужно добавить больше кислоты, чем в отсутствии белка. Разница в количестве добавленной кислоты, отложенная против соответствующего р. Н, и называется кривой титрования белка.
 Если титруются группы только одного типа, то кривая титрования имеет форму, совпадающую с одной из кривых на рис. 3. Титрование можно вести и в сторону больших р. Н добавлением щелочи. Часто белки титруют от р. Н, который меньше наименьшей величины р. Ка белковых групп (например, от р. Н 3), в щелочную сторону. При этом можно полагать, что в исходной точке кривой титрования (при р. Н 3) все белковые группы находятся в недиссоциированном состоянии (то есть связаны с протоном). Брать слишком низкую величину р. Н 0 нежелательно, так концентрация протонов в растворе будет выше, чем концентрация белковых групп. Поэтому на их нейтрализацию будет пот рачено больше щелочи, чем на нейтрализацию
Если титруются группы только одного типа, то кривая титрования имеет форму, совпадающую с одной из кривых на рис. 3. Титрование можно вести и в сторону больших р. Н добавлением щелочи. Часто белки титруют от р. Н, который меньше наименьшей величины р. Ка белковых групп (например, от р. Н 3), в щелочную сторону. При этом можно полагать, что в исходной точке кривой титрования (при р. Н 3) все белковые группы находятся в недиссоциированном состоянии (то есть связаны с протоном). Брать слишком низкую величину р. Н 0 нежелательно, так концентрация протонов в растворе будет выше, чем концентрация белковых групп. Поэтому на их нейтрализацию будет пот рачено больше щелочи, чем на нейтрализацию
 диссоциировавших из белка протонов, и в результате точность измерений будет невысокой. В связи с тем, что в белках имеется несколько типов групп с разными р. Ка, кривая титрования белка обычно пологая и не имеет четких перегибов, которые свойственны одиночным группам. В этом случае кривую разбивают на области, соответствующие областям титрования тех или иных групп (согласно табл. 2). Количество групп данного типа и среднюю величину их р. Ка определяют в каждой области. При переходе от кислых р. Н к щелочным заряд белка изменяется. Точка, в которой количество отрицательно и положительно заряженных групп одинаково, называется изоэлектрической (p. I).
диссоциировавших из белка протонов, и в результате точность измерений будет невысокой. В связи с тем, что в белках имеется несколько типов групп с разными р. Ка, кривая титрования белка обычно пологая и не имеет четких перегибов, которые свойственны одиночным группам. В этом случае кривую разбивают на области, соответствующие областям титрования тех или иных групп (согласно табл. 2). Количество групп данного типа и среднюю величину их р. Ка определяют в каждой области. При переходе от кислых р. Н к щелочным заряд белка изменяется. Точка, в которой количество отрицательно и положительно заряженных групп одинаково, называется изоэлектрической (p. I).
 Количество ионизированных атомных групп ЧСА при физиологическом значении р. Н раствора Таким образом, используя метод потенциометрического титрования альбумина, можно определить при физиологическом значении р. Н раствора количество его ионизированных атомных группировок. Данные представлены в таблице 3. Таблица 3. Количество ионизированных атомных групп ЧСА при физиологическом значении р. Н раствора, определенных методом потенциометрического титрования
Количество ионизированных атомных групп ЧСА при физиологическом значении р. Н раствора Таким образом, используя метод потенциометрического титрования альбумина, можно определить при физиологическом значении р. Н раствора количество его ионизированных атомных группировок. Данные представлены в таблице 3. Таблица 3. Количество ионизированных атомных групп ЧСА при физиологическом значении р. Н раствора, определенных методом потенциометрического титрования
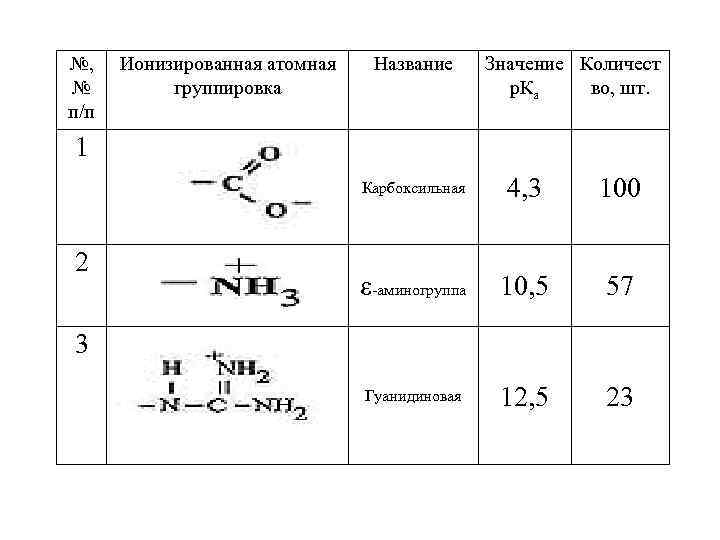 №, № п/п 1 Ионизированная атомная группировка Название 4, 3 100 ε 10, 5 57 Гуанидиновая 12, 5 23 Карбоксильная 2 Значение Количест р. Ка во, шт. -аминогруппа 3
№, № п/п 1 Ионизированная атомная группировка Название 4, 3 100 ε 10, 5 57 Гуанидиновая 12, 5 23 Карбоксильная 2 Значение Количест р. Ка во, шт. -аминогруппа 3
 Изоэлектрическая точка альбумина Изоэлектрическая точка для разных образцов САЧ находится в интервале от 4, 7 до 5, 5 ед. р. Н. Такая гетерогенность альбумина по заряду объясняется связыванием с белком различных заряженных веществ, прежде всего жирных кислот. Интересно отметить, что при возникновении в организме патологических процессов, увеличивается процент «щелочных» фракций альбумина. Метод определения изоэлектрической точки белка Теоретически изоэлектрическая точка (р. НI) может быть определена как величина р. Н раствора, при которой средний заряд молекулы равен нулю.
Изоэлектрическая точка альбумина Изоэлектрическая точка для разных образцов САЧ находится в интервале от 4, 7 до 5, 5 ед. р. Н. Такая гетерогенность альбумина по заряду объясняется связыванием с белком различных заряженных веществ, прежде всего жирных кислот. Интересно отметить, что при возникновении в организме патологических процессов, увеличивается процент «щелочных» фракций альбумина. Метод определения изоэлектрической точки белка Теоретически изоэлектрическая точка (р. НI) может быть определена как величина р. Н раствора, при которой средний заряд молекулы равен нулю.
 Согласно экспериментальному определению (по данным электрофореза), изоэлектрической точкой называется такое значение р. Н, при котором в среднем никакого переноса белка в электрическом поле не происходит. Так как электрофорез проводится только в буферных растворах, содержащих соли, то взаимодействие потоков может привести к ошибкам в определении р. НI. Однако в большинстве случаев теоретическое значение р. НI и экспериментальное почти идентичны. Теоретическое определение изоэлектрической точки может быть осуществлено следующим образом. а) Располагают все ионизирующие группы белка в порядке возрастания значений р. Ка, отмечая число атомных группировок каждого типа.
Согласно экспериментальному определению (по данным электрофореза), изоэлектрической точкой называется такое значение р. Н, при котором в среднем никакого переноса белка в электрическом поле не происходит. Так как электрофорез проводится только в буферных растворах, содержащих соли, то взаимодействие потоков может привести к ошибкам в определении р. НI. Однако в большинстве случаев теоретическое значение р. НI и экспериментальное почти идентичны. Теоретическое определение изоэлектрической точки может быть осуществлено следующим образом. а) Располагают все ионизирующие группы белка в порядке возрастания значений р. Ка, отмечая число атомных группировок каждого типа.
 б) Вычитают из общего числа кислых групп число основных (или наоборот, в зависимости от того, что преобладает). Разность будет соответствовать количеству групп, которые должны быть незаряженными в изоэлектрической точке. Это будут группы с минимальным значением р. Ка. в) Изоэлектрическую точку находят из уравнения р. НI = р. Ка + lg[ /(1 - )], (7) где р. Ка относится к группам, из которых только часть ионизирована; характеризует степень ионизации этих групп. В том случае, если число кислых групп совпадает с числом основных, р. НI определяют как среднее арифметическое от р. Ка этих групп.
б) Вычитают из общего числа кислых групп число основных (или наоборот, в зависимости от того, что преобладает). Разность будет соответствовать количеству групп, которые должны быть незаряженными в изоэлектрической точке. Это будут группы с минимальным значением р. Ка. в) Изоэлектрическую точку находят из уравнения р. НI = р. Ка + lg[ /(1 - )], (7) где р. Ка относится к группам, из которых только часть ионизирована; характеризует степень ионизации этих групп. В том случае, если число кислых групп совпадает с числом основных, р. НI определяют как среднее арифметическое от р. Ка этих групп.
 Определение изоэлектрической точки ЧСА Вычислим изоэлектрическую точку ЧСА. Как было показано выше в таблице № 3, альбумин содержит следующее количество заряженных групп: 100 карбоксильных групп с р. Ка = 4, 3(см. табл. 3); 57 -аминогрупп с р. Ка = 10, 5; 23 гуанидиновых групп с р. Ка = 12, 5. Число катионных групп в ЧСА будет равно 57 + 23 = 80. Очевидно, что в изоэлектрической точке должно быть 80 ионизированных карбоксил-анионных групп и 20 неионизированных карбоксильных групп. Тогда для карбоксильных групп получим степень ионизации = 80/100, а уравнение для вычисления изоэлектрической точки будет таким (см. уравнение 7):
Определение изоэлектрической точки ЧСА Вычислим изоэлектрическую точку ЧСА. Как было показано выше в таблице № 3, альбумин содержит следующее количество заряженных групп: 100 карбоксильных групп с р. Ка = 4, 3(см. табл. 3); 57 -аминогрупп с р. Ка = 10, 5; 23 гуанидиновых групп с р. Ка = 12, 5. Число катионных групп в ЧСА будет равно 57 + 23 = 80. Очевидно, что в изоэлектрической точке должно быть 80 ионизированных карбоксил-анионных групп и 20 неионизированных карбоксильных групп. Тогда для карбоксильных групп получим степень ионизации = 80/100, а уравнение для вычисления изоэлектрической точки будет таким (см. уравнение 7):