86c938010172833480c12db4cb1bed84.ppt
- Количество слайдов: 53
 Статистические аспекты клинических испытаний: от планирования до отчета
Статистические аспекты клинических испытаний: от планирования до отчета
 РОЛЬ СТАТИСТИЧЕСКИХ МЕТОДОВ ПРИ ПРОВЕДЕНИИ КЛИНИЧЕСКИХ ИСПЫТАНИЙ «…статистика — это совокупность методов, которые дают нам возможность принимать оптимальные решения в условиях неопределенности. » Абрахем Вальд В области клинических испытаний статистические методы являются одним из инструментов получения научно обоснованных доказательств эффективности и безопасности испытываемых лекарственных средств
РОЛЬ СТАТИСТИЧЕСКИХ МЕТОДОВ ПРИ ПРОВЕДЕНИИ КЛИНИЧЕСКИХ ИСПЫТАНИЙ «…статистика — это совокупность методов, которые дают нам возможность принимать оптимальные решения в условиях неопределенности. » Абрахем Вальд В области клинических испытаний статистические методы являются одним из инструментов получения научно обоснованных доказательств эффективности и безопасности испытываемых лекарственных средств
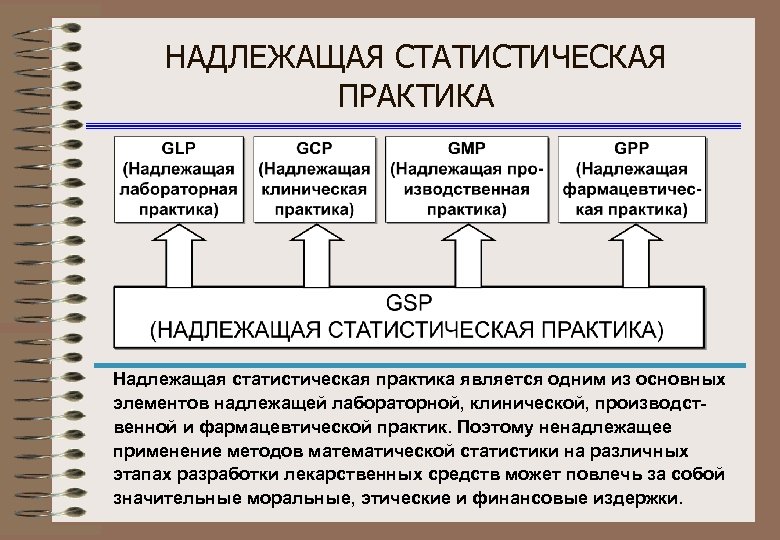 НАДЛЕЖАЩАЯ СТАТИСТИЧЕСКАЯ ПРАКТИКА Надлежащая статистическая практика является одним из основных элементов надлежащей лабораторной, клинической, производственной и фармацевтической практик. Поэтому ненадлежащее применение методов математической статистики на различных этапах разработки лекарственных средств может повлечь за собой значительные моральные, этические и финансовые издержки.
НАДЛЕЖАЩАЯ СТАТИСТИЧЕСКАЯ ПРАКТИКА Надлежащая статистическая практика является одним из основных элементов надлежащей лабораторной, клинической, производственной и фармацевтической практик. Поэтому ненадлежащее применение методов математической статистики на различных этапах разработки лекарственных средств может повлечь за собой значительные моральные, этические и финансовые издержки.
 Этапы клинических испытаний на которых требуется применение статистических методов ü На этапе планирования ― При разработке протокола ― При разработке схемы рандомизации ― При разработке ИРФ ü На этапе статистической обработки результатов испытания ü На этапе интерпретации полученных результатов при подготовке окончательного отчета
Этапы клинических испытаний на которых требуется применение статистических методов ü На этапе планирования ― При разработке протокола ― При разработке схемы рандомизации ― При разработке ИРФ ü На этапе статистической обработки результатов испытания ü На этапе интерпретации полученных результатов при подготовке окончательного отчета
 Лицо, отвечающее за правильность использования статистических методов при проведении КИ «Биостатистик – это специалист в области прикладной статистики, имеющий соответствующее образование или прошедший специальный курс обучения, а также имеющий опыт, достаточный для выполнения требований по применению методов статистического анализа при планировании и проведении клинических испытаний. »
Лицо, отвечающее за правильность использования статистических методов при проведении КИ «Биостатистик – это специалист в области прикладной статистики, имеющий соответствующее образование или прошедший специальный курс обучения, а также имеющий опыт, достаточный для выполнения требований по применению методов статистического анализа при планировании и проведении клинических испытаний. »
 Сравнительные клинические испытания Роль статистика на этапе планирования ü Участие в обсуждении плана (дизайна) испытания ü Обоснование и выбор метода распределения пациентов по группам ü Выбор соответствующих реальным ограничениям методов статистического анализа ü Статистическое обоснование размера выборки ü Участие в разработке ИРФ
Сравнительные клинические испытания Роль статистика на этапе планирования ü Участие в обсуждении плана (дизайна) испытания ü Обоснование и выбор метода распределения пациентов по группам ü Выбор соответствующих реальным ограничениям методов статистического анализа ü Статистическое обоснование размера выборки ü Участие в разработке ИРФ
 Клинические испытания Статистический вывод «… это перенос заключений, сделанных в результате статистического анализа выборочных дан-ных на целевую генеральную совокупность. »
Клинические испытания Статистический вывод «… это перенос заключений, сделанных в результате статистического анализа выборочных дан-ных на целевую генеральную совокупность. »
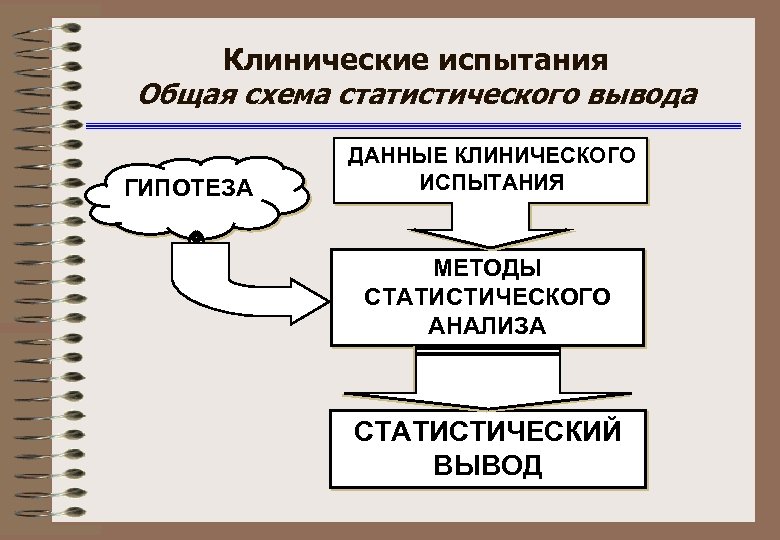 Клинические испытания Общая схема статистического вывода ГИПОТЕЗА ДАННЫЕ КЛИНИЧЕСКОГО ИСПЫТАНИЯ МЕТОДЫ СТАТИСТИЧЕСКОГО АНАЛИЗА СТАТИСТИЧЕСКИЙ ВЫВОД
Клинические испытания Общая схема статистического вывода ГИПОТЕЗА ДАННЫЕ КЛИНИЧЕСКОГО ИСПЫТАНИЯ МЕТОДЫ СТАТИСТИЧЕСКОГО АНАЛИЗА СТАТИСТИЧЕСКИЙ ВЫВОД
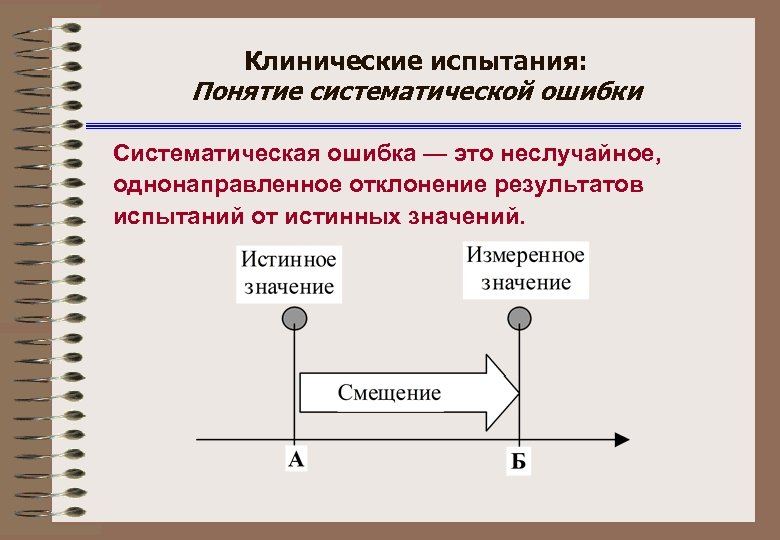 Клинические испытания: Понятие систематической ошибки Систематическая ошибка — это неслучайное, однонаправленное отклонение результатов испытаний от истинных значений.
Клинические испытания: Понятие систематической ошибки Систематическая ошибка — это неслучайное, однонаправленное отклонение результатов испытаний от истинных значений.
 Клинические испытания Виды систематических ошибок При проведении клинических испытаний, систематическая ошибка может возникать: Øиз-за систематических различий в сравниваемых группах (систематическая ошибка связанная с формированием выборки); Øиз-за влияния каких-либо побочных факторов или сопутствующего лечения, помимо исследуемого метода лечения (систематическая ошибка, связанная с проведением испытания); Øиз-за выбывания или исключения пациентов из исследования (систематическая ошибка, связанная с отсевом); Øиз-за метода выявления исходов (систематическая ошибка, связанная с выявлением исхода).
Клинические испытания Виды систематических ошибок При проведении клинических испытаний, систематическая ошибка может возникать: Øиз-за систематических различий в сравниваемых группах (систематическая ошибка связанная с формированием выборки); Øиз-за влияния каких-либо побочных факторов или сопутствующего лечения, помимо исследуемого метода лечения (систематическая ошибка, связанная с проведением испытания); Øиз-за выбывания или исключения пациентов из исследования (систематическая ошибка, связанная с отсевом); Øиз-за метода выявления исходов (систематическая ошибка, связанная с выявлением исхода).
 Клинические испытания Методы минимизации систематической ошибки Ø Наличие группы сравнения Ø Маскирование метода лечения как для пациентов, так и для исследователей Ø Использование рандомизации Ø Применение специальных статистических методов при обработке данных (например, ковариационного анализа)
Клинические испытания Методы минимизации систематической ошибки Ø Наличие группы сравнения Ø Маскирование метода лечения как для пациентов, так и для исследователей Ø Использование рандомизации Ø Применение специальных статистических методов при обработке данных (например, ковариационного анализа)
 Клинические испытания РАНДОМИЗАЦИЯ «…это процесс случайного распределения пациентов в группы лечения, с целью исключить всякую необъективность и связанное с ней вероятное смещение оценки. » Она гарантирует: Ø Что наклонности и предпочтения исследователя не повлияют на формирование групп с различными методами лечения Ø Устранение опасности «перестараться» при учете личных предпочтений, что может привести к противоположным смещениям
Клинические испытания РАНДОМИЗАЦИЯ «…это процесс случайного распределения пациентов в группы лечения, с целью исключить всякую необъективность и связанное с ней вероятное смещение оценки. » Она гарантирует: Ø Что наклонности и предпочтения исследователя не повлияют на формирование групп с различными методами лечения Ø Устранение опасности «перестараться» при учете личных предпочтений, что может привести к противоположным смещениям
 Клинические испытания: Преимущества рандомизации Рандомизация имеет три основных преимущества: Ø При рандомизации сводится к минимуму вероятность возникновения систематической ошибки, связанной с отбором испытуемых. Нерандомизированное отнесение испытуемых к той или иной группе затрудняет сравнение применявшихся методов лечения, поскольку сознательно или несознательно могли быть сформированы неоднородные группы. Ø Рандомизация облегчает маскирование методов лечения от исследователей, больных или лиц, оценивающих клинические исходы, например, путем использования плацебо, что снижает вероятность возникновения систематической ошибки после назначения лечения. Ø При использовании рандомизации становится возможным статистически выразить степень правдоподобия того, что различия в частоте клинических исходов между группами являются случайными.
Клинические испытания: Преимущества рандомизации Рандомизация имеет три основных преимущества: Ø При рандомизации сводится к минимуму вероятность возникновения систематической ошибки, связанной с отбором испытуемых. Нерандомизированное отнесение испытуемых к той или иной группе затрудняет сравнение применявшихся методов лечения, поскольку сознательно или несознательно могли быть сформированы неоднородные группы. Ø Рандомизация облегчает маскирование методов лечения от исследователей, больных или лиц, оценивающих клинические исходы, например, путем использования плацебо, что снижает вероятность возникновения систематической ошибки после назначения лечения. Ø При использовании рандомизации становится возможным статистически выразить степень правдоподобия того, что различия в частоте клинических исходов между группами являются случайными.
 Клинические испытания : ЭФФЕКТИВНОСТЬ РАНДОМИЗАЦИИ Правильно проведенная рандомизация исключает вероятность возникновения систематической ошибки, связанной с отбором участников, и относится к важнейшим составляющим высококачественного РКИ. Чтобы рандомизация была эффективной, она должна включать в себя 2 этапа: 1. Генерацию непредсказуемой последовательности включения участников в группы 2. Сокрытие данной последовательности от лиц, осуществляющих это включение
Клинические испытания : ЭФФЕКТИВНОСТЬ РАНДОМИЗАЦИИ Правильно проведенная рандомизация исключает вероятность возникновения систематической ошибки, связанной с отбором участников, и относится к важнейшим составляющим высококачественного РКИ. Чтобы рандомизация была эффективной, она должна включать в себя 2 этапа: 1. Генерацию непредсказуемой последовательности включения участников в группы 2. Сокрытие данной последовательности от лиц, осуществляющих это включение
 Клинические испытания : Типы рандомизации и способы распределения пациентов по группам ØФиксированная рандомизация: §Простая §Блоковая §Стратифицированная ØДинамическое распределение: §Метод «несимметричной монеты» §Адаптивная рандомизация §Минимизация Применяемый метод рандомизации должен быть достаточно детально описан в протоколе КИ.
Клинические испытания : Типы рандомизации и способы распределения пациентов по группам ØФиксированная рандомизация: §Простая §Блоковая §Стратифицированная ØДинамическое распределение: §Метод «несимметричной монеты» §Адаптивная рандомизация §Минимизация Применяемый метод рандомизации должен быть достаточно детально описан в протоколе КИ.
 Клинические испытания: Способы реализации рандомизации ØРандомизация в исследовательском центре: §Посредством списка кодов §Используя запечатанные конверты §Последовательно пронумерованный препарат ØЦентральная рандомизация §Посредством телефонной связи §По названию препарата §По номеру лота
Клинические испытания: Способы реализации рандомизации ØРандомизация в исследовательском центре: §Посредством списка кодов §Используя запечатанные конверты §Последовательно пронумерованный препарат ØЦентральная рандомизация §Посредством телефонной связи §По названию препарата §По номеру лота
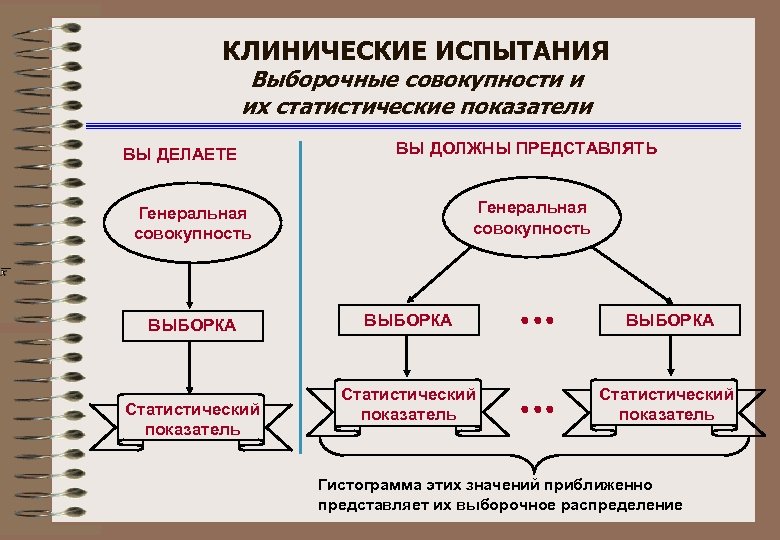 КЛИНИЧЕСКИЕ ИСПЫТАНИЯ Выборочные совокупности и их статистические показатели ВЫ ДЕЛАЕТЕ ВЫ ДОЛЖНЫ ПРЕДСТАВЛЯТЬ Генеральная совокупность ВЫБОРКА Статистический показатель Статистический показатель Гистограмма этих значений приближенно представляет их выборочное распределение
КЛИНИЧЕСКИЕ ИСПЫТАНИЯ Выборочные совокупности и их статистические показатели ВЫ ДЕЛАЕТЕ ВЫ ДОЛЖНЫ ПРЕДСТАВЛЯТЬ Генеральная совокупность ВЫБОРКА Статистический показатель Статистический показатель Гистограмма этих значений приближенно представляет их выборочное распределение
 Клинические испытания: Генеральная совокупность ГЕНЕРАЛЬНАЯ СОВОКУПНОСТЬ (ПОПУЛЯЦИЯ) ПРИ ПРОВЕДЕНИИ КЛНИЧЕСКОГО ИСПЫТАНИЯ – все потенциальные пациенты, соответствующие критериям включения / исключения данного испытания. Выводы, полученные на основании результатов клинического испытания корректно распространять лишь на генеральную совокупность. ! При извлечении из генеральной совокупности случайных выборок, вычисленные для этих выборок показатели (например, отношение рисков) БУДУТ ОТЛИЧАТЬСЯ. Значения этих показателей будут распределены по определенному закону.
Клинические испытания: Генеральная совокупность ГЕНЕРАЛЬНАЯ СОВОКУПНОСТЬ (ПОПУЛЯЦИЯ) ПРИ ПРОВЕДЕНИИ КЛНИЧЕСКОГО ИСПЫТАНИЯ – все потенциальные пациенты, соответствующие критериям включения / исключения данного испытания. Выводы, полученные на основании результатов клинического испытания корректно распространять лишь на генеральную совокупность. ! При извлечении из генеральной совокупности случайных выборок, вычисленные для этих выборок показатели (например, отношение рисков) БУДУТ ОТЛИЧАТЬСЯ. Значения этих показателей будут распределены по определенному закону.
 Клинические испытания: Точечные оценки Точечная оценка – это оценка определенного показателя, полученная на одной выборке. Например, величина систолического артериального давления или относительный риск развития побочной реакции. Однако, в случае проведения другого такого же исследования, будет получена ДРУГАЯ ТОЧЕЧНАЯ ОЦЕНКА. Истинное значение точечной оценки будет получено лишь при включении в испытание ВСЕЙ ГЕНЕРАЛЬНОЙ СОВОКУПНОСТИ пациентов, что практически выполнить невозможно. Истинное значение точечной оценки и оцененное ее значение по выборочным данным практически никогда не совпадают. Истинное значение 0 Оцененное значение 1
Клинические испытания: Точечные оценки Точечная оценка – это оценка определенного показателя, полученная на одной выборке. Например, величина систолического артериального давления или относительный риск развития побочной реакции. Однако, в случае проведения другого такого же исследования, будет получена ДРУГАЯ ТОЧЕЧНАЯ ОЦЕНКА. Истинное значение точечной оценки будет получено лишь при включении в испытание ВСЕЙ ГЕНЕРАЛЬНОЙ СОВОКУПНОСТИ пациентов, что практически выполнить невозможно. Истинное значение точечной оценки и оцененное ее значение по выборочным данным практически никогда не совпадают. Истинное значение 0 Оцененное значение 1
 Клинические испытания: Интервальные оценки Для большинства случаев точечной оценки статистического показателя недостаточно. Желательно еще с определенным уровнем доверия оценить интервал, в котором может с заданной вероятностью находиться истинное значение оцениваемого параметра генеральной совокупности. Для этого используются ДОВЕРИТЕЛЬНЫЕ ИНТЕРВАЛЫ. Оцененное по выборке значение статистического показателя (например, отношение рисков, шансов) Полуширина доверительного интервала Верхняя граница Нижняя граница 0 1 В этих пределах может находиться истинное значение интересующего исследователя параметра с заданной доверительной вероятностью
Клинические испытания: Интервальные оценки Для большинства случаев точечной оценки статистического показателя недостаточно. Желательно еще с определенным уровнем доверия оценить интервал, в котором может с заданной вероятностью находиться истинное значение оцениваемого параметра генеральной совокупности. Для этого используются ДОВЕРИТЕЛЬНЫЕ ИНТЕРВАЛЫ. Оцененное по выборке значение статистического показателя (например, отношение рисков, шансов) Полуширина доверительного интервала Верхняя граница Нижняя граница 0 1 В этих пределах может находиться истинное значение интересующего исследователя параметра с заданной доверительной вероятностью
 Клинические испытания Доверительный интервал и его ширина Доверительный интервал (ДИ) — интервал, относительно которого с наперед заданной вероятностью P=1 - можно утверждать, что он содержит неизвестное значение параметра оцениваемого параметра генеральной совокупности, где 1 - — доверительная вероятность, — уровень значимости. Обычно указывают 95% доверительный интервал означает, что истинное значение величины параметра, вычисленного на основе выборочных данных, с вероятностью в 95% находится в пределах этого интервала. 99, 9% ДИ 95% ДИ 90% ДИ Стандартное отклонение (2 = 68, 2 %) Выборочное значение параметра
Клинические испытания Доверительный интервал и его ширина Доверительный интервал (ДИ) — интервал, относительно которого с наперед заданной вероятностью P=1 - можно утверждать, что он содержит неизвестное значение параметра оцениваемого параметра генеральной совокупности, где 1 - — доверительная вероятность, — уровень значимости. Обычно указывают 95% доверительный интервал означает, что истинное значение величины параметра, вычисленного на основе выборочных данных, с вероятностью в 95% находится в пределах этого интервала. 99, 9% ДИ 95% ДИ 90% ДИ Стандартное отклонение (2 = 68, 2 %) Выборочное значение параметра
 Клинические испытания: Свойства доверительного интервала Совойства ДИ: 1. При помощи ДИ можно проверять статистические гипотезы (например, если доверительный интервал отношения рисков включает 1, то мы можем сделать вывод, что при заданном уровне значимости риски в группах отличаются статистически незначимо). 2. Широкий ДИ указывает на неточность оценки. Ширина ДИ характеризует степень нашего незнания. 3. Доверительные интервалы дают больше информации о параметре, чем простая точечная оценка. 4. Ширина ДИ зависит от стандартной ошибки, которая, в свою очередь, зависит от объема выборки.
Клинические испытания: Свойства доверительного интервала Совойства ДИ: 1. При помощи ДИ можно проверять статистические гипотезы (например, если доверительный интервал отношения рисков включает 1, то мы можем сделать вывод, что при заданном уровне значимости риски в группах отличаются статистически незначимо). 2. Широкий ДИ указывает на неточность оценки. Ширина ДИ характеризует степень нашего незнания. 3. Доверительные интервалы дают больше информации о параметре, чем простая точечная оценка. 4. Ширина ДИ зависит от стандартной ошибки, которая, в свою очередь, зависит от объема выборки.
 ТИПЫ СРАВНИТЕЛЬНЫХ КЛИНЧЕСКИХ ИСПЫТАНИЙ ü На превышающую эффективность Испытания, целью которых является доказательство того, что один препарат лучше другого препарата по показателю эффективности (одному или нескольким) при лечении определенного заболевания (заболеваний). ü На неуступающую эффективность Испытания, целью которых является доказательство того, что испытываемый препарат не хуже референтного по показателю (показателям) эффективности при лечении определенного заболевания (заболеваний). ü На терапевтическую эквивалентность Испытания, целю которых является доказательство терапевтической эквивалентности испытываемого препарата референтному при лечении определенного заболевания (заболеваний).
ТИПЫ СРАВНИТЕЛЬНЫХ КЛИНЧЕСКИХ ИСПЫТАНИЙ ü На превышающую эффективность Испытания, целью которых является доказательство того, что один препарат лучше другого препарата по показателю эффективности (одному или нескольким) при лечении определенного заболевания (заболеваний). ü На неуступающую эффективность Испытания, целью которых является доказательство того, что испытываемый препарат не хуже референтного по показателю (показателям) эффективности при лечении определенного заболевания (заболеваний). ü На терапевтическую эквивалентность Испытания, целю которых является доказательство терапевтической эквивалентности испытываемого препарата референтному при лечении определенного заболевания (заболеваний).
 Клинические испытания Проверка статистических гипотез: нулевая гипотеза и альтернативная гипотеза НУЛЕВОЙ ГИПОТЕЗОЙ называется статистическая гипотеза, справедливость которой проверяется при статистической проверке гипотез. Нулевая гипотеза обычно обозначается как Н 0. Наряду с нулевой гипотезой рассматривают АЛЬТЕРНАТИВНУЮ или КОНКУРИРУЮЩУЮ гипотезу Н 1, являющуюся логическим отрицанием Н 0. В клинических исследованиях нулевая и альтернативная гипотезы зависят от типа исследований.
Клинические испытания Проверка статистических гипотез: нулевая гипотеза и альтернативная гипотеза НУЛЕВОЙ ГИПОТЕЗОЙ называется статистическая гипотеза, справедливость которой проверяется при статистической проверке гипотез. Нулевая гипотеза обычно обозначается как Н 0. Наряду с нулевой гипотезой рассматривают АЛЬТЕРНАТИВНУЮ или КОНКУРИРУЮЩУЮ гипотезу Н 1, являющуюся логическим отрицанием Н 0. В клинических исследованиях нулевая и альтернативная гипотезы зависят от типа исследований.
 Клинические испытания Нулевая гипотеза для превышающей эффективности Для КИ на превышающую эффективность: Нулевая гипотеза (Н 0): Состоит в том, что различия между испытываемым препаратом и референтным меньше величины клинически значимых различий . Альтернативная гипотеза (Н 1): Состоит в том, что эффективность испытываемого препарата выше эффективности референтного на величину, превышающую величину клинически значимых различий .
Клинические испытания Нулевая гипотеза для превышающей эффективности Для КИ на превышающую эффективность: Нулевая гипотеза (Н 0): Состоит в том, что различия между испытываемым препаратом и референтным меньше величины клинически значимых различий . Альтернативная гипотеза (Н 1): Состоит в том, что эффективность испытываемого препарата выше эффективности референтного на величину, превышающую величину клинически значимых различий .
 Клинические испытания Нулевая гипотеза для неуступающей эффективности Для КИ на неуступающую эффективность: Нулевая гипотеза (Н 0): Состоит в том, что различия между испытываемым препаратом и референтным меньше величины клинически значимых различий -. Альтернативная гипотеза (Н 1): Состоит в том, что различия эффективности испытываемого препарата не меньше эффективности референтного на величину, превышающую величину клинически значимых различий .
Клинические испытания Нулевая гипотеза для неуступающей эффективности Для КИ на неуступающую эффективность: Нулевая гипотеза (Н 0): Состоит в том, что различия между испытываемым препаратом и референтным меньше величины клинически значимых различий -. Альтернативная гипотеза (Н 1): Состоит в том, что различия эффективности испытываемого препарата не меньше эффективности референтного на величину, превышающую величину клинически значимых различий .
 Клинические испытания Нулевая гипотеза для терапевтической эквивалентности Для КИ терапевтической эквивалентности: Нулевая гипотеза (Н 0): состоит в том, что различия эффективности исследуемых препаратов, имеющие, по крайней мере, размер , существуют. Альтернативная гипотеза (Н 1): состоит в том, что эффективности исследуемых препаратов отличаются статистически незначимо, то есть наблюдаемые различия вместе с доверительными интервалами не больше клинически значимой величины, .
Клинические испытания Нулевая гипотеза для терапевтической эквивалентности Для КИ терапевтической эквивалентности: Нулевая гипотеза (Н 0): состоит в том, что различия эффективности исследуемых препаратов, имеющие, по крайней мере, размер , существуют. Альтернативная гипотеза (Н 1): состоит в том, что эффективности исследуемых препаратов отличаются статистически незначимо, то есть наблюдаемые различия вместе с доверительными интервалами не больше клинически значимой величины, .
 Клинические испытания Вероятностные ошибки статистического вывода при испытаниях эквивалентности ИСТИНА: Препараты ВЫВОД Эквивалентны Не эквивалентны Истинно эквивалентны Ошибка 1 -го рода Ошибка 2 -го рода Истинно не эквивалентны
Клинические испытания Вероятностные ошибки статистического вывода при испытаниях эквивалентности ИСТИНА: Препараты ВЫВОД Эквивалентны Не эквивалентны Истинно эквивалентны Ошибка 1 -го рода Ошибка 2 -го рода Истинно не эквивалентны
 Сравнительные клинические испытания Статистический вывод: ошибка 1 -го рода и уровень значимости «…это вероятность того, что вывод об эквивалентности препаратов является ошибочным. » ØПри статистическом анализе обычно задается граничная вероятность совершения ошибки 1 -го рода, называемая уровнем значимости . ØОбычно уровень значимости берут равным 0, 05. Это означает, что мы допускаем вероятность ошибиться в 5% случаев. ØУровень значимости должен быть отображен в протоколе клинического исследования в разделе плана статистического анализа.
Сравнительные клинические испытания Статистический вывод: ошибка 1 -го рода и уровень значимости «…это вероятность того, что вывод об эквивалентности препаратов является ошибочным. » ØПри статистическом анализе обычно задается граничная вероятность совершения ошибки 1 -го рода, называемая уровнем значимости . ØОбычно уровень значимости берут равным 0, 05. Это означает, что мы допускаем вероятность ошибиться в 5% случаев. ØУровень значимости должен быть отображен в протоколе клинического исследования в разделе плана статистического анализа.
 Клинические испытания Проверка статистических гипотез: достигнутый уровень значимости (р-значение) p – это вероятность справедливости нулевой гипотезы (достигнутый уровень значимости) Обычно, при проверке гипотезы об отсутствии эквивалентности, если p < , то нулевая гипотеза об отсутствии эквивалентности отклоняется в пользу альтернативной.
Клинические испытания Проверка статистических гипотез: достигнутый уровень значимости (р-значение) p – это вероятность справедливости нулевой гипотезы (достигнутый уровень значимости) Обычно, при проверке гипотезы об отсутствии эквивалентности, если p < , то нулевая гипотеза об отсутствии эквивалентности отклоняется в пользу альтернативной.
 СТАТИСТИЧЕСКИЙ ВЫВОД: клиническая и статистическая значимость p < 0, 05 Значение «р» не может быть доказательством эффективности лечения. Значение p<0, 05 свидетельствуют ТОЛЬКО, о том, что различия между группами не случайны Статистическая значимость полученных результатов автоматически не означает их клинической значимости
СТАТИСТИЧЕСКИЙ ВЫВОД: клиническая и статистическая значимость p < 0, 05 Значение «р» не может быть доказательством эффективности лечения. Значение p<0, 05 свидетельствуют ТОЛЬКО, о том, что различия между группами не случайны Статистическая значимость полученных результатов автоматически не означает их клинической значимости
 Клинические испытания Статистический вывод: ошибка 2 -го рода «… это вероятность сделать вывод о том, что два исследуемых препарата являются не эквивалентными, в то время как, в действительности, они эквивалентны. » Ø Обычно обозначается символом « » и ее граничная величина задается равной 0, 2. Однако, в испытаниях эквивалентности, иногда, эта величина уменьшается до 0, 1.
Клинические испытания Статистический вывод: ошибка 2 -го рода «… это вероятность сделать вывод о том, что два исследуемых препарата являются не эквивалентными, в то время как, в действительности, они эквивалентны. » Ø Обычно обозначается символом « » и ее граничная величина задается равной 0, 2. Однако, в испытаниях эквивалентности, иногда, эта величина уменьшается до 0, 1.
 Клинические испытания Статистический вывод: статистическая мощность «… это вероятность доказать эквивалентность, если она действительно существует. » МОЩНОСТЬ = 1 – (ошибка 2 -го рода) Другое название мощности – ЧУВСТВИТЕЛЬНОСТЬ ØЧувствительность зависит от величины клинически важных различий ( ), разброса данных и объема выборки. Обычно для испытаний ее берут равной 80%.
Клинические испытания Статистический вывод: статистическая мощность «… это вероятность доказать эквивалентность, если она действительно существует. » МОЩНОСТЬ = 1 – (ошибка 2 -го рода) Другое название мощности – ЧУВСТВИТЕЛЬНОСТЬ ØЧувствительность зависит от величины клинически важных различий ( ), разброса данных и объема выборки. Обычно для испытаний ее берут равной 80%.
 Клинические испытания Вывод об эквивалентности, неуступающей или превышающей эффективности препаратов В настоящее время вывод о терапевтической эквивалентности, неуступающей или превышающей эффективности делается с использованием подхода, основанного на доверительных интервалах. Суть этого подхода состоит в следующем: 1. 2. 3. Находятся различия между группами (например, разность средних или долей положительных результатов). Находятся границы 95% доверительного интервала для найденной разности. Границы доверительного интервала сравниваются с границами зоны эквивалентности (неуступающей или превышающей эффективности). Если нижняя граница доверительного интервала больше нижней границы зоны эквивалентности, а верхняя граница ДИ меньше верхней границы зоны эквивалентности, то два препарата считаются эквивалентными по сравниваемым показателям.
Клинические испытания Вывод об эквивалентности, неуступающей или превышающей эффективности препаратов В настоящее время вывод о терапевтической эквивалентности, неуступающей или превышающей эффективности делается с использованием подхода, основанного на доверительных интервалах. Суть этого подхода состоит в следующем: 1. 2. 3. Находятся различия между группами (например, разность средних или долей положительных результатов). Находятся границы 95% доверительного интервала для найденной разности. Границы доверительного интервала сравниваются с границами зоны эквивалентности (неуступающей или превышающей эффективности). Если нижняя граница доверительного интервала больше нижней границы зоны эквивалентности, а верхняя граница ДИ меньше верхней границы зоны эквивалентности, то два препарата считаются эквивалентными по сравниваемым показателям.
 Испытания эквивалентности генериков: Принятие решения на основе ДИ (для нормально распределенных данных) Принятие решения в случае 100 (1 -2 )% двусторонних ДИ для разности средних ПРЕПАРАТЫ ЭКВИВАЛЕНТНЫ 0 ПРЕПАРАТЫ НЕ ЭКВИВАЛЕНТНЫ 0
Испытания эквивалентности генериков: Принятие решения на основе ДИ (для нормально распределенных данных) Принятие решения в случае 100 (1 -2 )% двусторонних ДИ для разности средних ПРЕПАРАТЫ ЭКВИВАЛЕНТНЫ 0 ПРЕПАРАТЫ НЕ ЭКВИВАЛЕНТНЫ 0
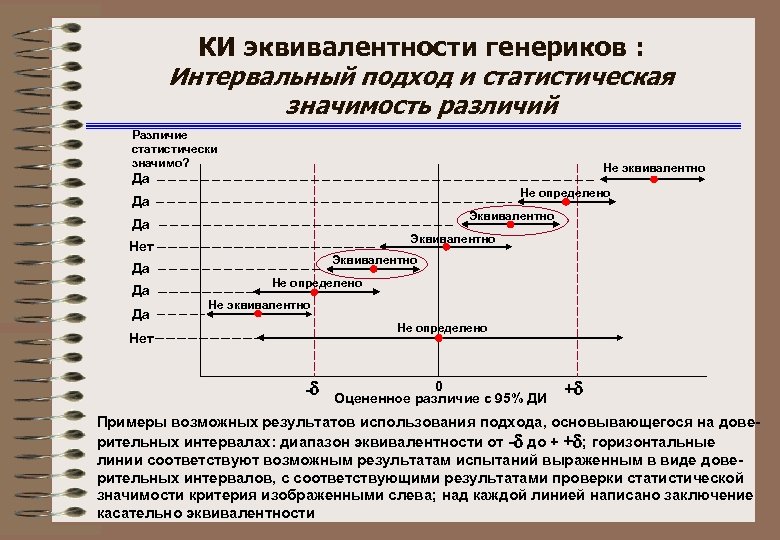 КИ эквивалентности генериков : Интервальный подход и статистическая значимость различий Различие статистически значимо? Не эквивалентно Да Не определено Да Эквивалентно Нет Эквивалентно Да Да Да Не определено Не эквивалентно Не определено Нет - 0 Оцененное различие с 95% ДИ + Примеры возможных результатов использования подхода, основывающегося на доверительных интервалах: диапазон эквивалентности от - до + + ; горизонтальные линии соответствуют возможным результатам испытаний выраженным в виде доверительных интервалов, с соответствующими результатами проверки статистической значимости критерия изображенными слева; над каждой линией написано заключение касательно эквивалентности
КИ эквивалентности генериков : Интервальный подход и статистическая значимость различий Различие статистически значимо? Не эквивалентно Да Не определено Да Эквивалентно Нет Эквивалентно Да Да Да Не определено Не эквивалентно Не определено Нет - 0 Оцененное различие с 95% ДИ + Примеры возможных результатов использования подхода, основывающегося на доверительных интервалах: диапазон эквивалентности от - до + + ; горизонтальные линии соответствуют возможным результатам испытаний выраженным в виде доверительных интервалов, с соответствующими результатами проверки статистической значимости критерия изображенными слева; над каждой линией написано заключение касательно эквивалентности
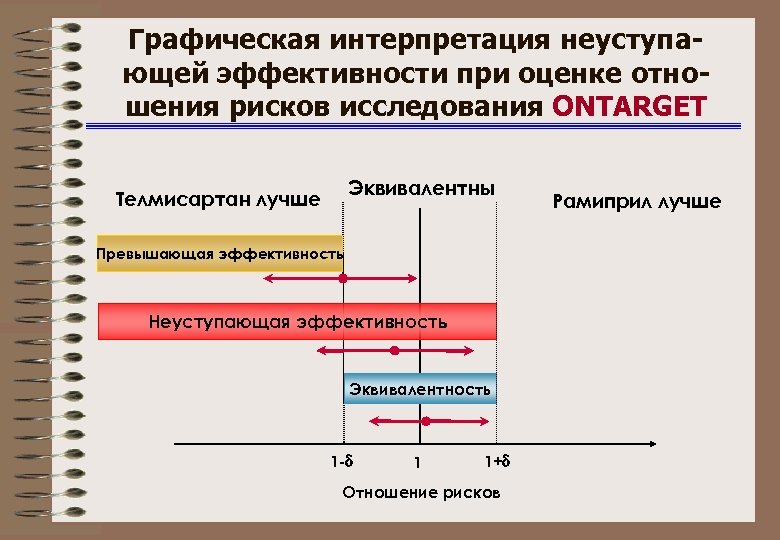 Графическая интерпретация неуступающей эффективности при оценке отношения рисков исcледования ONTARGET Эквивалентны Телмисартан лучше Превышающая эффективность Неуступающая эффективность Эквивалентность 1 - 1 1+ Отношение рисков Рамиприл лучше
Графическая интерпретация неуступающей эффективности при оценке отношения рисков исcледования ONTARGET Эквивалентны Телмисартан лучше Превышающая эффективность Неуступающая эффективность Эквивалентность 1 - 1 1+ Отношение рисков Рамиприл лучше
 Планирование клинического исследования Так как плохо спланированный опыт мало информативен, что нельзя исправить самой лучшей статистической техникой, то планирование эксперимента становится особо важным составным элементом статистики. Л. Закс «Статистическое оценивание»
Планирование клинического исследования Так как плохо спланированный опыт мало информативен, что нельзя исправить самой лучшей статистической техникой, то планирование эксперимента становится особо важным составным элементом статистики. Л. Закс «Статистическое оценивание»
 Сравнительные клинические испытания Место статистических методов в протоколе КИ В протоколе КИ статистические методы в основном должны быть представлены при описании: 1) Обоснования размера выборки 2) Рандомизации 3) Плана обработки результатов клинического испытания (методы, предпосылки их применения, альтернативные методы, уровни значимости)
Сравнительные клинические испытания Место статистических методов в протоколе КИ В протоколе КИ статистические методы в основном должны быть представлены при описании: 1) Обоснования размера выборки 2) Рандомизации 3) Плана обработки результатов клинического испытания (методы, предпосылки их применения, альтернативные методы, уровни значимости)
 Основные вопросы, касающиеся математической статистики, которые необходимо решить при планировании клинических исследований ü Обеспечение требуемого размера выборки; ü Устранение возможные источников систематических ошибок или минимизация их влияния; ü Выбор методов обработки данных, которые соответствуют поставленной цели и особенностям данных которые анализируются; ü Уменьшение «риска потребителя» .
Основные вопросы, касающиеся математической статистики, которые необходимо решить при планировании клинических исследований ü Обеспечение требуемого размера выборки; ü Устранение возможные источников систематических ошибок или минимизация их влияния; ü Выбор методов обработки данных, которые соответствуют поставленной цели и особенностям данных которые анализируются; ü Уменьшение «риска потребителя» .
 ТИПЫ ДИЗАЙНОВ КЛИНЧЕСКИХ ИССЛЕДОВАНИЙ ü ПАРАЛЛЕЛЬНЫЕ Используются наиболее часто при проведении клинических испытаний, однако требуют довольно больших размеров выборки. ü ПЕРЕКРЕСТНЫЕ Используются при испытаниях для некоторых категорий препаратов а также при испытаниях биоэквивалентности. ü ПОСЛЕДОВАТЕЛЬНЫЕ Применение таких дизайнов (например последовательных групп) позволяет в некоторых случаях уменьшить число испытуемых. ü ФАКТОРНЫЕ Подразумевают оценку двух или более методов лечения, применяющихся в различных комбинациях.
ТИПЫ ДИЗАЙНОВ КЛИНЧЕСКИХ ИССЛЕДОВАНИЙ ü ПАРАЛЛЕЛЬНЫЕ Используются наиболее часто при проведении клинических испытаний, однако требуют довольно больших размеров выборки. ü ПЕРЕКРЕСТНЫЕ Используются при испытаниях для некоторых категорий препаратов а также при испытаниях биоэквивалентности. ü ПОСЛЕДОВАТЕЛЬНЫЕ Применение таких дизайнов (например последовательных групп) позволяет в некоторых случаях уменьшить число испытуемых. ü ФАКТОРНЫЕ Подразумевают оценку двух или более методов лечения, применяющихся в различных комбинациях.
 ОПРЕДЕЛЕНИЕ РАЗМЕРА ВЫБОРКИ Требуемый размер выборки – это минимально достаточное количество испытуемых для получения КЛИНИЧЕСКИ и СТАТИСТИЧЕСКИ значимых результатов клинического испытания
ОПРЕДЕЛЕНИЕ РАЗМЕРА ВЫБОРКИ Требуемый размер выборки – это минимально достаточное количество испытуемых для получения КЛИНИЧЕСКИ и СТАТИСТИЧЕСКИ значимых результатов клинического испытания
 Клинические испытания: Размер выборки РАЗМЕР ВЫБОРКИ ДОЛЖЕН БЫТЬ ОБОСНОВАН В ПРОТОКОЛЕ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ. На размер выборки влияют: v Величина клинически важных различий ( ) v Вероятность совершения ошибки 1 -го рода, (обычно равна 0, 05 или 5%) v Вероятность совершения ошибки 2 -го рода, (обычно 0, 2) и, соответственно, мощность (80%) v Вариабельность главной переменной испытания (для количественных переменных) или доля положительных результатов (для бинарной переменной). v Цель клинического испытания.
Клинические испытания: Размер выборки РАЗМЕР ВЫБОРКИ ДОЛЖЕН БЫТЬ ОБОСНОВАН В ПРОТОКОЛЕ КЛИНИЧЕСКОГО ИССЛЕДОВАНИЯ. На размер выборки влияют: v Величина клинически важных различий ( ) v Вероятность совершения ошибки 1 -го рода, (обычно равна 0, 05 или 5%) v Вероятность совершения ошибки 2 -го рода, (обычно 0, 2) и, соответственно, мощность (80%) v Вариабельность главной переменной испытания (для количественных переменных) или доля положительных результатов (для бинарной переменной). v Цель клинического испытания.
 Клинические испытания: Обработка результатов План статистического анализа должен быть детально изложен в протоколе испытания. От типов данных и их характеристик зависит, какой метод анализа следует применить.
Клинические испытания: Обработка результатов План статистического анализа должен быть детально изложен в протоколе испытания. От типов данных и их характеристик зависит, какой метод анализа следует применить.
 Клинические испытания: Обработка результатов В плане статистического анализа должны быть предусмотрены методы для анализа предпосылок применения выбранных статистических методов, а также альтернативные статистические методы, которые должны применяться в случае невыполнения этих предпосылок.
Клинические испытания: Обработка результатов В плане статистического анализа должны быть предусмотрены методы для анализа предпосылок применения выбранных статистических методов, а также альтернативные статистические методы, которые должны применяться в случае невыполнения этих предпосылок.
 Клинические испытания: Представление результатов Результаты статистического анализа должны быть детально представлены в отчете клинического исследования. Это повышает доверие к выводам, полученным в результате клинического исследования.
Клинические испытания: Представление результатов Результаты статистического анализа должны быть детально представлены в отчете клинического исследования. Это повышает доверие к выводам, полученным в результате клинического исследования.
 ТИПИЧНЫЕ ОШИБКИ: Терминология ДОСТОВЕРНОСТЬ СТАТИСТИЧЕСКАЯ ЗНАЧИМОСТЬ «Язык воистину становится инструментом сокрытия мыслей. Но то, что нормально в обыденной речи, совершенно недопустимо в научных текстах, где слово становится термином, семантическое поле которого в идеале сужено до одного единственного означающего. » «О неправильном употреблении термина "достоверность" в российских научных психиатрических и общемедицинских статьях» Зорин Н. А. , Отдел информатики и системных исследований МНИИ психиатрии МЗ РФ
ТИПИЧНЫЕ ОШИБКИ: Терминология ДОСТОВЕРНОСТЬ СТАТИСТИЧЕСКАЯ ЗНАЧИМОСТЬ «Язык воистину становится инструментом сокрытия мыслей. Но то, что нормально в обыденной речи, совершенно недопустимо в научных текстах, где слово становится термином, семантическое поле которого в идеале сужено до одного единственного означающего. » «О неправильном употреблении термина "достоверность" в российских научных психиатрических и общемедицинских статьях» Зорин Н. А. , Отдел информатики и системных исследований МНИИ психиатрии МЗ РФ
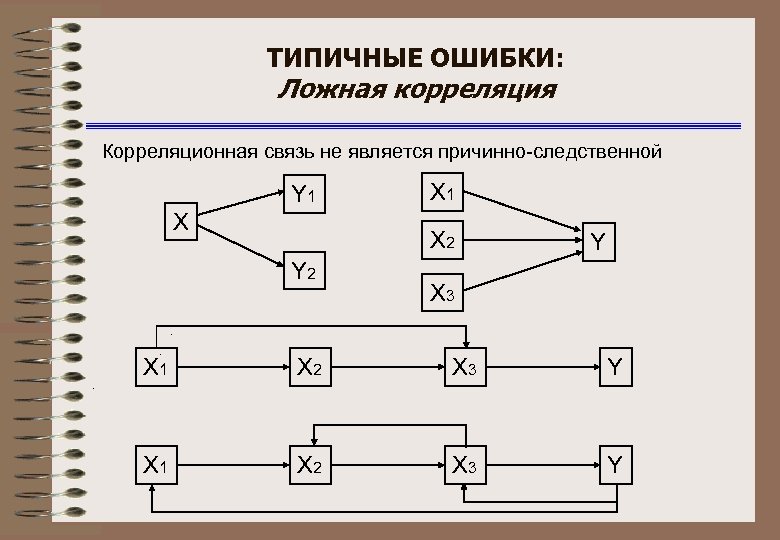 ТИПИЧНЫЕ ОШИБКИ: Ложная корреляция Корреляционная связь не является причинно-следственной Y 1 Х Х 1 Х 2 Y Х 3 Х 1 Х 2 Х 3 Y
ТИПИЧНЫЕ ОШИБКИ: Ложная корреляция Корреляционная связь не является причинно-следственной Y 1 Х Х 1 Х 2 Y Х 3 Х 1 Х 2 Х 3 Y
 ТИПИЧНЫЕ ОШИБКИ: Представление результатов M±m M (SE = m) или M (CI= M 1—M 2) p<… p=…
ТИПИЧНЫЕ ОШИБКИ: Представление результатов M±m M (SE = m) или M (CI= M 1—M 2) p<… p=…
 ТИПИЧНЫЕ ОШИБКИ: Представление результатов 1. Описывайте статистические методы настолько детально, чтобы грамотный читатель, имеющий доступ к исходным данным, мог проверить полученные Вами результаты. 2. По возможности, подвергайте полученные данные количественной оценке и представляйте их с соответствующими показателями ошибок измерения и неопределенности (такими как доверительные интервалы). 3. Приведите детали процесса рандомизации. Опишите, какие методы были применены для обеспечения "слепого" контроля и насколько успешно. 4. Приведите количество наблюдений. 5. Укажите число случаев, когда наблюдение осуществлялось не до конца исследования (например, количество больных, выбывших из клинического испытания). 6. Укажите, какие компьютерные программы, доступные для широкого пользователя, применялись в Вашей работе. 7. В разделе «Методы» укажите, какие статистические методы были использованы для их анализа данных. 8. Используйте графики в качестве альтернативы таблицам с большим числом данных, но не дублируйте материал в графиках и таблицах.
ТИПИЧНЫЕ ОШИБКИ: Представление результатов 1. Описывайте статистические методы настолько детально, чтобы грамотный читатель, имеющий доступ к исходным данным, мог проверить полученные Вами результаты. 2. По возможности, подвергайте полученные данные количественной оценке и представляйте их с соответствующими показателями ошибок измерения и неопределенности (такими как доверительные интервалы). 3. Приведите детали процесса рандомизации. Опишите, какие методы были применены для обеспечения "слепого" контроля и насколько успешно. 4. Приведите количество наблюдений. 5. Укажите число случаев, когда наблюдение осуществлялось не до конца исследования (например, количество больных, выбывших из клинического испытания). 6. Укажите, какие компьютерные программы, доступные для широкого пользователя, применялись в Вашей работе. 7. В разделе «Методы» укажите, какие статистические методы были использованы для их анализа данных. 8. Используйте графики в качестве альтернативы таблицам с большим числом данных, но не дублируйте материал в графиках и таблицах.
 Клинические испытания: Два статистических подхода В статистике существует два основных подхода для анализа данных: v Фриквентистский v Байесовский Фриквентистский – основанный на частоте происходящих событий. Байесовский – учитывающий уже имеющиеся знания.
Клинические испытания: Два статистических подхода В статистике существует два основных подхода для анализа данных: v Фриквентистский v Байесовский Фриквентистский – основанный на частоте происходящих событий. Байесовский – учитывающий уже имеющиеся знания.
 Клинические испытания: Байесовский подход Вероятности, основанные на нашем знании Данные клинических испытаний ТЕОРЕМА БАЙЕСА Пересмотренные значения вероятностей Reverend Thomas Bayes 1702 --1761.
Клинические испытания: Байесовский подход Вероятности, основанные на нашем знании Данные клинических испытаний ТЕОРЕМА БАЙЕСА Пересмотренные значения вероятностей Reverend Thomas Bayes 1702 --1761.
 Клинические испытания: Использование Байесовских подходов в клинических испытаниях позволяет: v УМЕНЬШИТЬ РАЗМЕР ВЫБОРКИ (!!!) v Экспертно устанавливать вероятность, что один препарат эквивалентен другому (не хуже другого; лучше другого), и учитывать это в выводах. Применение Байесовских подходов при планировании клинических испытаний и обработке их результатов требует специализированного программного обеспечения, математического моделирования и тщательного научного сопровождения.
Клинические испытания: Использование Байесовских подходов в клинических испытаниях позволяет: v УМЕНЬШИТЬ РАЗМЕР ВЫБОРКИ (!!!) v Экспертно устанавливать вероятность, что один препарат эквивалентен другому (не хуже другого; лучше другого), и учитывать это в выводах. Применение Байесовских подходов при планировании клинических испытаний и обработке их результатов требует специализированного программного обеспечения, математического моделирования и тщательного научного сопровождения.


