Биосинтез белка.ppt
- Количество слайдов: 24
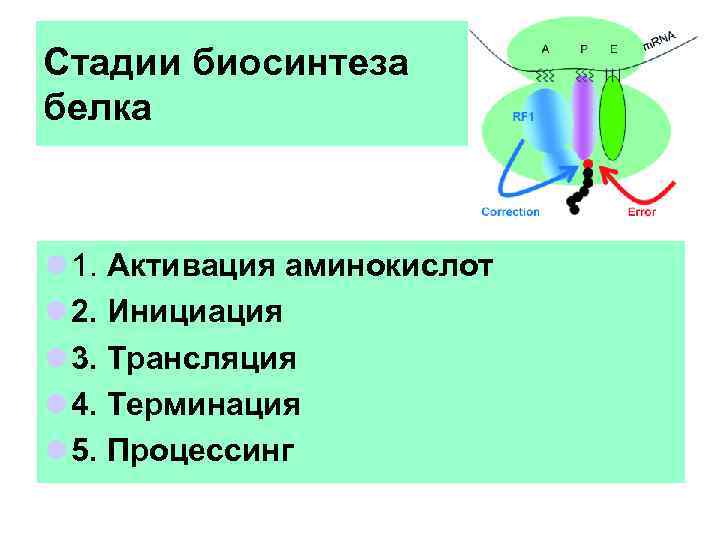
Стадии биосинтеза белка l 1. Активация аминокислот l 2. Инициация l 3. Трансляция l 4. Терминация l 5. Процессинг
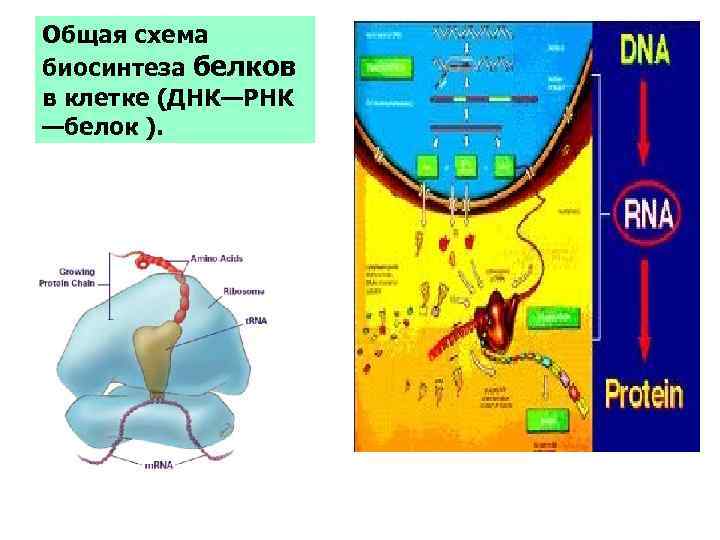
Общая схема биосинтеза белков в клетке (ДНК—РНК —белок ).

Условия биосинтеза белка l В биосинтезе белка участвует более 300 молекул. , которые формируют три потока. l 1 поток- информационный- включает генетический код, молекулы ДНК, м. РНК, ферменты репликации, и репарации, транскрипции, альтернативный сплайсинг.

l 2 поток – пластическийвключает рибосому, 20 протеиногенных аминокислот, 64 т. РНК, 20 а-а-т. РНК синтетаз, факторы инициации, элонгации, терминации. l 3 поток- энергетический- энергия всех нуклеотидтрифосфатов, энергия активации факторов всех стадий биосинтеза белка.

АКТИВИРОВАНИЕ И АКЦЕПТИРОВАНИЕ АМИНОКИСЛОТ 1. Аминокислота + АТФ = Аминоацил-аденилат + Пирофосфат 2. Аминоацил -аденилат + т. РНК= А-А—т. РНК + АМФ А-А—т. РНК поступает на рибосому в качестве субстрата для биосинтеза белка.
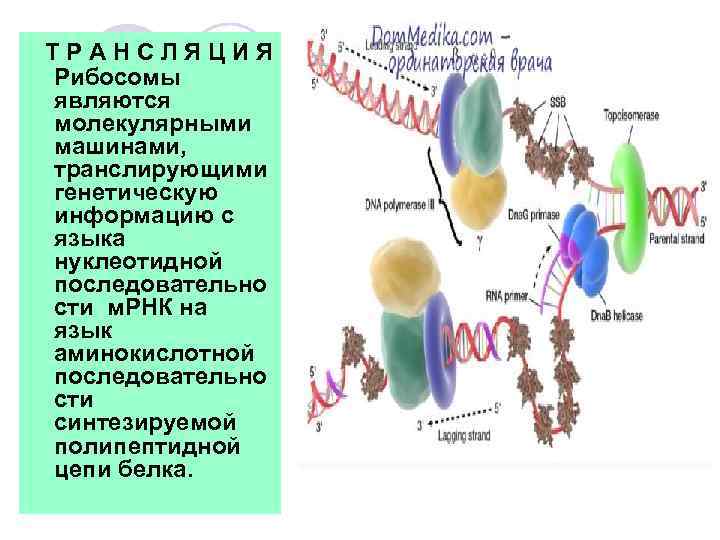
ТРАНСЛЯЦИЯ Рибосомы являются молекулярными машинами, транслирующими генетическую информацию с языка нуклеотидной последовательно сти м. РНК на язык аминокислотной последовательно сти синтезируемой полипептидной цепи белка.
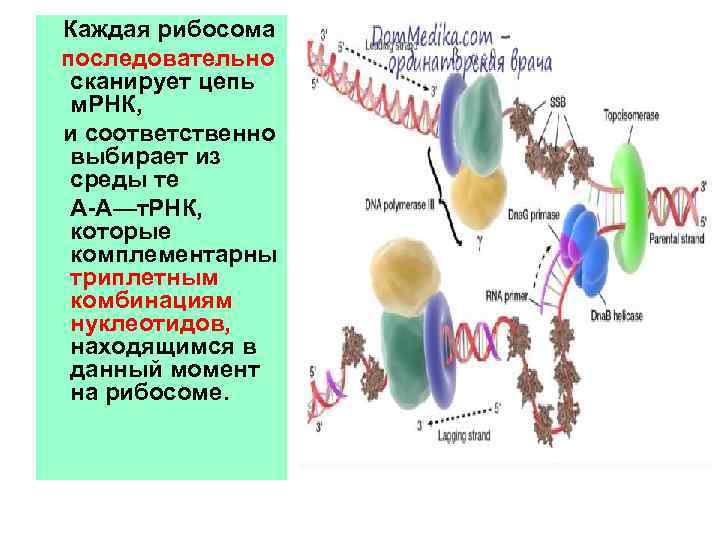
Каждая рибосома последовательно сканирует цепь м. РНК, и соответственно выбирает из среды те А-А—т. РНК, которые комплементарны триплетным комбинациям нуклеотидов, находящимся в данный момент на рибосоме.
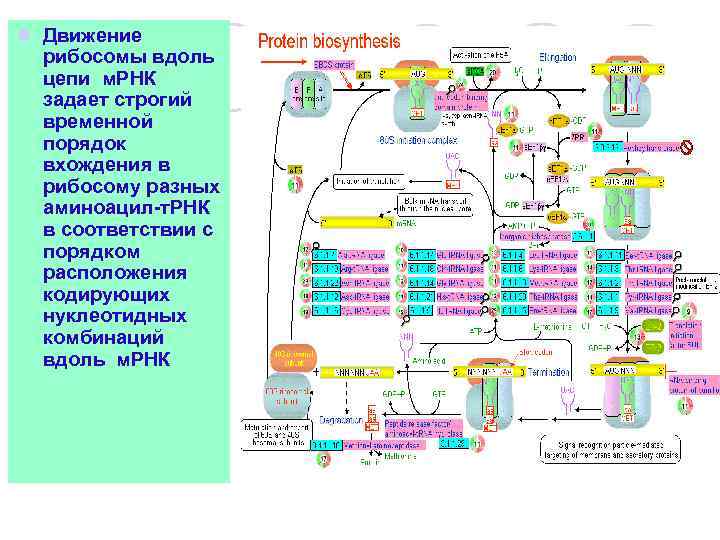
l Движение рибосомы вдоль цепи м. РНК задает строгий временной порядок вхождения в рибосому разных аминоацил-т. РНК в соответствии с порядком расположения кодирующих нуклеотидных комбинаций вдоль м. РНК
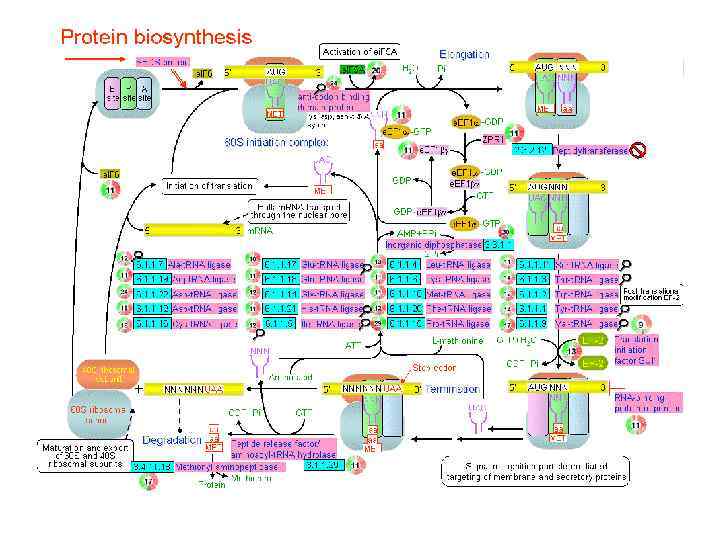

Каждый аминокислотный остаток, выбранный аминоацил—т. РНК, ковалентно присоединяется рибосомой к растущей полипептидной цепи, а деацилированная т. РНК освобождается из рибосомы. В такой последовательности строится полипептидная цепь

Формирование функционального белка : По мере синтеза полипептидной цепи она частично высовывается из рибосомы и начинает сворачиваться в глобулу ( котрансляционный фолдинг ). По завершению синтеза, по прочтении всей м. РНК, полипептидная цепь освобождается из рибосомы и окончательно сворачивается ( посттрансляционный фолдинг ).

Синтезируемый белок может транспортироваться через клеточные мембраны. Сворачивание белка и его транспорт сопровождается различными ковалентными модификациями с помощью ферментов
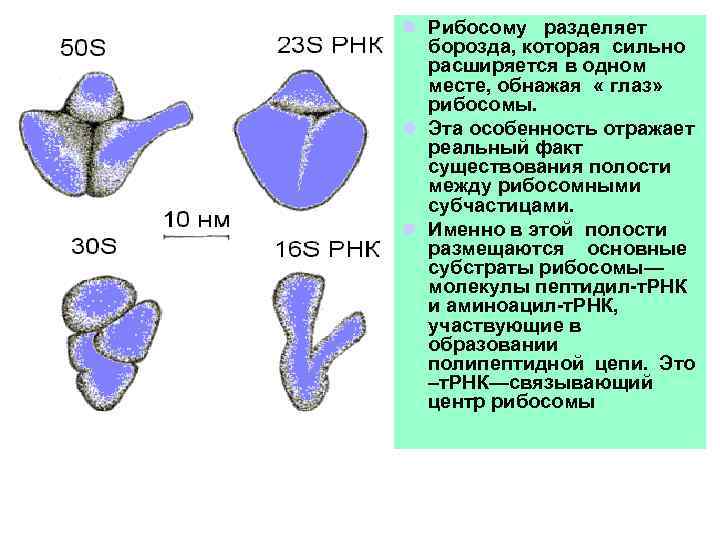
l Рибосому разделяет борозда, которая сильно расширяется в одном месте, обнажая « глаз» рибосомы. l Эта особенность отражает реальный факт существования полости между рибосомными субчастицами. l Именно в этой полости размещаются основные субстраты рибосомы— молекулы пептидил-т. РНК и аминоацил-т. РНК, участвующие в образовании полипептидной цепи. Это –т. РНК—связывающий центр рибосомы
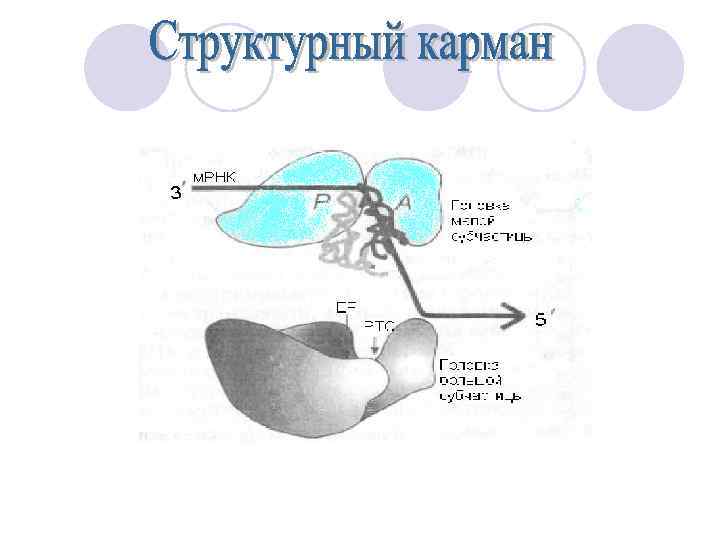
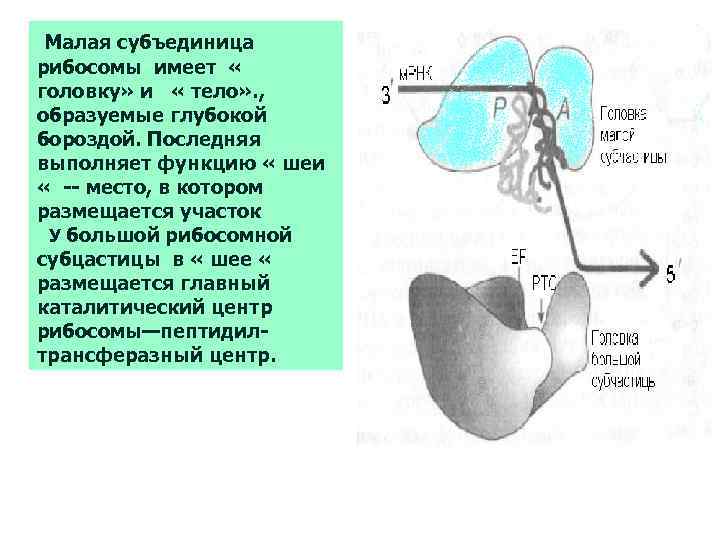
Малая субъединица рибосомы имеет « головку» и « тело» . , образуемые глубокой бороздой. Последняя выполняет функцию « шеи « -- место, в котором размещается участок У большой рибосомной субцастицы в « шее « размещается главный каталитический центр рибосомы—пептидилтрансферазный центр.
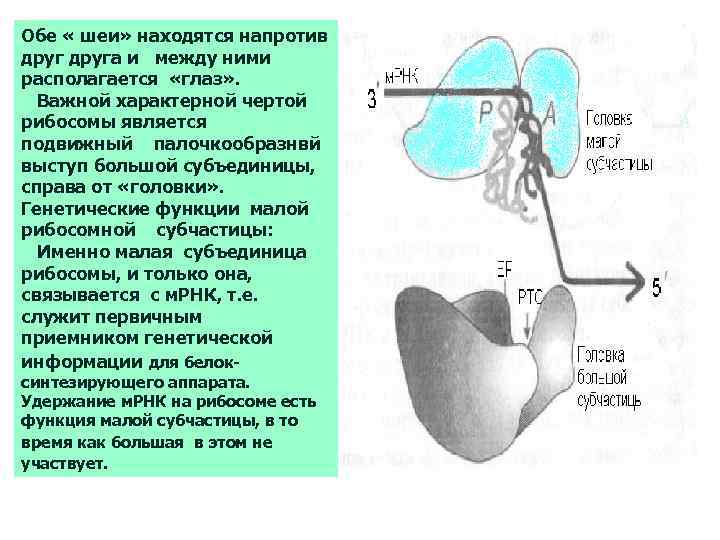
Обе « шеи» находятся напротив друга и между ними располагается «глаз» . Важной характерной чертой рибосомы является подвижный палочкообразнвй выступ большой субъединицы, справа от «головки» . Генетические функции малой рибосомной субчастицы: Именно малая субъединица рибосомы, и только она, связывается с м. РНК, т. е. служит первичным приемником генетической информации для белоксинтезирующего аппарата. Удержание м. РНК на рибосоме есть функция малой субчастицы, в то время как большая в этом не участвует.
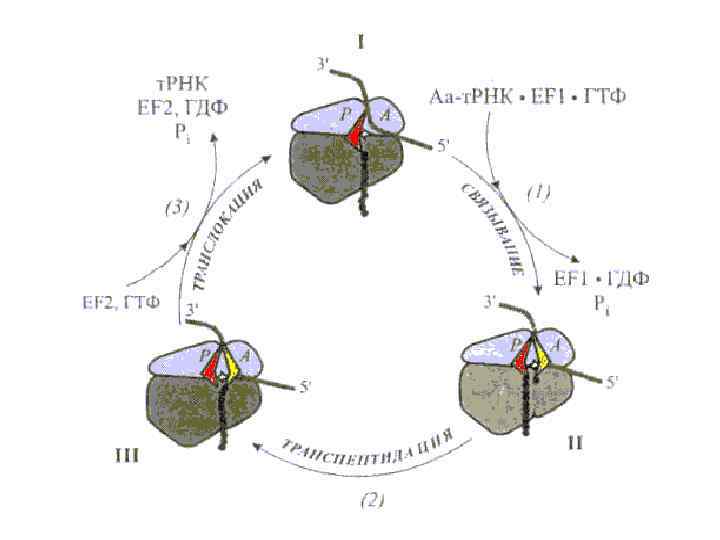
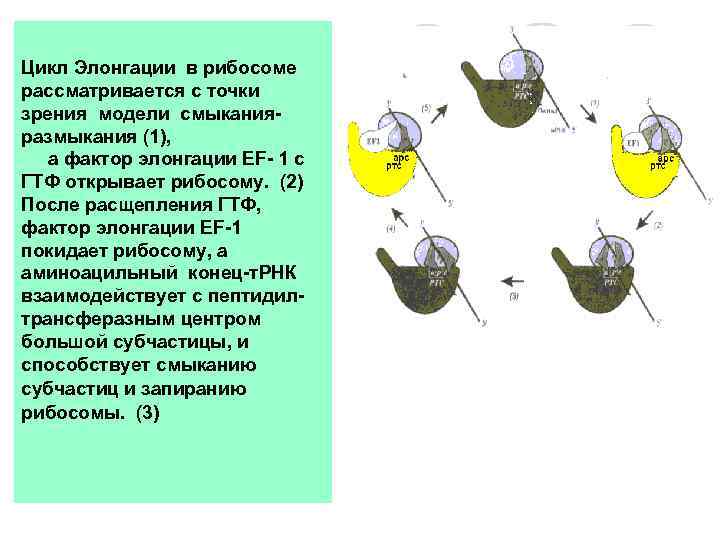
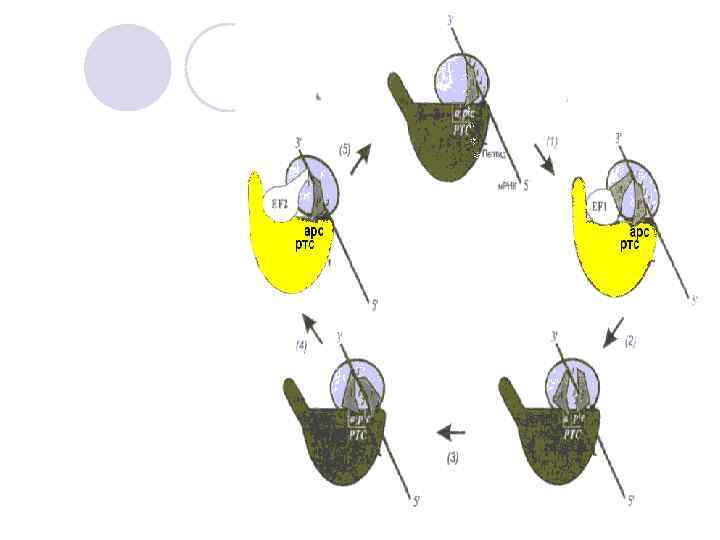
Цикл Элонгации в рибосоме рассматривается с точки зрения модели смыканияразмыкания (1), а фактор элонгации ЕF- 1 с ГТФ открывает рибосому. (2) После расщепления ГТФ, фактор элонгации ЕF-1 покидает рибосому, а аминоацильный конец-т. РНК взаимодействует с пептидилтрансферазным центром большой субчастицы, и способствует смыканию субчастиц и запиранию рибосомы. (3)

Антибиотики- вещества, синтезируемые микроорганизмами и подавляющие размножение бактерий, других микробов, а также вирусов и клеток. Большинство антибиотиков продуцируются микроорганизмами из рода актиномицетов ( Streptomyces sp. ) и определенными грибами. Однако существуют и синтетические антимикробные вещества, такие как сульфаниламиды и ингибиторы гираз.

Интеркаляторы такие как рифамицин, рубомицин и актиномицин D встраиваются в двойную спираль ДНК, таким образом препятствуя репликации и транскрипции. Интеркаляторы токсичны и для эукариот, поэтому их применение в качестве цитостатиков ограниченно.

Синтетические ингибиторы ДНК -топоизомераз, так называемые –Ингибиторы гираз воздействуют на репликацию, и тем самым подавляет репродукцию бактерий. К ингибиторам трансляции относится большая группа антибиотиков, воздействующих на рибосому ( Аминогликозиды, Тетрациклины, Эритромицин, Пуромицин, Хлорамфеникол). Тетрациклины- антибиотики широкого спектра действия. Аминогликозиды, воздействуют на все фазы трансляции.

Эритромицин нарушает нормальную функцию большой рибосомной субцастицы. Хлорамфениколявляется одним из немногих природных нитросоединений, ингибирующих пептидилтрансфер азу

Беталактамные антибиотики (наиболее известные пенициллин ыи цефалоспори ны) ингибируют синтез клеточных стенок бактерий.
Биосинтез белка.ppt