Строение компл. соед-й. Ситдикова Л.И..pptx
- Количество слайдов: 11

СРС по дисциплине «Реакционная способность химических соединений» Строений координационных (комплексных) соединений. Типы комплексов. Выполнила: студентка гр. 430151 Ситдикова Л. И. Проверила: Исхакова И. В.
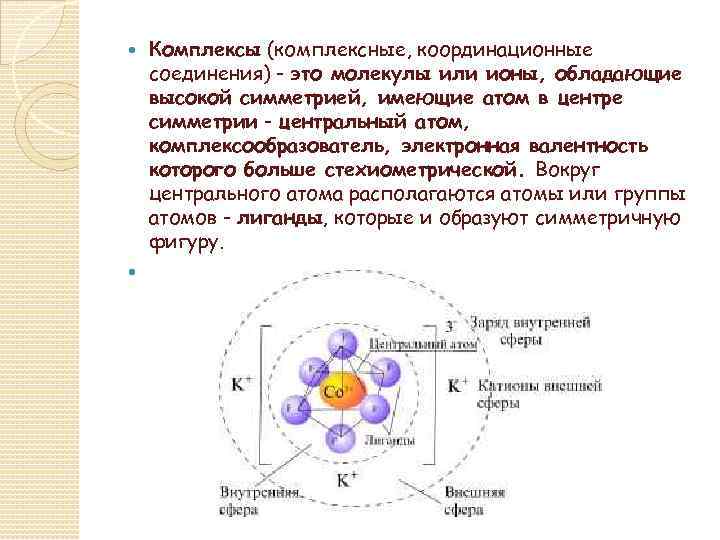
Комплексы (комплексные, координационные соединения) - это молекулы или ионы, обладающие высокой симметрией, имеющие атом в центре симметрии - центральный атом, комплексообразователь, электронная валентность которого больше стехиометрической. Вокруг центрального атома располагаются атомы или группы атомов - лиганды, которые и образуют симметричную фигуру.
![[Pt(NH 3)2 Cl 2] - квадрат с атомом Pt в центре (Vстх. = 2, [Pt(NH 3)2 Cl 2] - квадрат с атомом Pt в центре (Vстх. = 2,](https://present5.com/presentation/31537482_136617767/image-3.jpg)
[Pt(NH 3)2 Cl 2] - квадрат с атомом Pt в центре (Vстх. = 2, Vе = 4) и лигандами Cl- и NH 3 Квадратный комплекс [Pt(NH 3)2 Cl 2] [Co. F 6]3 - - октаэдр с атомом Co в центре и лигандами F (Vстх = 3, Vе = 6). Октаэдрмический комплексный ион [Co. F 6]3 -
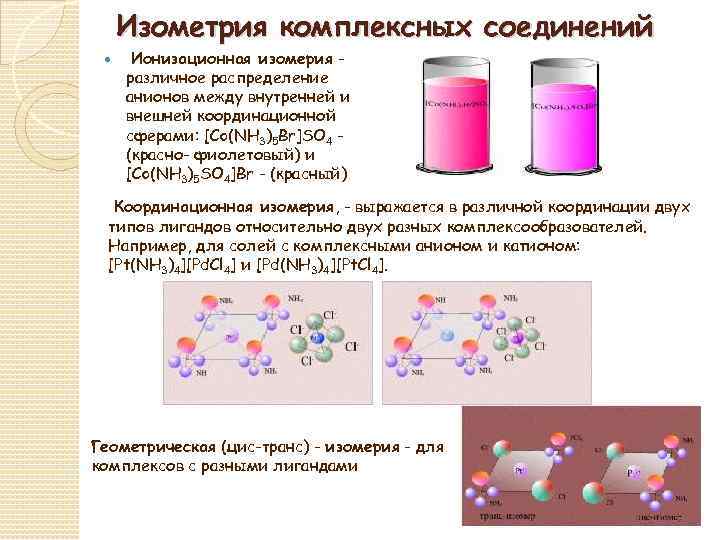
Изометрия комплексных соединений Ионизационная изомерия различное распределение анионов между внутренней и внешней координационной сферами: [Co(NH 3)5 Br]SO 4 (красно- фиолетовый) и [Co(NH 3)5 SO 4]Br - (красный) Координационная изомерия, - выражается в различной координации двух типов лигандов относительно двух разных комплексообразователей. Например, для солей с комплексными анионом и катионом: [Pt(NH 3)4][Pd. Cl 4] и [Pd(NH 3)4][Pt. Cl 4]. Геометрическая (цис-транс) - изомерия - для комплексов с разными лигандами

Химическая связь в комплексных соединениях Теория ВС для комплексных соединений. Пространственная структура комплексных частиц может быть объяснена с позиций метода (ВС). Согласно этому методу связь между центральным атомом и лигандами образуется за счет донорно-акцепторного взаимодействия: лиганд - донор, а центральный атом - акцептор электронной пары. При этом ковалентная s - связь образуется в результате перекрывания вакантной орбитали центрального атома или иона комплексообразователя с заполненными, т. е. содержащими неподеленные пары электронов, орбиталями лигандов. Максимально возможное число s связей определяет координационное число комплексообразователя. Поскольку при одинаковых лигандах образующиеся s - связи равноценны, то образование комплексной частицы сопровождается гибридизацией акцепторных орбиталей комплексообразователя, что определяет геометрию комплекса. Критерием для определения типа гибридизации могут служить опытные данные о магнитных свойствах образующихся комплексов. Образование комплексного иона [Co. F 6]3 - по методу валентной связи

Теория кристаллического поля для комплексов (ТКП). В этой теории рассчитывается электростатическое взаимодействие d - электронов центрального атома с лигандами, которые рассматриваются как отрицательные точечные заряды. Электроны центрального атома и лиганды, естественно, отталкиваются, таким образом в ТКП учитывается дополнительное отталкивательное (разрыхляющее) взаимодействие (в отличие от ТВС, где рассматривается только связывание). Основное, связывающее взаимодействие, в ТКП рассчитывают как чисто электростатическое, что не дает хороших результатов и поэтому обычно не используется.

Типы комплексных соединений Аквакомплексы представляют собой ионы или молекулы, в которых лигандами служат молекулы воды. В водных растворах солей почти все ионы существуют в виде акваионов, например, [Be(H 2 O)4]2+, [Al(H 2 O)6]3+, [Cr(H 2 O)6]3+ и т. д. При кристаллизации таких солей из водных растворов вода остается связанной с комплексообразователем: [Be(H 2 O)4]SO 4, [K(H 2 O)6][Al(H 2 O)6](SO 4)2, [Cr(H 2 O)6]Cl 3. Гидроксокомплексы – комплексные соединения, содержащие в качестве лигандов гидроксид-ионы OH-. Гидроксокомплексы образуются в реакциях протолиза из аквакомплексов: [Al(H 2 O)6]3+ + H 2 O [Al(H 2 O)5(OH)]2+ + H 3 O+ Аммиакаты – это комплексные соединения, в которых функции лигандов выполняют молекулы аммиака NH 3. Более точное название комплексов, содержащих аммиак во внутренней сфере – аммины; однако молекулы NH 3 могут находиться не только во внутренней, но и вовнешней сфере соединения – аммиаката. Аммиакаты разрушаются при любых воздействиях, которые удаляют (при нагревании) или разрушают (действием окислителя) молекулуаммиака, переводят аммиак в кислотной среде в катион аммония (катион аммония не содержит неподеленных пар электронов и поэтому не может выполнять функции лиганда), либо связывают центральный атом комплекса, например, в виде малорастворимого осадка

Ацидокомплексы. В ацидокомплексах лигандами служат анионы кислот, органических и неорганических: F-, Cl-, Br-, I-, CN-, NO 2 -, SO 42 -, C 2 O 42 -, CH 3 COO- и др. Эту группу комплексных соединений можно подразделить на две части: комплексы с кислородсодержащими лигандами и комплексы сбескислородными (преимущественно галогенидными или псевдогалогенидными) лигандами. Примерами ацидокомплексов с бескислородными лигандами могут служить гексахлороплатинат(IV) калия K 2[Pt. Cl 6] и гексацианоферрат(II) калия K 4[Fe(CN)6]. Платина химически растворяется в смеси концентрированных азотной и соляной кислот (так называемой “царской водке”) с образованием гексахлороплатината(IV) водорода H 2[Pt. Cl 6]: 3 Pt + 4 HNO 3 + 18 HCl = 3 H 2[Pt. Cl 6] + 4 NO + 8 HO 2 Анионгалогенаты – комплексные соединения, в которых и комплексообразователь, и лиганды представляют собой галогены Это комплексы состава M[ЭГ¢x. Г²y], где М – малозарядный крупный катион, например, катион щелочного металла или аммония (а также алкил- или ариламмония, фосфония, арсония и другие комплексные катионы с достаточно низкой поляризуемостью); Э – галогенкомплексообразователь, атом или молекула, обычно имеющий невысокую электроотрицательность (иод, бром, реже хлор); Г¢ и Г² галогенидные лиганды. .

Гидридные комплексы содержат в качестве лиганда гидридный ион Н-. Комплексообразователи в гидридных комплексах чаще всего элементы IIIA-группы – бор, алюминий, галлий, индий, таллий. В ряду [BH 4] > [Al. H 4]- > [Ga. H 4]- устойчивость гидридных комплексов падает. Гидридные комплексы – сильнейшие восстановители. Под действием кислот и в водной среде они разлагаются, выделяя водород Карбонильные комплексы. Комплексные соединения, в которых лигандом является карбонил – монооксид углерода СО, называютсякарбонильными. Степень окисления металла в комплексных карбонилах, как правило, нулевая. Карбонильные комплексы в обычных условиях – кристаллические вещества или жидкости, легколетучие и обладающими низкими температурами плавления и кипения п-комплексы (пи-комплексы) – это комплексные соединения, в которых в роли лигандов фигурируют ненасыщенные органические молекулы типа этилена, циклопентадиена, бензола и т. п. Наиболее известным примером таких комплексов служит ферроцен – бис(циклопентадиенил)железо состава [Fe(C 5 H 5)2]. Хелаты, или циклические комплексные соединения. Хелатами называют комплексные соединения, внутрення сфера которых состоит из циклических группировок, включающих комплексообразователь. Например, a-аминоуксусная кислота (глицин) может реагировать с гидроксидом меди с образованием сине-фиолетового прочного комплекса, растворимого в воде: Cu(OH)2 + 2 NH 2 COOH = [Cu(NH 2 COO)2] + 2 H 2 O

О реакционной способности комплексных соединений. Комплексные соединения участвуют в разнообразных химических реакциях, включая внутрисферное замещение одних лигандов на другие, диссоциацию лигандов, например молекул воды: [Pt. Cl 3 H 2 O]- + H 2 O [Pt. Cl 3 OH]2 - + H 3 O+, внутрисферные превращения лигандов, например, координированных нитрилов R-CЇN (R - органический радикал) в амидины [Pt(R-CЇN)2 Cl 2] + 2 NH 3 [Pt()2 Cl 2] и другие превращения. Многие комплексные соединения являются катализаторами различных процессов гомогенного и гетерогенного катализа. Часто при получении лекарственных препаратов на основе фармакологически активных комплексных соединений удается понизить токсичность как металла, так и лигандов, связанных в комплексе, и модифицировать в желаемом направлении их биологическую активность.

ЗАКЛЮЧЕНИЕ Координационная химия (химия комплексных соединений) длительное время считалась одним из разделов неорганической химии; объяснялось это тем, что большинство известных ранее координационных соединений содержало в качестве лигандов, как правило, типичные неорганические молекулы и ионы - аммиак, воду, нитро-, роданогруппу и т. п. Экспериментальные исследования неорганических комплексных соединений были начаты за несколько десятилетий до того, как стала бурно развиваться органическая химия. После создания А. Вернером координационной теории химия комплексных соединений стала постепенно, в течение десятилетий, превращаться в самостоятельный раздел химической науки. Ее успешное развитие связано с именами Трассера, Цейзе, Йергенсена, Грэма, Клауса, Бломстранда, школы А. Вернера, а в двадцатом веке - Л. А. Чугаева, И. И. Черняева, А. А. Гринберга, Чатта, Найхольма, Фишера, Бьеррума и многих других ученых различных стран. В наши дни координационая химия - интенсивно развивающаяся в различных направлениях наука, тесно переплетающаяся с другими областями химии.
Строение компл. соед-й. Ситдикова Л.И..pptx