алкины.pptx
- Количество слайдов: 18


Среди указанных веществ выберите вещество, которое не относится ни к одному из изученных ранее классов углеводородов: 1. СН 3 - СН 3 1860 г. 2. СН 2 = СН 2 ацетилен 3. СН ≡ СН 4. СН 2 = СН - СН = СН 2 П. Бертло
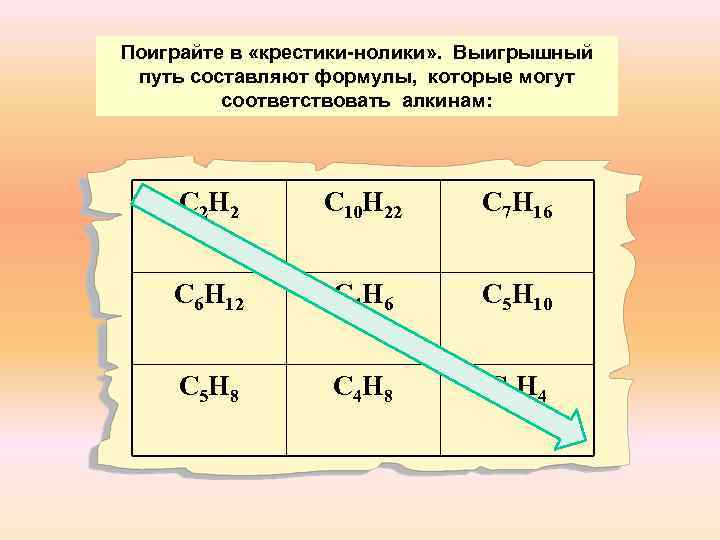
Поиграйте в «крестики-нолики» . Выигрышный путь составляют формулы, которые могут соответствовать алкинам: С 2 Н 2 С 10 Н 22 С 7 Н 16 С 6 Н 12 С 4 Н 6 С 5 Н 10 С 5 Н 8 С 4 Н 8 С 3 Н 4
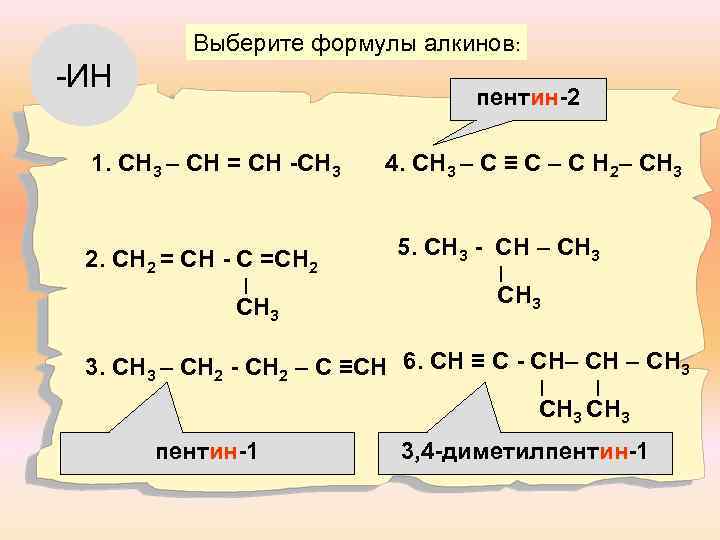
Выберите формулы алкинов: -ИН пентин-2 1. СН 3 – СН = СН -СН 3 2. СН 2 = СН - С =СН 2 ∣ СН 3 4. СН 3 – С ≡ С – С Н 2– СН 3 5. СН 3 - СН – СН 3 ∣ СН 3 3. СН 3 – СН 2 - СН 2 – С ≡СН 6. СН ≡ С - СН– СН 3 ∣ ∣ СН 3 пентин-1 3, 4 -диметилпентин-1

Изомерия 1) изомерия углеродного скелета (начиная с C 5 H 8) CH≡C-CH 2 -CH 3 CH≡C- CH(CH 3)- CH 3 пентин-1 3 -метилбутин-1 2) изомерия положения тройной связи (начиная с C 4 H 6) CH≡C-CH 2 -CH 3 -C≡C-CH 2 -CH 3 пентин-1 пентин-2 3) межклассовая изомерия (алкадиены). CH≡C-CH 2 -CH 3 CH 2=CH-CH 3 пентин-1 пентадиен-1, 3
Заполните таблицу «Состав и строение углеводородов» УВ С 2 Н 6 С 2 Н 4 С 2 НАЗВАНИЕ Связь между атомами углерода Вид гибридизации Валентный угол Длина связи (н. М) Форма молекулы
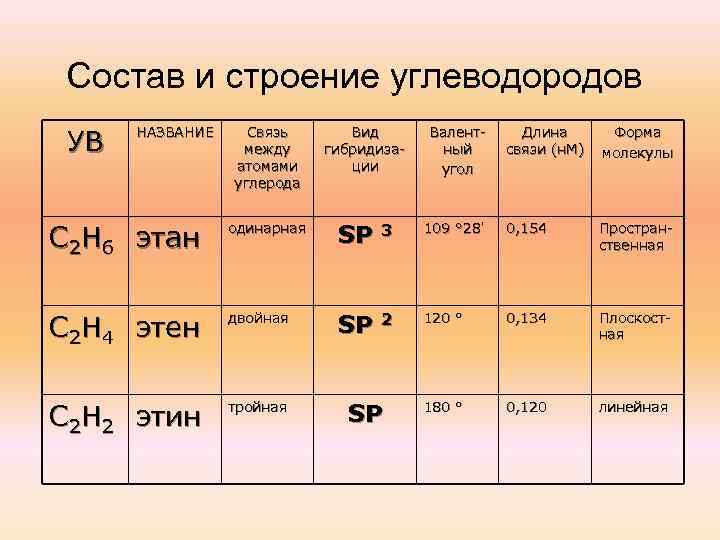
Состав и строение углеводородов УВ НАЗВАНИЕ Связь между атомами углерода Вид гибридизации Валентный угол , Длина связи (н. М) Форма молекулы 0, 154 Пространственная С 2 Н 6 этан одинарная SP 3 109 ° 28 С 2 Н 4 этен двойная SP 2 120 ° 0, 134 Плоскостная С 2 Н 2 этин тройная 180 ° 0, 120 линейная SP

Физические свойства алкинов Алкины представляют собой бесцветные газы (С 2 -С 14) или жидкости (С 15 -С 16). А начиная с С 17, алкины являются кристаллическими веществами.
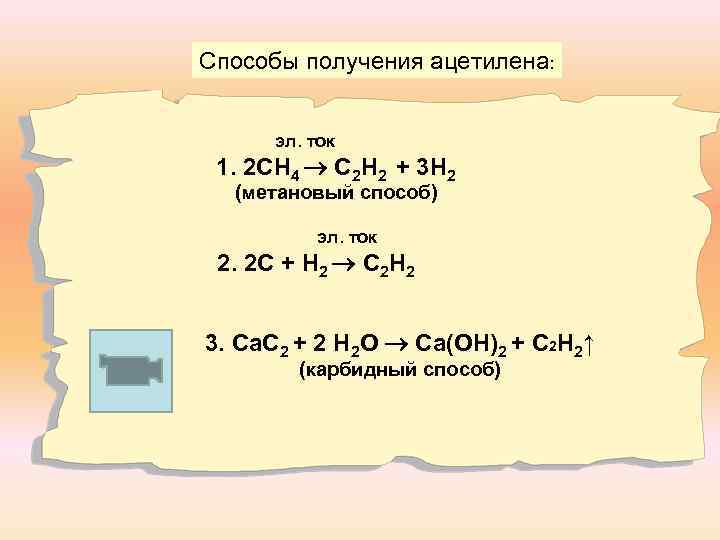
Способы получения ацетилена: эл. ток 1. 2 СН 4 С 2 Н 2 + 3 Н 2 (метановый способ) эл. ток 2. 2 С + Н 2 С 2 Н 2 3. Са. С 2 + 2 Н 2 О Са(ОН)2 + С 2 Н 2↑ (карбидный способ)
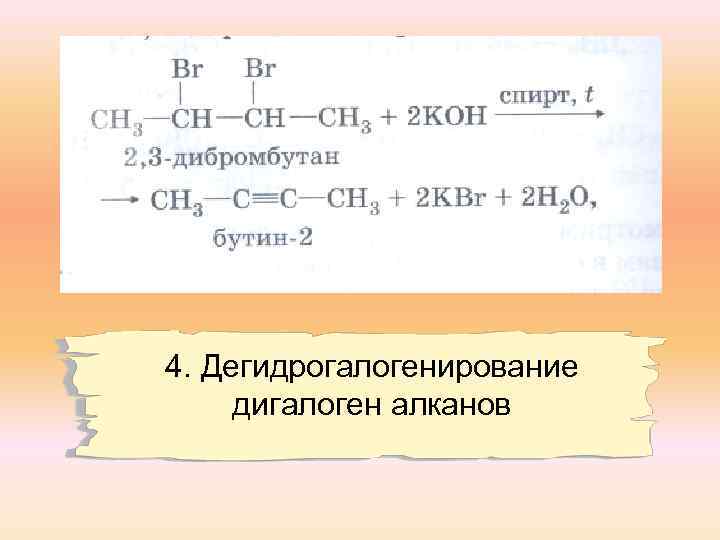
4. Дегидрогалогенирование дигалоген алканов
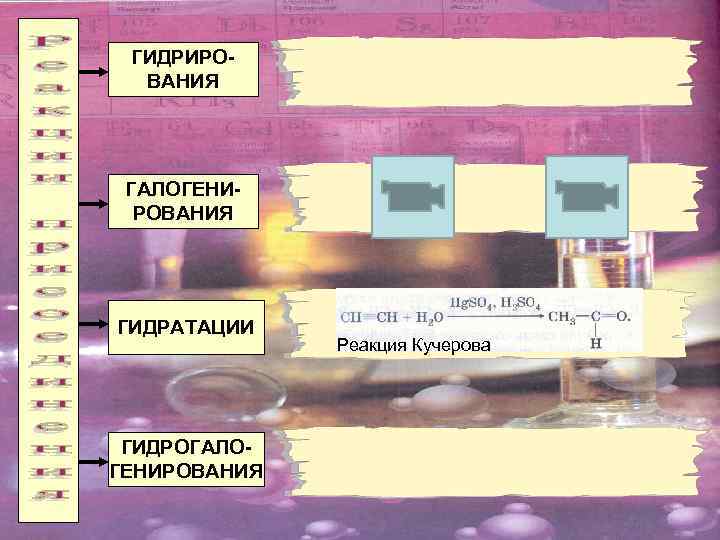
ГИДРИРОВАНИЯ ГАЛОГЕНИРОВАНИЯ ГИДРАТАЦИИ ГИДРОГАЛОГЕНИРОВАНИЯ Реакция Кучерова
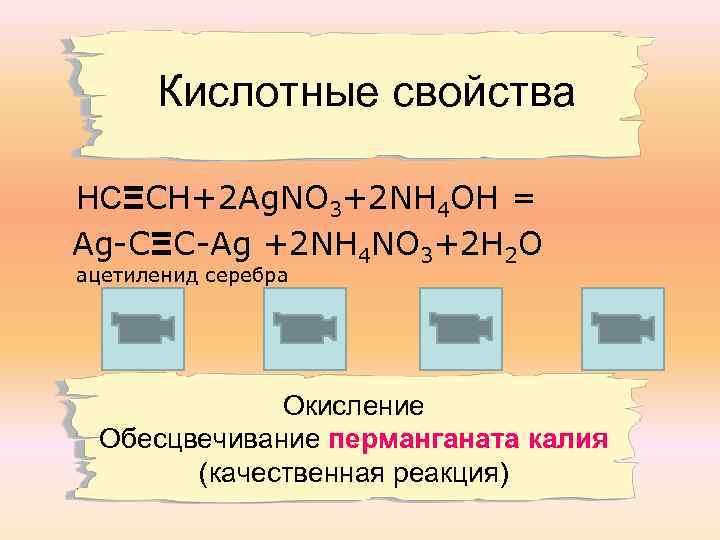
Кислотные свойства НСΞСН+2 Ag. NO 3+2 NH 4 OH = Ag-CΞC-Ag +2 NH 4 NO 3+2 H 2 O ацетиленид серебра Окисление Обесцвечивание перманганата калия (качественная реакция)

РЕАКЦИЯ ГОРЕНИЯ На воздухе ацетилен горит коптящим , светящимся пламенем. В конце XIX века А. Ле Шателье сделал важное наблюдение: ацетилен при горении в чистом кислороде дает самое горячее из известных в те годы пламя. Его температура достигает 4000 о. С! Сравните: температура плавления железа 1540 о. С. Вывод очевиден: пламенем ацетилена можно резать и сваривать металлы расходуется до 30 % всего производимого ацетилена

РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ • Димеризация НСΞСН+НСΞСН = СН 2=СН-С ΞСН винилацетилен • Тримеризация 3 С 2 Н 2=С 6 Н 6 Реакция Зелинского ( - СН 2 – СН –)n ∣ Сl
Поливинилхлорид ВИНИПЛАСТИКАТ Применение

е ы исл к гле аз У г й и еск ич ган ния р оро дине Хл ое с а Вод

Применение В конце 19 -го — начале 20 -го века широкой популярностью пользовались многочисленные ацетиленовые светильники (источником ацетилена служил дешевый карбид кальция), используемые на железнодорожном и водном транспорте, для освещения улиц, в быту. Несмотря на то, что сегодня массовое использование ацетиленовых фонарей ушло в прошлое, их выпуск и потребление не прекратились. Они производятся в небольших количествах как походное снаряжение

«Подъём по лестнице знаний» Составьте рассказ об алкинах Применение Характерные химические свойства Способы получения ацетилена Изомерия алкинов Родовой суффикс Общая формула Особенности строения
алкины.pptx