 Сполуки нітрогену з оксигеном
Сполуки нітрогену з оксигеном
 +1 N 2 O +2 NO +3 N 2 O 3 HNO 2 несолетвірні +4 +5 N 2 O 4 HNO 3 NO 2 Солетвірні (кислотні) N 2 O 5
+1 N 2 O +2 NO +3 N 2 O 3 HNO 2 несолетвірні +4 +5 N 2 O 4 HNO 3 NO 2 Солетвірні (кислотні) N 2 O 5
 N 2 O Добування -3 +5 t +1 NH 4 NO 3 → N 2 O + H 2 O 4 е Молекула лінійна => sp - гібридизація NNO N+ ↑ ↑ N- N- = N+ = O ↓↑ ↑ ↑ N ≡ N + – O- ↑↓ -3 +5 -2 NNO N N O 113 пм 118 пм
N 2 O Добування -3 +5 t +1 NH 4 NO 3 → N 2 O + H 2 O 4 е Молекула лінійна => sp - гібридизація NNO N+ ↑ ↑ N- N- = N+ = O ↓↑ ↑ ↑ N ≡ N + – O- ↑↓ -3 +5 -2 NNO N N O 113 пм 118 пм
 Властивості N 2 O – безбарвний газ зі слабким приємним запахом, разчинний у воді 1, 3 V N 2 O в 1 V H 2 O (н. у) tпл = -910 С tкип = -88, 50 С N 2 O “звеселяючий газ” t >5000 2 N 2 O → 2 N 2 + O 2
Властивості N 2 O – безбарвний газ зі слабким приємним запахом, разчинний у воді 1, 3 V N 2 O в 1 V H 2 O (н. у) tпл = -910 С tкип = -88, 50 С N 2 O “звеселяючий газ” t >5000 2 N 2 O → 2 N 2 + O 2
 N 2 O підтримує горіння багатьох речовин N 2 O – окисник, в водних розчинах може відновлюватись до NH 3, NH 2 OH N 2 O + Cu → N 2 + Cu. O N 2 O + H 2 → N 2 + H 2 O 2 N 2 O + 3 NH 3 → 4 N 2 + 3 H 2 O
N 2 O підтримує горіння багатьох речовин N 2 O – окисник, в водних розчинах може відновлюватись до NH 3, NH 2 OH N 2 O + Cu → N 2 + Cu. O N 2 O + H 2 → N 2 + H 2 O 2 N 2 O + 3 NH 3 → 4 N 2 + 3 H 2 O
 NO – газ без кольору і без запаху tпл = -1640 С tкип = -1510 С Молекула малополярна (μ = 2· 10 -31 Кл·м) Тому погано розчиняється у воді 7 V NO в 100 V H 2 O (00 C)
NO – газ без кольору і без запаху tпл = -1640 С tкип = -1510 С Молекула малополярна (μ = 2· 10 -31 Кл·м) Тому погано розчиняється у воді 7 V NO в 100 V H 2 O (00 C)
 АО N К. зв. =2, 5 МО NO AO O
АО N К. зв. =2, 5 МО NO AO O
 Димеризація може відбуватися за низьких температур (в твердому стані 100% N 2 O 2) ON· + · NO ⇆ ONNO N 2 O 2 Добування: Cu + 8 HNO 3(розв) → 3 Cu(NO 3)2 + 2 NO + 4 H 2 O В промисловості: 4 NH 3 + 5 O 2 Kat → 4 NO + 6 H 2 O
Димеризація може відбуватися за низьких температур (в твердому стані 100% N 2 O 2) ON· + · NO ⇆ ONNO N 2 O 2 Добування: Cu + 8 HNO 3(розв) → 3 Cu(NO 3)2 + 2 NO + 4 H 2 O В промисловості: 4 NH 3 + 5 O 2 Kat → 4 NO + 6 H 2 O
 В невеликих кількостях NO утворюється в атмосфері під час грозових розрядів N 2 + O 2 ⇆ 2 NO ∆ H= 90, 3 к. Дж/моль ∆S = 8, 7 Дж/моль·K
В невеликих кількостях NO утворюється в атмосфері під час грозових розрядів N 2 + O 2 ⇆ 2 NO ∆ H= 90, 3 к. Дж/моль ∆S = 8, 7 Дж/моль·K
 NO - відновник +2 2 NO + O 2 → 2 NO 2 (на повітрі, швидко) +4 +3 2 NO + Cl 2 → 2 NOCl – хлористий нітрозил (отруйний бурий газ) 5 NO + 2 KMn. O 4 + 6 H 2 SO 4 → 5 HNO 3 + 3 Mn. SO 4 + 3 KHSO 4 + 2 H 2 O
NO - відновник +2 2 NO + O 2 → 2 NO 2 (на повітрі, швидко) +4 +3 2 NO + Cl 2 → 2 NOCl – хлористий нітрозил (отруйний бурий газ) 5 NO + 2 KMn. O 4 + 6 H 2 SO 4 → 5 HNO 3 + 3 Mn. SO 4 + 3 KHSO 4 + 2 H 2 O
 NO може бути також окисником NO – стійкий розкладається лише за високих температур 2 NO t >5000 C → N 2 + O 2 В NO горять речовини, які зв’язують оксиген 2 H 2 + 2 NO → N 2↑ + 2 H 2 O
NO може бути також окисником NO – стійкий розкладається лише за високих температур 2 NO t >5000 C → N 2 + O 2 В NO горять речовини, які зв’язують оксиген 2 H 2 + 2 NO → N 2↑ + 2 H 2 O
 t 4 P + 10 NO → 5 N 2 + 2 P 2 O 5 t 2 Cu + 2 NO → N 2↑ + Cu. O 5 Cr. Cl 2 + NO + 4 H 2 → NH 3↑ + 5 Cr(OH)Cl 2
t 4 P + 10 NO → 5 N 2 + 2 P 2 O 5 t 2 Cu + 2 NO → N 2↑ + Cu. O 5 Cr. Cl 2 + NO + 4 H 2 → NH 3↑ + 5 Cr(OH)Cl 2
 N 2 O 3 Утворюється при охолодженні суміші NO та NO 2 ON· + ·NO 2 ⇆ N 2 O 3 речовина світло-синього кольору tпл = -1020 С 1160 O пм 186 пм 4 N 11 N O 121 пм 1130 O
N 2 O 3 Утворюється при охолодженні суміші NO та NO 2 ON· + ·NO 2 ⇆ N 2 O 3 речовина світло-синього кольору tпл = -1020 С 1160 O пм 186 пм 4 N 11 N O 121 пм 1130 O
 N 2 O 3 + H 2 O ⇆ HNO 2 – азотиста(нітритна) кислота Солі азотистої кислоти (нітрити) в промисловості добувають NO + NO 2 + 2 Na. OH → 2 Na. NO 2 + H 2 O
N 2 O 3 + H 2 O ⇆ HNO 2 – азотиста(нітритна) кислота Солі азотистої кислоти (нітрити) в промисловості добувають NO + NO 2 + 2 Na. OH → 2 Na. NO 2 + H 2 O
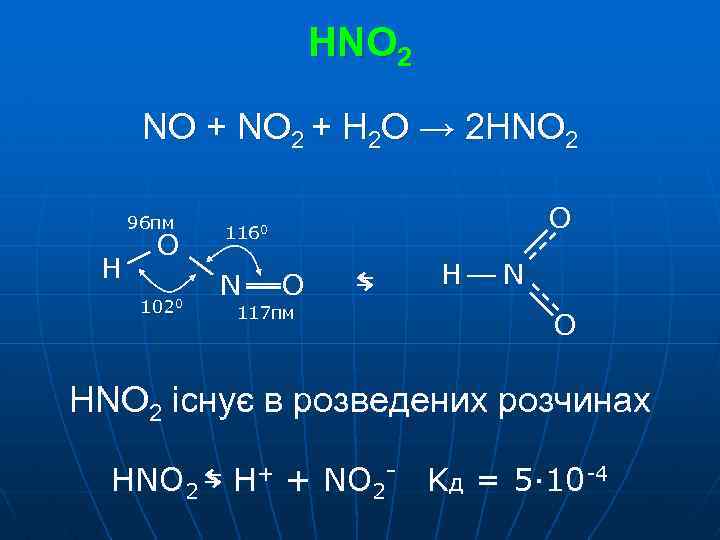 HNO 2 NO + NO 2 + H 2 O → 2 HNO 2 96 пм H O 1020 O 1160 N O 117 пм ⇆ H N O HNO 2 існує в розведених розчинах HNO 2 ⇆ H+ + NO 2 - Kд = 5· 10 -4
HNO 2 NO + NO 2 + H 2 O → 2 HNO 2 96 пм H O 1020 O 1160 N O 117 пм ⇆ H N O HNO 2 існує в розведених розчинах HNO 2 ⇆ H+ + NO 2 - Kд = 5· 10 -4
 HNO 2 проявляє амфотерні властивості O ONOH + H 2 SO 4 → N O O S H O O Нітрозилсірчана кислота NO+Clхлористий нітрозил +H 2 O
HNO 2 проявляє амфотерні властивості O ONOH + H 2 SO 4 → N O O S H O O Нітрозилсірчана кислота NO+Clхлористий нітрозил +H 2 O
 +3 N може проявляти як окисні так і відновні властивості +3 2 HNO 2 → N 2 O 3 + H 2 O +2 +4 NO NO 2
+3 N може проявляти як окисні так і відновні властивості +3 2 HNO 2 → N 2 O 3 + H 2 O +2 +4 NO NO 2
 Окисні властивості більш характерні ніж відновні HNO 2 + H+ + 1 e ⇆ NO + H 2 O E 0 = 1, 00 B H 2 S + 2 HNO 2→ S + NO + 2 H 2 O -1 +3 0 +2 2 KJ + 2 Na. NO 2 + 2 H 2 SO 4 → J 2 + 2 NO + ↓ 1 e· 2 ↑ 1 e K 2 SO 4 + Na 2 SO 4 + 2 H 2 O +7 +3 +2 2 KMn. O 4 + 5 Na. NO 2 +3 H 2 SO 4 → 2 Mn. SO 4 + ↑ 5 e +5 5 Na. NO 3 + K 2 SO 4 + 3 H 2 O ↓ 2 e
Окисні властивості більш характерні ніж відновні HNO 2 + H+ + 1 e ⇆ NO + H 2 O E 0 = 1, 00 B H 2 S + 2 HNO 2→ S + NO + 2 H 2 O -1 +3 0 +2 2 KJ + 2 Na. NO 2 + 2 H 2 SO 4 → J 2 + 2 NO + ↓ 1 e· 2 ↑ 1 e K 2 SO 4 + Na 2 SO 4 + 2 H 2 O +7 +3 +2 2 KMn. O 4 + 5 Na. NO 2 +3 H 2 SO 4 → 2 Mn. SO 4 + ↑ 5 e +5 5 Na. NO 3 + K 2 SO 4 + 3 H 2 O ↓ 2 e
 Оксид азоту (IV) NO 2 120 пм O · N 1300 O sp 2 - гібридизація ↑ ↑ ↑ N ↑↓ ↑ ↑ ↓↑ *N ↑
Оксид азоту (IV) NO 2 120 пм O · N 1300 O sp 2 - гібридизація ↑ ↑ ↑ N ↑↓ ↑ ↑ ↓↑ *N ↑
 . . · O N O
. . · O N O
 O O O N· + ·N 2 NO 2 -110 С ⇆ бурий газ O → O 2 N : NO 2 N 2 O 4 ∆H<0 безбарвна речовина O 175 пм N O O N O За t = 1500 C в парі існують тільки мономери NO 2
O O O N· + ·N 2 NO 2 -110 С ⇆ бурий газ O → O 2 N : NO 2 N 2 O 4 ∆H<0 безбарвна речовина O 175 пм N O O N O За t = 1500 C в парі існують тільки мономери NO 2
 +4 +3 +5 2 NO 2 + H 2 O → HNO 2 + HNO 3 Оксиду NO 2 – відповідають дві кислоти 2 NO 2 + 2 KOH → KNO 2 + KNO 3 +H 2 O NO 2 + Ca(OH)2 → У разі розинення в гарячій воді 2 NO 2 + H 2 O → HNO 3 + HNO 2 H 2 O N 2 O 3 NO t NO 2 3 NO 2 + H 2 O → 2 HNO 3 + NO↑
+4 +3 +5 2 NO 2 + H 2 O → HNO 2 + HNO 3 Оксиду NO 2 – відповідають дві кислоти 2 NO 2 + 2 KOH → KNO 2 + KNO 3 +H 2 O NO 2 + Ca(OH)2 → У разі розинення в гарячій воді 2 NO 2 + H 2 O → HNO 3 + HNO 2 H 2 O N 2 O 3 NO t NO 2 3 NO 2 + H 2 O → 2 HNO 3 + NO↑
 Якщо NO 2 розчиняється у воді в присутності кисню, то утворюється тільки азотна (нітратна) кислота 4 NO 2 + 2 H 2 O + O 2 → 4 HNO 3 2 NO 2 >5000 C → 2 NO↑ + O 2↑ Тому за високих температур NO 2 сильний окисник t 8 P + 10 NO 2 → 4 P 2 O 5 + 5 N 2 t 2 C + 2 NO 2 → 2 CO 2 + N 2
Якщо NO 2 розчиняється у воді в присутності кисню, то утворюється тільки азотна (нітратна) кислота 4 NO 2 + 2 H 2 O + O 2 → 4 HNO 3 2 NO 2 >5000 C → 2 NO↑ + O 2↑ Тому за високих температур NO 2 сильний окисник t 8 P + 10 NO 2 → 4 P 2 O 5 + 5 N 2 t 2 C + 2 NO 2 → 2 CO 2 + N 2
 N 2 O 5 2 HNO 3 + P 2 O 5 → N 2 O 5 + 2 HPO 3 +4 +5 -2 0 2 NO 2 + O 3 → N 2 O 5 + O 2 ↓ 1 e O 2·O ↑+2 e
N 2 O 5 2 HNO 3 + P 2 O 5 → N 2 O 5 + 2 HPO 3 +4 +5 -2 0 2 NO 2 + O 3 → N 2 O 5 + O 2 ↓ 1 e O 2·O ↑+2 e
 tсубл = 320 С в твердому стані N 2 O 5 - іонна сполука NO 2+NO 3 - нітрат нітронію В газоподібному стані має молекулярну будову N O 121 пм 146 пм O O 950 N 1340 O O
tсубл = 320 С в твердому стані N 2 O 5 - іонна сполука NO 2+NO 3 - нітрат нітронію В газоподібному стані має молекулярну будову N O 121 пм 146 пм O O 950 N 1340 O O
 N 2 O 5 + H 2 O → 2 HNO 3 не використовується в промисловості для добування HNO 3 N 2 O 5 + 2 Na. OH → 2 Na. NO 3 + H 2 O
N 2 O 5 + H 2 O → 2 HNO 3 не використовується в промисловості для добування HNO 3 N 2 O 5 + 2 Na. OH → 2 Na. NO 3 + H 2 O
 N 2 O 5 дуже нестійка сполука, розкладається вже за звичайних умов 2 N 2 O 5 → 4 NO 2 + O 2 N 2 O 5 – сильний окисник, реакції за участі N 2 O 5 відбуваються бурхливо N 2 O 5 + 5 H 2 → N 2 + 5 H 2 O N 2 O 5 + 2 P → N 2 + P 2 O 5
N 2 O 5 дуже нестійка сполука, розкладається вже за звичайних умов 2 N 2 O 5 → 4 NO 2 + O 2 N 2 O 5 – сильний окисник, реакції за участі N 2 O 5 відбуваються бурхливо N 2 O 5 + 5 H 2 → N 2 + 5 H 2 O N 2 O 5 + 2 P → N 2 + P 2 O 5
 HNO 3 Азотна (нітратна) кислота N 2 → NH 3 → NO 2 → HNO 3 4 NO 2 + 2 H 2 O → 4 HNO 3 Таким чином (за звичайного тиску) отримують 50% HNO 3 60 -62% отримують за підвищеного тиску (1 МПа)
HNO 3 Азотна (нітратна) кислота N 2 → NH 3 → NO 2 → HNO 3 4 NO 2 + 2 H 2 O → 4 HNO 3 Таким чином (за звичайного тиску) отримують 50% HNO 3 60 -62% отримують за підвищеного тиску (1 МПа)
 Будова молекули H O + N O H O O- + O- N O ↓↑ ↑ ↑ O- ↑↓ N+ ↑ H O + O -1/2 N O -1/2
Будова молекули H O + N O H O O- + O- N O ↓↑ ↑ ↑ O- ↑↓ N+ ↑ H O + O -1/2 N O -1/2
 H 96 пм 1090 O - м п 21 1 N 141 пм O O 1300 122 пм O N 1140 O 1200 O
H 96 пм 1090 O - м п 21 1 N 141 пм O O 1300 122 пм O N 1140 O 1200 O
 Властивості HNO 3 Сильна кислота HNO 3 → H+ + NO 3 Cильний окисник 0 +5 +5 +2 3 J 2 + 10 HNO 3 → HJO 3 + 10 NO + 2 H 2 O ↓ 5 e· 2 ↑ 3 e 3 P + 5 HNO 3 + H 2 O → 3 H 3 PO 4 + 5 NO
Властивості HNO 3 Сильна кислота HNO 3 → H+ + NO 3 Cильний окисник 0 +5 +5 +2 3 J 2 + 10 HNO 3 → HJO 3 + 10 NO + 2 H 2 O ↓ 5 e· 2 ↑ 3 e 3 P + 5 HNO 3 + H 2 O → 3 H 3 PO 4 + 5 NO
 Взаємодія з металами Me + HNO 3 → → сіль + продукт відновлення N + H 2 O Концентрована HNO 3 Розведена HNO 3 +4 NO 2 +2 +1 0 -3 NO N 2 NH 4 NO 3
Взаємодія з металами Me + HNO 3 → → сіль + продукт відновлення N + H 2 O Концентрована HNO 3 Розведена HNO 3 +4 NO 2 +2 +1 0 -3 NO N 2 NH 4 NO 3
 NO 3 - + 1 e + 2 H+ ⇆ NO 2 + H 2 O E 0 = 0, 80 B NO 3 - + 3 e + 4 H+ ⇆ NO + 2 H 2 O 2 NO 3 - + 8 e + 10 H+ ⇆ N 2 O + 5 H 2 O E 0 = 0, 96 B E 0 = 1, 12 B 2 NO 3 - + 10 e + 12 H+ ⇆ N 2 + 6 H 2 O E 0 = 1, 25 B NO 3 - + 8 e + 10 H+ ⇆ NH 4+ + 3 H 2 O E 0 = 0, 87 B
NO 3 - + 1 e + 2 H+ ⇆ NO 2 + H 2 O E 0 = 0, 80 B NO 3 - + 3 e + 4 H+ ⇆ NO + 2 H 2 O 2 NO 3 - + 8 e + 10 H+ ⇆ N 2 O + 5 H 2 O E 0 = 0, 96 B E 0 = 1, 12 B 2 NO 3 - + 10 e + 12 H+ ⇆ N 2 + 6 H 2 O E 0 = 1, 25 B NO 3 - + 8 e + 10 H+ ⇆ NH 4+ + 3 H 2 O E 0 = 0, 87 B
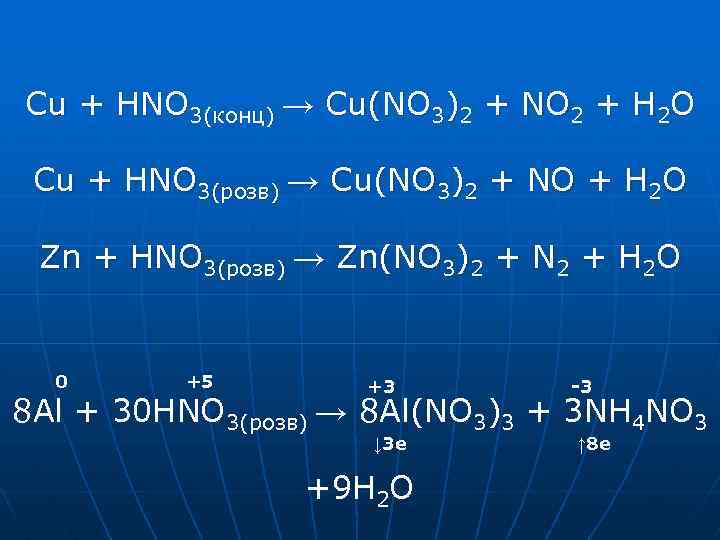 Cu + HNO 3(конц) → Cu(NO 3)2 + NO 2 + H 2 O Cu + HNO 3(розв) → Cu(NO 3)2 + NO + H 2 O Zn + HNO 3(розв) → Zn(NO 3)2 + N 2 + H 2 O 0 +5 +3 -3 8 Al + 30 HNO 3(розв) → 8 Al(NO 3)3 + 3 NH 4 NO 3 ↓ 3 e +9 H 2 O ↑ 8 e
Cu + HNO 3(конц) → Cu(NO 3)2 + NO 2 + H 2 O Cu + HNO 3(розв) → Cu(NO 3)2 + NO + H 2 O Zn + HNO 3(розв) → Zn(NO 3)2 + N 2 + H 2 O 0 +5 +3 -3 8 Al + 30 HNO 3(розв) → 8 Al(NO 3)3 + 3 NH 4 NO 3 ↓ 3 e +9 H 2 O ↑ 8 e

 Концентрована HNO 3 на холоді пасивує деякі метали: Al, Fe, Co, Ni, Cr та їх сплави HNO 3 не діє на Au, Os, Ir, Pt, Nb, Ta, W Царська горілка: суміш концентрованої HNO 3 і HCl (1: 3) 3 HCl + HNO 3 → NOCl + Cl 2 + 2 H 2 O 2 NOCl → 2 NO + Cl 2
Концентрована HNO 3 на холоді пасивує деякі метали: Al, Fe, Co, Ni, Cr та їх сплави HNO 3 не діє на Au, Os, Ir, Pt, Nb, Ta, W Царська горілка: суміш концентрованої HNO 3 і HCl (1: 3) 3 HCl + HNO 3 → NOCl + Cl 2 + 2 H 2 O 2 NOCl → 2 NO + Cl 2
 Au + HNO 3 + 3 HCl → Au. Cl 3 + NO + 2 H 2 O 3 Pt + 4 HNO 3 + 18 HCl → 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O
Au + HNO 3 + 3 HCl → Au. Cl 3 + NO + 2 H 2 O 3 Pt + 4 HNO 3 + 18 HCl → 3 H 2[Pt. Cl 6] + 4 NO + 8 H 2 O
 Солі азотної кислоти Добування: взаємодія HNO 3 з металами, оксидами, гідроксидами, карбонатами Всі нітрати добре розчиняються у воді Термічний розклад солей HNO 3 2 KNO 3 → 2 KNO 2 + O 2 t t 2 Cu(NO 3)2 → 2 Cu. O + 4 NO 2 + O 2 t 2 Ag. NO 3 → 2 Ag + 2 NO 2 + O 2 t NH 4 NO 3 → N 2 O + 2 H 2 O t 2 NH NO → 2 N + O + 4 H O
Солі азотної кислоти Добування: взаємодія HNO 3 з металами, оксидами, гідроксидами, карбонатами Всі нітрати добре розчиняються у воді Термічний розклад солей HNO 3 2 KNO 3 → 2 KNO 2 + O 2 t t 2 Cu(NO 3)2 → 2 Cu. O + 4 NO 2 + O 2 t 2 Ag. NO 3 → 2 Ag + 2 NO 2 + O 2 t NH 4 NO 3 → N 2 O + 2 H 2 O t 2 NH NO → 2 N + O + 4 H O



