 Спирты Выполнил : Николаевский Александр
Спирты Выполнил : Николаевский Александр
 План: Ø Определение данного класса веществ Ø Общая формула, характеристика связей Ø Номенклатура Ø Изомерия Ø Физические свойства
План: Ø Определение данного класса веществ Ø Общая формула, характеристика связей Ø Номенклатура Ø Изомерия Ø Физические свойства
 Общая формула предельных одноатомных спиртов Сn. H 2 n+1 OH n>1 или n=1 Все связи ковалентные. Между C – C неполярные , между C – H слабополярные, в группе OH сильно полярные.
Общая формула предельных одноатомных спиртов Сn. H 2 n+1 OH n>1 или n=1 Все связи ковалентные. Между C – C неполярные , между C – H слабополярные, в группе OH сильно полярные.
 Номенклатура: Название спиртов происходит от названия соответствующего углеводорода с добавлением суффикса - ол Или от названия углеводородного радикала с добавлением суффикса - овый Положение группы ОН указывается цифрой в конце.
Номенклатура: Название спиртов происходит от названия соответствующего углеводорода с добавлением суффикса - ол Или от названия углеводородного радикала с добавлением суффикса - овый Положение группы ОН указывается цифрой в конце.
 CH 3 – OH метанол (метиловый спирт) C 2 H 5 – OH этанол (этиловый спирт) CH 3 – CH 2 – OH пропанол-1 (первичный спирт) CH 3 – CH 3 пропанол-2 (вторичный спирт) | OH
CH 3 – OH метанол (метиловый спирт) C 2 H 5 – OH этанол (этиловый спирт) CH 3 – CH 2 – OH пропанол-1 (первичный спирт) CH 3 – CH 3 пропанол-2 (вторичный спирт) | OH
 Внутриклассовая изомерия предельных одноатомных спиртов: 1)изомерия углеродного скелета. 2) изомерия положения гидроксильной группы.
Внутриклассовая изомерия предельных одноатомных спиртов: 1)изомерия углеродного скелета. 2) изомерия положения гидроксильной группы.
 CH 3 OH 1 изомер метанол C 2 H 5 OH этанол CH 3 – CH 2 – OH 1 изомер
CH 3 OH 1 изомер метанол C 2 H 5 OH этанол CH 3 – CH 2 – OH 1 изомер
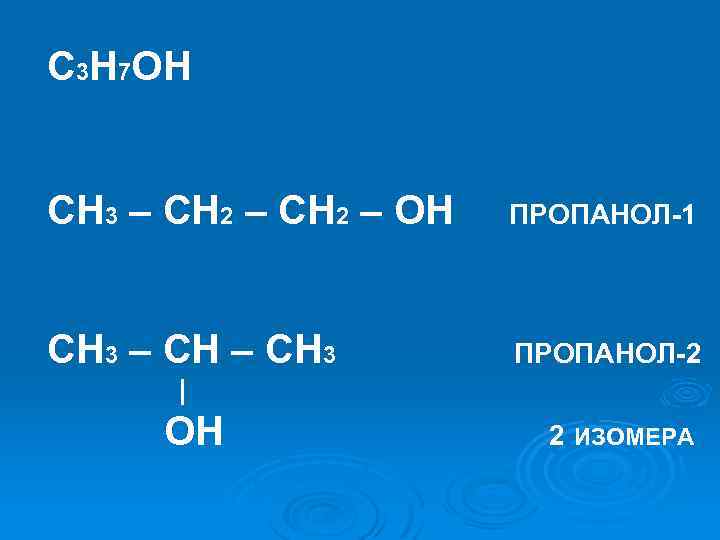 C 3 H 7 OH CH 3 – CH 2 – OH ПРОПАНОЛ-1 CH 3 – CH 3 ПРОПАНОЛ-2 | OH 2 ИЗОМЕРА
C 3 H 7 OH CH 3 – CH 2 – OH ПРОПАНОЛ-1 CH 3 – CH 3 ПРОПАНОЛ-2 | OH 2 ИЗОМЕРА
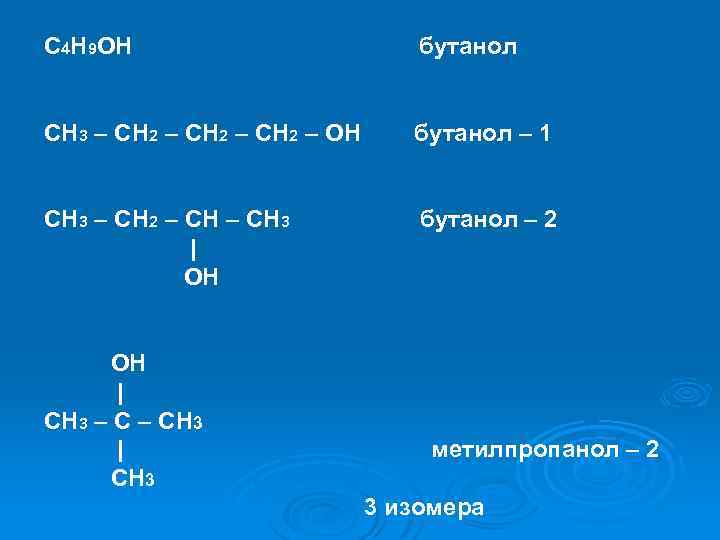 С 4 H 9 OH бутанол CH 3 – CH 2 – СH 2 – OH бутанол – 1 CH 3 – CH 2 – CH 3 бутанол – 2 | OH | CH 3 – CH 3 | метилпропанол – 2 CH 3 3 изомера
С 4 H 9 OH бутанол CH 3 – CH 2 – СH 2 – OH бутанол – 1 CH 3 – CH 2 – CH 3 бутанол – 2 | OH | CH 3 – CH 3 | метилпропанол – 2 CH 3 3 изомера
 Домашнее задание: 1. Постройте структурные формулы спиртов с молекулярной формулой C 5 H 11 OH и C 6 H 13 OH. Назовите их. Определите какой из спиртов первичный, какой вторичный и какой третичный.
Домашнее задание: 1. Постройте структурные формулы спиртов с молекулярной формулой C 5 H 11 OH и C 6 H 13 OH. Назовите их. Определите какой из спиртов первичный, какой вторичный и какой третичный.
 Межклассовая изомерия: Предельные одноатомные спирты изомерны простым эфирам. Общая формула простых эфиров: R 1 – O – R 2 R 1 и R 2 – углеводородные радикалы
Межклассовая изомерия: Предельные одноатомные спирты изомерны простым эфирам. Общая формула простых эфиров: R 1 – O – R 2 R 1 и R 2 – углеводородные радикалы
 CH 3 OH – не характерна C 2 H 5 OH CH 3 – O – CH 3 диметиловый эфир (симметричный) 1 изомер C 3 H 7 OH CH 3 – O – C 2 H 5 метилэтиловый эфир (несимметричный) 1 изомер
CH 3 OH – не характерна C 2 H 5 OH CH 3 – O – CH 3 диметиловый эфир (симметричный) 1 изомер C 3 H 7 OH CH 3 – O – C 2 H 5 метилэтиловый эфир (несимметричный) 1 изомер
 Домашнее задание: Какие эфиры изомерны бутанолу, пентанолу, гексанолу ? Постройте их структурные формулы, назовите, определите их симметричность.
Домашнее задание: Какие эфиры изомерны бутанолу, пентанолу, гексанолу ? Постройте их структурные формулы, назовите, определите их симметричность.
 Физические свойства спиртов: 1. Агрегатное состояние : среди спиртов нет газообразных веществ. Причина в водородных связях, которые устанавливаются между молекулами спиртов. 2. Низшие спирты - бесцветные легковоспламеняющиеся жидкости с характерным запахом. Высшие – твёрдые вещества.
Физические свойства спиртов: 1. Агрегатное состояние : среди спиртов нет газообразных веществ. Причина в водородных связях, которые устанавливаются между молекулами спиртов. 2. Низшие спирты - бесцветные легковоспламеняющиеся жидкости с характерным запахом. Высшие – твёрдые вещества.
 3. Отношение в воде: хорошо растворяются в воде. Причина в водородных связях, которые устанавливаются между молекулами спиртов и молекулами воды. По мере увеличения молекулярной массы растворимость снижается. 4. Температура кипения спиртов увеличивается по мере увеличения молекулярной массы. Температура кипения этанола равна 78, 39 °C.
3. Отношение в воде: хорошо растворяются в воде. Причина в водородных связях, которые устанавливаются между молекулами спиртов и молекулами воды. По мере увеличения молекулярной массы растворимость снижается. 4. Температура кипения спиртов увеличивается по мере увеличения молекулярной массы. Температура кипения этанола равна 78, 39 °C.
 Домашнее задание; Изобразите схему образования водородной связи, устанавливающуюся между молекулами метанола; метанола и воды. 2. Какой спирт бутанол – 1 или метилпропанол – 1 лучше растворяется в воде и почему ? У какого из этих спиртов ниже температура кипения ? 3. Расположите следующие вещества по мере увеличения температуры кипения: метанол, этанол, вода, уксусная кислота, ацетон, диметиловый эфир (используйте дополнительную справочную литературу). 1.
Домашнее задание; Изобразите схему образования водородной связи, устанавливающуюся между молекулами метанола; метанола и воды. 2. Какой спирт бутанол – 1 или метилпропанол – 1 лучше растворяется в воде и почему ? У какого из этих спиртов ниже температура кипения ? 3. Расположите следующие вещества по мере увеличения температуры кипения: метанол, этанол, вода, уксусная кислота, ацетон, диметиловый эфир (используйте дополнительную справочную литературу). 1.