Спирты_2016.pptx
- Количество слайдов: 52

Спирты

Общая характеристика Предельные одноатомные спирты – гидроксильные производные алканов, полученные при замещении одного атома водорода в молекуле алкана на одну гидроксильную группу Cn. H 2 n+2 → Cn. H 2 n+1− OH или R−OH или Cn. H 2 n+2 О, где n ≥ 1 Простейший представитель СН 3− OH метанол или метиловый спирт

Понятие о первичных, вторичных и третичных спиртах * СН 3−СН 2−СН 2−ОН * первичный спирт, бутанол-1, бутиловый спирт (А) СН 3−СН−СН 2 ∣ ∣ СН 3 ОН первичный спирт, 2 -метилпропанол-1, изобутиловый спирт (В) СН 3−СН 2−СН−СН 3 ∣ ОН вторичный спирт, бутанол-2, вторбутиловый спирт (С) ** СН 3 третичный спирт, ∣ *** 2 -метилпропанол-2, СН 3−С −СН 3 третбутиловый спирт (D) ∣ ОН Изомеры С-скелета : (А) и (В), (С) и (D); Изомеры положения группы −ОН: (А) и (С), (В) и (D)

Спирты Физические свойства
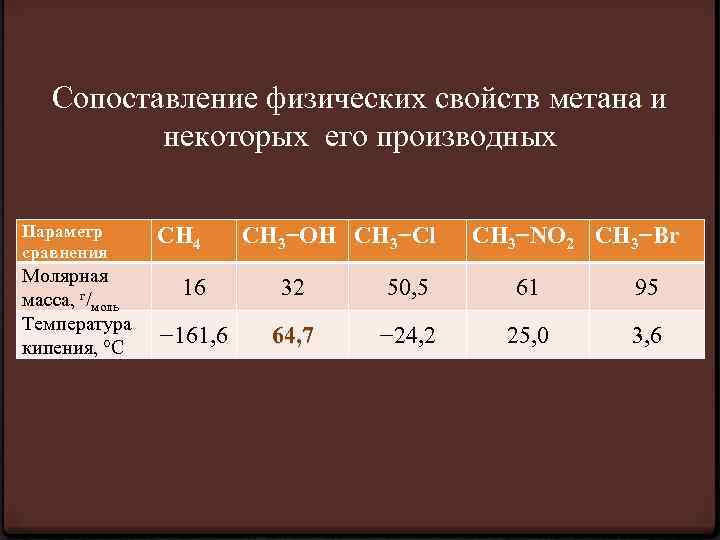
Сопоставление физических свойств метана и некоторых его производных Параметр сравнения Молярная масса, г/моль Температура кипения, °С CH 4 CH 3−OH CH 3−Cl CH 3−NO 2 CH 3−Br 16 32 50, 5 61 95 − 161, 6 64, 7 − 24, 2 25, 0 3, 6

Энергия связей в метаноле Водородная связь 16, 7 Энергия связи, к. Дж/моль Связь С—H Связь С—O Связь O—H 391, 7 383, 5 428, 8
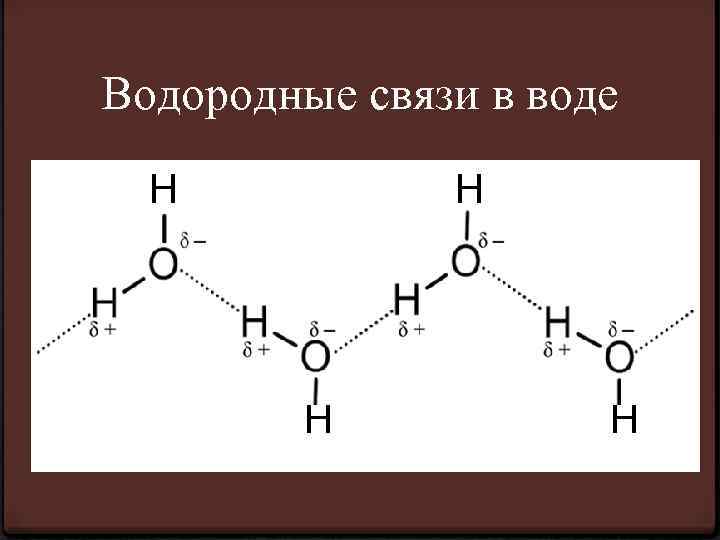
Водородные связи в воде Н Н
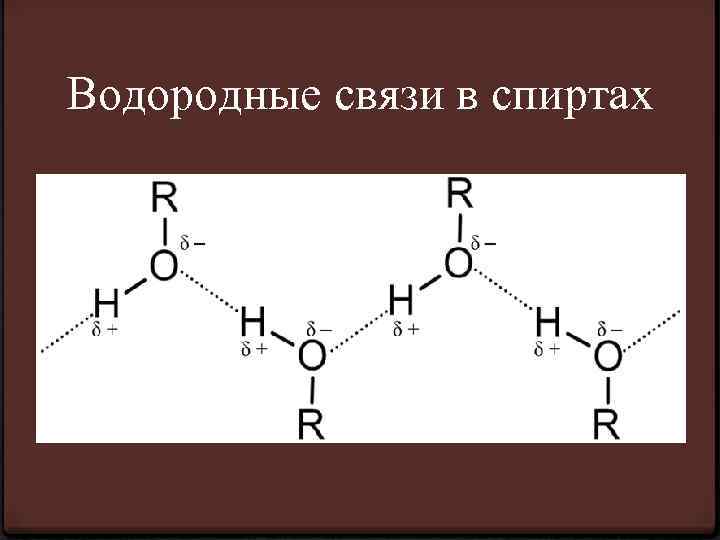
Водородные связи в спиртах
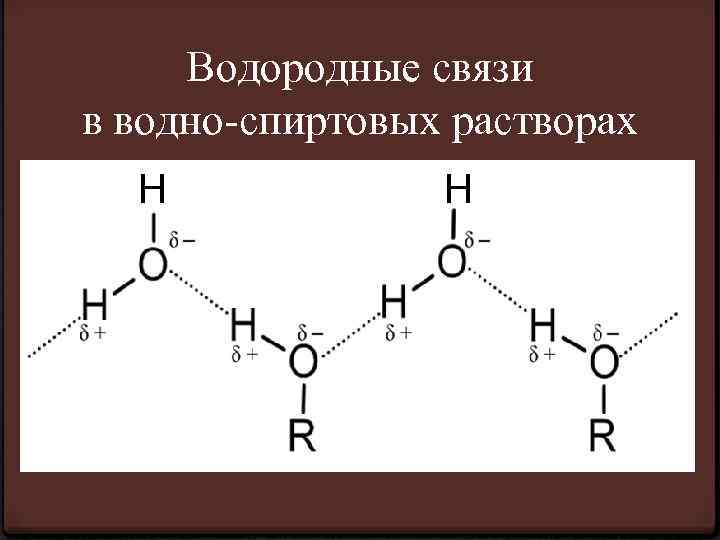
Водородные связи в водно-спиртовых растворах Н Н

I. Промыш ленные методы пол учения спиртов

1. Получение метанола на основе синтез-газа Синтез-газ – смесь газообразных оксида углерода (II) и водорода: Zn. O*, tºC, p CO + 2 H 2 ⇆ CH 3 OH * другой катализатор – Cr 2 O 3 tºC = 380ºC− 420ºC; p = 250 атм = 2, 5*107 Па

2. Получение этанола – спиртовое брожение углеводов Микробиологический метод получения этанола дрожжи C 6 H 12 O 6 → 2 C 2 H 5 OH + 2 CO 2 Известный с давних времён способ получения этанола − спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п. ) под действием ферментов, дрожжей и бактерий. Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путем дистилляции.

3. Гидратация алкенов а) получение этилена 1) прямая гидратация в качестве катализатора применяют ортофосфорную кислоту, нанесённую на активированный уголь: tºC, p, H 3 PO 4 /Cактивированный CH 2=CH 2 + H 2 O ⇆ CH 3−CH 2−O−H tºC = 300ºC; p = 70 атм = 7*106 Па = 7 МПа 2) гидратация через стадию образования эфира серной кислоты (*) с последующим его гидролизом (**) tºC, p CH 2=CH 2 + H 2 SO 4 концентрированная ⇆ CH 3−CH 2−O−SO 2−O−H (*) Н−O−SO 2−O−H (этилсерная кислота) tºC, p CH 3−CH 2−O −SO 2−O−H + H 2 O ⇆ C 2 H 5 OH + H 2 SO 4 (**) tºC = 80ºC− 90ºC; p = 35 атм = 3, 5*106 Па = 3, 5 МПа

б. получение изопропанола – гидратация пропилена 1) прямая гидратация tºC, p, H 3 PO 4 /Cактивированный CH 3−CH=CH 2+ H 2 O ⇆ CH 3−CH−O−H │ CH 3 tºC = 240ºC− 260ºC; p = 70 атм = 7*106 Па = 7 МПа 2) гидратация через стадию образования эфира серной кислоты (*) с последующим его гидролизом (**) tºC, p изопропилсерная кислота CH 3−CH=CH 2 + H 2 SO 4 концентрированная ⇆ CH 3−CH−OSO 2−O−H (*) │ tºC, p CH 3−CH−O−SO 2−O−H + H 2 O ⇆ CH 3−CH−OH + H 2 SO 4 (**) │ │ CH 3 tºC = 80ºC− 90ºC; p = 35 атм = 3, 5*106 Па = 3, 5 Мпа

4. Гидрирование карбонильных соединений а) получение изопропанола –гидрирование ацетона tºC, p, Cu* CH 3−C −CH 3 + H 2 ⇆ CH 3−CH−CH 3 ║ │ O OH * другой катализатор − Ni; Cr
![б) получение изобутанола и бутанола Первая стадия− оксосинтез из пропилена (*) [Ni(СО)4], tºC, p б) получение изобутанола и бутанола Первая стадия− оксосинтез из пропилена (*) [Ni(СО)4], tºC, p](https://present5.com/presentation/1/-122119337_437534288.pdf-img/-122119337_437534288.pdf-16.jpg)
б) получение изобутанола и бутанола Первая стадия− оксосинтез из пропилена (*) [Ni(СО)4], tºC, p CH 3−CH=CH 2 + CO + H 2 → CH 3−CH 2−C−H + CH 3−CH−C−H ║ │ ║ O CH 3 O tºC = 120ºC− 160ºC; p = 200 атм – 350 атм = 20 *106 Па − 35*106 Па = 20 − 35 Мпа Вторая стадия− каталитическое гидрирование альдегидов (**) масляный альдегид изомасляный альдегид Ni, tºC, p CH 3−CH 2−C−H + CH 3−CH−C−H + Н 2 ⇆ ║ │ ║ O CH 3 O ⇆ CH 3−CH 2−CH 2−О−H + CH 3−CH−CH 2−О−H │ CH 3

II. Лаборат орные методы пол учения спиртов

1. Щелочной гидролиз галогеналканов – универсальный метод получения спиртов Проблема – процесс обратимый, выход спирта – низкий tºC R−Br + H−OH ⇆ R−OH + H−Br (1) Решение проблемы – понизить концентрацию продукта реакции H−Br, добавив щелочь H−Br + Na−OH → Н−OH + Na−Br (2) (1) + (2) = (3) tºC R−Br + Na−OH → R−OH или + Na−Br (3) H 2 O tºC R−Br + Na−OH водный → R−OH + Na−Br (3)

1. Щелочной гидролиз галогеналканов – универсальный метод получения спиртов а) получение первичных спиртов * tºC * СН 3−СН 2−Br + К−OH → СН 3−СН 2−OH + бутилбромид H 2 O + К−Br б) получение вторичных спиртов tºC ** ** СН 3−СН 2−СН(Br) −СН 3 + Na−OH → СН 3−СН 2−СН(OH) −СН 3 + вторбутилбромид H 2 O + Na−Br в) получение третичных спиртов *** tºC *** СН 3−С(Br) −СН 3 + Na−OH → СН 3−С(ОН) −СН 3 + Na−Br ∣ H 2 O ∣ СН 3 третбутилбромид

2. Взаимодействие первичных аминов с азотистой кислотой – универсальный метод получения спиртов R−NН 2 + H−O−N=O → R−OH первичный амин + N 2↑ + Н 2 О Качественная реакция на первичные амины − взаимодействие с азотистой кислотой HNO 2 или H−O−N=O Признаки реакции (наблюдения): ü изменение характера запаха; ü выделение газа − Сколько радикалов связано с атомом азота? − Один радикал − Следовательно, амин какой? − Первичный

Шаг в сторону: понятие о первичных, вторичных и третичных аминах * СН 3−СН 2−СН 2−NН 2 первичный амин с первичным радикалом , бутанамин-1, бутиламин (один радикал) ** СН 3−СН 2−СН−СН 3 ∣ первичный амин со вторичным радикалом , бутанамин-2, вторбутиламин (один радикал) СН 3 ∣ *** СН 3−С −СН 3 ∣ NН 2 СН 3−СН 2−NH−СН 2−СН 3 первичный амин с третичным радикалом , 2 -метилпропанамин-2, третбутиламин (один радикал) NН 2 СН 3−СН 2−N−СН 3 ∣ СН 3 вторичный амин, диэтиламин (два радикала) третичный амин, диметилэтиламин (три радикала)

2. Взаимодействие первичных аминов с азотистой кислотой – универсальный метод получения спиртов а) получение первичных спиртов бутиламин * СН 3−СН 2−СН 2−NH 2 + HO−N=O → → СН 3−СН 2−СН 2−OH + N 2 ↑ + H 2 O б) получение вторичных спиртов ** СН 3−СН 2−СН(NH 2)−СН 3 + HO−N=O → вторбутиламин → СН 3−СН 2−СН(OH)−СН 3 + N 2 ↑ + H 2 O в) получение третичных спиртов *** СН 3−С(NH 2) −СН 3 + HO−N=O → СН 3−С(ОН) −СН 3 + N 2 ↑ + H 2 O ∣ ∣ СН 3 третбутиламин

3. Гидролиз сложных эфиров – универсальный метод получения спиртов а) При кислотном гидролизе образуется спирт и карбоновая кислота Проблема – процесс обратимый, выход спирта – низкий H 2 SO 4 конц. tºC R−С−О−R' + H−OH ⇆ R−С−О−Н + R'−O−H ∥ ∥ О О или H 2 SO 4 конц. tºC R−СООR' + H−OH ⇆ R−СООН + R'−O−H (1) Решение проблемы – понизить концентрацию продукта реакции R−СООН, добавив щелочь R−СООН + Na−OH → Н−OH (1) + (2) = (3) + R−СООNa (2) б) При щелочном гидролизе образуется спирт и соль карбоновой кислоты R−СООR' + Na−OH → R−СООNa + R'−O−H H 2 O, tºC (3)

Алгоритм «Как сконструировать формулу сложного эфира, который необходимо подвергнуть гидролизу для получения спирта с заданной структурой» 1. Построить структурную формулу спирта, выделить радикал, связанный с группой −ОН СН 3−СН 2−СН−СН 3 ∣ ОН СН 3−С−О−Н ∥ О СН 3−С−О− ∥ О 2. Составить формулу карбоновой кислоты 3. «Убрать» атом Н карбоксильной группы карбоновой кислоты, выделить полученный фрагмент 4. Соединив выделенные фрагменты, получить структуру исходного сложного эфира СН 3−С−О−СН−СН 2−СН 3 ∥ ∣ О СН 3

3. Гидролиз сложных эфиров – универсальный метод получения спиртов а) получение первичных спиртов бутилацетат H 2 O, tºC СН 3−СООСН 2−СН 3 + Na−OH → СН 3−СООNa + СН 3−СН 2−СН 2−OH * б) получение вторичных спиртов вторбутилацетат H 2 O, tºC СН 3−СООСН(СН 3)−СН 2−СН 3 + Na−OH → СН 3−СООNa + + СН 3−СН−СН 2−СН 3 ∣ ** OH в) получение третичных спиртов СН 3 третбутилацетат H 2 O, tºC ∣ *** СН 3−СООС(СН 3)3 + Na−OH → СН 3−СООNa + СН 3−С−СН 3 ∣ OH
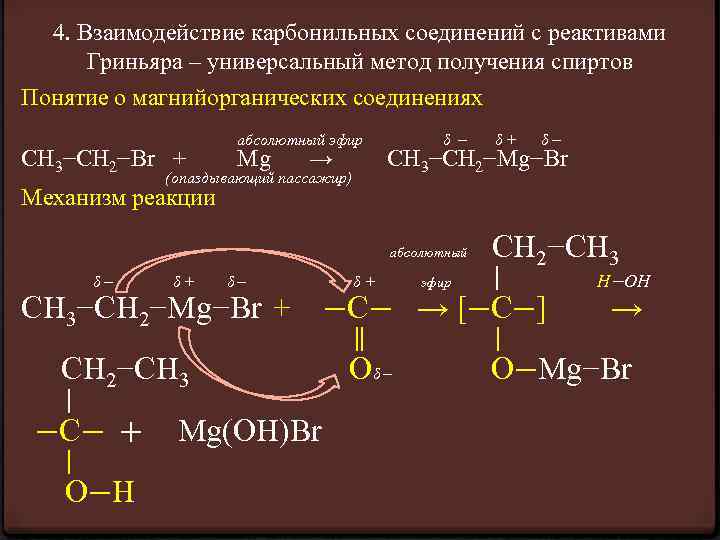
4. Взаимодействие карбонильных соединений с реактивами Гриньяра – универсальный метод получения спиртов Понятие о магнийорганических соединениях СН 3−СН 2−Br + абсолютный эфир Mg → (опаздывающий пассажир) δ− δ+ δ− СН 3−СН 2−Mg−Br Механизм реакции СН 2−СН 3 δ+ эфир ∣ Н−ОН −С− → [−С−] → ∥ ∣ Оδ − O−Mg−Br абсолютный δ− δ+ δ− СН 3−СН 2−Mg−Br + СН 2−СН 3 ∣ −С− + Mg(ОН)Br ∣ O−Н

4. Взаимодействие карбонильных соединений с реактивами Гриньяра – универсальный метод получения спиртов а) получение первичных спиртов {Н−Br} пропилмагнийбромид # абсолютный эфир СН 3−СН 2−Mg−Br + H−С−Н ∥ О # # Н−ОН → [СН 3−СН 2−СН 2−O−Mg−Br ] → формальдегид → СН 3−СН 2−СН 2−OH + Mg(ОН)Br {Mg Br 2} б) получение вторичных спиртов {Н−Br} этилмагнийбромид ## абсолютный эфир ## Н−ОН СН 3−СН 2−Mg−Br + СH 3−С−Н → [СН 3−СН 2−СН−O−Mg−Br ] → ∥ ∣ СН 3 О СН 3 ∣ ацетальдегид → СН 3−СН 2−СН−OH + Mg(ОН)Br {Mg Br 2} ## в) получение третичных спиртов СН 3 {Н−Br} СН 3 метилмагнийбромид ### абсолютный эфир ∣ ### Н−ОН ∣ ### СН 3−Mg−Br + СH 3−С−СH 3 → [СН 3−С−O−Mg−Br ] → СН 3−С−OH + ∥ ∣ ∣ О СН 3 + ацетон Mg(ОН)Br {Mg Br 2}

5. Гидратация алкенов – метод получения вторичных и третичных спиртов а) получение этанола – единственного первичного спирта этилен tºC, p этанол CH 2=CH 2 + Н−ОН ⇆ CH 3−CH 2−O−H (исключение) H 2 SO 4 концентрированная б) получение вторичных спиртов бутен-1 δ+ δ− tºC, p СН 3−СН 2−СН=СН 2 + Н−ОН ⇆ СН 3−СН 2−СН−СН 3 H 2 SO 4 концентрированная ∣ OН в) получение третичных спиртов 2 -метилпропен OН δ + δ− tºC, p ∣ СН 3−С=СН 2 + Н−ОН ⇆ СН 3−С−СН 3 ∣ H 2 SO 4 конц. ∣ СН 3

6. Каталитическое гидрирование карбонильных соединений – метод получения первичных и вторичных спиртов а) получение первичных спиртов бутаналь # СН 3−СН 2−С−Н ∥ О Ni, tºC, p # + Н 2 ⇆ СН 3−СН 2−СН 2−O−Н б) получение вторичных спиртов бутанон ## Ni, tºC, p ## СН 3−СН 2−С−СH 3 + Н 2 ⇆ СН 3−СН 2−СН−СН 3 ∥ ∣ О О−Н

7. Восстановление карбонильных соединений с помощью алюмогидрида лития – метод получения первичных и вторичных спиртов а) получение первичных спиртов бутаналь # 4 СН 3−СН 2−С−Н ∥ О 1) Li. Al. H 4, абсолютный эфир # → 4 СН 3−СН 2−СН 2−OН + Li. Al(OH)4 2) 4 Н 2 О б) получение вторичных спиртов бутанон ## 1) Li. Al. H 4, абсолютный эфир 4 СН 3−СН 2−С−СH 3 → СН 3−СН 2−СН−СН 3 + Li. Al(OH)4 ∥ 2) 4 Н 2 О ∣ ## О О−Н

Химически е свойства сп иртов

Для спиртов характерны реакции, которые сопровождаются разрывом üсвязи О−Н (I, кислотные свойства спиртов) первичные вторичные третичные увеличение активности üсвязи С−ОН (II, основные свойства спиртов, реакции нуклеофильного замещения SN у насыщенного атома углерода) первичные вторичные третичные увеличение активности

I. Кислотны е свойства сп иртов Реакции, ко торые сопровожд аются разрывом с вязи О┼Н

I. Кислотные свойства спиртов 1. Взаимодействие с активными – щелочными металлами СН 3−СН 2−О−Н + Na → СН 3−СН 2−О−Na + ½Н 2↑ 2 СН 3−СН 2−О−Н + 2 Na → 2 СН 3−СН 2−О−Na + Н 2↑ этиловый спирт этилат натрия − соль спирта − алкоголят СН 3−О−Н + Na → СН 3−О−Na 2 СН 3−О−Н + 2 Na → 2 СН 3−О−Na метиловый спирт + ½Н 2↑ + Н 2↑ метилат натрия − соль спирта − алкоголят 2. Взаимодействие со щелочами R−О−Н + Na−О−Н ≠ СН 3−О−Na + Н 2 О → СН 3−О−Н + Na−О−Н соль (алкоголят натрия) спирт щелочь необратимый гидролиз соли, образованной слабой кислотой (спиртом) и сильным основанием (гидроксидом щелочного металла)

I. Кислотные свойства спиртов 3. Взаимодействие с кислотами – реакция этерификации – образование сложных эфиров а) этерификация минеральными кислотами ü взаимодействие с азотной кислотой НNО 3 или Н−О−NО 2 H 2 SO 4 концентрированная СН 3−СН 2−О−(Н + Н−О)−NО 2 ⇄ СН 3−СН 2−О−NО 2 + + Н−ОН этиловый спирт этилнитрат Внимание: сложные эфиры азотной кислоты не путать с нитропроизводными алканов СН 3−СН 2−NО 2 − нитроэтан

I. Кислотные свойства спиртов ü взаимодействие с серной кислотой H 2 SO 4 или Н−О−SО 2−O−H СН 3−СН 2−О−(Н + Н−О)−SО 2−O−H концентрированная ⇄ ⇄ СН 3−СН 2−О−SО 2−O−Н + Н−ОН этилсульфат (нет избытка спирта) 2 СН 3−СН 2−О−(Н + Н−О)−SО 2−(O−H концентрированная ⇄ ⇄ СН 3−СН 2−О−SО 2−O−CH 2−CH 3 + 2 Н−ОН диэтилсульфат (есть избыток спирта) Внимание: сложные эфиры серной кислоты не путать с сульфопроизводными алканов СН 3−СН 2−SО 2−O−Н − сульфоэтан или этансульфокислота

I. Кислотные свойства спиртов 3. Взаимодействие с кислотами – реакция этерификации – образование сложных эфиров б) этерификация карбоновыми кислотами H 2 SO 4 концентрированная СН 3−СН 2−О−(Н + Н−О)−С–СН 3 ⇄ пропиловый спирт ║ уксусная кислота О ⇄ СН 3−СН 2−О−С–СН 3 + Н−ОН ║ О или H 2 SO 4 концентрированная СН 3−СН 2−О−(Н + НО)ОС–СН 3 ⇄ СН 3−СОО−СН 2−СН 3 + Н−ОН пропилацетат или пропилэтаноат или пропиловый эфир уксусной кислоты
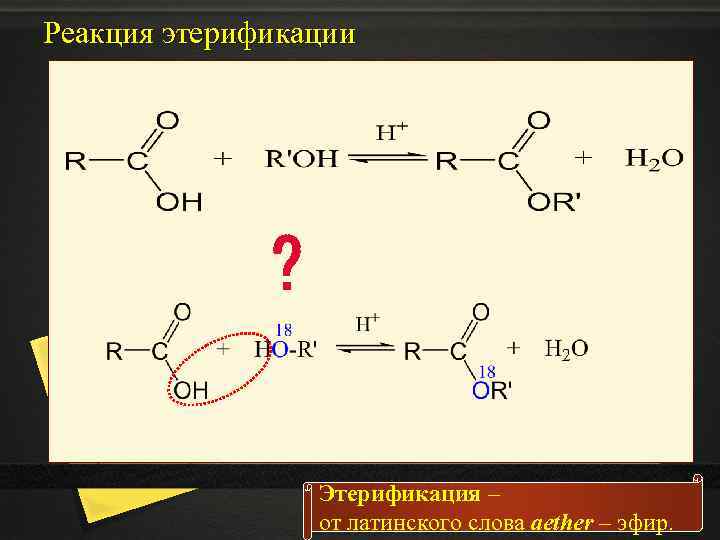
Реакция этерификации ? Этерификация – от латинского слова aether – эфир.

I. Кислотные свойства спиртов 4. Взаимодействие с реактивами Гриньяра – метод определения «атомности» спиртов СН 3−СН 2−О−(Н + СН 3)–Mg–I → → СН 3−СН 2−О−Mg–I + CH 4 ↑

I. Кислотные свойства спиртов 5. Взаимодействие с альдегидами – реакция нуклеофильного присоединения – образование полуацеталей (а) и ацеталей (б) а) δ− δ+ δ+ H 2 SO 4 концентрированная 1 2 3 СН 3−СН 2−О−Н + Н−С–СН 2–СН 3 ⇄ СН 3−СН 2−О−СН–СН 2–СН 3 ║ │ О δ− ОН полуацеталь 1 -этоксипропанол-1 б) δ− δ+ δ+ H 2 SO 4 концентрированная 1 2 3 2 СН 3−СН 2−О−Н + Н−С–СН 2–СН 3 ⇄ СН 3−СН 2−О−СН–СН 2−СН 3 ║ │ О δ− О−СН 2−СН 3 ацеталь + Н−ОН 1, 1 -диэтоксипропан

I. Кислотные свойства спиртов 6. Реакции дегидрирования и окисления спиртов ü Реакции дегидрирования и окисления спиртов сопровождаются разрывом связи −О┼Н; ü характерны только для первичных и вторичных спиртов, при дегидрировании и окислении которых образуются альдегиды и кетоны, соответственно; ü третичные спирты устойчивы к действию окислителей в относительно мягких условиях; ü в жестких условиях при окислении третичных спиртов происходит не только разрыв связи О−Н, но и связи С−С, что приводит к деструкции молекулы спирта

I. Кислотные свойства спиртов 6. а) дегидрирование Zn. O, 380°C Н−О−СН 2−СН 3 ⇄ Н−С–СН 2–СН 3 + H 2↑ пропанол-1 ║ пропаналь О Zn. O, 380°C СН 3 −СН−СН 3 ⇄ СН 3–С–СН 3 + H 2↑ │ пропанол-2 ║ пропанон OH О

I. Кислотные свойства спиртов 6. б) каталитическое окисление кислородом воздуха в присутствии меди в качестве катализатора Cu, 400°C 2 Н−О−СН 2−СН 3 + O 2 ⇄ 2 Н−С–СН 2–СН 3 + 2 H 2 O пропанол-1 ║ пропаналь О Cu, 400°C 2 СН 3 −СН−СН 3 + O 2 ⇄ 2 СН 3–С–СН 3 + 2 H 2 O │ пропанол-2 ║ пропанон OH О

I. Кислотные свойства спиртов 6. в) окисление оксидом меди (II) при нагревании Cu. O, 400°C Н−О−СН 2−СН 3 ⇄ Н−С–СН 2–СН 3 + Cu + H 2 O пропанол-1 ║ пропаналь О Cu. O, 400°C СН 3 −СН−СН 3 ⇄ СН 3–С–СН 3 + Cu + H 2 O │ пропанол-2 ║ пропанон OH О

I. Кислотные свойства спиртов 6. г) окисление сернокислым раствором перманганата калия При окислении первичных спиртов могут быть получены альдегиды (при нагревании, *) или карбоновые кислоты (в присутствии избытка окислителя, **) пропанол-1 t°C 5 НО−СН 2−СН 3 + 2 KMn. O 4 + 3 H 2 SO 4 → → 5 Н−С–СН 2–СН 3 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 О (*) ∥ пропаналь O пропанол-1 5 НО−СН 2−СН 3 + 4 KMn. O 4 + 6 H 2 SO 4 → → 5 НOOС–СН 2–СН 3 + 4 Mn. SO 4 + 2 K 2 SO 4 + 11 H 2 О (**) пропановая кислота При окислении метанола образуется углекислый газ 5 НО−СН 3 + 6 KMn. O 4 + 9 H 2 SO 4 → 5 СO 2 + 6 Mn. SO 4 + 3 K 2 SO 4 + 19 H 2 О

I. Кислотные свойства спиртов 6. г) окисление сернокислым раствором перманганата калия При окислении вторичных спиртов могут быть получены кетоны пропанол-2 5 СН 3−СН(ОН)−СН 3 + 2 KMn. O 4 + 3 H 2 SO 4 → 5 СН 3−С(О)–СН 3 + 2 Mn. SO 4 + K 2 SO 4 + 8 H 2 О пропанон-2 Третичные спирты в этих условиях не окисляются

II. Основны е свойства сп иртов Реакции, которые со провождаю тся разрывом с вязи С┼ОН – реакции о тщепления (Е) и нуклеофиль ного замещ ения (S ) у насыщенн N ого атома у глерода

I. Основные свойства спиртов 1. Дегидратация спиртов а) внутримолекулярная (подчиняется правилу Зайцева) H 2 SO 4 концентрированная, t°C=180°C* СН 3 −СН−СН 3 ⇄ СН 3–СН=СН 2 + H 2 О │ пропен OH пропанол-2 * − другие условия: Ø H 2 SO 4 концентрированная, t°C>150°C, Ø Al 2 O 3 , t°C > 350°C, Ø Al 2 O 3 , t°C=400°C

I. Основные свойства спиртов б) межмолекулярная − метод получения симметричных простых эфиров H 2 SO 4 концентрированная, t°C=140°C* 2 R−О−Н ⇄ R−О−R + H 2 О метанол пропанол-1 2 СН 3−О−H ⇄ СН 3−О−СН 3 + + H 2 О диметиловый эфир * − другие условия: Ø H 2 SO 4 концентрированная, t°C<140°C, Ø Al 2 O 3, t°C<350°C, Ø Al 2 O 3, t°C=350°C

I. Основные свойства спиртов б) межмолекулярная − метод получения несимметричных простых эфиров H 2 SO 4 концентрированная, t°C=140°C* 3 R−О−Н + 3 Н−О−R’ ⇄ ⇆ R−О−R’ + R−О−R + R’−О−R’ метанол + 3 H 2 О пропанол-1 3 СН 3−О−H + 3 Н−О−СН 2−СН 3 ⇄ метилпропиловый эфир диметиловый эфир СН 3−О−СН 2−СН 3 + 3 H 2 О + СН 3−О−СН 3 + дипропиловый эфир + СН 3−СН 2−О−СН 2−СН 3

I. Основные свойства спиртов 2. Взаимодействие с галогеноводородами − реакция нуклеофильного замещения (SN) у насыщенного атома углерода пропанол-2 Zn. Cl 2 2 -бромпропан СН 3 −СН−СН 3 + HBr ⇄ СН 3−СН−СН 3 + H 2 О │ │ OH Br 3. Взаимодействие с галогенидами серы и фосфора − реакция нуклеофильного замещения (SN) у насыщенного атома углерода СН 3 −СН−СН 3 + PCl 5 ⇄ СН 3−СН−СН 3 + POCl 3 + HCl │ │ OH Cl

II. Основные свойства спиртов 4. Взаимодействие с йодоводородом при нагревании – метод получения алканов t°C СН 3 −СН−СН 3 + 2 HI ⇄ СН 3−СН 2 + I 2 + H 2 О │ OH
Спирты_2016.pptx