Спирты и фенолы.pptx
- Количество слайдов: 41
 Спирты и фенолы Выполнили студенты группы 14 -ТПМ-3: Брамбалов Сергей Гришин Артем Федорук Дарья
Спирты и фенолы Выполнили студенты группы 14 -ТПМ-3: Брамбалов Сергей Гришин Артем Федорук Дарья
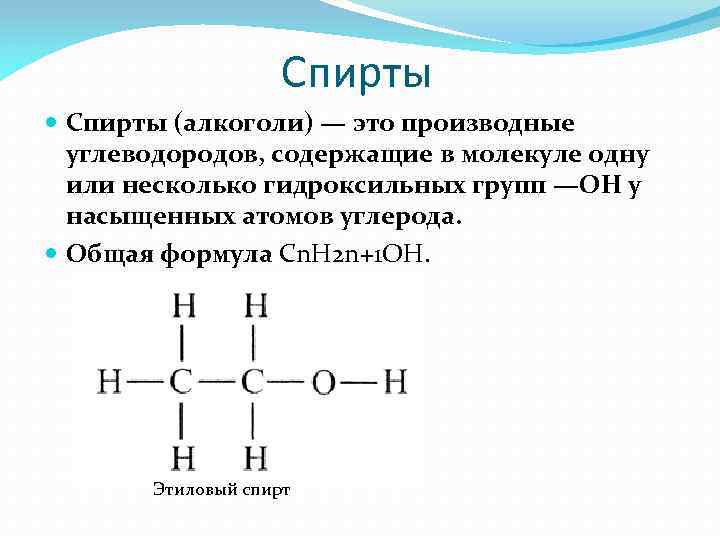 Спирты (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп —ОН у насыщенных атомов углерода. Общая формула Сn. H 2 n+1 OH. Этиловый спирт
Спирты (алкоголи) — это производные углеводородов, содержащие в молекуле одну или несколько гидроксильных групп —ОН у насыщенных атомов углерода. Общая формула Сn. H 2 n+1 OH. Этиловый спирт
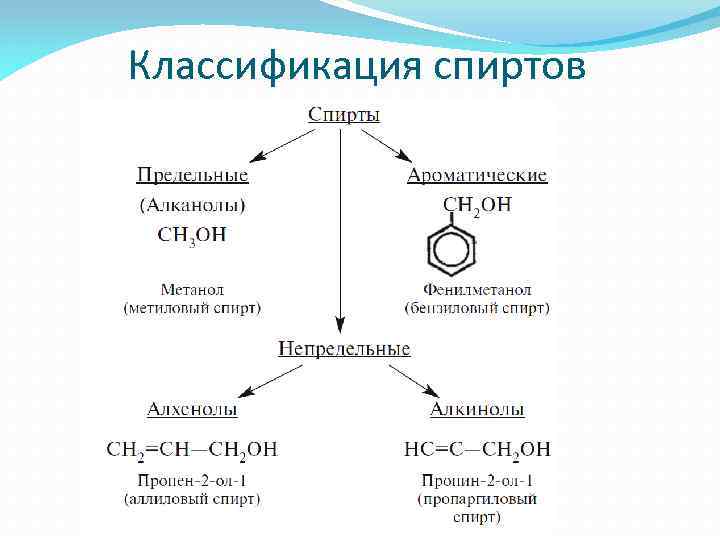 Классификация спиртов
Классификация спиртов

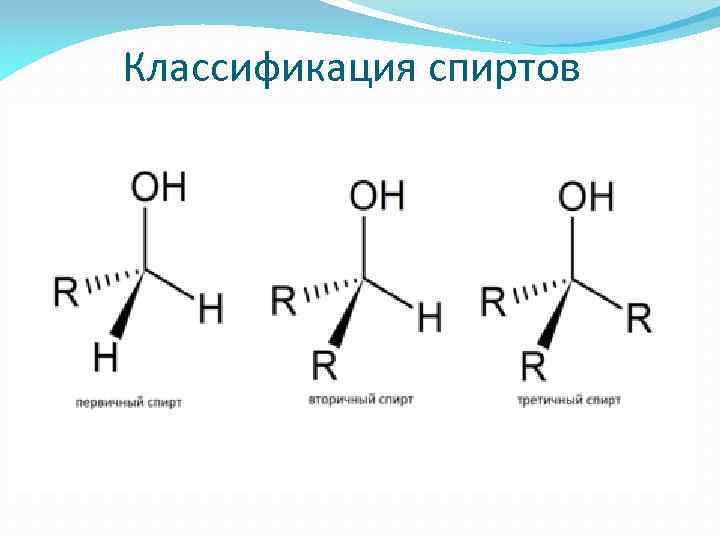 Классификация спиртов
Классификация спиртов
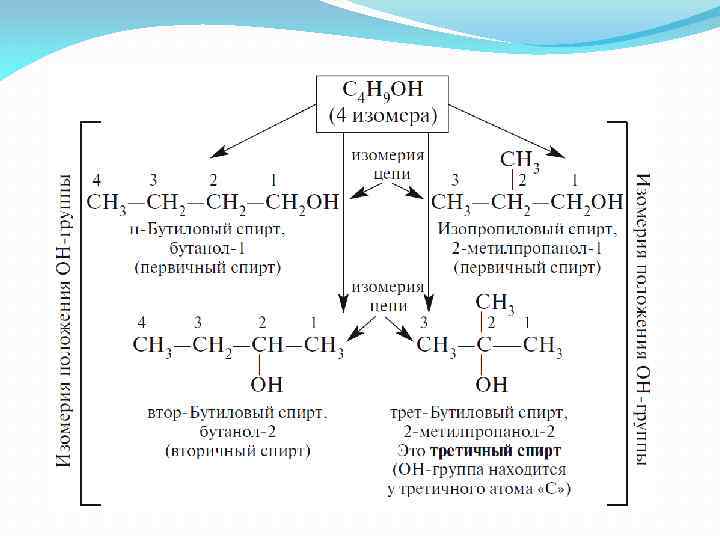
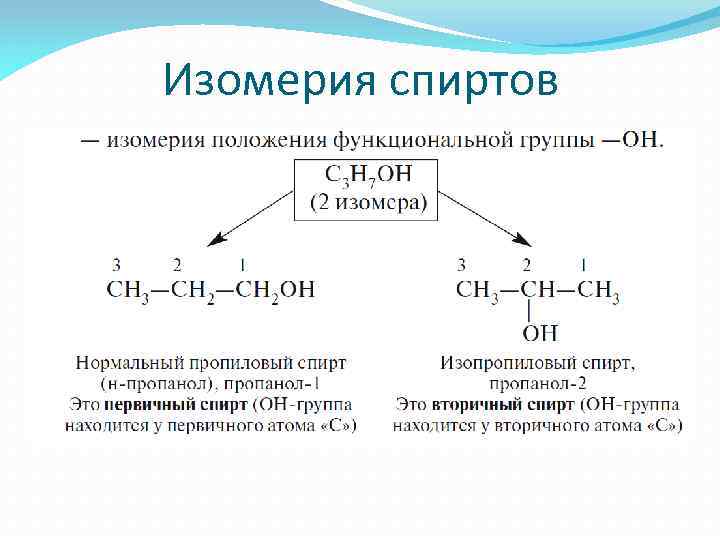 Изомерия спиртов
Изомерия спиртов
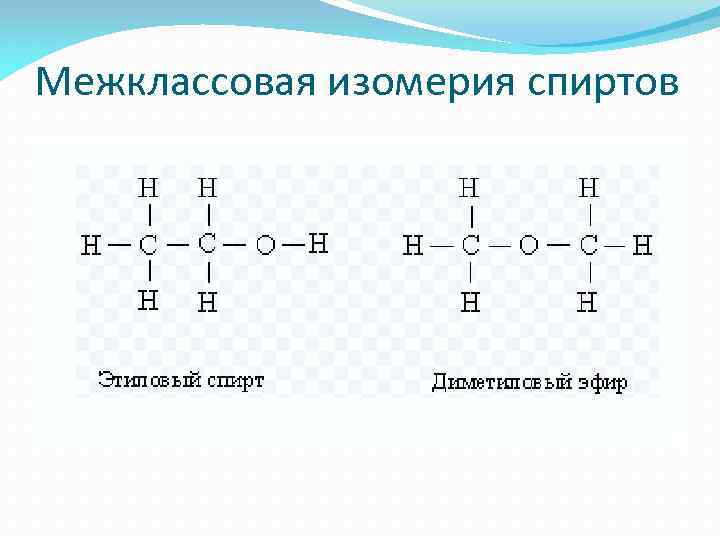 Межклассовая изомерия спиртов
Межклассовая изомерия спиртов
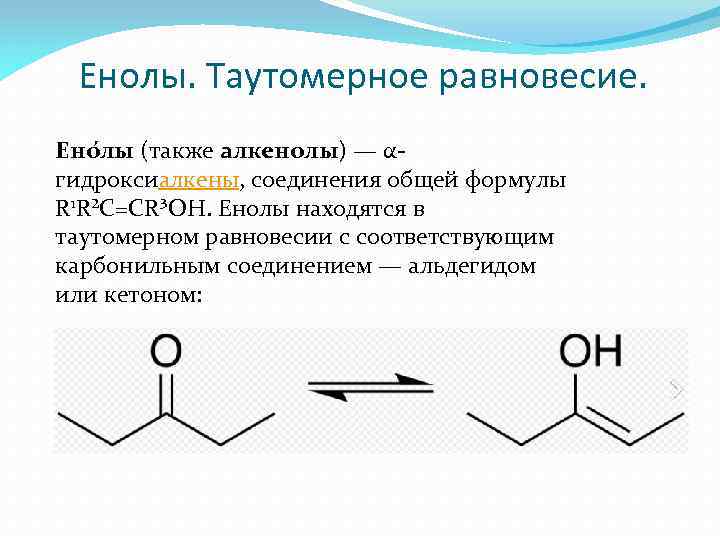 Енолы. Таутомерное равновесие. Ено лы (также алкенолы) — αгидроксиалкены, соединения общей формулы R 1 R²C=CR³OH. Енолы находятся в таутомерном равновесии с соответствующим карбонильным соединением — альдегидом или кетоном:
Енолы. Таутомерное равновесие. Ено лы (также алкенолы) — αгидроксиалкены, соединения общей формулы R 1 R²C=CR³OH. Енолы находятся в таутомерном равновесии с соответствующим карбонильным соединением — альдегидом или кетоном:
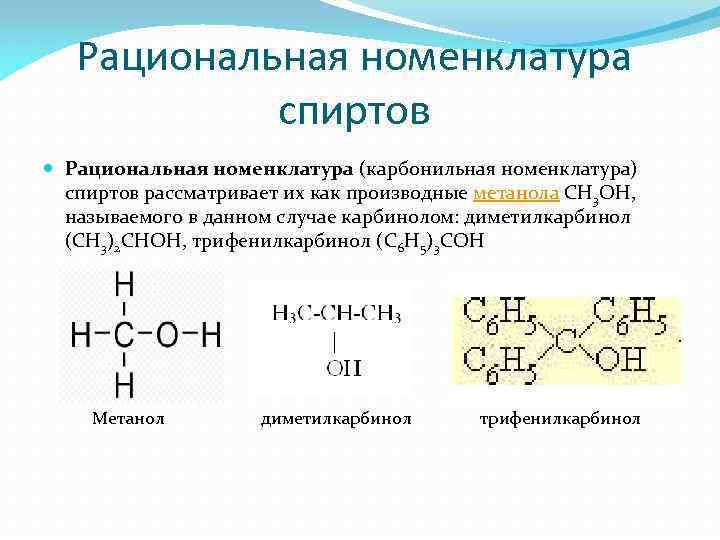 Рациональная номенклатура спиртов Рациональная номенклатура (карбонильная номенклатура) спиртов рассматривает их как производные метанола CH 3 OH, называемого в данном случае карбинолом: диметилкарбинол (СH 3)2 СНOH, трифенилкарбинол (С 6 H 5)3 COH Метанол диметилкарбинол трифенилкарбинол
Рациональная номенклатура спиртов Рациональная номенклатура (карбонильная номенклатура) спиртов рассматривает их как производные метанола CH 3 OH, называемого в данном случае карбинолом: диметилкарбинол (СH 3)2 СНOH, трифенилкарбинол (С 6 H 5)3 COH Метанол диметилкарбинол трифенилкарбинол
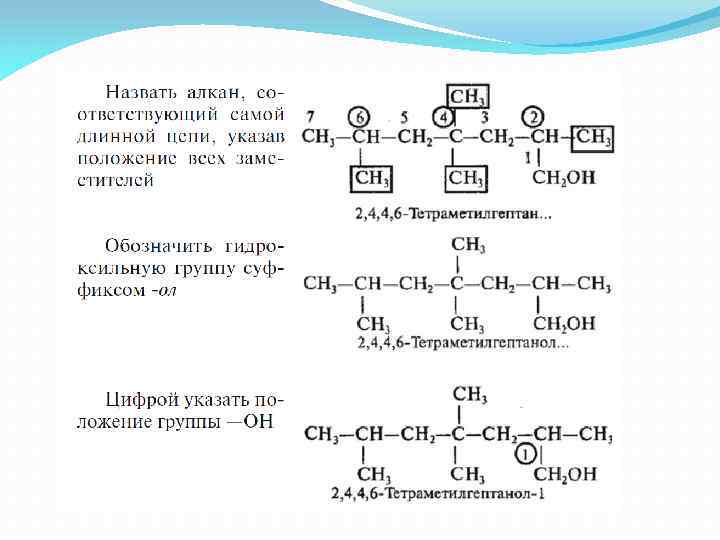
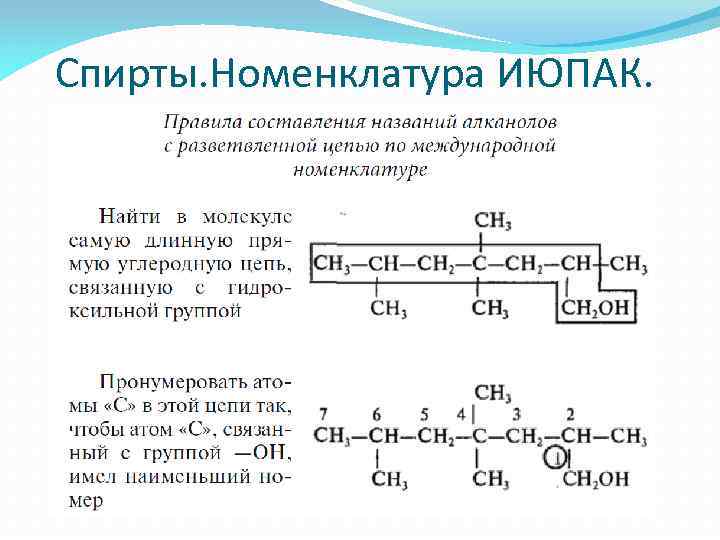 Спирты. Номенклатура ИЮПАК.
Спирты. Номенклатура ИЮПАК.
 Электронное строение Атомы углерода в алканолах находятся в состоянии sp 3 -гибридизации. Молекулы алканолов представляют собой диполи. Они содержат полярные связи С—Н, С— О, О—Н. Дипольные моменты связей С О и О Н направлены в сторону атома кислорода, поэтому атом «О» имеет частичный отрицательный заряд δ–, а атомы «С» и «Н» — частичные положительные заряды δ+. Полярность связи О—Н больше полярности связи С— О вследствие большей разности электроотрицательностей кислорода и водорода. Однако полярность и этой связи недостаточна для диссоциации ее с образованием ионов Н+. Поэтому спирты являются неэлектролитами.
Электронное строение Атомы углерода в алканолах находятся в состоянии sp 3 -гибридизации. Молекулы алканолов представляют собой диполи. Они содержат полярные связи С—Н, С— О, О—Н. Дипольные моменты связей С О и О Н направлены в сторону атома кислорода, поэтому атом «О» имеет частичный отрицательный заряд δ–, а атомы «С» и «Н» — частичные положительные заряды δ+. Полярность связи О—Н больше полярности связи С— О вследствие большей разности электроотрицательностей кислорода и водорода. Однако полярность и этой связи недостаточна для диссоциации ее с образованием ионов Н+. Поэтому спирты являются неэлектролитами.
 Физические свойства спиртов Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов. Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов угле рода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей. • Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностью (О, N, F, Cl) другой молекулы.
Физические свойства спиртов Полярность связи О—Н и наличие неподеленных пар электронов на атоме кислорода определяют физические свойства спиртов. Температуры кипения спиртов больше температуры кипения соответствующих алканов с тем же числом атомов угле рода. Это объясняется ассоциацией молекул спиртов вследствие образования межмолекулярных водородных связей. • Водородная связь — это особый вид связи, которая осуществляется при участии атома водорода гидроксильной или аминогруппы одной молекулы и атомами с большой электроотрицательностью (О, N, F, Cl) другой молекулы.
 Индуктивный эффект.
Индуктивный эффект.
 Химические свойства спиртов. I. Реакции замещения 1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О—Н. а) Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов:
Химические свойства спиртов. I. Реакции замещения 1. Замещение атома водорода гидроксильной группы вследствие разрыва связи О—Н. а) Взаимодействие с активными металлами с образованием алкоголятов (алканолятов) металлов:

 II. Реакции отщепления 1. Дегидратация, т. е. отщепление воды Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная. а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—О—R. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
II. Реакции отщепления 1. Дегидратация, т. е. отщепление воды Дегидратация спиртов может быть двух типов: межмолекулярная и внутримолекулярная. а) Межмолекулярная дегидратация спиртов с образованием простых эфиров R—О—R. Эти реакции могут протекать с участием одного спирта или смеси двух и более спиртов:
 б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
б) Внутримолекулярная дегидратация спиртов с образованием алкенов. Протекает при более высокой температуре. В отличие от межмолекулярной дегидратации в процессе этих реакций происходит отщепление молекулы воды от одной молекулы спирта:
 Первый член гомологического ряда алканолов — метанол СН 3 ОН — не вступает в реакции внутримолекулярной дегидратации. Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
Первый член гомологического ряда алканолов — метанол СН 3 ОН — не вступает в реакции внутримолекулярной дегидратации. Дегидратация вторичных и третичных спиртов происходит по правилу Зайцева:
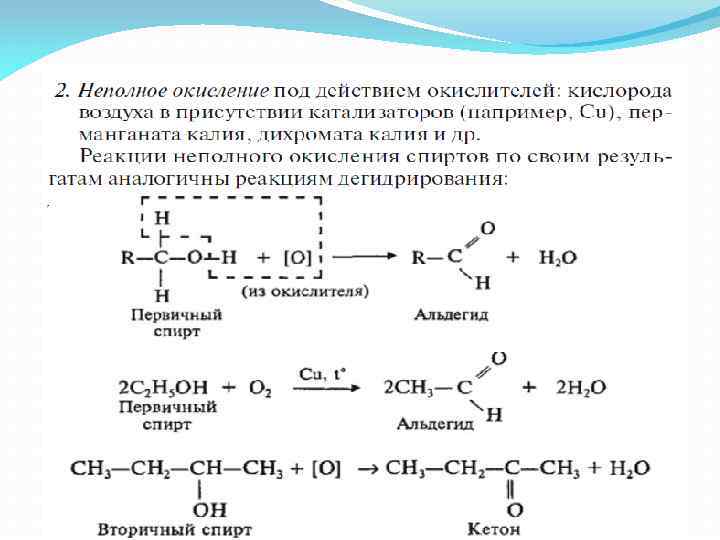
 III. Реакции окисления 1. Горение (полное окисление) Спирты горят на воздухе с выделением большого количества тепла (на этом основано использование спиртовок):
III. Реакции окисления 1. Горение (полное окисление) Спирты горят на воздухе с выделением большого количества тепла (на этом основано использование спиртовок):
 Многоатомные спирты Глицерин — вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с t °кип = 290 °С. Смешивается с водой во всех отношениях. глицерин, или пропан-триол-1, 2, 3 Качественная реакция на глицерин - это его взаимодействие с гидроксидом меди (II), в продуктах реакции образуется глицерат меди.
Многоатомные спирты Глицерин — вязкая, бесцветная, сладковатая на вкус нетоксичная жидкость с t °кип = 290 °С. Смешивается с водой во всех отношениях. глицерин, или пропан-триол-1, 2, 3 Качественная реакция на глицерин - это его взаимодействие с гидроксидом меди (II), в продуктах реакции образуется глицерат меди.
 Получение спиртов. 1. Гидратация алкенов, т. е. присоединение воды к алкенам. этилен 2. Гидролиз галогеналканов При действии водного раствора Na. OH атом галогена в галогеналкане замещается группой —ОН:
Получение спиртов. 1. Гидратация алкенов, т. е. присоединение воды к алкенам. этилен 2. Гидролиз галогеналканов При действии водного раствора Na. OH атом галогена в галогеналкане замещается группой —ОН:
 3. Гидрирование альдегидов и кетонов
3. Гидрирование альдегидов и кетонов
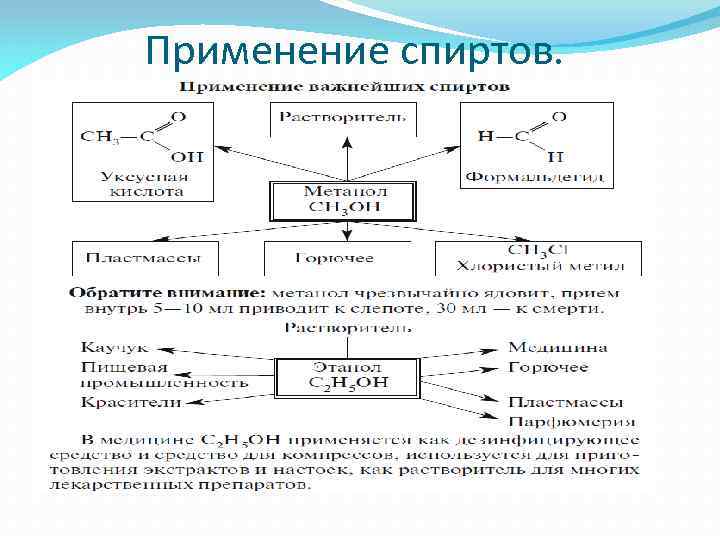 Применение спиртов.
Применение спиртов.
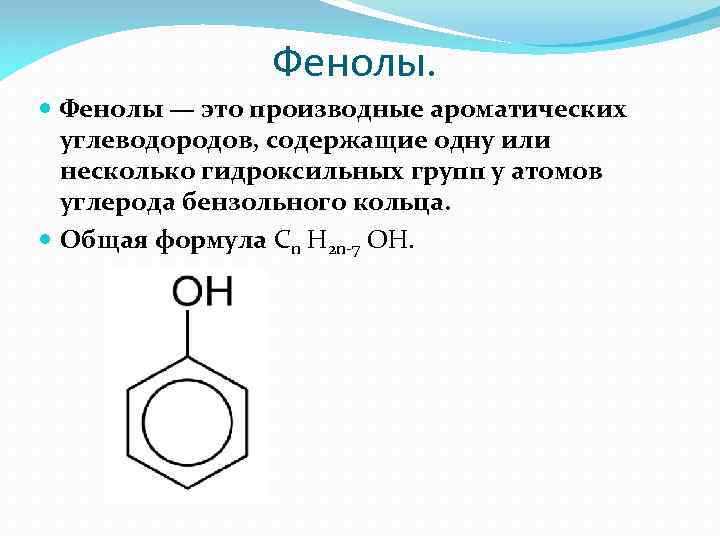 Фенолы. Фенолы — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца. Общая формула Cn H 2 n-7 OH.
Фенолы. Фенолы — это производные ароматических углеводородов, содержащие одну или несколько гидроксильных групп у атомов углерода бензольного кольца. Общая формула Cn H 2 n-7 OH.
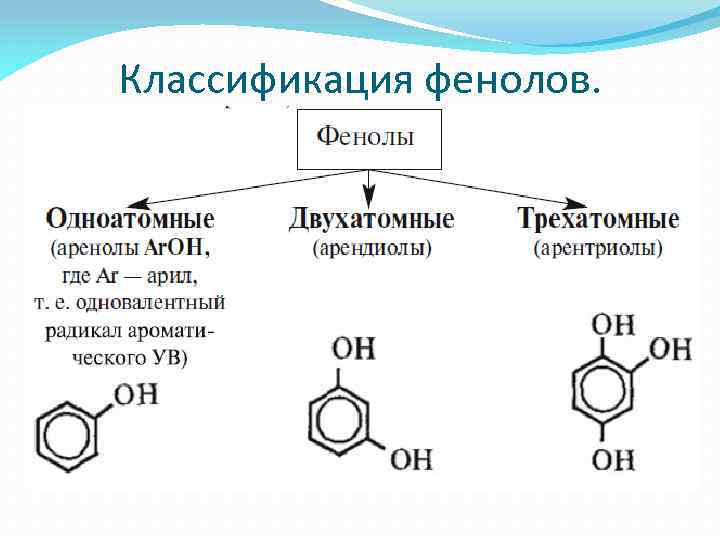 Классификация фенолов.
Классификация фенолов.
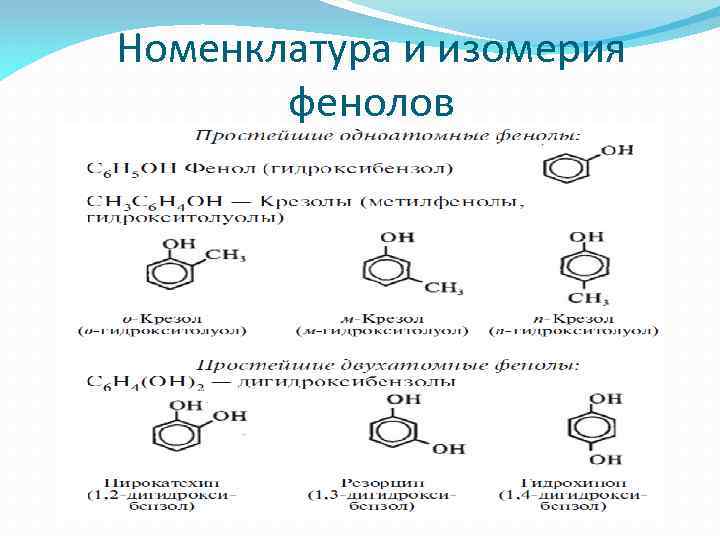 Номенклатура и изомерия фенолов
Номенклатура и изомерия фенолов
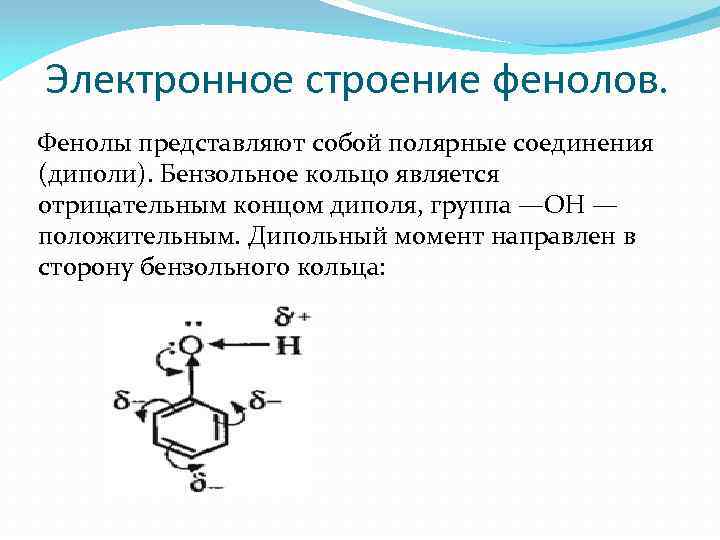 Электронное строение фенолов. Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа —ОН — положительным. Дипольный момент направлен в сторону бензольного кольца:
Электронное строение фенолов. Фенолы представляют собой полярные соединения (диполи). Бензольное кольцо является отрицательным концом диполя, группа —ОН — положительным. Дипольный момент направлен в сторону бензольного кольца:
 Как известно, гидроксильная группа —ОН является заместителем I рода, т. е. она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподеленных пар электронов атома кислорода ОН- группы вступает в сопряжение с π-системой бензольного кольца. Смещение неподеленной пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи О—Н. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается на свойствах фенола. Во-первых, повышается способность к замещению атомов водорода в о- и пположениях бензольного ядра, и в результате реакций замещения обычно образуются три замещенные производные фенола. Во-вторых, увеличение полярности связи О—Н под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу: Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые, являются неэлектролитами.
Как известно, гидроксильная группа —ОН является заместителем I рода, т. е. она способствует повышению электронной плотности в бензольном кольце (особенно в орто- и пара-положениях). Это обусловлено тем, что одна из неподеленных пар электронов атома кислорода ОН- группы вступает в сопряжение с π-системой бензольного кольца. Смещение неподеленной пары электронов атома кислорода в сторону бензольного кольца приводит к увеличению полярности связи О—Н. Таким образом, имеет место взаимное влияние атомов и атомных групп в молекуле фенола. Это взаимное влияние отражается на свойствах фенола. Во-первых, повышается способность к замещению атомов водорода в о- и пположениях бензольного ядра, и в результате реакций замещения обычно образуются три замещенные производные фенола. Во-вторых, увеличение полярности связи О—Н под действием бензольного ядра и появление достаточно большого положительного заряда на атоме водорода приводит к тому, что молекулы фенола диссоциируют в водных растворах по кислотному типу: Фенол является слабой кислотой. В этом состоит главное отличие фенолов от спиртов, которые, являются неэлектролитами.
 Физические свойства фенолов. Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол С 6 Н 5 ОН (карболовая кислота) — бесцветное кристаллическое вещество, t °плавл. = 43 °С, t °кип. = 182 °С, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °С смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
Физические свойства фенолов. Большинство одноатомных фенолов при нормальных условиях представляют собой бесцветные кристаллические вещества с невысокой температурой плавления и характерным запахом. Фенолы малорастворимы в воде, хорошо растворяются в органических растворителях, токсичны, при хранении на воздухе постепенно темнеют в результате окисления. Фенол С 6 Н 5 ОН (карболовая кислота) — бесцветное кристаллическое вещество, t °плавл. = 43 °С, t °кип. = 182 °С, на воздухе окисляется и становится розовым, при обычной температуре ограниченно растворим в воде, выше 66 °С смешивается с водой в любых соотношениях. Фенол — токсичное вещество, вызывает ожоги кожи, является антисептиком.
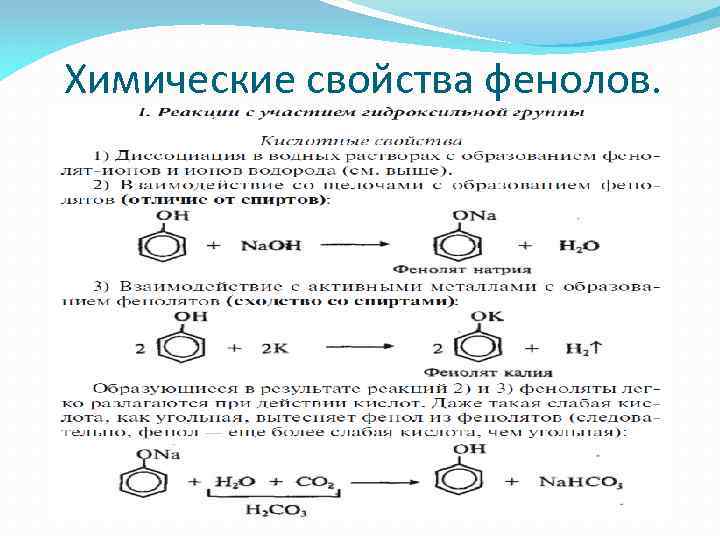 Химические свойства фенолов.
Химические свойства фенолов.



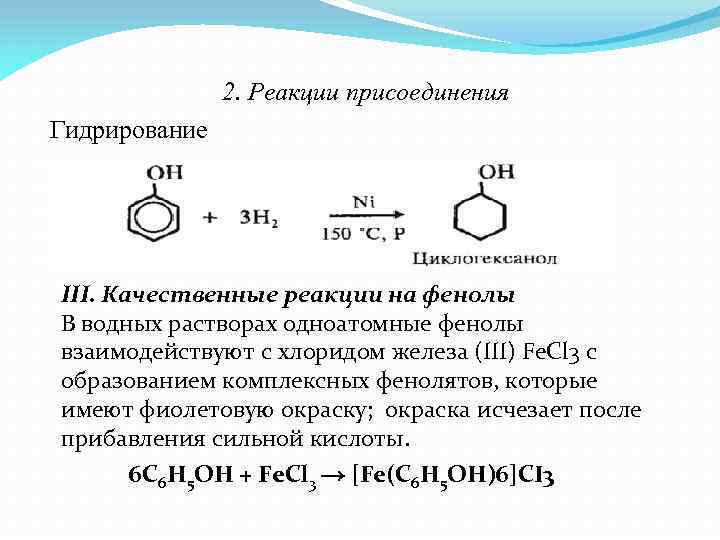 2. Реакции присоединения Гидрирование III. Качественные реакции на фенолы В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) Fe. Cl 3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты. 6 C 6 H 5 OH + Fe. Cl 3 → [Fe(C 6 H 5 OH)6]CI 3
2. Реакции присоединения Гидрирование III. Качественные реакции на фенолы В водных растворах одноатомные фенолы взаимодействуют с хлоридом железа (III) Fe. Cl 3 с образованием комплексных фенолятов, которые имеют фиолетовую окраску; окраска исчезает после прибавления сильной кислоты. 6 C 6 H 5 OH + Fe. Cl 3 → [Fe(C 6 H 5 OH)6]CI 3


 Применение фенолов.
Применение фенолов.
 Спасибо за внимание!
Спасибо за внимание!


