 Спирты и фенолы
Спирты и фенолы
 . Спирты - это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. Фенолы – органические соединения, в которых гидроксил связан с ароматическим кольцом В общем виде молекулы спирта и фенола можно представить как RОН
. Спирты - это производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами. Фенолы – органические соединения, в которых гидроксил связан с ароматическим кольцом В общем виде молекулы спирта и фенола можно представить как RОН
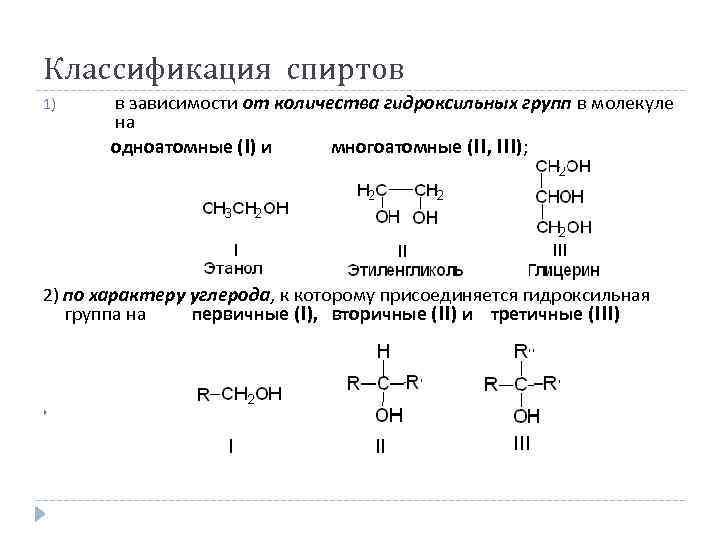 Классификация спиртов в зависимости от количества гидроксильных групп в молекуле на одноатомные (I) и многоатомные (II, III); 1) 2) по характеру углерода, к которому присоединяется гидроксильная группа на первичные (I), вторичные (II) и третичные (III)
Классификация спиртов в зависимости от количества гидроксильных групп в молекуле на одноатомные (I) и многоатомные (II, III); 1) 2) по характеру углерода, к которому присоединяется гидроксильная группа на первичные (I), вторичные (II) и третичные (III)
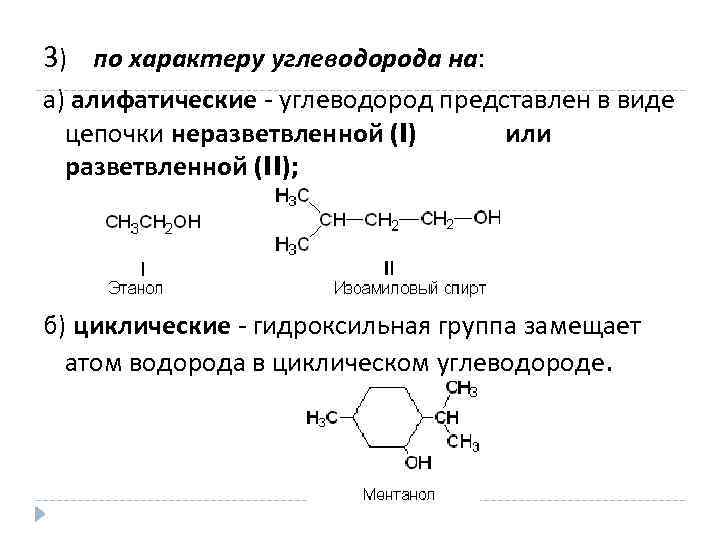 3) по характеру углеводорода на: а) алифатические - углеводород представлен в виде цепочки неразветвленной (I) или разветвленной (II); б) циклические - гидроксильная группа замещает атом водорода в циклическом углеводороде.
3) по характеру углеводорода на: а) алифатические - углеводород представлен в виде цепочки неразветвленной (I) или разветвленной (II); б) циклические - гидроксильная группа замещает атом водорода в циклическом углеводороде.
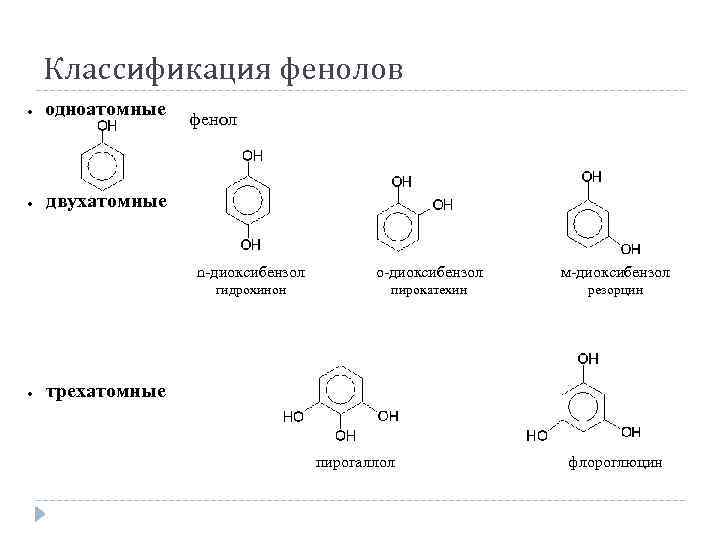 Классификация фенолов одноатомные · двухатомные · фенол трехатомные о-диоксибензол м-диоксибензол гидрохинон · n-диоксибензол пирокатехин резорцин пирогаллол флороглюцин
Классификация фенолов одноатомные · двухатомные · фенол трехатомные о-диоксибензол м-диоксибензол гидрохинон · n-диоксибензол пирокатехин резорцин пирогаллол флороглюцин
 Получение Спирт этиловый может быть получен из природных соединений в результате брожения сахаристых веществ: С 6 Н 12 О 6 С 2 Н 5 ОН +2 СО 2 и синтетически из непредельных соединений Фенолы получают из каменноугольной смолы и синтетически
Получение Спирт этиловый может быть получен из природных соединений в результате брожения сахаристых веществ: С 6 Н 12 О 6 С 2 Н 5 ОН +2 СО 2 и синтетически из непредельных соединений Фенолы получают из каменноугольной смолы и синтетически
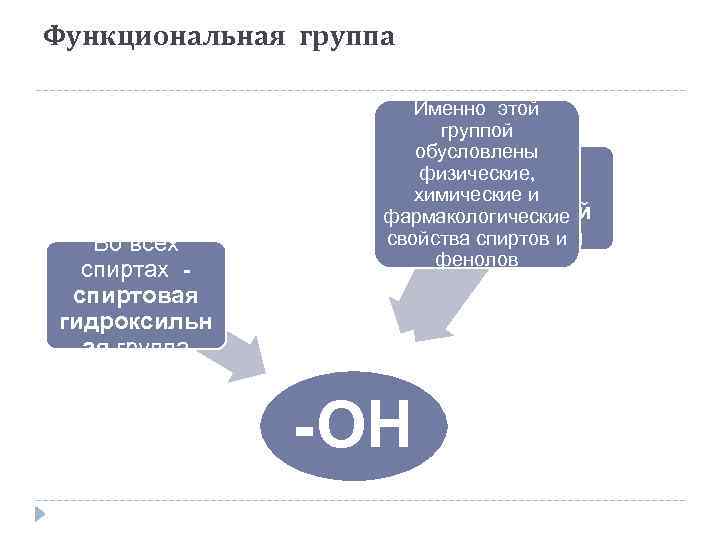 Функциональная группа Во всех спиртах спиртовая гидроксильн ая группа Именно этой группой обусловлены Во всех физические, фенолах химические и фенольный фармакологические свойства спиртов и гидроксил фенолов -ОН
Функциональная группа Во всех спиртах спиртовая гидроксильн ая группа Именно этой группой обусловлены Во всех физические, фенолах химические и фенольный фармакологические свойства спиртов и гидроксил фенолов -ОН
 Физические свойства спиртов Гидроксильная группа повышает растворимость вещества. Спирты, особенно низшие, это жидкости. растворимые в воде. С увеличением длины углеводородной цепи растворимость уменьшается. Вторичные спирты более растворимы, чем первичные, а третичные более растворимы, чем вторичные Температура кипения понижается от первичных спиртов к третичным. Многоатомные спирты имеют сладкий вкус, это свойство возрастает с увеличением гидроксильных групп в молекуле спирта
Физические свойства спиртов Гидроксильная группа повышает растворимость вещества. Спирты, особенно низшие, это жидкости. растворимые в воде. С увеличением длины углеводородной цепи растворимость уменьшается. Вторичные спирты более растворимы, чем первичные, а третичные более растворимы, чем вторичные Температура кипения понижается от первичных спиртов к третичным. Многоатомные спирты имеют сладкий вкус, это свойство возрастает с увеличением гидроксильных групп в молекуле спирта
 Физические свойства фенолов кристаллические вещества с сильным характерным запахом, одноатомные фенолы плохо растворимы в воде, двухатомные растворяются в воде. Вследствие окисления (особенно двухатомные) розовеют на воздухе, затем буреют.
Физические свойства фенолов кристаллические вещества с сильным характерным запахом, одноатомные фенолы плохо растворимы в воде, двухатомные растворяются в воде. Вследствие окисления (особенно двухатомные) розовеют на воздухе, затем буреют.
 Химические свойства спиртов 1 Кислотные свойства Спирты имеют нейтральную реакцию и реагируют с щелочными металлами с выделением водорода: 2 ROH + 2 Na → 2 RONa + H 2↑ 2 Основные свойства 2. 1. реакция элиминирования (отщепления воды в кислой среде) по правилу Зайцева 2. 2. Реакция этерификации одноатомных и многоатомных спиртов : R-OH + R 'COOH → R-COOR ' + H 2 O
Химические свойства спиртов 1 Кислотные свойства Спирты имеют нейтральную реакцию и реагируют с щелочными металлами с выделением водорода: 2 ROH + 2 Na → 2 RONa + H 2↑ 2 Основные свойства 2. 1. реакция элиминирования (отщепления воды в кислой среде) по правилу Зайцева 2. 2. Реакция этерификации одноатомных и многоатомных спиртов : R-OH + R 'COOH → R-COOR ' + H 2 O
 Химические свойства спиртов 3. Окисление сильными (одноатомные) и слабыми окислителями (многоатомные спирты) Первичные и вторичные спирты легко окисляются. При окислении первичных спиртов (I) образуются альдегиды, при окислении вторичных (II) - кетоны Третичные спирты окисляются с большим трудом.
Химические свойства спиртов 3. Окисление сильными (одноатомные) и слабыми окислителями (многоатомные спирты) Первичные и вторичные спирты легко окисляются. При окислении первичных спиртов (I) образуются альдегиды, при окислении вторичных (II) - кетоны Третичные спирты окисляются с большим трудом.
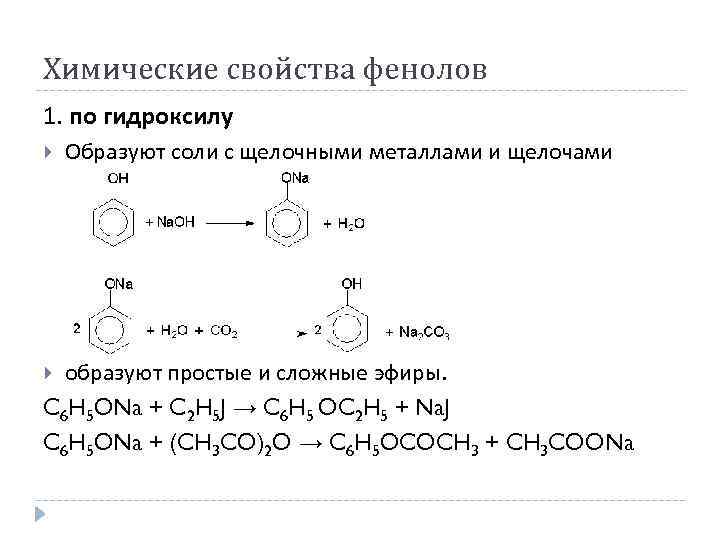 Химические свойства фенолов 1. по гидроксилу Образуют соли с щелочными металлами и щелочами образуют простые и сложные эфиры. C 6 H 5 ONa + C 2 H 5 J → C 6 H 5 OC 2 H 5 + Na. J C 6 H 5 ONa + (CH 3 CO)2 O → C 6 H 5 OCOCH 3 + CH 3 COONa
Химические свойства фенолов 1. по гидроксилу Образуют соли с щелочными металлами и щелочами образуют простые и сложные эфиры. C 6 H 5 ONa + C 2 H 5 J → C 6 H 5 OC 2 H 5 + Na. J C 6 H 5 ONa + (CH 3 CO)2 O → C 6 H 5 OCOCH 3 + CH 3 COONa
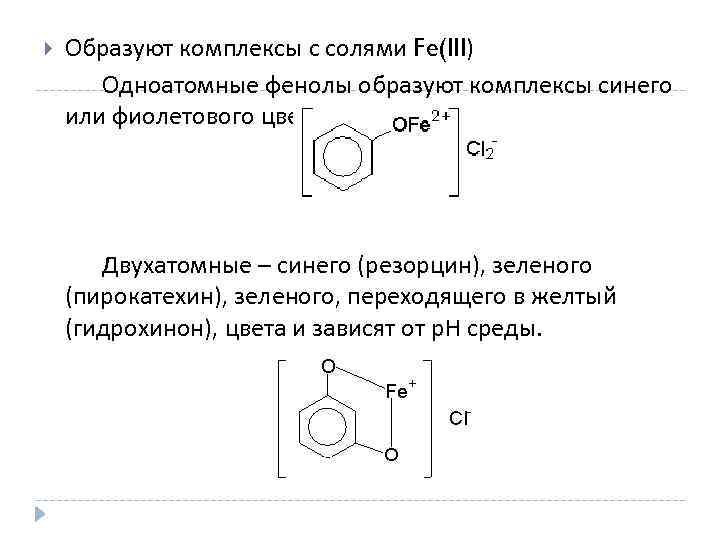 Образуют комплексы с солями Fe(III) Одноатомные фенолы образуют комплексы синего или фиолетового цвета. Двухатомные – синего (резорцин), зеленого (пирокатехин), зеленого, переходящего в желтый (гидрохинон), цвета и зависят от p. H среды.
Образуют комплексы с солями Fe(III) Одноатомные фенолы образуют комплексы синего или фиолетового цвета. Двухатомные – синего (резорцин), зеленого (пирокатехин), зеленого, переходящего в желтый (гидрохинон), цвета и зависят от p. H среды.
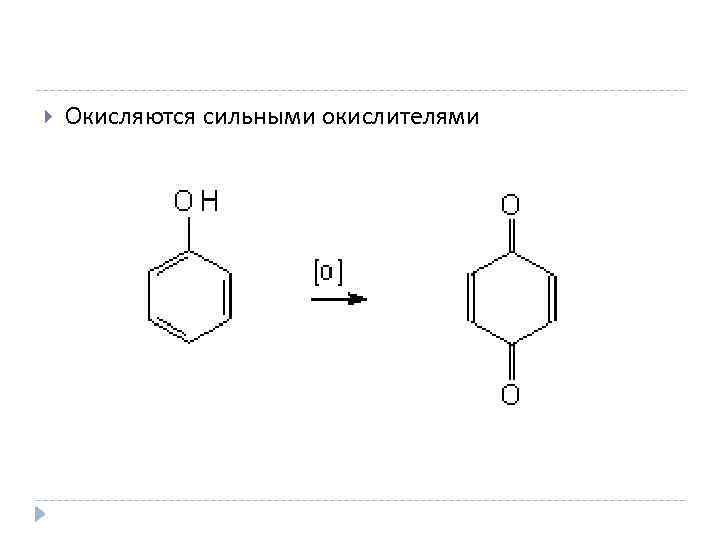 Окисляются сильными окислителями
Окисляются сильными окислителями
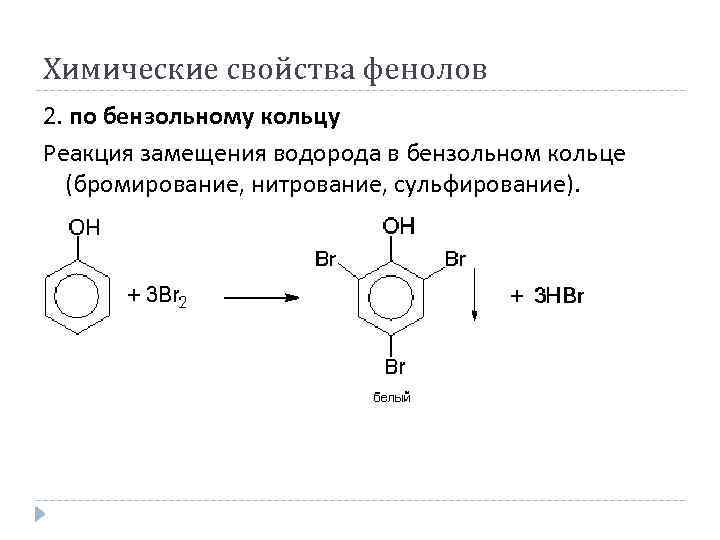 Химические свойства фенолов 2. по бензольному кольцу Реакция замещения водорода в бензольном кольце (бромирование, нитрование, сульфирование).
Химические свойства фенолов 2. по бензольному кольцу Реакция замещения водорода в бензольном кольце (бромирование, нитрование, сульфирование).
 Представители: Спирт этиловый Глицерин Фенол Нафтолы
Представители: Спирт этиловый Глицерин Фенол Нафтолы
 Качественные реакции Этерификация (образование сложных эфиров) Окисление - иодоформная проба для этанола CH 3 CH 2 OH + 4 J 2 + 6 Na. OH → CHJ 3↓ + HCOONa + 4 Na. J + 5 H 2 O - окисление хромовой смесью Комплексобразование с ионами меди(II) в щелочной среде
Качественные реакции Этерификация (образование сложных эфиров) Окисление - иодоформная проба для этанола CH 3 CH 2 OH + 4 J 2 + 6 Na. OH → CHJ 3↓ + HCOONa + 4 Na. J + 5 H 2 O - окисление хромовой смесью Комплексобразование с ионами меди(II) в щелочной среде
 Вопросы для самоконтроля Написать реакции получения простых эфиров этанола Написать реакции получения сложных эфиров А. Этанола Б. глицерина (нитроглицерина, глицерофосфата) Указать область их применения. Реакция дегидратации 3 -метилбутанола-2.
Вопросы для самоконтроля Написать реакции получения простых эфиров этанола Написать реакции получения сложных эфиров А. Этанола Б. глицерина (нитроглицерина, глицерофосфата) Указать область их применения. Реакция дегидратации 3 -метилбутанола-2.


