 СПИРТЫ 08. 02. 2018
СПИРТЫ 08. 02. 2018
 08. 02. 2018 2
08. 02. 2018 2
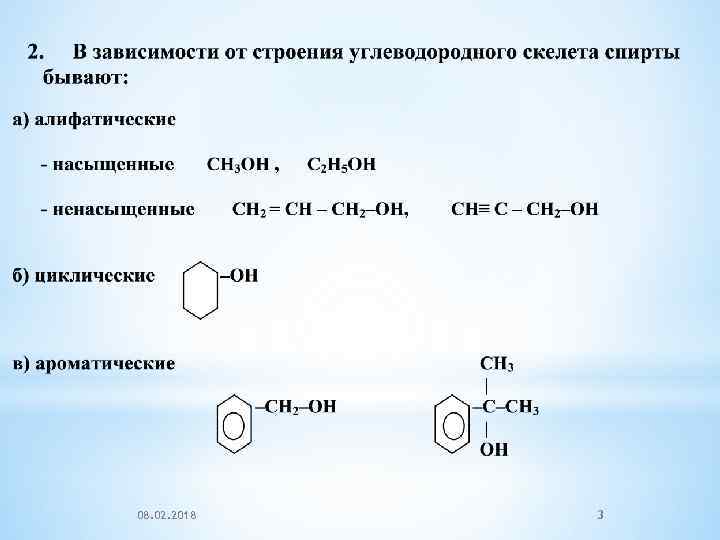 08. 02. 2018 3
08. 02. 2018 3
 08. 02. 2018 4
08. 02. 2018 4
 08. 02. 2018 5
08. 02. 2018 5
 08. 02. 2018 6
08. 02. 2018 6
 08. 02. 2018 7
08. 02. 2018 7
 08. 02. 2018
08. 02. 2018
 08. 02. 2018 9
08. 02. 2018 9
 Промышленное получение спиртов 1. Получение метилового спирта: До 1925 года метанол получали пиролизом древесины. В настоящее время его получают присоединением водорода к угарному газу (Баденская фабрика; Патар). Для проведения процесса требуются высокие температуры (около 450 о. С), давление (200 атм) и катализатор (Zn. O, Cr 2 O 3) : *Метанол является очень важным промышленным продуктом: он используется в производстве формальдегида, сложных эфиров, напр. диметилтерефталата, и др. продуктов и как растворитель. *Продукт окисления метанола – формальдегид – используется в производстве фенолоформальдегидных смол, карбамидных 08. 02. 2018 10 смол, изопрена и др. важных продуктов
Промышленное получение спиртов 1. Получение метилового спирта: До 1925 года метанол получали пиролизом древесины. В настоящее время его получают присоединением водорода к угарному газу (Баденская фабрика; Патар). Для проведения процесса требуются высокие температуры (около 450 о. С), давление (200 атм) и катализатор (Zn. O, Cr 2 O 3) : *Метанол является очень важным промышленным продуктом: он используется в производстве формальдегида, сложных эфиров, напр. диметилтерефталата, и др. продуктов и как растворитель. *Продукт окисления метанола – формальдегид – используется в производстве фенолоформальдегидных смол, карбамидных 08. 02. 2018 10 смол, изопрена и др. важных продуктов
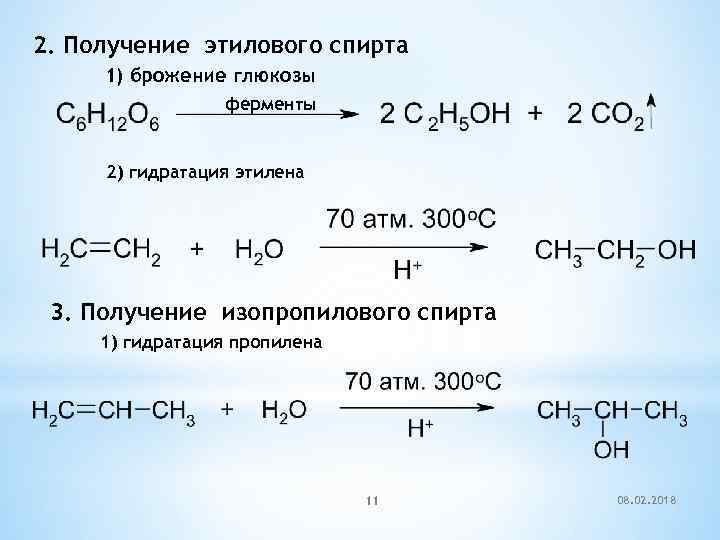 2. Получение этилового спирта 1) брожение глюкозы ферменты 2) гидратация этилена 3. Получение изопропилового спирта 1) гидратация пропилена 11 08. 02. 2018
2. Получение этилового спирта 1) брожение глюкозы ферменты 2) гидратация этилена 3. Получение изопропилового спирта 1) гидратация пропилена 11 08. 02. 2018
 08. 02. 2018 12
08. 02. 2018 12
 08. 02. 2018 13
08. 02. 2018 13
 08. 02. 2018 14
08. 02. 2018 14
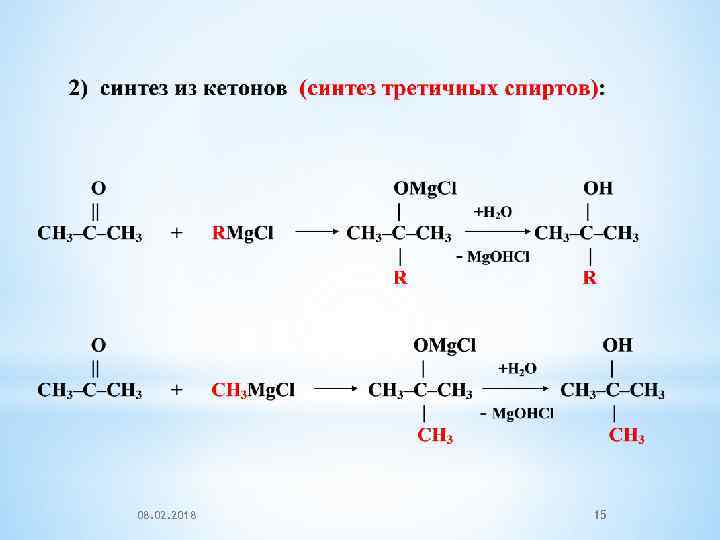 08. 02. 2018 15
08. 02. 2018 15
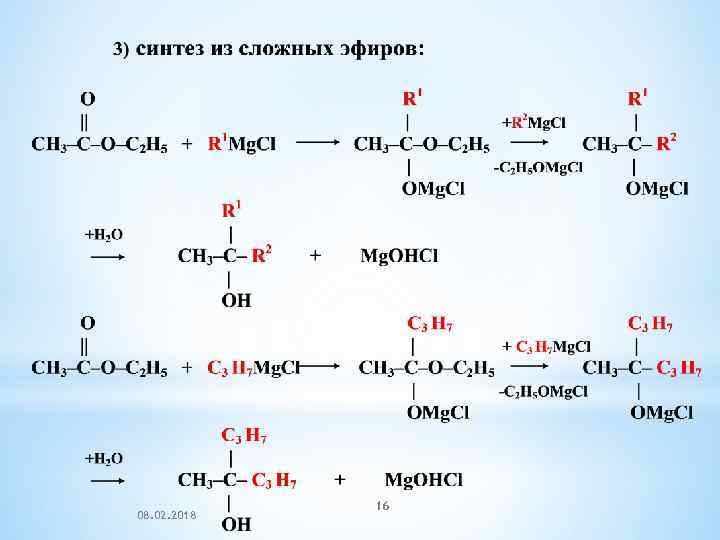 08. 02. 2018 16
08. 02. 2018 16
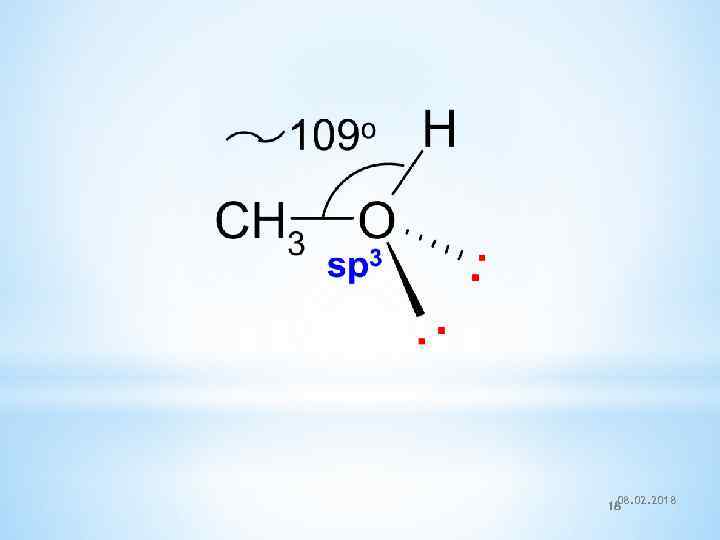
 IV. Электронное строение атома кислорода 08. 02. 2018 17
IV. Электронное строение атома кислорода 08. 02. 2018 17
 08. 02. 2018 18
08. 02. 2018 18
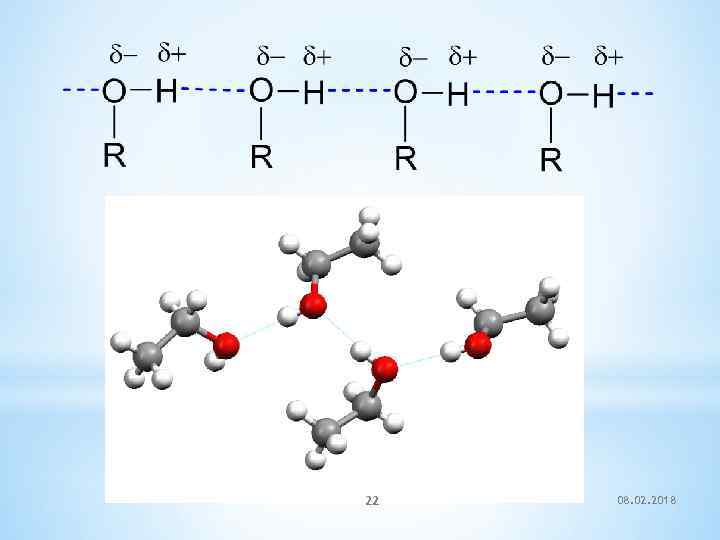
 V. Физические свойства *Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются с водой во всех отношениях. *С увеличением количества атомов углерода спирты всё более начинают напоминать углеводороды. *Растворимость амилового спирта (пентанола-1) – 2, 7 г/ 100 мл, *растворимость октанола-1 – 0, 059 г/ 100 г. 19 08. 02. 2018
V. Физические свойства *Гидроксигруппа является сильно полярной группой, поэтому низшие спирты растворяются в воде неограниченно: метанол, этанол, пропанол смешиваются с водой во всех отношениях. *С увеличением количества атомов углерода спирты всё более начинают напоминать углеводороды. *Растворимость амилового спирта (пентанола-1) – 2, 7 г/ 100 мл, *растворимость октанола-1 – 0, 059 г/ 100 г. 19 08. 02. 2018
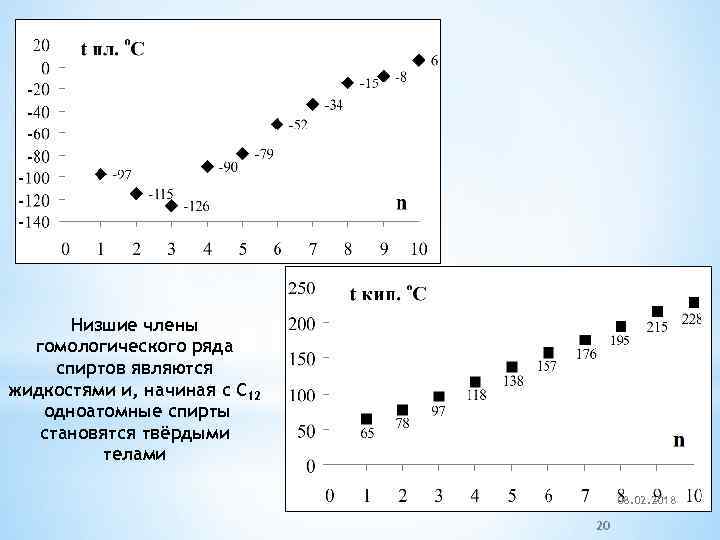 Низшие члены гомологического ряда спиртов являются жидкостями и, начиная с C 12 одноатомные спирты становятся твёрдыми телами * 08. 02. 2018 20
Низшие члены гомологического ряда спиртов являются жидкостями и, начиная с C 12 одноатомные спирты становятся твёрдыми телами * 08. 02. 2018 20
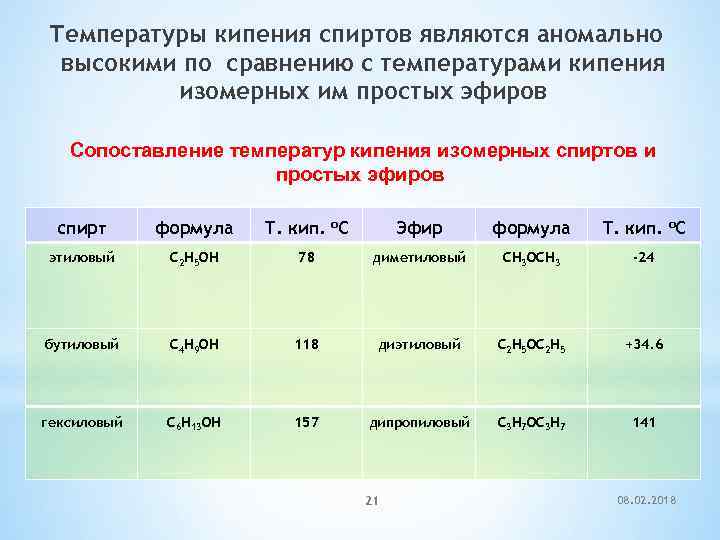 Температуры кипения спиртов являются аномально высокими по сравнению с температурами кипения изомерных им простых эфиров Сопоставление температур кипения изомерных спиртов и простых эфиров спирт формула Т. кип. о. С Эфир формула Т. кип. о. С этиловый C 2 H 5 OH 78 диметиловый CH 3 OCH 3 -24 бутиловый C 4 H 9 OH 118 диэтиловый C 2 H 5 OC 2 H 5 +34. 6 гексиловый C 6 H 13 OH 157 дипропиловый C 3 H 7 OC 3 H 7 141 21 08. 02. 2018
Температуры кипения спиртов являются аномально высокими по сравнению с температурами кипения изомерных им простых эфиров Сопоставление температур кипения изомерных спиртов и простых эфиров спирт формула Т. кип. о. С Эфир формула Т. кип. о. С этиловый C 2 H 5 OH 78 диметиловый CH 3 OCH 3 -24 бутиловый C 4 H 9 OH 118 диэтиловый C 2 H 5 OC 2 H 5 +34. 6 гексиловый C 6 H 13 OH 157 дипропиловый C 3 H 7 OC 3 H 7 141 21 08. 02. 2018
 22 08. 02. 2018
22 08. 02. 2018
 Метиловый спирт — сильный яд (особенно приеме внутрь) нервного и сердечнососудистого действия; поражает органы зрения вплоть до полной слепоты. В больших дозах (30 грамм и более) вызывает смерть 23 08. 02. 2018
Метиловый спирт — сильный яд (особенно приеме внутрь) нервного и сердечнососудистого действия; поражает органы зрения вплоть до полной слепоты. В больших дозах (30 грамм и более) вызывает смерть 23 08. 02. 2018
 Этиловый спирт обладает токсическим эффектом. Быстро Аллиловый спирт — вызывает острое отравление, в больших всасывается через слизистую количествах приеме внутрь оболочку желудка и тонкого — потеря сознания, тяжёлая кишечника, достигая кома и смерть. максимальной концентрации в крови через 20— 60 минут после его приёма, вызывая вначале возбуждение, а затем резкое угнетение центральной нервной Изопропиловый спирт по своему системы (в том числе разрушает токсическому воздействию мозговую оболочку) напоминает этанол, вызывая угнетение центральной нервной системы и поражая внутренние Этиленгликоль — очень органы. В высокой концентрации токсичен при попадании в приводит к коме, конвульсиям и организм; поражает ЦНС и летальному исходу почки, вызывает гемолиз эритроцитов; обладает мутагенным действием 08. 02. 2018 24
Этиловый спирт обладает токсическим эффектом. Быстро Аллиловый спирт — вызывает острое отравление, в больших всасывается через слизистую количествах приеме внутрь оболочку желудка и тонкого — потеря сознания, тяжёлая кишечника, достигая кома и смерть. максимальной концентрации в крови через 20— 60 минут после его приёма, вызывая вначале возбуждение, а затем резкое угнетение центральной нервной Изопропиловый спирт по своему системы (в том числе разрушает токсическому воздействию мозговую оболочку) напоминает этанол, вызывая угнетение центральной нервной системы и поражая внутренние Этиленгликоль — очень органы. В высокой концентрации токсичен при попадании в приводит к коме, конвульсиям и организм; поражает ЦНС и летальному исходу почки, вызывает гемолиз эритроцитов; обладает мутагенным действием 08. 02. 2018 24
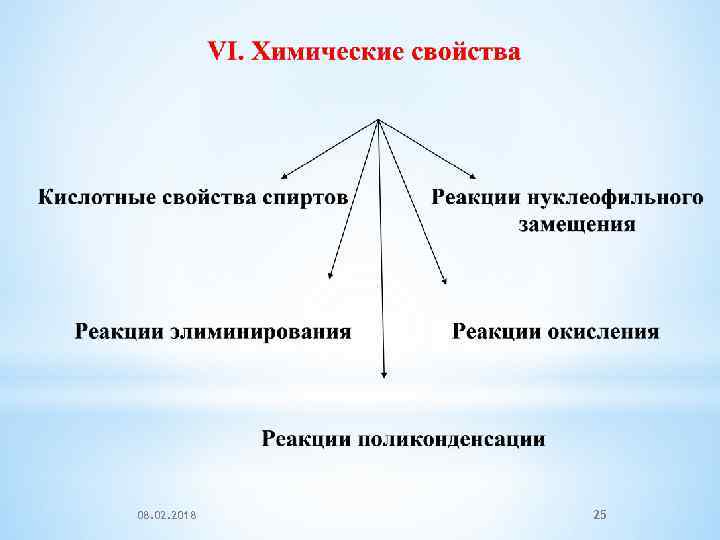 08. 02. 2018 25
08. 02. 2018 25
 1. Кислотные свойства спиртов Спирты подобно воде способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты способны диссоциировать по связи O−H с образованием алкоксид-иона: R – OH + H 2 O R – O - + H 3 O+ Кислотные характеристики спиртов оценивают по константе кислотности : 08. 02. 2018 26
1. Кислотные свойства спиртов Спирты подобно воде способны проявлять как кислотные, так и основные свойства. Как слабые кислоты, спирты способны диссоциировать по связи O−H с образованием алкоксид-иона: R – OH + H 2 O R – O - + H 3 O+ Кислотные характеристики спиртов оценивают по константе кислотности : 08. 02. 2018 26
 08. 02. 2018 27
08. 02. 2018 27
 08. 02. 2018 28
08. 02. 2018 28

 08. 02. 2018 30
08. 02. 2018 30
 08. 02. 2018 31
08. 02. 2018 31
 08. 02. 2018 32
08. 02. 2018 32
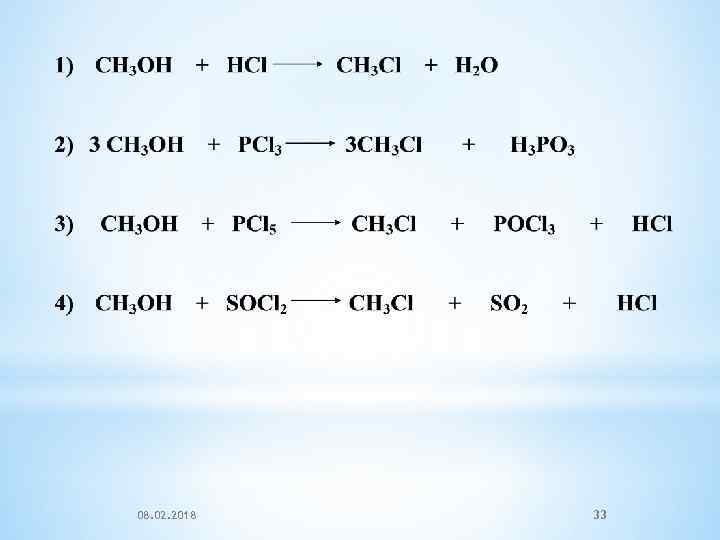 08. 02. 2018 33
08. 02. 2018 33
 08. 02. 2018 34
08. 02. 2018 34

 08. 02. 2018 36
08. 02. 2018 36
 37 08. 02. 2018
37 08. 02. 2018
 08. 02. 2018 38
08. 02. 2018 38

 08. 02. 2018 40
08. 02. 2018 40

 08. 02. 2018 42
08. 02. 2018 42

 МНОГОАТОМНЫЕ СПИРТЫ 1. Изомерия и номенклатура этиленгликоль глицерин эритрит Многоатомные спирты имеют общее название глициты 44 08. 02. 2018
МНОГОАТОМНЫЕ СПИРТЫ 1. Изомерия и номенклатура этиленгликоль глицерин эритрит Многоатомные спирты имеют общее название глициты 44 08. 02. 2018
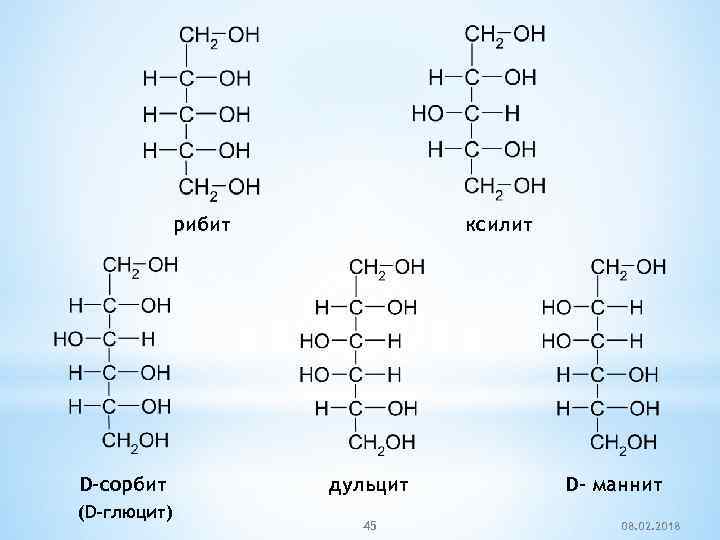 рибит D-сорбит (D-глюцит) ксилит дульцит 45 D- маннит 08. 02. 2018
рибит D-сорбит (D-глюцит) ксилит дульцит 45 D- маннит 08. 02. 2018
 Многоатомные спирты часто встречаются в природе. Сорбит содержится в плодах рябины (лат. sorbus – рябина), Маннит – в так называемой манне – застывшем сока ясеня Дульцит – содержится в мадагаскарской манне. 46 08. 02. 2018
Многоатомные спирты часто встречаются в природе. Сорбит содержится в плодах рябины (лат. sorbus – рябина), Маннит – в так называемой манне – застывшем сока ясеня Дульцит – содержится в мадагаскарской манне. 46 08. 02. 2018
 2. Физические и биологические свойства *Этиленгликоль и пропиленгликоль являются высококипящими жидкостями, глицерин представляет собой очень вязкую жидкость. Многоатомные спирты с количеством гидроксигрупп больше трёх являются твёрдыми телами. *Многоатомные спирты прекрасно растворяются в воде. Это обусловлено наличием нескольких полярных групп -OH. Водные растворы этиленгликоля не замерзают при очень низкой температуре, поэтому используются как антифризы в системах охлаждения двигателей внутреннего сгорания. *Почти все многоатомные спирты обладают сладким вкусом. Поэтому ксилит и сорбит используются в питании больных диабетом. 47 08. 02. 2018
2. Физические и биологические свойства *Этиленгликоль и пропиленгликоль являются высококипящими жидкостями, глицерин представляет собой очень вязкую жидкость. Многоатомные спирты с количеством гидроксигрупп больше трёх являются твёрдыми телами. *Многоатомные спирты прекрасно растворяются в воде. Это обусловлено наличием нескольких полярных групп -OH. Водные растворы этиленгликоля не замерзают при очень низкой температуре, поэтому используются как антифризы в системах охлаждения двигателей внутреннего сгорания. *Почти все многоатомные спирты обладают сладким вкусом. Поэтому ксилит и сорбит используются в питании больных диабетом. 47 08. 02. 2018
 3. Химические свойства: 1) кислотные свойства а) образование комплексных солей Качественная реакция на многоатомные спирты – образующееся комплексное соединение имеет интенсивную васильковую окраску 48 08. 02. 2018
3. Химические свойства: 1) кислотные свойства а) образование комплексных солей Качественная реакция на многоатомные спирты – образующееся комплексное соединение имеет интенсивную васильковую окраску 48 08. 02. 2018
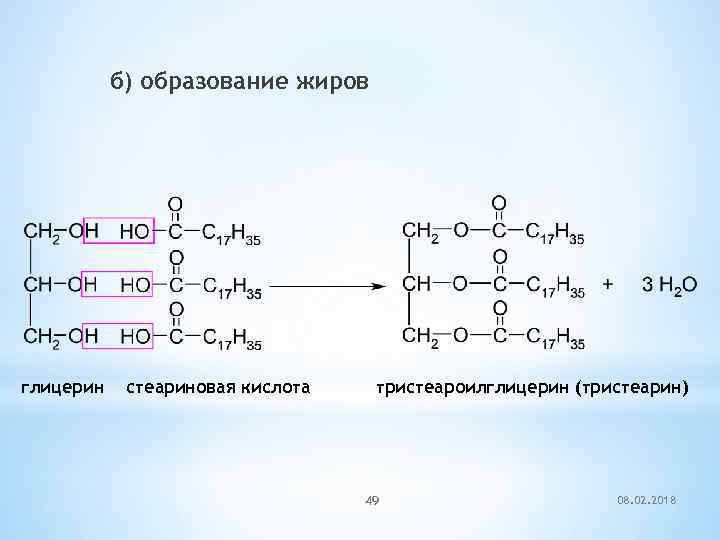 б) образование жиров глицерин стеариновая кислота тристеароилглицерин (тристеарин) 49 08. 02. 2018
б) образование жиров глицерин стеариновая кислота тристеароилглицерин (тристеарин) 49 08. 02. 2018
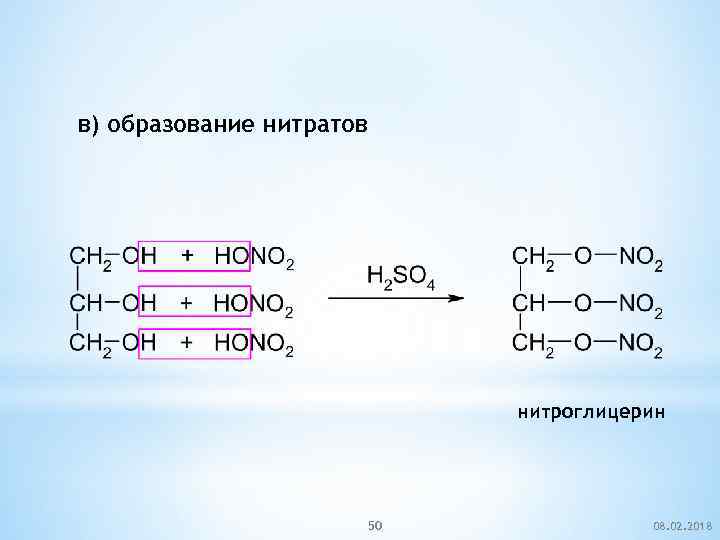 в) образование нитратов нитроглицерин 50 08. 02. 2018
в) образование нитратов нитроглицерин 50 08. 02. 2018
 Нитроглицерин используется во взрывчатых веществах - динамитах и бездымных порохах - баллиститах. Динамит и баллистит были изобретены А. Нобелем в 1867 и 1888 годах. В медицине нитроглицерин используется как сосудорасширяющее средство, используется приступах стенокардии. А. Нобель (1833 – 1896) 51 08. 02. 2018
Нитроглицерин используется во взрывчатых веществах - динамитах и бездымных порохах - баллиститах. Динамит и баллистит были изобретены А. Нобелем в 1867 и 1888 годах. В медицине нитроглицерин используется как сосудорасширяющее средство, используется приступах стенокардии. А. Нобель (1833 – 1896) 51 08. 02. 2018
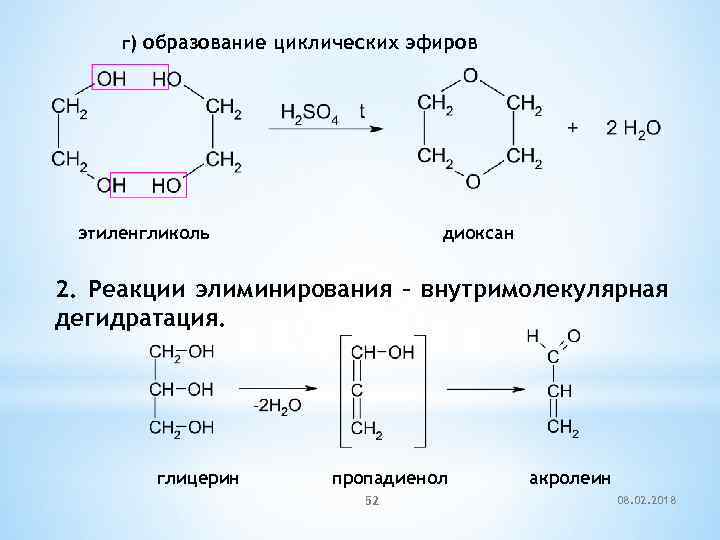 г) образование циклических эфиров этиленгликоль диоксан 2. Реакции элиминирования – внутримолекулярная дегидратация. глицерин пропадиенол 52 акролеин 08. 02. 2018
г) образование циклических эфиров этиленгликоль диоксан 2. Реакции элиминирования – внутримолекулярная дегидратация. глицерин пропадиенол 52 акролеин 08. 02. 2018
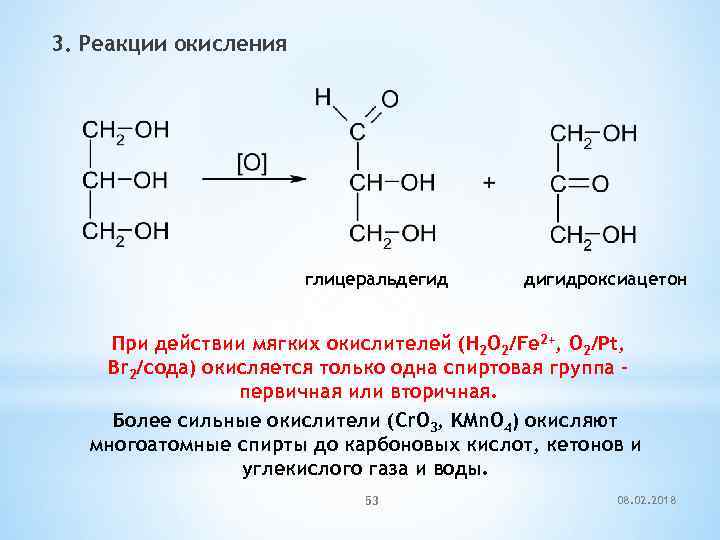 3. Реакции окисления глицеральдегид дигидроксиацетон При действии мягких окислителей (H 2 O 2/Fe 2+, O 2/Pt, Br 2/сода) окисляется только одна спиртовая группа – первичная или вторичная. Более сильные окислители (Cr. O 3, KMn. O 4) окисляют многоатомные спирты до карбоновых кислот, кетонов и углекислого газа и воды. 53 08. 02. 2018
3. Реакции окисления глицеральдегид дигидроксиацетон При действии мягких окислителей (H 2 O 2/Fe 2+, O 2/Pt, Br 2/сода) окисляется только одна спиртовая группа – первичная или вторичная. Более сильные окислители (Cr. O 3, KMn. O 4) окисляют многоатомные спирты до карбоновых кислот, кетонов и углекислого газа и воды. 53 08. 02. 2018
 08. 02. 2018 54
08. 02. 2018 54

 08. 02. 2018 56
08. 02. 2018 56
 08. 02. 2018 57
08. 02. 2018 57
 08. 02. 2018 58
08. 02. 2018 58
 59 08. 02. 2018
59 08. 02. 2018


