СПИРТИ • Спирти похідні вуглеводнів, у молекулах






















- Размер: 1.3 Mегабайта
- Количество слайдов: 37
Описание презентации СПИРТИ • Спирти похідні вуглеводнів, у молекулах по слайдам
 СПИРТИ • Спирти похідні вуглеводнів, у молекулах яких один або декілька атомів водню заміщені на гідроксильну групу (-ОН). Їх загальна формула R -ОН Число гідроксильних груп визначає атомність спиртів. Одноатомні спирти містять у молекулі одну ОН-групу (С 2 Н 5 ОН), двоатомні — дві ОН-групи (СН 2 ОН-СН 2 ОН), триатомні — три ОН групи (СН 2 ОН-СН 2 ОН). • Залежно від природи вуглеводневого радикалу, з яким зв’язана ОН-група, розрізняють первинні, вторинні та третинні спирти. СН 3 │ СН 3 —СН 2 —ОН СН 3 —СН—СН 3 —С—ОН │ ОН СН 3 Первинний спирт Вторинний спирт Третинний спирт
СПИРТИ • Спирти похідні вуглеводнів, у молекулах яких один або декілька атомів водню заміщені на гідроксильну групу (-ОН). Їх загальна формула R -ОН Число гідроксильних груп визначає атомність спиртів. Одноатомні спирти містять у молекулі одну ОН-групу (С 2 Н 5 ОН), двоатомні — дві ОН-групи (СН 2 ОН-СН 2 ОН), триатомні — три ОН групи (СН 2 ОН-СН 2 ОН). • Залежно від природи вуглеводневого радикалу, з яким зв’язана ОН-група, розрізняють первинні, вторинні та третинні спирти. СН 3 │ СН 3 —СН 2 —ОН СН 3 —СН—СН 3 —С—ОН │ ОН СН 3 Первинний спирт Вторинний спирт Третинний спирт
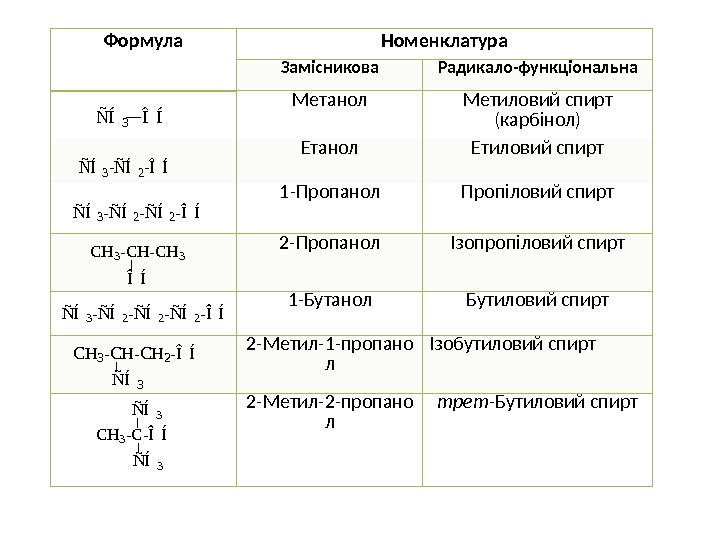
 ОДНОАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНОЛИ) НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ • За замісниковою номенклатурою назву одноатомних насичених спиртів утворюють від назви відповідного насиченого вуглеводню (алкану) з додаванням закінчення -ол. Головний ланцюг нумерується з того кінця, ближче до якого міститься ОН-група. • Широкого розповсюдження набули також назви за радикало-функціональною номенклатурою. Для утворення назви спирту називають вуглеводневий залишок, сполучений з ОН-групою, додають суфікс – овий і слово спирт.
ОДНОАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНОЛИ) НОМЕНКЛАТУРА ТА ІЗОМЕРІЯ • За замісниковою номенклатурою назву одноатомних насичених спиртів утворюють від назви відповідного насиченого вуглеводню (алкану) з додаванням закінчення -ол. Головний ланцюг нумерується з того кінця, ближче до якого міститься ОН-група. • Широкого розповсюдження набули також назви за радикало-функціональною номенклатурою. Для утворення назви спирту називають вуглеводневий залишок, сполучений з ОН-групою, додають суфікс – овий і слово спирт.
 Формула Номенклатура Замісникова Радикало-функціональна Метанол Метиловий спирт (карбінол) Етанол Етиловий спирт 1 -Пропанол Пропіловий спирт 2 -Пропанол Ізопропіловий спирт 1 -Бутанол Бутиловий спирт 2 -Метил-1 -пропано л Ізобутиловий спирт 2 -Метил-2 -пропано л трет -Бутиловий спиртÑ Í3 Î Í ÑÍ3 -ÑÍ2 -ÎÍ Ñ Í 3 — Ñ Í2 — Î Í C H 3 — C H 3 Î Í ÑÍ3 -ÑÍ2 -ÑÍ2 -ÎÍ C H 3 — C H 2 — Î Í Ñ Í 3 ÑÍ3 CH 3 -C-ÎÍ
Формула Номенклатура Замісникова Радикало-функціональна Метанол Метиловий спирт (карбінол) Етанол Етиловий спирт 1 -Пропанол Пропіловий спирт 2 -Пропанол Ізопропіловий спирт 1 -Бутанол Бутиловий спирт 2 -Метил-1 -пропано л Ізобутиловий спирт 2 -Метил-2 -пропано л трет -Бутиловий спиртÑ Í3 Î Í ÑÍ3 -ÑÍ2 -ÎÍ Ñ Í 3 — Ñ Í2 — Î Í C H 3 — C H 3 Î Í ÑÍ3 -ÑÍ2 -ÑÍ2 -ÎÍ C H 3 — C H 2 — Î Í Ñ Í 3 ÑÍ3 CH 3 -C-ÎÍ
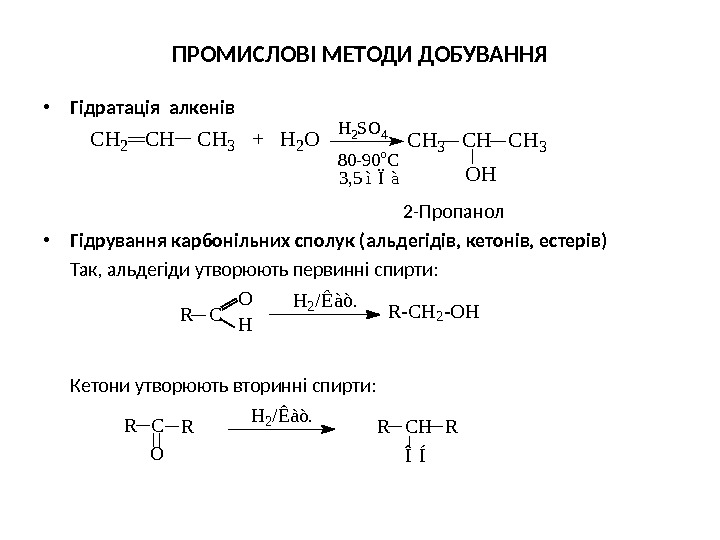
 МЕТОДИ ДОБУВАННЯ • До головних промислових методів добування відносяться: • гідратація алкенів, • гідрування карбонільних сполук, • реакція оксосинтезу , • ферментативна переробка вуглеводів. • Крім цього, існують лабораторні методи одержання спиртів: гідроліз галогеноалкілів та синтез за допомогою металоорганічних сполук.
МЕТОДИ ДОБУВАННЯ • До головних промислових методів добування відносяться: • гідратація алкенів, • гідрування карбонільних сполук, • реакція оксосинтезу , • ферментативна переробка вуглеводів. • Крім цього, існують лабораторні методи одержання спиртів: гідроліз галогеноалкілів та синтез за допомогою металоорганічних сполук.
 ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ • Гідратація алкенів 2 -Пропанол • Гідрування карбонільних сполук (альдегідів, кетонів, естерів) Так, альдегіди утворюють первинні спирти: Кетони утворюють вторинні спирти: C H 2 C H 3 + H 2 O C H 3 H 2 SO 4 O H 80 -90 o. C 3, 5 ìÏà R C O H R — C H 2 — O HH 2 / Ê à ò. Î ÍR C H R R C O R
ПРОМИСЛОВІ МЕТОДИ ДОБУВАННЯ • Гідратація алкенів 2 -Пропанол • Гідрування карбонільних сполук (альдегідів, кетонів, естерів) Так, альдегіди утворюють первинні спирти: Кетони утворюють вторинні спирти: C H 2 C H 3 + H 2 O C H 3 H 2 SO 4 O H 80 -90 o. C 3, 5 ìÏà R C O H R — C H 2 — O HH 2 / Ê à ò. Î ÍR C H R R C O R
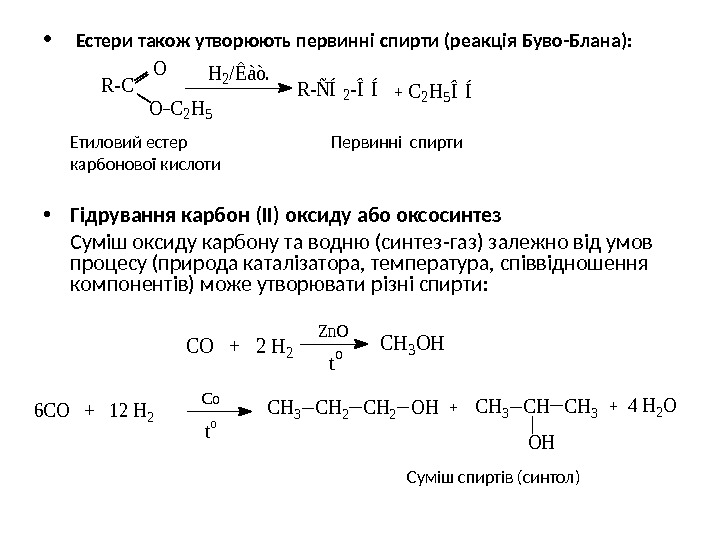
 • Естери також утворюють первинні спирти (реакція Буво-Блана): Етиловий естер Первинні спирти карбонової кислоти • Гідрування карбон (ІІ) оксиду або оксосинтез Суміш оксиду карбону та водню (синтез-газ) залежно від умов процесу (природа каталізатора, температура, співвідношення компонентів) може утворювати різні спирти: Суміш спиртів (синтол)R-ÑÍ2 -ÎÍR-C O H 2/Êàò. O C 2 H 5 ÎÍ CO + 2 H 2 CH 3 OH Zn. O t o 6 CO + 12 H 2 Co t o CH 3 CH 2 OHCH 3 CH 34 H 2 O OH
• Естери також утворюють первинні спирти (реакція Буво-Блана): Етиловий естер Первинні спирти карбонової кислоти • Гідрування карбон (ІІ) оксиду або оксосинтез Суміш оксиду карбону та водню (синтез-газ) залежно від умов процесу (природа каталізатора, температура, співвідношення компонентів) може утворювати різні спирти: Суміш спиртів (синтол)R-ÑÍ2 -ÎÍR-C O H 2/Êàò. O C 2 H 5 ÎÍ CO + 2 H 2 CH 3 OH Zn. O t o 6 CO + 12 H 2 Co t o CH 3 CH 2 OHCH 3 CH 34 H 2 O OH
 • Синтез вищих спиртів • Ферментативна переробка вуглеводів Ферментативне розщеплення вуглеводів (спиртове бродіння) здавна служить методом одержання етанолу: Моносахарид (глюкоза, фруктоза, маноза) O 2Ò ð è å ò è ë à ë þ ì ³ í ³ éA l ( C 2 H 5 ) 3 3 n C H 2 A l [ ( C H 2 ) n C 2 H 5 ] 3 A l [ O ( C H 2 ) n C 2 H 5 ] 3 3 H 2 O A l ( O H ) 3 3 H O ( C H 2 ) n C 2 H 5 C 6 H 1 2 O 6 2 C 2 H 5 O H 2 C O 2 Ф е р м е н т
• Синтез вищих спиртів • Ферментативна переробка вуглеводів Ферментативне розщеплення вуглеводів (спиртове бродіння) здавна служить методом одержання етанолу: Моносахарид (глюкоза, фруктоза, маноза) O 2Ò ð è å ò è ë à ë þ ì ³ í ³ éA l ( C 2 H 5 ) 3 3 n C H 2 A l [ ( C H 2 ) n C 2 H 5 ] 3 A l [ O ( C H 2 ) n C 2 H 5 ] 3 3 H 2 O A l ( O H ) 3 3 H O ( C H 2 ) n C 2 H 5 C 6 H 1 2 O 6 2 C 2 H 5 O H 2 C O 2 Ф е р м е н т
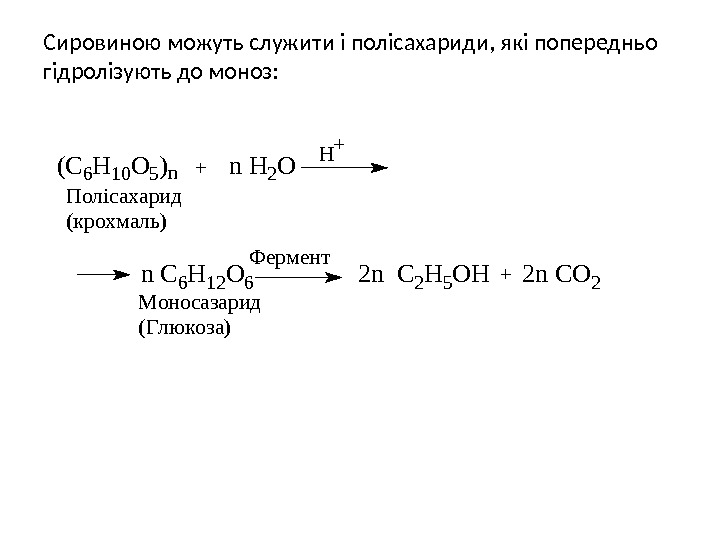
 Сировиною можуть служити і полісахариди, які попередньо гідролізують до моноз: n C 6 H 12 O 6 2 n C 2 H 5 O H 2 n C O 2 Ф е р м е н т М о н о с а з а р и д ( Г л ю к о з а ) П о л і с а х а р и д ( к р о х м а л ь )( C 6 H 10 O 5 )n n H 2 O H
Сировиною можуть служити і полісахариди, які попередньо гідролізують до моноз: n C 6 H 12 O 6 2 n C 2 H 5 O H 2 n C O 2 Ф е р м е н т М о н о с а з а р и д ( Г л ю к о з а ) П о л і с а х а р и д ( к р о х м а л ь )( C 6 H 10 O 5 )n n H 2 O H
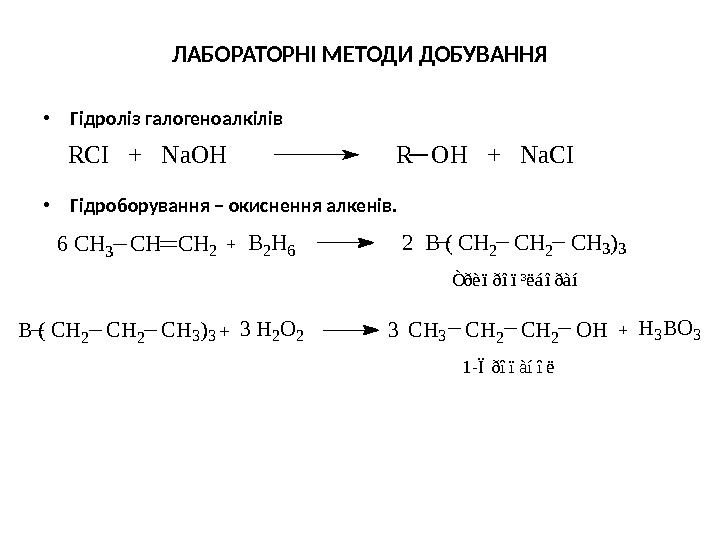
 ЛАБОРАТОРНІ МЕТОДИ ДОБУВАННЯ • Гідроліз галогеноалкілів • Гідроборування – окиснення алкенів. RCI + Na. OH R OH + Na. CI C H 3 C H 2 O H 1 — Ï ð î ï à í î ë 33 H 2 O 2 B ( C H 2 C H 3 ) 3 H 3 B O 3 C H 3 C H 2 Ò ð è ï ð î ï ³ ë á î ð à íB 2 H 6 2 B ( C H 2 C H 3 )
ЛАБОРАТОРНІ МЕТОДИ ДОБУВАННЯ • Гідроліз галогеноалкілів • Гідроборування – окиснення алкенів. RCI + Na. OH R OH + Na. CI C H 3 C H 2 O H 1 — Ï ð î ï à í î ë 33 H 2 O 2 B ( C H 2 C H 3 ) 3 H 3 B O 3 C H 3 C H 2 Ò ð è ï ð î ï ³ ë á î ð à íB 2 H 6 2 B ( C H 2 C H 3 )
 ФІЗИЧНІ ВЛАСТИВОСТІ • Температура кипіння спиртів вища, ніж у алкілгалогенідів і алканів з тим же числом атомів карбону. Це пояснюється наявністю водневих зв’язків між молекулами спирту, які ведуть до утворення асоціатів. • Спирти С 1 -С 10 — рідини, починаючи з С 11 — тверді речовини. Одноатомні спирти С 1 -С 3 змішуються з водою у будь-якому співвідношенні. Розчинність у воді інших спиртів зменшується з ростом довжини карбонового ланцюга в їх молекулах. H O RH O R
ФІЗИЧНІ ВЛАСТИВОСТІ • Температура кипіння спиртів вища, ніж у алкілгалогенідів і алканів з тим же числом атомів карбону. Це пояснюється наявністю водневих зв’язків між молекулами спирту, які ведуть до утворення асоціатів. • Спирти С 1 -С 10 — рідини, починаючи з С 11 — тверді речовини. Одноатомні спирти С 1 -С 3 змішуються з водою у будь-якому співвідношенні. Розчинність у воді інших спиртів зменшується з ростом довжини карбонового ланцюга в їх молекулах. H O RH O R
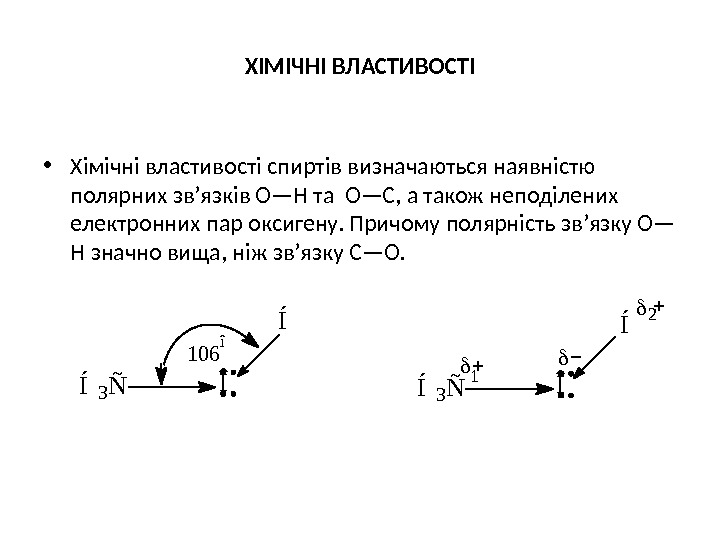
 ХІМІЧНІ ВЛАСТИВОСТІ • Хімічні властивості спиртів визначаються наявністю полярних зв’язків О—Н та О—С, а також неподілених електронних пар оксигену. Причому полярність зв’язку О— Н значно вища, ніж зв’язку С—О. Í 3 Ñ 106 î Í Í 3 Ñ Í Î1 2 Î
ХІМІЧНІ ВЛАСТИВОСТІ • Хімічні властивості спиртів визначаються наявністю полярних зв’язків О—Н та О—С, а також неподілених електронних пар оксигену. Причому полярність зв’язку О— Н значно вища, ніж зв’язку С—О. Í 3 Ñ 106 î Í Í 3 Ñ Í Î1 2 Î
 • Кислотно-основні властивості спиртів Зв’язок ОН у спиртах досить полярний, тому спирти дисоціюють з утворенням протонів, через що вони проявляють кислотні властивості. Кислотність спиртів підтверджується взаємодією їх з лужними металами (К, Na , тощо). При цьому утворюються алкоголяти, R —О Na. У водному середовищі алкоголяти легко гідролізують, тому одержати їх взаємодією спирту з лугом неможливо Однак, с пирти є слабшими кислотами, ніж вода і їх кислотність зменшується в ряді: первинний > вторинний > третинний. àáî R Î ÍR Î ÍROH 2 R O H + 2 N a 2 R O N a + H 2 R—ONa + H 2 O R—OH + Na. OH
• Кислотно-основні властивості спиртів Зв’язок ОН у спиртах досить полярний, тому спирти дисоціюють з утворенням протонів, через що вони проявляють кислотні властивості. Кислотність спиртів підтверджується взаємодією їх з лужними металами (К, Na , тощо). При цьому утворюються алкоголяти, R —О Na. У водному середовищі алкоголяти легко гідролізують, тому одержати їх взаємодією спирту з лугом неможливо Однак, с пирти є слабшими кислотами, ніж вода і їх кислотність зменшується в ряді: первинний > вторинний > третинний. àáî R Î ÍR Î ÍROH 2 R O H + 2 N a 2 R O N a + H 2 R—ONa + H 2 O R—OH + Na. OH
 Поряд з кислотними властивостями, спирти проявляють основні властивості за рахунок наявності на атомі кисню двох неподілених пар електронів (за теорією Льюїса основи — це донори електронів). Основність спиртів, на відміну від кислотності, зростає від первинних до третинних. Спирти доволі легко протонуються з утворенням алкоксоніевих йонів. Утворені алкоксонієві йони можуть відщеплювати воду, перетворюючись у карбокатіони Таким чином, спиртам характерні амфотерні властивості: слабка кислотність або основність будуть переважати, залежно від природи спирту. Крім того, наявність неподілених пар електронів на атомі кисню надає їм нуклеофільності. Особливо сильні нуклеофіли алкоксианіони R — O – , які утворюються при дисоціації алкоголятів. Î ñ í î â à Ë ü þ ¿ ñ à À ë ê î ê ñ î í ³ º â è éH a l H H a l. R Î Í H R H 2 O H a l R Î Í é î í
Поряд з кислотними властивостями, спирти проявляють основні властивості за рахунок наявності на атомі кисню двох неподілених пар електронів (за теорією Льюїса основи — це донори електронів). Основність спиртів, на відміну від кислотності, зростає від первинних до третинних. Спирти доволі легко протонуються з утворенням алкоксоніевих йонів. Утворені алкоксонієві йони можуть відщеплювати воду, перетворюючись у карбокатіони Таким чином, спиртам характерні амфотерні властивості: слабка кислотність або основність будуть переважати, залежно від природи спирту. Крім того, наявність неподілених пар електронів на атомі кисню надає їм нуклеофільності. Особливо сильні нуклеофіли алкоксианіони R — O – , які утворюються при дисоціації алкоголятів. Î ñ í î â à Ë ü þ ¿ ñ à À ë ê î ê ñ î í ³ º â è éH a l H H a l. R Î Í H R H 2 O H a l R Î Í é î í
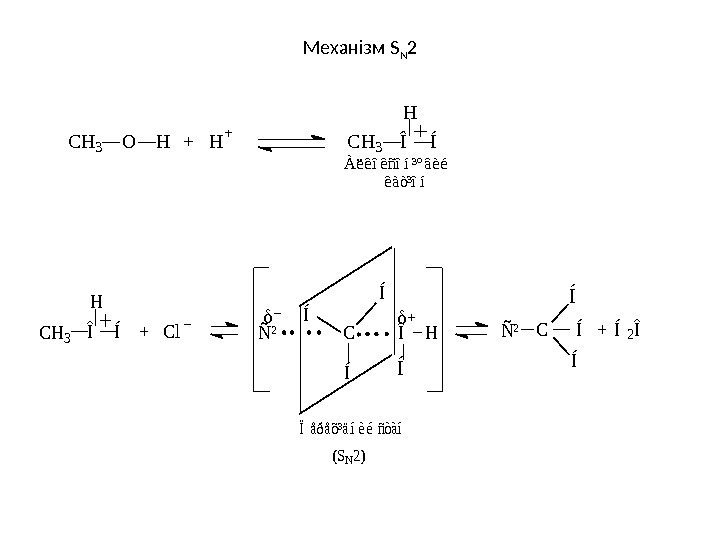
 • Заміщення гідроксильної групи на галоген При взаємодії спиртів з HCl , HBr тощо, відбувається заміщення НО-групи на галоген: Легше всього вступають у реакцію третинні спирти за механізмом S N 1 потім вторинні і нарешті первинні (механізм S N 2): С 2 Н 5—ОН + НСІ С 2 Н 5—СІ + Н 2 О Ø â è ä ê îÑ Ñ Í 3 Î Í Í Î Í Í Ñ Ñ Í 3 Ñ Í 3 Ñ Ñ Í 3Ï î â ³ ë ü í î H 2 O C lÑ Ñ Í
• Заміщення гідроксильної групи на галоген При взаємодії спиртів з HCl , HBr тощо, відбувається заміщення НО-групи на галоген: Легше всього вступають у реакцію третинні спирти за механізмом S N 1 потім вторинні і нарешті первинні (механізм S N 2): С 2 Н 5—ОН + НСІ С 2 Н 5—СІ + Н 2 О Ø â è ä ê îÑ Ñ Í 3 Î Í Í Î Í Í Ñ Ñ Í 3 Ñ Í 3 Ñ Ñ Í 3Ï î â ³ ë ü í î H 2 O C lÑ Ñ Í
 М еханізм S N 2 À ë ê î ê ñ î í ³ º â è é ê à ò ³ î í+ H + H Î ÍC H 3 O HѲ (SN 2) Ïåðåõ³äíèé ñòàí C Í Í2Î+ H Î ÍCH 3+ ClÎ H Í C Í Í Í Ñ²
М еханізм S N 2 À ë ê î ê ñ î í ³ º â è é ê à ò ³ î í+ H + H Î ÍC H 3 O HѲ (SN 2) Ïåðåõ³äíèé ñòàí C Í Í2Î+ H Î ÍCH 3+ ClÎ H Í C Í Í Í Ñ²
 Взаємодія з галогеннуклеофілами PCl 5 , PCl 3 , SOCl 2 , також веде до утворення алкілгалогенідів з майже кількісним виходом: С 2 Н 5 — ОН + РСІ 5 С 2 Н 5 — СІ + РОСІ 3 + НСІ О ксохлорид фосфору
Взаємодія з галогеннуклеофілами PCl 5 , PCl 3 , SOCl 2 , також веде до утворення алкілгалогенідів з майже кількісним виходом: С 2 Н 5 — ОН + РСІ 5 С 2 Н 5 — СІ + РОСІ 3 + НСІ О ксохлорид фосфору
 • Реакція утворення естерів (естерифікація) При взаємодії спиртів з органічними кислотами утворюються естери, які можна розглядати як похідні спиртів, у яких атом водню ОН-групи замінено на залишок кислоти -ацил. Естерифікація протікає у присутності каталізаторів – сильних мінеральних кислот (конц. H 2 SO 4 , H 3 PO 4 тощо). Реакція естерифікації – оборотна. Зворотна реакція називається гідролізом естеру. Î C O R 1 R HOC O R 1 Í H 2 OO R Í Å ñ ò å ð
• Реакція утворення естерів (естерифікація) При взаємодії спиртів з органічними кислотами утворюються естери, які можна розглядати як похідні спиртів, у яких атом водню ОН-групи замінено на залишок кислоти -ацил. Естерифікація протікає у присутності каталізаторів – сильних мінеральних кислот (конц. H 2 SO 4 , H 3 PO 4 тощо). Реакція естерифікації – оборотна. Зворотна реакція називається гідролізом естеру. Î C O R 1 R HOC O R 1 Í H 2 OO R Í Å ñ ò å ð
 • Дегідратація спиртів (реакція Е) Реакцією дегідратації зі спиртів отримують алкени та алкадієни. Дегідратація протікає при нагріванні спирту з концентрованою сульфатною або фосфатною кислотами (а також АІ 2 О 3 , . кислих солей цих кислот та ін. ). Встановлено, що легше дегідратуються третинні спирти, тоді вторинні і далі первинні. В результаті міжмолекулярної дегідратації утворюються етери: Î Í Í Ñ Ñ Í 3 H 2 O Ñ Í 2ÑÑ Í 3 Н+ С 2 Н 5 -ОН + НО-С 2 Н 5 -О-С 2 Н 5 -Н 2 О Диети ловий етер
• Дегідратація спиртів (реакція Е) Реакцією дегідратації зі спиртів отримують алкени та алкадієни. Дегідратація протікає при нагріванні спирту з концентрованою сульфатною або фосфатною кислотами (а також АІ 2 О 3 , . кислих солей цих кислот та ін. ). Встановлено, що легше дегідратуються третинні спирти, тоді вторинні і далі первинні. В результаті міжмолекулярної дегідратації утворюються етери: Î Í Í Ñ Ñ Í 3 H 2 O Ñ Í 2ÑÑ Í 3 Н+ С 2 Н 5 -ОН + НО-С 2 Н 5 -О-С 2 Н 5 -Н 2 О Диети ловий етер
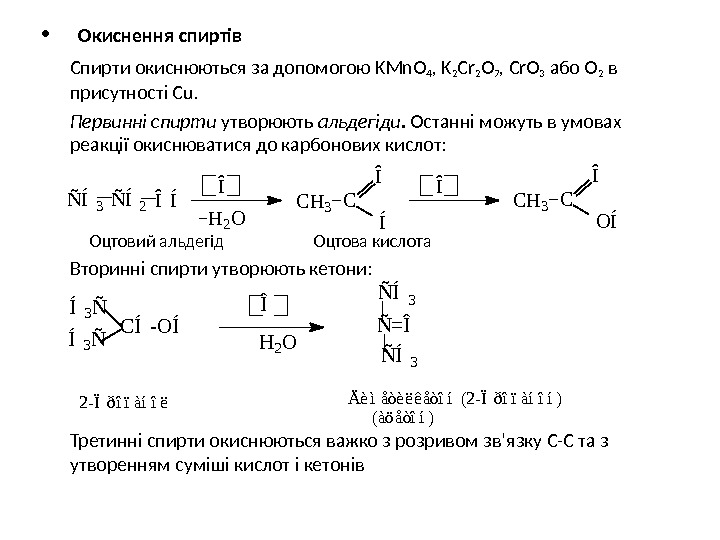
 • Окиснення спиртів Спирти окиснюються за допомогою KMn. O 4 , K 2 Cr 2 O 7 , Cr. O 3 або О 2 в присутності С u. Первинні спирти утворюють альдегіди. Останні можуть в умовах реакції окиснюватися до карбонових кислот: Оцтовий альдегід Оцтова кислота Вторинні спирти утворюють кетони: Третинні спирти окиснюються важко з розривом зв’язку С-С та з утворенням суміші кислот і кетонівÑ Í3 Ñ Í2 Î Í Î H 2 O C H 3 C Î Í O Í Î C C H 3Î Ä è ì å ò è ë ê å ò î í ( 2 — Ï ð î ï à í î í ) ( à ö å ò î í )2 — Ï ð î ï à í î ëÍ 3 Ñ C Í — O Í Í 3 Ñ Ñ = Î Ñ Í 3 Î H 2 O
• Окиснення спиртів Спирти окиснюються за допомогою KMn. O 4 , K 2 Cr 2 O 7 , Cr. O 3 або О 2 в присутності С u. Первинні спирти утворюють альдегіди. Останні можуть в умовах реакції окиснюватися до карбонових кислот: Оцтовий альдегід Оцтова кислота Вторинні спирти утворюють кетони: Третинні спирти окиснюються важко з розривом зв’язку С-С та з утворенням суміші кислот і кетонівÑ Í3 Ñ Í2 Î Í Î H 2 O C H 3 C Î Í O Í Î C C H 3Î Ä è ì å ò è ë ê å ò î í ( 2 — Ï ð î ï à í î í ) ( à ö å ò î í )2 — Ï ð î ï à í î ëÍ 3 Ñ C Í — O Í Í 3 Ñ Ñ = Î Ñ Í 3 Î H 2 O
 ОДНОАТОМНІ НЕНАСИЧЕНІ СПИРТИ (АЛКЕНОЛИ, АЛКІНОЛИ) Ненасиченими називаються такі спирти, у яких гідроксильна ОН-група зв’язана з атомом вуглецю ненасиченого вуглеводня. Їх назви за замісниковою номенклатурою складаються з назви вуглеводня і суфікса — ол. Нумерацію головного ланцюга починають з того кінця, ближче до якого знаходиться ОН-група. Назви за радикало-функціональною номенклатурою утворюються аналогічно до назв насичених спиртів. Етенол або Вініловий спирт 2 -Пропен-1 -ол або Аліловий спирт 3 -Бутен-2 -ол. CH 2=CÍ-ÎÍC H 2 = C Í — Ñ Í2 — Î Í Ñ Í Ñ — Ñ Í 2 — Î Í
ОДНОАТОМНІ НЕНАСИЧЕНІ СПИРТИ (АЛКЕНОЛИ, АЛКІНОЛИ) Ненасиченими називаються такі спирти, у яких гідроксильна ОН-група зв’язана з атомом вуглецю ненасиченого вуглеводня. Їх назви за замісниковою номенклатурою складаються з назви вуглеводня і суфікса — ол. Нумерацію головного ланцюга починають з того кінця, ближче до якого знаходиться ОН-група. Назви за радикало-функціональною номенклатурою утворюються аналогічно до назв насичених спиртів. Етенол або Вініловий спирт 2 -Пропен-1 -ол або Аліловий спирт 3 -Бутен-2 -ол. CH 2=CÍ-ÎÍC H 2 = C Í — Ñ Í2 — Î Í Ñ Í Ñ — Ñ Í 2 — Î Í
 Найпростіший представник — вініловий спирт у вільному вигляді не існує , тому що спирти з гідроксильною групою при вуглеці з подвійним зв ’ язком нестійкі і ізомеризуються в альдегіди і кетони ( правило А. П. Ельтекова — Ерленмейєра ). Натомість етери і естери вінілового спирту стійкі і застосовуються для одержання полімерів, наприклад: Вінілбутиловий етер Вінілацетат • Аліловий спирт використовують для одержання гліцеролу, акролеїну, акрилової кислоти. Етери алілового спирту застосовують для одержання пластичних мас. • Пропаргіловий спирт використовують в органічному синтезі. à á îC H 2 C Í O C 4 H 9 C H 2 C Í O C C H
Найпростіший представник — вініловий спирт у вільному вигляді не існує , тому що спирти з гідроксильною групою при вуглеці з подвійним зв ’ язком нестійкі і ізомеризуються в альдегіди і кетони ( правило А. П. Ельтекова — Ерленмейєра ). Натомість етери і естери вінілового спирту стійкі і застосовуються для одержання полімерів, наприклад: Вінілбутиловий етер Вінілацетат • Аліловий спирт використовують для одержання гліцеролу, акролеїну, акрилової кислоти. Етери алілового спирту застосовують для одержання пластичних мас. • Пропаргіловий спирт використовують в органічному синтезі. à á îC H 2 C Í O C 4 H 9 C H 2 C Í O C C H
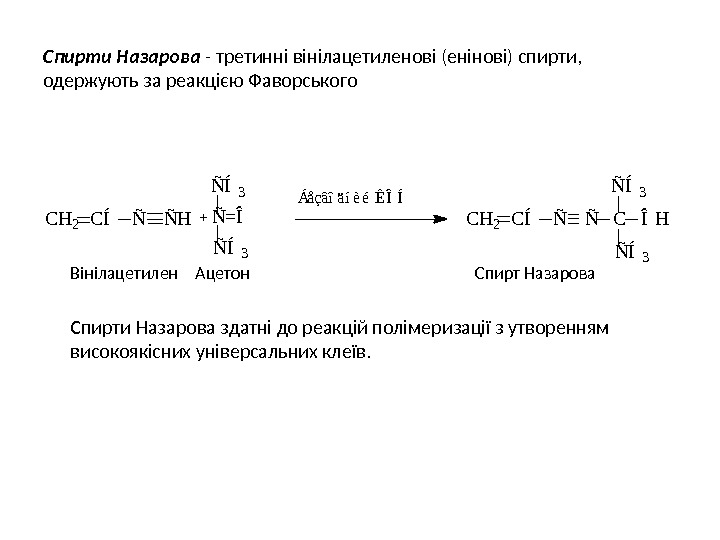
 Спирти Назарова — третинні вінілацетиленові (енінові) спирти, одержують за реакцією Фаворського Вінілацетилен Ацетон Спирт Назарова Спирти Назарова здатні до реакцій полімеризації з утворенням високоякісних універсальних клеїв. C H 2 C Í Ñ H Ñ = Î Ñ Í 3 Á å ç â î ä í è é Ê Î Í C H 2 C Í Ñ C Î HÑ Í
Спирти Назарова — третинні вінілацетиленові (енінові) спирти, одержують за реакцією Фаворського Вінілацетилен Ацетон Спирт Назарова Спирти Назарова здатні до реакцій полімеризації з утворенням високоякісних універсальних клеїв. C H 2 C Í Ñ H Ñ = Î Ñ Í 3 Á å ç â î ä í è é Ê Î Í C H 2 C Í Ñ C Î HÑ Í
 ДВОАТОМНІ НАСИЧЕНІ СПИРТИ (ГЛІКОЛІ АБО АЛКАНДІОЛИ) Двоатомні насичені спирти або гліколі — це спирти з двома гідроксильними групами при різних вуглецевих атомах. • За систематичною замісниковою номенклатурою для утворення назви гліколя до назви відповідного алкану додають закінчення -діол і вказують місце груп ОН в головному ланцюзі. За радикало-функціональною номенклатурою назви діолів утворюють додаючи до назви відповідного двохвалентного радикала, що зв’язаний з двома ОН-групами, суфіксу — гліколь. • Слід відзначити, що гліколі з двома ОН-групами при одному атомі вуглецю не існують тому, що такі продукти одразу втрачають воду і перетворюються в альдегіди або кетони. Î Í C H 3 C H H 2 OC H 3 C Î H Î Í
ДВОАТОМНІ НАСИЧЕНІ СПИРТИ (ГЛІКОЛІ АБО АЛКАНДІОЛИ) Двоатомні насичені спирти або гліколі — це спирти з двома гідроксильними групами при різних вуглецевих атомах. • За систематичною замісниковою номенклатурою для утворення назви гліколя до назви відповідного алкану додають закінчення -діол і вказують місце груп ОН в головному ланцюзі. За радикало-функціональною номенклатурою назви діолів утворюють додаючи до назви відповідного двохвалентного радикала, що зв’язаний з двома ОН-групами, суфіксу — гліколь. • Слід відзначити, що гліколі з двома ОН-групами при одному атомі вуглецю не існують тому, що такі продукти одразу втрачають воду і перетворюються в альдегіди або кетони. Î Í C H 3 C H H 2 OC H 3 C Î H Î Í
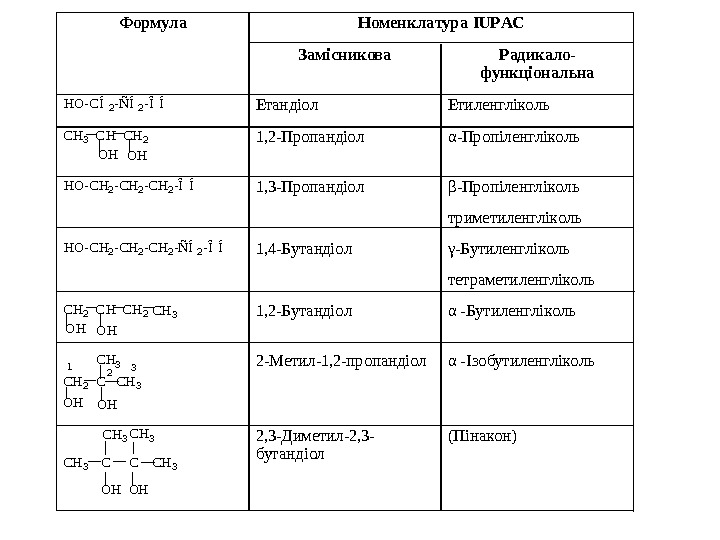
 Формула Номенклатура IUPAC Замісникова Радикало- функціональна HO-CÍ2 -ÑÍ2 -ÎÍ Етандіол Етиленгліколь ОН СН 3 СН 2 С Н ОН 1, 2 -Пропандіол α-Пропіленгліколь HO-CH 2 -CH 2 -ÎÍ 1, 3 -Пропандіол β-Пропіленгліколь триметиленгліколь HO-CH 2 -CH 2 -ÑÍ2 -ÎÍ 1, 4 -Бутандіол γ-Бутиленгліколь тетраметиленгліколь ОН НССН 2 ОН CH 3 1, 2 -Бутандіол α -Бутиленгліколь СН 3231 CH 2 C CH 3 ОНОН 2 -Метил-1, 2 -пропандіол α -Ізобутиленгліколь СН 3 CH 3 C С CH 3 ОНОН 2, 3 -Диметил-2, 3 — бутандіол (Пінакон)
Формула Номенклатура IUPAC Замісникова Радикало- функціональна HO-CÍ2 -ÑÍ2 -ÎÍ Етандіол Етиленгліколь ОН СН 3 СН 2 С Н ОН 1, 2 -Пропандіол α-Пропіленгліколь HO-CH 2 -CH 2 -ÎÍ 1, 3 -Пропандіол β-Пропіленгліколь триметиленгліколь HO-CH 2 -CH 2 -ÑÍ2 -ÎÍ 1, 4 -Бутандіол γ-Бутиленгліколь тетраметиленгліколь ОН НССН 2 ОН CH 3 1, 2 -Бутандіол α -Бутиленгліколь СН 3231 CH 2 C CH 3 ОНОН 2 -Метил-1, 2 -пропандіол α -Ізобутиленгліколь СН 3 CH 3 C С CH 3 ОНОН 2, 3 -Диметил-2, 3 — бутандіол (Пінакон)
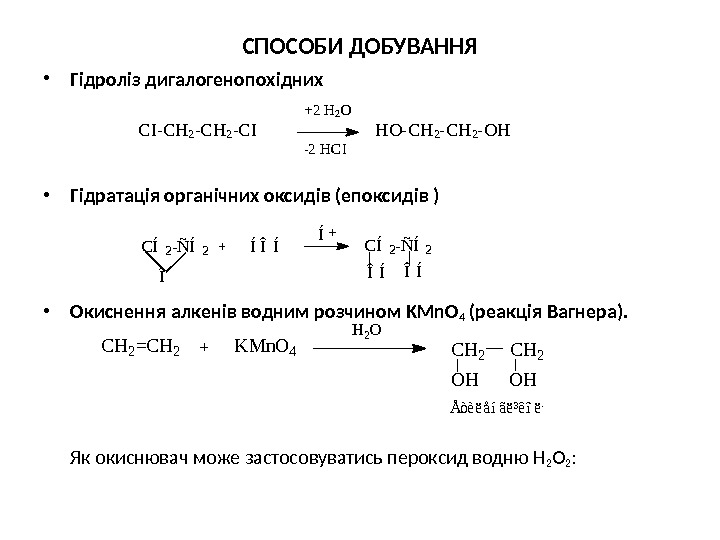
 СПОСОБИ ДОБУВАННЯ • Гідроліз дигалогенопохідних • Гідратація органічних оксидів (епоксидів ) • Окиснення алкенів водним розчином KMn. O 4 ( р еакція Вагнера). Як окиснювач може застосовуватись пероксид водню Н 2 О 2 : + 2 Н 2 О СІ — СН 2 — СІ НО — СН 2 — ОН — 2 НСІ Í CÍ 2 -ÑÍ 2 ÎÍÎÍ C H 2 = C H 2 K M n O 4 H 2 O C H 2 O H Å ò è ë å í ã ë ³ ê î ë ü
СПОСОБИ ДОБУВАННЯ • Гідроліз дигалогенопохідних • Гідратація органічних оксидів (епоксидів ) • Окиснення алкенів водним розчином KMn. O 4 ( р еакція Вагнера). Як окиснювач може застосовуватись пероксид водню Н 2 О 2 : + 2 Н 2 О СІ — СН 2 — СІ НО — СН 2 — ОН — 2 НСІ Í CÍ 2 -ÑÍ 2 ÎÍÎÍ C H 2 = C H 2 K M n O 4 H 2 O C H 2 O H Å ò è ë å í ã ë ³ ê î ë ü
 ФІЗИЧНІ ВЛАСТИВОСТІ • Гліколі мають більшу в’язкість і киплять при вищих температурах, ніж одно атомні спирти з тим же числом вуглецевих атомів, внаслідок наявності досить сильних водневих зв’язків. Вони краще розчиняються у воді, ніж одноатомні спирти.
ФІЗИЧНІ ВЛАСТИВОСТІ • Гліколі мають більшу в’язкість і киплять при вищих температурах, ніж одно атомні спирти з тим же числом вуглецевих атомів, внаслідок наявності досить сильних водневих зв’язків. Вони краще розчиняються у воді, ніж одноатомні спирти.
 ХІМІЧНІ ВЛАСТИВОСТІ За своїми хімічними властивостями вони аналогічні одноатомним спиртам. Однак, наявність двох гідроксильних груп надає їм ряд специфічних властивостей. • Кислотні властивості гліколів Завдяки наявності другої ОН-групи, що проявляє -І-ефект, кислотність гліколів вища, ніж одноатомних спиртів (особливо гліколів з гідроксильними групами при сусідніх атомах вуглецю). Такі гліколі, на відміну від спиртів, вже здатні реагувати з гідроксидами лужних металів утворюючи відповідні гліколяти. Ñ Í 2 Î Í Í à ò ð ³ é ã ³ ä ð î ã å í ã ë ³ ê î ë ÿ òN a O H H 2 OÑ Í 2 Î N a Ñ Í 2 Î Í Ñ Í 2 Î N a Í à ò ð ³ é ã ë ³ ê î ë ÿ ò
ХІМІЧНІ ВЛАСТИВОСТІ За своїми хімічними властивостями вони аналогічні одноатомним спиртам. Однак, наявність двох гідроксильних груп надає їм ряд специфічних властивостей. • Кислотні властивості гліколів Завдяки наявності другої ОН-групи, що проявляє -І-ефект, кислотність гліколів вища, ніж одноатомних спиртів (особливо гліколів з гідроксильними групами при сусідніх атомах вуглецю). Такі гліколі, на відміну від спиртів, вже здатні реагувати з гідроксидами лужних металів утворюючи відповідні гліколяти. Ñ Í 2 Î Í Í à ò ð ³ é ã ³ ä ð î ã å í ã ë ³ ê î ë ÿ òN a O H H 2 OÑ Í 2 Î N a Ñ Í 2 Î Í Ñ Í 2 Î N a Í à ò ð ³ é ã ë ³ ê î ë ÿ ò
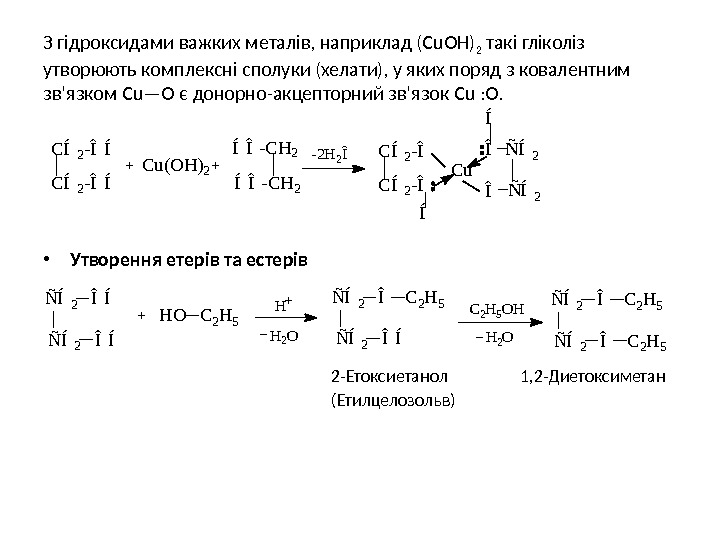
 З гідроксидами важких металів, наприклад (С u ОН) 2 такі гліколіз утворюють комплексні сполуки (хелати), у яких поряд з ковалентним зв’язком С u —О є донорно-акцепторний зв’язок С u : О. • Утворення етерів та естерів 2 -Етоксиетанол 1, 2 -Диетоксиметан (Етилцелозольв) Í Í Î — C H 2 — 2 H 2 Î C u ( O H ) 2 Ñ Í 2 Í Î — C H 2 C Í 2 — Î Í C Í 2 — Î Í C u Î Î Ñ Í 2 Ñ Í2 Î Í Ñ Í 2 Î Í H O C 2 H 5 H H 2 O Ñ Í 2 Î C 2 H 5 Ñ Í 2 Î Í C 2 H 5 O H H 2 O Ñ Í 2 Î C 2 H
З гідроксидами важких металів, наприклад (С u ОН) 2 такі гліколіз утворюють комплексні сполуки (хелати), у яких поряд з ковалентним зв’язком С u —О є донорно-акцепторний зв’язок С u : О. • Утворення етерів та естерів 2 -Етоксиетанол 1, 2 -Диетоксиметан (Етилцелозольв) Í Í Î — C H 2 — 2 H 2 Î C u ( O H ) 2 Ñ Í 2 Í Î — C H 2 C Í 2 — Î Í C Í 2 — Î Í C u Î Î Ñ Í 2 Ñ Í2 Î Í Ñ Í 2 Î Í H O C 2 H 5 H H 2 O Ñ Í 2 Î C 2 H 5 Ñ Í 2 Î Í C 2 H 5 O H H 2 O Ñ Í 2 Î C 2 H
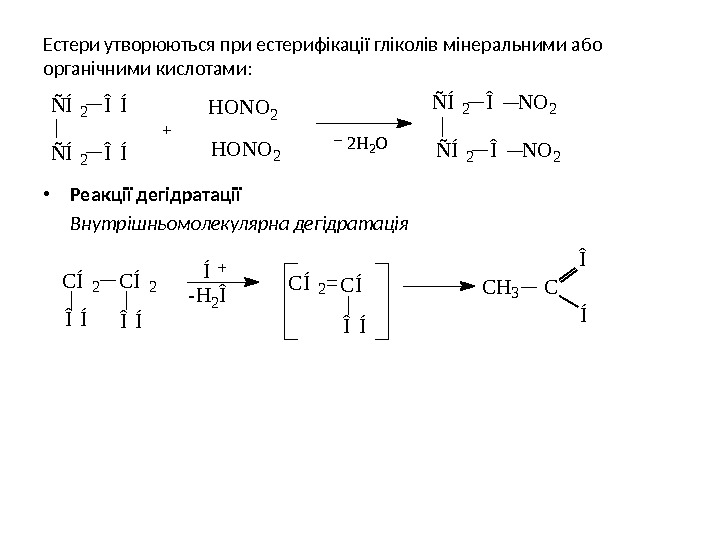
 Естери утворюються при естерифікації гліколів мінеральними або органічними кислотами: • Реакції дегідратації Внутрішньомолекулярна дегідратація H 2 O Ñ Í 2 Î N O 2Ñ Í 2 Î Í H O N O 2 2 Í Î Í C H 3 C Î ÍC Í 2 Î Í — H 2 Î Î ÍC Í 2 = C Í
Естери утворюються при естерифікації гліколів мінеральними або органічними кислотами: • Реакції дегідратації Внутрішньомолекулярна дегідратація H 2 O Ñ Í 2 Î N O 2Ñ Í 2 Î Í H O N O 2 2 Í Î Í C H 3 C Î ÍC Í 2 Î Í — H 2 Î Î ÍC Í 2 = C Í
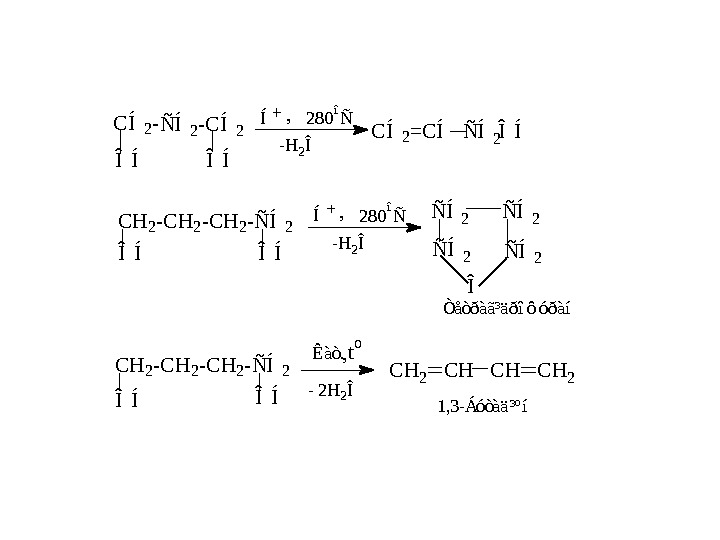
 1 , 3 — Á ó ò à ä ³ º íÊ à ò. Î Í C H 2 — Ñ Í 2 Î ÍÎ Í Ñ Í 2 Í — H 2 Î Î Í Ñ Í 2 — C Í 2 — Î Í , 2 8 0 î Ñ C Í 2 = C Í Ñ Í 2Ñ Í 2 Î Ò å ò ð à ã ³ ä ð î ô ó ð à í 2 8 0 î Ñ, — H 2 Î Í — 2 H 2 Î C H 2 C H 2 Î ÍC H 2 — Ñ Í 2 t o ,
1 , 3 — Á ó ò à ä ³ º íÊ à ò. Î Í C H 2 — Ñ Í 2 Î ÍÎ Í Ñ Í 2 Í — H 2 Î Î Í Ñ Í 2 — C Í 2 — Î Í , 2 8 0 î Ñ C Í 2 = C Í Ñ Í 2Ñ Í 2 Î Ò å ò ð à ã ³ ä ð î ô ó ð à í 2 8 0 î Ñ, — H 2 Î Í — 2 H 2 Î C H 2 C H 2 Î ÍC H 2 — Ñ Í 2 t o ,
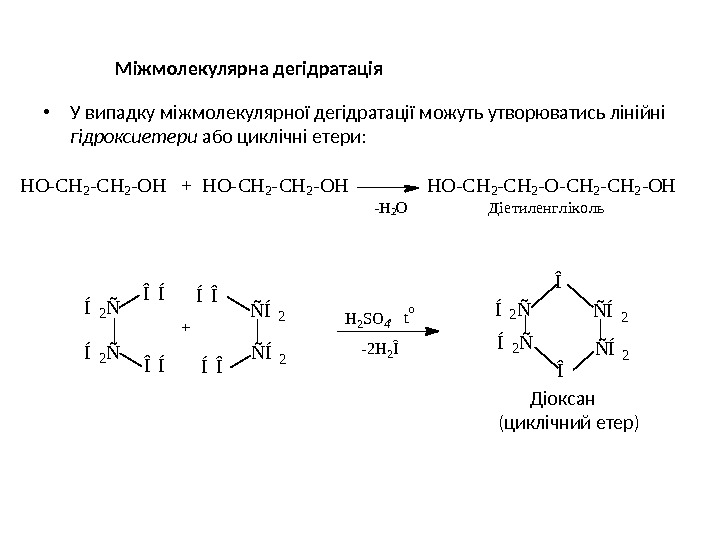
 Міжмолекулярна дегідратація • У випадку міжмолекулярної дегідратації можуть утворюватись лінійні гідроксиетери або циклічні етери: Діоксан (циклічний етер) НО-СН 2 -ОН + НО-СН 2 -ОН НО-СН 2 -СН 2 -ОН -Н 2 О Діетиленг лік оль — 2 H 2 ÎH 2 S O 4 t o, Î Ñ Í 2 ÎÍ 2 ÑÍ 2 Ñ Î Í Ñ Í 2Í Î
Міжмолекулярна дегідратація • У випадку міжмолекулярної дегідратації можуть утворюватись лінійні гідроксиетери або циклічні етери: Діоксан (циклічний етер) НО-СН 2 -ОН + НО-СН 2 -ОН НО-СН 2 -СН 2 -ОН -Н 2 О Діетиленг лік оль — 2 H 2 ÎH 2 S O 4 t o, Î Ñ Í 2 ÎÍ 2 ÑÍ 2 Ñ Î Í Ñ Í 2Í Î
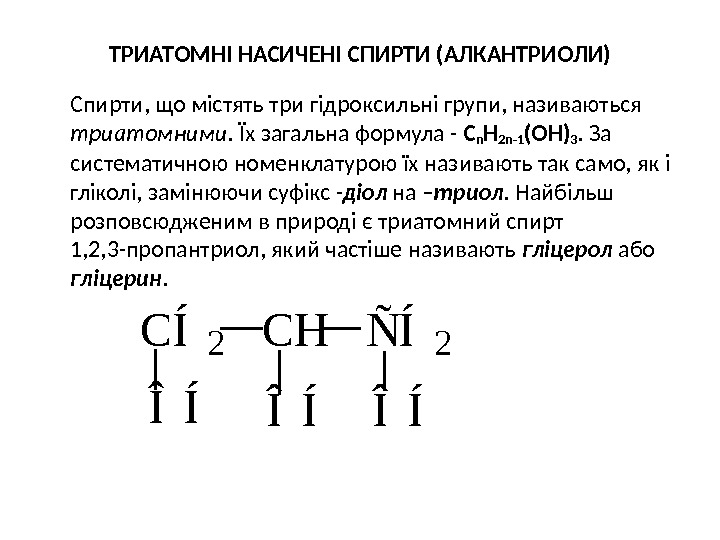
 ТРИАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНТР И ОЛИ) Спирти, що містять три гідроксильні групи, називаються триатомними. Їх загальна формула — С n Н 2 n -1 ( OH ) 3. За систематичною номенклатурою їх називають так само, як і гліколі, замінюючи суфікс — діол на – триол. Найбільш розповсюдженим в природі є триатомний спирт 1, 2, 3 -пропантриол, який частіше називають гліцерол або гліцерин. C Í 2 C H Ñ Í 2 Î Í Î Í
ТРИАТОМНІ НАСИЧЕНІ СПИРТИ (АЛКАНТР И ОЛИ) Спирти, що містять три гідроксильні групи, називаються триатомними. Їх загальна формула — С n Н 2 n -1 ( OH ) 3. За систематичною номенклатурою їх називають так само, як і гліколі, замінюючи суфікс — діол на – триол. Найбільш розповсюдженим в природі є триатомний спирт 1, 2, 3 -пропантриол, який частіше називають гліцерол або гліцерин. C Í 2 C H Ñ Í 2 Î Í Î Í
 ОДЕРЖАННЯ ГЛІЦЕРОЛУ 1. Гідроліз рослинних і тваринних жирів Жири є естерами гліцеролу та вищих жирних кислот. Загальна формула цих кислот де ( R = C 15 C 17 ). У присутності лужних або кислотних каталізаторів протікає реакція гідролізу, яку інколи не зовсім правильно називають омиленням, тому що в такий спосіб добувають мило: Î C O R H t o Ò ð è ï à ë ü ì ³ ò à ò ã ë ³ ö å ð î ë ó Í à ò ð ³ º â à ñ ³ ë ü ï à ë ü ì ³ ò è í î â î ¿ ê è ñ ë î ò è ( ì è ë î )3 N a O H 3 ÑÑ 1 5 Í 3 1 O Î N a C H Î ÍÎ Í Î ÍC Í 2 ÑÎ Î Ñ Í 2Ñ Í 2 Î ÑÑ Î O O Ñ 1 5 Í 3 1Ñ 1 5 Í
ОДЕРЖАННЯ ГЛІЦЕРОЛУ 1. Гідроліз рослинних і тваринних жирів Жири є естерами гліцеролу та вищих жирних кислот. Загальна формула цих кислот де ( R = C 15 C 17 ). У присутності лужних або кислотних каталізаторів протікає реакція гідролізу, яку інколи не зовсім правильно називають омиленням, тому що в такий спосіб добувають мило: Î C O R H t o Ò ð è ï à ë ü ì ³ ò à ò ã ë ³ ö å ð î ë ó Í à ò ð ³ º â à ñ ³ ë ü ï à ë ü ì ³ ò è í î â î ¿ ê è ñ ë î ò è ( ì è ë î )3 N a O H 3 ÑÑ 1 5 Í 3 1 O Î N a C H Î ÍÎ Í Î ÍC Í 2 ÑÎ Î Ñ Í 2Ñ Í 2 Î ÑÑ Î O O Ñ 1 5 Í 3 1Ñ 1 5 Í
 З пропену (головний промисловий метод одержання синтетичного гліцеролу) Через алілхлорид. Інколи застосовують приєднання до алілового спирту пероксиду водню: Ñ Í 2 Ñ ² + 5 % N a O H — N a C I + H O C I ( C I 2 + H 2 O ) + H O H — H C IÀ ë ³ ë õ ë î ð è ä À ë ³ ë î â è é ñ ï è ð ò Ì î í î õ ë î ð ã ³ ä ð è í è ã ë ³ ö å ð î ë óÑ Í 2 Î Í Ñ Í C Í 2 — Ñ Í 2 Î Í Ñ ² C Í 2 — Ñ Í 2 Î ÍÎ Í C Í 2 — Ñ Í 2 Î Í Ñ ² Î ÍÊ à ò. 7 0 î Ñ Î ÍÑ Í 2 C Í 2 = C Í Î Í Ñ Í C Í 2 Î Í Í O Î Í
З пропену (головний промисловий метод одержання синтетичного гліцеролу) Через алілхлорид. Інколи застосовують приєднання до алілового спирту пероксиду водню: Ñ Í 2 Ñ ² + 5 % N a O H — N a C I + H O C I ( C I 2 + H 2 O ) + H O H — H C IÀ ë ³ ë õ ë î ð è ä À ë ³ ë î â è é ñ ï è ð ò Ì î í î õ ë î ð ã ³ ä ð è í è ã ë ³ ö å ð î ë óÑ Í 2 Î Í Ñ Í C Í 2 — Ñ Í 2 Î Í Ñ ² C Í 2 — Ñ Í 2 Î ÍÎ Í C Í 2 — Ñ Í 2 Î Í Ñ ² Î ÍÊ à ò. 7 0 î Ñ Î ÍÑ Í 2 C Í 2 = C Í Î Í Ñ Í C Í 2 Î Í Í O Î Í
 ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Гліцерол за своїми властивостями нагадує гліколі. Це в’язка висококипляча рідина. Він гігроскопічний і добре розчиняється у воді. • 1. Кислотні властивості • За кислотністю гліцерол перевищує гліколь внаслідок взаємного індуктивного впливу (-І-еф. ) трьох гідроксильних груп. Так, з гідроксидами важких металів утворюються комплексні сполуки — гліцерати : Ñ Í 2 Î Í Í 2 Î 2 2 7 0 î Ñ ³ ä í î â ë å í í ÿ À ê ð î ë å ¿ íÑ Í 3 ÍÑ ÑÑ Í 2 ÍÑ Î Í Ñ Í 2 Ñ Í ( Î Í Ñ Í 2 ( Î Í ) Ñ Í 2 Î ÍÎ 2 , Ñ u ) C u ( O H ) 2 C H Î ÍÎ Í Î ÍC Í 2 Í Í Í C H ÎÎ Î C Í 2 ( ñ è í ü î ã î ê î ë ü î ð ó )Ì ³ ä ü ã ë ³ ö å ð à ò Ñ Í 2 Í Ñ Í 2 C Í ÎC Í 2 — Î C u Î Î Ñ Í — Î Í Í Î Í 2 H 2 O
ФІЗИЧНІ ТА ХІМІЧНІ ВЛАСТИВОСТІ Гліцерол за своїми властивостями нагадує гліколі. Це в’язка висококипляча рідина. Він гігроскопічний і добре розчиняється у воді. • 1. Кислотні властивості • За кислотністю гліцерол перевищує гліколь внаслідок взаємного індуктивного впливу (-І-еф. ) трьох гідроксильних груп. Так, з гідроксидами важких металів утворюються комплексні сполуки — гліцерати : Ñ Í 2 Î Í Í 2 Î 2 2 7 0 î Ñ ³ ä í î â ë å í í ÿ À ê ð î ë å ¿ íÑ Í 3 ÍÑ ÑÑ Í 2 ÍÑ Î Í Ñ Í 2 Ñ Í ( Î Í Ñ Í 2 ( Î Í ) Ñ Í 2 Î ÍÎ 2 , Ñ u ) C u ( O H ) 2 C H Î ÍÎ Í Î ÍC Í 2 Í Í Í C H ÎÎ Î C Í 2 ( ñ è í ü î ã î ê î ë ü î ð ó )Ì ³ ä ü ã ë ³ ö å ð à ò Ñ Í 2 Í Ñ Í 2 C Í ÎC Í 2 — Î C u Î Î Ñ Í — Î Í Í Î Í 2 H 2 O
 2. Утворення естерів Практичне значення має повний естер гліцеролу та нітратної кислоти — тринітрат гліцеролу , що застосовується у виробництві вибухових речовин і ліків (1% р-н — серцеві ліки, просочена ним деревинна тирса або інфузорна глина — динаміт): Взаємодією гліцеролу з карбоновими кислотами або їх ангідридами також одержують відповідні естери : C H Î ÍÎ Í Î ÍC Í 2 3 Í Î — N O 2 O N O 2 C H C Í 2 O N O 2 Ò ð è í ³ ò ð à ò ã ë ³ ö å ð î ë ó Í Î 23 Í C H Î ÍÎ Í Î ÍC Í 2 3 Í Î Ñ Ñ Í 3 t oÎ Í Î 23 C H C Í 2 Î Ñ Ñ Í 3Î
2. Утворення естерів Практичне значення має повний естер гліцеролу та нітратної кислоти — тринітрат гліцеролу , що застосовується у виробництві вибухових речовин і ліків (1% р-н — серцеві ліки, просочена ним деревинна тирса або інфузорна глина — динаміт): Взаємодією гліцеролу з карбоновими кислотами або їх ангідридами також одержують відповідні естери : C H Î ÍÎ Í Î ÍC Í 2 3 Í Î — N O 2 O N O 2 C H C Í 2 O N O 2 Ò ð è í ³ ò ð à ò ã ë ³ ö å ð î ë ó Í Î 23 Í C H Î ÍÎ Í Î ÍC Í 2 3 Í Î Ñ Ñ Í 3 t oÎ Í Î 23 C H C Í 2 Î Ñ Ñ Í 3Î
 3. Дегідратація гліцеролу У присутності водовідщеплюючих засобів або каталізаторів при нагріванні протікає реакція дегідратації гліцеролу: Гліцерол використовується в виробництві пластичних мас нітрогліцерину в текстильній промисловості , в шкіропереробній галузі , – при виправці шкір і наданні їм мякості ; в харчовій промисловості та при виробництві парфюмерно — косметичних засобів. t î Í + Î ÑC Í 2 = H C Í, — 2 Í 2 Î C H Î Í Î ÍC Í 2 Î ÍÑC Í 2 = H
3. Дегідратація гліцеролу У присутності водовідщеплюючих засобів або каталізаторів при нагріванні протікає реакція дегідратації гліцеролу: Гліцерол використовується в виробництві пластичних мас нітрогліцерину в текстильній промисловості , в шкіропереробній галузі , – при виправці шкір і наданні їм мякості ; в харчовій промисловості та при виробництві парфюмерно — косметичних засобів. t î Í + Î ÑC Í 2 = H C Í, — 2 Í 2 Î C H Î Í Î ÍC Í 2 Î ÍÑC Í 2 = H

