Презентация Ник- среды(2012).ppt
- Количество слайдов: 37

СОЗДАНИЕ НЕОБХОДИМЫХ УСЛОВИЙ ДЛЯ РОСТА КЛЕТОК В КУЛЬТУРЕ

СХЕМА ВЫДЕЛЕНИЯ МОНОСЛОЙНЫХ КЛЕТОК ИЗ ТКАНЕЙ ВЫДЕЛЕНИЕ СТЕРИЛЬНОЙ ТКАНИ | ДИССОЦИАЦИЯ ТКАНИ (МЕХАНИЧЕСКАЯ, ФЕРМЕНТАТИВНАЯ, С ПОМОЩЬЮ ХЕЛАТИРУЮЩИХ АГЕНТОВ ЛИБО КОМБИНАЦИИ РАЗЛИЧНЫХ ОБРАБОТОК ТКАНИ) Работа в ламинар-боксе, обеспечивающим поток стерильного (обеспыленного) воздуха. | ИНАКТИВАЦИЯ ПРОТЕАЗ В ПОЛУЧЕННОЙ СУСПЕНЗИИ КЛЕТОК (ДОБАВЛЕНИЕ 5% СЫВОРОТКИ КРОВИ) И ОСВОБОЖДЕНИЕ КЛЕТОК ОТ ОСТАТКОВ ТКАНИ (ФИЛЬТРОВАНИЕ ЧЕРЕЗ НЕЙЛОНОВЫЙ ФИЛЬТР) | ОСАЖДЕНИЕ КЛЕТОК (ЦЕНТРИФУГИРОВАНИЕ – 200 g, 10 мин. ) | СУСПЕНДИРОВАНИЕ КЛЕТОК В РОСТОВОЙ СРЕДЕ (ПИТАТЕЛЬНАЯ СРЕДА + 10 -20% СЫВОРОТКИ КРОВИ) | ПОДСЧЕТ КОНЦЕНТРАЦИИ КЛЕТОК В ГЕМОЦИТОМЕТРЕ | КОЛИЧЕСТВЕННЫЙ ВЫСЕВ КЛЕТОК В СОСУД ДЛЯ КУЛЬТИВИРОВАНИЯ | КУЛЬТИВИРОВАНИЕ КЛЕТОК В СО 2 – ИНКУБАТОРЕ (370 С, 95% ВОЗДУХА, 5% СО 2 )

УСЛОВИЯ, НЕОБХОДИМЫЕ ДЛЯ РОСТА И АКТИВНОСТИ КЛЕТОК В КУЛЬТУРЕ высокое качество жизненно важных фаз: твердой (поверхность субстрата), газообразной (смесь газов) и жидкой (питательная среда). В частности: 1) СТЕРИЛЬНАЯ ПОСУДА, ОТВЕЧАЮЩАЯ ТРЕБОВАНИЯМ «ДЛЯ КЛЕТОЧНЫХ КУЛЬТУР» (стеклянная или пластиковая). 2) ИНКУБАТОР, ПОДДЕРЖИВАЮЩИЙ ВСЕ НЕОБХОДИМЫЕ ПАРАМЕТРЫ (370, 2 -5% СО 2, ПОСТ. ВЛАЖНОСТЬ). 3) РОСТОВЫЕ СРЕДЫ, ПОДДЕРЖИВАЮЩИЕ СРЕДЫ, ДИФФЕРЕНЦИРОВОЧНЫЕ СРЕДЫ.

б а а б СККМ (стромальные клетки костного мозга) крысы: первичная культура (а), 1 пассаж (логарифмическая-б и стационарная фаза роста).

РОСТОВЫЕ СРЕДЫ, ПОДДЕРЖИВАЮЩИЕ СРЕДЫ, ДИФФЕРЕНЦИРОВОЧНЫЕ СРЕДЫ. РОСТОВЫЕ(А-В), ПОДДЕРЖИВАЮЩИЕ(Б, В) СРЕДЫ: А) ПИТАТЕЛЬНАЯ СРЕДА ПОСТОЯННОГО СОСТАВА + 5 -20% СЫВОРОТКИ КРОВИ ; Б) ПИТАТЕЛЬНАЯ СРЕДА ПОСТОЯННОГО СОСТАВА + 2 -3% СЫВОРОТКИ КРОВИ + ЦИТОКИНЫ; В) БЕССЫВОРОТОЧНАЯ СРЕДА - ПИТАТЕЛЬНАЯ СРЕДА ПОСТОЯННОГО СОСТАВА + ЗАМЕНИТЕЛИ СЫВОРОТКИ КРОВИ. ДИФФЕРЕНЦИРОВОЧНЫЕ СРЕДЫ: ПИТАТЕЛЬНАЯ СРЕДА ПОСТОЯННОГО СОСТАВА + 2 -10% СЫВОРОТКИ КРОВИ + Индукторы дифференцировки

Разработки физиологических растворов Долгое время в качестве жидкой фазы использовали плазму крови, тканевые экстракты, а затем сыворотку крови. Все эти комплексные препараты стимулировали пролиферацию различных типов клеток, однако, имели нестабильный химический состав. На пути стандартизации условий культивирования обнаружили, что одним из главных условий сохранения жизнеспособности клеток является поддержание в определенных пределах концентрации водородных ионов (р. Н) и осмотического давления. Эту функцию выполняет лежащая в основе питательной среды смесь солей, дополненная углеводом в качестве источника энергии – сбалансированный солевой раствор. В основе многих питательных сред лежат растворы Эрла и Хенкса. Растворы Эрла и Хенкса, а также фосфатно-солевой буфер Дальбеко широко используются и самостоятельно (для промывания клеток и для приготовления диссоциирующих растворов).

ПИТАТЕЛЬНЫЕ СРЕДЫ А) ОСМОТИЧНОСТЬ ПИТАТЕЛЬНЫХ СРЕД Осмотическое давление раствора определяется числом молей осмотически активных частиц (ионов и неионизированных молекул) растворенных веществ на 1 кг растворителя (осмоляльность) или на 1 л раствора (осмолярность). В разбавленных водных растворах эти величины близки. Общую осмоляльность раствора (осмоль/кг) можно представить в виде суммы mixi (i=1 -n), mi – концентрация i-го растворенного вещества (моль/кг), xi – количество частиц, на которое диссоциирует его молекула, n – количество веществ. Пределы осмоляльности варьируют в зависимости от происхождения клеток. Для клеток млекопитающих - 285 40 мосмоль/кг.

р. Н, БУФЕРНАЯ СИСТЕМА Для диплоидных фибробластов человека линии WI 38 оптимальны р. Н 7. 3 0. 15, а для фибробластов из эмбриона цыпленка – 7. 12 0. 18. В большинстве сред в качестве главного компонента системы, поддерживающей р. Н, используется бикарбонатный буфер. В растворе бикарбоната осуществляется равновесие НСО 3 = СО 2 + ОН Растворы с бикарбонатным буфером можно разделить на 2 группы: с низким (Хенкса) и высоким (Эрла) содержанием бикарбоната. . Альтернативные буферные системы: Аминокислотные (например, в среде Лейбовича); Синтетические органические буферы (HEPES –соль 2, 4 оксиэтил-1 -пиридинэтансульфоновой кислоты (р. Н 7, 2 -7, 4 при 37ºС). Он обычно используется в концентрации 0, 01 -0, 03 моля.
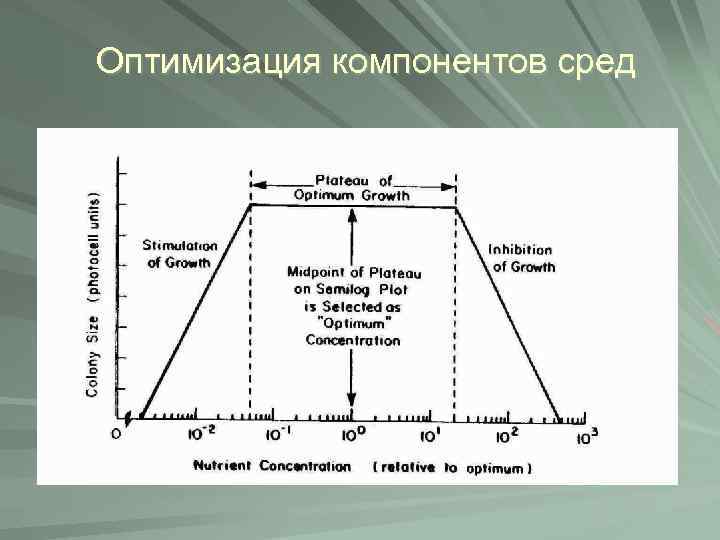
Оптимизация компонентов сред

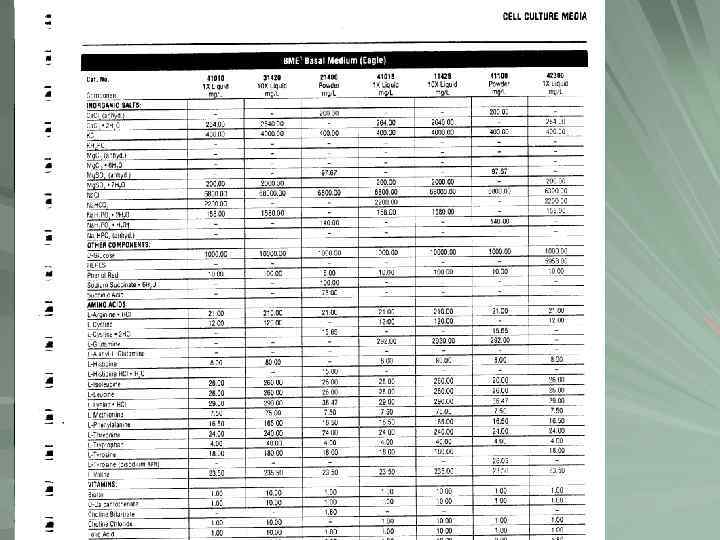
СОСТАВ ПИТАТЕЛЬНЫХ СРЕД Начиная с 1946 -47 питательные среды постоянного химического состава: Parker (1950 – 199), Eagle (1959 – MEM), Dulbecco (1959 – DMEM), а затем Ham (1963, 65 – F 10, F 12) и Kitamura (1968 – RPMI 1640). В настоящее время существует более 20 основных базовых сред, разработанных на основе указанных. Эти среды называются стандартными питательными средами. Основными компонентами сред являются аминокислоты (12 -25 наименований – н. ), витамины (8 -17 н. ), соли (6 -10 н. ), сахара (1 -3 н. ), основания нуклеиновых кислот, нуклеозиды, нуклеотиды (0 -7 н. ), а также липиды, индикатор р. Н и др. компоненты (1 -5 н. ). Одной из наиболее бедных по ассортименту компонентов является среда МЕМ (minimum essential medium) , разработанная Иглом как минимальная (28 -30 компонентов), наиболее богаты по ассортименту среды Хэма- F 10, F 12 (около 50 компонентов), а также среда 199 (60 комп. ). Большинство стандартных питательных сред основаны на бикарбонатной буферной системе. В некоторых случаях в них вводят для увеличения буферной емкости HEPES-буфер. Исключение составляет среда L 15 (Лейбовича), где буферную емкость обеспечивают аминокислоты.

Технологические особенности производства питательных сред 1. Фирмы-производители: Life Technologies-Gibco. BRL, Sigma, Serva и др. 2. Среды выпускают как стерильные сухие, так и жидкие. Срок хранения жидких сред 1 год, сухих 2 -3 года (при 40 С). 3. Возможность выпуска сухих питательных сред связана с получением тщательно обезвоженных и перемешанных в шаровой мельнице смесей всех компонентов и дальнейшей их герметичной упаковкой в атмосфере азота. Для приготовления жидких сред из таких смесей помимо сухого порошка стандартной питательной среды необходима особо чистая вода (сопротивление 18 Mg. Om), бикарбонат Na, разбавленные соляная кислота и щелочь для подведения р. Н, осмометр, р. Н-метр, установка для стерильного фильтрования сред (фирмы Millipore и других). 4. Стерилизация питательных сред, физиологических растворов, сыворотки и др. основаны на пропускании таких растворов через систему стерильных мембранных фильтров из нитроцеллюлозы с минимальным диаметром пор 0, 2 ммк. 5. Особо чистую воду получают на специальных установках, включающих активированный уголь (очистка от органических примесей), ионообменные смолы (очистка от ионов), мембранный фильтр с диаметром пор 0, 2 ммк (апирогенность). 6. Приготовленные среды проходят тесты на стерильность и все основные характеристики (р. Н, осмоляльность, влияние на жизнеспособность и пролиферацию культивируемых клеток).




СЫВОРОТКА КРОВИ Сыворотка крови - жидкая часть крови без форменных элементов и фибриногена, образующаяся в процессе свертывания крови. Сыворотка в своей основе и по своему составу сходна с плазмой, однако не содержит фибриногена и некоторых других компонентов, участвующих в свертывании крови. Количественное соотношение между белками сыворотки крови имеет диагностическое значение. Функции сыворотки при культивировании клеток: А). Обеспечивает клетки гормональными факторами, стимулирующими их рост и функции. Б). Обеспечивает клетки факторами, необходимыми для их прикрепления и распластывания. В). Обеспечивает клетки транспортными белками, переносящими гормоны, минеральные вещества, липиды и т. д.


Технологические особенности производства сыворотки крови Сыворотку получают из цельной крови в процессе формирования фибринового сгустка. Наиболее широко используют сыворотку крови плодов коров (СЭК). Аналогично питательным средам и другим растворам для культивирования клеток сыворотку стерилизуют путем фильтрования через систему стерильных мембранных фильтров из нитроцеллюлозы, помещенных в специальный фильтродержатель (Millipore, США). Приготовленные сыворотки проходят тесты на стерильность и все основные характеристики сред (р. Н, осмоляльность, влияние на жизнеспособность и пролиферацию культивируемых клеток). В настоящее время фирмы-производители (Life Technologies. Gibco. BRL, Hy Clone, Sigma, Serva) и дистрибьютеры (Биолот) сывороток тестируют их и в дальнейшем рекомендуют для культивирования определенных типов клеток: СККМ (МСК), гибридом, фибробластов.

Недостатки сыворотки 1). Для большинства клеток сыворотка не является физиологической жидкостью, с которой они контактировали в исходной ткани. 2). Сыворотка может быть цитотоксичной из-за присутствия селективных ингибиторов, бактериальных токсинов, некоторых липидов, а также ферментов типа полиаминооксидазы. 3). Активность сыворотки меняется от партии к партии. 4). Сыворотка может содержать недостаточное количество специфических для данных клеток ростовых факторов, что приводит к необходимости добавления этих факторов к культурам клеток.

БЕССЫВОРОТОЧНЫЕ СРЕДЫ. 1). Обеспечивают улучшение воспроизводимости результатов опытов вследствие большей стабильности состава среды. 2). Снижают риск заражения культуры вирусами, грибами, микоплазмой. 3). Облегчают очистку продуктов клеточного метаболизма. 4). Не содержат цитотоксических примесей.
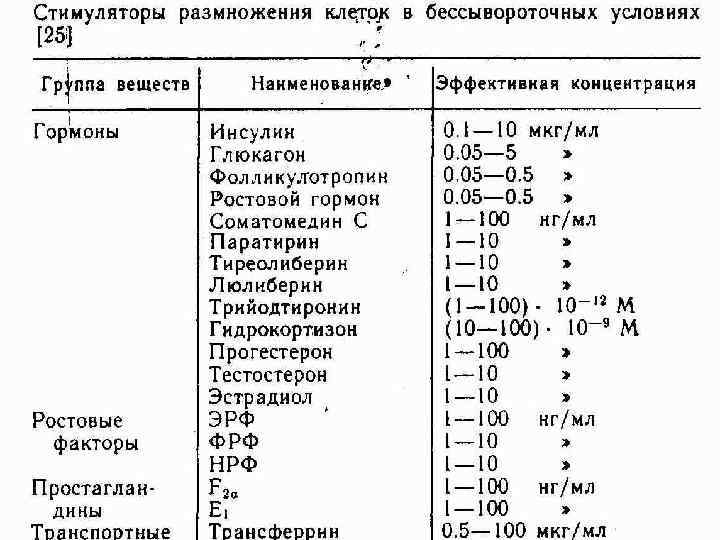

Примеры бессывороточных сред для разных типов клеток: 1). Для гибридом и миелом: среды Искова (Iskov’s: IMDM); DMEM/F 12 + ITESA (insulin, transferrin, ethanolamine, selenite, albumin); DMEM/F 12 + безбелковый стимулятор (гидрокортизон и микроэлементы). 2). Для диплоидных фибробластов человека: DMEM/199+ (ITESA, ФРЭ- фактор роста эпидермиса, дексаметазон, фибронектин, путресцин, фетуин, молибдат). 3). Для кератиноцитов человека: MCDB 104 + (IE + ФРЭ, гидрокортизон, фосфоэтаноламин).

Недостатки бессывороточных сред: 1). Бессывороточная среда пригодна только для одного типа клеток. 2). В б/с средах клетки имеют пониженную жизнеспособность. 3). При пересевах монослойных культур необходимо использовать ингибиторы пртеаз.
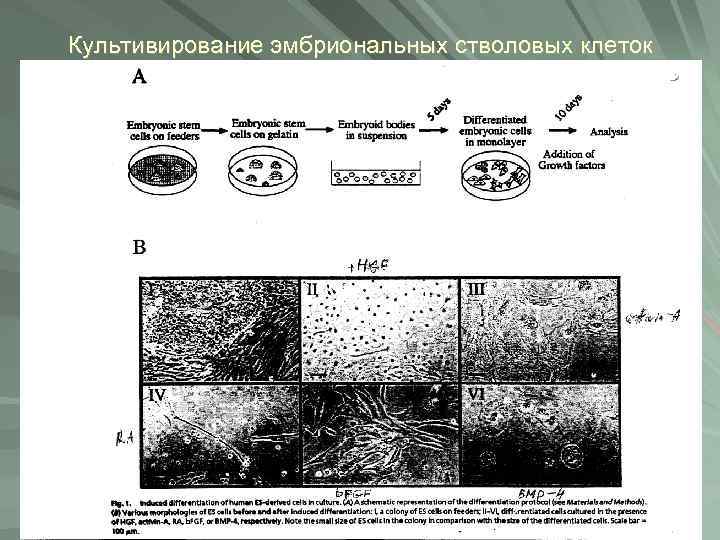
Культивирование эмбриональных стволовых клеток

Культивирование СККМ (стромальных клеток костного мозга) Среды: αMEM (2 варианта), DMEM-LG c MCDB 201 c добавочным L- глутамином (2 m. M) Сыворотка эмбрионов коров: 10 -20%; 2% - при культивировании на фибронектине с добавками EGF, PDGF, ITS и др. Количество пассажей в культуре: MSCs человека - 5 -6; 8 -10 - при плотности посева 2 -10 х10 3 клсм 2 , в среде с 10 -20%СЭК; MPCs человека - до 100 - при той же плотности в среде с 2% СЭК; MPCs крысы - до 100 - при той же плотности в среде с 2% СЭК. Формирование колоний: в первичной культуре – стабильно все типы СККМ; 2 -30 пас. - MPCs - стабильно

Адипоцитарная дифференцировка Состав индуцирующей среды: αМЕМ лошадиная сыворотка (10%) гентамицин (50 мкг/мл) дексаметазон (10 н. М) аскорбиновая кислота (50 мкг/мл) ITS + LA-BSA Обработка индуктором в течение 2 недель. Смена среды каждые 3 -4 дня.

а б СККМ крысы, адипоцитарная дифференцировка: а – первичная культура, б – 3 -й пассаж, окраска жировым красным.

Хондрогенная дифференцировка Состав индуцирующей среды DMEM - HG 10 -7 М дексаметазона 50 мкг/мл аскорбата натрия 1 х ITS (раствор, включающий инсулин, трансферрин, селенит натрия), 1 х LA-BSA (раствор, содержащий линолиевую кислоту и бычий сывороточный альбумин) TGFβ 3 (5 ng/ml), пируват Na (110 мг/мл). Обработка индуктором в течение 2 -3 недель. Смена среды каждые 3 -4 дня.
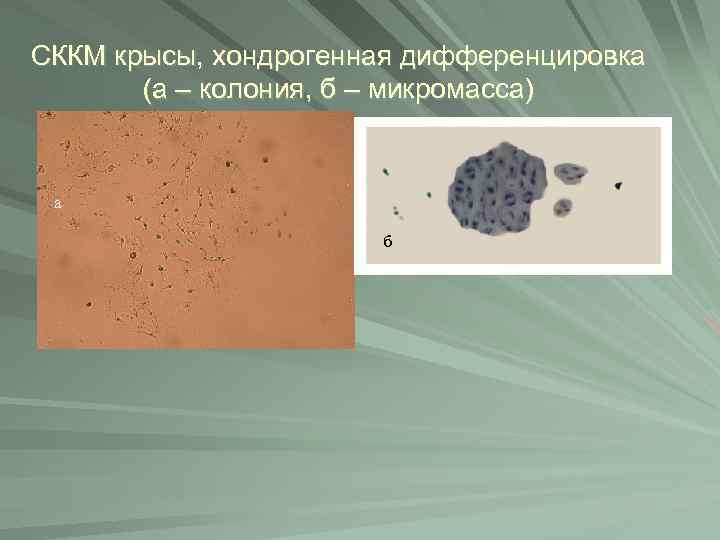
СККМ крысы, хондрогенная дифференцировка (а – колония, б – микромасса) а б

Морфология недифференцированных (а) и предифференцированных в течение 10 суток в дифференцировочных средах (б-г) СККМ кролика 4 пассажа. Окраска: а – по Романовскому (недифференцированные клетки различной формы); б – жировым красным (выявлены капли нейтральных липидов в адипоцитах); в – смесью BCIP/NBT (выявляна щелочная фосфатаза в межклеточном пространстве и цитоплазме остеобластов); г – толуидиновым синим (выявлены сульфатированные протеогликаны в межклеточном пространстве и цитоплазме хондробластов) а б в г

Оптимизация культивирования клеток Культуральная среда играет ключевую роль при выделении и выращивании клеток. Конструирование ткане-инженерных эквивалентов с целью их использования в регенеративной медицине требует разработки новых подходов к оптимизации культивирования клеток в 3 D- матрицах. В этом случае помимо среды ключевую роль в культивировании клеток играет матрица. Кроме того, для успешного культивирования клеток помимо среды, стерильности и определенной температуры важны еще 2 фазы in vitro: твердая (подложка культурального сосуда), газообразная (смесь воздуха и СО 2). Оптимизация условий и технологий культивирования создает возможность выращивания большого количества клетокпродуцентов.
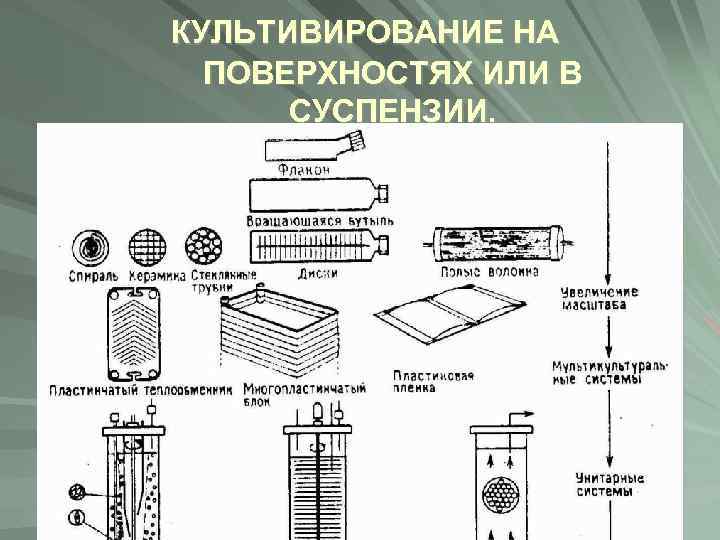
КУЛЬТИВИРОВАНИЕ НА ПОВЕРХНОСТЯХ ИЛИ В СУСПЕНЗИИ.

КРУПНОМАСШТАБНОЕ КУЛЬТИВИРОВАНИЕ. ПОДДЕРЖАНИЕ СТАБИЛЬНЫХ УСЛОВИЙ КУЛЬТИВИРОВАНИЯ. Ферментеры для клеток-продуцентов (гибридомы) с автоматическими системами контроля жизнеобеспечения клеток.
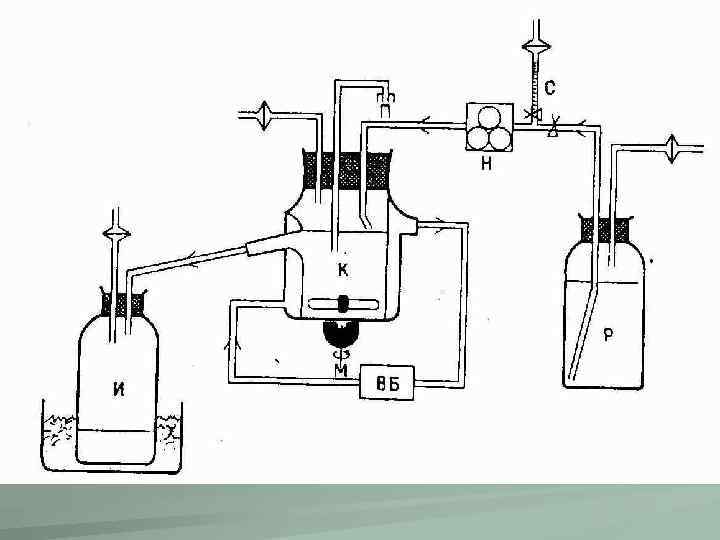

Культивирование клеток в объемных матрицах Для дальнейшего усовершенствования условий жизнедеятельности клеток in vitro и приближения их к условиям in vivo были разработаны новые поверхности для культивирования клеток (например, покрытые белком адгезии фибронектином). Кроме того, были начаты работы по созданию 3 D-матриц из различных полимеров. Это направление особенно важно для разработки биоинженерных имплантатов, состоящих из культивируемых клеток и объемного матрикса-носителя. Например, в Отделе клеточных культур Института цитологии РАН были созданы дермальные эквиваленты из коллагенового геля с внесенными в него фибробластами кожи, которые успешно применяют при лечении трофических язв, а также имплантаты из деминерализованной костной ткани (ДКТ), коллагенового геля и СККМ, которые могут быть использованы в лечении сложных нарушений костной ткани.

Выводы 1. Для роста и активности клеток в культуре необходимо высокое качество жизненно важных фаз: твердой (поверхность субстрата), газообразной (смесь газов) и жидкой (среда). 2. Среды для культивирования клеток выбирают или разрабатывают согласно поставленным задачам и типу культивируемых клеток. 3. Основные типы сред: ростовые, поддерживающие, транспортные и дифференцировочные. 4. Основные составляющие большинства сред: питательная среда постоянного состава и сыворотка крови. 5. В бессывороточных средах вместо сыворотки используют смеси, включающие факторы адгезии, митогены, транспортные белки, липиды и др. 6. Выбор среды зависит от типа клеток и задачи исследования. 7. Необходимо учитывать, что в процессе культивирования происходят изменения как самих клеток, так и среды культивирования, которую клетки обогащают продуктами жизнедеятельности. Среда становится кондиционированной. При создании ткане-инженерных эквивалентов с целью их использования в регенеративной медицине необходима разработка культивирования клеток в 3 Dматрицах. В этом случае помимо среды ключевую роль в культивировании клеток играет такая матрица.

СПИСОК ЛИТЕРАТУРЫ: 1)Р. Фрешни - «Культура животных клеток. Методы» - Москва, Мир, 1989 г. 2)Сб. «Методы культивирования клеток» (отв. ред. Г. П. Пинаев) – Ленинград, Наука, 1988. 3)”Nutritional requirements of cultured cells” (ed. H. Katsuta) – Tokio Univ. Press, 1978. 4) Methods in Enzymology, v. LVIII – Academic Press, New York, S. Francisco, London, 1979 5) Catalogue “Cell Culture” of LIFE TECHNOLOGIES (Gibco. BRL) – INVITROGEN. 6) Сб. «Методы культивирования клеток» (под ред. Г. П. Пинаева, М. С. Богдановой) – СПб, изд Политехн. Ун-та, 2008
Презентация Ник- среды(2012).ppt