01 - Классификация и виды катализа.pptx
- Количество слайдов: 34
 Современный катализ
Современный катализ
 Цель дисциплины – изучение основ теории катализа, основных закономерностей каталитических процессов применительно к современным химическим технологиям, а также формирование знаний и умений, позволяющих проводить экспериментальные исследования каталитических процессов.
Цель дисциплины – изучение основ теории катализа, основных закономерностей каталитических процессов применительно к современным химическим технологиям, а также формирование знаний и умений, позволяющих проводить экспериментальные исследования каталитических процессов.
 Задачи дисциплины - формирование знаний и представлений о закономерностях каталитических процессов; - формирование умения экспериментального и теоретического исследования кинетики каталитических реакций; - формирование навыков математического анализа и моделирования каталитических процессов.
Задачи дисциплины - формирование знаний и представлений о закономерностях каталитических процессов; - формирование умения экспериментального и теоретического исследования кинетики каталитических реакций; - формирование навыков математического анализа и моделирования каталитических процессов.
 Рекомендуемая литература 1. Куликов М. А. Катализ и каталитические процессы. – Пермь: Березниковский филиал Перм. нац. исслед. политехн. ун-та, 2013. – 328 с. 2. Куликов М. А. Катализ и каталитические процессы: учеб. -метод. пособие. – Пермь: Березниковский филиал Перм. нац. исслед. политехн. унта, 2013. – 51 с. 3. Чоркендорф И. Современный катализ и химическая кинетика: научное издание. – Долгопрудный: Издательский дом «Интеллект» , 2010. – 504 с. 4. Колесников И. М. Катализ и производство катализаторов. – М. : «Техника» , ТУМА ГРУПП, 2004. – 400 с. 5. Промышленный катализ в лекциях / под ред. А. С. Носкова. – М. : Калвис, 2005. – 136 с.
Рекомендуемая литература 1. Куликов М. А. Катализ и каталитические процессы. – Пермь: Березниковский филиал Перм. нац. исслед. политехн. ун-та, 2013. – 328 с. 2. Куликов М. А. Катализ и каталитические процессы: учеб. -метод. пособие. – Пермь: Березниковский филиал Перм. нац. исслед. политехн. унта, 2013. – 51 с. 3. Чоркендорф И. Современный катализ и химическая кинетика: научное издание. – Долгопрудный: Издательский дом «Интеллект» , 2010. – 504 с. 4. Колесников И. М. Катализ и производство катализаторов. – М. : «Техника» , ТУМА ГРУПП, 2004. – 400 с. 5. Промышленный катализ в лекциях / под ред. А. С. Носкова. – М. : Калвис, 2005. – 136 с.
 Направления развития катализа Ø Ø Ø теоретические (кинетические, термодинамические, квантовохимические) исследования механизмов катализа и активных центров катализаторов; гомогенный и гетерогенный катализ с помощью высокоорганизованных наносистем, в первую очередь безлигандными и молекулярными кластерами металлов, а также катализ гетерогенизированными на поверхности носителей кластерами и комплексами переходных и постпереходных металлов; катализ в малотоннажной химии, включая реакции гидроформилирования, гидрирования, алкилирования, гидроконденсации;
Направления развития катализа Ø Ø Ø теоретические (кинетические, термодинамические, квантовохимические) исследования механизмов катализа и активных центров катализаторов; гомогенный и гетерогенный катализ с помощью высокоорганизованных наносистем, в первую очередь безлигандными и молекулярными кластерами металлов, а также катализ гетерогенизированными на поверхности носителей кластерами и комплексами переходных и постпереходных металлов; катализ в малотоннажной химии, включая реакции гидроформилирования, гидрирования, алкилирования, гидроконденсации;
 Направления развития катализа Ø Ø Ø новые технологии в нефтеперерабатывающей и нефтехимической промышленности (высокоселективные, малоотходные, малотоннажные, гибкие); новые методы приготовления, активации и регенерации катализаторов; селективное окисление органических и биоорганических субстратов (материалов) и их антиокислительная стабилизация;
Направления развития катализа Ø Ø Ø новые технологии в нефтеперерабатывающей и нефтехимической промышленности (высокоселективные, малоотходные, малотоннажные, гибкие); новые методы приготовления, активации и регенерации катализаторов; селективное окисление органических и биоорганических субстратов (материалов) и их антиокислительная стабилизация;
 Направления развития катализа Ø Ø Ø удаление токсичных отходов, очистка отходящих газов и воды от токсичных примесей; ферментативные процессы; катализ и топливо будущего (новые компоненты дизельных топлив, бензинов).
Направления развития катализа Ø Ø Ø удаление токсичных отходов, очистка отходящих газов и воды от токсичных примесей; ферментативные процессы; катализ и топливо будущего (новые компоненты дизельных топлив, бензинов).
 Классификация и виды катализа
Классификация и виды катализа
 Катализом (от греч. «katalysis» – разрушение) на- зывают изменение скорости или возбуждение химической реакции при воздействии веществ – катализаторов, которые участвуют в реакции, но не входят в состав конечных продуктов. Катализатор не находится в стехиометрическом отношении с продуктами и, как правило, регенерируется после каждого цикла превращений реагентов в продукты.
Катализом (от греч. «katalysis» – разрушение) на- зывают изменение скорости или возбуждение химической реакции при воздействии веществ – катализаторов, которые участвуют в реакции, но не входят в состав конечных продуктов. Катализатор не находится в стехиометрическом отношении с продуктами и, как правило, регенерируется после каждого цикла превращений реагентов в продукты.
 Существуют также определения катализа, включающие в себя дополнительные указания: 1) на химическую неизменяемость катализатора во время реакции, 2) на химический характер промежуточного взаимодействия реагентов с катализатором, 3) на многократность этого взаимодействия.
Существуют также определения катализа, включающие в себя дополнительные указания: 1) на химическую неизменяемость катализатора во время реакции, 2) на химический характер промежуточного взаимодействия реагентов с катализатором, 3) на многократность этого взаимодействия.
 Различают положительный катализ, когда катализатор ускоряет реакцию, и отрицательный, когда катализатор замедляет реакцию. Явление ускорения реакции при воздействии продукта реакции или одного из промежуточных веществ называют автокатализом.
Различают положительный катализ, когда катализатор ускоряет реакцию, и отрицательный, когда катализатор замедляет реакцию. Явление ускорения реакции при воздействии продукта реакции или одного из промежуточных веществ называют автокатализом.
 Если катализатор и реагирующие вещества находятся в одной и той же фазе (в большинстве случаев жидкой), катализ называют гомогенным. В этом случае катализатор равномерно распределен по реакционному объему в атомно- или молекулярно-дисперсном состоянии. Если катализатор и реагирующие вещества находятся в разных фазах, между которыми имеется граница раздела, катализ называют гетерогенным. Наиболее распространен случай, когда твердый катализатор ускоряет реакцию между газами или реакцию в растворе.
Если катализатор и реагирующие вещества находятся в одной и той же фазе (в большинстве случаев жидкой), катализ называют гомогенным. В этом случае катализатор равномерно распределен по реакционному объему в атомно- или молекулярно-дисперсном состоянии. Если катализатор и реагирующие вещества находятся в разных фазах, между которыми имеется граница раздела, катализ называют гетерогенным. Наиболее распространен случай, когда твердый катализатор ускоряет реакцию между газами или реакцию в растворе.
 Микрогетерогенный катализ коллоидными или полимерными частицами занимает промежуточное положение. Гетерогенно-гомогенным катализом называют процессы, начинающиеся на поверхности твердого катализатора и далее продолжающиеся в газовой или жидкой фазе за счет вылета с поверхности активных промежуточных частиц. В этом случае катализатор инициирует начальное превращение реагента, а продолжение цепи происходит без его участия.
Микрогетерогенный катализ коллоидными или полимерными частицами занимает промежуточное положение. Гетерогенно-гомогенным катализом называют процессы, начинающиеся на поверхности твердого катализатора и далее продолжающиеся в газовой или жидкой фазе за счет вылета с поверхности активных промежуточных частиц. В этом случае катализатор инициирует начальное превращение реагента, а продолжение цепи происходит без его участия.
 По механизму действия катализаторов каталитические реакции можно разделить на два больших класса: окислительно-восстановительные (одноэлектронные) - процессы, связанные с переходом электронов: окисление, восстановление, гидрирование, дегидрирование, разложение кислородсодержащих соединений. Типичными катализаторами для них являются металлы и полупроводники, то есть вещества, обладающие подвижными и легко возбуждаемыми электронами.
По механизму действия катализаторов каталитические реакции можно разделить на два больших класса: окислительно-восстановительные (одноэлектронные) - процессы, связанные с переходом электронов: окисление, восстановление, гидрирование, дегидрирование, разложение кислородсодержащих соединений. Типичными катализаторами для них являются металлы и полупроводники, то есть вещества, обладающие подвижными и легко возбуждаемыми электронами.
 По механизму действия катализаторов каталитические реакции можно разделить на два больших класса: кислотно-основные (ионные) - реакции кислотно-основного взаимодействия: каталитический крекинг, гидратация, дегидратация, гидролиз, многие реакции изомеризации, полимеризации, конденсации органических веществ. Типичными катализаторами этого класса являются твердые тела, обладающие кислотными и основными свойствами.
По механизму действия катализаторов каталитические реакции можно разделить на два больших класса: кислотно-основные (ионные) - реакции кислотно-основного взаимодействия: каталитический крекинг, гидратация, дегидратация, гидролиз, многие реакции изомеризации, полимеризации, конденсации органических веществ. Типичными катализаторами этого класса являются твердые тела, обладающие кислотными и основными свойствами.
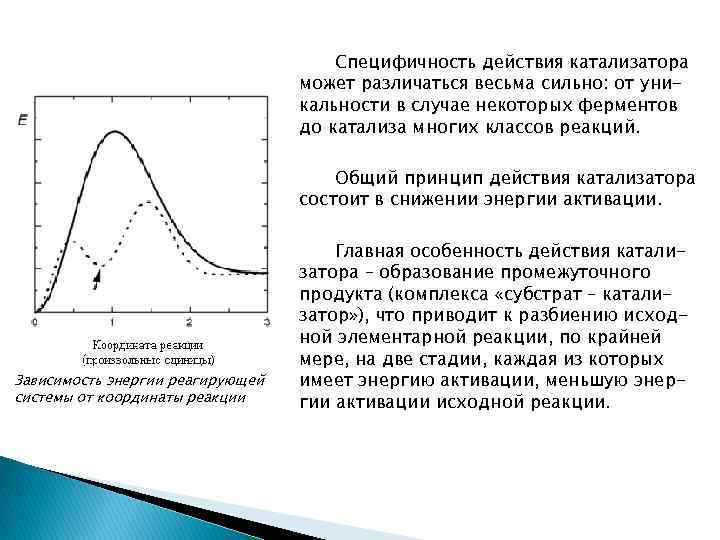 Специфичность действия катализатора может различаться весьма сильно: от уникальности в случае некоторых ферментов до катализа многих классов реакций. Общий принцип действия катализатора состоит в снижении энергии активации. Зависимость энергии реагирующей системы от координаты реакции Главная особенность действия катализатора – образование промежуточного продукта (комплекса «субстрат – катализатор» ), что приводит к разбиению исходной элементарной реакции, по крайней мере, на две стадии, каждая из которых имеет энергию активации, меньшую энергии активации исходной реакции.
Специфичность действия катализатора может различаться весьма сильно: от уникальности в случае некоторых ферментов до катализа многих классов реакций. Общий принцип действия катализатора состоит в снижении энергии активации. Зависимость энергии реагирующей системы от координаты реакции Главная особенность действия катализатора – образование промежуточного продукта (комплекса «субстрат – катализатор» ), что приводит к разбиению исходной элементарной реакции, по крайней мере, на две стадии, каждая из которых имеет энергию активации, меньшую энергии активации исходной реакции.
 История развития катализа
История развития катализа
 Основные этапы развития катализа 1 этап – с древнейших времён до XVIII века 2 этап – XVIII век – первые каталитические процессы: 1778 год – Пристли обнаружил разложение спирта на этилен и воду; 1782 год – Шееле открыл этерификацию карбоновых кислот спиртами; 1793 год – Клеман и Дезорм доказали каталитический механизм камерного процесса.
Основные этапы развития катализа 1 этап – с древнейших времён до XVIII века 2 этап – XVIII век – первые каталитические процессы: 1778 год – Пристли обнаружил разложение спирта на этилен и воду; 1782 год – Шееле открыл этерификацию карбоновых кислот спиртами; 1793 год – Клеман и Дезорм доказали каталитический механизм камерного процесса.
 Основные этапы развития катализа 3 этап – XIX век – становление теории и практики катализа 1811 год – Кирхгоф разработал способ превращения крахмала в сахар; 1822 год – Дёберейнер открыл окисление водорода на платиновой губке; 1838 год – Кюльман открыл окисление аммиака в оксиды азота на платине; 1875 год – Винклер разработал каталитический способ окисления диоксида серы.
Основные этапы развития катализа 3 этап – XIX век – становление теории и практики катализа 1811 год – Кирхгоф разработал способ превращения крахмала в сахар; 1822 год – Дёберейнер открыл окисление водорода на платиновой губке; 1838 год – Кюльман открыл окисление аммиака в оксиды азота на платине; 1875 год – Винклер разработал каталитический способ окисления диоксида серы.
 Основные этапы развития катализа 4 этап – XX век – развитие теории и практики катализа Нобелевские премии по химии: 1909 год – работы Оствальда по катализу; 1912 год – Сабатье открыл каталитические свойства никеля; 1918 год – Габер создал промышленный метод получения аммиака; 1931 год – Бош разработал аппаратуру высокого давления; 1932 год – Ленгмюр развил применение атомно-молекулярных представлений к катализу; 1956 год – Семёнов Н. Н. и Хиншелвуд С. Н. создали теорию цепных реакций.
Основные этапы развития катализа 4 этап – XX век – развитие теории и практики катализа Нобелевские премии по химии: 1909 год – работы Оствальда по катализу; 1912 год – Сабатье открыл каталитические свойства никеля; 1918 год – Габер создал промышленный метод получения аммиака; 1931 год – Бош разработал аппаратуру высокого давления; 1932 год – Ленгмюр развил применение атомно-молекулярных представлений к катализу; 1956 год – Семёнов Н. Н. и Хиншелвуд С. Н. создали теорию цепных реакций.
 Катализ в технологии неорганических веществ
Катализ в технологии неорганических веществ
 Производство серной кислоты Производство синтез-газа конверсией метана Производство соединений связанного азота Промышленный синтез метанола
Производство серной кислоты Производство синтез-газа конверсией метана Производство соединений связанного азота Промышленный синтез метанола
 Теории катализа
Теории катализа
 Теория объёмных промежуточных соединений Одна из первых теорий как гомогенного, так и гетерогенного катализа. Считается, что ускорение реакции достигается за счёт того, что каждая из стадий идёт быстрее суммарного некаталитического процесса. Положительной стороной теории является то, что она исходит из представлений о химическом характере взаимодействия катализатора с реагентами и даёт определённые указания для подбора катализаторов: их следует искать среди веществ, вступающих в реакцию с реагентами. Недостатки: образование промежуточных соединений в виде отдельной фазы теоретически не обосновано и противоречит опытным данным, игнорирование физического состояния катализатора и ряд других.
Теория объёмных промежуточных соединений Одна из первых теорий как гомогенного, так и гетерогенного катализа. Считается, что ускорение реакции достигается за счёт того, что каждая из стадий идёт быстрее суммарного некаталитического процесса. Положительной стороной теории является то, что она исходит из представлений о химическом характере взаимодействия катализатора с реагентами и даёт определённые указания для подбора катализаторов: их следует искать среди веществ, вступающих в реакцию с реагентами. Недостатки: образование промежуточных соединений в виде отдельной фазы теоретически не обосновано и противоречит опытным данным, игнорирование физического состояния катализатора и ряд других.
 Адсорбционные теории катализа Эти теории относятся к числу физических теорий катализа. Фарадей считал, что каталитическая реакция протекает в адсорбционном слое на поверхности катализатора. Он полагал, что ускорение достигается за счёт концентрирования вещества в этом слое. Причина значительного увеличения скорости реакции в при сутствиикатализатора объясняется в современных вариантах теории разрыхляющим действием катализатора на связи в реагентах. Активированные молекулы с разрыхленными связями адсорбируются легче и обладают теплотой адсорбции большей, чем молекулы исходных и образующихся веществ, то есть катализатор снижает энергию активации и тем самым ускоряет каталитическую реакцию.
Адсорбционные теории катализа Эти теории относятся к числу физических теорий катализа. Фарадей считал, что каталитическая реакция протекает в адсорбционном слое на поверхности катализатора. Он полагал, что ускорение достигается за счёт концентрирования вещества в этом слое. Причина значительного увеличения скорости реакции в при сутствиикатализатора объясняется в современных вариантах теории разрыхляющим действием катализатора на связи в реагентах. Активированные молекулы с разрыхленными связями адсорбируются легче и обладают теплотой адсорбции большей, чем молекулы исходных и образующихся веществ, то есть катализатор снижает энергию активации и тем самым ускоряет каталитическую реакцию.
 Цепная теория катализа относится к гетерогенному катализу. Причиной ускорения каталитических процессов является цепной механизм реакции, который зарождается на поверхности катализатора благодаря его радикальному характеру, при этом катализатор рассматривается как полирадикал, дающий начало цепным превращениям. А + В С K + A A + K A + B + K C + K где K – катализатор-полирадикал.
Цепная теория катализа относится к гетерогенному катализу. Причиной ускорения каталитических процессов является цепной механизм реакции, который зарождается на поверхности катализатора благодаря его радикальному характеру, при этом катализатор рассматривается как полирадикал, дающий начало цепным превращениям. А + В С K + A A + K A + B + K C + K где K – катализатор-полирадикал.
 Мультиплетная теория катализа Относится к гетерогенному катализу. В основе этой теории лежит принцип геометрического соответствия, согласно которому на поверхности катализатора можно выделить адсорбционный комплекс «мультиплет» – группы атомов, соприкасающихся с реагирующими молекулами. Чётких представлений о природе промежуточного мультиплетного комплекса нет. При структурном соответствии его рассматривают как активный комплекс, а при энергетическом соответствии – промежуточное поверхностное соединение, представляющее собой адсорбированные атомы или частицы, получающиеся при разрыве химической связи в реагентах.
Мультиплетная теория катализа Относится к гетерогенному катализу. В основе этой теории лежит принцип геометрического соответствия, согласно которому на поверхности катализатора можно выделить адсорбционный комплекс «мультиплет» – группы атомов, соприкасающихся с реагирующими молекулами. Чётких представлений о природе промежуточного мультиплетного комплекса нет. При структурном соответствии его рассматривают как активный комплекс, а при энергетическом соответствии – промежуточное поверхностное соединение, представляющее собой адсорбированные атомы или частицы, получающиеся при разрыве химической связи в реагентах.
 Мультиплетная теория катализа Важным моментом теории является одновременная адсорбция всех реагентов, образующих мультиплетный комплекс, на группе активных центров катализатора – на так называемом мультиплете. Мультиплетная теория предъявляет к катализаторам два требования, выраженные принципами структурного и энергетического соответствия. По первому принципу необходимо соответствие между параметрами кристаллической решётки катализатора и длинами рвущихся и образующихся в процессе реакции связей. По второму принципу каталитическая активность определяется не только геометрией, но и энергетикой промежуточного взаимодействия.
Мультиплетная теория катализа Важным моментом теории является одновременная адсорбция всех реагентов, образующих мультиплетный комплекс, на группе активных центров катализатора – на так называемом мультиплете. Мультиплетная теория предъявляет к катализаторам два требования, выраженные принципами структурного и энергетического соответствия. По первому принципу необходимо соответствие между параметрами кристаллической решётки катализатора и длинами рвущихся и образующихся в процессе реакции связей. По второму принципу каталитическая активность определяется не только геометрией, но и энергетикой промежуточного взаимодействия.
 Электронная теория катализа Электронная теория в основном относится к катализу на полупроводниках и даёт детальную картину каталитического процесса. Она рассматривает структуру электронных уровней в твёрдых телах, энергию отрыва электрона от поверхности и другие параметры. Эти параметры зависят не от свойств отдельного атома, а от свойств всего твёрдого тела. Современная электронная теория катализа пытается связать каталитические свойства полупроводников с работой выхода электрона, электропроводностью катализатора и другими факторами, такими как окраска твёрдых тел, ширина запрещённой зоны полупроводника и другими.
Электронная теория катализа Электронная теория в основном относится к катализу на полупроводниках и даёт детальную картину каталитического процесса. Она рассматривает структуру электронных уровней в твёрдых телах, энергию отрыва электрона от поверхности и другие параметры. Эти параметры зависят не от свойств отдельного атома, а от свойств всего твёрдого тела. Современная электронная теория катализа пытается связать каталитические свойства полупроводников с работой выхода электрона, электропроводностью катализатора и другими факторами, такими как окраска твёрдых тел, ширина запрещённой зоны полупроводника и другими.
 Электронная теория катализа В основе теории лежат четыре постулата. 1) Химическая адсорбция вещества на поверхности полупроводника протекает в двух формах: слабая и прочная адсорбции. Термин слабой и прочной адсорбции обозначает только характер связи, а не её прочность. Слабая адсорбция протекает без участия свободных электронов и дырок, а прочная адсорбция – с участием носителей тока. 2) Все формы адсорбции могут сосуществовать одновременно и находиться в равновесии.
Электронная теория катализа В основе теории лежат четыре постулата. 1) Химическая адсорбция вещества на поверхности полупроводника протекает в двух формах: слабая и прочная адсорбции. Термин слабой и прочной адсорбции обозначает только характер связи, а не её прочность. Слабая адсорбция протекает без участия свободных электронов и дырок, а прочная адсорбция – с участием носителей тока. 2) Все формы адсорбции могут сосуществовать одновременно и находиться в равновесии.
 Электронная теория катализа В основе теории лежат четыре постулата. 3) Различные формы адсорбированных частиц обладают разной реакционной способностью. Наибольшей реакционной способностью обладают радикалы и ионы, которые образуются как при слабой, так и прочной адсорбции. При адсорбции валентно ненасыщенных молекул или частиц R , R–, R+ реакционноспособные формы сохраняются при слабой адсорбции, а при адсорбции валентно насыщенных молекул – при прочной адсорбции.
Электронная теория катализа В основе теории лежат четыре постулата. 3) Различные формы адсорбированных частиц обладают разной реакционной способностью. Наибольшей реакционной способностью обладают радикалы и ионы, которые образуются как при слабой, так и прочной адсорбции. При адсорбции валентно ненасыщенных молекул или частиц R , R–, R+ реакционноспособные формы сохраняются при слабой адсорбции, а при адсорбции валентно насыщенных молекул – при прочной адсорбции.
 Электронная теория катализа В основе теории лежат четыре постулата. 4) Свободные электроны и дырки полупроводника рассматриваются как свободные валентности, которые могут блуждать по кристаллу, причём между объёмом и поверхностью полупроводника происходит непрерывный обмен валентностями. Свободные валентности принимают участие в акте адсорбции.
Электронная теория катализа В основе теории лежат четыре постулата. 4) Свободные электроны и дырки полупроводника рассматриваются как свободные валентности, которые могут блуждать по кристаллу, причём между объёмом и поверхностью полупроводника происходит непрерывный обмен валентностями. Свободные валентности принимают участие в акте адсорбции.
 Катализ на металлах Металлические катализаторы нашли применение в процессах гидрирования и дегидрирования, платформига, окисления. Чаще всего используют металлические катализаторы на носителях. Активность металлических катализаторов различна: Ø для реакций гидрирования высокой активностью обладают Pt, Pd, Ni и другие металлы; Ø Ø Ø для синтеза аммиака металлы можно расположить по убыванию активности: Ru > Fe > Co > Ni > Rh > Re > Pt; для реакций гидрогенолиза: Rh > W > Ni > Fe > Pt > Co; для реакций окисления максимальной активностью обладает платина, а селективностью – серебро.
Катализ на металлах Металлические катализаторы нашли применение в процессах гидрирования и дегидрирования, платформига, окисления. Чаще всего используют металлические катализаторы на носителях. Активность металлических катализаторов различна: Ø для реакций гидрирования высокой активностью обладают Pt, Pd, Ni и другие металлы; Ø Ø Ø для синтеза аммиака металлы можно расположить по убыванию активности: Ru > Fe > Co > Ni > Rh > Re > Pt; для реакций гидрогенолиза: Rh > W > Ni > Fe > Pt > Co; для реакций окисления максимальной активностью обладает платина, а селективностью – серебро.
 Катализ на металлах Для объяснения каталитической активности металлов используют две теории: 1) зонная теория металлов - особые свойства переходных металлов объясняются наличием d-электронов. 2) валентная теория металлов Полинга – в основе лежит экспериментальный факт о немонотонном изменении теплоты сублимации металлов от числа валентным электронов.
Катализ на металлах Для объяснения каталитической активности металлов используют две теории: 1) зонная теория металлов - особые свойства переходных металлов объясняются наличием d-электронов. 2) валентная теория металлов Полинга – в основе лежит экспериментальный факт о немонотонном изменении теплоты сублимации металлов от числа валентным электронов.


