1 I начало термодинамики.ppt
- Количество слайдов: 14

Современное определение физической химии – это наука, объясняющая химические явления и устанавливающая их общие закономерности на основе принципов физики и с использованием физических экспериментальных методов. Важнейшая проблема современной физической химии – установление связи между строением вещества и его реакционной способностью. Первый учебник по физической химии был издан Нернстом в 1893 году, он назывался “Теоретическая химия на основе правила Авогадро и термодинамики”. Основными разделами физической химии являются: - строение вещества - химическая термодинамика (сюда включаются три закона термодинамики, учение о химическом и фазовом равновесии, учение о растворах) - электрохимия - химическая кинетика и катализ

Основные понятия химической термодинамики Химическая термодинамика изучает законы взаимного превращения различных видов энергии, состояние равновесия, а также возможность, направление и предел протекания самопроизвольных процессов. Термодинамическая система – это совокупность материальных объектов, выбранных нами произвольно для изучения, которая отделена от всего окружающего (называемого внешней средой) некоторой границей (условной или реальной). Изолированная система – это система, которая не может обмениваться с окружающей средой ни веществом, ни энергией и имеет постоянный объем. Закрытая система – это система, которая не может обмениваться с окружающей средой веществом (т. е. имеет постоянную массу), но может обмениваться энергией (в форме теплоты или работы). Открытая система – это система, которая может обмениваться с окружающей средой и веществом, и энергией. Кроме того, системы могут быть гомогенными (однородными), которые состоят из одной фазы, и гетерогенными (неоднородными), состоящими из двух или более фаз.

Термодинамические параметры состояния системы – (температура, объем, давление и т. д. ) – это определенные измеряемые свойства системы, характеризующие ее состояние. Состояние системы – это совокупность термодинамических параметров системы. Различают: экстенсивные и интенсивные свойства Экстенсивные свойства, зависят от массы системы (V, m, U, H и т. д. ) и обладают аддитивностью: свойство системы равно сумме свойств ее частей. Интенсивные свойства, не зависят от массы системы (T, p, , и т. д. ). Эти свойства не суммируются, а выравниваются. 1) Равновесные и неравновесные процессы. Равновесные процессы- это процессы, проходящие через непрерывный ряд равновесных состояний. Равновесное состояние системы – состояние, не изменяющееся во времени и не требующее для своего поддержания воздействия каких-либо внешних факторов. Неравновесные процессы — это процессы, после протекания которых систему нельзя вернуть в исходное состояние без того, чтобы в ней не осталось каких-либо изменений. .

• • • 2). Обратимые и необратимые процессы. Обратимые процессы –это процессы при протекании которых система возвращается в исходное состояние без того, чтобы в окружающей среде остались какие-либо изменения. В противном случае процессы будут необратимыми. В дальнейшем часто можно считать понятия обратимого и равновесного процесса совпадающими 3). Самопроизвольные и несамопроизвольные процессы. Самопроизвольные – процессы, происходящие сами собой не требующие затраты энергии извне и приближающие систему к равновесию. Несамопроизвольные – процессы, требующие затраты энергии извне. Химическая реакция – это разновидность процесса, при котором наблюдается изменение химического состава системы. Энергия – мера способности системы совершать работу. Внутренней энергией системы называется сумма всех видов энергии, за исключением кинетической энергии системы в целом и ее потенциальной энергии положения. Полная энергия системы равна сумме ее внутренней энергии, кинетической и потенциальной энергии системы как целого.

Первый закон термодинамики Q = d. U + A Формулировки первого закона термодинамики: 1. Теплота, подводимая к системе, идет на изменение внутренней энергии (функция состояния системы) и на совершение системой работы. 2. Энергия системы постоянна. 3. Энергия не исчезает бесследно и не возникает из ничего, переход её из одного вида в другой происходит в строго эквивалентных количествах. 4. Вечный двигатель 1 первого рода невозможен. Для изолированной системы справедливо условие: U = const, d. U = 0. Формулировка первого начала термодинамики для изолированной системы: «Запас внутренней энергии в изолированной системе постоянен» .
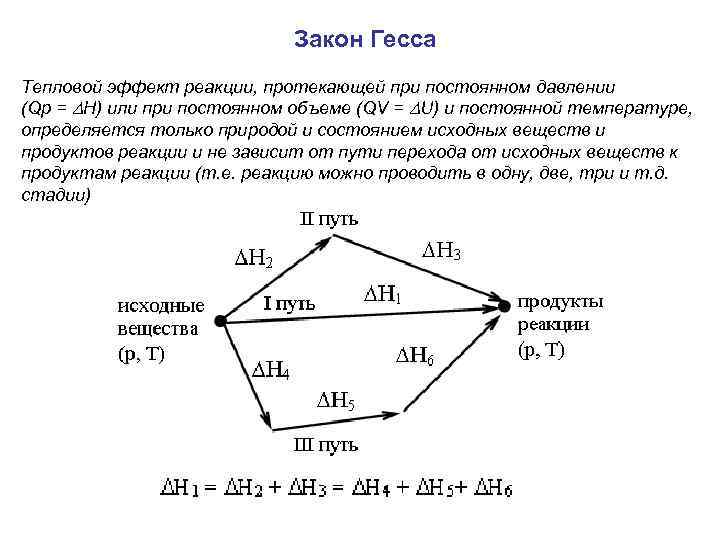
Закон Гесса Тепловой эффект реакции, протекающей при постоянном давлении (Qp = Н) или при постоянном объеме (QV = U) и постоянной температуре, определяется только природой и состоянием исходных веществ и продуктов реакции и не зависит от пути перехода от исходных веществ к продуктам реакции (т. е. реакцию можно проводить в одну, две, три и т. д. стадии)

Следствия из закона Гесса

Теплоемкость вещества Для идеальных газов справедливо уравнение Майера:

Теплоемкость газов Для одноатомных идеальных газов Для двухатомных идеальных газов и линейных многоатомных Для многоатомных

Теплоемкость твердых тел правило Дюлонга - Пти C = n(3 R) правило Неймана - Коппа С = р. С 1 + q. С 2 + … Эмпирические данные для вычисления теплоемкости элемент С Н В Si O F P S C 7, 6 9, 6 11, 3 15, 9 16, 8 21, 0 22, 6
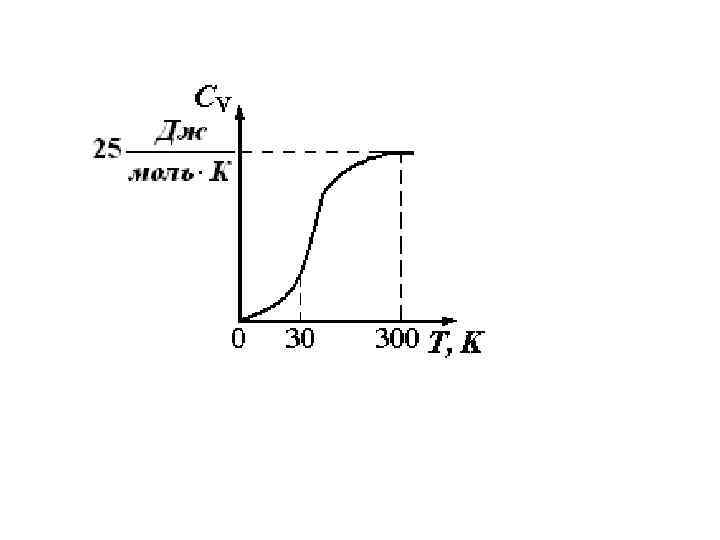

Расчет работы расширения идеального газа и теплоты в различных процессах

Зависимость теплового эффекта химической реакции от температуры. Уравнение Кирхгофа уравнение Кирхгофа
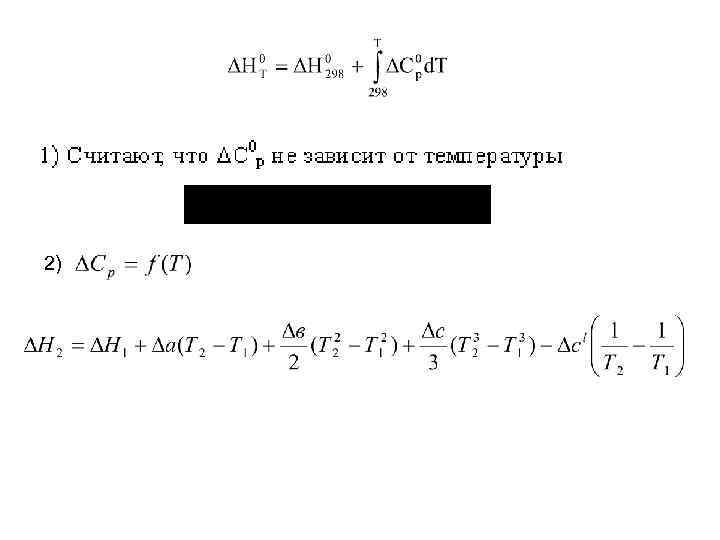
2)
1 I начало термодинамики.ppt