2012-сем-аналитич-химия.ppt
- Количество слайдов: 14
 Состав Количественная характеристика содержания компонентов Строение Совокупность связей вещества Структура Форма, размеры и характер взаимного расположения компонентов Свойства
Состав Количественная характеристика содержания компонентов Строение Совокупность связей вещества Структура Форма, размеры и характер взаимного расположения компонентов Свойства
 Изучает принципы и методы идентификации, определения состава и количества химических веществ. По тому, сколько вещества требуется для проведения анализа, различают макро- (≥ 1 г), микро- (~10 мг) и ультрамикроанализ (<1 мг). Различают качественный и количественный анализ. Для качественного обнаружения веществ используются аналитические реакции, сопровождающиеся видимым эффектом: выпадением или растворением осадка, образованием или изменением окраски, выделением газов. Каждая реакция характеризуется определенной чувствительностью – минимальным количеством вещества, которое можно обнаружить с ее помощью в определенных условиях (обычно в диапазоне 0, 2 -10 мкг).
Изучает принципы и методы идентификации, определения состава и количества химических веществ. По тому, сколько вещества требуется для проведения анализа, различают макро- (≥ 1 г), микро- (~10 мг) и ультрамикроанализ (<1 мг). Различают качественный и количественный анализ. Для качественного обнаружения веществ используются аналитические реакции, сопровождающиеся видимым эффектом: выпадением или растворением осадка, образованием или изменением окраски, выделением газов. Каждая реакция характеризуется определенной чувствительностью – минимальным количеством вещества, которое можно обнаружить с ее помощью в определенных условиях (обычно в диапазоне 0, 2 -10 мкг).
 Аналитические реакции бывают специфическими и характерными. Специфические используются для обнаружения только одного определенного вещества (иона). Напр. , крахмал – на иод. Характерные позволяют обнаружить несколько различных веществ (ионов). Напр. , ионы Cl- образуют белые осадки с ионами Ag+, Pb 2+ и др. Обесцвечивание бромной воды при контакте с органическими соединениями указывает на наличие в них кратных (двойной или тройной) связей. В случаях, когда в смеси могут присутствовать вещества, мешающие проведению анализу, их стараются связать химическим путем или производят разделение исходной смеси. К наиболее важным методам разделения веществ относятся: Перегонка Экстракция Хроматография.
Аналитические реакции бывают специфическими и характерными. Специфические используются для обнаружения только одного определенного вещества (иона). Напр. , крахмал – на иод. Характерные позволяют обнаружить несколько различных веществ (ионов). Напр. , ионы Cl- образуют белые осадки с ионами Ag+, Pb 2+ и др. Обесцвечивание бромной воды при контакте с органическими соединениями указывает на наличие в них кратных (двойной или тройной) связей. В случаях, когда в смеси могут присутствовать вещества, мешающие проведению анализу, их стараются связать химическим путем или производят разделение исходной смеси. К наиболее важным методам разделения веществ относятся: Перегонка Экстракция Хроматография.
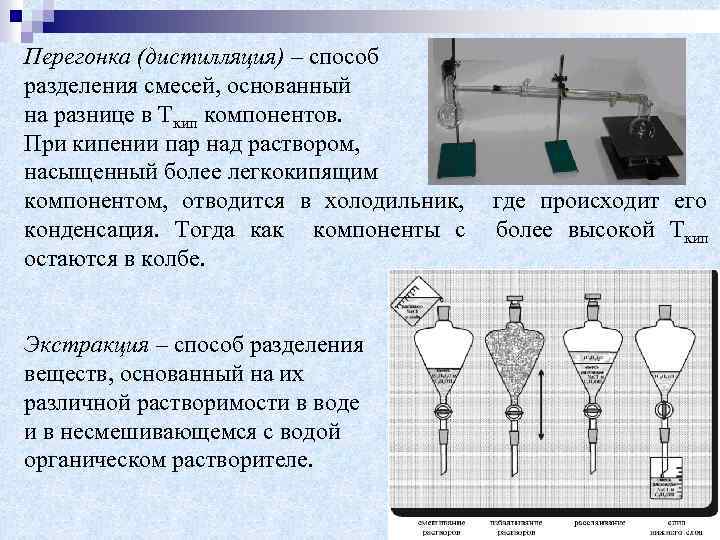 Перегонка (дистилляция) – способ разделения смесей, основанный на разнице в Ткип компонентов. При кипении пар над раствором, насыщенный более легкокипящим компонентом, отводится в холодильник, конденсация. Тогда как компоненты с остаются в колбе. Экстракция – способ разделения веществ, основанный на их различной растворимости в воде и в несмешивающемся с водой органическом растворителе. где происходит его более высокой Ткип
Перегонка (дистилляция) – способ разделения смесей, основанный на разнице в Ткип компонентов. При кипении пар над раствором, насыщенный более легкокипящим компонентом, отводится в холодильник, конденсация. Тогда как компоненты с остаются в колбе. Экстракция – способ разделения веществ, основанный на их различной растворимости в воде и в несмешивающемся с водой органическом растворителе. где происходит его более высокой Ткип
 Хроматография (от греч. цвет и пишу) – метод разделения, идентификации и количественного определения веществ, основанный на различном распределении вещества между двумя фазами (подвижной и неподвижной). Разработан в 1904 г. русским ботаником М. С. Цветом. Михаил Семенович В основе лежат процессы адсорбции и ЦВЕТ (1872– 1919) десорбции вещества. Адсорбция – повышение концентрации одного вещества у поверхности другого. Десорбция – процесс, обратный адсорбции. Хорошими адсорбционными свойствами обладают вещества с большой площадью поверхности, напр. активированный уголь, природные алюмосиликаты и т. д.
Хроматография (от греч. цвет и пишу) – метод разделения, идентификации и количественного определения веществ, основанный на различном распределении вещества между двумя фазами (подвижной и неподвижной). Разработан в 1904 г. русским ботаником М. С. Цветом. Михаил Семенович В основе лежат процессы адсорбции и ЦВЕТ (1872– 1919) десорбции вещества. Адсорбция – повышение концентрации одного вещества у поверхности другого. Десорбция – процесс, обратный адсорбции. Хорошими адсорбционными свойствами обладают вещества с большой площадью поверхности, напр. активированный уголь, природные алюмосиликаты и т. д.
 Схема хроматографического разделения. 1. В верхнюю часть колонки, наполненной адсорбентом, подают исследуемую смесь (жидкий или газовый раствор). 2. После этого через колонку с постоянной скоростью пропускают растворитель. 3. Вещества в смеси по-разному сорбируются адсорбентом, и потому одни быстрее, а другие медленнее вымываются из колонки. 4. На выходе из колонки детектор фиксирует, напр. , по изменению теплопроводности, появление того или иного компонента.
Схема хроматографического разделения. 1. В верхнюю часть колонки, наполненной адсорбентом, подают исследуемую смесь (жидкий или газовый раствор). 2. После этого через колонку с постоянной скоростью пропускают растворитель. 3. Вещества в смеси по-разному сорбируются адсорбентом, и потому одни быстрее, а другие медленнее вымываются из колонки. 4. На выходе из колонки детектор фиксирует, напр. , по изменению теплопроводности, появление того или иного компонента.
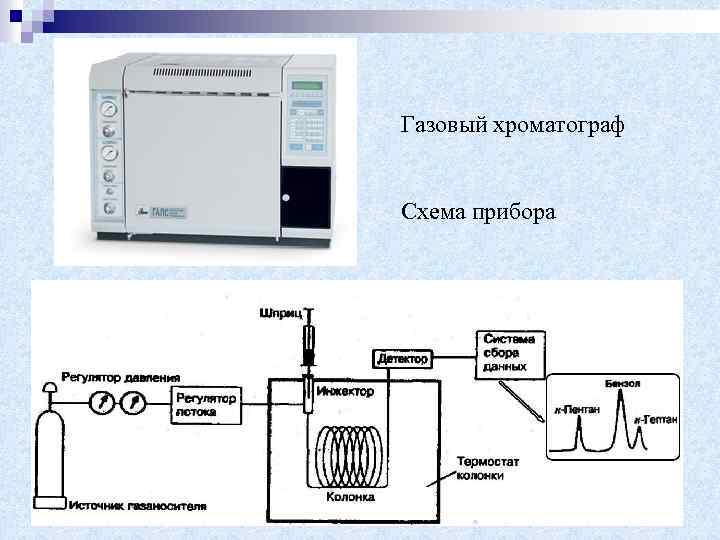 Газовый хроматограф Схема прибора
Газовый хроматограф Схема прибора
 Хроматомасс-спектрометр позволяет и разделить смесь на компоненты, и сразу определить ее состав. В детекторе алкан С 12 Н 26 с молярной массой 170 а. е. м. Под действием пучка электронов молекула распадается на ряд «осколков» с меньшей массой. В результате получается строго определенный набор ионов, характерный только для данной молекулы.
Хроматомасс-спектрометр позволяет и разделить смесь на компоненты, и сразу определить ее состав. В детекторе алкан С 12 Н 26 с молярной массой 170 а. е. м. Под действием пучка электронов молекула распадается на ряд «осколков» с меньшей массой. В результате получается строго определенный набор ионов, характерный только для данной молекулы.
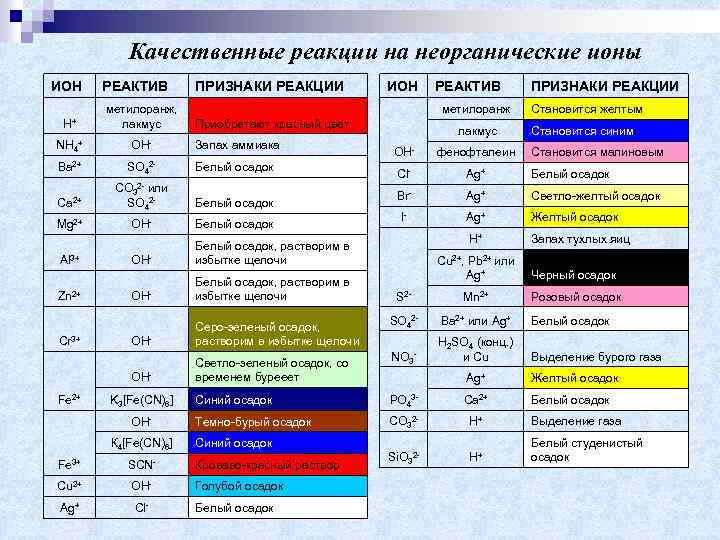 Качественные реакции на неорганические ионы ИОН РЕАКТИВ ПРИЗНАКИ РЕАКЦИИ Н+ метилоранж, лакмус Приобретают красный цвет NH 4+ OH- Запах аммиака Ba 2+ SO 42 - Белый осадок Ca 2+ Mg 2+ Al 3+ Zn 2+ Cr 3+ CO 32 - или SO 42 - Белый осадок ОНОН- Белый осадок, растворим в избытке щелочи ОН- Серо-зеленый осадок, растворим в избытке щелочи лакмус ОНК 4[Fe(CN)6] Светло-зеленый осадок, со временем бурееет ПРИЗНАКИ РЕАКЦИИ Становится желтым Становится синим OН- фенофталеин Cl- Ag+ Белый осадок Br- Ag+ Светло-желтый осадок I- Ag+ Желтый осадок Н+ Запах тухлых яиц Белый осадок, растворим в избытке щелочи K 3[Fe(CN)6] РЕАКТИВ метилоранж ОН- ОНFe 2+ ИОН Становится малиновым Cu 2+, Pb 2+ или Ag+ Черный осадок S 2 - Mn 2+ Розовый осадок SO 42 - Ba 2+ или Ag+ Белый осадок NO 3 - H 2 SO 4 (конц. ) и Cu Выделение бурого газа Ag+ Желтый осадок Белый осадок Синий осадок PO 43 - Ca 2+ Темно-бурый осадок CО 32 - Н+ Выделение газа Si. O 32 - Н+ Белый студенистый осадок Синий осадок Fe 3+ SCN- Кроваво-красный раствор Cu 2+ ОН- Голубой осадок Ag+ Cl- Белый осадок
Качественные реакции на неорганические ионы ИОН РЕАКТИВ ПРИЗНАКИ РЕАКЦИИ Н+ метилоранж, лакмус Приобретают красный цвет NH 4+ OH- Запах аммиака Ba 2+ SO 42 - Белый осадок Ca 2+ Mg 2+ Al 3+ Zn 2+ Cr 3+ CO 32 - или SO 42 - Белый осадок ОНОН- Белый осадок, растворим в избытке щелочи ОН- Серо-зеленый осадок, растворим в избытке щелочи лакмус ОНК 4[Fe(CN)6] Светло-зеленый осадок, со временем бурееет ПРИЗНАКИ РЕАКЦИИ Становится желтым Становится синим OН- фенофталеин Cl- Ag+ Белый осадок Br- Ag+ Светло-желтый осадок I- Ag+ Желтый осадок Н+ Запах тухлых яиц Белый осадок, растворим в избытке щелочи K 3[Fe(CN)6] РЕАКТИВ метилоранж ОН- ОНFe 2+ ИОН Становится малиновым Cu 2+, Pb 2+ или Ag+ Черный осадок S 2 - Mn 2+ Розовый осадок SO 42 - Ba 2+ или Ag+ Белый осадок NO 3 - H 2 SO 4 (конц. ) и Cu Выделение бурого газа Ag+ Желтый осадок Белый осадок Синий осадок PO 43 - Ca 2+ Темно-бурый осадок CО 32 - Н+ Выделение газа Si. O 32 - Н+ Белый студенистый осадок Синий осадок Fe 3+ SCN- Кроваво-красный раствор Cu 2+ ОН- Голубой осадок Ag+ Cl- Белый осадок
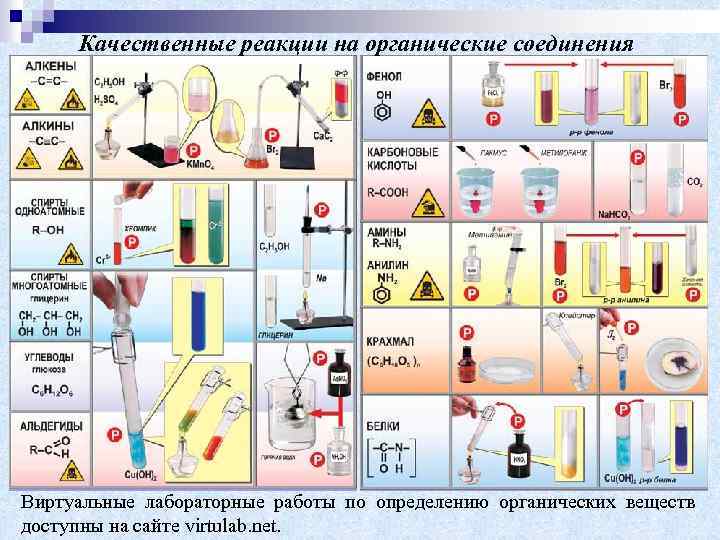 Качественные реакции на органические соединения Виртуальные лабораторные работы по определению органических веществ доступны на сайте virtulab. net.
Качественные реакции на органические соединения Виртуальные лабораторные работы по определению органических веществ доступны на сайте virtulab. net.
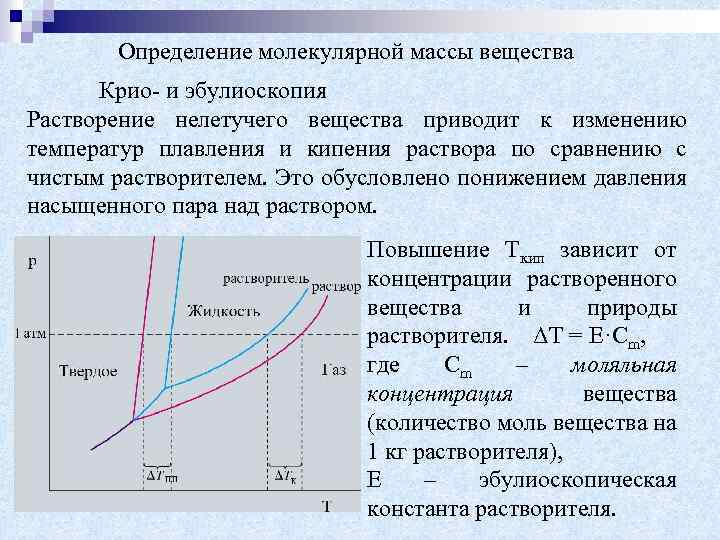 Определение молекулярной массы вещества Крио- и эбулиоскопия Растворение нелетучего вещества приводит к изменению температур плавления и кипения раствора по сравнению с чистым растворителем. Это обусловлено понижением давления насыщенного пара над раствором. Повышение Ткип зависит от концентрации растворенного вещества и природы растворителя. ΔТ = Е·Сm, где Сm – моляльная концентрация вещества (количество моль вещества на 1 кг растворителя), Е – эбулиоскопическая константа растворителя.
Определение молекулярной массы вещества Крио- и эбулиоскопия Растворение нелетучего вещества приводит к изменению температур плавления и кипения раствора по сравнению с чистым растворителем. Это обусловлено понижением давления насыщенного пара над раствором. Повышение Ткип зависит от концентрации растворенного вещества и природы растворителя. ΔТ = Е·Сm, где Сm – моляльная концентрация вещества (количество моль вещества на 1 кг растворителя), Е – эбулиоскопическая константа растворителя.
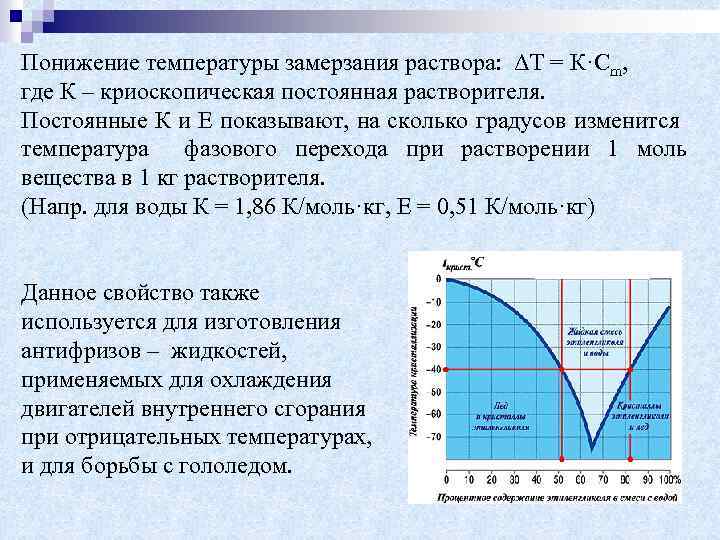 Понижение температуры замерзания раствора: ΔТ = К·Сm, где К – криоскопическая постоянная растворителя. Постоянные К и Е показывают, на сколько градусов изменится температура фазового перехода при растворении 1 моль вещества в 1 кг растворителя. (Напр. для воды К = 1, 86 К/моль·кг, Е = 0, 51 К/моль·кг) Данное свойство также используется для изготовления антифризов – жидкостей, применяемых для охлаждения двигателей внутреннего сгорания при отрицательных температурах, и для борьбы с гололедом.
Понижение температуры замерзания раствора: ΔТ = К·Сm, где К – криоскопическая постоянная растворителя. Постоянные К и Е показывают, на сколько градусов изменится температура фазового перехода при растворении 1 моль вещества в 1 кг растворителя. (Напр. для воды К = 1, 86 К/моль·кг, Е = 0, 51 К/моль·кг) Данное свойство также используется для изготовления антифризов – жидкостей, применяемых для охлаждения двигателей внутреннего сгорания при отрицательных температурах, и для борьбы с гололедом.
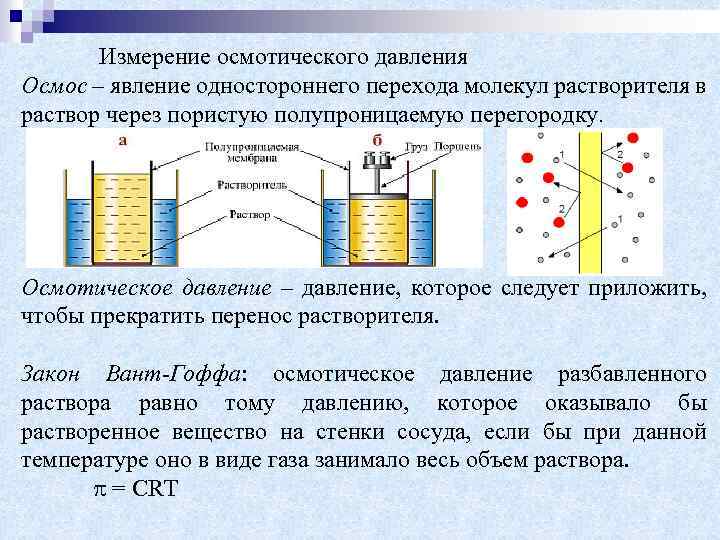 Измерение осмотического давления Осмос – явление одностороннего перехода молекул растворителя в раствор через пористую полупроницаемую перегородку. Осмотическое давление – давление, которое следует приложить, чтобы прекратить перенос растворителя. Закон Вант-Гоффа: осмотическое давление разбавленного раствора равно тому давлению, которое оказывало бы растворенное вещество на стенки сосуда, если бы при данной температуре оно в виде газа занимало весь объем раствора. = CRT
Измерение осмотического давления Осмос – явление одностороннего перехода молекул растворителя в раствор через пористую полупроницаемую перегородку. Осмотическое давление – давление, которое следует приложить, чтобы прекратить перенос растворителя. Закон Вант-Гоффа: осмотическое давление разбавленного раствора равно тому давлению, которое оказывало бы растворенное вещество на стенки сосуда, если бы при данной температуре оно в виде газа занимало весь объем раствора. = CRT



