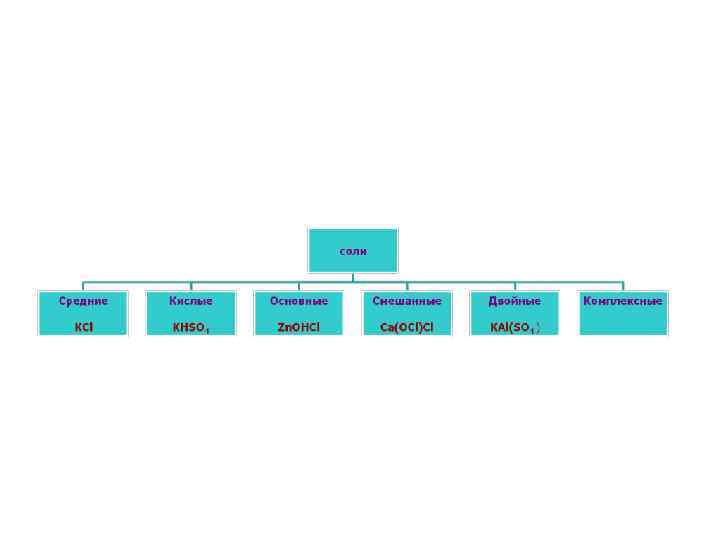
 • Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. • Соли – это сложные вещества, состоящие из катионов металлов и анионов кислотных остатков. • Общая формула солей – • • Мех(Кис. Ост)у. у –заряд катиона металла, х– заряд аниона кислотного остатка.
• Соли – это сложные вещества, состоящие из атомов металла и кислотных остатков. • Соли – это сложные вещества, состоящие из катионов металлов и анионов кислотных остатков. • Общая формула солей – • • Мех(Кис. Ост)у. у –заряд катиона металла, х– заряд аниона кислотного остатка.
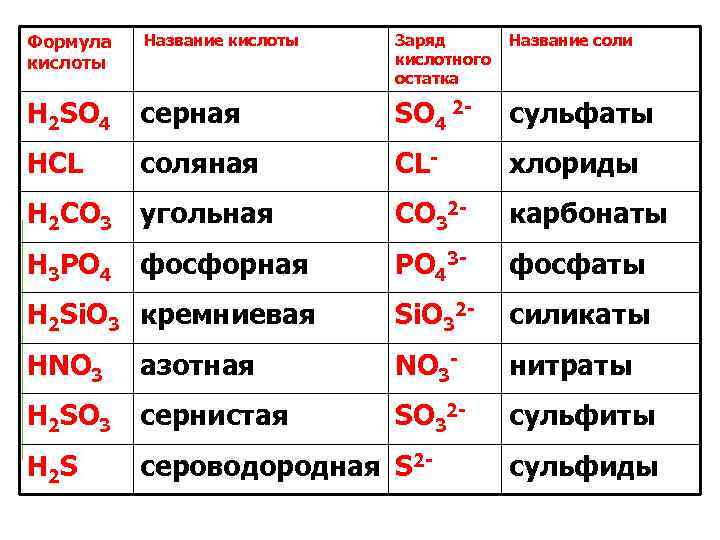 Формула кислоты Название кислоты Заряд Название соли кислотного остатка H 2 SO 4 серная SO 4 2 - сульфаты HCL соляная CL- хлориды H 2 CO 3 угольная CO 32 - карбонаты H 3 PO 4 фосфорная PO 43 - фосфаты H 2 Si. O 3 кремниевая Si. O 32 - силикаты HNO 3 азотная NO 3 - нитраты H 2 SO 3 сернистая SO 32 - сульфиты H 2 S сероводородная S 2 - сульфиды
Формула кислоты Название кислоты Заряд Название соли кислотного остатка H 2 SO 4 серная SO 4 2 - сульфаты HCL соляная CL- хлориды H 2 CO 3 угольная CO 32 - карбонаты H 3 PO 4 фосфорная PO 43 - фосфаты H 2 Si. O 3 кремниевая Si. O 32 - силикаты HNO 3 азотная NO 3 - нитраты H 2 SO 3 сернистая SO 32 - сульфиты H 2 S сероводородная S 2 - сульфиды
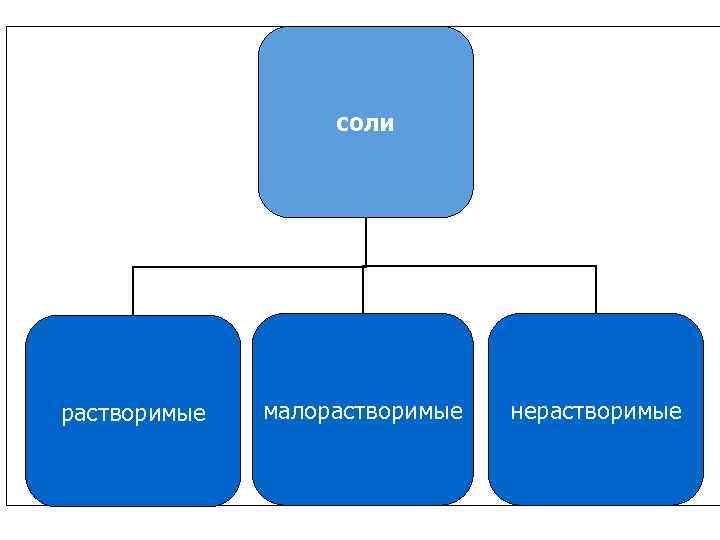 соли растворимые малорастворимые нерастворимые
соли растворимые малорастворимые нерастворимые
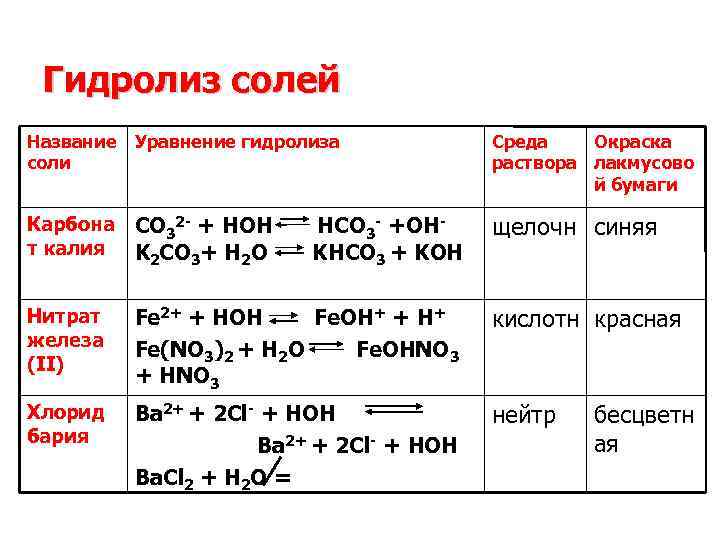 Гидролиз солей Название Уравнение гидролиза соли Среда Окраска раствора лакмусово й бумаги Карбона CO 32 - + HOH HCO 3 - +OHт калия K 2 CO 3+ H 2 O KHCO 3 + KOH щелочн синяя Нитрат железа (II) Fe 2+ + HOH Fe. OH+ + H+ Fe(NO 3)2 + H 2 O Fe. OHNO 3 + HNO 3 кислотн красная Хлорид бария Ba 2+ + 2 Cl- + HOH Ba 2+ + 2 Cl- + HOH Ba. Cl 2 + H 2 O = нейтр бесцветн ая
Гидролиз солей Название Уравнение гидролиза соли Среда Окраска раствора лакмусово й бумаги Карбона CO 32 - + HOH HCO 3 - +OHт калия K 2 CO 3+ H 2 O KHCO 3 + KOH щелочн синяя Нитрат железа (II) Fe 2+ + HOH Fe. OH+ + H+ Fe(NO 3)2 + H 2 O Fe. OHNO 3 + HNO 3 кислотн красная Хлорид бария Ba 2+ + 2 Cl- + HOH Ba 2+ + 2 Cl- + HOH Ba. Cl 2 + H 2 O = нейтр бесцветн ая
 ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
ГИДРОЛИЗ – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
 Окраска лакмоида в растворах солей: хлорида алюминия Al. Cl 3 карбоната натрия Na 2 CO 3 • Na. Cl Хлорида натрия
Окраска лакмоида в растворах солей: хлорида алюминия Al. Cl 3 карбоната натрия Na 2 CO 3 • Na. Cl Хлорида натрия
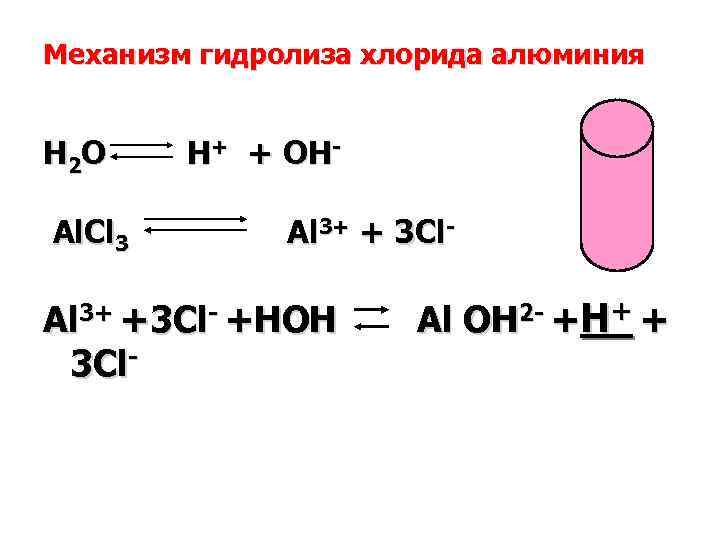 Механизм гидролиза хлорида алюминия H 2 O H+ + OH- Al. Cl 3 Al 3+ + 3 Cl- Al 3+ +3 Cl- +HOH Al OH 2 - +H+ + 3 Cl-
Механизм гидролиза хлорида алюминия H 2 O H+ + OH- Al. Cl 3 Al 3+ + 3 Cl- Al 3+ +3 Cl- +HOH Al OH 2 - +H+ + 3 Cl-
![Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH]- Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH]-](https://present5.com/presentation/120225529_180012763/image-9.jpg) Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ [OH] < [H] (что сильней того и больше!) К и с л о т н а я среда
Схема гидролиза хлорида алюминия Al. Cl 3 Al(OH)3 HCl слабое основание сильная кислота [OH]- < [H]+ [OH] < [H] (что сильней того и больше!) К и с л о т н а я среда
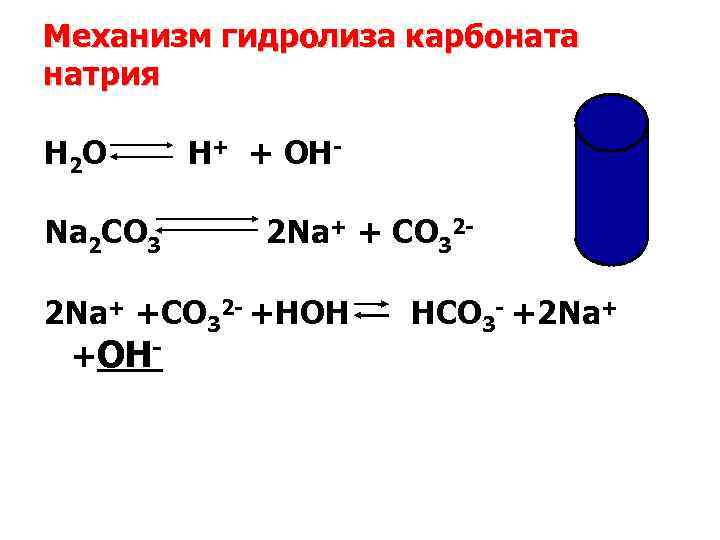 Механизм гидролиза карбоната натрия H 2 O H+ + OH- Na 2 CO 3 2 Na+ + CO 322 Na+ +CO 32 - +HOH HCO 3 - +2 Na+ +OH-
Механизм гидролиза карбоната натрия H 2 O H+ + OH- Na 2 CO 3 2 Na+ + CO 322 Na+ +CO 32 - +HOH HCO 3 - +2 Na+ +OH-
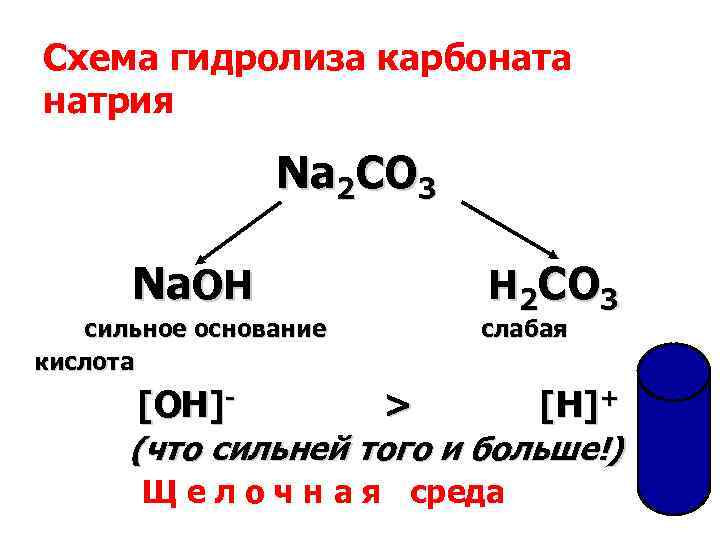 Схема гидролиза карбоната натрия Na 2 CO 3 Na. OH H 2 CO 3 сильное основание слабая кислота [OH]- > [H]+ [OH] > [H] (что сильней того и больше!) Щ е л о ч н а я среда
Схема гидролиза карбоната натрия Na 2 CO 3 Na. OH H 2 CO 3 сильное основание слабая кислота [OH]- > [H]+ [OH] > [H] (что сильней того и больше!) Щ е л о ч н а я среда
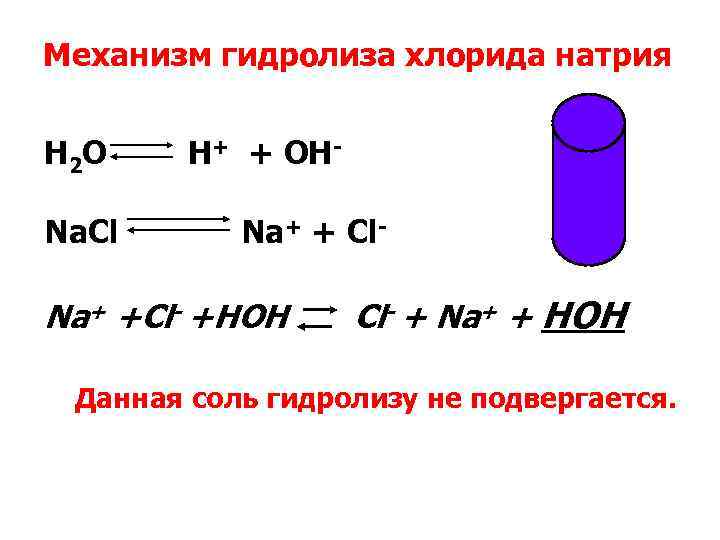 Механизм гидролиза хлорида натрия H 2 O H+ + OH- Na. Сl Na+ + Cl Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
Механизм гидролиза хлорида натрия H 2 O H+ + OH- Na. Сl Na+ + Cl Na+ +Cl- +HOH Cl- + Na+ + HOH Данная соль гидролизу не подвергается.
 Роль гидролиза в природе • Преобразование земной коры • Обеспечение слабощелочной среды морской воды
Роль гидролиза в природе • Преобразование земной коры • Обеспечение слабощелочной среды морской воды
 Роль гидролиза в народном хозяйстве • Порча производственного оборудования • Выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи) • Очистка промышленных стоков и питьевой воды (сульфат алюминия + вода гидроксид алюминия) • Подготовка тканей к окрашиванию • Известкование почв основано на гидролизе
Роль гидролиза в народном хозяйстве • Порча производственного оборудования • Выработка из непищевого сырья ценных продуктов (бумага, мыло, спирт, глюкоза, белковые дрожжи) • Очистка промышленных стоков и питьевой воды (сульфат алюминия + вода гидроксид алюминия) • Подготовка тканей к окрашиванию • Известкование почв основано на гидролизе
 Роль гидролиза в повседневной жизни человека • Стирка • Мытье посуды • Умывание с мылом • Процессы пищеварения
Роль гидролиза в повседневной жизни человека • Стирка • Мытье посуды • Умывание с мылом • Процессы пищеварения
 Влияние нитратов на окружающую среду на организм человека. Азот основной питательный элемент, который влияет на рост вегетативных органов – стеблей и листьев. Азотные удобрения рекомендуются вносить поздней осенью или ранней весной, так как талые воды смывают половину удобрений. Важно соблюдать нормы и сроки внесения. Избыточное употребление азотных удобрений не только ведёт к аккумуляции нитратов в растениях, но и приводит к загрязнению окружающей среды. Один из признаков загрязнения водоёма, цветение воды, вызванное буйным размножением водорослей. Для самих растений нитраты безвредны, а для человека и животных опасны. Смертельная доза для человека 8– 15 гр. Многие растения способны накапливать большое количество нитратов, например: капуста, кабачки, петрушка, укроп, свекла во время роста и развития стеблей и листьев А при созревании семян потребление азота практически прекращается Плоды , достигшие полной зрелости, не содержат нитратов. Попадая в организм человека, часть нитратов всасывается в желудочно-кишечном тракте в неизмененном виде, а другая часть может превращаться в ядовитые нитриты, аммиак. Признаки небольшого отравления – слабость, головокружение, тошнота. Первая помощь при отравлении нитратами – обильное промывание желудка, приём активированного угля. Уменьшить вредное влияние нитратов – употребление витамина С: ввести в рацион питания чёрную и красную смородину, другие ягоды и фрукты, в висячих плодах нитратов нет И конечно же зелёный чай.
Влияние нитратов на окружающую среду на организм человека. Азот основной питательный элемент, который влияет на рост вегетативных органов – стеблей и листьев. Азотные удобрения рекомендуются вносить поздней осенью или ранней весной, так как талые воды смывают половину удобрений. Важно соблюдать нормы и сроки внесения. Избыточное употребление азотных удобрений не только ведёт к аккумуляции нитратов в растениях, но и приводит к загрязнению окружающей среды. Один из признаков загрязнения водоёма, цветение воды, вызванное буйным размножением водорослей. Для самих растений нитраты безвредны, а для человека и животных опасны. Смертельная доза для человека 8– 15 гр. Многие растения способны накапливать большое количество нитратов, например: капуста, кабачки, петрушка, укроп, свекла во время роста и развития стеблей и листьев А при созревании семян потребление азота практически прекращается Плоды , достигшие полной зрелости, не содержат нитратов. Попадая в организм человека, часть нитратов всасывается в желудочно-кишечном тракте в неизмененном виде, а другая часть может превращаться в ядовитые нитриты, аммиак. Признаки небольшого отравления – слабость, головокружение, тошнота. Первая помощь при отравлении нитратами – обильное промывание желудка, приём активированного угля. Уменьшить вредное влияние нитратов – употребление витамина С: ввести в рацион питания чёрную и красную смородину, другие ягоды и фрукты, в висячих плодах нитратов нет И конечно же зелёный чай.
 Использование солей натрия • Нитрат серебра, который чернит ткать, бумагу (ляпис) применяют как противомикробное средство для лечения кожных язв, прижигания бородавок • Нитрит висмута назначают внутрь при язвенной болезни желудка и двенадцатиперстной кишки. наружно – в мазях, присыпках при воспалительных заболеваниях кожи. • Нитрит натрия применяют в медицине как спазмолитическое средство. • Нитриты применяют в колбасном производстве 30 г на 100 кг. фарша. Нитриты придают колбасе розовый цвет. К тому же присутствие нитритов необходимо ещё и по другой причине: они предотвращают развитие микроорганизмов, выделяющих токсические вещества
Использование солей натрия • Нитрат серебра, который чернит ткать, бумагу (ляпис) применяют как противомикробное средство для лечения кожных язв, прижигания бородавок • Нитрит висмута назначают внутрь при язвенной болезни желудка и двенадцатиперстной кишки. наружно – в мазях, присыпках при воспалительных заболеваниях кожи. • Нитрит натрия применяют в медицине как спазмолитическое средство. • Нитриты применяют в колбасном производстве 30 г на 100 кг. фарша. Нитриты придают колбасе розовый цвет. К тому же присутствие нитритов необходимо ещё и по другой причине: они предотвращают развитие микроорганизмов, выделяющих токсические вещества


