соли аммония.pptx
- Количество слайдов: 16

СОЛИ АММОНИЯ

Ион аммония образован только неметаллами NH 4+ Так же, как и ионы металлов, он образует свои соли (NH 4+К. О. ) Все соли аммония растворимы в воде. Без азота нет белка, без белка нет жизни.

Соли аммо ния — соли, содержащие одновалентный ион аммония NH 4+; по строению, цвету и другим свойствам они похожи на соответствующие соли калия. Все соли аммония растворимы в воде, полностью диссоциируют в водном растворе.

Химические свойства 1. Сильные электролиты (диссоциируют в водных растворах): NH 4 Cl ↔ NH 4 ++ Cl 2. С кислотами (реакция обмена): (NH 4) 2 CO 3 + 2 НCl → 2 NH 4 Cl + Н 2 O + CO 2 ↑ 2 NH 4+ + CO 32 - + 2 H+ + 2 Cl- → 2 NH 4+ + 2 Cl- + Н 2 O + CO 2 ↑ CO 32 - + 2 H+ → Н 2 O + CO 2 ↑

Химические свойства 3. C солями (реакция обмена): (NH 4)2 SO 4 + Ba(NO 3)2 → Ba. SO 4 ↓ + 2 NH 4 NO 3 2 NH 4+ + SO 42 - + Ba 2+ + 2 NO 3 - → Ba. SO 4 ↓ + 2 NH 4+ + 2 NO 3 Ba 2+ + SO 42 - → Ba. SO 4 ↓ 4. При нагревании со щелочами выделяется аммиак (качественная реакция на ион аммония): NH 4 Cl + Na. OH → Na. Cl + NH 3 ↑ + Н 2 O
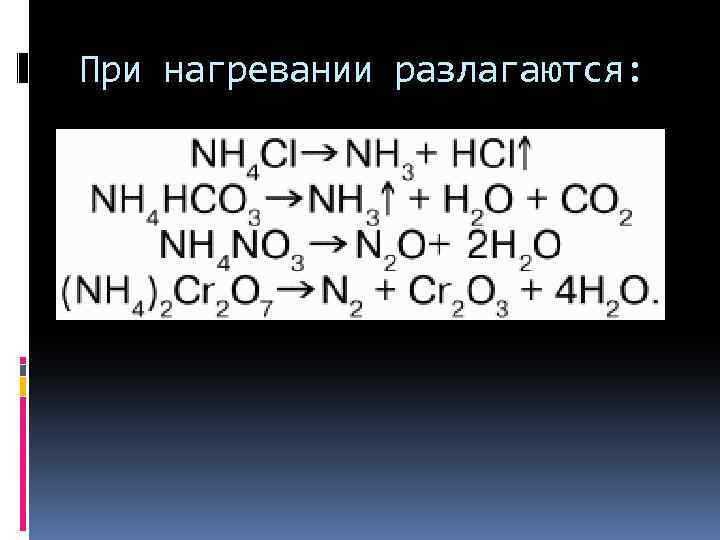
При нагревании разлагаются:

Применение солей аммония в пиротехнике; в хлебопечении и кондитерской промышленности; в сельском хозяйстве- удобрения; при паянии металлов (нашатырь- хлорид аммония); электролит в сухих элементах (хлорид аммония).

применение солей аммония Нитрат аммония NH 4 NО 3 в смеси с порошками алюминия и угля используют в качестве взрывчатого вещества - аммонала , который широко применяют при разработке горных пород.

применение солей аммония Гидрокарбонат аммония NH 4 HCO 3 и карбонат аммония (NH 4)2 CO 3 применяют в кондитерском деле, так как они легко разлагаются при нагревании и образуют газы, разрыхляющие тесто и делающие его пышным, например: NH 4 HCO 3 = NH 3↑ + Н 2 O↑ + CO 2↑

применение солей аммония Соли аммония используются в качестве удобрений

применение солей аммония Хлорид аммония NH 4 Cl используют при паянии, так как он очищает поверхность металла от оксидной плёнки и к ней хорошо пристаёт припой.

применение солей аммония в гальванических элементах (сухих батареях)

применение солей аммония Хлорид аммония применяется при изготовлении дымовых шашек

получение солей аммония Аммиак (или гидроксид аммония) + кислота. NH 3 + HNO 3 = NH 4 NO 3 2 NH 4 OH + H 2 SO 4 =(NH 4) 2 SO 4+ 2 Н 2 O

Заключение Роль азотистых соединений в жизни человека и общества очень велика, а применении разнообразно. Азот – основа жизни на Земле. На Земле постоянно происходят процессы превращения веществ живой и неживой природы. В результате этих превращений неорганические вещества неживой природы – соли аммония могут превращаться в сложные органические вещества – белки. А белки – это основа всего живого В белках содержится 18 % азота. Без азота нет белка, без белка нет жизни!

Домашнее задание § 26, № 4, 5 с. 155
соли аммония.pptx