серд.сосуд.система.ppt
- Количество слайдов: 37



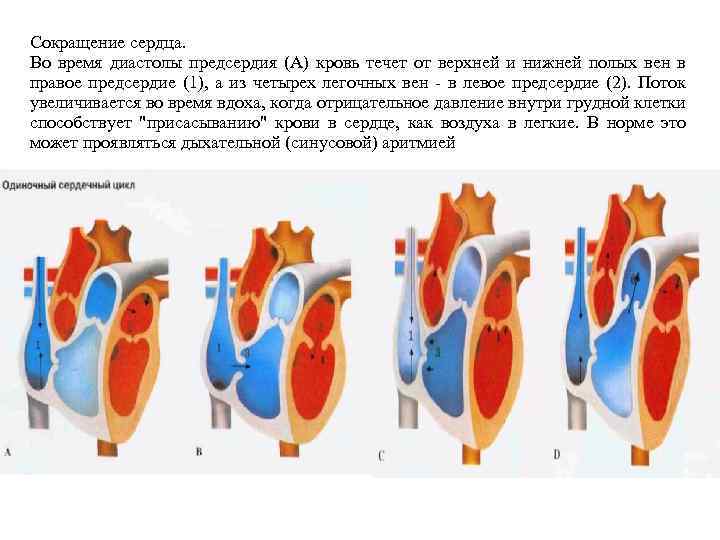 Сокращение сердца. Во время диастолы предсердия (А) кровь течет от верхней и нижней полых вен в правое предсердие (1), а из четырех легочных вен - в левое предсердие (2). Поток увеличивается во время вдоха, когда отрицательное давление внутри грудной клетки способствует "присасыванию" крови в сердце, как воздуха в легкие. В норме это может проявляться дыхательной (синусовой) аритмией
Сокращение сердца. Во время диастолы предсердия (А) кровь течет от верхней и нижней полых вен в правое предсердие (1), а из четырех легочных вен - в левое предсердие (2). Поток увеличивается во время вдоха, когда отрицательное давление внутри грудной клетки способствует "присасыванию" крови в сердце, как воздуха в легкие. В норме это может проявляться дыхательной (синусовой) аритмией
 Систола предсердий заканчивается (С), когда возбуждение достигает атриовентрикулярного узла и распространяется по ветвям пучка Гиса, вызывая систолу желудочков. Атриовентрикулярные клапаны (3, 4) быстро захлопываются, сухожильные нити и сосочковые мышцы желудочков препятствуют их заворачиванию (пролапсу) в предсердия. Венозная кровь заполняет предсердия (1, 2) во время их диастолы и систолы желудочков. Когда систола желудочков заканчивается (В), давление в них падает, два атриовентрикулярных клапана - 3 -створ-чатый (3) и митральный (4) - открываются, и кровь поступает из предсердий (1, 2) в желудочки. Очередная волна возбуждения из синусного узла, распространяясь, вызывает систолу предсердий, во время которой через полностью открытые атриовентрикулярные отверстия в расслабленные желудочки нагнетается дополнительная порция крови. Быстро возрастающее давление в желудочках (D) открывает аортальный клапан (5) и клапан легочного ствола (6); потоки крови устремляются в большой и малый круги кровообращения. Эластичность стенок артерий заставляет клапаны (5, 6) резко захлопываться в конце систолы желудочков. Звуки, возникающие при резком захлопывании атриовентрикулярных и полулунных клапанов, выслушиваются через стенку грудной клетки как тоны сердца - "тук-тук".
Систола предсердий заканчивается (С), когда возбуждение достигает атриовентрикулярного узла и распространяется по ветвям пучка Гиса, вызывая систолу желудочков. Атриовентрикулярные клапаны (3, 4) быстро захлопываются, сухожильные нити и сосочковые мышцы желудочков препятствуют их заворачиванию (пролапсу) в предсердия. Венозная кровь заполняет предсердия (1, 2) во время их диастолы и систолы желудочков. Когда систола желудочков заканчивается (В), давление в них падает, два атриовентрикулярных клапана - 3 -створ-чатый (3) и митральный (4) - открываются, и кровь поступает из предсердий (1, 2) в желудочки. Очередная волна возбуждения из синусного узла, распространяясь, вызывает систолу предсердий, во время которой через полностью открытые атриовентрикулярные отверстия в расслабленные желудочки нагнетается дополнительная порция крови. Быстро возрастающее давление в желудочках (D) открывает аортальный клапан (5) и клапан легочного ствола (6); потоки крови устремляются в большой и малый круги кровообращения. Эластичность стенок артерий заставляет клапаны (5, 6) резко захлопываться в конце систолы желудочков. Звуки, возникающие при резком захлопывании атриовентрикулярных и полулунных клапанов, выслушиваются через стенку грудной клетки как тоны сердца - "тук-тук".
 РЕГУЛЯЦИЯ ФУНКЦИЙ СЕРДЦА СЕРДЕЧНЫЙ ВЫБРОС. В норме величина сердечного выброса варьирует в широких пределах: при необходимости сердечный выброс может увеличиваться более чем в 5 раз по сравнению с уровнем покоя. Поскольку желудочки соединены последовательно, их выбросы при каждом сокращении должны быть примерно одинаковыми. Так, если выброс правого желудочка будет всего на 20 % больше, чем выброс левого, то через несколько минут неизбежно наступит отек легкого в результате переполнения кровью малого круга кровообращения. Однако в норме этого не происходит, что свидетельствует о наличии механизма, согласующего выбросы обоих желудочков. Даже в тех случаях, когда возрастает системное сосудистое сопротивление (например, в результате сужения сосудов), опасного застоя крови не происходит: левый желудочек быстро приспосабливается к изменившимся условиям, начинает сокращаться сильнее и развивает давление, достаточное для выброса прежнего количества крови. Колебания венозного возврата и диастолического наполнения также компенсируются путем приспособительных изменений сердечного выброса. Эта удивительная способность сердца к адаптации обусловлена двумя типами регуляторных механизмов: • внутрисердечной регуляцией - (такая регуляция связана с особыми свойствами самого миокарда, благодаря чему он действует в условиях изолированного сердца); • экстракардиальной регуляцией, которую осуществляют эндокринные железы и вегетативная нервная система.
РЕГУЛЯЦИЯ ФУНКЦИЙ СЕРДЦА СЕРДЕЧНЫЙ ВЫБРОС. В норме величина сердечного выброса варьирует в широких пределах: при необходимости сердечный выброс может увеличиваться более чем в 5 раз по сравнению с уровнем покоя. Поскольку желудочки соединены последовательно, их выбросы при каждом сокращении должны быть примерно одинаковыми. Так, если выброс правого желудочка будет всего на 20 % больше, чем выброс левого, то через несколько минут неизбежно наступит отек легкого в результате переполнения кровью малого круга кровообращения. Однако в норме этого не происходит, что свидетельствует о наличии механизма, согласующего выбросы обоих желудочков. Даже в тех случаях, когда возрастает системное сосудистое сопротивление (например, в результате сужения сосудов), опасного застоя крови не происходит: левый желудочек быстро приспосабливается к изменившимся условиям, начинает сокращаться сильнее и развивает давление, достаточное для выброса прежнего количества крови. Колебания венозного возврата и диастолического наполнения также компенсируются путем приспособительных изменений сердечного выброса. Эта удивительная способность сердца к адаптации обусловлена двумя типами регуляторных механизмов: • внутрисердечной регуляцией - (такая регуляция связана с особыми свойствами самого миокарда, благодаря чему он действует в условиях изолированного сердца); • экстракардиальной регуляцией, которую осуществляют эндокринные железы и вегетативная нервная система.



 Работу сердца контролируют сердечные центры продолговатого мозга и моста через парасимпатические и симпатические волокна, которые влияют на ЧСС (хронотропное действие), силу сокращений (инотропное действие), скорость предсердно-желудочкового проведения (дромотропное действие), возбудимость сердечной мышцы (батмотропное действие). Холинергические и адренергические (преимущественно безмиелиновые) волокна образуют в стенке сердца несколько нервных сплетений, содержащих внутрисердечные ганглии. Скопления ганглиев в основном сосредоточены в стенке правого предсердия и в области устьев полых вен. Стимуляция симпатических нервов: • увеличивает частоту спонтанной деполяризации мембран водителей ритма, • облегчает проведение импульса в волокнах Пуркинье, • увеличивает частоту и силу сокращения рабочих кардиомиоцитов. Стимуляция парасимпатических нервов: • уменьшает частоту генерации импульсов пейсмекерами, • снижает скорость проведения импульса в волокнах Пуркинье, • уменьшает силу и частоту сокращения миокарда.
Работу сердца контролируют сердечные центры продолговатого мозга и моста через парасимпатические и симпатические волокна, которые влияют на ЧСС (хронотропное действие), силу сокращений (инотропное действие), скорость предсердно-желудочкового проведения (дромотропное действие), возбудимость сердечной мышцы (батмотропное действие). Холинергические и адренергические (преимущественно безмиелиновые) волокна образуют в стенке сердца несколько нервных сплетений, содержащих внутрисердечные ганглии. Скопления ганглиев в основном сосредоточены в стенке правого предсердия и в области устьев полых вен. Стимуляция симпатических нервов: • увеличивает частоту спонтанной деполяризации мембран водителей ритма, • облегчает проведение импульса в волокнах Пуркинье, • увеличивает частоту и силу сокращения рабочих кардиомиоцитов. Стимуляция парасимпатических нервов: • уменьшает частоту генерации импульсов пейсмекерами, • снижает скорость проведения импульса в волокнах Пуркинье, • уменьшает силу и частоту сокращения миокарда.
 ПАРАСИМПАТИЧЕСКАЯ ИННЕРВАЦИЯ. Преганглионарные парасимпатические волокна для сердца проходят в составе блуждающего нерва с обеих сторон. Волокна правого блуждающего нерва иннервируют правое предсердие и образуют густое сплетение в области синуснопредсердного узла. Волокна левого блуждающего нерва проходят преимущественно к предсердно-желудочковому узлу. Поэтому правый блуждающий нерв влияет главным образом на ЧСС, а левый - на предсердно-желудочковое проведение. Желудочки имеют менее выраженную парасимпатическую иннервацию. Внутрисердечные нейроны почти все холинергические (парасимпатические). На них заканчиваются терминали холинергических аксонов блуждающего нерва. Эффекты. Под действием парасимпатических волокон сила сокращений предсердий уменьшается (отрицательный инотропный эффект), снижается ЧСС (отрицательный хронотропный эффект), увеличивается предсердно-желудочковая задержка проведения (отрицательный дромотропный эффект), вплоть до полной преходящей предсердножелудочковой блокады, понижается возбудимость сердечной мышцы (отрицательный батмотропный эффект).
ПАРАСИМПАТИЧЕСКАЯ ИННЕРВАЦИЯ. Преганглионарные парасимпатические волокна для сердца проходят в составе блуждающего нерва с обеих сторон. Волокна правого блуждающего нерва иннервируют правое предсердие и образуют густое сплетение в области синуснопредсердного узла. Волокна левого блуждающего нерва проходят преимущественно к предсердно-желудочковому узлу. Поэтому правый блуждающий нерв влияет главным образом на ЧСС, а левый - на предсердно-желудочковое проведение. Желудочки имеют менее выраженную парасимпатическую иннервацию. Внутрисердечные нейроны почти все холинергические (парасимпатические). На них заканчиваются терминали холинергических аксонов блуждающего нерва. Эффекты. Под действием парасимпатических волокон сила сокращений предсердий уменьшается (отрицательный инотропный эффект), снижается ЧСС (отрицательный хронотропный эффект), увеличивается предсердно-желудочковая задержка проведения (отрицательный дромотропный эффект), вплоть до полной преходящей предсердножелудочковой блокады, понижается возбудимость сердечной мышцы (отрицательный батмотропный эффект).
 СИМПАТИЧЕСКАЯ ИННЕРВАЦИЯ. Преганглионарные симпатические волокна для сердца идут от боковых рогов верхних грудных сегментов спинного мозга. Постганглионарные адренергические волокна образованы аксонами нейронов ганглиев симпатической нервной цепочки (звездчатый и отчасти верхний шейный симпатические узлы). Они подходят к органу в составе нескольких сердечных нервов и равномерно распределяются по всем отделам сердца. Терминальные ветви пронизывают миокард, соровождают коронарные сосуды и подходят к элементам проводящей системы. Миокард предсердий имеет более высокую плотность адренергических волокон. Каждый пятый кардиомиоцит желудочков снабжается адренергической терминалью, заканчивающейся на расстоянии 50 мкм от плазмолеммы кардиомиоцита. Эффекты. Под действием симпатических волокон сила сокращений предсердий и желудочков увеличивается (положительный инотропный эффект), возрастает ЧСС (положительный хронотропный эффект), укорачивается интервал между сокращениями предсердий и желудочков (положительный дромотропный эффект), повышается возбудимость сердца (положительный батмотропный эффект).
СИМПАТИЧЕСКАЯ ИННЕРВАЦИЯ. Преганглионарные симпатические волокна для сердца идут от боковых рогов верхних грудных сегментов спинного мозга. Постганглионарные адренергические волокна образованы аксонами нейронов ганглиев симпатической нервной цепочки (звездчатый и отчасти верхний шейный симпатические узлы). Они подходят к органу в составе нескольких сердечных нервов и равномерно распределяются по всем отделам сердца. Терминальные ветви пронизывают миокард, соровождают коронарные сосуды и подходят к элементам проводящей системы. Миокард предсердий имеет более высокую плотность адренергических волокон. Каждый пятый кардиомиоцит желудочков снабжается адренергической терминалью, заканчивающейся на расстоянии 50 мкм от плазмолеммы кардиомиоцита. Эффекты. Под действием симпатических волокон сила сокращений предсердий и желудочков увеличивается (положительный инотропный эффект), возрастает ЧСС (положительный хронотропный эффект), укорачивается интервал между сокращениями предсердий и желудочков (положительный дромотропный эффект), повышается возбудимость сердца (положительный батмотропный эффект).
 Периоды и фазы сердечного цикла Систола желудочков — период сокращения желудочков, что позволяет протолкнуть кровь в артериальное русло. В сокращении желудочков можно выделить несколько периодов и фаз: Период напряжения — характеризуется началом сокращения мышечной массы желудочков без изменения объема крови внутри них. Асинхронное сокращение — начало возбуждения миокарда желудочков, когда только отдельные волокна вовлечены. Изменения давления в желудочках хватает для закрытия предсердно-желудочковых клапанов в конце этой фазы. Изоволюметрическое сокращение — вовлечен практически весь миокард желудочков, но изменения объема крови внутри них не происходит, так как закрыты выносящие (полулунные — аортальный и легочный) клапаны. Термин изометрическое сокращение не совсем точен, так как в это время происходит изменение формы (ремоделирование) желудочков, натяжение хорд. Период изгнания — характеризуется изгнанием крови из желудочков. Быстрое изгнание — период от момента открытия полулунных клапанов до достижения в полости желудочков систолического давления — за этот период выбрасывается максимальное количество крови. Медленное изгнание — период, когда давление в полости желудочков начинает снижаться, но все еще больше диастолического давления. В это время кровь из желудочков продолжает двигаться под действием сообщенной ей кинетической энергии, до момента выравнивания давления в полости желудочков и выносящих сосудов. В состоянии спокойствия желудочек сердца взрослого человека за каждую систолу выбрасывает от 60 мл крови (ударный объем). Сердечный цикл длится до 1 с, соответственно, сердце делает от 60 сокращений в минуту (частота сердечных сокращений, ЧСС). Нетрудно подсчитать, что даже в состоянии покоя сердце перегоняет 4 л крови в минуту (минутный объем сердца, МОС). Во время максимальной нагрузки ударный объём сердца тренированого человека может превышать 200 мл, пульс — превышать 200 ударов в минуту, а циркуляция крови может достигать 40 л в минуту.
Периоды и фазы сердечного цикла Систола желудочков — период сокращения желудочков, что позволяет протолкнуть кровь в артериальное русло. В сокращении желудочков можно выделить несколько периодов и фаз: Период напряжения — характеризуется началом сокращения мышечной массы желудочков без изменения объема крови внутри них. Асинхронное сокращение — начало возбуждения миокарда желудочков, когда только отдельные волокна вовлечены. Изменения давления в желудочках хватает для закрытия предсердно-желудочковых клапанов в конце этой фазы. Изоволюметрическое сокращение — вовлечен практически весь миокард желудочков, но изменения объема крови внутри них не происходит, так как закрыты выносящие (полулунные — аортальный и легочный) клапаны. Термин изометрическое сокращение не совсем точен, так как в это время происходит изменение формы (ремоделирование) желудочков, натяжение хорд. Период изгнания — характеризуется изгнанием крови из желудочков. Быстрое изгнание — период от момента открытия полулунных клапанов до достижения в полости желудочков систолического давления — за этот период выбрасывается максимальное количество крови. Медленное изгнание — период, когда давление в полости желудочков начинает снижаться, но все еще больше диастолического давления. В это время кровь из желудочков продолжает двигаться под действием сообщенной ей кинетической энергии, до момента выравнивания давления в полости желудочков и выносящих сосудов. В состоянии спокойствия желудочек сердца взрослого человека за каждую систолу выбрасывает от 60 мл крови (ударный объем). Сердечный цикл длится до 1 с, соответственно, сердце делает от 60 сокращений в минуту (частота сердечных сокращений, ЧСС). Нетрудно подсчитать, что даже в состоянии покоя сердце перегоняет 4 л крови в минуту (минутный объем сердца, МОС). Во время максимальной нагрузки ударный объём сердца тренированого человека может превышать 200 мл, пульс — превышать 200 ударов в минуту, а циркуляция крови может достигать 40 л в минуту.
 Диастола — период времени, в течение которого сердце расслабляется для приема крови. В целом характеризуется снижением давления в полости желудочков, закрытием полулунных клапанов и открытием предсердно-желудочковых клапанов с продвижением крови в желудочки. Диастола желудочков Протодиастола — период начала расслабления миокарда с падением давления ниже, чем в выносящих сосудах, что приводит к закрытию полулунных клапанов. Изоволюметрическое расслабление — аналогична фазе изволюметрического сокращения, но с точностью до наоборот. Происходит удлинение мышечных волокон, но без изменения объема полости желудочков. Фаза заканчивается открытием предсердножелудочковых (митрального и трехстворчатого) клапанов. Период наполнения Быстрое наполнение — желудочки стремительно восстанавливают свою форму в расслабленном состоянии, что значительно снижает давление в их полости и засасывает кровь из предсердий. Медленное наполнение — желудочки практически полностью восстановили свою форму, кровь течет уже из-за градиента давления в полых венах, где оно выше на 2 -3 мм рт. ст. Систола предсердий Является завершающей фазой диастолы. При нормальной частоте сердечных сокращений вклад сокращения предсердий невелик (около 8 %), так как за относительно длинную диастолу кровь уже успевает наполнить желудочки. Однако, с увеличением частоты сокращений, в основном снижается длительность диастолы и вклад систолы предсердий в наполнение желудочков становится весьма существенным.
Диастола — период времени, в течение которого сердце расслабляется для приема крови. В целом характеризуется снижением давления в полости желудочков, закрытием полулунных клапанов и открытием предсердно-желудочковых клапанов с продвижением крови в желудочки. Диастола желудочков Протодиастола — период начала расслабления миокарда с падением давления ниже, чем в выносящих сосудах, что приводит к закрытию полулунных клапанов. Изоволюметрическое расслабление — аналогична фазе изволюметрического сокращения, но с точностью до наоборот. Происходит удлинение мышечных волокон, но без изменения объема полости желудочков. Фаза заканчивается открытием предсердножелудочковых (митрального и трехстворчатого) клапанов. Период наполнения Быстрое наполнение — желудочки стремительно восстанавливают свою форму в расслабленном состоянии, что значительно снижает давление в их полости и засасывает кровь из предсердий. Медленное наполнение — желудочки практически полностью восстановили свою форму, кровь течет уже из-за градиента давления в полых венах, где оно выше на 2 -3 мм рт. ст. Систола предсердий Является завершающей фазой диастолы. При нормальной частоте сердечных сокращений вклад сокращения предсердий невелик (около 8 %), так как за относительно длинную диастолу кровь уже успевает наполнить желудочки. Однако, с увеличением частоты сокращений, в основном снижается длительность диастолы и вклад систолы предсердий в наполнение желудочков становится весьма существенным.
 Электрическая систола (интервал QT). Выделяют электрическую систолу — электрическую активность, которая стимулирует миокард и вызывает механическую систолу — сокращение сердечной мышцы и уменьшение сердечных камер в объеме. Термин диастола означает расслабление мышцы. Во время сердечного цикла происходит повышение и снижение давления крови, соответственно высокое давление в момент систолы желудочков называется систолическим, а низкое во время их диастолы — диастолическим. Частота повторения сердечного цикла называется частотой сердечных сокращений, её задает водитель ритма сердца. Интервал QT (электрическая систола) — равен расстоянию от начала комплекса QRS до завершения зубца (волны) T. Соответствует времени механического сокращения желудочков миокарда. Так как этот показатель отражает процессы деполяризации и реполяризации миокарда, его иногда образно называют электрическая систола сердца. Продолжительность зависит от пола, возраста и частоты ритма. У детей продолжительность интервала QT меньше, чем у взрослых. Электрическая систола желудочков (QT) — константа для данной частоты ритма отдельно для мужчин и для женщин. Если продолжительность интервала QT превышает нормативы больше чем на 50 мс, то говорят об удлинении электрической систолы желудочков, что является характерным признаком кардиосклероза. Для определения нормальной продолжительности интервала QT при определенной частоте сердечного ритма предложены различные формулы, номограммы, расчетные и эмпирические таблицы. Широкое распространение получила формула Базетта для расчета должного интервала QT. В норме интервал QT составляет 0, 35 -0, 44 с (17, 5 -22 клеточки). Интервал QT является постоянной величиной для частоты ритма (отдельно для мужчин и женщин).
Электрическая систола (интервал QT). Выделяют электрическую систолу — электрическую активность, которая стимулирует миокард и вызывает механическую систолу — сокращение сердечной мышцы и уменьшение сердечных камер в объеме. Термин диастола означает расслабление мышцы. Во время сердечного цикла происходит повышение и снижение давления крови, соответственно высокое давление в момент систолы желудочков называется систолическим, а низкое во время их диастолы — диастолическим. Частота повторения сердечного цикла называется частотой сердечных сокращений, её задает водитель ритма сердца. Интервал QT (электрическая систола) — равен расстоянию от начала комплекса QRS до завершения зубца (волны) T. Соответствует времени механического сокращения желудочков миокарда. Так как этот показатель отражает процессы деполяризации и реполяризации миокарда, его иногда образно называют электрическая систола сердца. Продолжительность зависит от пола, возраста и частоты ритма. У детей продолжительность интервала QT меньше, чем у взрослых. Электрическая систола желудочков (QT) — константа для данной частоты ритма отдельно для мужчин и для женщин. Если продолжительность интервала QT превышает нормативы больше чем на 50 мс, то говорят об удлинении электрической систолы желудочков, что является характерным признаком кардиосклероза. Для определения нормальной продолжительности интервала QT при определенной частоте сердечного ритма предложены различные формулы, номограммы, расчетные и эмпирические таблицы. Широкое распространение получила формула Базетта для расчета должного интервала QT. В норме интервал QT составляет 0, 35 -0, 44 с (17, 5 -22 клеточки). Интервал QT является постоянной величиной для частоты ритма (отдельно для мужчин и женщин).
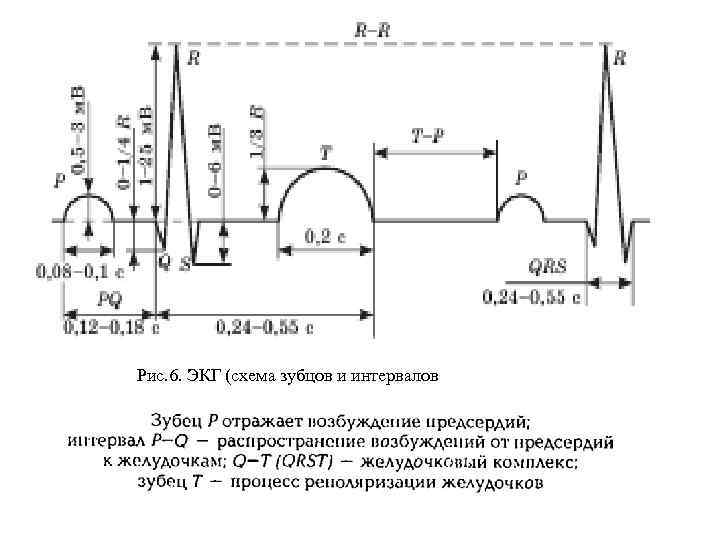 Рис. 6. ЭКГ (схема зубцов и интервалов
Рис. 6. ЭКГ (схема зубцов и интервалов

 Измеряют длину интервала RR в мм, умножают на 0, 02 с (если скорость движения ленты равна 50 мм/с), на 0, 04 с (если скорость движения бумаги 25 мм/с), на 0, 01 с (если скорость движения бумаги 100 мм/с). Рассчитывают ЧСС = 60/RR, уд, мин. Фактические показатели сравнивают с должными величинами, рассчитанными по рекомендации Ю. Р. Шейх–Заде с соавт. : 1/3 ДЧСС = 48* Высота зубцов, отражающая их вольтаж (m. V), колеблется в следующих пределах: Зубец Р =0, 05 – 0, 30 m. V; зубец R = 0, 60 – 1, 60 m. V; зубец Т = 0, 25 – 0, 50 m. V. При анализе ЭКГ пользуются сопоставлением фактической систолы с ее должной величиной, определяемой по формуле Q – T = k R – R , Где Q – T – длительность систолы, с; R – длительность сердечного цикла, с K – коэффициент, равный в среднем для мужчин – 0, 37; для женщин – 0, 40, для детей – 0, 38. Определяют систолический показатель (СП) и сравнивают его с должной величиной: СП = (Q – T) * 100 / (R – R), %.
Измеряют длину интервала RR в мм, умножают на 0, 02 с (если скорость движения ленты равна 50 мм/с), на 0, 04 с (если скорость движения бумаги 25 мм/с), на 0, 01 с (если скорость движения бумаги 100 мм/с). Рассчитывают ЧСС = 60/RR, уд, мин. Фактические показатели сравнивают с должными величинами, рассчитанными по рекомендации Ю. Р. Шейх–Заде с соавт. : 1/3 ДЧСС = 48* Высота зубцов, отражающая их вольтаж (m. V), колеблется в следующих пределах: Зубец Р =0, 05 – 0, 30 m. V; зубец R = 0, 60 – 1, 60 m. V; зубец Т = 0, 25 – 0, 50 m. V. При анализе ЭКГ пользуются сопоставлением фактической систолы с ее должной величиной, определяемой по формуле Q – T = k R – R , Где Q – T – длительность систолы, с; R – длительность сердечного цикла, с K – коэффициент, равный в среднем для мужчин – 0, 37; для женщин – 0, 40, для детей – 0, 38. Определяют систолический показатель (СП) и сравнивают его с должной величиной: СП = (Q – T) * 100 / (R – R), %.
 Оценка результатов: При нормальном состоянии сердца расхождение между фактической и должной систолой составляет не более 15% в ту или другую сторону. Если эти величины укладываются в данные параметры, то это говорит о нормальном распространении волн возбуждения по сердечной мышце. Увеличение СП против должной величины на 5% расценивают как признак неполноценной функции сердечной мышцы.
Оценка результатов: При нормальном состоянии сердца расхождение между фактической и должной систолой составляет не более 15% в ту или другую сторону. Если эти величины укладываются в данные параметры, то это говорит о нормальном распространении волн возбуждения по сердечной мышце. Увеличение СП против должной величины на 5% расценивают как признак неполноценной функции сердечной мышцы.
 Кровеносные сосуды. Первые кровеносные сосуды появляются в мезенхиме стенки желточного мешка на 2 – 3 –й неделе эмбриогенеза человека, а также в стенке хориона в составе так называемых кровяных островков. Часть мезенхимных клеток по периферии островков теряет связь с клетками, расположенными в центральной части, уплощается и превращается в эндотелиальные клетки первичных кровеносных сосудов. Клетки в центральной части островка округляются, дифференцируются и превращаются в клетки крови. Из мезенхимных клеток, окружающих сосуд, позднее дифференцируются гладкие мышечные клетки, перициты и адвентициальные клетки сосуда, а также фибробласты. В теле зародыша из мезенхимы образуются первичные кровеносные сосуды, имеющие вид трубочек и щелевидных пространств. В конце 3 -й недели внутриутробного развития сосуды тела зародыша начинают сообщаться с сосудами внезародышевых органов. Дальнейшее развитие стенки сосудов происходит после начала циркуляции крови под влиянием тех гемодинамических условий (кровяное давление, скорость кровотока) которые создаются в различных частях тела, что обусловливает появление специфических особенностей строения стенки внутриорганных и внеорганных сосудов. В ходе перестроек первичных сосудов в эмбриогенезе часть из них редуцируется. ____________________ желточный мешок – наиболее древний в эволюции внезародышевый орган, депонирующий питательные вещества (желток), необходимые для развития зародыша. У человека он образован внезародышевой энтодермой и внезародышевой мезодермой (мезенхимой) хорион, или ворсинчатая оболочка, появляется впервые у млекопитающих, развивается из трофобласта и внезародышевой мезодермы
Кровеносные сосуды. Первые кровеносные сосуды появляются в мезенхиме стенки желточного мешка на 2 – 3 –й неделе эмбриогенеза человека, а также в стенке хориона в составе так называемых кровяных островков. Часть мезенхимных клеток по периферии островков теряет связь с клетками, расположенными в центральной части, уплощается и превращается в эндотелиальные клетки первичных кровеносных сосудов. Клетки в центральной части островка округляются, дифференцируются и превращаются в клетки крови. Из мезенхимных клеток, окружающих сосуд, позднее дифференцируются гладкие мышечные клетки, перициты и адвентициальные клетки сосуда, а также фибробласты. В теле зародыша из мезенхимы образуются первичные кровеносные сосуды, имеющие вид трубочек и щелевидных пространств. В конце 3 -й недели внутриутробного развития сосуды тела зародыша начинают сообщаться с сосудами внезародышевых органов. Дальнейшее развитие стенки сосудов происходит после начала циркуляции крови под влиянием тех гемодинамических условий (кровяное давление, скорость кровотока) которые создаются в различных частях тела, что обусловливает появление специфических особенностей строения стенки внутриорганных и внеорганных сосудов. В ходе перестроек первичных сосудов в эмбриогенезе часть из них редуцируется. ____________________ желточный мешок – наиболее древний в эволюции внезародышевый орган, депонирующий питательные вещества (желток), необходимые для развития зародыша. У человека он образован внезародышевой энтодермой и внезародышевой мезодермой (мезенхимой) хорион, или ворсинчатая оболочка, появляется впервые у млекопитающих, развивается из трофобласта и внезародышевой мезодермы

![Возрастная инволюция [1] 1. Возрастная инволюция органов и тканей /В. Х. Хавинсон [и др. Возрастная инволюция [1] 1. Возрастная инволюция органов и тканей /В. Х. Хавинсон [и др.](https://present5.com/presentation/101125458_162916779/image-22.jpg) Возрастная инволюция [1] 1. Возрастная инволюция органов и тканей /В. Х. Хавинсон [и др. ] //Успехи физиологических наук. 2003. – Т. 34, № 1. - С. 78 – 91. Эндотелий представляет собой монослой специализированных клеток, выстилающих изнутри все абсолютно сосуды в организме – от мельчайших капилляров до крупных артерий и вен. Участки эндотелия, выстилающие сосудистое ложе разных органов, имеют анатомическую общность, но при этом существенно различаются по генной и биохимической специфичности, типам рецепторов, набору белков-предшественников, ферментов, трансмиттеров (то же, что и медиаторы). Соответственно физиологические изменения (в том числе и возрастные) в эндотелии коронарных сосудов, легких и мозга протекают по-разному. Особенностями старения эндотелия являются возрастание полиморфизма и увеличение частоты полиплоидных (многоядерных) эндотелиальных клеток. Так, в аорте человека к 35 -40 годам содержание полиплоидных клеток может достигать 30 % от общего количества эндотелиоцитов, что отражает, очевидно, возрастное снижение пролиферативной способности эндотелия. Эндотелиальная выстилка истончается, появляются базальные выросты клеточной мембраны, ядра приобретают фестончатый вид (в виде зубчатого или волокнистого), расширяется перинуклеарное пространство. В цитоплазме эндотелиоцитов увеличивается число лизосом и миелиноподобных структур, степень адгезии клеток снижается, клеточная гибель путем апоптоза учащается, что приводит к очаговым нарушениям целостности эндотелиального пласта. Базальная мембрана эндотелия утолщается и приобретает слоистый вид.
Возрастная инволюция [1] 1. Возрастная инволюция органов и тканей /В. Х. Хавинсон [и др. ] //Успехи физиологических наук. 2003. – Т. 34, № 1. - С. 78 – 91. Эндотелий представляет собой монослой специализированных клеток, выстилающих изнутри все абсолютно сосуды в организме – от мельчайших капилляров до крупных артерий и вен. Участки эндотелия, выстилающие сосудистое ложе разных органов, имеют анатомическую общность, но при этом существенно различаются по генной и биохимической специфичности, типам рецепторов, набору белков-предшественников, ферментов, трансмиттеров (то же, что и медиаторы). Соответственно физиологические изменения (в том числе и возрастные) в эндотелии коронарных сосудов, легких и мозга протекают по-разному. Особенностями старения эндотелия являются возрастание полиморфизма и увеличение частоты полиплоидных (многоядерных) эндотелиальных клеток. Так, в аорте человека к 35 -40 годам содержание полиплоидных клеток может достигать 30 % от общего количества эндотелиоцитов, что отражает, очевидно, возрастное снижение пролиферативной способности эндотелия. Эндотелиальная выстилка истончается, появляются базальные выросты клеточной мембраны, ядра приобретают фестончатый вид (в виде зубчатого или волокнистого), расширяется перинуклеарное пространство. В цитоплазме эндотелиоцитов увеличивается число лизосом и миелиноподобных структур, степень адгезии клеток снижается, клеточная гибель путем апоптоза учащается, что приводит к очаговым нарушениям целостности эндотелиального пласта. Базальная мембрана эндотелия утолщается и приобретает слоистый вид.
 Функциональное состояние сосудов во многом зависит от эластических свойств их стенок. Эластичность стенок сосудов в значительной степени определяется соотношением коллагена и эластина. Так, в аорте человека наиболее высокий уровень эластина отмечается в 20 лет, к 30 годам он снижается на 5 -8%. В легочной артерии, наоборот, количество эластина с 30 лет прогрессивно нарастает к 70— 80 годам. Однако значительно более существенны качественные изменения эластина - сдвиги в его аминокислотном составе. С возрастом в эластине стенки аорты резко увеличивается количество дикарбоновых кислот, в особенности аспарагиновой и глютаминовой. Содержание глицина и пролина в эластине аорты с возрастом снижается. Изменение в аминокислотном составе эластина может объяснить нарастающее с возрастом накопление солей кальция в стенке сосудов. Ионы кальция связываются со свободными карбоксильными группами дикарбоновых кислот и осаждаются в эндотелии в виде фосфата кальция. Следует отметить, что количество коллагена в стенке аорты человека с возрастом не изменяется [2]. В механизме возрастной потери эластичности сосудов важное место занимают изменения физико-химических свойств коллагена. В процессе онтогенеза происходит увеличение внутри- и межмолекулярных связей и соответствующее увеличение жесткости коллагена, что приводит к повышению кристаллизации, уменьшению степени набухания, снижению растворимости коллагена, увеличению диаметра коллагеновых волокон, увеличению их прочности, уменьшению растяжимости Предполагается, что в механизме описанных возрастных изменений молекул коллагена принимают участие тирозин и лизин. Онтогенетические изменения структуры и свойств коллагена оказывают существенное влияние на функциональное состояние сосудов [2].
Функциональное состояние сосудов во многом зависит от эластических свойств их стенок. Эластичность стенок сосудов в значительной степени определяется соотношением коллагена и эластина. Так, в аорте человека наиболее высокий уровень эластина отмечается в 20 лет, к 30 годам он снижается на 5 -8%. В легочной артерии, наоборот, количество эластина с 30 лет прогрессивно нарастает к 70— 80 годам. Однако значительно более существенны качественные изменения эластина - сдвиги в его аминокислотном составе. С возрастом в эластине стенки аорты резко увеличивается количество дикарбоновых кислот, в особенности аспарагиновой и глютаминовой. Содержание глицина и пролина в эластине аорты с возрастом снижается. Изменение в аминокислотном составе эластина может объяснить нарастающее с возрастом накопление солей кальция в стенке сосудов. Ионы кальция связываются со свободными карбоксильными группами дикарбоновых кислот и осаждаются в эндотелии в виде фосфата кальция. Следует отметить, что количество коллагена в стенке аорты человека с возрастом не изменяется [2]. В механизме возрастной потери эластичности сосудов важное место занимают изменения физико-химических свойств коллагена. В процессе онтогенеза происходит увеличение внутри- и межмолекулярных связей и соответствующее увеличение жесткости коллагена, что приводит к повышению кристаллизации, уменьшению степени набухания, снижению растворимости коллагена, увеличению диаметра коллагеновых волокон, увеличению их прочности, уменьшению растяжимости Предполагается, что в механизме описанных возрастных изменений молекул коллагена принимают участие тирозин и лизин. Онтогенетические изменения структуры и свойств коллагена оказывают существенное влияние на функциональное состояние сосудов [2].
 При старении происходит накопление сдвигов в содержании мукополисахаридов в стенке сосудов, что играет определенную роль в развитии атеросклеротического процесса. С возрастом уменьшается скорость обновления мукополисахаридов, накапливается хондроитинсульфат В. В процессе старения существенно увеличивается содержание зольных веществ в стенке сосудов. В первую очередь это связано с накоплением солей кальция и фосфора. Так, в аорте человека, количество кальция растет от 0. 07% (у 2 -4 -летних детей) до 0. 84% (в 60 -69 лет). Особенно резко возрастает содержание кальция после 65 лет. Существуют данные, что к 60 -70 годам количество кальция в аорте человека возрастает более чем в 30 раз, достигая величины свыше 1000 мг% [2]. Важное значение в возникновении сосудистой патологии имеют возрастные изменения липидного обмена в эндотелии сосудистой стенки. Ведущая роль в этом процессе принадлежит активной трансформации холестерина и инфильтрации (процесс проникновения) им стенки сосудов.
При старении происходит накопление сдвигов в содержании мукополисахаридов в стенке сосудов, что играет определенную роль в развитии атеросклеротического процесса. С возрастом уменьшается скорость обновления мукополисахаридов, накапливается хондроитинсульфат В. В процессе старения существенно увеличивается содержание зольных веществ в стенке сосудов. В первую очередь это связано с накоплением солей кальция и фосфора. Так, в аорте человека, количество кальция растет от 0. 07% (у 2 -4 -летних детей) до 0. 84% (в 60 -69 лет). Особенно резко возрастает содержание кальция после 65 лет. Существуют данные, что к 60 -70 годам количество кальция в аорте человека возрастает более чем в 30 раз, достигая величины свыше 1000 мг% [2]. Важное значение в возникновении сосудистой патологии имеют возрастные изменения липидного обмена в эндотелии сосудистой стенки. Ведущая роль в этом процессе принадлежит активной трансформации холестерина и инфильтрации (процесс проникновения) им стенки сосудов.
 По современным представлениям, атеросклероз является основной возрастной патологией сосудов. Долгое время основной теорией возникновения атеросклероза считалась "липидная" теория. Но в 1980 г. Furchgott и Zavadsky обнаружили существование эндотелиального релаксирующего фактора (оксида азота NO), что явилось причиной пересмотра сложившихся представлений в отношении атерогенеза - возникли гипотеза первичной эндотелиальной дисфункции и многофакторная теория развития и прогрессирования атеросклероза как полиорганного, системного процесса. Однако, тем не менее, до сих пор одной из главных причин возникновения атеросклероза считается повышение уровня общего холестерина (ХС) в плазме [3, 4]. По химическому строению ХС представляет собой вторичный циклический одноатомный спирт, который становится компонентом липидов только после его этерификации (этерификация – получение сложных эфиров из кислот и спиртов). К основным факторам риска развития атеросклероза относят повышение содержания в плазме крови липопротеидов низкой, промежуточной и очень низкой плотности (ЛПНП, ЛППП, ЛПОНП соответственно), которые служат переносчиками жирных кислот и синтезируемого в печени ХС к периферическим клеткам. Очевидно, что повышенное содержание указанных липопротеидов предрасполагает к отложению ХС в различных тканях и стенках артерий. ЛПОНП а ЛПНП, попадая в гладкомышечные клетки артериальных стенок при гиперхолинестеринемии, накапливаются в интиме (внутренняя оболочка стенки сосудов), вызывая тем самым структурные изменения артерий, нарушение их сократительной способности и, в свою очередь, изменение реологических свойств крови, повышение уровня фибриногена. Последнее способствует агрегации тромбоцитов и приводит к тромбообразованию. Напротив, ЛПВП захватывают ХС из периферических клеток и транспортируют его в печень, где осуществляется элиминация (элиминация – исключение, удаление, устранение) ХС из организма с желчью с последующим окислением его до желчных кислот. Можно считать установленным, что дислипопротеидемии с повышенным содержанием ХС, входящего в состав ЛПНП и ЛПОНП и соответственно общего ХС, представляют собой факторы повышенного риска заболеваний, связанных с атеросклерозом. Напротив, повышенный уровень ЛПВП сопровождается снижением риска заболеваемости ишемической болезнью сердца (ИБС). Пока не ясно, существует ли какая-либо корреляция между уровнем ХС и атерогенных классов ЛП в сыворотке кровии частотой развития нарушений мозгового кровообращения.
По современным представлениям, атеросклероз является основной возрастной патологией сосудов. Долгое время основной теорией возникновения атеросклероза считалась "липидная" теория. Но в 1980 г. Furchgott и Zavadsky обнаружили существование эндотелиального релаксирующего фактора (оксида азота NO), что явилось причиной пересмотра сложившихся представлений в отношении атерогенеза - возникли гипотеза первичной эндотелиальной дисфункции и многофакторная теория развития и прогрессирования атеросклероза как полиорганного, системного процесса. Однако, тем не менее, до сих пор одной из главных причин возникновения атеросклероза считается повышение уровня общего холестерина (ХС) в плазме [3, 4]. По химическому строению ХС представляет собой вторичный циклический одноатомный спирт, который становится компонентом липидов только после его этерификации (этерификация – получение сложных эфиров из кислот и спиртов). К основным факторам риска развития атеросклероза относят повышение содержания в плазме крови липопротеидов низкой, промежуточной и очень низкой плотности (ЛПНП, ЛППП, ЛПОНП соответственно), которые служат переносчиками жирных кислот и синтезируемого в печени ХС к периферическим клеткам. Очевидно, что повышенное содержание указанных липопротеидов предрасполагает к отложению ХС в различных тканях и стенках артерий. ЛПОНП а ЛПНП, попадая в гладкомышечные клетки артериальных стенок при гиперхолинестеринемии, накапливаются в интиме (внутренняя оболочка стенки сосудов), вызывая тем самым структурные изменения артерий, нарушение их сократительной способности и, в свою очередь, изменение реологических свойств крови, повышение уровня фибриногена. Последнее способствует агрегации тромбоцитов и приводит к тромбообразованию. Напротив, ЛПВП захватывают ХС из периферических клеток и транспортируют его в печень, где осуществляется элиминация (элиминация – исключение, удаление, устранение) ХС из организма с желчью с последующим окислением его до желчных кислот. Можно считать установленным, что дислипопротеидемии с повышенным содержанием ХС, входящего в состав ЛПНП и ЛПОНП и соответственно общего ХС, представляют собой факторы повышенного риска заболеваний, связанных с атеросклерозом. Напротив, повышенный уровень ЛПВП сопровождается снижением риска заболеваемости ишемической болезнью сердца (ИБС). Пока не ясно, существует ли какая-либо корреляция между уровнем ХС и атерогенных классов ЛП в сыворотке кровии частотой развития нарушений мозгового кровообращения.
 Развитие и прогрессирование атеросклероза в значительной мере обусловлено не только атерогенным профилем липопротеидов, но и повышением их концентрации, а также нарушениями, возникающими в свертывающей и противосвертывающей системах крови [3]. Обнаружено, что в интервале от 20 к 50 годам происходит повышение содержания ХС в крови, связанное с возрастным увеличением ХС ЛПОНП, что объясняет усиление процессов атерогенеза именно в этом возрасте. По мнению А. Л. Мясникова и И. В. Давыдовского [5], "атеросклероз - не просто болезнь, а болезнь возраста". Это подтверждается наличием корреляции между уровнем ХС сыворотки крови и прогрессированием облитерирующих (облитерация – заращение просвета) артериопатий нижних конечностей: гистологические исследования сосудистой стенки показали, что, если до 50 лет содержание ХС в сосудистой стенке верхних и нижних конечностей примерно одинаково, то к 70 годам в сосудистой стенке артерий именно нижних конечностей уровень ХС повышается более чем в 2 раза. Для анализа механизмов возникновения и развития атеросклероза представляется целесообразным рассматривать обе основные теории ("липидную" и теорию "ответа на повреждение сосудистой стенки") этиологии этого заболевания, поскольку атерогенез является комплексным процессом [6]. Есть предположение, что дисфункция эндотелия сосудов предшествует атеросклеротическим изменениям в них [7]. По мнению О. А. Гомазкова [8], дисфункцию эндотелия следует понимать как развитие дисбаланса химических регуляторов физиологического равновесия, т. е. нарушение "баланса противоположно действующих начал: усиление-ослабление сосудистого тонуса, агрегация-дезагрегация клеток крови, увеличение-уменьшение числа сосудистых клеток". Следствием возникновения и развития этого дисбаланса является целый ряд заболеваний, в том числе и эндокринные возрастные нарушения.
Развитие и прогрессирование атеросклероза в значительной мере обусловлено не только атерогенным профилем липопротеидов, но и повышением их концентрации, а также нарушениями, возникающими в свертывающей и противосвертывающей системах крови [3]. Обнаружено, что в интервале от 20 к 50 годам происходит повышение содержания ХС в крови, связанное с возрастным увеличением ХС ЛПОНП, что объясняет усиление процессов атерогенеза именно в этом возрасте. По мнению А. Л. Мясникова и И. В. Давыдовского [5], "атеросклероз - не просто болезнь, а болезнь возраста". Это подтверждается наличием корреляции между уровнем ХС сыворотки крови и прогрессированием облитерирующих (облитерация – заращение просвета) артериопатий нижних конечностей: гистологические исследования сосудистой стенки показали, что, если до 50 лет содержание ХС в сосудистой стенке верхних и нижних конечностей примерно одинаково, то к 70 годам в сосудистой стенке артерий именно нижних конечностей уровень ХС повышается более чем в 2 раза. Для анализа механизмов возникновения и развития атеросклероза представляется целесообразным рассматривать обе основные теории ("липидную" и теорию "ответа на повреждение сосудистой стенки") этиологии этого заболевания, поскольку атерогенез является комплексным процессом [6]. Есть предположение, что дисфункция эндотелия сосудов предшествует атеросклеротическим изменениям в них [7]. По мнению О. А. Гомазкова [8], дисфункцию эндотелия следует понимать как развитие дисбаланса химических регуляторов физиологического равновесия, т. е. нарушение "баланса противоположно действующих начал: усиление-ослабление сосудистого тонуса, агрегация-дезагрегация клеток крови, увеличение-уменьшение числа сосудистых клеток". Следствием возникновения и развития этого дисбаланса является целый ряд заболеваний, в том числе и эндокринные возрастные нарушения.
 К основным причинам возникновения дисфункции эндотелия в настоящее время относят гипертензию и курение, достоверно способствующее усилению окисления ХС ЛПНП [9]. Наблюдающееся на этом фоне снижение активности образования липолитических ферментов в эндотелии ускоряет инфильтрацию сосудистой стенки липидами [3]. Данные, полученные при исследовании нарушении регуляции сосудистого тонуса в условиях гиперлипидемии, были положены в основу концепции, согласно которой извращенная вазомоторная реакция эндотелия, проявляющаяся либо в виде спазма артерии, либо в виде отсутствия какой-либо сосудистой реакции, представляет собой инициальный (первоначальный) этап развития атеросклероза [7]. По данным Bilato и Crow [10], на функциональную деятельность и реактивность эндотелия влияют также процессы старения организма. В последнее время появляется всё больше фактов, свидетельствующих о том, что в патогенезе атеросклероза не последнюю роль играют реакции, которые принято относить к воспалительным. Один из ключевых моментов процесса атерогенеза - миграция моноцитов через эндотелий. Активная роль эндотелиальной выстилки сосудов состоит в синтезе так называемых адгезивных молекул, которые, распознавая специфические места связывания на лейкоцитах, направляют их в субэндотелиальный слой. В настоящее время описаны так называемые селектины, из которых на эндотелии экспрессируются Р- и Е-типы, иммуноглобулиноподобные молекулы и некоторые представители семейства интегринов. Показано, что часть этих молекул появляется на эндотелиальной мембране после активации эндо-телиоцита. Стимулом, активирующим выработку адгезивных молекул, могут служить факторы риска атеросклероза, такие как, например, гиперхо-лестеринемия. Существенную роль в активации эндотелиоцитов могут играть компоненты системы комплемента. Действие "комплекса, атакующего мембраны", - конечного продукта каскада активации системы комплемента на эндотелий вызывает секрецию интерлейкина 8, белка хемотаксиса моноцитов-1, экспрессию адгезивных молекул (Р- и Е- селектинов) и секрецию фактора Виллебранда.
К основным причинам возникновения дисфункции эндотелия в настоящее время относят гипертензию и курение, достоверно способствующее усилению окисления ХС ЛПНП [9]. Наблюдающееся на этом фоне снижение активности образования липолитических ферментов в эндотелии ускоряет инфильтрацию сосудистой стенки липидами [3]. Данные, полученные при исследовании нарушении регуляции сосудистого тонуса в условиях гиперлипидемии, были положены в основу концепции, согласно которой извращенная вазомоторная реакция эндотелия, проявляющаяся либо в виде спазма артерии, либо в виде отсутствия какой-либо сосудистой реакции, представляет собой инициальный (первоначальный) этап развития атеросклероза [7]. По данным Bilato и Crow [10], на функциональную деятельность и реактивность эндотелия влияют также процессы старения организма. В последнее время появляется всё больше фактов, свидетельствующих о том, что в патогенезе атеросклероза не последнюю роль играют реакции, которые принято относить к воспалительным. Один из ключевых моментов процесса атерогенеза - миграция моноцитов через эндотелий. Активная роль эндотелиальной выстилки сосудов состоит в синтезе так называемых адгезивных молекул, которые, распознавая специфические места связывания на лейкоцитах, направляют их в субэндотелиальный слой. В настоящее время описаны так называемые селектины, из которых на эндотелии экспрессируются Р- и Е-типы, иммуноглобулиноподобные молекулы и некоторые представители семейства интегринов. Показано, что часть этих молекул появляется на эндотелиальной мембране после активации эндо-телиоцита. Стимулом, активирующим выработку адгезивных молекул, могут служить факторы риска атеросклероза, такие как, например, гиперхо-лестеринемия. Существенную роль в активации эндотелиоцитов могут играть компоненты системы комплемента. Действие "комплекса, атакующего мембраны", - конечного продукта каскада активации системы комплемента на эндотелий вызывает секрецию интерлейкина 8, белка хемотаксиса моноцитов-1, экспрессию адгезивных молекул (Р- и Е- селектинов) и секрецию фактора Виллебранда.
 Эндотелий осуществляет и синтез целого ряда факторов роста, участвующих в формировании атеросклеротического поражения. Увеличение их продукции также происходит под действием медиаторов воспаления и факторов риска атеросклероза. В течение последних лет ведется поиск инфекционного агента (или агентов), ответственных за инициацию воспаления. Главным кандидатом на сегодняшний день является Chlamydia pneumoniae. Хламидии могут размножаться внутри эндотелиальных клеток и макрофагов, вызывая локальное воспаление и активацию атеросклеротического процесса. Применение соответствующей антибактериальной терапии улучшает клиническое течение ишемической болезни сердца [11].
Эндотелий осуществляет и синтез целого ряда факторов роста, участвующих в формировании атеросклеротического поражения. Увеличение их продукции также происходит под действием медиаторов воспаления и факторов риска атеросклероза. В течение последних лет ведется поиск инфекционного агента (или агентов), ответственных за инициацию воспаления. Главным кандидатом на сегодняшний день является Chlamydia pneumoniae. Хламидии могут размножаться внутри эндотелиальных клеток и макрофагов, вызывая локальное воспаление и активацию атеросклеротического процесса. Применение соответствующей антибактериальной терапии улучшает клиническое течение ишемической болезни сердца [11].
 Список литературы 2. Возрастная физиология //Руководство /Отв. Ред. В. Н. Черниговский. - Л. : Наука, 1975. – 692 с. 3. Мякотных, В. С. Современное состояние проблемы атерорсклероза /В. С. Мякотных, Боровкова, Т. А. //Успехи геронтологии. – 2000. – Вып. 4. – С. 112 – 118. 4. Dyker, G. Influence of cholesterol on survival after stroke: retrospective study /G. Dyker, J. Weir, R. Leer //Brit. Med. J. – 1997. - № 314. – P. 1584 – 1588. 5. Мясников, А. Л. Гипертоническая болезнь и атеросклероз /А. Л. Мясников, И. В. Давыдовский. – М. : Медицина, 1965. – 615 с. 6. Горев, Н. Н. Возраст, гипертензия м атеросклероз /Н. Н. Горев, Л. П. Черкасский. – М. : Медицина, 1988. – 175 с. 7. Затейщикова, А. А. Эндотелиальная регуляция сосудистого тонуса: методы исследования и клиническое значение /А. А. Затейщикова, Д. А. Затейщиков //Кардиология. – 1998. - № 9. – С. 68 – 80. 8. Гомазков, О. А. Эндотелий – «эндокринное дерево» /О. А. Гомазков //Природа. – 2000. - № 5. – С. 38 – 46. 9. Иванова, О. В. Эндотелиальная дисфункция – важный этап развития атеросклеротического поражения сосудов (обзор литературы) /О. В. Иванова, Г. Н. Соболева, Ю. А. Карпов //Тер. арх. - 1997. - № 6. – С. 75 – 78. 10. Bilato, C. Atherosclerosis and the vascular biology of aging /C. Bilato, M. T. Grow //Clin. And Exp. Res. – 1996. - № 4. - Р. 221 – 234. 11. Сидоренко, Б. А. Дисфункция эндотелия в патогенезе атеросклероза и его осложнений /Б. А. Сидоренко, Д. А. Затейщиков //Кремлевская медицина. Клин. вестник. – 1999. - № 2. – С. 69 – 74.
Список литературы 2. Возрастная физиология //Руководство /Отв. Ред. В. Н. Черниговский. - Л. : Наука, 1975. – 692 с. 3. Мякотных, В. С. Современное состояние проблемы атерорсклероза /В. С. Мякотных, Боровкова, Т. А. //Успехи геронтологии. – 2000. – Вып. 4. – С. 112 – 118. 4. Dyker, G. Influence of cholesterol on survival after stroke: retrospective study /G. Dyker, J. Weir, R. Leer //Brit. Med. J. – 1997. - № 314. – P. 1584 – 1588. 5. Мясников, А. Л. Гипертоническая болезнь и атеросклероз /А. Л. Мясников, И. В. Давыдовский. – М. : Медицина, 1965. – 615 с. 6. Горев, Н. Н. Возраст, гипертензия м атеросклероз /Н. Н. Горев, Л. П. Черкасский. – М. : Медицина, 1988. – 175 с. 7. Затейщикова, А. А. Эндотелиальная регуляция сосудистого тонуса: методы исследования и клиническое значение /А. А. Затейщикова, Д. А. Затейщиков //Кардиология. – 1998. - № 9. – С. 68 – 80. 8. Гомазков, О. А. Эндотелий – «эндокринное дерево» /О. А. Гомазков //Природа. – 2000. - № 5. – С. 38 – 46. 9. Иванова, О. В. Эндотелиальная дисфункция – важный этап развития атеросклеротического поражения сосудов (обзор литературы) /О. В. Иванова, Г. Н. Соболева, Ю. А. Карпов //Тер. арх. - 1997. - № 6. – С. 75 – 78. 10. Bilato, C. Atherosclerosis and the vascular biology of aging /C. Bilato, M. T. Grow //Clin. And Exp. Res. – 1996. - № 4. - Р. 221 – 234. 11. Сидоренко, Б. А. Дисфункция эндотелия в патогенезе атеросклероза и его осложнений /Б. А. Сидоренко, Д. А. Затейщиков //Кремлевская медицина. Клин. вестник. – 1999. - № 2. – С. 69 – 74.
 ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ СОСУДИСТОЙ СИСТЕМЫ Все сосуды в зависимости от выполняемой ими функции можно подразделить на шесть групп: • Амортизирующие сосуды (сосуды эластического типа). • Резистивные сосуды. • Сосуды - сфинктеры. • Обменные сосуды. • Емкостные сосуды. • Шунтирующие сосуды. АМОРТИЗИРУЮЩИЕ СОСУДЫ. К этим сосудам относятся артерии эластического типа с относительно большим содержанием эластических волокон, такие, как аорта, легочная артерия и прилегающие к ним участки больших артерий. Выраженные эластические свойства таких сосудов, в частности аорты, обусловливают амортизирующий эффект, который заключается в амортизации (сглаживании) периодических систолических волн кровотока. РЕЗИСТИВНЫЕ СОСУДЫ. К ним относятся концевые артерии, артериолы и в меньшей степени капилляры и венулы. Именно концевые артерии и артериолы, т. е. прекапиллярные сосуды, имеющие малый просвет и толстые стенки с развитой гладкой мускулатурой, оказывают наибольшее сопротивление кровотоку. Изменения стенок сокращения мышечных волокон этих сосудов приводят к отчетливым изменениям их диаметра и, следовательно, общей площади поперечного сечения (когда речь идет о многочисленных артериолах).
ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ СОСУДИСТОЙ СИСТЕМЫ Все сосуды в зависимости от выполняемой ими функции можно подразделить на шесть групп: • Амортизирующие сосуды (сосуды эластического типа). • Резистивные сосуды. • Сосуды - сфинктеры. • Обменные сосуды. • Емкостные сосуды. • Шунтирующие сосуды. АМОРТИЗИРУЮЩИЕ СОСУДЫ. К этим сосудам относятся артерии эластического типа с относительно большим содержанием эластических волокон, такие, как аорта, легочная артерия и прилегающие к ним участки больших артерий. Выраженные эластические свойства таких сосудов, в частности аорты, обусловливают амортизирующий эффект, который заключается в амортизации (сглаживании) периодических систолических волн кровотока. РЕЗИСТИВНЫЕ СОСУДЫ. К ним относятся концевые артерии, артериолы и в меньшей степени капилляры и венулы. Именно концевые артерии и артериолы, т. е. прекапиллярные сосуды, имеющие малый просвет и толстые стенки с развитой гладкой мускулатурой, оказывают наибольшее сопротивление кровотоку. Изменения стенок сокращения мышечных волокон этих сосудов приводят к отчетливым изменениям их диаметра и, следовательно, общей площади поперечного сечения (когда речь идет о многочисленных артериолах).
 СОСУДЫ СФИНКТЕРЫ. От сужения или расширения сфинктеров последних отделов прекапиллярных артериол - зависит число функционирующих капилляров, т. е. площадь обменной поверхности капилляров. ОБМЕННЫЕ СОСУДЫ. К этим сосудам относятся капилляры. Именно в них происходят такие важнейшие процессы, как диффузия и фильтрация. Капилляры не способны к сокращениям; диаметр их изменяется пассивно вслед за колебаниями в пре- и посткапиллярных сосудах. Диффузия и фильтрация происходят также в венулах, которые следует поэтому относить к обменным сосудам. Необходимо отметить, что основой гематоэнцефалического барьера является непрерывный эндотелий капилляров (мы уже говорили о капиллярах с непрерывным эндотелием). Этот гематоэнцефалический барьер надежно изолирует мозг от временных изменений состава крови. ЕМКОСТНЫЕ СОСУДЫ. Емкостные сосуды - это главным образом вены. Благодаря своей высокой растяжимости вены способны вмещать или выбрасывать большие объемы крови без существенного влияния на другие параметры кровотока. В связи с этим они могут играть роль резервуаров крови. Некоторые вены при низком внутрисосудистом давлении уплощены (т. е. имеют овальный просвет) и поэтому могут вмещать некоторый дополнительный объем, не растягиваясь, а лишь приобретая более цилиндрическую форму.
СОСУДЫ СФИНКТЕРЫ. От сужения или расширения сфинктеров последних отделов прекапиллярных артериол - зависит число функционирующих капилляров, т. е. площадь обменной поверхности капилляров. ОБМЕННЫЕ СОСУДЫ. К этим сосудам относятся капилляры. Именно в них происходят такие важнейшие процессы, как диффузия и фильтрация. Капилляры не способны к сокращениям; диаметр их изменяется пассивно вслед за колебаниями в пре- и посткапиллярных сосудах. Диффузия и фильтрация происходят также в венулах, которые следует поэтому относить к обменным сосудам. Необходимо отметить, что основой гематоэнцефалического барьера является непрерывный эндотелий капилляров (мы уже говорили о капиллярах с непрерывным эндотелием). Этот гематоэнцефалический барьер надежно изолирует мозг от временных изменений состава крови. ЕМКОСТНЫЕ СОСУДЫ. Емкостные сосуды - это главным образом вены. Благодаря своей высокой растяжимости вены способны вмещать или выбрасывать большие объемы крови без существенного влияния на другие параметры кровотока. В связи с этим они могут играть роль резервуаров крови. Некоторые вены при низком внутрисосудистом давлении уплощены (т. е. имеют овальный просвет) и поэтому могут вмещать некоторый дополнительный объем, не растягиваясь, а лишь приобретая более цилиндрическую форму.
 Некоторые вены отличаются особенно высокой емкостью как резервуары крови, что связано с их анатомическим строением. К таким венам относятся прежде всего: вены печени; крупные вены чревной области; вены подсосочкового сплетения. Вместе эти вены могут удерживать более 1000 мл крови, которая выбрасывается при необходимости. Кратковременное депонирование и выброс достаточно больших количеств крови могут осуществляться также легочными венами, соединенными с системным кровообращением параллельно. При этом изменяется венозный возврат к правому сердцу и/или выброс левого сердца. В замкнутой сосудистой системе изменения емкости какого-либо отдела обязательно сопровождаются перераспределением объема крови. Поэтому изменения емкости вен, наступающие при сокращениях гладких мышц, влияют на распределение крови во всей кровеносной системе и тем самым прямо или косвенно на общую функцию кровообращения. ШУНТИРУЮЩИЕ СОСУДЫ - это артериовенозные анастомозы, которые имеются во многих тканях, особенно много их в коже акральных участков (пальцев рук и ног и мочки уха). Когда эти сосуды открыты, кровоток через капилляры либо уменьшается, либо полностью прекращается. В настоящее время многие исследователи выделяют резорбтивные сосуды – лимфатические сосуды.
Некоторые вены отличаются особенно высокой емкостью как резервуары крови, что связано с их анатомическим строением. К таким венам относятся прежде всего: вены печени; крупные вены чревной области; вены подсосочкового сплетения. Вместе эти вены могут удерживать более 1000 мл крови, которая выбрасывается при необходимости. Кратковременное депонирование и выброс достаточно больших количеств крови могут осуществляться также легочными венами, соединенными с системным кровообращением параллельно. При этом изменяется венозный возврат к правому сердцу и/или выброс левого сердца. В замкнутой сосудистой системе изменения емкости какого-либо отдела обязательно сопровождаются перераспределением объема крови. Поэтому изменения емкости вен, наступающие при сокращениях гладких мышц, влияют на распределение крови во всей кровеносной системе и тем самым прямо или косвенно на общую функцию кровообращения. ШУНТИРУЮЩИЕ СОСУДЫ - это артериовенозные анастомозы, которые имеются во многих тканях, особенно много их в коже акральных участков (пальцев рук и ног и мочки уха). Когда эти сосуды открыты, кровоток через капилляры либо уменьшается, либо полностью прекращается. В настоящее время многие исследователи выделяют резорбтивные сосуды – лимфатические сосуды.
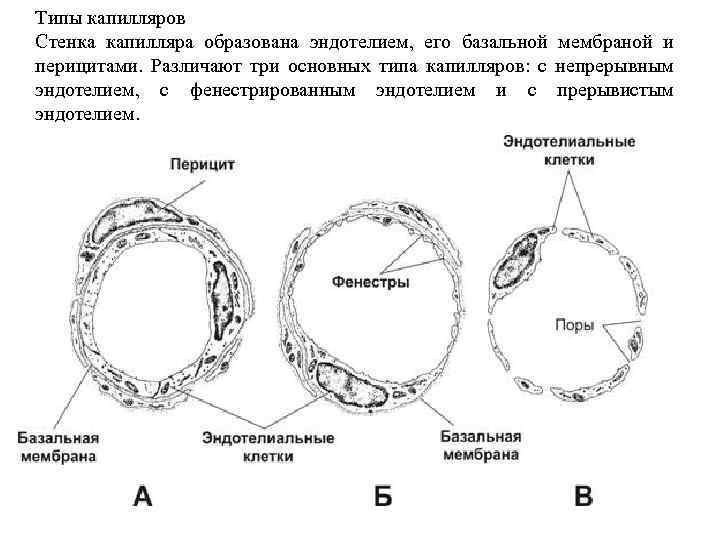 Типы капилляров Стенка капилляра образована эндотелием, его базальной мембраной и перицитами. Различают три основных типа капилляров: с непрерывным эндотелием, с фенестрированным эндотелием и с прерывистым эндотелием.
Типы капилляров Стенка капилляра образована эндотелием, его базальной мембраной и перицитами. Различают три основных типа капилляров: с непрерывным эндотелием, с фенестрированным эндотелием и с прерывистым эндотелием.
 Капилляры с непрерывным эндотелием — наиболее распространённый тип. Диаметр их просвета менее 10 мкм. Эндотелиальные клетки связаны при помощи плотных контактов, содержат множество пиноцитозных пузырьков, участвующих в транспорте метаболитов между кровью и тканями. Капилляры этого типа характерны для мышц. Капилляры с фенестрированным эндотелием присутствуют в капиллярных клубочках почки, эндокринных железах, ворсинках кишки, в эндокринной части поджелудочной железы. Фенестра — истончённый участок эндотелиальной клетки диаметром 50– 80 нм. Предполагают, что фенестры облегчают транспорт веществ через эндотелий. Наиболее чётко фенестры видны на электронограммах капилляров почечных телец. Капилляр с прерывистым эндотелием называют также капилляром синусоидного типа, или синусоидом. Подобный тип капилляров присутствует в кроветворных органах, состоит из эндотелиальных клеток с щелями между ними и прерывистой базальной мембраны.
Капилляры с непрерывным эндотелием — наиболее распространённый тип. Диаметр их просвета менее 10 мкм. Эндотелиальные клетки связаны при помощи плотных контактов, содержат множество пиноцитозных пузырьков, участвующих в транспорте метаболитов между кровью и тканями. Капилляры этого типа характерны для мышц. Капилляры с фенестрированным эндотелием присутствуют в капиллярных клубочках почки, эндокринных железах, ворсинках кишки, в эндокринной части поджелудочной железы. Фенестра — истончённый участок эндотелиальной клетки диаметром 50– 80 нм. Предполагают, что фенестры облегчают транспорт веществ через эндотелий. Наиболее чётко фенестры видны на электронограммах капилляров почечных телец. Капилляр с прерывистым эндотелием называют также капилляром синусоидного типа, или синусоидом. Подобный тип капилляров присутствует в кроветворных органах, состоит из эндотелиальных клеток с щелями между ними и прерывистой базальной мембраны.
 Гематоэнцефалический барьер надёжно изолирует мозг от временных изменений состава крови. Непрерывный эндотелий капилляров — основа гематоэнцефалического барьера: эндотелиальные клетки связаны при помощи непрерывных цепочек плотных контактов. Снаружи эндотелиальная трубка покрыта базальной мембраной. Капилляры почти полностью окружены отростками астроцитов. Гематоэнцефалический барьер функционирует как избирательный фильтр. Наибольшей проницаемостью обладают вещества, растворимые в липидах (например, никотин, этиловый спирт, героин). Глюкоза транспортируется из крови в мозг при помощи соответствующих транспортёров. Особое значение для мозга имеет система транспорта тормозного нейромедиатора — аминокислоты глицина. Его концентрация в непосредственной близости от нейронов должна быть значительно ниже, чем в крови. Эти различия в концентрации глицина обеспечивают транспортные системы эндотелия.
Гематоэнцефалический барьер надёжно изолирует мозг от временных изменений состава крови. Непрерывный эндотелий капилляров — основа гематоэнцефалического барьера: эндотелиальные клетки связаны при помощи непрерывных цепочек плотных контактов. Снаружи эндотелиальная трубка покрыта базальной мембраной. Капилляры почти полностью окружены отростками астроцитов. Гематоэнцефалический барьер функционирует как избирательный фильтр. Наибольшей проницаемостью обладают вещества, растворимые в липидах (например, никотин, этиловый спирт, героин). Глюкоза транспортируется из крови в мозг при помощи соответствующих транспортёров. Особое значение для мозга имеет система транспорта тормозного нейромедиатора — аминокислоты глицина. Его концентрация в непосредственной близости от нейронов должна быть значительно ниже, чем в крови. Эти различия в концентрации глицина обеспечивают транспортные системы эндотелия.
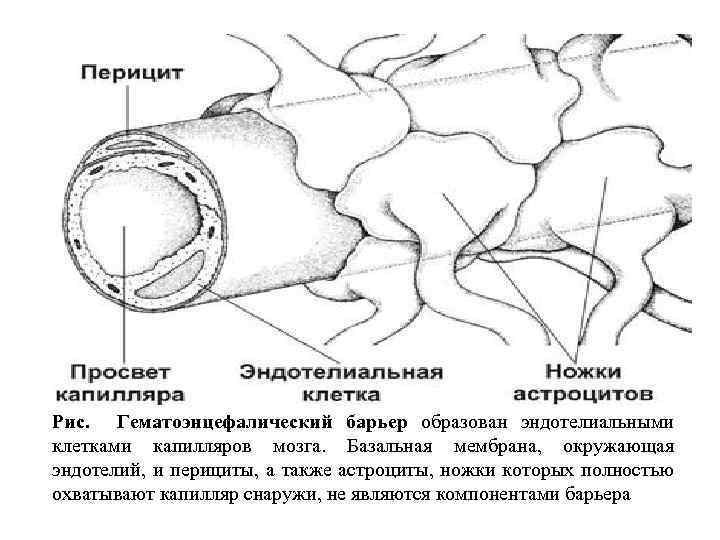 Рис. Гематоэнцефалический барьер образован эндотелиальными клетками капилляров мозга. Базальная мембрана, окружающая эндотелий, и перициты, а также астроциты, ножки которых полностью охватывают капилляр снаружи, не являются компонентами барьера
Рис. Гематоэнцефалический барьер образован эндотелиальными клетками капилляров мозга. Базальная мембрана, окружающая эндотелий, и перициты, а также астроциты, ножки которых полностью охватывают капилляр снаружи, не являются компонентами барьера
 Регуляция деятельности сердца Частота сердечных сокращений регулируется вегетативными центрами продолговатого и спинного мозга. Парасимпатические (блуждающие) нервы уменьшают их ритм и силу, а симпатические увеличивают, особенно при физических и эмоциональных нагрузках. Подобное действие на сердце оказывает и гормон надпочечников адреналин. Хеморецепторы каротидных телец реагируют на снижение уровня кислорода и повышение углекислого газа в крови, вследствие чего возникает тахикардия. Барорецепторы каротидного синуса посылают сигналы по афферентным нервам в сосудодвигательный и сердечный центры продолговатого мозга. Давление крови Артериальное давление измеряется двумя цифрами. Систолическое, или максимальное, давление соответствует выбросу крови в аорту; диастолическое, или минимальное, давление соответствует закрытию аортального клапана и расслаблению желудочков. Эластичность крупных артерий позволяет им пассивно расширяться, а сокращение мышечного слоя - поддерживать поток артериальной крови во время диастолы. Потеря эластичности с возрастом сопровождается повышением давления. Кровяное давление измеряется при помощи сфигмоманометра, в миллиметрах рт. ст. У взрослого здорового человека в расслабленном состоянии, в положении сидя или лежа систолическое давление составляет примерно 120 -130 мм рт. ст. , а диастолическое - 70 -80 мм рт. ст. С возрастом эти цифры возрастают. В вертикальном положении кровяное давление немного повышается вследствие нервно-рефлекторного сокращения мелких кровеносных сосудов.
Регуляция деятельности сердца Частота сердечных сокращений регулируется вегетативными центрами продолговатого и спинного мозга. Парасимпатические (блуждающие) нервы уменьшают их ритм и силу, а симпатические увеличивают, особенно при физических и эмоциональных нагрузках. Подобное действие на сердце оказывает и гормон надпочечников адреналин. Хеморецепторы каротидных телец реагируют на снижение уровня кислорода и повышение углекислого газа в крови, вследствие чего возникает тахикардия. Барорецепторы каротидного синуса посылают сигналы по афферентным нервам в сосудодвигательный и сердечный центры продолговатого мозга. Давление крови Артериальное давление измеряется двумя цифрами. Систолическое, или максимальное, давление соответствует выбросу крови в аорту; диастолическое, или минимальное, давление соответствует закрытию аортального клапана и расслаблению желудочков. Эластичность крупных артерий позволяет им пассивно расширяться, а сокращение мышечного слоя - поддерживать поток артериальной крови во время диастолы. Потеря эластичности с возрастом сопровождается повышением давления. Кровяное давление измеряется при помощи сфигмоманометра, в миллиметрах рт. ст. У взрослого здорового человека в расслабленном состоянии, в положении сидя или лежа систолическое давление составляет примерно 120 -130 мм рт. ст. , а диастолическое - 70 -80 мм рт. ст. С возрастом эти цифры возрастают. В вертикальном положении кровяное давление немного повышается вследствие нервно-рефлекторного сокращения мелких кровеносных сосудов.


