b527600fe9b8401e5a30d69682c20557.ppt
- Количество слайдов: 74

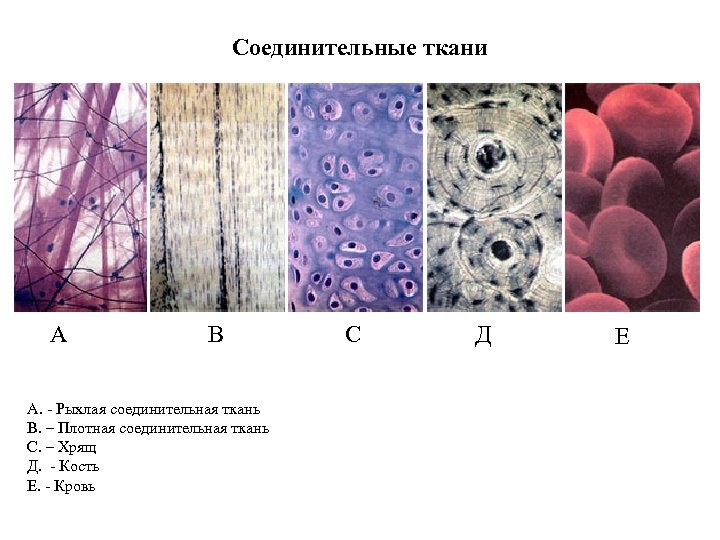 Соединительные ткани А В А. Рыхлая соединительная ткань В. – Плотная соединительная ткань С. – Хрящ Д. Кость Е. Кровь С Д Е
Соединительные ткани А В А. Рыхлая соединительная ткань В. – Плотная соединительная ткань С. – Хрящ Д. Кость Е. Кровь С Д Е
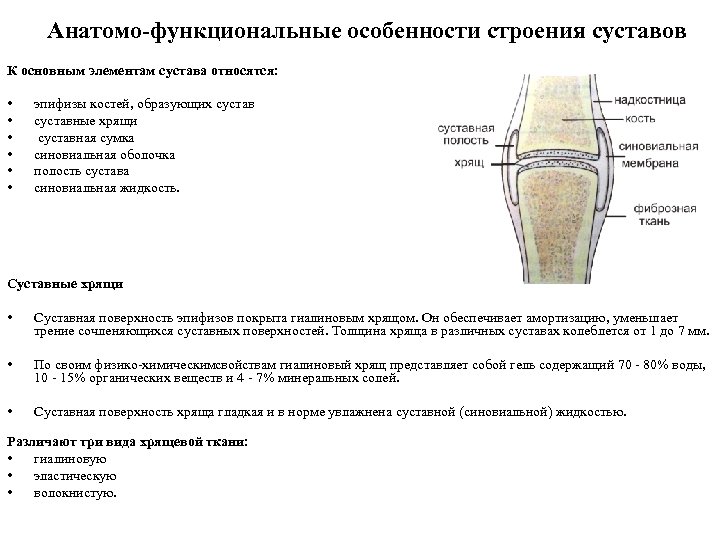 Анатомо-функциональные особенности строения суставов К основным элементам сустава относятся: • • • эпифизы костей, образующих суставные хрящи суставная сумка синовиальная оболочка полость сустава синовиальная жидкость. Суставные хрящи • • • Суставная поверхность эпифизов покрыта гиалиновым хрящом. Он обеспечивает амортизацию, уменьшает трение сочленяющихся суставных поверхностей. Толщина хряща в различных суставах колеблется от 1 до 7 мм. По своим физико химическим свойствам гиалиновый хрящ представляет собой гель содержащий 70 80% воды, 10 15% органических веществ и 4 7% минеральных солей. Суставная поверхность хряща гладкая и в норме увлажнена суставной (синовиальной) жидкостью. Различают три вида хрящевой ткани: • гиалиновую • эластическую • волокнистую.
Анатомо-функциональные особенности строения суставов К основным элементам сустава относятся: • • • эпифизы костей, образующих суставные хрящи суставная сумка синовиальная оболочка полость сустава синовиальная жидкость. Суставные хрящи • • • Суставная поверхность эпифизов покрыта гиалиновым хрящом. Он обеспечивает амортизацию, уменьшает трение сочленяющихся суставных поверхностей. Толщина хряща в различных суставах колеблется от 1 до 7 мм. По своим физико химическим свойствам гиалиновый хрящ представляет собой гель содержащий 70 80% воды, 10 15% органических веществ и 4 7% минеральных солей. Суставная поверхность хряща гладкая и в норме увлажнена суставной (синовиальной) жидкостью. Различают три вида хрящевой ткани: • гиалиновую • эластическую • волокнистую.
 Анатомо-функциональные особенности строения суставов Синовиальная оболочка • выстилает всю поверхность суставной полости и связки, расположенные в суставе, за исключением хрящевых участков. • продуцирует синовиальную жидкость • обеспечивает обмен веществ в полости сустава, питание суставного хряща, дополнительную амортизацию суставов, повышает подвижности эпифизов. Синовиальная жидкость • В норме в суставной полости содержится (в зависимости от размера суставов от 0, 1 до 4 мл) синовиальная жидкость. Синовиальная жидкость: • уменьшает взаимное трение, увеличивает сцепление суставных поверхностей, повышает подвижность • обеспечивает питание суставного хряща • служит дополнительным амортизатором.
Анатомо-функциональные особенности строения суставов Синовиальная оболочка • выстилает всю поверхность суставной полости и связки, расположенные в суставе, за исключением хрящевых участков. • продуцирует синовиальную жидкость • обеспечивает обмен веществ в полости сустава, питание суставного хряща, дополнительную амортизацию суставов, повышает подвижности эпифизов. Синовиальная жидкость • В норме в суставной полости содержится (в зависимости от размера суставов от 0, 1 до 4 мл) синовиальная жидкость. Синовиальная жидкость: • уменьшает взаимное трение, увеличивает сцепление суставных поверхностей, повышает подвижность • обеспечивает питание суставного хряща • служит дополнительным амортизатором.
 Анатомо-функциональные особенности строения суставов Краткая характеристика клеток хрящевой ткани • Хондробласты – небольшие уплощенные клетки, способные делиться и синтезировать межклеточное вещество. Происходящий при этом рост хряща называется периферическим, или аппозиционным, т. е. путем «наложения» новых слоев хряща. • Хондроциты имеют больший размер и овальную форму, образуют изогенные группы из 2 6 клеток. Они лежат в особых полостях межклеточного вещества – лакунах. • Хондроциты участвуют в регуляции синтеза (анаболизм) и деградации (катаболизм) компонентов хрящевого матрикса, которые в норме находятся в сбалансированном состоянии. • За счёт деятельности хондроцитов происходит увеличение массы хряща изнутри интерстициальный рост. Краткая характеристика межклеточного вещества • Межклеточное вещество состоит из волокон и основного, или аморфного, вещества. Большинство волокон представлено коллагеновыми волокнами, а в эластических хрящах – еще и эластическими волокнами, находящимися в гидратированном геле из гликозаминогликанов и протеогликанов.
Анатомо-функциональные особенности строения суставов Краткая характеристика клеток хрящевой ткани • Хондробласты – небольшие уплощенные клетки, способные делиться и синтезировать межклеточное вещество. Происходящий при этом рост хряща называется периферическим, или аппозиционным, т. е. путем «наложения» новых слоев хряща. • Хондроциты имеют больший размер и овальную форму, образуют изогенные группы из 2 6 клеток. Они лежат в особых полостях межклеточного вещества – лакунах. • Хондроциты участвуют в регуляции синтеза (анаболизм) и деградации (катаболизм) компонентов хрящевого матрикса, которые в норме находятся в сбалансированном состоянии. • За счёт деятельности хондроцитов происходит увеличение массы хряща изнутри интерстициальный рост. Краткая характеристика межклеточного вещества • Межклеточное вещество состоит из волокон и основного, или аморфного, вещества. Большинство волокон представлено коллагеновыми волокнами, а в эластических хрящах – еще и эластическими волокнами, находящимися в гидратированном геле из гликозаминогликанов и протеогликанов.
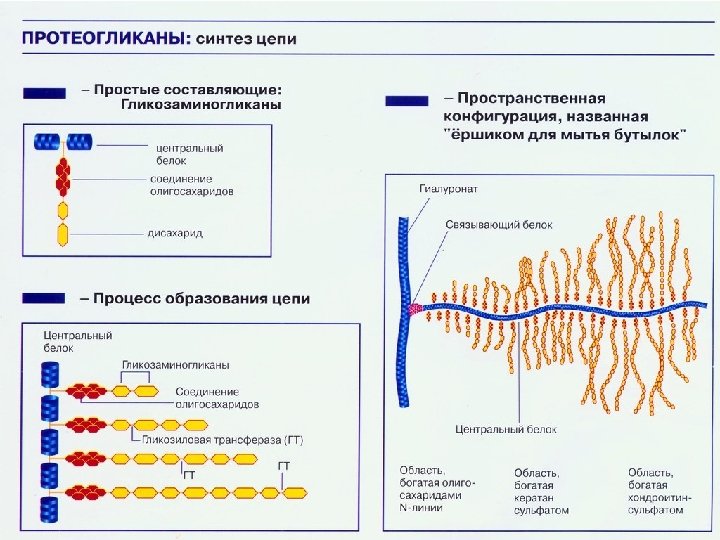
 Характеристика межклеточного вещества Протеогликаны – крупные макромолекулы, состоящие из многочисленных цепочек гликозаминогликанов и олигосахаридов, прикрепленных к центральному протеиновому ядру. Роль протеогликанов: • каркас для коллагена • обеспечение связи воды и катионов с образованием эластичного слоя, который смазывает и защищает хрящ. К гликозаминогликанам относятся: • кератансульфат • дерматансульфат • гепарансульфат • хондроитинсульфат и гиалуроновая кислота
Характеристика межклеточного вещества Протеогликаны – крупные макромолекулы, состоящие из многочисленных цепочек гликозаминогликанов и олигосахаридов, прикрепленных к центральному протеиновому ядру. Роль протеогликанов: • каркас для коллагена • обеспечение связи воды и катионов с образованием эластичного слоя, который смазывает и защищает хрящ. К гликозаминогликанам относятся: • кератансульфат • дерматансульфат • гепарансульфат • хондроитинсульфат и гиалуроновая кислота
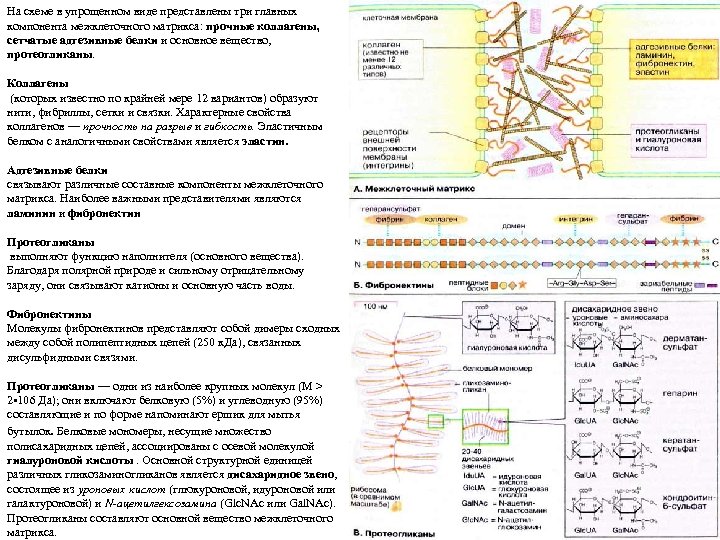 На схеме в упрощенном виде представлены три главных компонента межклеточного матрикса: прочные коллагены, сетчатые адгезивные белки и основное вещество, протеогликаны. Коллагены (которых известно по крайней мере 12 вариантов) образуют нити, фибриллы, сетки и связки. Характерные свойства коллагенов — прочность на разрыв и гибкость. Эластичным белком с аналогичными свойствами является эластин. Адгезивные белки связывают различные составные компоненты межклеточного матрикса. Наиболее важными представителями являются ламинин и фибронектин Протеогликаны выполняют функцию наполнителя (основного вещества). Благодаря полярной природе и сильному отрицательному заряду, они связывают катионы и основную часть воды. Фибронектины Молекулы фибронектинов представляют собой димеры сходных между собой полипептидных цепей (250 к. Да), связанных дисульфидными связями. Протеогликаны — одни из наиболее крупных молекул (М > 2 • 106 Да); они включают белковую (5%) и углеводную (95%) составляющие и по форме напоминают ершик для мытья бутылок. Белковые мономеры, несущие множество полисахаридных цепей, ассоциированы с осевой молекулой гиалуроновой кислоты. Основной структурной единицей различных гликозаминогликанов является дисахаридное звено, состоящее из уроновых кислот (глюкуроновой, идуроновой или галактуроновой) и N-ацетилгексозамина (Glc. NAc или Gal. NAc). Протеогликаны составляют основной вещество межклеточного матрикса.
На схеме в упрощенном виде представлены три главных компонента межклеточного матрикса: прочные коллагены, сетчатые адгезивные белки и основное вещество, протеогликаны. Коллагены (которых известно по крайней мере 12 вариантов) образуют нити, фибриллы, сетки и связки. Характерные свойства коллагенов — прочность на разрыв и гибкость. Эластичным белком с аналогичными свойствами является эластин. Адгезивные белки связывают различные составные компоненты межклеточного матрикса. Наиболее важными представителями являются ламинин и фибронектин Протеогликаны выполняют функцию наполнителя (основного вещества). Благодаря полярной природе и сильному отрицательному заряду, они связывают катионы и основную часть воды. Фибронектины Молекулы фибронектинов представляют собой димеры сходных между собой полипептидных цепей (250 к. Да), связанных дисульфидными связями. Протеогликаны — одни из наиболее крупных молекул (М > 2 • 106 Да); они включают белковую (5%) и углеводную (95%) составляющие и по форме напоминают ершик для мытья бутылок. Белковые мономеры, несущие множество полисахаридных цепей, ассоциированы с осевой молекулой гиалуроновой кислоты. Основной структурной единицей различных гликозаминогликанов является дисахаридное звено, состоящее из уроновых кислот (глюкуроновой, идуроновой или галактуроновой) и N-ацетилгексозамина (Glc. NAc или Gal. NAc). Протеогликаны составляют основной вещество межклеточного матрикса.
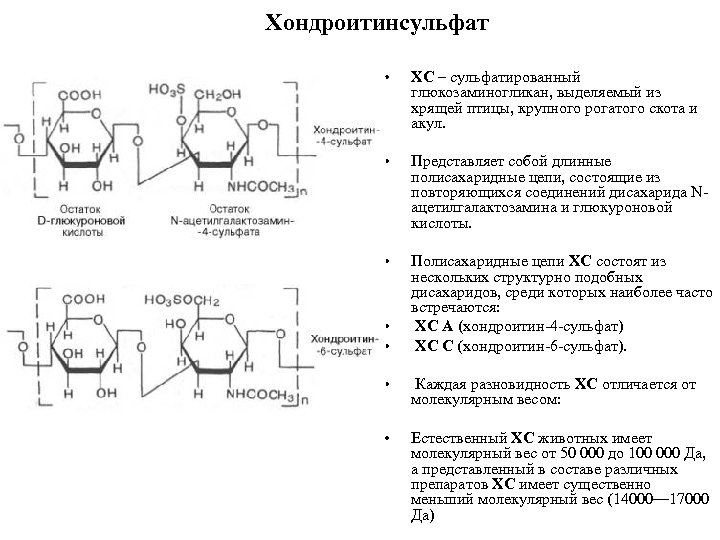 Хондроитинсульфат • ХС – сульфатированный глюкозаминогликан, выделяемый из хрящей птицы, крупного рогатого скота и акул. • Представляет собой длинные полисахаридные цепи, состоящие из повторяющихся соединений дисахарида N ацетилгалактозамина и глюкуроновой кислоты. • Полисахаридные цепи ХС состоят из нескольких структурно подобных дисахаридов, среди которых наиболее часто встречаются: ХС А (хондроитин 4 сульфат) ХС C (хондроитин 6 сульфат). • • • Каждая разновидность ХС отличается от молекулярным весом: • Естественный ХС животных имеет молекулярный вес от 50 000 до 100 000 Да, а представленный в составе различных препаратов ХС имеет существенно меньший молекулярный вес (14000— 17000 Да)
Хондроитинсульфат • ХС – сульфатированный глюкозаминогликан, выделяемый из хрящей птицы, крупного рогатого скота и акул. • Представляет собой длинные полисахаридные цепи, состоящие из повторяющихся соединений дисахарида N ацетилгалактозамина и глюкуроновой кислоты. • Полисахаридные цепи ХС состоят из нескольких структурно подобных дисахаридов, среди которых наиболее часто встречаются: ХС А (хондроитин 4 сульфат) ХС C (хондроитин 6 сульфат). • • • Каждая разновидность ХС отличается от молекулярным весом: • Естественный ХС животных имеет молекулярный вес от 50 000 до 100 000 Да, а представленный в составе различных препаратов ХС имеет существенно меньший молекулярный вес (14000— 17000 Да)
 Обмен веществ и энергии • Все происходящие в организме преобразования вещества и энергии объединены общим названием метаболизм (обмен веществ). • На клеточном уровне эти преобразования осуществляются через сложные последовательности реакций, называемые путями метаболизма, которые могут включать тысячи разнообразных реакций.
Обмен веществ и энергии • Все происходящие в организме преобразования вещества и энергии объединены общим названием метаболизм (обмен веществ). • На клеточном уровне эти преобразования осуществляются через сложные последовательности реакций, называемые путями метаболизма, которые могут включать тысячи разнообразных реакций.
 Обмен веществ и энергии • Эти реакции протекают не хаотически, а в строго определенной последовательности и регулируются множеством генетических и химических механизмов. • Метаболизм можно разделить на два взаимосвязанных, но разнонаправленных процесса: § анаболизм (ассимиляция) § катаболизм (диссимиляция)
Обмен веществ и энергии • Эти реакции протекают не хаотически, а в строго определенной последовательности и регулируются множеством генетических и химических механизмов. • Метаболизм можно разделить на два взаимосвязанных, но разнонаправленных процесса: § анаболизм (ассимиляция) § катаболизм (диссимиляция)
 Обмен веществ и энергии • Анаболизм это совокупность процессов биосинтеза органических веществ (компонентов клетки и других структур органов и тканей). • Анаболизм обеспечивает рост, развитие, обновление биологических структур, а также накопление энергии (синтез макроэргов). • Анаболизм заключается в химической модификации и перестройке поступающих с пищей молекул в другие более сложные биологические молекулы. Например, включение аминокислот в синтезируемые клеткой белки в соответствии с инструкцией, содержащейся в генетическом материале данной клетки.
Обмен веществ и энергии • Анаболизм это совокупность процессов биосинтеза органических веществ (компонентов клетки и других структур органов и тканей). • Анаболизм обеспечивает рост, развитие, обновление биологических структур, а также накопление энергии (синтез макроэргов). • Анаболизм заключается в химической модификации и перестройке поступающих с пищей молекул в другие более сложные биологические молекулы. Например, включение аминокислот в синтезируемые клеткой белки в соответствии с инструкцией, содержащейся в генетическом материале данной клетки.
 Обмен веществ и энергии • Катаболизм это совокупность процессов расщепления сложных молекул до более простых веществ с использованием части из них в качестве субстратов для биосинтеза и расщеплением другой части до конечных продуктов метаболизма с образованием энергии. • К конечным продуктам метаболизма относятся: ü ü вода (у человека примерно 350 мл в день) двуокись углерода (около 230 мл/мин) окись углерода (0, 007 мл/мин) мочевина (около 30 г/день), а также другие вещества, содержащие азот (примерно б г/день).
Обмен веществ и энергии • Катаболизм это совокупность процессов расщепления сложных молекул до более простых веществ с использованием части из них в качестве субстратов для биосинтеза и расщеплением другой части до конечных продуктов метаболизма с образованием энергии. • К конечным продуктам метаболизма относятся: ü ü вода (у человека примерно 350 мл в день) двуокись углерода (около 230 мл/мин) окись углерода (0, 007 мл/мин) мочевина (около 30 г/день), а также другие вещества, содержащие азот (примерно б г/день).
 Обмен веществ и энергии • Процессы анаболизма и катаболизма находятся в в состоянии динамического равновесия. • Преобладание анаболических процессов над катаболическими приводит к росту, накоплению массы тканей, а преобладание катаболических процессов ведет к частичному разрушению тканевых структур.
Обмен веществ и энергии • Процессы анаболизма и катаболизма находятся в в состоянии динамического равновесия. • Преобладание анаболических процессов над катаболическими приводит к росту, накоплению массы тканей, а преобладание катаболических процессов ведет к частичному разрушению тканевых структур.
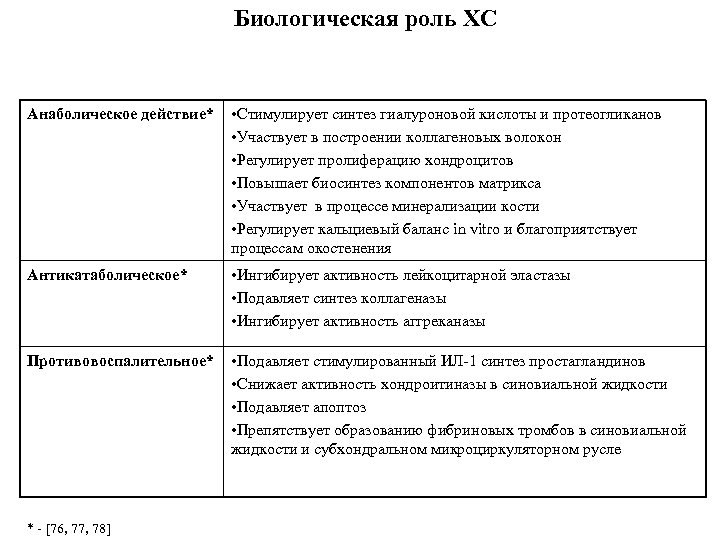 Биологическая роль ХС Анаболическое действие* • Стимулирует синтез гиалуроновой кислоты и протеогликанов • Участвует в построении коллагеновых волокон • Регулирует пролиферацию хондроцитов • Повышает биосинтез компонентов матрикса • Участвует в процессе минерализации кости • Регулирует кальциевый баланс in vitro и благоприятствует процессам окостенения Антикатаболическое* • Ингибирует активность лейкоцитарной эластазы • Подавляет синтез коллагеназы • Ингибирует активность аггреканазы Противовоспалительное* • Подавляет стимулированный ИЛ 1 синтез простагландинов • Снижает активность хондроитиназы в синовиальной жидкости • Подавляет апоптоз • Препятствует образованию фибриновых тромбов в синовиальной жидкости и субхондральном микроциркуляторном русле * [76, 77, 78]
Биологическая роль ХС Анаболическое действие* • Стимулирует синтез гиалуроновой кислоты и протеогликанов • Участвует в построении коллагеновых волокон • Регулирует пролиферацию хондроцитов • Повышает биосинтез компонентов матрикса • Участвует в процессе минерализации кости • Регулирует кальциевый баланс in vitro и благоприятствует процессам окостенения Антикатаболическое* • Ингибирует активность лейкоцитарной эластазы • Подавляет синтез коллагеназы • Ингибирует активность аггреканазы Противовоспалительное* • Подавляет стимулированный ИЛ 1 синтез простагландинов • Снижает активность хондроитиназы в синовиальной жидкости • Подавляет апоптоз • Препятствует образованию фибриновых тромбов в синовиальной жидкости и субхондральном микроциркуляторном русле * [76, 77, 78]
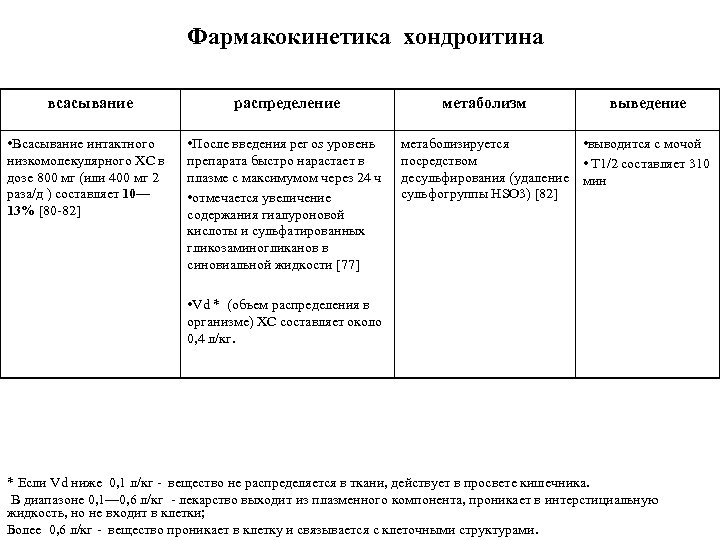 Фармакокинетика хондроитина всасывание распределение • Всасывание интактного низкомолекулярного ХС в дозе 800 мг (или 400 мг 2 раза/д ) составляет 10— 13% [80 82] • После введения per os уровень препарата быстро нарастает в плазме с максимумом через 24 ч • отмечается увеличение содержания гиалуроновой кислоты и сульфатированных гликозаминогликанов в синовиальной жидкости [77] метаболизм выведение метаболизируется • выводится с мочой посредством • T 1/2 составляет 310 десульфирования (удаление мин сульфогруппы HSO 3) [82] • Vd * (объем распределения в организме) ХС составляет около 0, 4 л/кг. * Если Vd ниже 0, 1 л/кг вещество не распределяется в ткани, действует в просвете кишечника. В диапазоне 0, 1— 0, 6 л/кг лекарство выходит из плазменного компонента, проникает в интерстициальную жидкость, но не входит в клетки; Более 0, 6 л/кг вещество проникает в клетку и связывается с клеточными структурами.
Фармакокинетика хондроитина всасывание распределение • Всасывание интактного низкомолекулярного ХС в дозе 800 мг (или 400 мг 2 раза/д ) составляет 10— 13% [80 82] • После введения per os уровень препарата быстро нарастает в плазме с максимумом через 24 ч • отмечается увеличение содержания гиалуроновой кислоты и сульфатированных гликозаминогликанов в синовиальной жидкости [77] метаболизм выведение метаболизируется • выводится с мочой посредством • T 1/2 составляет 310 десульфирования (удаление мин сульфогруппы HSO 3) [82] • Vd * (объем распределения в организме) ХС составляет около 0, 4 л/кг. * Если Vd ниже 0, 1 л/кг вещество не распределяется в ткани, действует в просвете кишечника. В диапазоне 0, 1— 0, 6 л/кг лекарство выходит из плазменного компонента, проникает в интерстициальную жидкость, но не входит в клетки; Более 0, 6 л/кг вещество проникает в клетку и связывается с клеточными структурами.
 Историческая справка В начале 1956 г. , ученые Каролинского Института в Стокгольме (Швеция) показали, что in vitro добавление глюкозамина гидрохлорида в ткань сустава (хрящ) увеличило производство хондроитин сульфата и других глюкозаминогликанов. Ряд других исследователей из Института фармакологии Боннского университета и Университета штата Иллинойс подтвердили первоначальные исследования. Фактически было показано, что добавление глюкозамина гидрохлорида увеличивает производство глюкозаминогликанов на 170 %. В 1980 г. , Итальянская фармацевтическая компания поддержала Клинические исследования влияния дополнительного количества глюкозамина, принимаемого перорально, на пациентов с остеоартритом. С 1980 по 1994 г. было исследовано более 2500 пациентов, страдающих от остеоартрита. Результаты оказались положительными. В 80 % или более случаев пациенты, получавшие 1, 5 г глюкозамина ежедневно, сообщили о существенном сокращении боли, ускоренном восстановлении, и частично о полном восстановлении функции составов после 4 6 недель лечения.
Историческая справка В начале 1956 г. , ученые Каролинского Института в Стокгольме (Швеция) показали, что in vitro добавление глюкозамина гидрохлорида в ткань сустава (хрящ) увеличило производство хондроитин сульфата и других глюкозаминогликанов. Ряд других исследователей из Института фармакологии Боннского университета и Университета штата Иллинойс подтвердили первоначальные исследования. Фактически было показано, что добавление глюкозамина гидрохлорида увеличивает производство глюкозаминогликанов на 170 %. В 1980 г. , Итальянская фармацевтическая компания поддержала Клинические исследования влияния дополнительного количества глюкозамина, принимаемого перорально, на пациентов с остеоартритом. С 1980 по 1994 г. было исследовано более 2500 пациентов, страдающих от остеоартрита. Результаты оказались положительными. В 80 % или более случаев пациенты, получавшие 1, 5 г глюкозамина ежедневно, сообщили о существенном сокращении боли, ускоренном восстановлении, и частично о полном восстановлении функции составов после 4 6 недель лечения.
 Глюкозамин Эмпирическая формула: C 6 H 13 NO 5 Молекулярный вес: 179, 17 ГГ Эмпирическая формула: C 6 H 14 O 5 NCl. Молекулярная масса: 215, 64 Содержание глюкозамина в гидрохлориде 83% (179, 17/215, 64*100%) • Глюкозамин – природный аминомоносахарид, который в организме синтезируется в виде глюкозамин 6 фосфата. • o o o Глюкозамин, как предшественник, необходим для синтеза многих глюкозаминогликанов: ХС гиалуроновой кислоты гепарин сульфата, кератан сульфата и гиалуронана. • Глюкозамин важный компонент клеточной мембраны. • Глюкозамин играет важную роль в формировании костно хрящевого и сухожильно связочного аппаратов, синовиальной жидкости, кожи, ногтей, сердечных клапанов и кровеносных сосудов (Setnikar I. , 1984). Существует три соли глюкозамина: • N ацетилглюкозамин, • глюкозамин сульфат (ГС) • глюкозамин гидрохлорид (ГГ) (Алексеева Л. И. , 2004). ГС Эмпирическая формула: C 6 H 13 NO 5 * H 2 SO 4. Молекулярная масса: 277, 24 Содержание глюкозамина в кристаллическом ГС – 78, 5% (179, 17/277, 24*100%) • ГГ получают путем полного кислотного гидролиза природного хитина в концентрированной соляной кислоте при температуре кипения реакционной смеси. • ГС производят из ГГ, добавляя в него натрия или калия сульфат с дальнейшей ко кристализацией полученной смеси, в дальнейшем ГС стабилизируется хлоридом натрия и содержит до 30% хлорида.
Глюкозамин Эмпирическая формула: C 6 H 13 NO 5 Молекулярный вес: 179, 17 ГГ Эмпирическая формула: C 6 H 14 O 5 NCl. Молекулярная масса: 215, 64 Содержание глюкозамина в гидрохлориде 83% (179, 17/215, 64*100%) • Глюкозамин – природный аминомоносахарид, который в организме синтезируется в виде глюкозамин 6 фосфата. • o o o Глюкозамин, как предшественник, необходим для синтеза многих глюкозаминогликанов: ХС гиалуроновой кислоты гепарин сульфата, кератан сульфата и гиалуронана. • Глюкозамин важный компонент клеточной мембраны. • Глюкозамин играет важную роль в формировании костно хрящевого и сухожильно связочного аппаратов, синовиальной жидкости, кожи, ногтей, сердечных клапанов и кровеносных сосудов (Setnikar I. , 1984). Существует три соли глюкозамина: • N ацетилглюкозамин, • глюкозамин сульфат (ГС) • глюкозамин гидрохлорид (ГГ) (Алексеева Л. И. , 2004). ГС Эмпирическая формула: C 6 H 13 NO 5 * H 2 SO 4. Молекулярная масса: 277, 24 Содержание глюкозамина в кристаллическом ГС – 78, 5% (179, 17/277, 24*100%) • ГГ получают путем полного кислотного гидролиза природного хитина в концентрированной соляной кислоте при температуре кипения реакционной смеси. • ГС производят из ГГ, добавляя в него натрия или калия сульфат с дальнейшей ко кристализацией полученной смеси, в дальнейшем ГС стабилизируется хлоридом натрия и содержит до 30% хлорида.
 Биологическая роль Анаболическое действие • Является исходным материалом для синтеза протеогликанов, гликозаминогликанов и гиалуроновой кислоты • Стимулирует синтез коллагена • Стимулирует включение 35 S 4 (маркера синтеза гликозаминогликанов) в хондроциты • Усиливает синтез гликозаминогликанов в культуре клеток • стимулирует in vitro и in vivo захват 35 S 4 и 3 Н пролина суставным хрящем. • Повышает синтетическую активность хондроцитов • Оказывает хондропротекторный и остеотропный эффект • Способствует нормализации содержания общих хондроитинсульфатов и активности щелочной фосфатазы. Антикатаболическое • Ингибирует действия стромелизина, агреканозина, коллагеназы, фосфолипазы А 2. • Активирует адгезию хондроцитов к фибронектину Противовоспалительное • Блокирует образования супероксидных радикалов • Подавляет активность лизосомальных ферментов • Угнетает индуцированный синтез оксида азота • Снижает содержания ИЛ 1 в синовиальной жидкости.
Биологическая роль Анаболическое действие • Является исходным материалом для синтеза протеогликанов, гликозаминогликанов и гиалуроновой кислоты • Стимулирует синтез коллагена • Стимулирует включение 35 S 4 (маркера синтеза гликозаминогликанов) в хондроциты • Усиливает синтез гликозаминогликанов в культуре клеток • стимулирует in vitro и in vivo захват 35 S 4 и 3 Н пролина суставным хрящем. • Повышает синтетическую активность хондроцитов • Оказывает хондропротекторный и остеотропный эффект • Способствует нормализации содержания общих хондроитинсульфатов и активности щелочной фосфатазы. Антикатаболическое • Ингибирует действия стромелизина, агреканозина, коллагеназы, фосфолипазы А 2. • Активирует адгезию хондроцитов к фибронектину Противовоспалительное • Блокирует образования супероксидных радикалов • Подавляет активность лизосомальных ферментов • Угнетает индуцированный синтез оксида азота • Снижает содержания ИЛ 1 в синовиальной жидкости.
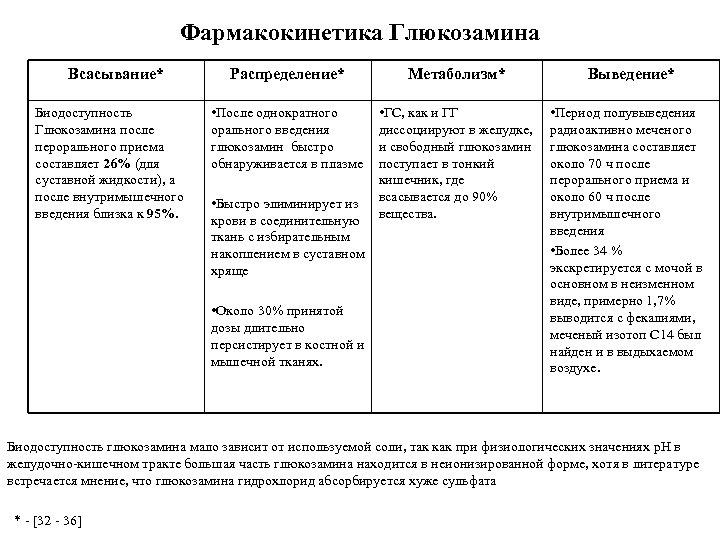 Фармакокинетика Глюкозамина Всасывание* Биодоступность Глюкозамина после перорального приема составляет 26% (для суставной жидкости), а после внутримышечного введения близка к 95%. Распределение* Метаболизм* Выведение* • После однократного орального введения глюкозамин быстро обнаруживается в плазме • ГС, как и ГГ диссоциируют в желудке, и свободный глюкозамин поступает в тонкий кишечник, где всасывается до 90% вещества. • Период полувыведения радиоактивно меченого глюкозамина составляет около 70 ч после перорального приема и около 60 ч после внутримышечного введения • Более 34 % экскретируется с мочой в основном в неизменном виде, примерно 1, 7% выводится с фекалиями, меченый изотоп С 14 был найден и в выдыхаемом воздухе. • Быстро элиминирует из крови в соединительную ткань с избирательным накоплением в суставном хряще • Около 30% принятой дозы длительно персистирует в костной и мышечной тканях. Биодоступность глюкозамина мало зависит от используемой соли, так как при физиологических значениях р. Н в желудочно кишечном тракте большая часть глюкозамина находится в неионизированной форме, хотя в литературе встречается мнение, что глюкозамина гидрохлорид абсорбируется хуже сульфата * [32 36]
Фармакокинетика Глюкозамина Всасывание* Биодоступность Глюкозамина после перорального приема составляет 26% (для суставной жидкости), а после внутримышечного введения близка к 95%. Распределение* Метаболизм* Выведение* • После однократного орального введения глюкозамин быстро обнаруживается в плазме • ГС, как и ГГ диссоциируют в желудке, и свободный глюкозамин поступает в тонкий кишечник, где всасывается до 90% вещества. • Период полувыведения радиоактивно меченого глюкозамина составляет около 70 ч после перорального приема и около 60 ч после внутримышечного введения • Более 34 % экскретируется с мочой в основном в неизменном виде, примерно 1, 7% выводится с фекалиями, меченый изотоп С 14 был найден и в выдыхаемом воздухе. • Быстро элиминирует из крови в соединительную ткань с избирательным накоплением в суставном хряще • Около 30% принятой дозы длительно персистирует в костной и мышечной тканях. Биодоступность глюкозамина мало зависит от используемой соли, так как при физиологических значениях р. Н в желудочно кишечном тракте большая часть глюкозамина находится в неионизированной форме, хотя в литературе встречается мнение, что глюкозамина гидрохлорид абсорбируется хуже сульфата * [32 36]
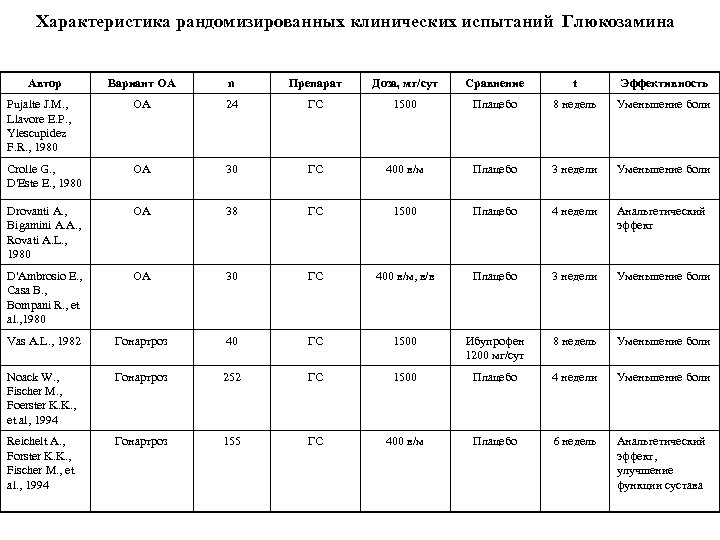 Характеристика рандомизированных клинических испытаний Глюкозамина Автор Вариант ОА n Препарат Доза, мг/сут Сравнение t Эффективность Pujalte J. M. , Llavore E. P. , Ylescupidez F. R. , 1980 ОА 24 ГС 1500 Плацебо 8 недель Уменьшение боли Crolle G. , D'Este E. , 1980 ОА 30 ГС 400 в/м Плацебо 3 недели Уменьшение боли Drovanti A. , Bigamini A. A. , Rovati A. L. , 1980 ОА 38 ГС 1500 Плацебо 4 недели Анальгетический эффект D'Ambrosio E. , Casa B. , Bompani R. , et al. , 1980 ОА 30 ГС 400 в/м, в/в Плацебо 3 недели Уменьшение боли Vas A. L. , 1982 Гонартроз 40 ГС 1500 Ибупрофен 1200 мг/сут 8 недель Уменьшение боли Noack W. , Fischer M. , Foerster K. K. , et al, 1994 Гонартроз 252 ГС 1500 Плацебо 4 недели Уменьшение боли Reichelt A. , Forster K. K. , Fischer M. , et al. , 1994 Гонартроз 155 ГС 400 в/м Плацебо 6 недель Анальгетический эффект, улучшение функции сустава
Характеристика рандомизированных клинических испытаний Глюкозамина Автор Вариант ОА n Препарат Доза, мг/сут Сравнение t Эффективность Pujalte J. M. , Llavore E. P. , Ylescupidez F. R. , 1980 ОА 24 ГС 1500 Плацебо 8 недель Уменьшение боли Crolle G. , D'Este E. , 1980 ОА 30 ГС 400 в/м Плацебо 3 недели Уменьшение боли Drovanti A. , Bigamini A. A. , Rovati A. L. , 1980 ОА 38 ГС 1500 Плацебо 4 недели Анальгетический эффект D'Ambrosio E. , Casa B. , Bompani R. , et al. , 1980 ОА 30 ГС 400 в/м, в/в Плацебо 3 недели Уменьшение боли Vas A. L. , 1982 Гонартроз 40 ГС 1500 Ибупрофен 1200 мг/сут 8 недель Уменьшение боли Noack W. , Fischer M. , Foerster K. K. , et al, 1994 Гонартроз 252 ГС 1500 Плацебо 4 недели Уменьшение боли Reichelt A. , Forster K. K. , Fischer M. , et al. , 1994 Гонартроз 155 ГС 400 в/м Плацебо 6 недель Анальгетический эффект, улучшение функции сустава
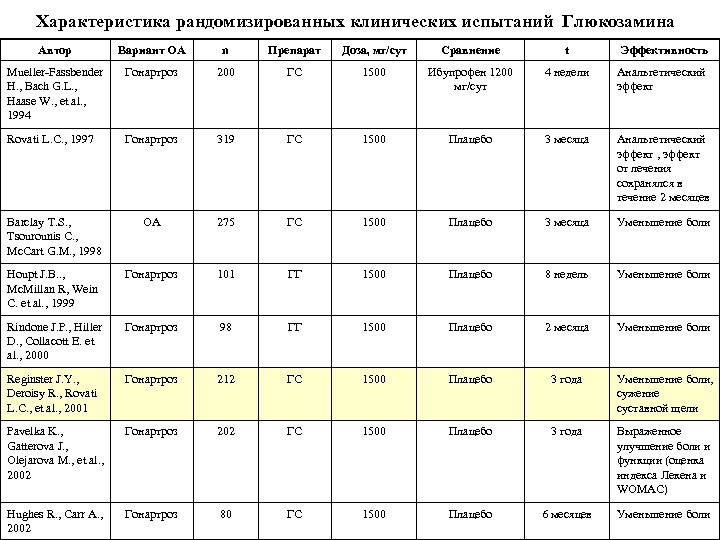 Характеристика рандомизированных клинических испытаний Глюкозамина Автор Вариант ОА n Препарат Доза, мг/сут Сравнение t Эффективность Mueller Fassbender H. , Bach G. L. , Haase W. , et al. , 1994 Гонартроз 200 ГС 1500 Ибупрофен 1200 мг/сут 4 недели Анальгетический эффект Rovati L. C. , 1997 Гонартроз 319 ГС 1500 Плацебо 3 месяца Анальгетический эффект , эффект от лечения сохранялся в течение 2 месяцев Barclay T. S. , Tsourounis C. , Mc. Cart G. M. , 1998 ОА 275 ГС 1500 Плацебо 3 месяца Уменьшение боли Houpt J. B. . , Mc. Millan R, Wein C. et al. , 1999 Гонартроз 101 ГГ 1500 Плацебо 8 недель Уменьшение боли Rindone J. P. , Hiller D. , Collacott E. et al. , 2000 Гонартроз 98 ГГ 1500 Плацебо 2 месяца Уменьшение боли Reginster J. Y. , Deroisy R. , Rovati L. C. , et al. , 2001 Гонартроз 212 ГС 1500 Плацебо 3 года Уменьшение боли, сужение суставной щели Pavelka K. , Gatterova J. , Olejarova M. , et al. , 2002 Гонартроз 202 ГС 1500 Плацебо 3 года Выраженное улучшение боли и функции (оценка индекса Лекена и WOMAC) Hughes R. , Carr A. , 2002 Гонартроз 80 ГС 1500 Плацебо 6 месяцев Уменьшение боли
Характеристика рандомизированных клинических испытаний Глюкозамина Автор Вариант ОА n Препарат Доза, мг/сут Сравнение t Эффективность Mueller Fassbender H. , Bach G. L. , Haase W. , et al. , 1994 Гонартроз 200 ГС 1500 Ибупрофен 1200 мг/сут 4 недели Анальгетический эффект Rovati L. C. , 1997 Гонартроз 319 ГС 1500 Плацебо 3 месяца Анальгетический эффект , эффект от лечения сохранялся в течение 2 месяцев Barclay T. S. , Tsourounis C. , Mc. Cart G. M. , 1998 ОА 275 ГС 1500 Плацебо 3 месяца Уменьшение боли Houpt J. B. . , Mc. Millan R, Wein C. et al. , 1999 Гонартроз 101 ГГ 1500 Плацебо 8 недель Уменьшение боли Rindone J. P. , Hiller D. , Collacott E. et al. , 2000 Гонартроз 98 ГГ 1500 Плацебо 2 месяца Уменьшение боли Reginster J. Y. , Deroisy R. , Rovati L. C. , et al. , 2001 Гонартроз 212 ГС 1500 Плацебо 3 года Уменьшение боли, сужение суставной щели Pavelka K. , Gatterova J. , Olejarova M. , et al. , 2002 Гонартроз 202 ГС 1500 Плацебо 3 года Выраженное улучшение боли и функции (оценка индекса Лекена и WOMAC) Hughes R. , Carr A. , 2002 Гонартроз 80 ГС 1500 Плацебо 6 месяцев Уменьшение боли
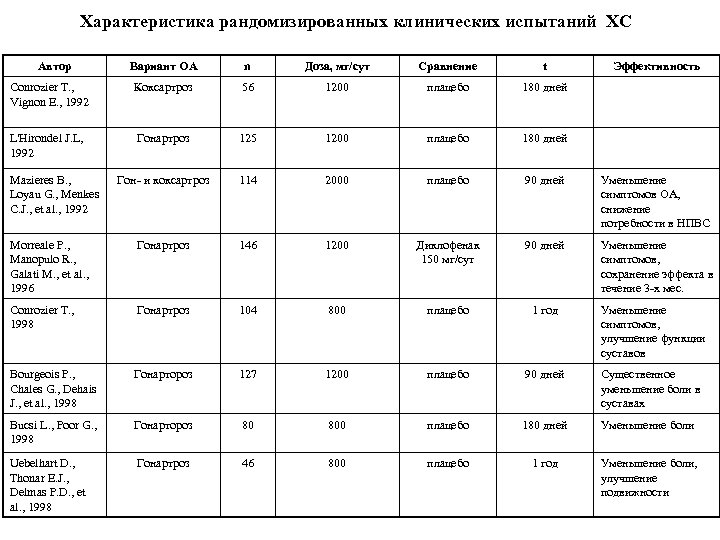 Характеристика рандомизированных клинических испытаний ХС Автор Вариант ОА n Доза, мг/сут Сравнение t Conrozier T. , Vignon E. , 1992 Коксартроз 56 1200 плацебо 180 дней L'Hirondel J. L, 1992 Гонартроз 125 1200 плацебо 180 дней Гон и коксартроз 114 2000 плацебо 90 дней Уменьшение симптомов ОА, снижение потребности в НПВС Morreale P. , Manopulo R. , Galati M. , et al. , 1996 Гонартроз 146 1200 Диклофенак 150 мг/сут 90 дней Уменьшение симптомов, сохранение эффекта в течение 3 х мес. Conrozier T. , 1998 Гонартроз 104 800 плацебо 1 год Уменьшение симптомов, улучшение функции суставов Bourgeois P. , Chales G. , Dehais J. , et al. , 1998 Гонартороз 127 1200 плацебо 90 дней Существенное уменьшение боли в суставах Bucsi L. , Poor G. , 1998 Гонартороз 80 800 плацебо 180 дней Уменьшение боли Uebelhart D. , Thonar E. J. , Delmas P. D. , et al. , 1998 Гонартроз 46 800 плацебо 1 год Уменьшение боли, улучшение подвижности Mazieres B. , Loyau G. , Menkes C. J. , et al. , 1992 Эффективность
Характеристика рандомизированных клинических испытаний ХС Автор Вариант ОА n Доза, мг/сут Сравнение t Conrozier T. , Vignon E. , 1992 Коксартроз 56 1200 плацебо 180 дней L'Hirondel J. L, 1992 Гонартроз 125 1200 плацебо 180 дней Гон и коксартроз 114 2000 плацебо 90 дней Уменьшение симптомов ОА, снижение потребности в НПВС Morreale P. , Manopulo R. , Galati M. , et al. , 1996 Гонартроз 146 1200 Диклофенак 150 мг/сут 90 дней Уменьшение симптомов, сохранение эффекта в течение 3 х мес. Conrozier T. , 1998 Гонартроз 104 800 плацебо 1 год Уменьшение симптомов, улучшение функции суставов Bourgeois P. , Chales G. , Dehais J. , et al. , 1998 Гонартороз 127 1200 плацебо 90 дней Существенное уменьшение боли в суставах Bucsi L. , Poor G. , 1998 Гонартороз 80 800 плацебо 180 дней Уменьшение боли Uebelhart D. , Thonar E. J. , Delmas P. D. , et al. , 1998 Гонартроз 46 800 плацебо 1 год Уменьшение боли, улучшение подвижности Mazieres B. , Loyau G. , Menkes C. J. , et al. , 1992 Эффективность
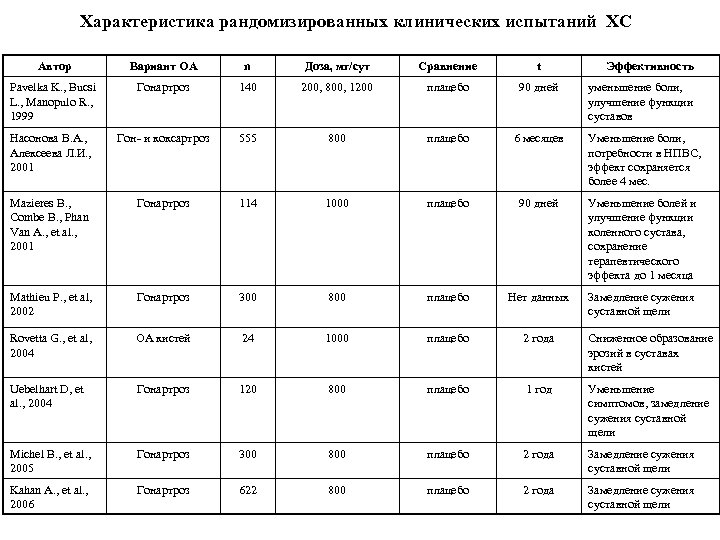 Характеристика рандомизированных клинических испытаний ХС Автор Вариант ОА n Доза, мг/сут Сравнение t Эффективность Pavelka K. , Bucsi L. , Manopulo R. , 1999 Гонартроз 140 200, 800, 1200 плацебо 90 дней Насонова В. А. , Алексеева Л. И. , 2001 Гон и коксартроз 555 800 плацебо 6 месяцев Уменьшение боли, потребности в НПВС, эффект сохраняется более 4 мес. Mazieres B. , Combe B. , Phan Van A. , et al. , 2001 Гонартроз 114 1000 плацебо 90 дней Уменьшение болей и улучшение функции коленного сустава, сохранение терапевтического эффекта до 1 месяца Mathieu P. , et al, 2002 Гонартроз 300 800 плацебо Нет данных Замедление сужения суставной щели Rovetta G. , et al, 2004 ОА кистей 24 1000 плацебо 2 года Сниженное образование эрозий в суставах кистей Uebelhart D, et al. , 2004 Гонартроз 120 800 плацебо 1 год Уменьшение симптомов, замедление сужения суставной щели Michel B. , et al. , 2005 Гонартроз 300 800 плацебо 2 года Замедление сужения суставной щели Kahan A. , et al. , 2006 Гонартроз 622 800 плацебо 2 года Замедление сужения суставной щели уменьшение боли, улучшение функции суставов
Характеристика рандомизированных клинических испытаний ХС Автор Вариант ОА n Доза, мг/сут Сравнение t Эффективность Pavelka K. , Bucsi L. , Manopulo R. , 1999 Гонартроз 140 200, 800, 1200 плацебо 90 дней Насонова В. А. , Алексеева Л. И. , 2001 Гон и коксартроз 555 800 плацебо 6 месяцев Уменьшение боли, потребности в НПВС, эффект сохраняется более 4 мес. Mazieres B. , Combe B. , Phan Van A. , et al. , 2001 Гонартроз 114 1000 плацебо 90 дней Уменьшение болей и улучшение функции коленного сустава, сохранение терапевтического эффекта до 1 месяца Mathieu P. , et al, 2002 Гонартроз 300 800 плацебо Нет данных Замедление сужения суставной щели Rovetta G. , et al, 2004 ОА кистей 24 1000 плацебо 2 года Сниженное образование эрозий в суставах кистей Uebelhart D, et al. , 2004 Гонартроз 120 800 плацебо 1 год Уменьшение симптомов, замедление сужения суставной щели Michel B. , et al. , 2005 Гонартроз 300 800 плацебо 2 года Замедление сужения суставной щели Kahan A. , et al. , 2006 Гонартроз 622 800 плацебо 2 года Замедление сужения суставной щели уменьшение боли, улучшение функции суставов
 Резюме • Авторы приходят к заключению, что хондроитин сульфат и глюкозамин оказывают умеренное или значительное воздействие на выраженность болевого синдрома и функциональную подвижность суставов при ОА по сравнению с плацебо: o глюкозамин обладает структурно модифицирующим (при трехлетнем приеме замедляет дегенеративный процесс в суставном хряще) и симптоматическим действием o хондроитин – симптоматическим (оказывает положительное влияние на индекс Лекена, показатели ВАШ). • Хондропротекторы действительно оказывают защитное действие в отношении суставного хряща, препятствуют его разрушению и способствуют (хотя бы частично) его восстановлению. Эти данные дают основание считать, что хондроитин сульфат и глюкозамин обладают также и патогенетическим действием и способны оказывать модифицирующее влияние на течение остеоартроза. • По мнению многих специалистов, хондропротекторы с доказанным защитным эффектом в отношении хряща должны стать основой длительной базисной терапии остеоартроза. • Благоприятные клинико фармакологические свойства глюкозамина делают его средством выбора для базисной терапии остеоартроза. Средняя эффективная суточная доза должна быть не менее 1500 мг в сутки. Лечение глюкозамином дает возможность получить эффект уже через 2 4 недели. • Применение хондроитин сульфата (его суточная доза в среднем составляет 1000 1500 мг) особенно показано у пожилых больных при сопутствующем атеросклерозе, ожирении, нарушении липидного обмена, метаболическом синдроме, сопутствующем сахарном диабете, благодаря наличию антитромботического, гепариноподобного эффекта и снижению уровня холестерина и липопротеидов. • По сравнению с глюкозамином эффект хондроитин сульфата наступает несколько позднее. • Глюкозамин и ХС — «модификаторы биологического ответа» - уменьшают патологические проявления в хряще в ответ на нагрузку и повышают способность хряща к самовосстановлению.
Резюме • Авторы приходят к заключению, что хондроитин сульфат и глюкозамин оказывают умеренное или значительное воздействие на выраженность болевого синдрома и функциональную подвижность суставов при ОА по сравнению с плацебо: o глюкозамин обладает структурно модифицирующим (при трехлетнем приеме замедляет дегенеративный процесс в суставном хряще) и симптоматическим действием o хондроитин – симптоматическим (оказывает положительное влияние на индекс Лекена, показатели ВАШ). • Хондропротекторы действительно оказывают защитное действие в отношении суставного хряща, препятствуют его разрушению и способствуют (хотя бы частично) его восстановлению. Эти данные дают основание считать, что хондроитин сульфат и глюкозамин обладают также и патогенетическим действием и способны оказывать модифицирующее влияние на течение остеоартроза. • По мнению многих специалистов, хондропротекторы с доказанным защитным эффектом в отношении хряща должны стать основой длительной базисной терапии остеоартроза. • Благоприятные клинико фармакологические свойства глюкозамина делают его средством выбора для базисной терапии остеоартроза. Средняя эффективная суточная доза должна быть не менее 1500 мг в сутки. Лечение глюкозамином дает возможность получить эффект уже через 2 4 недели. • Применение хондроитин сульфата (его суточная доза в среднем составляет 1000 1500 мг) особенно показано у пожилых больных при сопутствующем атеросклерозе, ожирении, нарушении липидного обмена, метаболическом синдроме, сопутствующем сахарном диабете, благодаря наличию антитромботического, гепариноподобного эффекта и снижению уровня холестерина и липопротеидов. • По сравнению с глюкозамином эффект хондроитин сульфата наступает несколько позднее. • Глюкозамин и ХС — «модификаторы биологического ответа» - уменьшают патологические проявления в хряще в ответ на нагрузку и повышают способность хряща к самовосстановлению.
 Что является более зффективным в лечении остеоартроза: глюкозамин, хондроитин или их комбинация? • Учитывая экспериментальные данные (сочетание ХС и ГГ увеличивало продукцию глюкозаминогликанов хондроцитами на 96, 6% по сравнению с 32% при проведении монотерапии одним из компонентов) и доказанную клиническую эффективность, комбинированное применение ХС и ГГ является перспективным направлением современной артрологии Lippielo L. , 1999, Leffler C. N. , 1999, Shanclad W. E. , 1998.
Что является более зффективным в лечении остеоартроза: глюкозамин, хондроитин или их комбинация? • Учитывая экспериментальные данные (сочетание ХС и ГГ увеличивало продукцию глюкозаминогликанов хондроцитами на 96, 6% по сравнению с 32% при проведении монотерапии одним из компонентов) и доказанную клиническую эффективность, комбинированное применение ХС и ГГ является перспективным направлением современной артрологии Lippielo L. , 1999, Leffler C. N. , 1999, Shanclad W. E. , 1998.
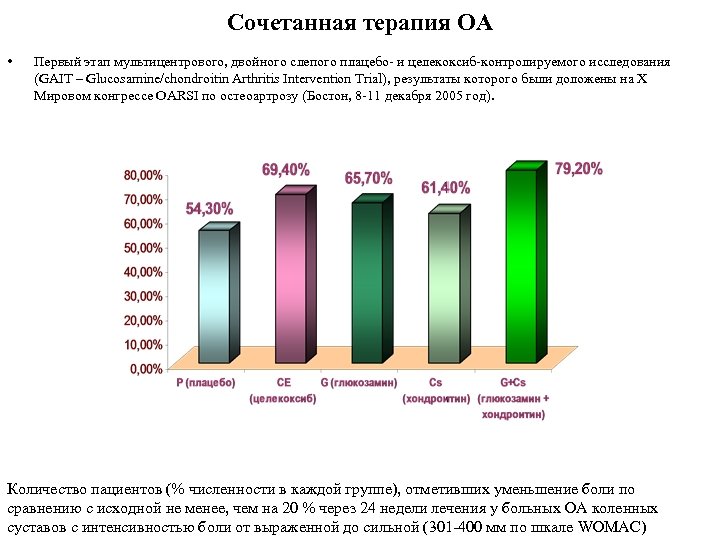 Сочетанная терапия ОА • Первый этап мультицентрового, двойного слепого плацебо и целекоксиб контролируемого исследования (GAIT – Glucosamine/chondroitin Arthritis Intervention Trial), результаты которого были доложены на X Мировом конгрессе OARSI по остеоартрозу (Бостон, 8 11 декабря 2005 год). Количество пациентов (% численности в каждой группе), отметивших уменьшение боли по сравнению с исходной не менее, чем на 20 % через 24 недели лечения у больных ОА коленных суставов с интенсивностью боли от выраженной до сильной (301 400 мм по шкале WOMAC)
Сочетанная терапия ОА • Первый этап мультицентрового, двойного слепого плацебо и целекоксиб контролируемого исследования (GAIT – Glucosamine/chondroitin Arthritis Intervention Trial), результаты которого были доложены на X Мировом конгрессе OARSI по остеоартрозу (Бостон, 8 11 декабря 2005 год). Количество пациентов (% численности в каждой группе), отметивших уменьшение боли по сравнению с исходной не менее, чем на 20 % через 24 недели лечения у больных ОА коленных суставов с интенсивностью боли от выраженной до сильной (301 400 мм по шкале WOMAC)
 Сочетанная терапия ОА The Glucosamine/Chondroitin Arthritis Intervention Trial • Комбинация глюкозамина с хондроитином достоверно эффективнее, чем плацебо, хондроитин, глюкозамин, целекоксиб у больных с ОА коленных суставов при выраженной и сильной боли (301 400 мм). • Целекоксиб достоверно эффективнее, чем плацебо, хондроитин, глюкозамин и их комбинация при слабой/средней боли (≤ 300 мм) • Хондроитин и/или глюкозамин без комбинации по эффективности сопоставимы с плацебо • Все изучаемые препараты хорошо переносились Совместное применение хондроитин сульфата и глюкозамина обеспечивает более быстрое насыщение организма хондропротекторами по сравнению с действием одного компонента, а также более выраженный клинический эффект.
Сочетанная терапия ОА The Glucosamine/Chondroitin Arthritis Intervention Trial • Комбинация глюкозамина с хондроитином достоверно эффективнее, чем плацебо, хондроитин, глюкозамин, целекоксиб у больных с ОА коленных суставов при выраженной и сильной боли (301 400 мм). • Целекоксиб достоверно эффективнее, чем плацебо, хондроитин, глюкозамин и их комбинация при слабой/средней боли (≤ 300 мм) • Хондроитин и/или глюкозамин без комбинации по эффективности сопоставимы с плацебо • Все изучаемые препараты хорошо переносились Совместное применение хондроитин сульфата и глюкозамина обеспечивает более быстрое насыщение организма хондропротекторами по сравнению с действием одного компонента, а также более выраженный клинический эффект.
![Переносимость, побочные явления • Глюкозамин безопасен приеме в очень высоких дозах [37 40 ]: Переносимость, побочные явления • Глюкозамин безопасен приеме в очень высоких дозах [37 40 ]:](https://present5.com/presentation/b527600fe9b8401e5a30d69682c20557/image-29.jpg) Переносимость, побочные явления • Глюкозамин безопасен приеме в очень высоких дозах [37 40 ]: • LD 50 ГГ для мышей составляет 15 000 мг/кг при пероральном приеме 1 100 мг/кг при в/в приеме 6 200 мг/кг при п/к • Клинические исследования показали отсутствие значимого влияния на обмен глюкозы приеме в Глюкозамина терапевтических дозах [ 38 40]. • Глюкозамин не влияет на уровень гликозилированного гемоглобина в исследовании у больных сахарным диабетом 2 го типа [41]. Безопасность глюкозамина подтверждается данными клинических исследований. • Количество публикаций 37 N = 3 173 T =21 1095 дней Плацебо Эффективность: 93 % безопасность высокая 7% легкая тошнота, диспепсические явления • ХС является безопасным веществом, его LD 50 при пероральном приеме превышает 10 г/кг [85]. ХС обладает незначительными антикоагулянтными свойствами, которые практически не проявляются приеме внутрь [86]. Частота побочных эффектов ХС в клинических исследованиях сопоставима с плацебо [42, 87]. • В исследованиях, посвященных переносимости глюкозамина и хондроитина, установили отсутствие токсичности и наличия тяжелых побочных эффектов, а также клинических, биохимических или гематологических изменений при длительном его приеме. • Анализируя клиническую эффективность и переносимость хондропротекторных средств, следует выделить несомненные преимущества хондроитин сульфата и глюкозамина как достаточно эффективных и безопасных.
Переносимость, побочные явления • Глюкозамин безопасен приеме в очень высоких дозах [37 40 ]: • LD 50 ГГ для мышей составляет 15 000 мг/кг при пероральном приеме 1 100 мг/кг при в/в приеме 6 200 мг/кг при п/к • Клинические исследования показали отсутствие значимого влияния на обмен глюкозы приеме в Глюкозамина терапевтических дозах [ 38 40]. • Глюкозамин не влияет на уровень гликозилированного гемоглобина в исследовании у больных сахарным диабетом 2 го типа [41]. Безопасность глюкозамина подтверждается данными клинических исследований. • Количество публикаций 37 N = 3 173 T =21 1095 дней Плацебо Эффективность: 93 % безопасность высокая 7% легкая тошнота, диспепсические явления • ХС является безопасным веществом, его LD 50 при пероральном приеме превышает 10 г/кг [85]. ХС обладает незначительными антикоагулянтными свойствами, которые практически не проявляются приеме внутрь [86]. Частота побочных эффектов ХС в клинических исследованиях сопоставима с плацебо [42, 87]. • В исследованиях, посвященных переносимости глюкозамина и хондроитина, установили отсутствие токсичности и наличия тяжелых побочных эффектов, а также клинических, биохимических или гематологических изменений при длительном его приеме. • Анализируя клиническую эффективность и переносимость хондропротекторных средств, следует выделить несомненные преимущества хондроитин сульфата и глюкозамина как достаточно эффективных и безопасных.
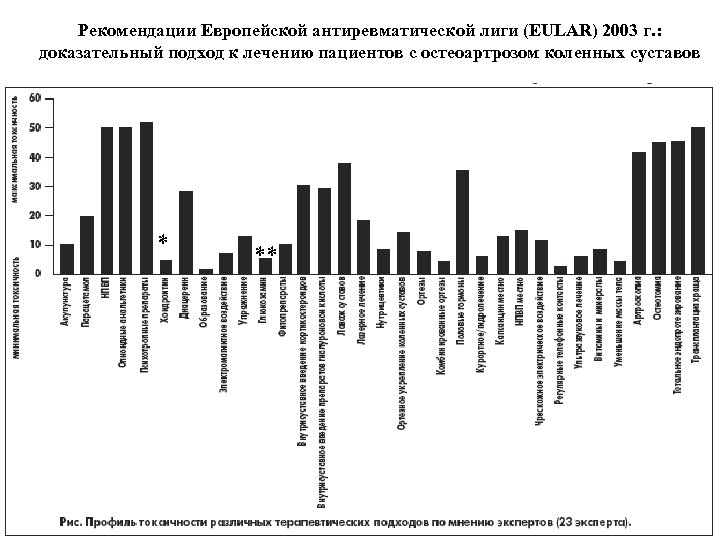 Рекомендации Европейской антиревматической лиги (EULAR) 2003 г. : доказательный подход к лечению пациентов с остеоартрозом коленных суставов * **
Рекомендации Европейской антиревматической лиги (EULAR) 2003 г. : доказательный подход к лечению пациентов с остеоартрозом коленных суставов * **
 Терафлекс – основа конструктивной терапии заболеваний суставов и позвоночника НН 2'НС 1 Химическое название: 2 дезокси 2 амино глюкозы гидрохлорид НН 2'НС 1 Фармакологическое действие препарата стимуляция регенерации хрящевой ткани. Состав: Глюкозамина гидрохлорид – 500 мг Натрия Хондроитина сульфат – 400 мг
Терафлекс – основа конструктивной терапии заболеваний суставов и позвоночника НН 2'НС 1 Химическое название: 2 дезокси 2 амино глюкозы гидрохлорид НН 2'НС 1 Фармакологическое действие препарата стимуляция регенерации хрящевой ткани. Состав: Глюкозамина гидрохлорид – 500 мг Натрия Хондроитина сульфат – 400 мг
 ТЕРАФЛЕКС ПОКАЗАНИЯ К ПРИМЕНЕНИЮ • Обладает противовоспалительным и анальгетическим действием • ОСТЕОАРТРОЗ ПЕРВИЧНЫЙ И • Улучшает подвижность суставов • ОСТЕОХОНДРОЗ ВТОРИЧНЫЙ • Снижает потребность в НПВС • Улучшает качество жизни пациента • ДЕГЕНЕРАТИВНО ДИСТРОФИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПОЗВОНОЧНИКА И СУСТАВОВ • ОСТЕОПОРОЗ
ТЕРАФЛЕКС ПОКАЗАНИЯ К ПРИМЕНЕНИЮ • Обладает противовоспалительным и анальгетическим действием • ОСТЕОАРТРОЗ ПЕРВИЧНЫЙ И • Улучшает подвижность суставов • ОСТЕОХОНДРОЗ ВТОРИЧНЫЙ • Снижает потребность в НПВС • Улучшает качество жизни пациента • ДЕГЕНЕРАТИВНО ДИСТРОФИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПОЗВОНОЧНИКА И СУСТАВОВ • ОСТЕОПОРОЗ
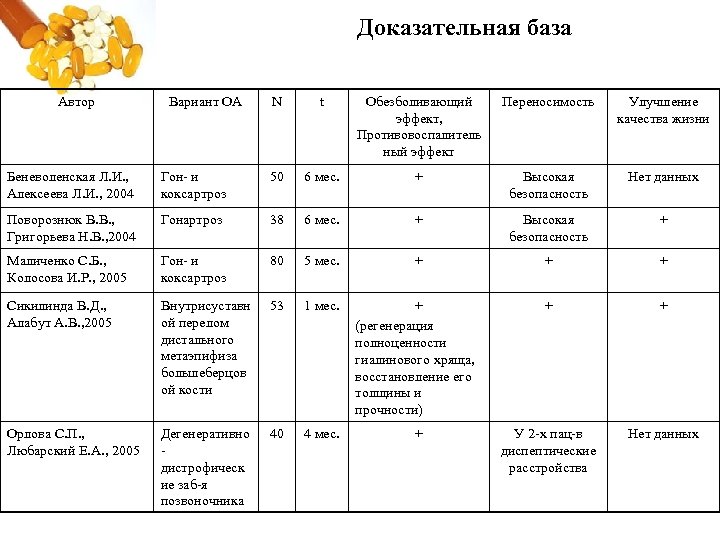 Доказательная база Автор Вариант ОА N t Обезболивающий эффект, Противовоспалитель ный эффект Переносимость Улучшение качества жизни Беневоленская Л. И. , Алексеева Л. И. , 2004 Гон и коксартроз 50 6 мес. + Высокая безопасность Нет данных Поворознюк В. В. , Григорьева Н. В. , 2004 Гонартроз 38 6 мес. + Высокая безопасность + Маличенко С. Б. , Колосова И. Р. , 2005 Гон и коксартроз 80 5 мес. + + + Сикилинда В. Д. , Алабут А. В. , 2005 Внутрисуставн ой перелом дистального метаэпифиза большеберцов ой кости 53 1 мес. + (регенерация полноценности гиалинового хряща, восстановление его толщины и прочности) + + Орлова С. П. , Любарский Е. А. , 2005 Дегенеративно дистрофическ ие заб я позвоночника 40 4 мес. + У 2 х пац в диспептические расстройства Нет данных
Доказательная база Автор Вариант ОА N t Обезболивающий эффект, Противовоспалитель ный эффект Переносимость Улучшение качества жизни Беневоленская Л. И. , Алексеева Л. И. , 2004 Гон и коксартроз 50 6 мес. + Высокая безопасность Нет данных Поворознюк В. В. , Григорьева Н. В. , 2004 Гонартроз 38 6 мес. + Высокая безопасность + Маличенко С. Б. , Колосова И. Р. , 2005 Гон и коксартроз 80 5 мес. + + + Сикилинда В. Д. , Алабут А. В. , 2005 Внутрисуставн ой перелом дистального метаэпифиза большеберцов ой кости 53 1 мес. + (регенерация полноценности гиалинового хряща, восстановление его толщины и прочности) + + Орлова С. П. , Любарский Е. А. , 2005 Дегенеративно дистрофическ ие заб я позвоночника 40 4 мес. + У 2 х пац в диспептические расстройства Нет данных
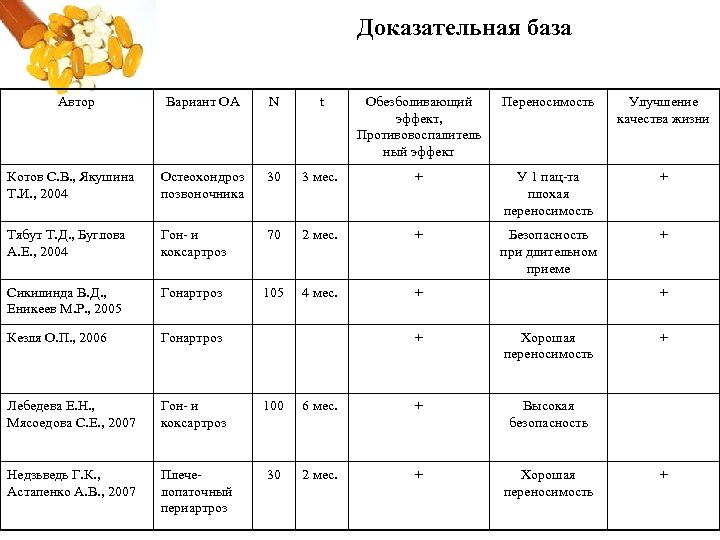 Доказательная база Автор Вариант ОА N t Обезболивающий эффект, Противовоспалитель ный эффект Переносимость Улучшение качества жизни Котов С. В. , Якушина Т. И. , 2004 Остеохондроз позвоночника 30 3 мес. + У 1 пац та плохая переносимость + Тябут Т. Д. , Буглова А. Е. , 2004 Гон и коксартроз 70 2 мес. + Безопасность при длительном приеме + Сикилинда В. Д. , Еникеев М. Р. , 2005 Гонартроз 105 4 мес. + Кезля О. П. , 2006 Гонартроз Лебедева Е. Н. , Мясоедова С. Е. , 2007 Гон и коксартроз 100 Недзьведь Г. К. , Астапенко А. В. , 2007 Плече лопаточный периартроз 30 + + Хорошая переносимость 6 мес. + Высокая безопасность 2 мес. + Хорошая переносимость + +
Доказательная база Автор Вариант ОА N t Обезболивающий эффект, Противовоспалитель ный эффект Переносимость Улучшение качества жизни Котов С. В. , Якушина Т. И. , 2004 Остеохондроз позвоночника 30 3 мес. + У 1 пац та плохая переносимость + Тябут Т. Д. , Буглова А. Е. , 2004 Гон и коксартроз 70 2 мес. + Безопасность при длительном приеме + Сикилинда В. Д. , Еникеев М. Р. , 2005 Гонартроз 105 4 мес. + Кезля О. П. , 2006 Гонартроз Лебедева Е. Н. , Мясоедова С. Е. , 2007 Гон и коксартроз 100 Недзьведь Г. К. , Астапенко А. В. , 2007 Плече лопаточный периартроз 30 + + Хорошая переносимость 6 мес. + Высокая безопасность 2 мес. + Хорошая переносимость + +
 КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ ОСТЕОАРТРОЗА КОЛЕННОГО СУСТАВА Кезля О. П. ГУО «Бел. МАПО» , кафедра травматологии и ортопедии, Минск 2007 год
КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ ОСТЕОАРТРОЗА КОЛЕННОГО СУСТАВА Кезля О. П. ГУО «Бел. МАПО» , кафедра травматологии и ортопедии, Минск 2007 год
 ЦЕЛЬ ИССЛЕДОВАНИЯ Оценить эффективность препарата Терафлекс (капс. ) в комплексном лечении остеоартроза коленного сустава. В исследование включены 48 пациентов: N 1 = 20 – пациенты с первой степенью повреждения хрящевого покрытия N 2 = 28 пациенты со второй степенью повреждения хрящевого покрытия Средний возраст 35 ± 3, 9 года Контрольная группа – 20 пациентов Все пациенты были обследованы клинически, лабораторно, рентгенологически.
ЦЕЛЬ ИССЛЕДОВАНИЯ Оценить эффективность препарата Терафлекс (капс. ) в комплексном лечении остеоартроза коленного сустава. В исследование включены 48 пациентов: N 1 = 20 – пациенты с первой степенью повреждения хрящевого покрытия N 2 = 28 пациенты со второй степенью повреждения хрящевого покрытия Средний возраст 35 ± 3, 9 года Контрольная группа – 20 пациентов Все пациенты были обследованы клинически, лабораторно, рентгенологически.
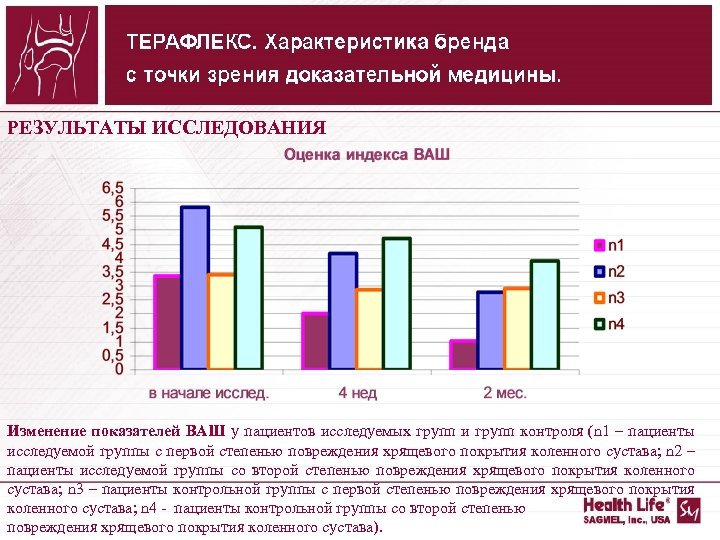 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Изменение показателей ВАШ у пациентов исследуемых групп и групп контроля (n 1 – пациенты исследуемой группы с первой степенью повреждения хрящевого покрытия коленного сустава; n 2 – пациенты исследуемой группы со второй степенью повреждения хрящевого покрытия коленного сустава; n 3 – пациенты контрольной группы с первой степенью повреждения хрящевого покрытия коленного сустава; n 4 пациенты контрольной группы со второй степенью повреждения хрящевого покрытия коленного сустава).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Изменение показателей ВАШ у пациентов исследуемых групп и групп контроля (n 1 – пациенты исследуемой группы с первой степенью повреждения хрящевого покрытия коленного сустава; n 2 – пациенты исследуемой группы со второй степенью повреждения хрящевого покрытия коленного сустава; n 3 – пациенты контрольной группы с первой степенью повреждения хрящевого покрытия коленного сустава; n 4 пациенты контрольной группы со второй степенью повреждения хрящевого покрытия коленного сустава).
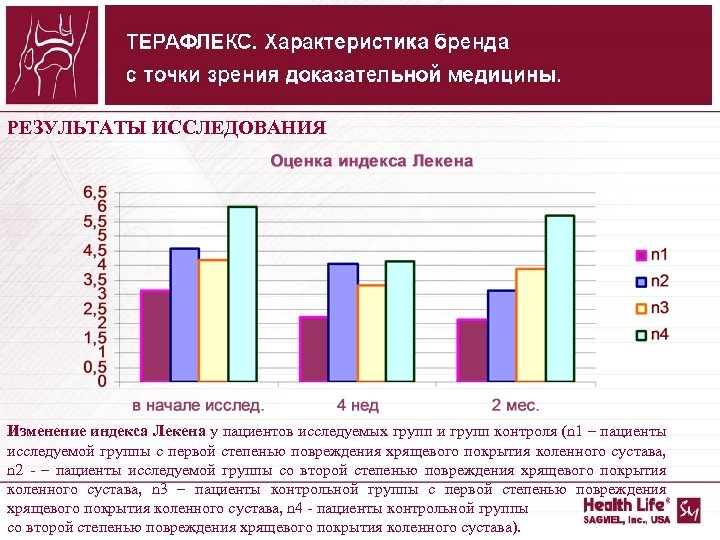 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Изменение индекса Лекена у пациентов исследуемых групп и групп контроля (n 1 – пациенты исследуемой группы с первой степенью повреждения хрящевого покрытия коленного сустава, n 2 – пациенты исследуемой группы со второй степенью повреждения хрящевого покрытия коленного сустава, n 3 – пациенты контрольной группы с первой степенью повреждения хрящевого покрытия коленного сустава, n 4 пациенты контрольной группы со второй степенью повреждения хрящевого покрытия коленного сустава).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Изменение индекса Лекена у пациентов исследуемых групп и групп контроля (n 1 – пациенты исследуемой группы с первой степенью повреждения хрящевого покрытия коленного сустава, n 2 – пациенты исследуемой группы со второй степенью повреждения хрящевого покрытия коленного сустава, n 3 – пациенты контрольной группы с первой степенью повреждения хрящевого покрытия коленного сустава, n 4 пациенты контрольной группы со второй степенью повреждения хрящевого покрытия коленного сустава).
 ВЫВОДЫ • Результаты лечения гонартроза с использованием артроскопии коленного сустава и применения препарата Терафлекс показали его высокую эффективность (уменьшение болевого синдрома, восстановление объема движений, улучшение функциональных возможностей). • Отсутствие побочных эффектов и хорошая переносимость препарата Терафлекс открывают перспективу широкого применения данного препарата у больных с остеоарторозом коленных суставов.
ВЫВОДЫ • Результаты лечения гонартроза с использованием артроскопии коленного сустава и применения препарата Терафлекс показали его высокую эффективность (уменьшение болевого синдрома, восстановление объема движений, улучшение функциональных возможностей). • Отсутствие побочных эффектов и хорошая переносимость препарата Терафлекс открывают перспективу широкого применения данного препарата у больных с остеоарторозом коленных суставов.
 ТЕРАФЛЕКС В ЛЕЧЕНИИ НЕЙРОДИСТРОФИЧЕСКИХ ПРОЯВЛЕНИЙ ОСТЕОХОНДРОЗА ШЕЙНОГО ОТДЕЛА ПОЗВОНОЧНИКА Недзьведь Г. К. , Астапенко А. В. РНПЦ неврологии и нейрохирургии, Минск 2007 год
ТЕРАФЛЕКС В ЛЕЧЕНИИ НЕЙРОДИСТРОФИЧЕСКИХ ПРОЯВЛЕНИЙ ОСТЕОХОНДРОЗА ШЕЙНОГО ОТДЕЛА ПОЗВОНОЧНИКА Недзьведь Г. К. , Астапенко А. В. РНПЦ неврологии и нейрохирургии, Минск 2007 год
 ЦЕЛЬ ИССЛЕДОВАНИЯ Изучить эффективность препарата Терафлекс при нейродистрофических проявлениях остеохондроза шейного отдела позвоночника. Материалы и методы Под наблюдением находилось 30 больных (16 женщин, 14 мужчин). Средний возраст составил 51, 4 + 2, 1 лет. По клиническим синдромам больные распределились следующим образом: n = 18 цервибрахиалгия с нейродистрофическим синдромом в форме плечелопаточного периартроза n = 5 поражения С 6 или С 7 корешка в сочетании с плечелопаточным периартрозом n = 7 цервикобрахиалгия в сочетании с люмбалгией. У всех пациентов был стойкий умеренно выраженный болевой синдром. Терафлекс назначали по обычной схеме. Курс лечения составил 2 месяца. Эффект лечения оценивали по динамике болевого синдрома и степени функциональных нарушений и на основании данных неврологического статуса, а также при помощи шкал и методов количественной оценки.
ЦЕЛЬ ИССЛЕДОВАНИЯ Изучить эффективность препарата Терафлекс при нейродистрофических проявлениях остеохондроза шейного отдела позвоночника. Материалы и методы Под наблюдением находилось 30 больных (16 женщин, 14 мужчин). Средний возраст составил 51, 4 + 2, 1 лет. По клиническим синдромам больные распределились следующим образом: n = 18 цервибрахиалгия с нейродистрофическим синдромом в форме плечелопаточного периартроза n = 5 поражения С 6 или С 7 корешка в сочетании с плечелопаточным периартрозом n = 7 цервикобрахиалгия в сочетании с люмбалгией. У всех пациентов был стойкий умеренно выраженный болевой синдром. Терафлекс назначали по обычной схеме. Курс лечения составил 2 месяца. Эффект лечения оценивали по динамике болевого синдрома и степени функциональных нарушений и на основании данных неврологического статуса, а также при помощи шкал и методов количественной оценки.
 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Регресс болевого синдрома
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Регресс болевого синдрома
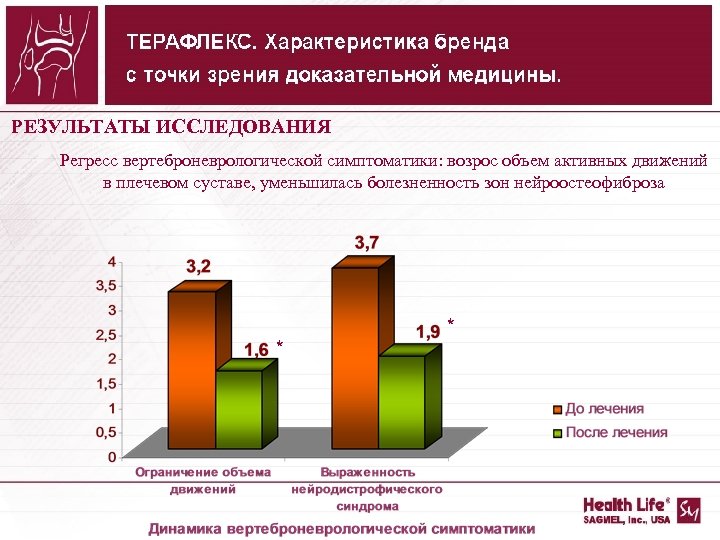 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Регресс вертеброневрологической симптоматики: возрос объем активных движений в плечевом суставе, уменьшилась болезненность зон нейроостеофиброза * *
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ Регресс вертеброневрологической симптоматики: возрос объем активных движений в плечевом суставе, уменьшилась болезненность зон нейроостеофиброза * *
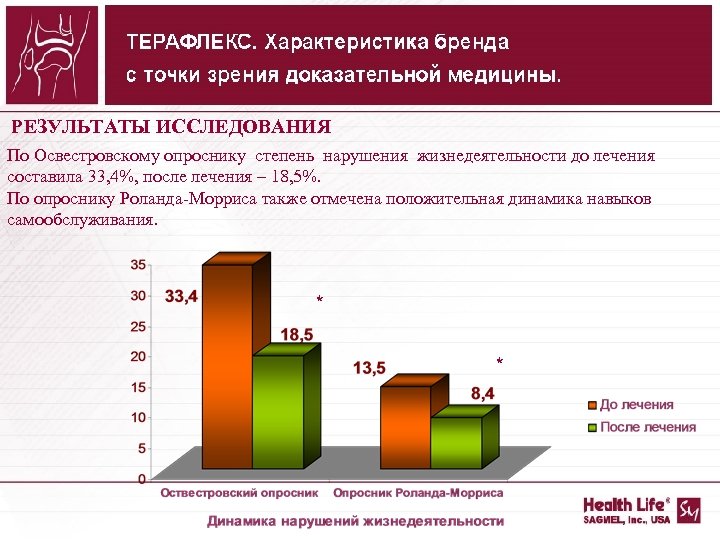 РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ По Освестровскому опроснику степень нарушения жизнедеятельности до лечения составила 33, 4%, после лечения – 18, 5%. По опроснику Роланда Морриса также отмечена положительная динамика навыков самообслуживания. * *
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ По Освестровскому опроснику степень нарушения жизнедеятельности до лечения составила 33, 4%, после лечения – 18, 5%. По опроснику Роланда Морриса также отмечена положительная динамика навыков самообслуживания. * *
 ВЫВОДЫ • Проведенные исследования позволили сделать вывод, что Терафлекс является эффективным средством лечения нейродистрофических проявлений шейного остеохондроза. • Проведение курса лечения сопровождалось регрессом болевого синдрома, увеличением объема движений в плечевом суставе. • Следует отметить хорошую переносимость препарата и отсутствие побочных эффектов а анализируемой группе больных
ВЫВОДЫ • Проведенные исследования позволили сделать вывод, что Терафлекс является эффективным средством лечения нейродистрофических проявлений шейного остеохондроза. • Проведение курса лечения сопровождалось регрессом болевого синдрома, увеличением объема движений в плечевом суставе. • Следует отметить хорошую переносимость препарата и отсутствие побочных эффектов а анализируемой группе больных
 Зачем необходимы комбинированные препараты ? • Комбинация различных активных компонентов в препарате может иметь ряд преимуществ: улучшение комплаенса для пациента, упрощение назначения, повышение профиля безопасности без уменьшения терапевтической эффективности (Raffa, 2001). • Большинство комбинаций имеет аддитивный* эффект. • Однако, в некоторых случаях, комбинация оказывает эффект превышающий аддитивный (синергизм)* (Bolan et al. , 2002). Многолетний опыт исследования различных комбинаций препаратов отражен в многочисленных публикациях и монографиях (Tallarida et al. , 1999, Raffa et al. , 1993, Tallarida et al. , 1989; Raffa et al. , 2000; Tallarida, 2001). • С особым интересом рассматриваются случаи усиления анальгезирующего эффекта. При исследовании комбинации глюкозамина сульфата с наиболее часто используемыми неопиоидными анальгетиками определяется антиноцицептивный синергизм (ибупрофн, кетопрофен). • В частности, комбинация глюкозамина и ибупрофена является наиболее перспективной для проведения клинических исследований.
Зачем необходимы комбинированные препараты ? • Комбинация различных активных компонентов в препарате может иметь ряд преимуществ: улучшение комплаенса для пациента, упрощение назначения, повышение профиля безопасности без уменьшения терапевтической эффективности (Raffa, 2001). • Большинство комбинаций имеет аддитивный* эффект. • Однако, в некоторых случаях, комбинация оказывает эффект превышающий аддитивный (синергизм)* (Bolan et al. , 2002). Многолетний опыт исследования различных комбинаций препаратов отражен в многочисленных публикациях и монографиях (Tallarida et al. , 1999, Raffa et al. , 1993, Tallarida et al. , 1989; Raffa et al. , 2000; Tallarida, 2001). • С особым интересом рассматриваются случаи усиления анальгезирующего эффекта. При исследовании комбинации глюкозамина сульфата с наиболее часто используемыми неопиоидными анальгетиками определяется антиноцицептивный синергизм (ибупрофн, кетопрофен). • В частности, комбинация глюкозамина и ибупрофена является наиболее перспективной для проведения клинических исследований.
 Антиноцицептивная синергия**, аддитивный* и субаддитивный*** эффект комбинации глюкозамина и неопиоидных анальгетиков у мышей (Ronald J. Tallarida, Alan Cowan, and Robert B. Raffa Temple University School of Medicine and Temple University School of Pharmacy, Philadelphia, Pennsylvania), 2003 г. *Аддитивный эффект взаимодействие, в результате которого эффект двух применяемых вместе препаратов равен их суммарному действию. **Синергизм взаимодействие, в результате которого эффект двух применяемых вместе препаратов превышает их суммарное действие. ***Субаддитив взаимодействие, в результате которого эффект двух применяемых вместе препаратов меньше ожидаемого суммарного действия
Антиноцицептивная синергия**, аддитивный* и субаддитивный*** эффект комбинации глюкозамина и неопиоидных анальгетиков у мышей (Ronald J. Tallarida, Alan Cowan, and Robert B. Raffa Temple University School of Medicine and Temple University School of Pharmacy, Philadelphia, Pennsylvania), 2003 г. *Аддитивный эффект взаимодействие, в результате которого эффект двух применяемых вместе препаратов равен их суммарному действию. **Синергизм взаимодействие, в результате которого эффект двух применяемых вместе препаратов превышает их суммарное действие. ***Субаддитив взаимодействие, в результате которого эффект двух применяемых вместе препаратов меньше ожидаемого суммарного действия
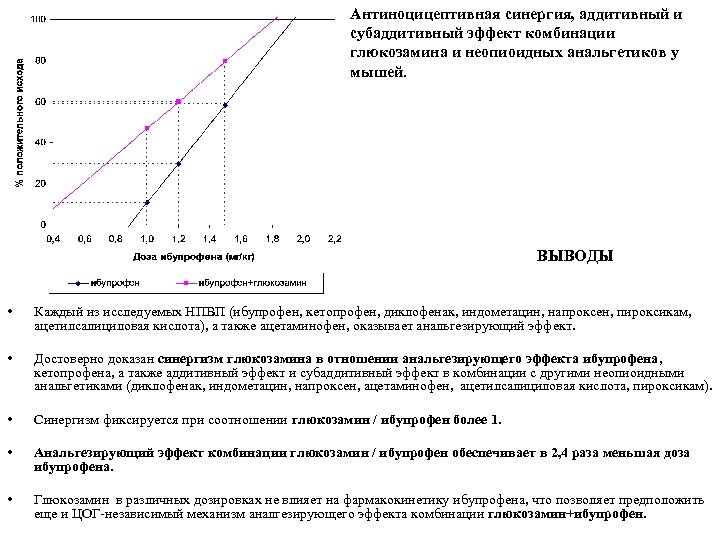 Антиноцицептивная синергия, аддитивный и субаддитивный эффект комбинации глюкозамина и неопиоидных анальгетиков у мышей. ВЫВОДЫ • Каждый из исследуемых НПВП (ибупрофен, кетопрофен, диклофенак, индометацин, напроксен, пироксикам, ацетилсалициловая кислота), а также ацетаминофен, оказывает анальгезирующий эффект. • Достоверно доказан синергизм глюкозамина в отношении анальгезирующего эффекта ибупрофена, кетопрофена, а также аддитивный эффект и субаддитивный эффект в комбинации с другими неопиоидными анальгетиками (диклофенак, индометацин, напроксен, ацетаминофен, ацетилсалициловая кислота, пироксикам). • Синергизм фиксируется при соотношении глюкозамин / ибупрофен более 1. • Анальгезирующий эффект комбинации глюкозамин / ибупрофен обеспечивает в 2, 4 раза меньшая доза ибупрофена. • Глюкозамин в различных дозировках не влияет на фармакокинетику ибупрофена, что позволяет предположить еще и ЦОГ независимый механизм аналгезирующего эффекта комбинации глюкозамин+ибупрофен.
Антиноцицептивная синергия, аддитивный и субаддитивный эффект комбинации глюкозамина и неопиоидных анальгетиков у мышей. ВЫВОДЫ • Каждый из исследуемых НПВП (ибупрофен, кетопрофен, диклофенак, индометацин, напроксен, пироксикам, ацетилсалициловая кислота), а также ацетаминофен, оказывает анальгезирующий эффект. • Достоверно доказан синергизм глюкозамина в отношении анальгезирующего эффекта ибупрофена, кетопрофена, а также аддитивный эффект и субаддитивный эффект в комбинации с другими неопиоидными анальгетиками (диклофенак, индометацин, напроксен, ацетаминофен, ацетилсалициловая кислота, пироксикам). • Синергизм фиксируется при соотношении глюкозамин / ибупрофен более 1. • Анальгезирующий эффект комбинации глюкозамин / ибупрофен обеспечивает в 2, 4 раза меньшая доза ибупрофена. • Глюкозамин в различных дозировках не влияет на фармакокинетику ибупрофена, что позволяет предположить еще и ЦОГ независимый механизм аналгезирующего эффекта комбинации глюкозамин+ибупрофен.
 Терапевтические подходы к назначению комбинации глюкозамина + ибупрофена • Уменьшение боли • Уменьшение функциональной недостаточности суставов • Ограничение прогрессирования заболевания • Улучшение качества жизни больных Терафлекс Адванс Состав: Глюкозамина сульфат – 250 мг Натрия Хондроитина сульфат – 200 мг Ибупрофен – 100 мг
Терапевтические подходы к назначению комбинации глюкозамина + ибупрофена • Уменьшение боли • Уменьшение функциональной недостаточности суставов • Ограничение прогрессирования заболевания • Улучшение качества жизни больных Терафлекс Адванс Состав: Глюкозамина сульфат – 250 мг Натрия Хондроитина сульфат – 200 мг Ибупрофен – 100 мг
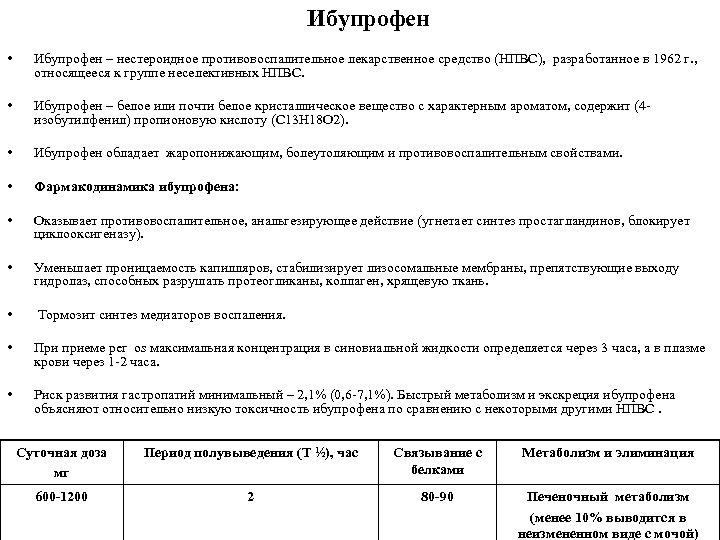 Ибупрофен • • Ибупрофен – нестероидное противовоспалительное лекарственное средство (НПВС), разработанное в 1962 г. , относящееся к группе неселективных НПВС. Ибупрофен – белое или почти белое кристаллическое вещество с характерным ароматом, содержит (4 изобутилфенил) пропионовую кислоту (C 13 H 18 O 2). • Ибупрофен обладает жаропонижающим, болеутоляющим и противовоспалительным свойствами. • Фармакодинамика ибупрофена: • Оказывает противовоспалительное, анальгезирующее действие (угнетает синтез простагландинов, блокирует циклооксигеназу). • Уменьшает проницаемость капилляров, стабилизирует лизосомальные мембраны, препятствующие выходу гидролаз, способных разрушать протеогликаны, коллаген, хрящевую ткань. • Тормозит синтез медиаторов воспаления. • При приеме per os максимальная концентрация в синовиальной жидкости определяется через 3 часа, а в плазме крови через 1 2 часа. • Риск развития гастропатий минимальный – 2, 1% (0, 6 7, 1%). Быстрый метаболизм и экскреция ибупрофена объясняют относительно низкую токсичность ибупрофена по сравнению с некоторыми другими НПВС. Суточная доза мг Период полувыведения (Т ½), час Связывание с белками Метаболизм и элиминация 600 -1200 2 80 -90 Печеночный метаболизм (менее 10% выводится в неизмененном виде с мочой)
Ибупрофен • • Ибупрофен – нестероидное противовоспалительное лекарственное средство (НПВС), разработанное в 1962 г. , относящееся к группе неселективных НПВС. Ибупрофен – белое или почти белое кристаллическое вещество с характерным ароматом, содержит (4 изобутилфенил) пропионовую кислоту (C 13 H 18 O 2). • Ибупрофен обладает жаропонижающим, болеутоляющим и противовоспалительным свойствами. • Фармакодинамика ибупрофена: • Оказывает противовоспалительное, анальгезирующее действие (угнетает синтез простагландинов, блокирует циклооксигеназу). • Уменьшает проницаемость капилляров, стабилизирует лизосомальные мембраны, препятствующие выходу гидролаз, способных разрушать протеогликаны, коллаген, хрящевую ткань. • Тормозит синтез медиаторов воспаления. • При приеме per os максимальная концентрация в синовиальной жидкости определяется через 3 часа, а в плазме крови через 1 2 часа. • Риск развития гастропатий минимальный – 2, 1% (0, 6 7, 1%). Быстрый метаболизм и экскреция ибупрофена объясняют относительно низкую токсичность ибупрофена по сравнению с некоторыми другими НПВС. Суточная доза мг Период полувыведения (Т ½), час Связывание с белками Метаболизм и элиминация 600 -1200 2 80 -90 Печеночный метаболизм (менее 10% выводится в неизмененном виде с мочой)
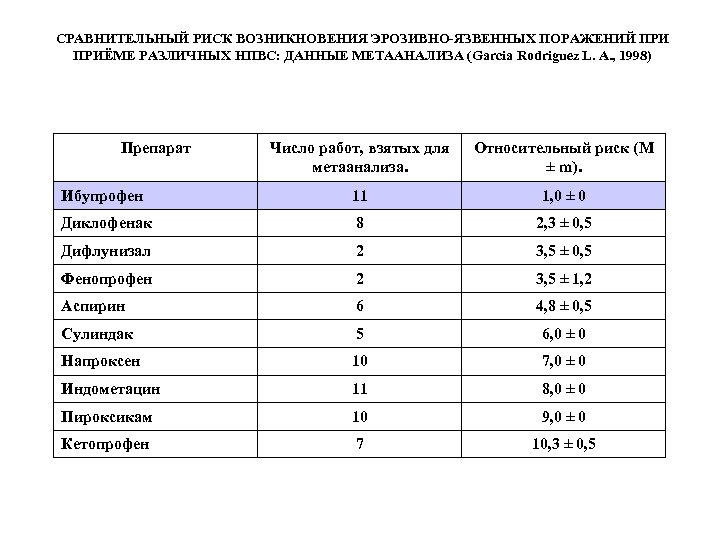 СРАВНИТЕЛЬНЫЙ РИСК ВОЗНИКНОВЕНИЯ ЭРОЗИВНО-ЯЗВЕННЫХ ПОРАЖЕНИЙ ПРИЁМЕ РАЗЛИЧНЫХ НПВС: ДАННЫЕ МЕТААНАЛИЗА (Garcia Rodriguez L. A. , 1998) Препарат Число работ, взятых для метаанализа. Относительный риск (М ± m). Ибупрофен 11 1, 0 ± 0 Диклофенак 8 2, 3 ± 0, 5 Дифлунизал 2 3, 5 ± 0, 5 Фенопрофен 2 3, 5 ± 1, 2 Аспирин 6 4, 8 ± 0, 5 Сулиндак 5 6, 0 ± 0 Напроксен 10 7, 0 ± 0 Индометацин 11 8, 0 ± 0 Пироксикам 10 9, 0 ± 0 Кетопрофен 7 10, 3 ± 0, 5
СРАВНИТЕЛЬНЫЙ РИСК ВОЗНИКНОВЕНИЯ ЭРОЗИВНО-ЯЗВЕННЫХ ПОРАЖЕНИЙ ПРИЁМЕ РАЗЛИЧНЫХ НПВС: ДАННЫЕ МЕТААНАЛИЗА (Garcia Rodriguez L. A. , 1998) Препарат Число работ, взятых для метаанализа. Относительный риск (М ± m). Ибупрофен 11 1, 0 ± 0 Диклофенак 8 2, 3 ± 0, 5 Дифлунизал 2 3, 5 ± 0, 5 Фенопрофен 2 3, 5 ± 1, 2 Аспирин 6 4, 8 ± 0, 5 Сулиндак 5 6, 0 ± 0 Напроксен 10 7, 0 ± 0 Индометацин 11 8, 0 ± 0 Пироксикам 10 9, 0 ± 0 Кетопрофен 7 10, 3 ± 0, 5
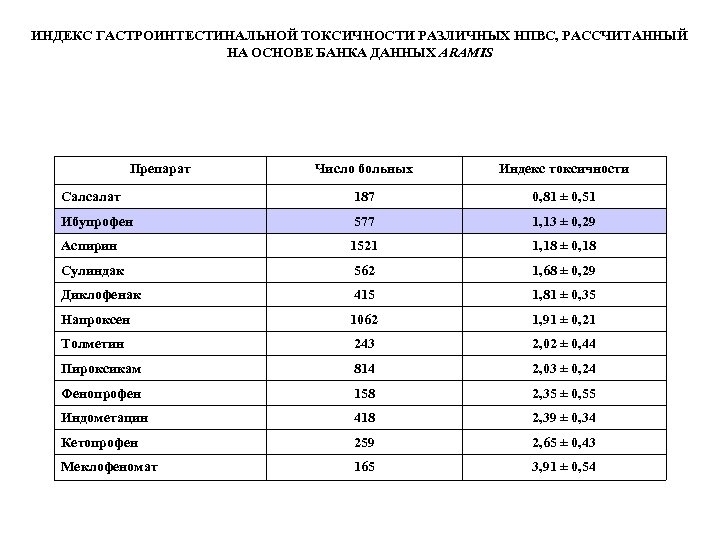 ИНДЕКС ГАСТРОИНТЕСТИНАЛЬНОЙ ТОКСИЧНОСТИ РАЗЛИЧНЫХ НПВС, РАССЧИТАННЫЙ НА ОСНОВЕ БАНКА ДАННЫХ ARAMIS Препарат Число больных Индекс токсичности Салсалат 187 0, 81 ± 0, 51 Ибупрофен 577 1, 13 ± 0, 29 Аспирин 1521 1, 18 ± 0, 18 Сулиндак 562 1, 68 ± 0, 29 Диклофенак 415 1, 81 ± 0, 35 Напроксен 1062 1, 91 ± 0, 21 Толметин 243 2, 02 ± 0, 44 Пироксикам 814 2, 03 ± 0, 24 Фенопрофен 158 2, 35 ± 0, 55 Индометацин 418 2, 39 ± 0, 34 Кетопрофен 259 2, 65 ± 0, 43 Меклофеномат 165 3, 91 ± 0, 54
ИНДЕКС ГАСТРОИНТЕСТИНАЛЬНОЙ ТОКСИЧНОСТИ РАЗЛИЧНЫХ НПВС, РАССЧИТАННЫЙ НА ОСНОВЕ БАНКА ДАННЫХ ARAMIS Препарат Число больных Индекс токсичности Салсалат 187 0, 81 ± 0, 51 Ибупрофен 577 1, 13 ± 0, 29 Аспирин 1521 1, 18 ± 0, 18 Сулиндак 562 1, 68 ± 0, 29 Диклофенак 415 1, 81 ± 0, 35 Напроксен 1062 1, 91 ± 0, 21 Толметин 243 2, 02 ± 0, 44 Пироксикам 814 2, 03 ± 0, 24 Фенопрофен 158 2, 35 ± 0, 55 Индометацин 418 2, 39 ± 0, 34 Кетопрофен 259 2, 65 ± 0, 43 Меклофеномат 165 3, 91 ± 0, 54
 Влияние НПВС на процессы биосинтеза в хрящевой ткани* I — подавляющие воспаление и нейтральные к артрозу II — подавляющие воспаление и усиливающие артроз III — подавляющие воспаление и способствующие нормализации обменных процессов в хрящевой ткани Действие НПВС на процессы биосинтеза в хрящевой ткани* I нейтральное II угнетающее III стимулирующее Ибупрофен, Пироксикам, диклофенак, сулиндак, солпафлекс Ацетилсалициловая кислота, индометацин, фенопрофен Беноксапрофен, тиапрофеновая кислота, парацетамол *А. Г. Вознеснский Клиническая фармакология НПВС, Москва, 1998 И. А. Зупанец Критерии выбора НПВС и ненаркотических анальгетиков Провизор, № 19, 1998.
Влияние НПВС на процессы биосинтеза в хрящевой ткани* I — подавляющие воспаление и нейтральные к артрозу II — подавляющие воспаление и усиливающие артроз III — подавляющие воспаление и способствующие нормализации обменных процессов в хрящевой ткани Действие НПВС на процессы биосинтеза в хрящевой ткани* I нейтральное II угнетающее III стимулирующее Ибупрофен, Пироксикам, диклофенак, сулиндак, солпафлекс Ацетилсалициловая кислота, индометацин, фенопрофен Беноксапрофен, тиапрофеновая кислота, парацетамол *А. Г. Вознеснский Клиническая фармакология НПВС, Москва, 1998 И. А. Зупанец Критерии выбора НПВС и ненаркотических анальгетиков Провизор, № 19, 1998.
 ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ТЕРАФЛЕКС Адванс УСТРАНЕНИЕ БОЛЕВОГО, ВОСПАЛИТЕЛЬНОГО СИНДРОМА ПРИ: • ОСТЕОАРТРОЗЕ ПЕРВИЧНОМ И ВТОРИЧНОМ • ДЕГЕНЕРАТИВНО ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЯХ СУСТАВОВ КОНЕЧНОСТЕЙ И МЕЖПОЗВОНОЧНЫХ ДИСКОВ • ПОСЛЕ ТРАВМ СУСТАВОВ
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ТЕРАФЛЕКС Адванс УСТРАНЕНИЕ БОЛЕВОГО, ВОСПАЛИТЕЛЬНОГО СИНДРОМА ПРИ: • ОСТЕОАРТРОЗЕ ПЕРВИЧНОМ И ВТОРИЧНОМ • ДЕГЕНЕРАТИВНО ДИСТРОФИЧЕСКИХ ЗАБОЛЕВАНИЯХ СУСТАВОВ КОНЕЧНОСТЕЙ И МЕЖПОЗВОНОЧНЫХ ДИСКОВ • ПОСЛЕ ТРАВМ СУСТАВОВ
 Комплексное лечение остеоартроза- средства для наружного применения Крем Терафлекс М СОСТАВ: 1 грамм крема содержит: • • хондроитина сульфат глюкозамина гидрохлорид камфоры масла мяты перечной 8 мг 32 мг 9 мг
Комплексное лечение остеоартроза- средства для наружного применения Крем Терафлекс М СОСТАВ: 1 грамм крема содержит: • • хондроитина сульфат глюкозамина гидрохлорид камфоры масла мяты перечной 8 мг 32 мг 9 мг
 ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ТЕРАФЛЕКС М • ОСТЕОАРТРОЗ ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ • ОСТЕОХОНДРОЗ • ДЕГЕНЕРАТИВНО ДИСТРОФИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПОЗВОНОЧНИКА И СУСТАВОВ • СИМПТОМАТИЧЕСКОЕ ОБЕЗБОЛИВАЮЩЕЕ СРЕДСТВО ПРИ УШИБАХ, РАСТЯЖЕНИЯХ, ТРАВМАХ, РАДИКУЛИТЕ
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ ТЕРАФЛЕКС М • ОСТЕОАРТРОЗ ПЕРВИЧНЫЙ И ВТОРИЧНЫЙ • ОСТЕОХОНДРОЗ • ДЕГЕНЕРАТИВНО ДИСТРОФИЧЕСКИЕ ЗАБОЛЕВАНИЯ ПОЗВОНОЧНИКА И СУСТАВОВ • СИМПТОМАТИЧЕСКОЕ ОБЕЗБОЛИВАЮЩЕЕ СРЕДСТВО ПРИ УШИБАХ, РАСТЯЖЕНИЯХ, ТРАВМАХ, РАДИКУЛИТЕ
 Мята перечная (Mentha piperita L. ) Химический состав и фармакологические свойства • • • Листья мяты перечной содержат: эфирное масло (2, 5— 4, 5 %), состоящее из ментола и его эфиров, главным образом эфиров изовалериановой и уксусной кислот (в соцветиях до 4— 6 %, в стеблях — 0, 3 %). аскорбиновую кислоту, рутин, каротин. • Основу эфирного масла мяты перечной составляют ментол, α пинен, лимонен, цинеол, дипентен, пулегон, β фелландрен и другие терпеноиды. Кроме того, в листьях содержатся органические кислоты, дубильные вещества, флавониды, каротин, бетаин, гесперидин, микроэлементы (медь, марганец, стронций и др. ) и другие химические соединения. • Мята перечная обладает широким спектром фармакологической активности: o За счет местнораздражающего эффекта и стимулирующего влияния на периферические нейрорецепторы кожи и слизистых оболочек усиливает капиллярное кровообращение. o Раздражает нервные окончания, вызывая ощущение холода и легкого покалывания. o Оказывает анестетическое действие, антисептическое действие и противовоспалительное действие.
Мята перечная (Mentha piperita L. ) Химический состав и фармакологические свойства • • • Листья мяты перечной содержат: эфирное масло (2, 5— 4, 5 %), состоящее из ментола и его эфиров, главным образом эфиров изовалериановой и уксусной кислот (в соцветиях до 4— 6 %, в стеблях — 0, 3 %). аскорбиновую кислоту, рутин, каротин. • Основу эфирного масла мяты перечной составляют ментол, α пинен, лимонен, цинеол, дипентен, пулегон, β фелландрен и другие терпеноиды. Кроме того, в листьях содержатся органические кислоты, дубильные вещества, флавониды, каротин, бетаин, гесперидин, микроэлементы (медь, марганец, стронций и др. ) и другие химические соединения. • Мята перечная обладает широким спектром фармакологической активности: o За счет местнораздражающего эффекта и стимулирующего влияния на периферические нейрорецепторы кожи и слизистых оболочек усиливает капиллярное кровообращение. o Раздражает нервные окончания, вызывая ощущение холода и легкого покалывания. o Оказывает анестетическое действие, антисептическое действие и противовоспалительное действие.
 Камфора (Камфорное дерево, камфорный лавр) Cinnamomum camphora (L. ) Sieh. — большое вечнозеленое дерево, высотой до 20— 50 метров. Историческая справка Камфорное дерево было завезено в Австралию в 1822 году в качестве декоративного растения для использования в садах и парках, однако оно стало сорняком для эндемичной флоры на территориях Квинсленда и к северу от Нового Южного Уэльса с благоприятным для него влажным субтропическим климатом, что очень сильно сказалось на уязвимых экосистемах Австралии. Растение объявлено сорным для всего штата Квинсленд. Раскидистые массивные корневища разрушают городские дренажные и канализационные системы, портят речные насыпи. Листья камфорного дерева содежат большое количество терпеновых компонентов, которые ухудшают качество воды, уничтожая тем самым пресноводных рыб. Камфорные деревья захватили пастбищные территории, а также конкурируют с эвкалиптовыми деревьями — единственным источником пищи для коал, находящихся на грани исчезновения во многих частях восточной Австралии.
Камфора (Камфорное дерево, камфорный лавр) Cinnamomum camphora (L. ) Sieh. — большое вечнозеленое дерево, высотой до 20— 50 метров. Историческая справка Камфорное дерево было завезено в Австралию в 1822 году в качестве декоративного растения для использования в садах и парках, однако оно стало сорняком для эндемичной флоры на территориях Квинсленда и к северу от Нового Южного Уэльса с благоприятным для него влажным субтропическим климатом, что очень сильно сказалось на уязвимых экосистемах Австралии. Растение объявлено сорным для всего штата Квинсленд. Раскидистые массивные корневища разрушают городские дренажные и канализационные системы, портят речные насыпи. Листья камфорного дерева содежат большое количество терпеновых компонентов, которые ухудшают качество воды, уничтожая тем самым пресноводных рыб. Камфорные деревья захватили пастбищные территории, а также конкурируют с эвкалиптовыми деревьями — единственным источником пищи для коал, находящихся на грани исчезновения во многих частях восточной Австралии.
 Камфора • Древесина камфорного лавра практически не повреждается насекомыми, поэтому ее применяют для изготовления мелких бытовых изделий (шкатулки, веера , бусы). • Ранее много деревьев рубили для получения натуральной камфоры, широко используемой в медицине, но сегодня практически вся применяемая камфора — синтетическая.
Камфора • Древесина камфорного лавра практически не повреждается насекомыми, поэтому ее применяют для изготовления мелких бытовых изделий (шкатулки, веера , бусы). • Ранее много деревьев рубили для получения натуральной камфоры, широко используемой в медицине, но сегодня практически вся применяемая камфора — синтетическая.
 Камфора • Камфора (Camphora) — терпеноил, кетон терпенового ряда; формула C 10 H 16 O. • Бесцветные легколетучие кристаллы с характерным запахом; плохо растворима в воде, хорошо — в малополярных органических растворителях, в том числе в спиртах; существует в виде двух оптически активных форм ((+)− и (−)− формы, t пл. 178, 5— 179°C) и в виде рацемической смеси, t пл. = 178— 178, 5°С. Синтетическую камфору в промышленности получают (в виде рацемической смеси) переработкой скипидара или его основного компонента — пинена. • Фармакологические свойства: • раздражает чувствительные нервные окончания кожи и подкожных тканей • расширяет поверхностные сосуды, вызывает ощущение жара • ингибирует агрегацию тромбоцитов, улучшает микроциркуляцию • оказывает умеренное антисептическое действие
Камфора • Камфора (Camphora) — терпеноил, кетон терпенового ряда; формула C 10 H 16 O. • Бесцветные легколетучие кристаллы с характерным запахом; плохо растворима в воде, хорошо — в малополярных органических растворителях, в том числе в спиртах; существует в виде двух оптически активных форм ((+)− и (−)− формы, t пл. 178, 5— 179°C) и в виде рацемической смеси, t пл. = 178— 178, 5°С. Синтетическую камфору в промышленности получают (в виде рацемической смеси) переработкой скипидара или его основного компонента — пинена. • Фармакологические свойства: • раздражает чувствительные нервные окончания кожи и подкожных тканей • расширяет поверхностные сосуды, вызывает ощущение жара • ингибирует агрегацию тромбоцитов, улучшает микроциркуляцию • оказывает умеренное антисептическое действие
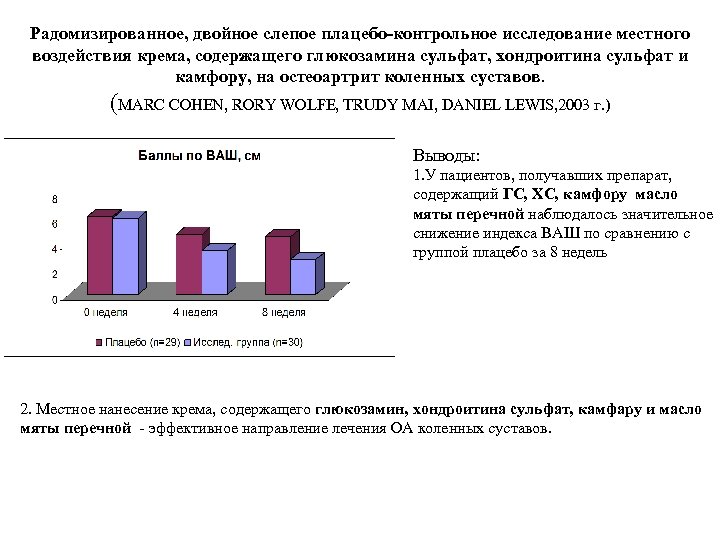 Радомизированное, двойное слепое плацебо-контрольное исследование местного воздействия крема, содержащего глюкозамина сульфат, хондроитина сульфат и камфору, на остеоартрит коленных суставов. (MARC COHEN, RORY WOLFE, TRUDY MAI, DANIEL LEWIS, 2003 г. ) Выводы: 1. У пациентов, получавших препарат, содержащий ГС, ХС, камфору масло мяты перечной наблюдалось значительное снижение индекса ВАШ по сравнению с группой плацебо за 8 недель 2. Местное нанесение крема, содержащего глюкозамин, хондроитина сульфат, камфару и масло мяты перечной эффективное направление лечения ОА коленных суставов.
Радомизированное, двойное слепое плацебо-контрольное исследование местного воздействия крема, содержащего глюкозамина сульфат, хондроитина сульфат и камфору, на остеоартрит коленных суставов. (MARC COHEN, RORY WOLFE, TRUDY MAI, DANIEL LEWIS, 2003 г. ) Выводы: 1. У пациентов, получавших препарат, содержащий ГС, ХС, камфору масло мяты перечной наблюдалось значительное снижение индекса ВАШ по сравнению с группой плацебо за 8 недель 2. Местное нанесение крема, содержащего глюкозамин, хондроитина сульфат, камфару и масло мяты перечной эффективное направление лечения ОА коленных суставов.
 ПРИМЕНЕНИЕ КРЕМА ТЕРАФЛЕКС М В КОМПЛЕКСНОМ ЛЕЧЕНИИ БОЛЬНЫХ АРТРОЗОМ КОЛЕННЫХ СУСТАВОВ Дець В. В. , Грабовская О. А. Одесский Государственный медицинский университет Украина – 2006 г.
ПРИМЕНЕНИЕ КРЕМА ТЕРАФЛЕКС М В КОМПЛЕКСНОМ ЛЕЧЕНИИ БОЛЬНЫХ АРТРОЗОМ КОЛЕННЫХ СУСТАВОВ Дець В. В. , Грабовская О. А. Одесский Государственный медицинский университет Украина – 2006 г.
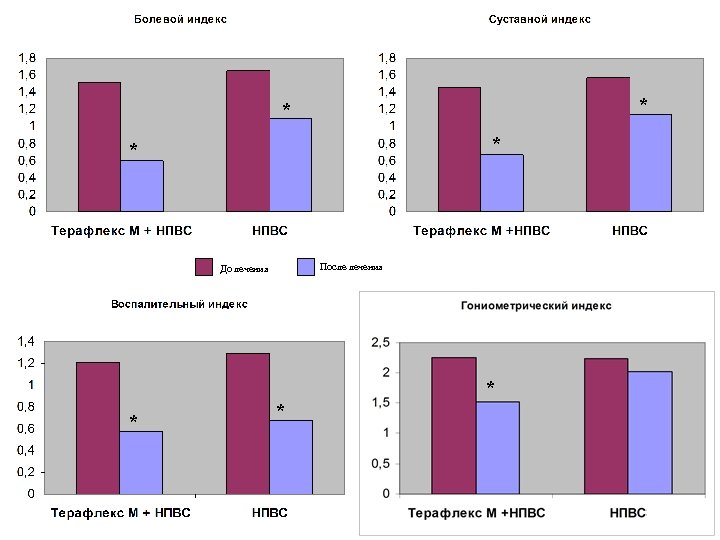 * * После лечения До лечения * * *
* * После лечения До лечения * * *
 Выводы • Крем Терафлекс М в сочетании с НПВС достоверно эффективнее, чем монотерапия НПВС у пациентов с ОА коленных суставов • Фонрофорез с кремом Терафлекс М более быстро (в 75 % случаев) купирует боль, воспалительные явления, восстанавливает объем движений в коленных суставах • Монотерапия НПВС у пациентов с гонартрозом различной степени ФНС не приводит к изменениям гониометрического показателя, в отличие от комбинированной терапии с использованием крема Терафлекс М
Выводы • Крем Терафлекс М в сочетании с НПВС достоверно эффективнее, чем монотерапия НПВС у пациентов с ОА коленных суставов • Фонрофорез с кремом Терафлекс М более быстро (в 75 % случаев) купирует боль, воспалительные явления, восстанавливает объем движений в коленных суставах • Монотерапия НПВС у пациентов с гонартрозом различной степени ФНС не приводит к изменениям гониометрического показателя, в отличие от комбинированной терапии с использованием крема Терафлекс М
 ЛОКАЛЬНАЯ ТЕРАПИЯ ОСТЕОАРТРОЗА РАЗЛИЧНОЙ ЛОКАЛИЗАЦИИ ПРЕПАРАТОМ ТЕРАФЛЕКС М (крем) Т. Д. Тябут, А. Е. Буглова, О. Ю. Фомин, Т. Н. Якушева ГУО « Бел. МАПО» , 1 ГКБ Минск – 2006 год
ЛОКАЛЬНАЯ ТЕРАПИЯ ОСТЕОАРТРОЗА РАЗЛИЧНОЙ ЛОКАЛИЗАЦИИ ПРЕПАРАТОМ ТЕРАФЛЕКС М (крем) Т. Д. Тябут, А. Е. Буглова, О. Ю. Фомин, Т. Н. Якушева ГУО « Бел. МАПО» , 1 ГКБ Минск – 2006 год
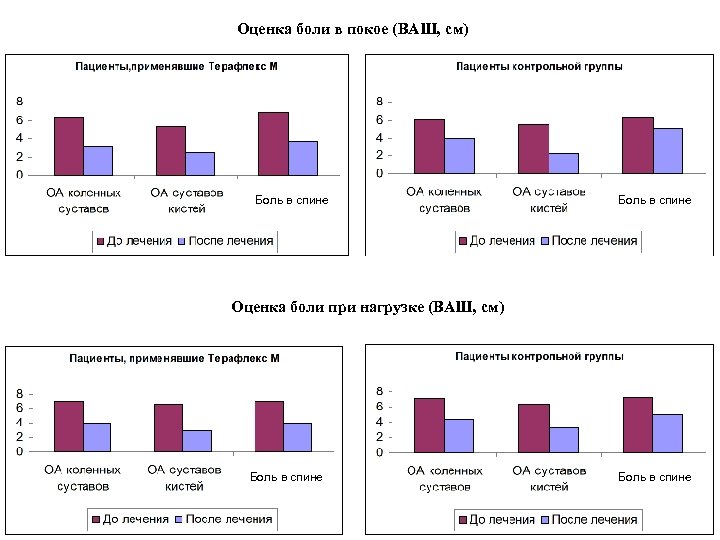 Оценка боли в покое (ВАШ, см) Боль в спине Оценка боли при нагрузке (ВАШ, см) Боль в спине
Оценка боли в покое (ВАШ, см) Боль в спине Оценка боли при нагрузке (ВАШ, см) Боль в спине
 ВЫВОДЫ • Крем Терафлекс М – эффективен как средство локальной терапии остеоартроза различной локализации и вертеброгенных болей в спине. • Крем Терафлекс М снижает уровень боли и улучшает функциональные возможности больных • Крем Терафлекс М – улучшает качество жизни пациента, как в состоянии покоя, так и при физических нагрузках. • Крем Терафлекс М – обладает хорошей переносимостью
ВЫВОДЫ • Крем Терафлекс М – эффективен как средство локальной терапии остеоартроза различной локализации и вертеброгенных болей в спине. • Крем Терафлекс М снижает уровень боли и улучшает функциональные возможности больных • Крем Терафлекс М – улучшает качество жизни пациента, как в состоянии покоя, так и при физических нагрузках. • Крем Терафлекс М – обладает хорошей переносимостью
 Список использованной литературы 1. Фоломеева О. М. , Дубинина Т. В. , Логинова Е. Ю. , и др. Заболеваемость населения России ревматическими заболеваниями в начале нового столетия. Тер арх 2003; 75(5): 5— 9. 2. Towheed T. E. , Anastassiades T. P. , Shea B. , et al. Glucosamine therapy for treating osteoarthritis (Cochrane Review). In: The Cochrane Library, 3, 2004. Chichester, UK: John Wiley & Sons, Ltd 3. Brooks P. M. Impact of osteoarthritis on individuals and society: how much disability? Social consequences and health economic implications. Current Opinion in Rheumatology 2002; 14: 573— 7 4. Morehead K. , Sack K. E. Osteoarthritis. What therapies for this disease of many causes? Postgrad Med 2003; 114(5): 11— 7. 5. Felson D. T. , Lawrence R. C. , Hochberg M. C. , et al. NIH Conference. Osteoarthritis: New Insights. Part 2. Treatment approaches. Annals of Internal Medicine 2000; 133(9): 726— 37. 6. Felson D. T. , Lawrence R. C. , Dieppe P. A. , et al. NIH Conference. Osteoarthritis: New Insights. Part 1. The disease and its risk factors. Annals of Internal Medicine 2000; 133(8): 635— 46. 7. Yelin E. The economics of osteoarthritis. In: K. D. Brandt, M. Doherty and L. S. Lohmander, editors. Osteoarthritis, Oxford: 1998, 23— 30 8. Allaire S. H. Update on work disability in rheumatic diseases. Current Opinion in Rheumatology 2001; 13: 93— 8 9. Fautrel B. , Guillemin F. Cost of illness studies in rheumatic diseases. Current Opinion in Rheumatology 2002; 14: 121— 6 10. Алексеева Л. И. Новые направления терапии остеоартроза. Фарматека 2003; (5): 20— 4. 11. Алексеева Л. И. Перспективы хондропротективной терапии остеоартроза. Научно практическая ревматология 2003; (4): 83— 6. 12. Committee for Proprietary Medicinal Products. Points to consider on clinical investigation of medicinal products used in the treatment of osteoarthritis. London, England: European Agency for th Evaluation of Medicinal Products; July 1998. 13. Food and Drug Administration. Guidance for industry: Clinical development programs for drugs, devices, and biological products intended for the treatment of osteoarthritis, Washington, DC: FDA; 1999, FDA document 07/1999
Список использованной литературы 1. Фоломеева О. М. , Дубинина Т. В. , Логинова Е. Ю. , и др. Заболеваемость населения России ревматическими заболеваниями в начале нового столетия. Тер арх 2003; 75(5): 5— 9. 2. Towheed T. E. , Anastassiades T. P. , Shea B. , et al. Glucosamine therapy for treating osteoarthritis (Cochrane Review). In: The Cochrane Library, 3, 2004. Chichester, UK: John Wiley & Sons, Ltd 3. Brooks P. M. Impact of osteoarthritis on individuals and society: how much disability? Social consequences and health economic implications. Current Opinion in Rheumatology 2002; 14: 573— 7 4. Morehead K. , Sack K. E. Osteoarthritis. What therapies for this disease of many causes? Postgrad Med 2003; 114(5): 11— 7. 5. Felson D. T. , Lawrence R. C. , Hochberg M. C. , et al. NIH Conference. Osteoarthritis: New Insights. Part 2. Treatment approaches. Annals of Internal Medicine 2000; 133(9): 726— 37. 6. Felson D. T. , Lawrence R. C. , Dieppe P. A. , et al. NIH Conference. Osteoarthritis: New Insights. Part 1. The disease and its risk factors. Annals of Internal Medicine 2000; 133(8): 635— 46. 7. Yelin E. The economics of osteoarthritis. In: K. D. Brandt, M. Doherty and L. S. Lohmander, editors. Osteoarthritis, Oxford: 1998, 23— 30 8. Allaire S. H. Update on work disability in rheumatic diseases. Current Opinion in Rheumatology 2001; 13: 93— 8 9. Fautrel B. , Guillemin F. Cost of illness studies in rheumatic diseases. Current Opinion in Rheumatology 2002; 14: 121— 6 10. Алексеева Л. И. Новые направления терапии остеоартроза. Фарматека 2003; (5): 20— 4. 11. Алексеева Л. И. Перспективы хондропротективной терапии остеоартроза. Научно практическая ревматология 2003; (4): 83— 6. 12. Committee for Proprietary Medicinal Products. Points to consider on clinical investigation of medicinal products used in the treatment of osteoarthritis. London, England: European Agency for th Evaluation of Medicinal Products; July 1998. 13. Food and Drug Administration. Guidance for industry: Clinical development programs for drugs, devices, and biological products intended for the treatment of osteoarthritis, Washington, DC: FDA; 1999, FDA document 07/1999
 14. Bellamy N. , Kirwan J. , Boers M. , et al. . Recommendations for a core set of outcome measures for future phase III clinical trials in knee, hip and hand osteoarthritis. Consensus development at OMERACT III. J Rheumatol 1997; 24: 799— 802. 15. Group for the Respect of Ethics and Excellence in Science (GREES): Osteoarthritis Section. Recommendations for the registration of drugs used in the treatment of Osteoarthritis. Ann Rheum Dis 1996; 55: 552— 7. 16. Altman R. , Brandt K. , Hochberg M. , et al. Design and conduct of clinical trials in patients with osteoarthritis: recommendations from a task force of the Osteoarthritis Research Society. Osteoarthritis Cartilage 1996; 4: 217— 43. 17. Abadie E. , Ethgen D. , Avouac B. , et al (GREES). Recommendations for the use of new methods to assess the efficacy of disease modifying drugs in the treatment of osteoarthritis. Osteoarthritis Cartilage 2004; 12(4): 263— 8. 18. Beary J. F. Joint Structure Modification in Osteoarthritis: Development of SMOAD Drugs. Current Rheumatology Reports 2001; 3: 506— 512 19. Buckland Wright J. C. , Wolfe F. , Ward R. J. , et al. Substantial superiority of semiflexed (MTP) views in knee osteoarthritis: a comparative radiographic study, without fluoroscopy of standing extended, semiflexed (MTP), and Schuss views. J Rheumatol 1999; 26: 2664– 2674. 20. Mazzuca S. A. Imaging and Osteoarthritis: What Is the Predictive Value? Current Rheumatology Reports 2003; 5: 27— 32 21. Brandt K. D. , Mazzuca S. A. , Conrozier T. , et al. Which is the best radiographic protocol for a clinical trial of a structure modifying drug in patients with knee osteoarthritis? Proceedings of January 17– 18, 2002 workshop in Toussus le Noble, France. J Rheumatol 2002; 29: 1308— 20. 22. Brandt K. D. Management of Osteoarthritis. In: Kelley's Textbook of Rheumatology, 6 th ed. , 2001, 1419— 32. 23. Pavelka K. , Gatterova J. , Gollerova V. , et al. A 5 year randomized controlled, doubleblind study of glycosaminoglycan polysulphuric acid complex (Rumalon) as a structure modifying therapy in osteoarthritis of the hip and knee. Osteoarthritis Cartilage 2000; 8(5): 335— 42.
14. Bellamy N. , Kirwan J. , Boers M. , et al. . Recommendations for a core set of outcome measures for future phase III clinical trials in knee, hip and hand osteoarthritis. Consensus development at OMERACT III. J Rheumatol 1997; 24: 799— 802. 15. Group for the Respect of Ethics and Excellence in Science (GREES): Osteoarthritis Section. Recommendations for the registration of drugs used in the treatment of Osteoarthritis. Ann Rheum Dis 1996; 55: 552— 7. 16. Altman R. , Brandt K. , Hochberg M. , et al. Design and conduct of clinical trials in patients with osteoarthritis: recommendations from a task force of the Osteoarthritis Research Society. Osteoarthritis Cartilage 1996; 4: 217— 43. 17. Abadie E. , Ethgen D. , Avouac B. , et al (GREES). Recommendations for the use of new methods to assess the efficacy of disease modifying drugs in the treatment of osteoarthritis. Osteoarthritis Cartilage 2004; 12(4): 263— 8. 18. Beary J. F. Joint Structure Modification in Osteoarthritis: Development of SMOAD Drugs. Current Rheumatology Reports 2001; 3: 506— 512 19. Buckland Wright J. C. , Wolfe F. , Ward R. J. , et al. Substantial superiority of semiflexed (MTP) views in knee osteoarthritis: a comparative radiographic study, without fluoroscopy of standing extended, semiflexed (MTP), and Schuss views. J Rheumatol 1999; 26: 2664– 2674. 20. Mazzuca S. A. Imaging and Osteoarthritis: What Is the Predictive Value? Current Rheumatology Reports 2003; 5: 27— 32 21. Brandt K. D. , Mazzuca S. A. , Conrozier T. , et al. Which is the best radiographic protocol for a clinical trial of a structure modifying drug in patients with knee osteoarthritis? Proceedings of January 17– 18, 2002 workshop in Toussus le Noble, France. J Rheumatol 2002; 29: 1308— 20. 22. Brandt K. D. Management of Osteoarthritis. In: Kelley's Textbook of Rheumatology, 6 th ed. , 2001, 1419— 32. 23. Pavelka K. , Gatterova J. , Gollerova V. , et al. A 5 year randomized controlled, doubleblind study of glycosaminoglycan polysulphuric acid complex (Rumalon) as a structure modifying therapy in osteoarthritis of the hip and knee. Osteoarthritis Cartilage 2000; 8(5): 335— 42.
 24. EULAR standardised operating procedures for the elaboration, evaluation, dissemination, and implementation of recommendations endorsed by the EULAR standing committees. Ann Rheum Dis 2004; 63: 1172— 6. 25. Jadad A. R. , Moore R. A. , Carroll D. , et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials 1996; 17(1): 1— 12. 26. Runkel D. R. , Cupp M. J. Glucosamine sulfate use in osteoarthritis. Am J Health Syst Pharm 1999; 56(3): 267— 9. 27. Gandhi N. , Laidler J. K. Preparation of glucosamine hydrochloride. Assignee: Alberta Research Council Inc. (Edmonton, CA) United States Patent 6, 486, 307 2002. 28. De Wan M. , Volpi G. Method of preparing mixed glucosamine salts. Assignee: Rotta Research B. V. Amsterdam (Swiss Branch) (Lugano, CH) United States Patent 5, 847, 107 1998. 29. Russell A. S. , Aghazadeh–Habashi A. , Jamali F. Active ingredient consistency of commercially available glucosamine sulfate products. J Rheumatol 2002; 29: 2407— 9. 30. Adebowale A. O. , Cox D. S. , Liang Z. , Eddington N. D. Analysis of glucosamine and chondroitin sulfate content in marketed products and the Caco 2 permaebility of chondroitin sulfate raw materials. J Am Nutraceutical Assoc 2000; 3: 37— 44. 31. Deal C. L. , Moskowitz R. W. Nutraceuticals as therapeutic agents in osteoarthritis. The role of glucosamine, chondroitin sulfate, and collagen hydrolysate. Rheum Dis Clin North Am 1999; 25(2): 379— 95. 32. Setnikar I. , Rovati L. C. Absorption, distribution, metabolism and excretion of glucosamine sulfate. A review. Arzneimittel Forsch 2001; 51: 699— 725. 33. Aghazadeh Habashi A. , Sattari S. , Pasutto F. M. , et al. Single dose pharmacokinetics and bioavailability of glucosamine in the rat. J Pharm Sci 2002; 5(2): 181— 4
24. EULAR standardised operating procedures for the elaboration, evaluation, dissemination, and implementation of recommendations endorsed by the EULAR standing committees. Ann Rheum Dis 2004; 63: 1172— 6. 25. Jadad A. R. , Moore R. A. , Carroll D. , et al. Assessing the quality of reports of randomized clinical trials: is blinding necessary? Control Clin Trials 1996; 17(1): 1— 12. 26. Runkel D. R. , Cupp M. J. Glucosamine sulfate use in osteoarthritis. Am J Health Syst Pharm 1999; 56(3): 267— 9. 27. Gandhi N. , Laidler J. K. Preparation of glucosamine hydrochloride. Assignee: Alberta Research Council Inc. (Edmonton, CA) United States Patent 6, 486, 307 2002. 28. De Wan M. , Volpi G. Method of preparing mixed glucosamine salts. Assignee: Rotta Research B. V. Amsterdam (Swiss Branch) (Lugano, CH) United States Patent 5, 847, 107 1998. 29. Russell A. S. , Aghazadeh–Habashi A. , Jamali F. Active ingredient consistency of commercially available glucosamine sulfate products. J Rheumatol 2002; 29: 2407— 9. 30. Adebowale A. O. , Cox D. S. , Liang Z. , Eddington N. D. Analysis of glucosamine and chondroitin sulfate content in marketed products and the Caco 2 permaebility of chondroitin sulfate raw materials. J Am Nutraceutical Assoc 2000; 3: 37— 44. 31. Deal C. L. , Moskowitz R. W. Nutraceuticals as therapeutic agents in osteoarthritis. The role of glucosamine, chondroitin sulfate, and collagen hydrolysate. Rheum Dis Clin North Am 1999; 25(2): 379— 95. 32. Setnikar I. , Rovati L. C. Absorption, distribution, metabolism and excretion of glucosamine sulfate. A review. Arzneimittel Forsch 2001; 51: 699— 725. 33. Aghazadeh Habashi A. , Sattari S. , Pasutto F. M. , et al. Single dose pharmacokinetics and bioavailability of glucosamine in the rat. J Pharm Sci 2002; 5(2): 181— 4
 34. Setnikar I. , Palumbo R. , Canali S. , et al. Pharmacokinetics of glucosamine in man. Arzneimittel Forsch 1993; 43(10): 1109— 13. 35. Barclay T. S. , Tsourounis C. , Mc. Cart G. M. Glucosamine. Ann Pharmacother 1998; 32(5): 574— 9. 36. Institute of Medicine. Safety review: Draft 3 prototype monograph on glucosamine. Washington, DC, National Academy of Sciences 2003: 1— 84. 37. Senin P. , Makovec F. , Rovati L. Stable compounds of glucosamine sulphate. Assignee: Rotta Research Laboratorium S. p. A. (Milan, IT) United States Patent 4, 642, 340 1987. 38. Almada A. , Harvey P. , Platt K. Effects of chronic oral glucosamine sulfate on fasting insulin resistance index (FIRI) in non diabetic individuals [Abstract]. FASEB J 2000; 14(4): A 750. 39. Monauni T. , Zenti M. G. , Cretti A. , et al. Effects of glucosamine infusion on insulin secretion and insulin action in humans. Diabetes 2000; 49(6): 926— 935. 40. Yu J. G. , Boies S. M. , Olefsky J. M. The effect of oral glucosamine sulfate on insulin sensitivity in human subjects. Diabetes Care 2003; 26: 1941— 2. 41. Scroggie D. A. , Albright A. , Harris M. D. The effect of glucosamine chondroitin supplementation on glycosylated hemoglobin levels in patients with type 2 diabetes mellitus: a placebo controlled, double blinded, randomized clinical trial. Arch Intern Med 2003; 163(13): 1587— 90. 42. Richy F. , Bruyere O. , Ethgen O. , et al. Structural and symptomatic efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta analysis. Archntern Med 2003; 163: 1514— 22. 43. Mc. Alindon T. Glucosamine and chondroitin for osteoarthritis? Bulletin on the rheumatic diseases 2001; 50(7): 1— 4. 44. Kayne S. B. , Wadeson K. , Mac. Adam A. Is glucosamine an effective treatment for osteoarthritis? A meta analysis. Pharm J 2000; 265: 759— 63. 45. Towheed T. E. , Hochberg M. C. A systematic review of randomized controlled trials of pharmacological therapy in osteoarthritis of the knee with an emphasis on trial methodology. Sem Arthritis Rheum 1997; 26(5): 755— 70. 46. Glucosamine and Arthritis. Bandolier. Evidence based thinking about healthcare 1997; 46(2).
34. Setnikar I. , Palumbo R. , Canali S. , et al. Pharmacokinetics of glucosamine in man. Arzneimittel Forsch 1993; 43(10): 1109— 13. 35. Barclay T. S. , Tsourounis C. , Mc. Cart G. M. Glucosamine. Ann Pharmacother 1998; 32(5): 574— 9. 36. Institute of Medicine. Safety review: Draft 3 prototype monograph on glucosamine. Washington, DC, National Academy of Sciences 2003: 1— 84. 37. Senin P. , Makovec F. , Rovati L. Stable compounds of glucosamine sulphate. Assignee: Rotta Research Laboratorium S. p. A. (Milan, IT) United States Patent 4, 642, 340 1987. 38. Almada A. , Harvey P. , Platt K. Effects of chronic oral glucosamine sulfate on fasting insulin resistance index (FIRI) in non diabetic individuals [Abstract]. FASEB J 2000; 14(4): A 750. 39. Monauni T. , Zenti M. G. , Cretti A. , et al. Effects of glucosamine infusion on insulin secretion and insulin action in humans. Diabetes 2000; 49(6): 926— 935. 40. Yu J. G. , Boies S. M. , Olefsky J. M. The effect of oral glucosamine sulfate on insulin sensitivity in human subjects. Diabetes Care 2003; 26: 1941— 2. 41. Scroggie D. A. , Albright A. , Harris M. D. The effect of glucosamine chondroitin supplementation on glycosylated hemoglobin levels in patients with type 2 diabetes mellitus: a placebo controlled, double blinded, randomized clinical trial. Arch Intern Med 2003; 163(13): 1587— 90. 42. Richy F. , Bruyere O. , Ethgen O. , et al. Structural and symptomatic efficacy of glucosamine and chondroitin in knee osteoarthritis: a comprehensive meta analysis. Archntern Med 2003; 163: 1514— 22. 43. Mc. Alindon T. Glucosamine and chondroitin for osteoarthritis? Bulletin on the rheumatic diseases 2001; 50(7): 1— 4. 44. Kayne S. B. , Wadeson K. , Mac. Adam A. Is glucosamine an effective treatment for osteoarthritis? A meta analysis. Pharm J 2000; 265: 759— 63. 45. Towheed T. E. , Hochberg M. C. A systematic review of randomized controlled trials of pharmacological therapy in osteoarthritis of the knee with an emphasis on trial methodology. Sem Arthritis Rheum 1997; 26(5): 755— 70. 46. Glucosamine and Arthritis. Bandolier. Evidence based thinking about healthcare 1997; 46(2).
 47. Mc. Alindon T. E. , La. Valley M. P. , Gulin J. P. , et al. Glucosamine and chondroitin for treatment of osteoarthritis. A systematic quality assessment and meta analysis. JAMA 2000; 283(11): 1469— 75. 48. Hauselmann H. J. Nutripharmaceuticals for osteoarthritis. Best Practice and Research Clinical Rheumatology 2001; 15(4): 595— 607. 49. Glucosamine and Arthritis Update. Bandolier. Evidence based thinking about healthcare 2001; 85(2). 50. Ruane R. , Griffiths P. Glucosamine therapy compared to ibuprofen for joint pain. British Journal of Community Nursing 2002; 7(3): 148— 52. 51. Pujalte J. M. , Llavore E. P. , Ylescupidez F. R. Double blind clinical evaluation of oral glucosamine sulphate in the basic treatment of arthritis. Curr Med Res Opin 1980; 7: 110— 4. 52. Crolle G. , D'Este E. Glucosamine sulphate for the management of arthrosis: a controlled clinical investigation. Curr Med Res Opin 1980; 7(2): 104— 9. 31 53. D'Ambrosio E. , Casa B. , Bompani R. , et al. Glucosamine sulfate: a controlled clinical investigation in arthrosis. Pharmacotherpeutica 1981; 2: 504— 8. 54. Drovanti A. , Bigamini A. A. , Rovati A. L. Therapeutic activity of oral glucosamine sulfate in osteoarthrosis: A placebo controlled double blind investigation. Clin Ther 1980; 3: 260— 72. 55. Vas A. L. Double blind clinical evaluation of the relative efficacy of ibuprofen and glucosamine sulphate in the management of osteoarthritis of the knee in out patients. Cur. Med Res Opin 1982; 8(3): 145— 9. 56. Noack W. , Fischer M. , Foerster K. K. , et al. Glucosamine sulfate in osteoarthritis of the knee. Osteoarthritis Cartilage 1994; 2: 51— 9. 57. Reichelt A. , Forster K. K. , Fischer M. , et al. Efficacy and safety of intramuscular Glucosamine sulfate in osteoarthritis of the knee: a randomised, placebo controlled, double blind study. Arzneimittel Forsch 1994; 44(1): 75— 80. 58. Mueller Fassbender H. , Bach G. L. , Haase W. , et al. Glucosamine sulfate compared to ibuprofen in osteoarthritis of the knee. Osteoarthritis Cartilage 1994; 2: 61— 9. 59. Rovati L. C. The clinical profile of Glucosamine sulfate as a selective symptom modifiyng drug in osteoarthritis: current data and perspectives [Abstract]. Osteoarthritis Cartilage 1997; 5 (Suppl A): 72. 60. Houpt J. B. . , Mc. Millan R, Wein C. et al. Effect of glucosamine hydrochloride in the treatment of pain of osteoarthritis of the knee. J Rheumatol 1999; 26: 2423— 30
47. Mc. Alindon T. E. , La. Valley M. P. , Gulin J. P. , et al. Glucosamine and chondroitin for treatment of osteoarthritis. A systematic quality assessment and meta analysis. JAMA 2000; 283(11): 1469— 75. 48. Hauselmann H. J. Nutripharmaceuticals for osteoarthritis. Best Practice and Research Clinical Rheumatology 2001; 15(4): 595— 607. 49. Glucosamine and Arthritis Update. Bandolier. Evidence based thinking about healthcare 2001; 85(2). 50. Ruane R. , Griffiths P. Glucosamine therapy compared to ibuprofen for joint pain. British Journal of Community Nursing 2002; 7(3): 148— 52. 51. Pujalte J. M. , Llavore E. P. , Ylescupidez F. R. Double blind clinical evaluation of oral glucosamine sulphate in the basic treatment of arthritis. Curr Med Res Opin 1980; 7: 110— 4. 52. Crolle G. , D'Este E. Glucosamine sulphate for the management of arthrosis: a controlled clinical investigation. Curr Med Res Opin 1980; 7(2): 104— 9. 31 53. D'Ambrosio E. , Casa B. , Bompani R. , et al. Glucosamine sulfate: a controlled clinical investigation in arthrosis. Pharmacotherpeutica 1981; 2: 504— 8. 54. Drovanti A. , Bigamini A. A. , Rovati A. L. Therapeutic activity of oral glucosamine sulfate in osteoarthrosis: A placebo controlled double blind investigation. Clin Ther 1980; 3: 260— 72. 55. Vas A. L. Double blind clinical evaluation of the relative efficacy of ibuprofen and glucosamine sulphate in the management of osteoarthritis of the knee in out patients. Cur. Med Res Opin 1982; 8(3): 145— 9. 56. Noack W. , Fischer M. , Foerster K. K. , et al. Glucosamine sulfate in osteoarthritis of the knee. Osteoarthritis Cartilage 1994; 2: 51— 9. 57. Reichelt A. , Forster K. K. , Fischer M. , et al. Efficacy and safety of intramuscular Glucosamine sulfate in osteoarthritis of the knee: a randomised, placebo controlled, double blind study. Arzneimittel Forsch 1994; 44(1): 75— 80. 58. Mueller Fassbender H. , Bach G. L. , Haase W. , et al. Glucosamine sulfate compared to ibuprofen in osteoarthritis of the knee. Osteoarthritis Cartilage 1994; 2: 61— 9. 59. Rovati L. C. The clinical profile of Glucosamine sulfate as a selective symptom modifiyng drug in osteoarthritis: current data and perspectives [Abstract]. Osteoarthritis Cartilage 1997; 5 (Suppl A): 72. 60. Houpt J. B. . , Mc. Millan R, Wein C. et al. Effect of glucosamine hydrochloride in the treatment of pain of osteoarthritis of the knee. J Rheumatol 1999; 26: 2423— 30
 61. Rindone J. P. , Hiller D. , Collacott E. et al. Randomized, controlled trial of glucosamine for treating osteoarthritis of the knee. West J Med 2000; 172(2): 91— 4. 62. Hughes R. , Carr A. A randomized, double blind, placebo controlled trial of glucosamine sulphate as an analgesic in osteoarthritis of the knee. Rheumatology 2002; 41(3): 279— 84. 63. Cibere J. , Kopec J. A. , Thorne A. , et al. Randomized, double blind, placebo controlled glucosamine discontinuation trial in knee osteoarthritis. Arthritis Rheum (Arthritis Care Res) 2004; 51(5): 738— 45. 64. Van der Kran P. M. , de. Vries B. J. , Vitters E. L. , et al. Inhibition of glycosaminoglycan synthesis in anatomically intact rat patellar cartilage by paracetamol induced sulfate depletion. Biochem Pharmacol 1988; 37: 3683— 90. 65. Reginster J. Y. , Deroisy R. , Rovati L. C. , et al. Long term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo controlled clinical trial. Lancet 2001; 357(9252): 251— 6. 66. Pavelka K. , Gatterova J. , Olejarova M. , et al. Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3 year, randomized, placebo controlled, doubleblind study. Arch Intern Med 2002; 162(18): 2113— 23. 67. Bruyere O. , Honore A. , Ethgen O. , et al. Correlation between radiographic severity of knee osteoarthritis and future disease progression. Results from a 3 year prospective, placebo controlled study evaluating the effect of glucosamine sulfate. Osteoarthritis and Cartilage 2003; 11: 1— 5. 68. Pavelka K. , Bruyere O. , Rovati L. C. , et al. Relief in mild to moderate pain is not a confounder in joint space narrowing assessment of full extension knee radiographs in recent osteoarthritis structure modifying drug trials. Osteoarthritis Cartilage 2003; 11(10): 730— 7. 32 69. Bruyere O. , Compere S. , Rovati L. C. , et al. Five year Follow up of Patients from a Previous 3 year Randomised, Controlled Trial of Glucosamine Sulfate in Knee Osteoarthritis [Abstract]. Arthritis Rheum 2003; 48(Suppl. ): A 89. 70. Pavelka K. , Gatterová J. , Giacovelli G. , et al. Glucosamine sulfate prevents total joint replacement in the long term follow up of knee osteoarthritis patients [Abstract]. Arthritis Rheum 2004; 49(Suppl. ): A 251 71. Bruyere O. , Pavelka K. , Rovati L. C. , et al. Glucosamine sulfate reduces osteoarthritis progression in postmenopausal women with knee osteoarthritis: evidence from two 3 year studies. Menopause 2004; 11(2): 138— 43. 72. Mantovani L. G. , Belisari A. , Cristoforetti C. , et al. Cost benefit analysis of glucosamine sulfate use [Abstract]. Ann Rheum Dis 2001; 60(Suppl 1): 236.
61. Rindone J. P. , Hiller D. , Collacott E. et al. Randomized, controlled trial of glucosamine for treating osteoarthritis of the knee. West J Med 2000; 172(2): 91— 4. 62. Hughes R. , Carr A. A randomized, double blind, placebo controlled trial of glucosamine sulphate as an analgesic in osteoarthritis of the knee. Rheumatology 2002; 41(3): 279— 84. 63. Cibere J. , Kopec J. A. , Thorne A. , et al. Randomized, double blind, placebo controlled glucosamine discontinuation trial in knee osteoarthritis. Arthritis Rheum (Arthritis Care Res) 2004; 51(5): 738— 45. 64. Van der Kran P. M. , de. Vries B. J. , Vitters E. L. , et al. Inhibition of glycosaminoglycan synthesis in anatomically intact rat patellar cartilage by paracetamol induced sulfate depletion. Biochem Pharmacol 1988; 37: 3683— 90. 65. Reginster J. Y. , Deroisy R. , Rovati L. C. , et al. Long term effects of glucosamine sulphate on osteoarthritis progression: a randomised, placebo controlled clinical trial. Lancet 2001; 357(9252): 251— 6. 66. Pavelka K. , Gatterova J. , Olejarova M. , et al. Glucosamine sulfate use and delay of progression of knee osteoarthritis: a 3 year, randomized, placebo controlled, doubleblind study. Arch Intern Med 2002; 162(18): 2113— 23. 67. Bruyere O. , Honore A. , Ethgen O. , et al. Correlation between radiographic severity of knee osteoarthritis and future disease progression. Results from a 3 year prospective, placebo controlled study evaluating the effect of glucosamine sulfate. Osteoarthritis and Cartilage 2003; 11: 1— 5. 68. Pavelka K. , Bruyere O. , Rovati L. C. , et al. Relief in mild to moderate pain is not a confounder in joint space narrowing assessment of full extension knee radiographs in recent osteoarthritis structure modifying drug trials. Osteoarthritis Cartilage 2003; 11(10): 730— 7. 32 69. Bruyere O. , Compere S. , Rovati L. C. , et al. Five year Follow up of Patients from a Previous 3 year Randomised, Controlled Trial of Glucosamine Sulfate in Knee Osteoarthritis [Abstract]. Arthritis Rheum 2003; 48(Suppl. ): A 89. 70. Pavelka K. , Gatterová J. , Giacovelli G. , et al. Glucosamine sulfate prevents total joint replacement in the long term follow up of knee osteoarthritis patients [Abstract]. Arthritis Rheum 2004; 49(Suppl. ): A 251 71. Bruyere O. , Pavelka K. , Rovati L. C. , et al. Glucosamine sulfate reduces osteoarthritis progression in postmenopausal women with knee osteoarthritis: evidence from two 3 year studies. Menopause 2004; 11(2): 138— 43. 72. Mantovani L. G. , Belisari A. , Cristoforetti C. , et al. Cost benefit analysis of glucosamine sulfate use [Abstract]. Ann Rheum Dis 2001; 60(Suppl 1): 236.
 72. Jordan K. M. , Arden N. K. , Doherty M. , et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003; 62: 1145— 55 73. Насонов Е. Л. , Алексеева Л. И. Хондроитин сульфат (Структум) при лечении остеоартроза: патогенетическое обоснование и клиническая эффективность. Тер арх 2001; 73 (11): 87— 9. 74. Bali J. P. , Cousse H. , Neuzil E. Biochemical basis of the pharmacological action of chondroitin sulfates on the osteoarticular system. Sem Arthritis Rheum 2001; 31: 58— 68. 75. Nerucci F. , Fioravanti A. , Cicero M. R. , et al. Effects of chondroitin sulfate and interleukin 1 on human chondrocyte cultures exposed to pressurization: a biochemical and morphological study. Osteoarthritis Cartilage 2000, 8: 279— 87. 76. Baici A. , Hörler D. , Moser B. , et al. Analysis of glycosaminoglycans in human serum after oral administration of chondroitin sulfate. Rheumatol Int 1992; 12: 81— 8. 77. Conte A. , Volpi N. , Palmieri L. , et al. Biochemical and pharmacokinetic aspects of oral treatment with chondroitin sulfate. Arzneimittel Forsch 1995; 45: 918— 25. 78. Adebowale A. , Du J. , Liang Z. , et al. The bioavailability and pharmacokinetics of glucosamine hydrochloride and low molecular weight chondroitin sulfate after single and multiple doses to beagle dogs. Biopharm Drug Dispos 2002; 23: 217— 25. 79. Volpi N. Oral bioavailability of chondroitin sulfate (Condrosulf((R)) and its constituents in healthy male volunteers. Osteoarthritis Cartilage 2002; 10: 768— 71. 80. Structure modifying Drugs for Osteoarthritis – The Role of Chondroitin 4&6 Sulphate. A report by IBSA, Institut Biochimique SA. Business Briefing: European Pharmaco. Therapy January 2003. 81. A Pharmacokinetic Study of Glucosamine and Chondroitin. Study ID Numbers 1 R 21 AT 001938 01, NLM Identifier NCT 00086229. http: //clinicaltrials. gov/show/ NCT 00086229 Clinical. Trials. gov processed this record on 2004 08 19
72. Jordan K. M. , Arden N. K. , Doherty M. , et al. EULAR Recommendations 2003: an evidence based approach to the management of knee osteoarthritis: Report of a Task Force of the Standing Committee for International Clinical Studies Including Therapeutic Trials (ESCISIT). Ann Rheum Dis 2003; 62: 1145— 55 73. Насонов Е. Л. , Алексеева Л. И. Хондроитин сульфат (Структум) при лечении остеоартроза: патогенетическое обоснование и клиническая эффективность. Тер арх 2001; 73 (11): 87— 9. 74. Bali J. P. , Cousse H. , Neuzil E. Biochemical basis of the pharmacological action of chondroitin sulfates on the osteoarticular system. Sem Arthritis Rheum 2001; 31: 58— 68. 75. Nerucci F. , Fioravanti A. , Cicero M. R. , et al. Effects of chondroitin sulfate and interleukin 1 on human chondrocyte cultures exposed to pressurization: a biochemical and morphological study. Osteoarthritis Cartilage 2000, 8: 279— 87. 76. Baici A. , Hörler D. , Moser B. , et al. Analysis of glycosaminoglycans in human serum after oral administration of chondroitin sulfate. Rheumatol Int 1992; 12: 81— 8. 77. Conte A. , Volpi N. , Palmieri L. , et al. Biochemical and pharmacokinetic aspects of oral treatment with chondroitin sulfate. Arzneimittel Forsch 1995; 45: 918— 25. 78. Adebowale A. , Du J. , Liang Z. , et al. The bioavailability and pharmacokinetics of glucosamine hydrochloride and low molecular weight chondroitin sulfate after single and multiple doses to beagle dogs. Biopharm Drug Dispos 2002; 23: 217— 25. 79. Volpi N. Oral bioavailability of chondroitin sulfate (Condrosulf((R)) and its constituents in healthy male volunteers. Osteoarthritis Cartilage 2002; 10: 768— 71. 80. Structure modifying Drugs for Osteoarthritis – The Role of Chondroitin 4&6 Sulphate. A report by IBSA, Institut Biochimique SA. Business Briefing: European Pharmaco. Therapy January 2003. 81. A Pharmacokinetic Study of Glucosamine and Chondroitin. Study ID Numbers 1 R 21 AT 001938 01, NLM Identifier NCT 00086229. http: //clinicaltrials. gov/show/ NCT 00086229 Clinical. Trials. gov processed this record on 2004 08 19


