6 Сложные вещества_new.ppt
- Количество слайдов: 20
 Сложные соединения
Сложные соединения
 • Число компонентов – 3 и более • Традиционное деление: основания, кислоты и соли (в т. ч. и комплексные • Исключения: карбонилы металлов, многие хелаты и внутрикомплексные соединения, соединения типа Cd. Sn. As 2, Zn. Ge. P 2, Cu. Fe. S 2 и др. • Универсальный признак для единой классификации – доминирующий тип химической связи 2
• Число компонентов – 3 и более • Традиционное деление: основания, кислоты и соли (в т. ч. и комплексные • Исключения: карбонилы металлов, многие хелаты и внутрикомплексные соединения, соединения типа Cd. Sn. As 2, Zn. Ge. P 2, Cu. Fe. S 2 и др. • Универсальный признак для единой классификации – доминирующий тип химической связи 2
 • Доминирует ионное взаимодействие, по крайней мере между отдельными фрагментами. Сюда относятся сложные соли, кислоты и основания. • Отличительная особенность – гетеродесмичный характер структур. Внутри фрагментов преимущественно ковалентные взаимодействия, между ними — преимущественное ионное. ▪ K 2 SO 4 – ромбическая структура, в узлах тетраэдры SO 4 и атомы K. Между фрагментами – преимущественно ионная связь, внутри – ковалентная (S-O) ▪ K 2[Pt. Cl 6]. Октаэдры Pt. Cl 6 (ковалентная связь) занимает позиции в ГЦК ячейке, а атомы K связаны с ними ионной связью и располагаются в тетраэдрических пустотах 3
• Доминирует ионное взаимодействие, по крайней мере между отдельными фрагментами. Сюда относятся сложные соли, кислоты и основания. • Отличительная особенность – гетеродесмичный характер структур. Внутри фрагментов преимущественно ковалентные взаимодействия, между ними — преимущественное ионное. ▪ K 2 SO 4 – ромбическая структура, в узлах тетраэдры SO 4 и атомы K. Между фрагментами – преимущественно ионная связь, внутри – ковалентная (S-O) ▪ K 2[Pt. Cl 6]. Октаэдры Pt. Cl 6 (ковалентная связь) занимает позиции в ГЦК ячейке, а атомы K связаны с ними ионной связью и располагаются в тетраэдрических пустотах 3
 • Вещества, в которых наблюдается только ковалентные взаимодействия. Они не обладают ни кислотным, ни основным, ни солеобразным характером. ▪ Cu. Fe. S 2 – халькопирит, тетраэдрические гибридные ковалентные sp 3 -связи, к. ч. = 4 ▪ Cd. Sn. P 2, Zn. Ge. As 2 – тройные алмазоподобные п/п, изоэлектронные аналоги AIIIBV. Трехмерные ковалентные структуры, к. ч. = 4. 4
• Вещества, в которых наблюдается только ковалентные взаимодействия. Они не обладают ни кислотным, ни основным, ни солеобразным характером. ▪ Cu. Fe. S 2 – халькопирит, тетраэдрические гибридные ковалентные sp 3 -связи, к. ч. = 4 ▪ Cd. Sn. P 2, Zn. Ge. As 2 – тройные алмазоподобные п/п, изоэлектронные аналоги AIIIBV. Трехмерные ковалентные структуры, к. ч. = 4. 4
 • Кроме гомодесмичных тетраэдрических структур могут реализовываться слоистые, островковые, цепные, молекулярные структуры ▪ Карбонилы переходных металлов, внутрикомплексные соединения и хелаты • Между фрагментами ван-дер-ваальсовы взаимодействия 5
• Кроме гомодесмичных тетраэдрических структур могут реализовываться слоистые, островковые, цепные, молекулярные структуры ▪ Карбонилы переходных металлов, внутрикомплексные соединения и хелаты • Между фрагментами ван-дер-ваальсовы взаимодействия 5
 • Интерметаллические многокомпонентные фазы с доминирующим металлическим типом связи • Реализация плотноупакованных структур с широкими областями гомогенности 6
• Интерметаллические многокомпонентные фазы с доминирующим металлическим типом связи • Реализация плотноупакованных структур с широкими областями гомогенности 6
 Генетическая связь сложных соединений с более простыми • H 2 SO 4 – SO 3 + H 2 O • Ca(OH)2 – Ca. O + H 2 O • 2 Al(OH)3 – Al 2 O 3 + 3 H 2 O • Cu(OH)2 – Cu. O + H 2 O • Na 2 Si. O 3 – Na 2 O + Si. O 2 Можно рассматривать как продукты взаимодействия, хотя прямая реакция неосуществима • Формально: Cu. Fe. S 2 – Cu. S + Fe. S; Cd. Sn. P 2 – Cd 3 P 2 + Sn 3 P 4 • Этот справедливо и для комплексных соединений ▪ 4 KCN + Fe(CN)2 = K 4[Fe(CN)6] ▪ 3 Na. F + Al. F 3 = Na 3[Al. F 6] 7
Генетическая связь сложных соединений с более простыми • H 2 SO 4 – SO 3 + H 2 O • Ca(OH)2 – Ca. O + H 2 O • 2 Al(OH)3 – Al 2 O 3 + 3 H 2 O • Cu(OH)2 – Cu. O + H 2 O • Na 2 Si. O 3 – Na 2 O + Si. O 2 Можно рассматривать как продукты взаимодействия, хотя прямая реакция неосуществима • Формально: Cu. Fe. S 2 – Cu. S + Fe. S; Cd. Sn. P 2 – Cd 3 P 2 + Sn 3 P 4 • Этот справедливо и для комплексных соединений ▪ 4 KCN + Fe(CN)2 = K 4[Fe(CN)6] ▪ 3 Na. F + Al. F 3 = Na 3[Al. F 6] 7
 Сложные минералы • Mg 3 H 4 Si 2 O 9 – 3 Mg. O · 2 Si. O 2 · 2 H 2 O (асбест) • H 4 Al 2 Si 2 O 9 – Al 2 O 3 · 2 Si. O 2 · 2 H 2 O (каолин) • Чем резче бинарные соединения отличаются друг от друга по свойствам, тем более вероятно возникновение сильно полярного взаимодействия между структурными фрагментами сложного соединения (основания, кислоты, соли). • Иначе – преимущественно ионное взаимодействие не реализуется 8
Сложные минералы • Mg 3 H 4 Si 2 O 9 – 3 Mg. O · 2 Si. O 2 · 2 H 2 O (асбест) • H 4 Al 2 Si 2 O 9 – Al 2 O 3 · 2 Si. O 2 · 2 H 2 O (каолин) • Чем резче бинарные соединения отличаются друг от друга по свойствам, тем более вероятно возникновение сильно полярного взаимодействия между структурными фрагментами сложного соединения (основания, кислоты, соли). • Иначе – преимущественно ионное взаимодействие не реализуется 8
 • Неравноценность функций бинарных соединений, составляющих сложное • K 2 Al 2 Si 6 O 16 – K 2 O · Al 2 O 3 · 6 Si. O 2 (ортоклаз) Связан с каркасом преимущественно ионной связью, выщелачивается водой 9 Ковалентный алюмосиликатный каркас
• Неравноценность функций бинарных соединений, составляющих сложное • K 2 Al 2 Si 6 O 16 – K 2 O · Al 2 O 3 · 6 Si. O 2 (ортоклаз) Связан с каркасом преимущественно ионной связью, выщелачивается водой 9 Ковалентный алюмосиликатный каркас
 Гидроксиды как характеристические соединения
Гидроксиды как характеристические соединения
 • Гидроксиды рассматриваются как продукты взаимодействия оксидов с водой, независимо от того, может ли это взаимодействие происходить в действительности или гидроксид может быть получен только косвенным путем H 2 O + H 2 O = H 3 O+ + OH– • Свойства гидроксида определяют принадлежность элемента к металлам (основания) или неметаллам (кислоты) • Этими характеристическими свойствами гидроксиды обладают только в H 2 O растворах N 2 O 5 + H 2 O HNO 3 → H+ + NO 3– сильная кислота HNO 3 + HF → H 2 NO 3+ + F– 11 типичное сжиженный основание фтороводород
• Гидроксиды рассматриваются как продукты взаимодействия оксидов с водой, независимо от того, может ли это взаимодействие происходить в действительности или гидроксид может быть получен только косвенным путем H 2 O + H 2 O = H 3 O+ + OH– • Свойства гидроксида определяют принадлежность элемента к металлам (основания) или неметаллам (кислоты) • Этими характеристическими свойствами гидроксиды обладают только в H 2 O растворах N 2 O 5 + H 2 O HNO 3 → H+ + NO 3– сильная кислота HNO 3 + HF → H 2 NO 3+ + F– 11 типичное сжиженный основание фтороводород
 • Характер диссоциации гидроксидов (по кислотному или основному типу), а также степень диссоциации зависит от природы растворителя, его донорно-акцепторной активности по отношению к протону • В ряду HF — H 2 O — NH 3 увеличивается сродство к протону, поэтому слабые в водных растворах кислоты становятся сильными в средах жидкого NH 3 и основаниями в среде жидкого HF 12
• Характер диссоциации гидроксидов (по кислотному или основному типу), а также степень диссоциации зависит от природы растворителя, его донорно-акцепторной активности по отношению к протону • В ряду HF — H 2 O — NH 3 увеличивается сродство к протону, поэтому слабые в водных растворах кислоты становятся сильными в средах жидкого NH 3 и основаниями в среде жидкого HF 12
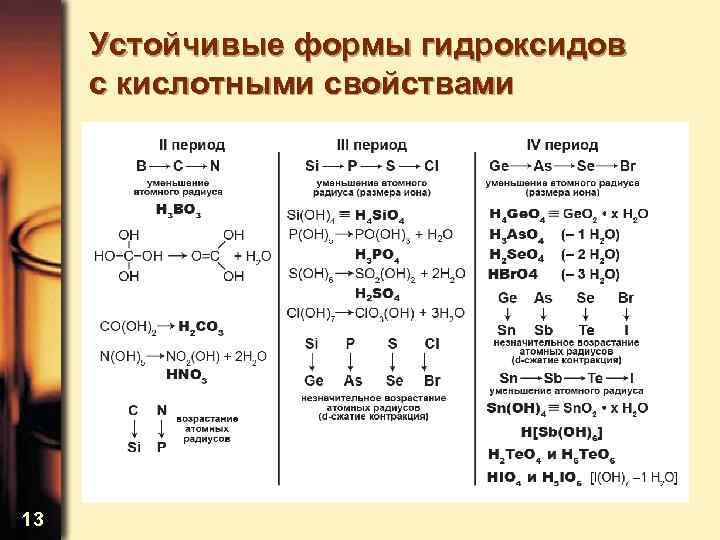 Устойчивые формы гидроксидов с кислотными свойствами 13
Устойчивые формы гидроксидов с кислотными свойствами 13
 Кислотные гидроксиды переходных металлов в высших степенях окисления 14
Кислотные гидроксиды переходных металлов в высших степенях окисления 14
 • Э(OH)n (m = 0) – очень слабые кислоты ▪ (H 3 PO 3, HOCl, H 6 Te. O 6) ▪ Kдис. = 10– 8— 10– 10 • ЭO(OH)n (m = 1) – слабые кислоты ▪ HCl. O 2, HNO 2, H 2 CO 3 ▪ Kдис. = 10– 2— 10– 4 • ЭO 2(OH)2 (m = 2) – сильные кислоты ▪ HNO 3 Kдис. = 4· 101 ▪ H 2 SO 4 Kдис. = 1· 103 • ЭO 3(OH)n (m = 3) – очень сильные кислоты ▪ HCl. O 4 Kдис. = 1· 1010 15
• Э(OH)n (m = 0) – очень слабые кислоты ▪ (H 3 PO 3, HOCl, H 6 Te. O 6) ▪ Kдис. = 10– 8— 10– 10 • ЭO(OH)n (m = 1) – слабые кислоты ▪ HCl. O 2, HNO 2, H 2 CO 3 ▪ Kдис. = 10– 2— 10– 4 • ЭO 2(OH)2 (m = 2) – сильные кислоты ▪ HNO 3 Kдис. = 4· 101 ▪ H 2 SO 4 Kдис. = 1· 103 • ЭO 3(OH)n (m = 3) – очень сильные кислоты ▪ HCl. O 4 Kдис. = 1· 1010 15
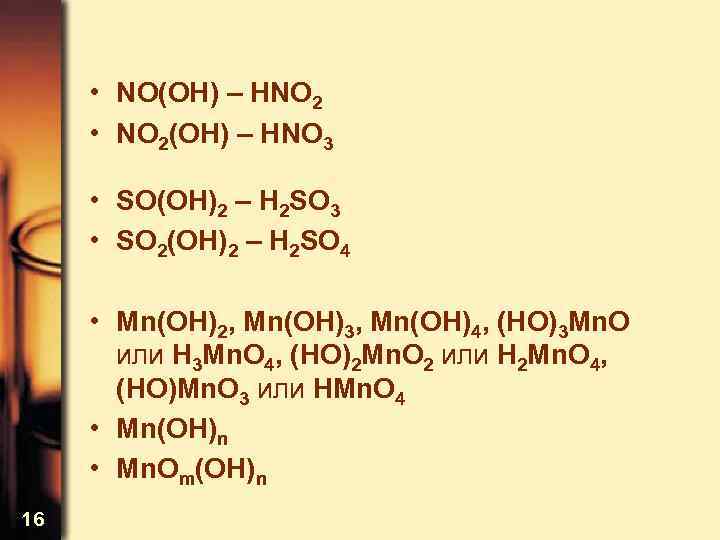 • NO(OH) – HNO 2 • NO 2(OH) – HNO 3 • SO(OH)2 – H 2 SO 3 • SO 2(OH)2 – H 2 SO 4 • Mn(OH)2, Mn(OH)3, Mn(OH)4, (HO)3 Mn. O или H 3 Mn. O 4, (HO)2 Mn. O 2 или H 2 Mn. O 4, (HO)Mn. O 3 или HMn. O 4 • Mn(OH)n • Mn. Om(OH)n 16
• NO(OH) – HNO 2 • NO 2(OH) – HNO 3 • SO(OH)2 – H 2 SO 3 • SO 2(OH)2 – H 2 SO 4 • Mn(OH)2, Mn(OH)3, Mn(OH)4, (HO)3 Mn. O или H 3 Mn. O 4, (HO)2 Mn. O 2 или H 2 Mn. O 4, (HO)Mn. O 3 или HMn. O 4 • Mn(OH)n • Mn. Om(OH)n 16
 Проявление кислотно-основных свойств гидроксидов при химическом взаимодействии Cu(OH)2 + 2 Na. OH = Na 2[Cu(OH)4] Mn(OH)2 + 2 OH– = [Mn(OH)6]4– H 3 O+ + NO 3– +N 2 O 5 → 3 HNO 3 → H 3 O+ + 2 NO 3– + NO 2+ кислотная HNO 3 + 2 HCl. O 4 = H 3 O+ + NO 2+ + 2 Cl. O 4– HNO 3 + 2 H 2 SO 4 = H 3 O+ + NO 2+ + 2 HSO 4– SO 3 + H 2 O → SO 42– + 2 H+ SO 2 + H 2 O → HSO 32– + 2 H+ 17 нитроил – основная
Проявление кислотно-основных свойств гидроксидов при химическом взаимодействии Cu(OH)2 + 2 Na. OH = Na 2[Cu(OH)4] Mn(OH)2 + 2 OH– = [Mn(OH)6]4– H 3 O+ + NO 3– +N 2 O 5 → 3 HNO 3 → H 3 O+ + 2 NO 3– + NO 2+ кислотная HNO 3 + 2 HCl. O 4 = H 3 O+ + NO 2+ + 2 Cl. O 4– HNO 3 + 2 H 2 SO 4 = H 3 O+ + NO 2+ + 2 HSO 4– SO 3 + H 2 O → SO 42– + 2 H+ SO 2 + H 2 O → HSO 32– + 2 H+ 17 нитроил – основная
![Ge. O 2 + 2 H 2 O + 2 OH– = [Ge(OH)6]2– амфотерные Ge. O 2 + 2 H 2 O + 2 OH– = [Ge(OH)6]2– амфотерные](https://present5.com/presentation/14884915_68581660/image-18.jpg) Ge. O 2 + 2 H 2 O + 2 OH– = [Ge(OH)6]2– амфотерные с преобладанием кислотных св-в Zn(OH)2 + H+ = Zn(OH)+ + H 2 O амфотерные с преобладанием основных св-в 3 OH– Ga(OH)3 H+ [Ga(OH)6]3– Ga(OH)2+ + H 2 O • Диссоциация слабоосновных гидроксидов Fe(OH)2 → Fe(OH)+ + OH– 18
Ge. O 2 + 2 H 2 O + 2 OH– = [Ge(OH)6]2– амфотерные с преобладанием кислотных св-в Zn(OH)2 + H+ = Zn(OH)+ + H 2 O амфотерные с преобладанием основных св-в 3 OH– Ga(OH)3 H+ [Ga(OH)6]3– Ga(OH)2+ + H 2 O • Диссоциация слабоосновных гидроксидов Fe(OH)2 → Fe(OH)+ + OH– 18
 • Диссоциация гидроксидов типичных металлов Na. OH + aq → Na+aq + OH– • Образование оксо-катионов Zr. O(OH)2 + 2 H+ = Zr. O 2+ + 2 H 2 O цирконил Ti. O 2+ (титанил), UO 2+ (уранил) SO 2+ (тионил), SO 22+ (сульфурил), Sb. O+ (антимонил) 19
• Диссоциация гидроксидов типичных металлов Na. OH + aq → Na+aq + OH– • Образование оксо-катионов Zr. O(OH)2 + 2 H+ = Zr. O 2+ + 2 H 2 O цирконил Ti. O 2+ (титанил), UO 2+ (уранил) SO 2+ (тионил), SO 22+ (сульфурил), Sb. O+ (антимонил) 19
 Окислительно-восстановительные свойства гидроксидов • 2 H+ + 2 e → H 2 • E = 0, 059 lg[H+] = – 0, 059 p. H 20
Окислительно-восстановительные свойства гидроксидов • 2 H+ + 2 e → H 2 • E = 0, 059 lg[H+] = – 0, 059 p. H 20


