Скрининговые методы диагностики.ppt
- Количество слайдов: 105
 Скрининговые методы диагностики злокачественных опухолей
Скрининговые методы диагностики злокачественных опухолей
 • В современных условиях диагноз злокачественного новообразования перестал быть приговором. • Лечение, начатое на доклинических (in situ) и ранних стадиях (I и II), позволяет добиваться не только высоких показателей выживаемости, но и сохранения привычного качества жизни. • Высокий процент ранних стадий можно получить занимаясь профилактикой и ранней диагностикой злокачественных новообразований
• В современных условиях диагноз злокачественного новообразования перестал быть приговором. • Лечение, начатое на доклинических (in situ) и ранних стадиях (I и II), позволяет добиваться не только высоких показателей выживаемости, но и сохранения привычного качества жизни. • Высокий процент ранних стадий можно получить занимаясь профилактикой и ранней диагностикой злокачественных новообразований
 Основу ранней диагностики злокачественных новообразований составляет онкологический скрининг. Целью этой массовой медицинской процедуры является выявление лиц, у которых злокачественные опухоли могут быть заподозрены и клинически себя ещё не проявлять.
Основу ранней диагностики злокачественных новообразований составляет онкологический скрининг. Целью этой массовой медицинской процедуры является выявление лиц, у которых злокачественные опухоли могут быть заподозрены и клинически себя ещё не проявлять.
 повышает выявляемость ЗН в стадии in situ и ранних I и II стадиях Скрининг СНИЖАЕТ смертность от злокачественных новообразований повышают выявляемость ЗН в стадии in situ и ранних I и II стадиях Профилактический осмотр Формирование групп риска Диспансеризация Выявление пациентов ЗН в ранних стадиях снижают риск развития рака СНИЖАЕТ смертность от злокачественных новообразований увеличивают пятилетнюю выживаемость снижают одногодичную летальность уменьшают первичный выход на инвалидность СНИЖАЕТ смертность от злокачественных новообразований
повышает выявляемость ЗН в стадии in situ и ранних I и II стадиях Скрининг СНИЖАЕТ смертность от злокачественных новообразований повышают выявляемость ЗН в стадии in situ и ранних I и II стадиях Профилактический осмотр Формирование групп риска Диспансеризация Выявление пациентов ЗН в ранних стадиях снижают риск развития рака СНИЖАЕТ смертность от злокачественных новообразований увеличивают пятилетнюю выживаемость снижают одногодичную летальность уменьшают первичный выход на инвалидность СНИЖАЕТ смертность от злокачественных новообразований
 Скрининг (анг. Screen – просеивать, сортировать, отбирать) массовое обследование населения с целью выявления лиц с наличием определенного признака заболевания при отсутствии клинических симптомов. • Родоначальник скрининга в онкологии – Георг Папаниколау (1883 – 1962) – цитологическое исследование мазков с поверхности шейки матки для ранней диагностики рака; • Цель онкологического скрининга – снижение смертности больных; • Задача скрининга – формирование контингентов, имеющих наибольшую вероятность заболевания и подлежащих диагностическим исследованиям с целью отбора лиц, действительно являющихся носителями рассматриваемой патологии; • Непосредственный результат – обнаружение рака до момента клинического проявления;
Скрининг (анг. Screen – просеивать, сортировать, отбирать) массовое обследование населения с целью выявления лиц с наличием определенного признака заболевания при отсутствии клинических симптомов. • Родоначальник скрининга в онкологии – Георг Папаниколау (1883 – 1962) – цитологическое исследование мазков с поверхности шейки матки для ранней диагностики рака; • Цель онкологического скрининга – снижение смертности больных; • Задача скрининга – формирование контингентов, имеющих наибольшую вероятность заболевания и подлежащих диагностическим исследованиям с целью отбора лиц, действительно являющихся носителями рассматриваемой патологии; • Непосредственный результат – обнаружение рака до момента клинического проявления;
 Согласно международному консенсусу, это означает, что такой человек может прожить после лечения не менее 15 лет и умереть не от обнаруженной при скрининге злокачественной опухоли, а от других причин, например от так называемых «нормальных» болезней – атеросклероза, ишемической болезни сердца, таких заболеваний эндокринной системы, как диабет и гипотиреоз.
Согласно международному консенсусу, это означает, что такой человек может прожить после лечения не менее 15 лет и умереть не от обнаруженной при скрининге злокачественной опухоли, а от других причин, например от так называемых «нормальных» болезней – атеросклероза, ишемической болезни сердца, таких заболеваний эндокринной системы, как диабет и гипотиреоз.
 Мониторинг больных злокачественными новообразованиями - это медицинская процедура, состоящая в регулярном наблюдении за лицами, излеченными по поводу новообразований (третья клиническая группа), у которых из клеток, так называемой, «остаточной опухоли» могут развиться рецидив или отдаленные метастазы. Проведенное комплексное лечение больных с опухолями основных локализаций в действительности оказывается не радикальным примерно у 20 -25% и требует продолжения наблюдения и специального лечения. Сроки появления рецидивов или отдаленных метастазов могут составлять от нескольких месяцев до 10 -25 лет.
Мониторинг больных злокачественными новообразованиями - это медицинская процедура, состоящая в регулярном наблюдении за лицами, излеченными по поводу новообразований (третья клиническая группа), у которых из клеток, так называемой, «остаточной опухоли» могут развиться рецидив или отдаленные метастазы. Проведенное комплексное лечение больных с опухолями основных локализаций в действительности оказывается не радикальным примерно у 20 -25% и требует продолжения наблюдения и специального лечения. Сроки появления рецидивов или отдаленных метастазов могут составлять от нескольких месяцев до 10 -25 лет.
 Скрининг • Чувствительность скринингового теста – это его способность выявлять заболевания. • Специфичность – характеризует способность теста выявлять лиц, не имеющих болезни. • Показатель выявляемости – число больных раком (гистологически верифицированным) на 1000 лиц, прошедших скрининг.
Скрининг • Чувствительность скринингового теста – это его способность выявлять заболевания. • Специфичность – характеризует способность теста выявлять лиц, не имеющих болезни. • Показатель выявляемости – число больных раком (гистологически верифицированным) на 1000 лиц, прошедших скрининг.
 Высокий потенциал скрининга: • рак молочной железы; • рак шейки матки; • рак ободочной и прямой кишки Заридзе Д. Г. , 2005; NIH. Cervical cancer // NIH Consensus Statement, April 1 -3. Bethesda, MD: National Institutes of Health. – 1996. – 43. – P. 1 -26. IARC. Breast cancer screening / IARC Handbook of Cancer Prevention. Lyon: International Agency for Research on Cancer, 2002; Kudalkar P. R. et al. , 2003 ? ? ? • Рак предстательной железы; • Рак легкого; • Рак яичников;
Высокий потенциал скрининга: • рак молочной железы; • рак шейки матки; • рак ободочной и прямой кишки Заридзе Д. Г. , 2005; NIH. Cervical cancer // NIH Consensus Statement, April 1 -3. Bethesda, MD: National Institutes of Health. – 1996. – 43. – P. 1 -26. IARC. Breast cancer screening / IARC Handbook of Cancer Prevention. Lyon: International Agency for Research on Cancer, 2002; Kudalkar P. R. et al. , 2003 ? ? ? • Рак предстательной железы; • Рак легкого; • Рак яичников;
 Программа развития онкологической помощи в Республике Казахстан на 2012 -2016 годы Основные цели программы: • Повышение ожидаемой продолжительности и качества жизни казахстанцев путем снижения смертности населения от онкологических заболеваний. • Увеличение продолжительности жизни за счет внедрения современных методов профилактики, ранней диагностики злокачественных новообразований, лечения и реабилитации онкологических больных, совершенствования материальнотехнической базы онкологических учреждений и учреждений общей лечебной сети
Программа развития онкологической помощи в Республике Казахстан на 2012 -2016 годы Основные цели программы: • Повышение ожидаемой продолжительности и качества жизни казахстанцев путем снижения смертности населения от онкологических заболеваний. • Увеличение продолжительности жизни за счет внедрения современных методов профилактики, ранней диагностики злокачественных новообразований, лечения и реабилитации онкологических больных, совершенствования материальнотехнической базы онкологических учреждений и учреждений общей лечебной сети
 Cкрининг рака шейки матки (РШМ)
Cкрининг рака шейки матки (РШМ)
 Cкрининг рака шейки матки (РШМ) Цитологическое исследование мазков (по Папаниколау) с поверхности шейки матки и из цервикального канала – тест, позволяющий обнаруживать больных с предраковыми заболеваниями и начальными стадиями рака. Для повышения качества исследования целесообразно использовать для забора материала цервекс-щеточку. Не следует делать мазок при наличии воспаления и во время менструации.
Cкрининг рака шейки матки (РШМ) Цитологическое исследование мазков (по Папаниколау) с поверхности шейки матки и из цервикального канала – тест, позволяющий обнаруживать больных с предраковыми заболеваниями и начальными стадиями рака. Для повышения качества исследования целесообразно использовать для забора материала цервекс-щеточку. Не следует делать мазок при наличии воспаления и во время менструации.
 Факторы эффективности цитологического скрининга РШМ: • Широта охвата скринингом женского населения; • Периодичность проведения (эффективность скрининга примерно одинакова при интервалах между обследованиями в 1 год и 2 года); • Чувствительность цитологического метода (в 70 -90% случаев причиной ложноотрицательных цитологических ответов является плохой забор материала, 10 -30% - ошибочная интерпретация цитологических данных);
Факторы эффективности цитологического скрининга РШМ: • Широта охвата скринингом женского населения; • Периодичность проведения (эффективность скрининга примерно одинакова при интервалах между обследованиями в 1 год и 2 года); • Чувствительность цитологического метода (в 70 -90% случаев причиной ложноотрицательных цитологических ответов является плохой забор материала, 10 -30% - ошибочная интерпретация цитологических данных);
 Группы скрининга Рекомендуется проводить скрининговое обследование на рак шейки матки всем женщинам репродуктивного возраста, начиная с 21 года или не позднее чем через 3 года после начала половой жизни, по крайней мере каждые 3 года.
Группы скрининга Рекомендуется проводить скрининговое обследование на рак шейки матки всем женщинам репродуктивного возраста, начиная с 21 года или не позднее чем через 3 года после начала половой жизни, по крайней мере каждые 3 года.
 Группы скрининга Начиная с 30 лет, женщины, имевшие 3 последовательных отрицательных результата при исследовании мазков из шейки матки, могут проходить скрининг КАЖДЫЕ 2 -3 ГОДА. Женщины, переболевшие раком шейки матки, инфицированные ВПЧ или с ослабленной иммунной системой в результате химиотерапии или длительного применения глюкокортикоидов, должны проходить скрининг на рак шейки матки ЕЖЕГОДНО.
Группы скрининга Начиная с 30 лет, женщины, имевшие 3 последовательных отрицательных результата при исследовании мазков из шейки матки, могут проходить скрининг КАЖДЫЕ 2 -3 ГОДА. Женщины, переболевшие раком шейки матки, инфицированные ВПЧ или с ослабленной иммунной системой в результате химиотерапии или длительного применения глюкокортикоидов, должны проходить скрининг на рак шейки матки ЕЖЕГОДНО.
 ПАП тест Пап-тест позволяет идентифицировать женщин с асимптомным течением предраковых поражений и раками шейки матки на ранних стадиях. Использование этого метода ограничено ввиду низкой специфичности и чувствительности. Ложнонегативные результаты составляют 15 -50%, ложнопозитивные - 30%. Это обусловлено субъективностью цитологических диагнозов, так как могут не одинаково интерпретированы разными патоморфологами. В последнее время все большое значение приобретает анализ экспрессии иммуногистохимических маркеров, поскольку при этом существенным образом повышается качество информации, которую невозможно получить при традиционном гистологическом исследовании. Определение иммунофенотипа опухоли или ЦИН может рассматриваться как основание для выбора рациональной схемы терапии или выделения групп риска, т. е. тех пациенток, которые требуют более тщательного наблюдения в связи с возможностью дальнейшей прогрессии повреждений шейки матки.
ПАП тест Пап-тест позволяет идентифицировать женщин с асимптомным течением предраковых поражений и раками шейки матки на ранних стадиях. Использование этого метода ограничено ввиду низкой специфичности и чувствительности. Ложнонегативные результаты составляют 15 -50%, ложнопозитивные - 30%. Это обусловлено субъективностью цитологических диагнозов, так как могут не одинаково интерпретированы разными патоморфологами. В последнее время все большое значение приобретает анализ экспрессии иммуногистохимических маркеров, поскольку при этом существенным образом повышается качество информации, которую невозможно получить при традиционном гистологическом исследовании. Определение иммунофенотипа опухоли или ЦИН может рассматриваться как основание для выбора рациональной схемы терапии или выделения групп риска, т. е. тех пациенток, которые требуют более тщательного наблюдения в связи с возможностью дальнейшей прогрессии повреждений шейки матки.
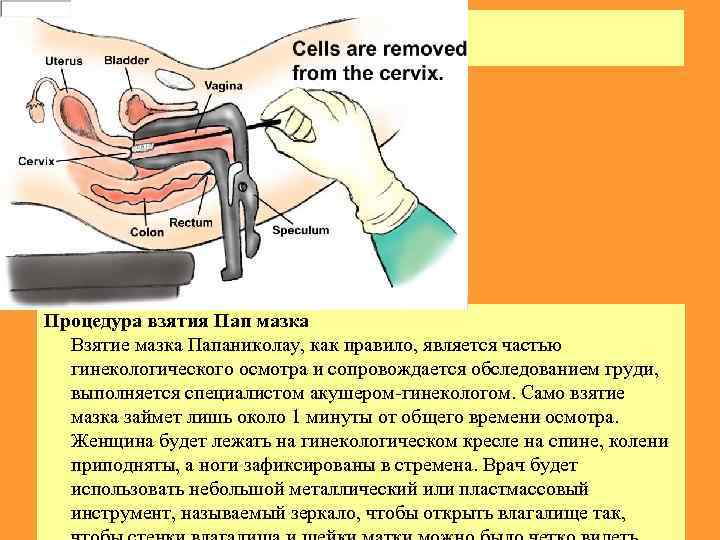 ПАП тест Процедура взятия Пап мазка Взятие мазка Папаниколау, как правило, является частью гинекологического осмотра и сопровождается обследованием груди, выполняется специалистом акушером-гинекологом. Само взятие мазка займет лишь около 1 минуты от общего времени осмотра. Женщина будет лежать на гинекологическом кресле на спине, колени приподняты, а ноги зафиксированы в стремена. Врач будет использовать небольшой металлический или пластмассовый инструмент, называемый зеркало, чтобы открыть влагалище так,
ПАП тест Процедура взятия Пап мазка Взятие мазка Папаниколау, как правило, является частью гинекологического осмотра и сопровождается обследованием груди, выполняется специалистом акушером-гинекологом. Само взятие мазка займет лишь около 1 минуты от общего времени осмотра. Женщина будет лежать на гинекологическом кресле на спине, колени приподняты, а ноги зафиксированы в стремена. Врач будет использовать небольшой металлический или пластмассовый инструмент, называемый зеркало, чтобы открыть влагалище так,



 Интерпретация результатов мазка Правильно интерпретировать результаты мазка способен только врач-специалист. В современной практике широко распространена оценка изменений в клетках по, так называемой, методике Папаниколау, когда выделяются пять стадий развития патологии. 1 стадия: клетки с какими-либо отклонениями отсутствуют, наблюдается нормальная цитологическая картина. Эта стадия, характерная для совершенно здоровых женщин. 2 стадия: имеются небольшие изменения в строении клеток, обусловленные, однако, воспалительным процессом внутренних половых органов. Данная стадия также является нормой, но при этом, врач обязательно порекомендует Вам более тщательное обследование на предмет выявления причин воспаления и их устранения. 3 стадия: имеются клетки с аномалиями в строении ядер, однако их количество чрезвычайно мало. В этой ситуации необходимо повторное взятие мазка или проведение специального гистологического обследования измененной ткани. 4 стадия: можно обнаружить отдельные клетки с явно злокачественными изменениями (такими, как увеличенная масса клеточных ядер, изменения в хромосомах и цитоплазме). Вместе с тем, это дает основания лишь подозревать заболевание, а не ставить окончательный диагноз. 5 стадия: в мазках наблюдается большое количество типично раковых клеток.
Интерпретация результатов мазка Правильно интерпретировать результаты мазка способен только врач-специалист. В современной практике широко распространена оценка изменений в клетках по, так называемой, методике Папаниколау, когда выделяются пять стадий развития патологии. 1 стадия: клетки с какими-либо отклонениями отсутствуют, наблюдается нормальная цитологическая картина. Эта стадия, характерная для совершенно здоровых женщин. 2 стадия: имеются небольшие изменения в строении клеток, обусловленные, однако, воспалительным процессом внутренних половых органов. Данная стадия также является нормой, но при этом, врач обязательно порекомендует Вам более тщательное обследование на предмет выявления причин воспаления и их устранения. 3 стадия: имеются клетки с аномалиями в строении ядер, однако их количество чрезвычайно мало. В этой ситуации необходимо повторное взятие мазка или проведение специального гистологического обследования измененной ткани. 4 стадия: можно обнаружить отдельные клетки с явно злокачественными изменениями (такими, как увеличенная масса клеточных ядер, изменения в хромосомах и цитоплазме). Вместе с тем, это дает основания лишь подозревать заболевание, а не ставить окончательный диагноз. 5 стадия: в мазках наблюдается большое количество типично раковых клеток.
 Достоверность цитологических мазков из влагалища высока (Пап-теста), когда речь идет об изменениях в шейке матки. Тем не менее, данный анализ ничего не говорит о состоянии самой матки, яичников или маточных труб. И в 20 -30% случаях Пап-тест дает ложно-отрицательные результаты. Гарантию же достоверной интерпретации данных дает только комплексное обследование (кольпоскопия шейки матки, биопсия слизистой оболочки и др. ). Большинство лабораторий в Соединенных Штатах используют стандартный набор терминов называемый классификация Бетезда (цервикально-вагинальный цитологический диагноз) для доклада или интерпретации результатов мазка Папаниколау. По классификация Бетезда образцы мазка Папаниколау , которые не имеют аномальных клеток, интерпретируются как "отрицательный результат внутриэпителиального или злокачественного поражения" (то есть женщины, не имеют рак). Образцы с клеточными нарушениями подразделяются на следующие категории (как указано в Национальном институте рака (США):
Достоверность цитологических мазков из влагалища высока (Пап-теста), когда речь идет об изменениях в шейке матки. Тем не менее, данный анализ ничего не говорит о состоянии самой матки, яичников или маточных труб. И в 20 -30% случаях Пап-тест дает ложно-отрицательные результаты. Гарантию же достоверной интерпретации данных дает только комплексное обследование (кольпоскопия шейки матки, биопсия слизистой оболочки и др. ). Большинство лабораторий в Соединенных Штатах используют стандартный набор терминов называемый классификация Бетезда (цервикально-вагинальный цитологический диагноз) для доклада или интерпретации результатов мазка Папаниколау. По классификация Бетезда образцы мазка Папаниколау , которые не имеют аномальных клеток, интерпретируются как "отрицательный результат внутриэпителиального или злокачественного поражения" (то есть женщины, не имеют рак). Образцы с клеточными нарушениями подразделяются на следующие категории (как указано в Национальном институте рака (США):
 ASC (атипичные плоскоклеточные клетки): плоскоклеточные клетки тонкие, плоские клетки, которые образуют поверхность шейки матки. Система Бетезда делит эту категорию на следующие 2 группы: ASC-US (атипичные плоскоклеточные клетки неопределенной значимости): плоскоклеточные клетки не представляются совершенно нормальным, но врачи не уверены, что изменения означают рак. Иногда эти изменения связаны с ВПЧ-инфекцией. ACS-US считаются мягкие аномалии. ASC-H (атипичные клетки плоскоклеточные, не может быть исключены плоскоклеточные внутриэпителиальные поражения): клетки не нормальные, но врачи не уверены, что изменения означают рак. ASC-H часто означает предраковое состояние. AGC (атипичные клетки железистой): железистые клетки -слизь-продуцирующие клетки найдены в эндоцервикальном канале (в центре шейки матки) или в слизистой оболочке матки. Железистые клетки не нормальные, но врачи не уверены, что клеточные изменения означают. AIS (эндоцервикальная аденокарцинома): предраковые клетки в железистой ткани. LSIL (слабовыраженные плоскоклеточные внутриэпителиальные поражения): Low-класс означает, что есть некоторые ранние изменения размера и формы клеток. Слово поражения относится к области аномальной ткани. Интраэпителиальная ссылается на слой клеток, которые образуют поверхность шейки матки. LSILs считаются незначительными отклонениями в результате инфицирования ВПЧ. HSIL (ярковыраженные плоскоклеточные внутриэпителиальные поражения): Ярковыраженные означает, что есть более заметные изменения в размерах и форме ненормальных (предраковых) клеток, то есть клетки очень отличаются от нормальных клеток. HSILs характеризуется более серьезными отклонениями и имеют более высокую вероятность прогрессирования рака.
ASC (атипичные плоскоклеточные клетки): плоскоклеточные клетки тонкие, плоские клетки, которые образуют поверхность шейки матки. Система Бетезда делит эту категорию на следующие 2 группы: ASC-US (атипичные плоскоклеточные клетки неопределенной значимости): плоскоклеточные клетки не представляются совершенно нормальным, но врачи не уверены, что изменения означают рак. Иногда эти изменения связаны с ВПЧ-инфекцией. ACS-US считаются мягкие аномалии. ASC-H (атипичные клетки плоскоклеточные, не может быть исключены плоскоклеточные внутриэпителиальные поражения): клетки не нормальные, но врачи не уверены, что изменения означают рак. ASC-H часто означает предраковое состояние. AGC (атипичные клетки железистой): железистые клетки -слизь-продуцирующие клетки найдены в эндоцервикальном канале (в центре шейки матки) или в слизистой оболочке матки. Железистые клетки не нормальные, но врачи не уверены, что клеточные изменения означают. AIS (эндоцервикальная аденокарцинома): предраковые клетки в железистой ткани. LSIL (слабовыраженные плоскоклеточные внутриэпителиальные поражения): Low-класс означает, что есть некоторые ранние изменения размера и формы клеток. Слово поражения относится к области аномальной ткани. Интраэпителиальная ссылается на слой клеток, которые образуют поверхность шейки матки. LSILs считаются незначительными отклонениями в результате инфицирования ВПЧ. HSIL (ярковыраженные плоскоклеточные внутриэпителиальные поражения): Ярковыраженные означает, что есть более заметные изменения в размерах и форме ненормальных (предраковых) клеток, то есть клетки очень отличаются от нормальных клеток. HSILs характеризуется более серьезными отклонениями и имеют более высокую вероятность прогрессирования рака.
 Скрининг Тест на вирус папилломы человека может быть дополнением к первичному скринингу. Доказано, что тесты на ВПЧ-инфекцию, выполненные с помощью ПЦР, более чувствительны, чем жидкостная цитология (88 -91% по сравнению с 61%), но менее специфичны. Тест на вирус папилломы человека при скрининге на рак шейки матки может быть целесообразным у женщин старше 30 лет, инфицированных в течение длительного времени, а также у пациенток, имеющих пограничные изменения или цитологические изменения низкой степени злокачественности.
Скрининг Тест на вирус папилломы человека может быть дополнением к первичному скринингу. Доказано, что тесты на ВПЧ-инфекцию, выполненные с помощью ПЦР, более чувствительны, чем жидкостная цитология (88 -91% по сравнению с 61%), но менее специфичны. Тест на вирус папилломы человека при скрининге на рак шейки матки может быть целесообразным у женщин старше 30 лет, инфицированных в течение длительного времени, а также у пациенток, имеющих пограничные изменения или цитологические изменения низкой степени злокачественности.




 Скрининг РШМ • Снижение заболеваемости среди женщин в возрасте 35 -64 лет при скрининговом интервале 5 лет составляет 84%, 3 года – 91%, 2 и 1 год – 93 и 94 % соответственно. • Рак шейки матки у пожилых женщин прогрессирует с той же скоростью, что и у молодых. • Случаи рака шейки матки, обнаруженные при скрининге, чаще имеют более благоприятную, с точки зрения прогноза, стадию рака ( карцинома in situ).
Скрининг РШМ • Снижение заболеваемости среди женщин в возрасте 35 -64 лет при скрининговом интервале 5 лет составляет 84%, 3 года – 91%, 2 и 1 год – 93 и 94 % соответственно. • Рак шейки матки у пожилых женщин прогрессирует с той же скоростью, что и у молодых. • Случаи рака шейки матки, обнаруженные при скрининге, чаще имеют более благоприятную, с точки зрения прогноза, стадию рака ( карцинома in situ).
 Скрининг колоректального рака (КРР)
Скрининг колоректального рака (КРР)
 Колоректальнй рак Колоректальный рак (КРР) - широко распространенная в мире патология. Ежегодная заболеваемость - 1 млн случаев, а ежегодная смертность - более 500 тыс, в РК – 8, 5% Прогноз: заболеваемость КРР в мире в следующие два десятилетия увеличится в результате роста населения как в развитых, так и в развивающихся странах. Чаще КРР возникает из аденом толстой кишки, у пациентов с генетически детерминированными синдромами полипоза или воспалительными заболеваниями кишки (ВЗК). При проведении колоноскопии в рамках скрининга установлено, что распространенность аденоматозных полипов составляет 18 -36%. Клинические факторы риска при воспалительных заболеваниях кишки (ВЗК): повышение уровня риска развития колоректального рака у пациентов с ВЗК убедительно доказано. Факторы риска : • длительность заболевания, • распространенность поражения, • молодой возраст в начале заболевания, • наличие таких осложнений, как первичный склерозирующий холангит или стенозирование, • неадекватная медикаментозная терапия (возможно)
Колоректальнй рак Колоректальный рак (КРР) - широко распространенная в мире патология. Ежегодная заболеваемость - 1 млн случаев, а ежегодная смертность - более 500 тыс, в РК – 8, 5% Прогноз: заболеваемость КРР в мире в следующие два десятилетия увеличится в результате роста населения как в развитых, так и в развивающихся странах. Чаще КРР возникает из аденом толстой кишки, у пациентов с генетически детерминированными синдромами полипоза или воспалительными заболеваниями кишки (ВЗК). При проведении колоноскопии в рамках скрининга установлено, что распространенность аденоматозных полипов составляет 18 -36%. Клинические факторы риска при воспалительных заболеваниях кишки (ВЗК): повышение уровня риска развития колоректального рака у пациентов с ВЗК убедительно доказано. Факторы риска : • длительность заболевания, • распространенность поражения, • молодой возраст в начале заболевания, • наличие таких осложнений, как первичный склерозирующий холангит или стенозирование, • неадекватная медикаментозная терапия (возможно)
 Скрининг колоректального рака (КРР) • Скрининговые программы по выявлению колоректального (КРР) рака в РК не развиты и их эффективность не превышает 1%. • Считается, что в 90% КРР можно предупредить, поскольку раннее удаление аденомы может заблокировать дальнейшую прогрессию опухоли. • Частота развития рака из ворсинчатой опухоли более 2 см в диаметре составляет 35 -53%, при диаметре более 3 см – 100%.
Скрининг колоректального рака (КРР) • Скрининговые программы по выявлению колоректального (КРР) рака в РК не развиты и их эффективность не превышает 1%. • Считается, что в 90% КРР можно предупредить, поскольку раннее удаление аденомы может заблокировать дальнейшую прогрессию опухоли. • Частота развития рака из ворсинчатой опухоли более 2 см в диаметре составляет 35 -53%, при диаметре более 3 см – 100%.
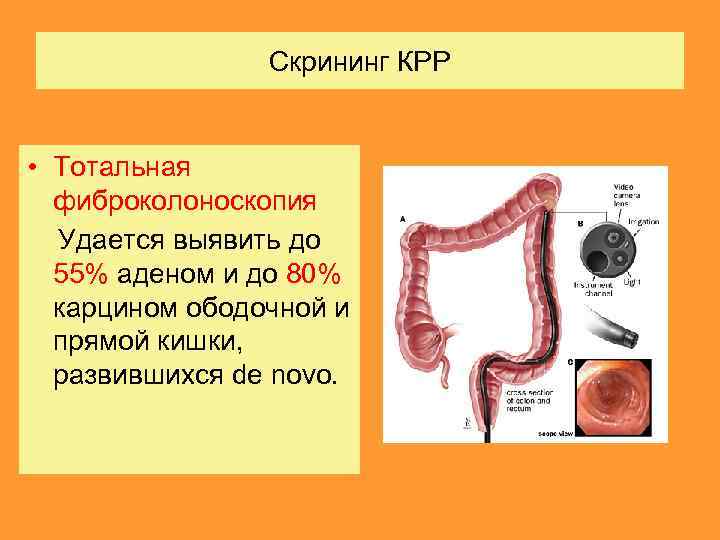 Скрининг КРР • Тотальная фиброколоноскопия Удается выявить до 55% аденом и до 80% карцином ободочной и прямой кишки, развившихся de novo.
Скрининг КРР • Тотальная фиброколоноскопия Удается выявить до 55% аденом и до 80% карцином ободочной и прямой кишки, развившихся de novo.
 Факторы риска при воспалительных заболеваниях кишечника Общепризнанным является повышенный риск развития КРР у пациентов с воспалительными заболеваниями кишечника. Заболеваемость КРР у таких больных возрастает спустя 8 -10 лет с момента диагностики заболевания и достигает 15% через 30 лет. К факторам риска относятся большая длительность болезни, распространенность поражения кишечника, проявление в молодом возрасте, осложнение заболевания в виде склерозирующего холангита или стеноза. Неадекватные наблюдение и фармакотерапия также могут быть дополнительным риском. .
Факторы риска при воспалительных заболеваниях кишечника Общепризнанным является повышенный риск развития КРР у пациентов с воспалительными заболеваниями кишечника. Заболеваемость КРР у таких больных возрастает спустя 8 -10 лет с момента диагностики заболевания и достигает 15% через 30 лет. К факторам риска относятся большая длительность болезни, распространенность поражения кишечника, проявление в молодом возрасте, осложнение заболевания в виде склерозирующего холангита или стеноза. Неадекватные наблюдение и фармакотерапия также могут быть дополнительным риском. .
 МЕТОДЫ Наиболее известный тест – FOBT (Fecal Occult Blood Test)– определение малых количеств скрытой крови в содержимом кишечника. Тест дает реакцию благодаря пероксидазной активности крови, но склонен вступать в реакцию и с другими пероксидазами, содержащимися в определенных фруктах, овощах и «красном» мясе. Он выполняется в домашней обстановке. Берутся по 2 образца кала в течение 3 дней. Требуется в течение 3 дней до теста соблюдать диету без животных белков. Тест следует повторять ежегодно. Однократное исследование одного образца кала не рекомендуется. В США этому тесту подвергаются 17, 3% населения.
МЕТОДЫ Наиболее известный тест – FOBT (Fecal Occult Blood Test)– определение малых количеств скрытой крови в содержимом кишечника. Тест дает реакцию благодаря пероксидазной активности крови, но склонен вступать в реакцию и с другими пероксидазами, содержащимися в определенных фруктах, овощах и «красном» мясе. Он выполняется в домашней обстановке. Берутся по 2 образца кала в течение 3 дней. Требуется в течение 3 дней до теста соблюдать диету без животных белков. Тест следует повторять ежегодно. Однократное исследование одного образца кала не рекомендуется. В США этому тесту подвергаются 17, 3% населения.
 МЕТОДЫ Анализ кала на скрытую кровь (FOBT) как скрининговый тест для КРР имеет несколько особенностей. Чувствительность теста составляет лишь 50– 60% при однократном применении, но может вырасти до 90% при использовании каждые 1 -2 года на протяжении длительного периода времени (программированная чувствительность). Несмотря на то, что чувствительность может быть повышена применением регидратации, вариабельность реакции делает тест несостоятельным как метод скрининга. Низкая чувствительность приводит к большому числу ложноотрицательных результатов и, как следствие, ненужной перепроверке. В большинстве случаев положительный результат теста на скрытую кровь является ложноотрицательным, пациенты направляются для дальнейшего обследования, как правило, на колоноскопию. Другой проблемой скрининга методом FOBT является то, что эффективность его требует сопоставления результатов тестирования за много лет. Разработаны несколько вариантов данного теста (Hemoccult, Hemoccult II)
МЕТОДЫ Анализ кала на скрытую кровь (FOBT) как скрининговый тест для КРР имеет несколько особенностей. Чувствительность теста составляет лишь 50– 60% при однократном применении, но может вырасти до 90% при использовании каждые 1 -2 года на протяжении длительного периода времени (программированная чувствительность). Несмотря на то, что чувствительность может быть повышена применением регидратации, вариабельность реакции делает тест несостоятельным как метод скрининга. Низкая чувствительность приводит к большому числу ложноотрицательных результатов и, как следствие, ненужной перепроверке. В большинстве случаев положительный результат теста на скрытую кровь является ложноотрицательным, пациенты направляются для дальнейшего обследования, как правило, на колоноскопию. Другой проблемой скрининга методом FOBT является то, что эффективность его требует сопоставления результатов тестирования за много лет. Разработаны несколько вариантов данного теста (Hemoccult, Hemoccult II)
 Тест кала на скрытую кровь (гемоккульт-тест) Используется у лиц старше 50 лет, не имеющих факторов риска КРР. У лиц старше 40 лет с наличием предрасполагающих факторов риска (наследственный неполипозный рак толстой кишки; семейный аденоматозный полипоз; НЯК). При наследственной предрасположенности + тест на микросателитную нестабильность. Достоинство: • дешевизна и простота выполнения Недостатки: • Ложноотрицательные результаты при наличии рака до 50%, а при аденомах ободочной кишки до 70%. • Малоинформативен при наличии полипов менее 2 см, при локализации образований в правой половине ободочной кишки и при непостоянно кровоточащей опухоли. • Требует предварительной подготовки
Тест кала на скрытую кровь (гемоккульт-тест) Используется у лиц старше 50 лет, не имеющих факторов риска КРР. У лиц старше 40 лет с наличием предрасполагающих факторов риска (наследственный неполипозный рак толстой кишки; семейный аденоматозный полипоз; НЯК). При наследственной предрасположенности + тест на микросателитную нестабильность. Достоинство: • дешевизна и простота выполнения Недостатки: • Ложноотрицательные результаты при наличии рака до 50%, а при аденомах ободочной кишки до 70%. • Малоинформативен при наличии полипов менее 2 см, при локализации образований в правой половине ободочной кишки и при непостоянно кровоточащей опухоли. • Требует предварительной подготовки
 МЕТОДЫ В настоящий момент во многих странах метод FOBT уже заменили тестом FIT (или IFOBT), который определяет гемоглобин с использованием чувствительной и специфичной технологии. Метод иммунохимического исследования кала на скрытую кровь – FIT – более удобен, не требует специальной диеты, для его производства можно иметь меньшее число образцов кала. Методы позволяют снизить риск смерти от РТК на 15%, кроме того, FOBT и FIT уменьшают заболеваемость РТК на 20% благодаря диагностике крупных полипов и последующего их удаления при колоноскопии. При положительных тестах на скрытую кровь пациенты должны обследоваться дополнительными методами.
МЕТОДЫ В настоящий момент во многих странах метод FOBT уже заменили тестом FIT (или IFOBT), который определяет гемоглобин с использованием чувствительной и специфичной технологии. Метод иммунохимического исследования кала на скрытую кровь – FIT – более удобен, не требует специальной диеты, для его производства можно иметь меньшее число образцов кала. Методы позволяют снизить риск смерти от РТК на 15%, кроме того, FOBT и FIT уменьшают заболеваемость РТК на 20% благодаря диагностике крупных полипов и последующего их удаления при колоноскопии. При положительных тестах на скрытую кровь пациенты должны обследоваться дополнительными методами.
 МЕТОДЫ Анализ кала на ДНК для КРР Есть данные, что определение поврежденной ДНК в стуле может служить методом раннего выявления КРР. Метод основывается на выявлении мутантных генов TP 53, BAT 26, K-RAS в выделенной из кала и умноженной с помощью полимеразной цепной реакции (PCR) ДНК клеток колоректальных опухолей. В одном из исследований сравнивали панель из 21 мутации со стандартным тестом на скрытую кровь у 2507 пациентов. Чувствительность панели ДНК для КРР составила 52% в сравнении с 13% для теста на скрытую кровь, а специфичность была схожей (94, 4% против 95, 2%). Результаты для анализа на скрытую кровь были значительно хуже. Данные были подтверждены несколькими дополнительными небольшими исследованиями, с суммарной чувствительностью на уровне 65% и специфичностью – 95%. Новая версия теста с несколькими мутациями показала чувствительность на уровне 80%.
МЕТОДЫ Анализ кала на ДНК для КРР Есть данные, что определение поврежденной ДНК в стуле может служить методом раннего выявления КРР. Метод основывается на выявлении мутантных генов TP 53, BAT 26, K-RAS в выделенной из кала и умноженной с помощью полимеразной цепной реакции (PCR) ДНК клеток колоректальных опухолей. В одном из исследований сравнивали панель из 21 мутации со стандартным тестом на скрытую кровь у 2507 пациентов. Чувствительность панели ДНК для КРР составила 52% в сравнении с 13% для теста на скрытую кровь, а специфичность была схожей (94, 4% против 95, 2%). Результаты для анализа на скрытую кровь были значительно хуже. Данные были подтверждены несколькими дополнительными небольшими исследованиями, с суммарной чувствительностью на уровне 65% и специфичностью – 95%. Новая версия теста с несколькими мутациями показала чувствительность на уровне 80%.
 МЕТОДЫ Раково-эмбриональный антиген (РЭА) начал применяться с 1965 года (Mould и Freadman). Первоначально считали, что РЭА секретируется эмбриональными клетками только желудочно-кишечного тракта. В дальнейшем было установлено, что РЭА определяется в крови и здоровых, а также больных с неопухолевыми заболеваниями. При обследовании больных с различными злокачественными новообразованиями установлено, что антиген не является веществом специфичным только для рака органов желудочнокишечного тракта. Повышение концентрации РЭА (более 6 мкг/л) наблюдается также при злокачественных опухолях молочной железы, матки, легкого. В настоящее время общепризнанным фактом является то, что использование РЭА имеет большее значение в диагностике у лиц в группе повышенного риска рака толстой кишки, в прогнозировании рецидивов после радикального лечения колоректального рака, а также в оценке эффективности лечения больных с этой патологией. (РОНЦ, Москва)
МЕТОДЫ Раково-эмбриональный антиген (РЭА) начал применяться с 1965 года (Mould и Freadman). Первоначально считали, что РЭА секретируется эмбриональными клетками только желудочно-кишечного тракта. В дальнейшем было установлено, что РЭА определяется в крови и здоровых, а также больных с неопухолевыми заболеваниями. При обследовании больных с различными злокачественными новообразованиями установлено, что антиген не является веществом специфичным только для рака органов желудочнокишечного тракта. Повышение концентрации РЭА (более 6 мкг/л) наблюдается также при злокачественных опухолях молочной железы, матки, легкого. В настоящее время общепризнанным фактом является то, что использование РЭА имеет большее значение в диагностике у лиц в группе повышенного риска рака толстой кишки, в прогнозировании рецидивов после радикального лечения колоректального рака, а также в оценке эффективности лечения больных с этой патологией. (РОНЦ, Москва)
 Кальпротектин – маркер активности лейкоцитов и воспаления в ЖКТ Это белок активной фазы, также называется МRP 8/14 или S 100 A 8/A 9; основной белок цитозоля, связывающий кальций и цинк. Выделяется в больших количествах с калом при воспалениях в кишечном тракте, в т. ч. при болезни Крона, гельминтозах, сопровождающихся нарушением слизистой оболочки кишечника. Ценность метода: низкая концентрация в кале означает отсутствие органического заболевания кишечника, а высокая – его наличие. Чувствительность для болезни Крона до 100%, специфичность 97%. • Высокая стабильность ФК в кале – в течение нескольких дней. • Низкая стоимость, неинвазивность (метод снижает количество болезненных исследований), быстрота. !!! Определение Кальпротектина в фекалиях облегчает диагностику колоректального рака у больных воспалительными заболеваниями кишечника и позволяет осуществлять контроль над развитием болезни.
Кальпротектин – маркер активности лейкоцитов и воспаления в ЖКТ Это белок активной фазы, также называется МRP 8/14 или S 100 A 8/A 9; основной белок цитозоля, связывающий кальций и цинк. Выделяется в больших количествах с калом при воспалениях в кишечном тракте, в т. ч. при болезни Крона, гельминтозах, сопровождающихся нарушением слизистой оболочки кишечника. Ценность метода: низкая концентрация в кале означает отсутствие органического заболевания кишечника, а высокая – его наличие. Чувствительность для болезни Крона до 100%, специфичность 97%. • Высокая стабильность ФК в кале – в течение нескольких дней. • Низкая стоимость, неинвазивность (метод снижает количество болезненных исследований), быстрота. !!! Определение Кальпротектина в фекалиях облегчает диагностику колоректального рака у больных воспалительными заболеваниями кишечника и позволяет осуществлять контроль над развитием болезни.
 Кальпротектин – маркер воспаления Доказана высокая клиническая значимость теста при воспалении кишечника: при НЯК и болезни Крона, в т. ч. для ранней диагностики, определения интенсивности болезни, реакции на лечение, прогнозирования обострения, доказательства ремиссии. О вероятности клинического рецидива свидетельствует повышенное содержание фекального кальпротектина, подтверждающее слабое воспаление (тест будет повышенным даже на фоне нормальных значений СРБ). Интенсивность воспаления коррелирует с тяжестью процесса. Нормализация уровня кальпротектина означает восстановление слизистой. Концентрация кальпротектина достигает максимальных значений у детей с сочетанным поражением толстой и подвздошной кишки и тотальным поражением желудочно-кишечного тракта. Определение его содержания является информативным критерием определения активности течения. У пациентов с воспалительными заболеваниями кишечника общепризнанным является повышенный риск развития колоректального рака.
Кальпротектин – маркер воспаления Доказана высокая клиническая значимость теста при воспалении кишечника: при НЯК и болезни Крона, в т. ч. для ранней диагностики, определения интенсивности болезни, реакции на лечение, прогнозирования обострения, доказательства ремиссии. О вероятности клинического рецидива свидетельствует повышенное содержание фекального кальпротектина, подтверждающее слабое воспаление (тест будет повышенным даже на фоне нормальных значений СРБ). Интенсивность воспаления коррелирует с тяжестью процесса. Нормализация уровня кальпротектина означает восстановление слизистой. Концентрация кальпротектина достигает максимальных значений у детей с сочетанным поражением толстой и подвздошной кишки и тотальным поражением желудочно-кишечного тракта. Определение его содержания является информативным критерием определения активности течения. У пациентов с воспалительными заболеваниями кишечника общепризнанным является повышенный риск развития колоректального рака.
 Фекальный трансферрин и гемоглобин (количественное определение) 1. Диагностика рака кишечника и полипозов. 2. Профилактическое обследование на рак кишечника Создана платформа для организации скрининга на колоректальный рак с целью его выявления на ранних стадиях (система профилактики рака кишечника). Колоректальный рак занимает второе место в России как причина смерти среди женщин (после рака груди) и третье место среди мужчин (после рака легких и желудка). Используемые в России методы диагностики выявляют впервые рак в значительной части случаев в запущенной форме (3 -4 стадии), и одна треть из этих больных умирает уже в первый год после установления диагноза.
Фекальный трансферрин и гемоглобин (количественное определение) 1. Диагностика рака кишечника и полипозов. 2. Профилактическое обследование на рак кишечника Создана платформа для организации скрининга на колоректальный рак с целью его выявления на ранних стадиях (система профилактики рака кишечника). Колоректальный рак занимает второе место в России как причина смерти среди женщин (после рака груди) и третье место среди мужчин (после рака легких и желудка). Используемые в России методы диагностики выявляют впервые рак в значительной части случаев в запущенной форме (3 -4 стадии), и одна треть из этих больных умирает уже в первый год после установления диагноза.
 Фекальный трансферрин и гемоглобин (количественное определение) Показания для обследования: • хронические воспалительные заболевания ЖКТ, колиты; • прием аспирина и нестероидных препаратов; • после длительной АБ-терапии и неоднократного курса • язвенная болезнь желудка • аутоиммунные заболевания кишечника • болезнь Крона и подозрение на неё • семейный аденоматозный полипоз • полипы и подозрение на их наличие • рак кишечника • мониторинг состояния кишечника после оперативного вмешательства (особенно при наличии опухолевого процесса). • обследование членов семьи первой и второй степени родства, у которых был выявлен рак кишечника; • наследственный неполипозный колоректальный рак; • профилактическое обследование лиц старше 40 лет (1 раз в год) • глистные инвазии, особенно в случае повторного заражения и хронического течения; • состояние после холецистэктомии
Фекальный трансферрин и гемоглобин (количественное определение) Показания для обследования: • хронические воспалительные заболевания ЖКТ, колиты; • прием аспирина и нестероидных препаратов; • после длительной АБ-терапии и неоднократного курса • язвенная болезнь желудка • аутоиммунные заболевания кишечника • болезнь Крона и подозрение на неё • семейный аденоматозный полипоз • полипы и подозрение на их наличие • рак кишечника • мониторинг состояния кишечника после оперативного вмешательства (особенно при наличии опухолевого процесса). • обследование членов семьи первой и второй степени родства, у которых был выявлен рак кишечника; • наследственный неполипозный колоректальный рак; • профилактическое обследование лиц старше 40 лет (1 раз в год) • глистные инвазии, особенно в случае повторного заражения и хронического течения; • состояние после холецистэктомии
 Фекальный трансферрин и гемоглобин (количественное определение) Данный тест по своей чувствительности намного превосходит известный тест «на скрытую кровь» . Трансферрин сохраняется более длительное время, чем гемоглобин в кале. Не требуется специальной диеты и отмены ЛС. Повышенное содержание трансферрина свидетельствует о поражении верхних отделов кишечника, а гемоглобина – нижних отделов. Если оба показателя высоки, то это свидетельствует об обширном процессе. Чем выше показатель, тем больше глубина либо зона поражения. Внедрение теста в скрининговые исследования по профилактике и с диагностической целью, с одной стороны, значительно снижают потребность использования колоноскопии за счет нерационального проведения, но, с другой стороны. увеличит частоту колоноскопий за счет дополнительного выявления ранних стадий предраковых состояний и рака. Она проводится при повышенных показателях трансферрина и гемоглобина.
Фекальный трансферрин и гемоглобин (количественное определение) Данный тест по своей чувствительности намного превосходит известный тест «на скрытую кровь» . Трансферрин сохраняется более длительное время, чем гемоглобин в кале. Не требуется специальной диеты и отмены ЛС. Повышенное содержание трансферрина свидетельствует о поражении верхних отделов кишечника, а гемоглобина – нижних отделов. Если оба показателя высоки, то это свидетельствует об обширном процессе. Чем выше показатель, тем больше глубина либо зона поражения. Внедрение теста в скрининговые исследования по профилактике и с диагностической целью, с одной стороны, значительно снижают потребность использования колоноскопии за счет нерационального проведения, но, с другой стороны. увеличит частоту колоноскопий за счет дополнительного выявления ранних стадий предраковых состояний и рака. Она проводится при повышенных показателях трансферрина и гемоглобина.
 Фекальный трансферрин и гемоглобин (количественное определение) Уже после 40 лет среди формально здорового населения возрастает частота случаев аденомы и других новообразований толстой кишки. Аденома развивается у 5 -10% лиц старше 40 лет, причем с возрастом частота развития этой патологии повышается и в 50 -59 лет достигает 35%. После 50 лет риск возникновения колоректального рака удваивается в каждую последующую декаду жизни. Практически все современные программы скрининга РАКА предусматривают обязательное обследование населения старше 50 лет даже при отсутствии жалоб на дисфункцию кишечника.
Фекальный трансферрин и гемоглобин (количественное определение) Уже после 40 лет среди формально здорового населения возрастает частота случаев аденомы и других новообразований толстой кишки. Аденома развивается у 5 -10% лиц старше 40 лет, причем с возрастом частота развития этой патологии повышается и в 50 -59 лет достигает 35%. После 50 лет риск возникновения колоректального рака удваивается в каждую последующую декаду жизни. Практически все современные программы скрининга РАКА предусматривают обязательное обследование населения старше 50 лет даже при отсутствии жалоб на дисфункцию кишечника.
 Сравнительная характеристика методов выявления желудочно-кишечного кровотечения Гваяковая проба, амидопириновая проба, экспресс-тесты на «скрытую кровь» i. FOBT (иммунологический тест) Требует специальной диеты (исключение Результат не зависит от диеты, которая не требуется на 3 -4 дня мяса, рыбы, яиц и др. продуктов) Определяет гемоглобин в качественной реакции ( «есть-нет» ) Определяет количество гемоглобина, что особенно важно для мониторинга Не определяет трансферрин Определяет трансферрин (количество!) Нет автоматизации, большое влияние «человеческого фактора» на результат анализа Проводится в автоматическом режиме с высокой производительностью Имеет более низкую чувствительность Имеет высокую чувствительность (89 -90%) Может давать ложноположительные результаты Практически не дает ложно-положительных результатов Не позволяет дифференцировать уровни и глубину поражения желудочно-кишечного тракта Позволяет устанавливать глубину и уровень поражения Имеет низкую эффективность при мониторинге Высокая эффективность при мониторинге за счет сопоставления количества (уровня) аналитов в динамике
Сравнительная характеристика методов выявления желудочно-кишечного кровотечения Гваяковая проба, амидопириновая проба, экспресс-тесты на «скрытую кровь» i. FOBT (иммунологический тест) Требует специальной диеты (исключение Результат не зависит от диеты, которая не требуется на 3 -4 дня мяса, рыбы, яиц и др. продуктов) Определяет гемоглобин в качественной реакции ( «есть-нет» ) Определяет количество гемоглобина, что особенно важно для мониторинга Не определяет трансферрин Определяет трансферрин (количество!) Нет автоматизации, большое влияние «человеческого фактора» на результат анализа Проводится в автоматическом режиме с высокой производительностью Имеет более низкую чувствительность Имеет высокую чувствительность (89 -90%) Может давать ложноположительные результаты Практически не дает ложно-положительных результатов Не позволяет дифференцировать уровни и глубину поражения желудочно-кишечного тракта Позволяет устанавливать глубину и уровень поражения Имеет низкую эффективность при мониторинге Высокая эффективность при мониторинге за счет сопоставления количества (уровня) аналитов в динамике
 Правила забора. Кал забирается в специальные контейнеры (пачи) с наполнителем. Рекомендуют для диагностики применять двухдневный метод (двукратный сбор кала позволяет на 2 -3% увеличить частоту выявления поражения кишечника). Контейнеры с калом можно доставлять в лабораторию в течение 5 дней (одновременно два контейнера либо по одному) Можно транспортировать (пересылать) на большие расстояния.
Правила забора. Кал забирается в специальные контейнеры (пачи) с наполнителем. Рекомендуют для диагностики применять двухдневный метод (двукратный сбор кала позволяет на 2 -3% увеличить частоту выявления поражения кишечника). Контейнеры с калом можно доставлять в лабораторию в течение 5 дней (одновременно два контейнера либо по одному) Можно транспортировать (пересылать) на большие расстояния.
 Клинико-лабораторные параллели при патологии ЖКТ Параметр Клиническая интерпретация Трансферрин (Tf) (кол-во до 25 пкг/мл) Норма. Нет повреждения слизистой верхних отделов кишечника Трансферрин (Tf) в кол-ве более 50 пкг/мл Наличие воспалительного процесса в верхних отделах кишечника, гельминто Гемоглобин (Hb) (кол-во - до Норма. 50 пкг/мл) Нет повреждения слизистой нижних отделов кишечника Гемоглобин (Hb) (кол-во более 100 пкг/мл) Повреждение слизистой нижних отделов кишечника воспалительного или опухолевого характера (полип ранняя стадия рака) Трансферрин (Tf) в кол-ве более 200 пкг/мл + Гемоглобин (Hb) в кол-ве более 300 пкг/мл Повреждение слизистой верхних и нижних отделов. Аутоиммунный процесс (болезнь Крона, НЭК, НЯК), эрозивный процесс вследствие кишечной инфекции, после АБтерапии (повреждение следствие токсина А и В клостридий), полипы, рак
Клинико-лабораторные параллели при патологии ЖКТ Параметр Клиническая интерпретация Трансферрин (Tf) (кол-во до 25 пкг/мл) Норма. Нет повреждения слизистой верхних отделов кишечника Трансферрин (Tf) в кол-ве более 50 пкг/мл Наличие воспалительного процесса в верхних отделах кишечника, гельминто Гемоглобин (Hb) (кол-во - до Норма. 50 пкг/мл) Нет повреждения слизистой нижних отделов кишечника Гемоглобин (Hb) (кол-во более 100 пкг/мл) Повреждение слизистой нижних отделов кишечника воспалительного или опухолевого характера (полип ранняя стадия рака) Трансферрин (Tf) в кол-ве более 200 пкг/мл + Гемоглобин (Hb) в кол-ве более 300 пкг/мл Повреждение слизистой верхних и нижних отделов. Аутоиммунный процесс (болезнь Крона, НЭК, НЯК), эрозивный процесс вследствие кишечной инфекции, после АБтерапии (повреждение следствие токсина А и В клостридий), полипы, рак
 Клинико-лабораторные параллели при патологии ЖКТ Параметр Клиническая интерпретация Снижение кол-ва. Tf и Hb в динамике Эффективное лечение Повышение кол-ва. Tf и Hb в динамике Прогрессирование процесса. Низкая эффективность лечения Повышенное кол-во. Tf и Hb при низком (в пределах нормы) уровне кальпротектина Отсутствие воспалительного процесса. Повреждение слизистой верхних и нижних отделов кишечника Повышенное кол-во. Tf и Hb при высоком уровне кальпротектина Выраженный воспалительный процесс и наличие системного повреждения кишечника (болезнь Крона, НЯК, НЭК) или развитие рака. Выраженность процесса коррелирует с уровнем аналита. Повышение уровня Tf или Hb (или Tf + Hb) после оперативного лечения у больных с полипами либо раком Прогрессирование, рецидивирование. Возможность метастазирования. Снижение уровня Tf или Hb (или Tf + Hb) после оперативного лечения у больных с полипами либо раком Эффективное лечение. Необходим мониторинг через 3 -6 мес ( в зависимости от выраженности процесса и наличия факторов риска)
Клинико-лабораторные параллели при патологии ЖКТ Параметр Клиническая интерпретация Снижение кол-ва. Tf и Hb в динамике Эффективное лечение Повышение кол-ва. Tf и Hb в динамике Прогрессирование процесса. Низкая эффективность лечения Повышенное кол-во. Tf и Hb при низком (в пределах нормы) уровне кальпротектина Отсутствие воспалительного процесса. Повреждение слизистой верхних и нижних отделов кишечника Повышенное кол-во. Tf и Hb при высоком уровне кальпротектина Выраженный воспалительный процесс и наличие системного повреждения кишечника (болезнь Крона, НЯК, НЭК) или развитие рака. Выраженность процесса коррелирует с уровнем аналита. Повышение уровня Tf или Hb (или Tf + Hb) после оперативного лечения у больных с полипами либо раком Прогрессирование, рецидивирование. Возможность метастазирования. Снижение уровня Tf или Hb (или Tf + Hb) после оперативного лечения у больных с полипами либо раком Эффективное лечение. Необходим мониторинг через 3 -6 мес ( в зависимости от выраженности процесса и наличия факторов риска)
 Заключение Создана платформа для скрининга на колоректальный рак!!! Основана на определении в кале количества трансферрина и гемоглобина (параллельное определение двух тестов значительно улучшает диагностику – на 33% при использовании i. FOBT по сравнению с гваяковым тестом) Практически все современные программы скрининга в мире предусматривают обязательное обследование населения старше 50 лет даже при отсутствии жалоб на дисфункцию кишечника. Целями скрининга являются: обнаружение и удаление аденоматозных полипов; диагностика ранних стадий рака. Скрининг потенциально может уменьшить заболеваемость. Снижение показателей заболеваемости приводит к снижению смертности. Кроме того, на общих показателях смертности отразится высокая пропорция ранних раков, результаты лечения которых значительно лучше, чем в III или IV стадии.
Заключение Создана платформа для скрининга на колоректальный рак!!! Основана на определении в кале количества трансферрина и гемоглобина (параллельное определение двух тестов значительно улучшает диагностику – на 33% при использовании i. FOBT по сравнению с гваяковым тестом) Практически все современные программы скрининга в мире предусматривают обязательное обследование населения старше 50 лет даже при отсутствии жалоб на дисфункцию кишечника. Целями скрининга являются: обнаружение и удаление аденоматозных полипов; диагностика ранних стадий рака. Скрининг потенциально может уменьшить заболеваемость. Снижение показателей заболеваемости приводит к снижению смертности. Кроме того, на общих показателях смертности отразится высокая пропорция ранних раков, результаты лечения которых значительно лучше, чем в III или IV стадии.
 Эндоскопические методы скрининга Гибкая сигмоскопия позволяет проводить визуальный осмотр внутренней поверхности толстой кишки на расстоянии до 60 см от анального отверстия. Эта методика может выявлять колоректальные полипы и рак, а также используется для удаления полипов и взятия биопсии для патоморфологического исследования. К преимуществам гибкой сигмоскопии относят то что процедура требует меньше времени, чем колоноскопия; подготовка толстой кишки проходит легче и быстрее; сопутствующая патология может игнорироваться в процедурах, которые не сопровождаются полипэктомией, нет необходимости в проведении седации. Однако, есть очевидный недостаток – исследование только лишь левой половины толстой кишки приводит к пропуску правосторонних повреждений.
Эндоскопические методы скрининга Гибкая сигмоскопия позволяет проводить визуальный осмотр внутренней поверхности толстой кишки на расстоянии до 60 см от анального отверстия. Эта методика может выявлять колоректальные полипы и рак, а также используется для удаления полипов и взятия биопсии для патоморфологического исследования. К преимуществам гибкой сигмоскопии относят то что процедура требует меньше времени, чем колоноскопия; подготовка толстой кишки проходит легче и быстрее; сопутствующая патология может игнорироваться в процедурах, которые не сопровождаются полипэктомией, нет необходимости в проведении седации. Однако, есть очевидный недостаток – исследование только лишь левой половины толстой кишки приводит к пропуску правосторонних повреждений.
 Эндоскопические методы скрининга В то время как специфичность эндоскопического осмотра очень высока (98– 100% с единичными ложноположительными результатами), чувствительность является низкой в отношении всей толстой кишки и находится в пределах 35– 70%, что обусловлено значительным числом правосторонних аденом в случае отсутствия или пропуска дистальных образований во время гибкой сигмоскопии. Сигмоскопию продолжают использовать в качестве скринингового метода для раннего выявления рака и его профилактики. Исследования «случай-контроль» показали, что скрининговая сигмоскопия снижает смертность от КРР на 60– 70% в исследуемой области. Опасные для жизни пациента осложнения случаются в одном случае на 10000.
Эндоскопические методы скрининга В то время как специфичность эндоскопического осмотра очень высока (98– 100% с единичными ложноположительными результатами), чувствительность является низкой в отношении всей толстой кишки и находится в пределах 35– 70%, что обусловлено значительным числом правосторонних аденом в случае отсутствия или пропуска дистальных образований во время гибкой сигмоскопии. Сигмоскопию продолжают использовать в качестве скринингового метода для раннего выявления рака и его профилактики. Исследования «случай-контроль» показали, что скрининговая сигмоскопия снижает смертность от КРР на 60– 70% в исследуемой области. Опасные для жизни пациента осложнения случаются в одном случае на 10000.
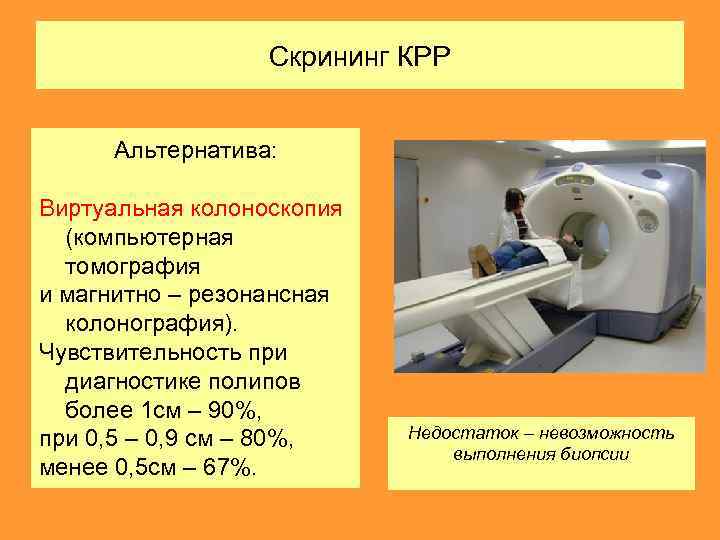 Скрининг КРР Альтернатива: Виртуальная колоноскопия (компьютерная томография и магнитно – резонансная колонография). Чувствительность при диагностике полипов более 1 см – 90%, при 0, 5 – 0, 9 см – 80%, менее 0, 5 см – 67%. Недостаток – невозможность выполнения биопсии
Скрининг КРР Альтернатива: Виртуальная колоноскопия (компьютерная томография и магнитно – резонансная колонография). Чувствительность при диагностике полипов более 1 см – 90%, при 0, 5 – 0, 9 см – 80%, менее 0, 5 см – 67%. Недостаток – невозможность выполнения биопсии
 Cкрининг рака легкого (РЛ)
Cкрининг рака легкого (РЛ)
 Скрининг рака легкого (РЛ) • • Рентгенография грудной клетки (крупнокадровая флюорография) Цитологическое исследование мокроты на атипические клетки
Скрининг рака легкого (РЛ) • • Рентгенография грудной клетки (крупнокадровая флюорография) Цитологическое исследование мокроты на атипические клетки
 Скрининг рака желудка (РЖ)
Скрининг рака желудка (РЖ)
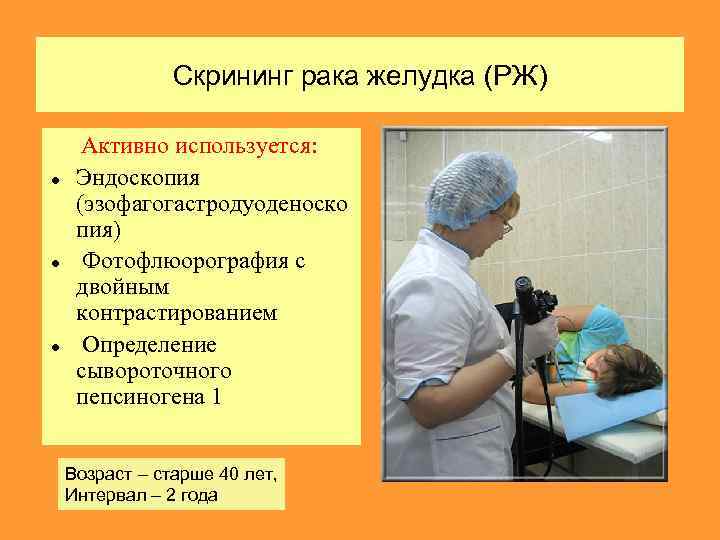 Скрининг рака желудка (РЖ) Активно используется: Эндоскопия (эзофагогастродуоденоско пия) Фотофлюорография с двойным контрастированием Определение сывороточного пепсиногена 1 Возраст – старше 40 лет, Интервал – 2 года
Скрининг рака желудка (РЖ) Активно используется: Эндоскопия (эзофагогастродуоденоско пия) Фотофлюорография с двойным контрастированием Определение сывороточного пепсиногена 1 Возраст – старше 40 лет, Интервал – 2 года
 Маркер атрофии тела желудка – сывороточной пепсиноген. Низкий сывороточный пепсиноген – значит, выраженный атрофический гастрит, значит, более высок риск рака желудка.
Маркер атрофии тела желудка – сывороточной пепсиноген. Низкий сывороточный пепсиноген – значит, выраженный атрофический гастрит, значит, более высок риск рака желудка.
 Скрининг рака предстательной железы (РПЖ)
Скрининг рака предстательной железы (РПЖ)
 Чаще всего РПЖ заболевают в возрасте 50 лет и старше; однако среди мужчин с отягощенной наследственность (сыновья и братья больных РПЖ) вероятность заболевания увеличивается с 40 лет
Чаще всего РПЖ заболевают в возрасте 50 лет и старше; однако среди мужчин с отягощенной наследственность (сыновья и братья больных РПЖ) вероятность заболевания увеличивается с 40 лет
 Скрининговые мероприятия целесообразно начинать с 40 -50 лет. В то же время, как показывает клинический опыт, пациенты могут быть значительно моложе 40 лет, в связи с чем молодой возраст никогда не должен рассматриваться в качестве аргумента для исключения у больных РПЖ. Можно предположить, что по мере усовершенствования методики и удешевления скрининга контингент обследуемых будет расширяться за счет лиц более молодого возраста
Скрининговые мероприятия целесообразно начинать с 40 -50 лет. В то же время, как показывает клинический опыт, пациенты могут быть значительно моложе 40 лет, в связи с чем молодой возраст никогда не должен рассматриваться в качестве аргумента для исключения у больных РПЖ. Можно предположить, что по мере усовершенствования методики и удешевления скрининга контингент обследуемых будет расширяться за счет лиц более молодого возраста
 Верхняя возрастная граница для лиц, подлежащих профилактическому обследованию с целью выявления доклинических форм РПЖ: 70 – 75 лет
Верхняя возрастная граница для лиц, подлежащих профилактическому обследованию с целью выявления доклинических форм РПЖ: 70 – 75 лет
 Периодичность проведения скринингового обследования - 1 раз в год Для лиц, отнесенных к группе повышенного риска - 1 раз в 6 мес.
Периодичность проведения скринингового обследования - 1 раз в год Для лиц, отнесенных к группе повышенного риска - 1 раз в 6 мес.
 Идеального диагностического теста на РПЖ, т. е. теста, обладающего высокой чувствительностью и абсолютной специфичностью, до настоящего времени нет. Поэтому скрининг базируется на сочетанном использовании трех методов исследования:
Идеального диагностического теста на РПЖ, т. е. теста, обладающего высокой чувствительностью и абсолютной специфичностью, до настоящего времени нет. Поэтому скрининг базируется на сочетанном использовании трех методов исследования:
 Анализ крови на простатический специфический антиген (ПСА) Пальпация предстательной железы через прямую кишку (ПРИ) ТРУЗИ (трансректальное УЗИ)
Анализ крови на простатический специфический антиген (ПСА) Пальпация предстательной железы через прямую кишку (ПРИ) ТРУЗИ (трансректальное УЗИ)
 Главный компонент скрининга – определение уровня ПСА в сыворотке крови Тест характеризуется: - хорошей воспроизводимостью - высокой чувствительностью - неинвазивностью - небольшой стоимостью - возможностью обследования больших групп мужского населения - не требуется непосредственного контакта пациента с врачом
Главный компонент скрининга – определение уровня ПСА в сыворотке крови Тест характеризуется: - хорошей воспроизводимостью - высокой чувствительностью - неинвазивностью - небольшой стоимостью - возможностью обследования больших групп мужского населения - не требуется непосредственного контакта пациента с врачом
 ПСА впервые выделен в 1979 году M. Wang. Представляет собой гликопротеид, продуцируемый секреторными клетками эпителия предстательной железы. Основное количество ПСА является составной частью простатического секрета. В норме 0, 1% всего ПСА проникает в кровь. В крови ПСА находится как в свободной так и в связанной формах
ПСА впервые выделен в 1979 году M. Wang. Представляет собой гликопротеид, продуцируемый секреторными клетками эпителия предстательной железы. Основное количество ПСА является составной частью простатического секрета. В норме 0, 1% всего ПСА проникает в кровь. В крови ПСА находится как в свободной так и в связанной формах
 Наиболее частые причины - повышения уровня ПСА: Воспалительные процессы (простатит, абсцесс); Урологические манипуляции, травмирующие простату; Доброкачественная гиперплазия (ДГП); Злокачественные новообразования
Наиболее частые причины - повышения уровня ПСА: Воспалительные процессы (простатит, абсцесс); Урологические манипуляции, травмирующие простату; Доброкачественная гиперплазия (ДГП); Злокачественные новообразования
 Обладая органоспецифичностью, ПСА не является опухолеспецифичным маркером, чем объясняется значительное количество ложно -положительных заключений при использовании ПСА в процедуре скрининга
Обладая органоспецифичностью, ПСА не является опухолеспецифичным маркером, чем объясняется значительное количество ложно -положительных заключений при использовании ПСА в процедуре скрининга
 Уровень ПСА увеличивается с возрастом, поэтому верхняя граница нормы для различных возрастов различно и колеблется от 2, 5 нг/мл в 4049 лет до 6, 5 нг/мл в 70 -79 лет Возраст (лет) 40 -49 50 -59 60 -69 ПСА (нгмл) 70 -79 2, 5 6, 5 3, 5 4, 5
Уровень ПСА увеличивается с возрастом, поэтому верхняя граница нормы для различных возрастов различно и колеблется от 2, 5 нг/мл в 4049 лет до 6, 5 нг/мл в 70 -79 лет Возраст (лет) 40 -49 50 -59 60 -69 ПСА (нгмл) 70 -79 2, 5 6, 5 3, 5 4, 5
 Рак предстательной железы (PSA) Уровень в крови ниже 4 нг/мл считается нормальным При уровне PSA 4 -10 нг/мл - отмечен положительный результат биопсий в 22% случаев При уровне PSA более 10 нг/мл – положительный результат биопсий получают в 66% случаев Уровень увеличивается при любых заболеваниях, манипуляциях с предстательной железой Используется для стадирования, мониторинга и прогнозирования
Рак предстательной железы (PSA) Уровень в крови ниже 4 нг/мл считается нормальным При уровне PSA 4 -10 нг/мл - отмечен положительный результат биопсий в 22% случаев При уровне PSA более 10 нг/мл – положительный результат биопсий получают в 66% случаев Уровень увеличивается при любых заболеваниях, манипуляциях с предстательной железой Используется для стадирования, мониторинга и прогнозирования
 Верхняя граница нормы ПСА = 4 нг/мл Однако, в последние годы детально обследуются лица с меньшим уровнем ПСА, вплоть до 2, 5 нг/мл
Верхняя граница нормы ПСА = 4 нг/мл Однако, в последние годы детально обследуются лица с меньшим уровнем ПСА, вплоть до 2, 5 нг/мл
 Наибольшие диагностические трудности вызывает увеличение ПСА, обусловленное ДГП Повышение ПСА в диапазоне 4 -10 нг/мл (так называемая «серая зона» ) в 70% случаев вызывается доброкачественной гиперплазией Это вызывает значительное количество ложно-положительных заключений, что приводит к увеличению числа биопсий предстательной железы
Наибольшие диагностические трудности вызывает увеличение ПСА, обусловленное ДГП Повышение ПСА в диапазоне 4 -10 нг/мл (так называемая «серая зона» ) в 70% случаев вызывается доброкачественной гиперплазией Это вызывает значительное количество ложно-положительных заключений, что приводит к увеличению числа биопсий предстательной железы
 Для повышения точности дифференциальной диагностики между ДГП и РПЖ был разработан ряд дополнительных диагностических признаков:
Для повышения точности дифференциальной диагностики между ДГП и РПЖ был разработан ряд дополнительных диагностических признаков:
 q Соотношение свободного ПСА к общему (пороговое значение = 0, 15 или 15%). >15 характерно для ДГП, <15 патогномонично для рака. Для определения этого показателя уровень общего ПСА должен быть от 4 до 10 нг/мл. q Динамический прирост ПСА во времени. Вероятность развития рака считается достаточно высокой при ежегодном увеличении уровня на 0, 75 -1, 0 нг/мл или более q Определение плотности ПСА (отношение уровня общего ПСА к объему предстательной железы, вычисленному при ТРУЗИ)
q Соотношение свободного ПСА к общему (пороговое значение = 0, 15 или 15%). >15 характерно для ДГП, <15 патогномонично для рака. Для определения этого показателя уровень общего ПСА должен быть от 4 до 10 нг/мл. q Динамический прирост ПСА во времени. Вероятность развития рака считается достаточно высокой при ежегодном увеличении уровня на 0, 75 -1, 0 нг/мл или более q Определение плотности ПСА (отношение уровня общего ПСА к объему предстательной железы, вычисленному при ТРУЗИ)
 У части больных РПЖ уровень ПСА не превышает нормы. Доля больных раком, имеющих уровень ПСА ниже 4, 0 нг/мл может достигать 23%
У части больных РПЖ уровень ПСА не превышает нормы. Доля больных раком, имеющих уровень ПСА ниже 4, 0 нг/мл может достигать 23%
 Немногим более 10 лет назад практически единственным методом скрининга РПЖ являлась пальпация через прямую кишку. Однако метод совершенно непригоден для выявления опухолей I стадии, хотя в диагностике РПЖ более поздних стадий может оказать значительную помощь.
Немногим более 10 лет назад практически единственным методом скрининга РПЖ являлась пальпация через прямую кишку. Однако метод совершенно непригоден для выявления опухолей I стадии, хотя в диагностике РПЖ более поздних стадий может оказать значительную помощь.
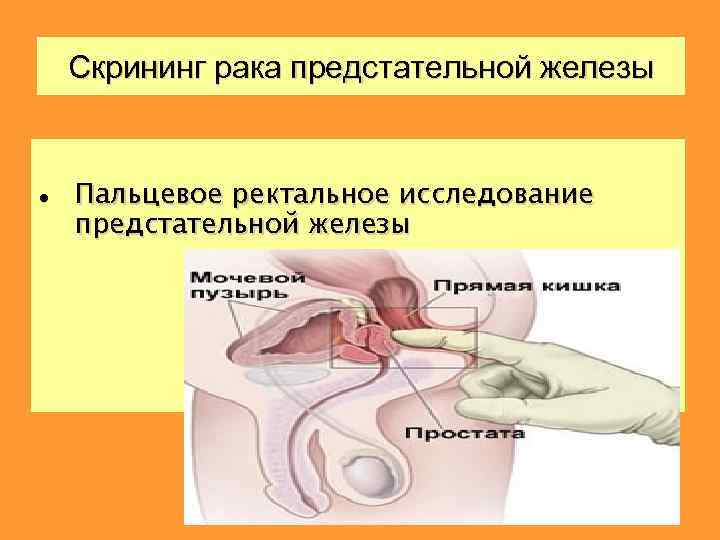 Скрининг рака предстательной железы Пальцевое ректальное исследование предстательной железы
Скрининг рака предстательной железы Пальцевое ректальное исследование предстательной железы
 При пальпации обращают внимание на: q. Размеры q. Форму q. Консистенцию q. Характер поверхности q. Выраженность срединной и латеральных бороздок Классический признак рака – очаг уплотнения ткани увеличенной предстательной железы
При пальпации обращают внимание на: q. Размеры q. Форму q. Консистенцию q. Характер поверхности q. Выраженность срединной и латеральных бороздок Классический признак рака – очаг уплотнения ткани увеличенной предстательной железы
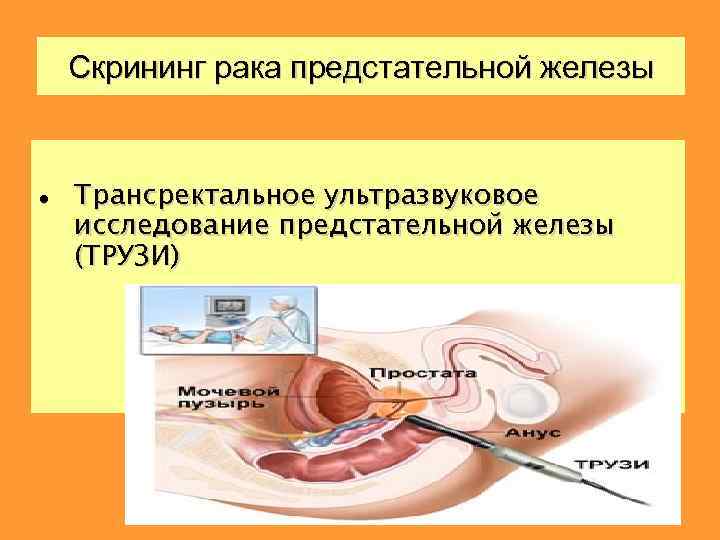 Скрининг рака предстательной железы Трансректальное ультразвуковое исследование предстательной железы (ТРУЗИ)
Скрининг рака предстательной железы Трансректальное ультразвуковое исследование предстательной железы (ТРУЗИ)
 Трансректальное УЗИ используется преимущественно на ранних этапах диагностики. Позволяет получить информацию о возможном наличии опухолевых очагов, их размерах, количестве и локализации. Опухоль как правило гипоэхогенна. Развивается: 68% - из периферических отделов 24% - из транзиторной зоны 8% - из центральной зоны
Трансректальное УЗИ используется преимущественно на ранних этапах диагностики. Позволяет получить информацию о возможном наличии опухолевых очагов, их размерах, количестве и локализации. Опухоль как правило гипоэхогенна. Развивается: 68% - из периферических отделов 24% - из транзиторной зоны 8% - из центральной зоны
 ТРУЗИ способно визуализировать центральную и транзиторную зоны, что делает его незаменимым в выявлении предполагаемых очагов опухолевого роста, расположенных на значительном расстоянии от периферических отделов железы, которые не могут быть определены пальпаторно. Способствует выявлению вовлечения в патологический процесс капсулы ПЖ, парапростатической клетчатки, семенных пузырьков, мочевого пузыря и прямой кишки.
ТРУЗИ способно визуализировать центральную и транзиторную зоны, что делает его незаменимым в выявлении предполагаемых очагов опухолевого роста, расположенных на значительном расстоянии от периферических отделов железы, которые не могут быть определены пальпаторно. Способствует выявлению вовлечения в патологический процесс капсулы ПЖ, парапростатической клетчатки, семенных пузырьков, мочевого пузыря и прямой кишки.
 Главным направлением использования ТРУЗИ является обеспечение прицельного характера биопсии предстательной железы под визуальным контролем
Главным направлением использования ТРУЗИ является обеспечение прицельного характера биопсии предстательной железы под визуальным контролем
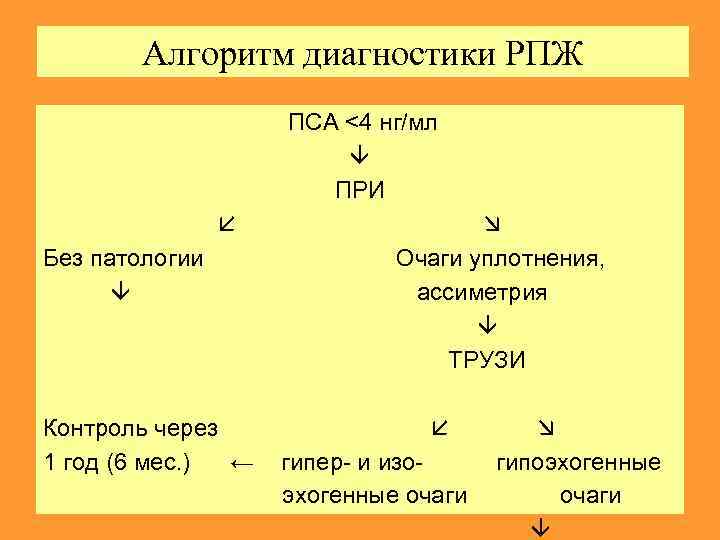 Алгоритм диагностики РПЖ ПСА <4 нг/мл ПРИ Без патологии Очаги уплотнения, ассиметрия ТРУЗИ Контроль через 1 год (6 мес. ) ← гипер- и изо- гипоэхогенные эхогенные очаги
Алгоритм диагностики РПЖ ПСА <4 нг/мл ПРИ Без патологии Очаги уплотнения, ассиметрия ТРУЗИ Контроль через 1 год (6 мес. ) ← гипер- и изо- гипоэхогенные эхогенные очаги
 Алгоритм диагностики РПЖ ПСА=4 -10 нг/мл ПРИ без патологии очаги уплотнения, ассиметрия Контроль ПСА через 6 недель ПСА<4 ПСА>4 Контроль через Мультифокальная биопсия 1 год (6 мес. )
Алгоритм диагностики РПЖ ПСА=4 -10 нг/мл ПРИ без патологии очаги уплотнения, ассиметрия Контроль ПСА через 6 недель ПСА<4 ПСА>4 Контроль через Мультифокальная биопсия 1 год (6 мес. )
 Алгоритм диагностики РПЖ ПСА>10 ПРИ Мультифокальная биопсия
Алгоритм диагностики РПЖ ПСА>10 ПРИ Мультифокальная биопсия
 Скрининг рака молочной железы (РМЖ)
Скрининг рака молочной железы (РМЖ)
 Рак молочной железы (РМЖ) • В структуре злокачественных заболеваний у женщин занимает 1 место. • Распространенность РМЖ и рост смертности от этого заболевания определяет чрезвычайную актуальность его распознавания на ранних стадиях.
Рак молочной железы (РМЖ) • В структуре злокачественных заболеваний у женщин занимает 1 место. • Распространенность РМЖ и рост смертности от этого заболевания определяет чрезвычайную актуальность его распознавания на ранних стадиях.
 «Золотым стандартом» скрининга рака молочной железы служит маммография, проведение которой позволяет снизить смертность на 30 -50%.
«Золотым стандартом» скрининга рака молочной железы служит маммография, проведение которой позволяет снизить смертность на 30 -50%.
 Рекомендации МАИР (Лион) и отдела рака ВОЗ • маммография (пленочная или цифровая) у всех (без учета групп риска) женщин • в «таргетной» когорте 50 – 69 лет обследование повторяется каждые 2 года • наличие канцеррегистра для учета показателей заболеваемости и смертности
Рекомендации МАИР (Лион) и отдела рака ВОЗ • маммография (пленочная или цифровая) у всех (без учета групп риска) женщин • в «таргетной» когорте 50 – 69 лет обследование повторяется каждые 2 года • наличие канцеррегистра для учета показателей заболеваемости и смертности
 Маммографический скрининг • Возраст – 40 лет и старше; • При отсутствии патологии молочных желез - маммография 1 раз в 2 года; • При наличии факторов риска (наличие в семейном анамнезе 2 -х родственниц, страдавших раком молочной железы; фактор травмы молочной железы, в том числе, и хирургической; пострадавшие вследствие радиационных катастроф; наличие в анамнезе рака молочной железы; наличие в анамнезе туберкулеза; ) - маммография 1 раз в год.
Маммографический скрининг • Возраст – 40 лет и старше; • При отсутствии патологии молочных желез - маммография 1 раз в 2 года; • При наличии факторов риска (наличие в семейном анамнезе 2 -х родственниц, страдавших раком молочной железы; фактор травмы молочной железы, в том числе, и хирургической; пострадавшие вследствие радиационных катастроф; наличие в анамнезе рака молочной железы; наличие в анамнезе туберкулеза; ) - маммография 1 раз в год.
 Причины отсутствия эффекта скрининга • низкий показатель участия (compliance) приглашенных на маммографию (<60%); • применение однопроекционной маммографии (одна косая или боковая проекция); • значительные (>2 лет) интервалы между отдельными раундами скрининга и увеличение частоты "интервальных" РМЖ с высокой скоростью роста; • несовершенная техника, оборудование, низкочувствительная пленка; • дефекты работы канцер – регистров. Неточная информация о причинах смерти;
Причины отсутствия эффекта скрининга • низкий показатель участия (compliance) приглашенных на маммографию (<60%); • применение однопроекционной маммографии (одна косая или боковая проекция); • значительные (>2 лет) интервалы между отдельными раундами скрининга и увеличение частоты "интервальных" РМЖ с высокой скоростью роста; • несовершенная техника, оборудование, низкочувствительная пленка; • дефекты работы канцер – регистров. Неточная информация о причинах смерти;
 Томосинтез более эффективно выявляет рак молочной железы, чем маммография Согласно результатам проведенного в университете Лунда (Швеция) исследования, опубликованным в журнале European Radiology, система томографической реконструкции в трех измерениях обнаруживает рак молочной железы на 40% чаще, чем традиционная маммография. Кроме того, эта процедура не столь дискомфортна для женщин, поскольку давление на грудь в два раза меньше. Поэтому исследователи считают переход на этот новый метод неизбежным.
Томосинтез более эффективно выявляет рак молочной железы, чем маммография Согласно результатам проведенного в университете Лунда (Швеция) исследования, опубликованным в журнале European Radiology, система томографической реконструкции в трех измерениях обнаруживает рак молочной железы на 40% чаще, чем традиционная маммография. Кроме того, эта процедура не столь дискомфортна для женщин, поскольку давление на грудь в два раза меньше. Поэтому исследователи считают переход на этот новый метод неизбежным.
 Одно из преимуществ томосинтеза — более низкие дозы облучения, чем при традиционной маммографии. Также при томосинтезе снижена степень дискомфорта и боль, поскольку нет необходимости в таком сильном давлении на грудь.
Одно из преимуществ томосинтеза — более низкие дозы облучения, чем при традиционной маммографии. Также при томосинтезе снижена степень дискомфорта и боль, поскольку нет необходимости в таком сильном давлении на грудь.
 • Скрининг РМЖ увеличивает количество выявленных случаев РМЖ, диагностированных В ранних стадиях • Скрининг уменьшает рецидивирование РМЖ • Скрининг снижает смертность от РМЖ среди пожилых женщин • Скрининг уменьшает затраты на специальное лечение РМЖ • Скрининг влияет и на показатели смертности от РМЖ среди молодых женщин
• Скрининг РМЖ увеличивает количество выявленных случаев РМЖ, диагностированных В ранних стадиях • Скрининг уменьшает рецидивирование РМЖ • Скрининг снижает смертность от РМЖ среди пожилых женщин • Скрининг уменьшает затраты на специальное лечение РМЖ • Скрининг влияет и на показатели смертности от РМЖ среди молодых женщин
 Скрининг - массовое обследование населения с целью выявления лиц с наличием определенного признака заболевания при отсутствии клинических симптомов. Профилактический осмотр комплекс диагностических мероприятий, направленных на выявление заболевания.
Скрининг - массовое обследование населения с целью выявления лиц с наличием определенного признака заболевания при отсутствии клинических симптомов. Профилактический осмотр комплекс диагностических мероприятий, направленных на выявление заболевания.
 • Проведение массовых профилактических осмотров экономически затратно даже для развитых стран, а процент выявляемости злокачественных новообразований оставляет желать лучшего. • Целесообразно формировать группы онкологического риска с целью проведения в них профилактических осмотров. • Показатели выявляемости злокачественных новообразований в таких группах значительно выше.
• Проведение массовых профилактических осмотров экономически затратно даже для развитых стран, а процент выявляемости злокачественных новообразований оставляет желать лучшего. • Целесообразно формировать группы онкологического риска с целью проведения в них профилактических осмотров. • Показатели выявляемости злокачественных новообразований в таких группах значительно выше.
 Анкета для формирования групп онкологического риска 1. 2. 3. 4. 5. 6. 7. 8. Факторы риска: Лица, имеющие 2 -х кровных родственников больных ЗН Пациенты, перенесшие рак Лица, имеющие врождённые пигментные невусы Люди, ежедневно длительно проводящие время на солнце, либо подвергающиеся периодическому интенсивному воздействию солнца Пострадавшие вследствие радиационных катастроф Лица, работающие в химическом производстве Курение Туберкулез в анамнезе
Анкета для формирования групп онкологического риска 1. 2. 3. 4. 5. 6. 7. 8. Факторы риска: Лица, имеющие 2 -х кровных родственников больных ЗН Пациенты, перенесшие рак Лица, имеющие врождённые пигментные невусы Люди, ежедневно длительно проводящие время на солнце, либо подвергающиеся периодическому интенсивному воздействию солнца Пострадавшие вследствие радиационных катастроф Лица, работающие в химическом производстве Курение Туберкулез в анамнезе
 Анкета для формирования групп онкологического риска Факторы риска: 9. Тяжелая пневмония в анамнезе 10. Ожирение 11. Инфицирование штаммами вируса папилломы человека высокого онкогенного риска (штаммы 16, 18, 31, 33, 45 и др. ). 12. Предраковые заболевания 13. Облигатные предраковые заболевания При наличии фактора облигатного предракового заболевания либо 3 -х и более положительных других факторов риска пациента включают в группу онкологического риска.
Анкета для формирования групп онкологического риска Факторы риска: 9. Тяжелая пневмония в анамнезе 10. Ожирение 11. Инфицирование штаммами вируса папилломы человека высокого онкогенного риска (штаммы 16, 18, 31, 33, 45 и др. ). 12. Предраковые заболевания 13. Облигатные предраковые заболевания При наличии фактора облигатного предракового заболевания либо 3 -х и более положительных других факторов риска пациента включают в группу онкологического риска.
 Мероприятия, проводимые в группах онкологического риска 1 раз в год: - обследование в смотровом кабинете; - осмотр врачами: терапевтом, гинекологом; - проведение лабораторных исследований: ОАК, ОАМ; - флюорография; - маммография - женщинам после 40 лет; - УЗИ молочных желез - до 40 лет; - УЗИ щитовидной железы; - УЗИ органов брюшной полости;
Мероприятия, проводимые в группах онкологического риска 1 раз в год: - обследование в смотровом кабинете; - осмотр врачами: терапевтом, гинекологом; - проведение лабораторных исследований: ОАК, ОАМ; - флюорография; - маммография - женщинам после 40 лет; - УЗИ молочных желез - до 40 лет; - УЗИ щитовидной железы; - УЗИ органов брюшной полости;
 Первым из таких методов явился способ диагностики злокачественных новообразований, получивший название «Онкотест» (3, 11). Согласно гипотезе, на которой основан этот метод, опухолевые антигены оседают на поверхности эритроцитов, меняя их заряд и некоторые свойства. Антигены могут быть самыми разнообразными, в зависимости от вида и локализации злокачественной опухоли. Однако общим для них является то, что в их структуре присутствуют ионы кальция. Эти антигены мы условно называем кальций-белковыми комплексами (КБК). Реактивы, наносимые на мазок крови онкологического больного, взаимодействуют с КБК, вызывая аглютинацию и выпадение в осадок эритроцитов, с образованием после высыхания характерного рисунка. У здорового человека КБК в крови отсутствуют, или их очень мало, поэтому аглютинации и выпадения в осадок эритроцитов не происходит. По мере высыхания реактивов силы поверхностного натяжения растягивают эритроциты к краям "пятна", центр которого остается прозрачным.
Первым из таких методов явился способ диагностики злокачественных новообразований, получивший название «Онкотест» (3, 11). Согласно гипотезе, на которой основан этот метод, опухолевые антигены оседают на поверхности эритроцитов, меняя их заряд и некоторые свойства. Антигены могут быть самыми разнообразными, в зависимости от вида и локализации злокачественной опухоли. Однако общим для них является то, что в их структуре присутствуют ионы кальция. Эти антигены мы условно называем кальций-белковыми комплексами (КБК). Реактивы, наносимые на мазок крови онкологического больного, взаимодействуют с КБК, вызывая аглютинацию и выпадение в осадок эритроцитов, с образованием после высыхания характерного рисунка. У здорового человека КБК в крови отсутствуют, или их очень мало, поэтому аглютинации и выпадения в осадок эритроцитов не происходит. По мере высыхания реактивов силы поверхностного натяжения растягивают эритроциты к краям "пятна", центр которого остается прозрачным.
 «Онкотест– 2» . Новый тест основан на определении специфических веществ, выделяемых злокачественной опухолью, но уже не в цельной крови, а в сыворотке обследуемого. С наибольшей вероятностью эти вещества относятся к ядерным белкам или их составляющим. Реактивы, добавляемые к сыворотке обследуемого, взаимодействуют с этими веществами, образуя иммунные комплексы, которые проявляются на свету и изменяют оптическую плотность опытной сыворотки по сравнению с контролем.
«Онкотест– 2» . Новый тест основан на определении специфических веществ, выделяемых злокачественной опухолью, но уже не в цельной крови, а в сыворотке обследуемого. С наибольшей вероятностью эти вещества относятся к ядерным белкам или их составляющим. Реактивы, добавляемые к сыворотке обследуемого, взаимодействуют с этими веществами, образуя иммунные комплексы, которые проявляются на свету и изменяют оптическую плотность опытной сыворотки по сравнению с контролем.
 Истинно просвещенный предупреждает болезни, а невежда – только лечит их
Истинно просвещенный предупреждает болезни, а невежда – только лечит их
 Спасибо за внимание !
Спасибо за внимание !


