03 Ферменты.ppt
- Количество слайдов: 19

Скорость химических реакций Правило Вант-Гоффа (Jacobus Henricus (Henry) van 't Hoff ) V 2 — скорость реакции при температуре T 2, V 1 — скорость реакции при температуре T 1, γ — температурный коэффициент реакции (если он равен 2, например, то скорость реакции будет увеличиваться в 2 раза при повышении температуры на 10 градусов). Уравнение Аррениуса (Svante August Arrhenius) Число молекул, обладающих энергией , пропорционально EA — энергия активации скорости реакции, A — фактор частоты для реакции , показывает, насколько вероятно, что молекулы реагентов при столкновениях имеют правильную ориентацию для того, чтобы произошла химическая реакция, R — универсальная газовая постоянная, T — температура в кельвинах.
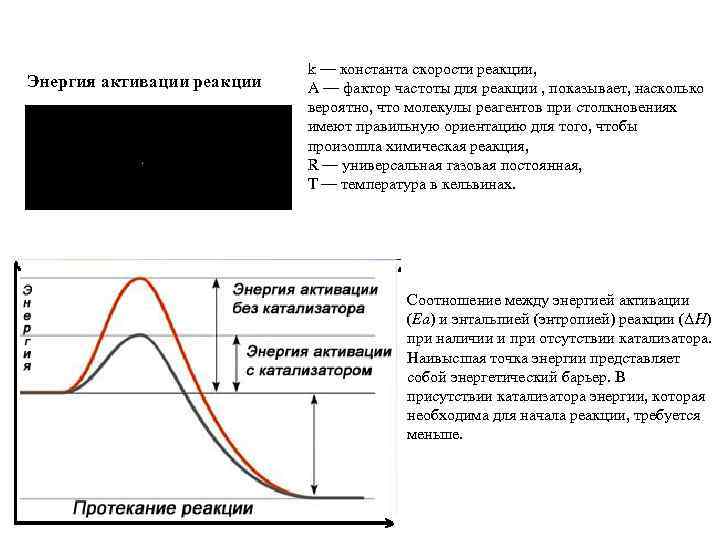
Энергия активации реакции k — константа скорости реакции, A — фактор частоты для реакции , показывает, насколько вероятно, что молекулы реагентов при столкновениях имеют правильную ориентацию для того, чтобы произошла химическая реакция, R — универсальная газовая постоянная, T — температура в кельвинах. Соотношение между энергией активации (Ea) и энтальпией (энтропией) реакции (ΔH) при наличии и при отсутствии катализатора. Наивысшая точка энергии представляет собой энергетический барьер. В присутствии катализатора энергии, которая необходима для начала реакции, требуется меньше.
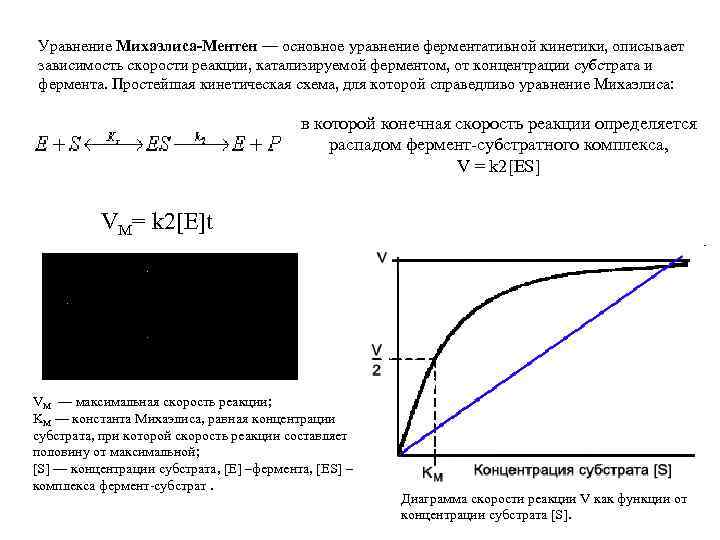
Уравнение Михаэлиса-Ментен — основное уравнение ферментативной кинетики, описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса: в которой конечная скорость реакции определяется распадом фермент-субстратного комплекса, V = k 2[ES] VM= k 2[E]t VM — максимальная скорость реакции; KM — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной; [S] — концентрации субстрата, [E] –фермента, [ES] – комплекса фермент-субстрат. Диаграмма скорости реакции V как функции от концентрации субстрата [S].
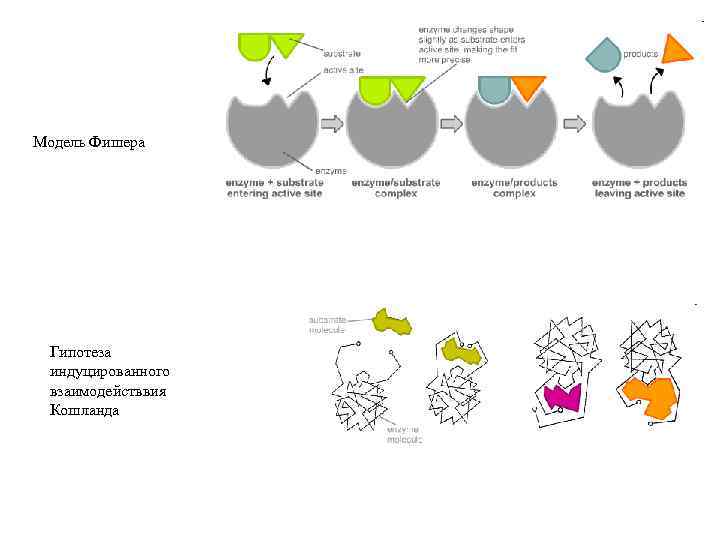
Модель Фишера Гипотеза индуцированного взаимодействвия Кошланда

Классификация ферментов По типу катализируемых реакций ферменты подразделяются на 6 классов согласно иерархической классификации ферментов (КФ, EC — Enzyme Comission code). Каждый класс содержит подклассы, так что фермент описывается совокупностью четырёх чисел, разделённых точками. Например, пепсин имеет название ЕС 3. 4. 23. 1. Первое число грубо описывает механизм реакции, катализируемой ферментом: * КФ 1: Оксидоредуктазы, катализирующие окисление или восстановление. Пример: каталаза, алкогольдегидрогеназа * КФ 2: Трансферазы, катализирующие перенос химических групп с одной молекулы субстрата на другую. Среди трансфераз особо выделяют киназы, переносящие фосфатную группу, как правило, с молекулы АТФ. * КФ 3: Гидролазы, катализирующие гидролиз химических связей. Пример: эстеразы, пепсин, трипсин, амилаза, липопротеинлипаза * КФ 4: Лиазы, катализирующие разрыв химических связей без гидролиза с образованием двойной связи в одном из продуктов. * КФ 5: Изомеразы, катализирующие структурные или геометрические изменения в молекуле субстрата. * КФ 6: Лигазы, катализирующие образование химических связей между субстратами за счет гидролиза АТФ. Пример: ДНК-полимераза

* КФ 1. 1 включает ферменты, взаимодействующие с CH—OH группой доноров; * КФ 1. 2 включает ферменты, взаимодействующие с альдегидной или оксо-группой доноров; * КФ 1. 3 включает ферменты, взаимодействующие с CH—CH группой доноров; * КФ 1. 4 включает ферменты, взаимодействующие с CH—NH 2 группой доноров; * КФ 1. 5 включает ферменты, взаимодействующие с CH—NH группой доноров; * КФ 1. 6 включает ферменты, взаимодействующие с НАД · H или НАДФ · H; * КФ 1. 7 включает ферменты, взаимодействующие с другими азотосодержащими соединениями в качестве доноров; * КФ 1. 8 включает ферменты, взаимодействующие с сероусодержащей группой доноров; * КФ 1. 9 включает ферменты, взаимодействующие с гемовой группой доноров; * КФ 1. 10 включает ферменты, взаимодействующие с дифенолами и родственными соединениями в качестве доноров; * КФ 1. 11 включает ферменты, взаимодействующие с пероксидом в качестве акцептора (пероксидазы); * КФ 1. 12 включает ферменты, взаимодействующие с водородом в качестве донора; * КФ 1. 13 включает ферменты, взаимодействующие с одиночными донорами со встраиванием молекулярного кислорода (оксигеназы); * КФ 1. 14 включает ферменты, взаимодействующие с парными донорами со встраиванием молекулярного кислорода; * КФ 1. 15 включает ферменты, взаимодействующие с супероксид-радикалами в качестве акцепторов; * КФ 1. 16 включает ферменты, окисляющие ионы металлов; * КФ 1. 17 включает ферменты, взаимодействующие с CH или CH 2 группами; * КФ 1. 18 включает ферменты, взаимодействующие с железосерными белками в качестве доноров; * КФ 1. 19 включает ферменты, взаимодействующие с восстановленным флаводоксином в качестве донора; * КФ 1. 20 включает ферменты, взаимодействующие с фосфором или мышьяком в качестве донора; * КФ 1. 21 включает ферменты, взаимодействующие с молекулами вида X—H и Y—H с образованием связи X—Y; * КФ 1. 97 включает другие оксидоредуктазы.
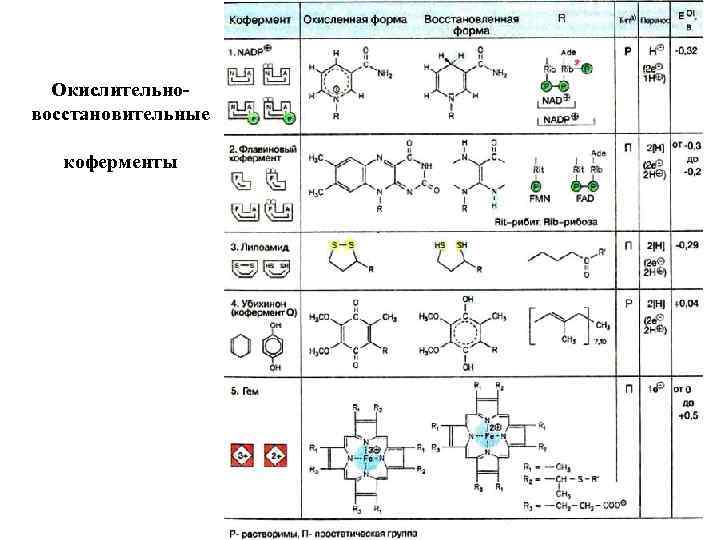
Окислительновосстановительные коферменты
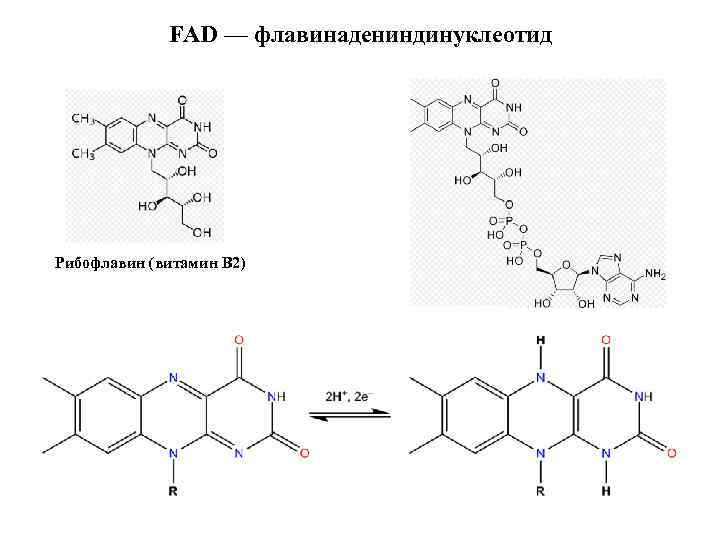
FAD — флавинадениндинуклеотид Рибофлавин (витамин B 2)
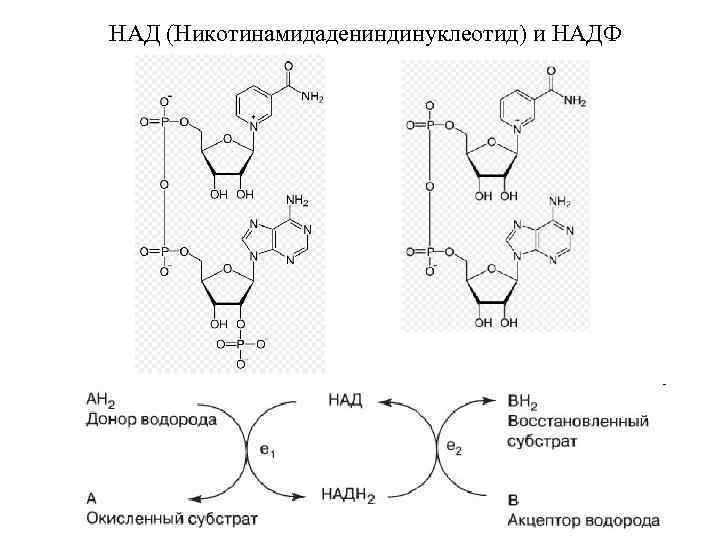
НАД (Никотинамидадениндинуклеотид) и НАДФ
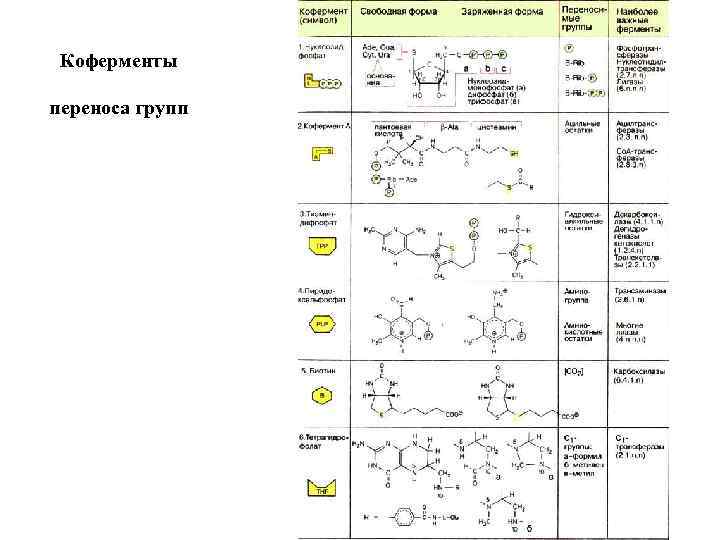
Коферменты переноса групп
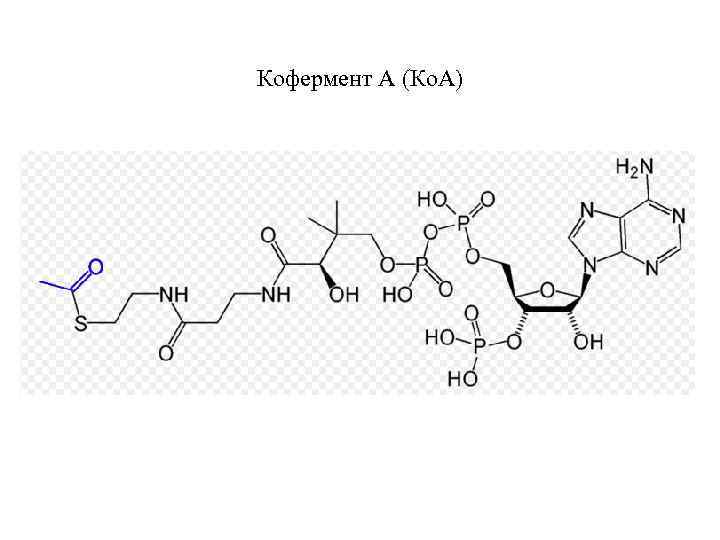
Кофермент А (Ко. А)
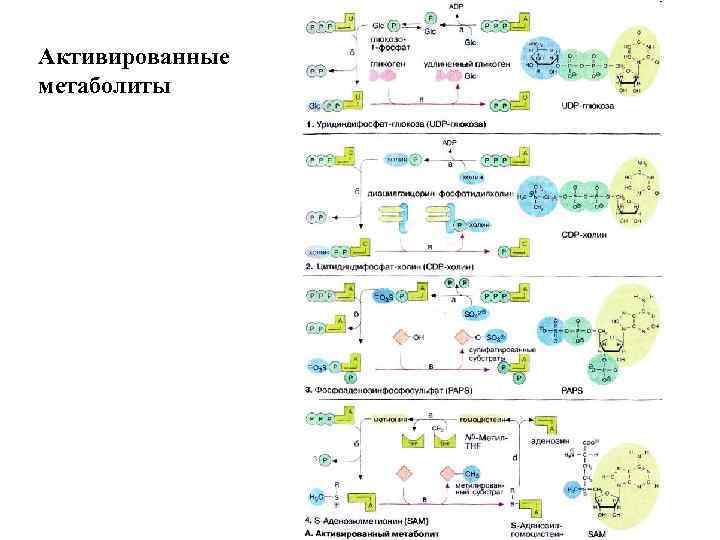
Активированные метаболиты

Множественные формы ферментов можно разделить на две категории: 1. Изоферменты 2. Собственно множественные формы (истинные) Изоферменты - это ферменты, синтез которых кодируется разными генами, у них разная первичная структура и разные свойства, но они катализируют одну и ту же реакцию. Виды изоферментов: 1. Органные - ферменты гликолиза в печени и мышцах. 2. Клеточные - малатдегидрогеназа цитоплазматическая и митохондриальная (ферменты разные, но катализируют одну и ту же реакцию). 3. Гибридные - ферменты с четвертичной структурой, образуются в результате нековалентного связывания отдельных субъединиц (лактатдегидрогеназа - 4 субъединицы 2 типов). 5. Мутантные - образуются в результате единичной мутации гена. 6. Аллоферменты - кодируются разными аллелями одного и того же гена.
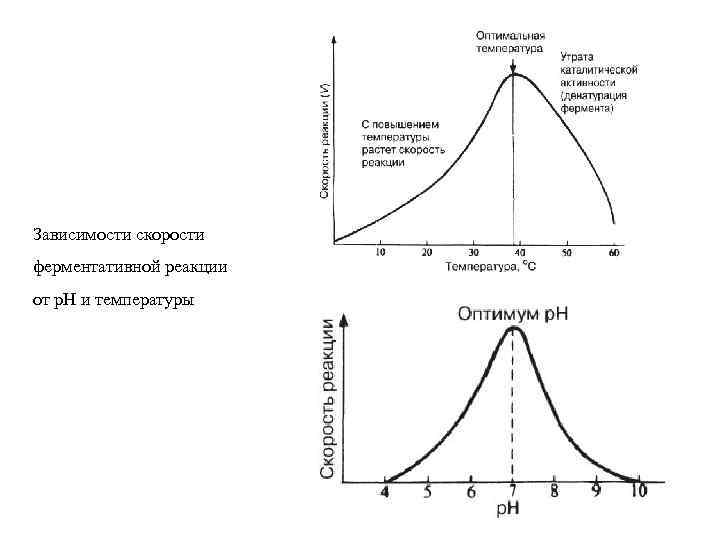
Зависимости скорости ферментативной реакции от р. Н и температуры
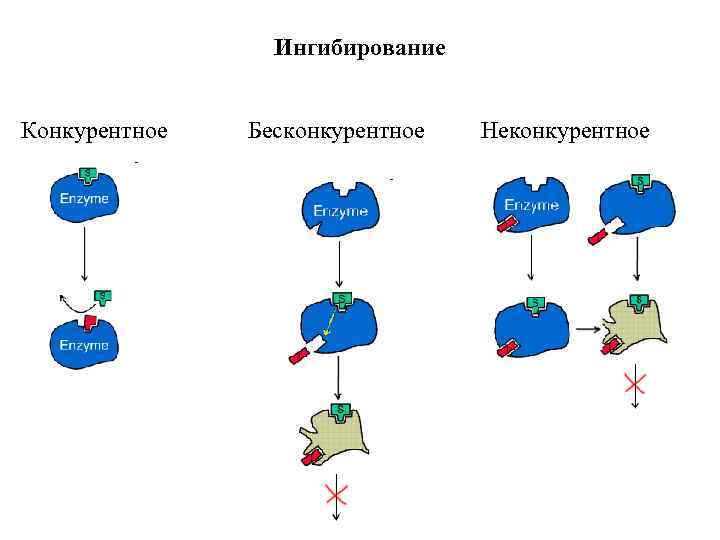
Ингибирование Конкурентное Бесконкурентное Неконкурентное
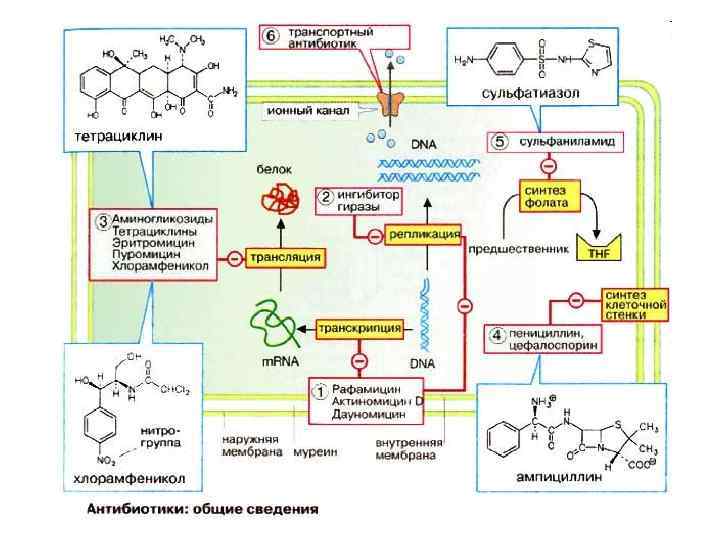
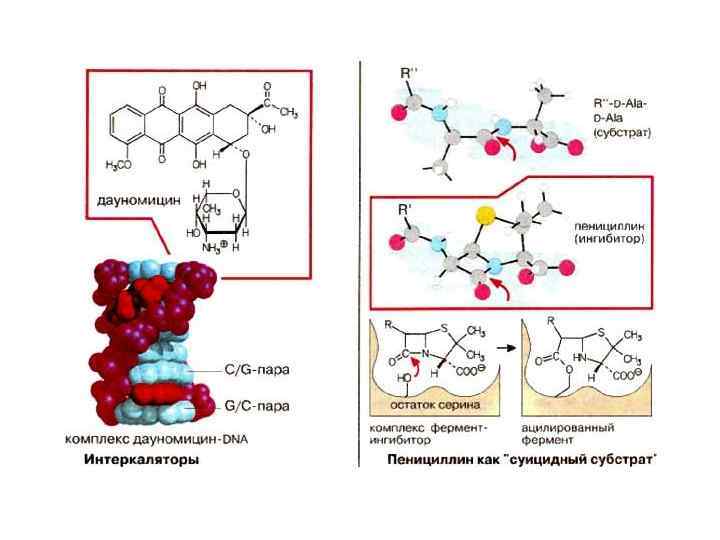
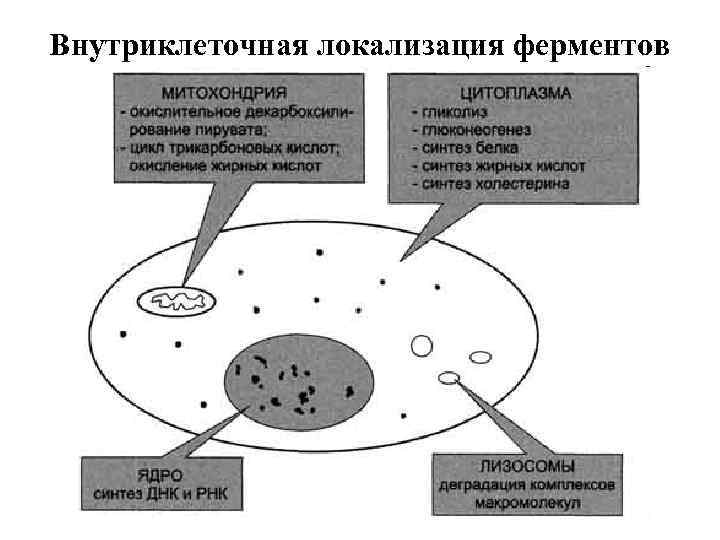
Внутриклеточная локализация ферментов
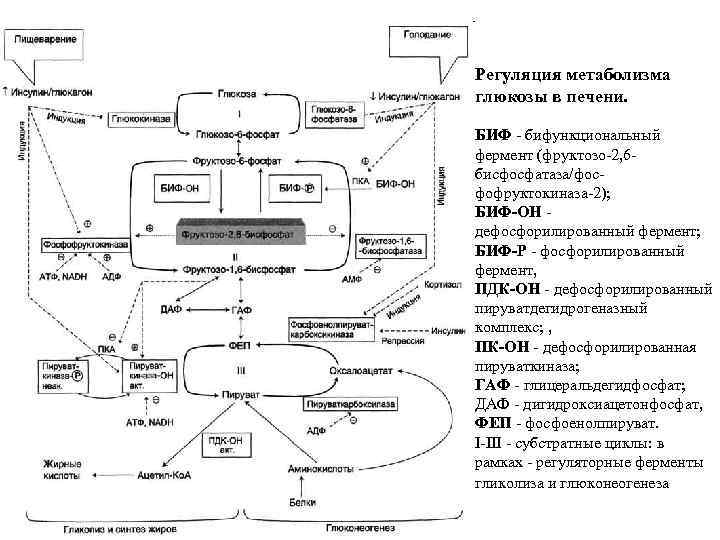
Регуляция метаболизма глюкозы в печени. БИФ - бифункциональный фермент (фруктозо-2, 6 бисфосфатаза/фосфофруктокиназа-2); БИФ-ОН - дефосфорилированный фермент; БИФ-Р - фосфорилированный фермент, ПДК-ОН - дефосфорилированный пируватдегидрогеназный комплекс; , ПК-ОН - дефосфорилированная пируваткиназа; ГАФ - глицеральдегидфосфат; ДАФ - дигидроксиацетонфосфат, ФЕП - фосфоенолпируват. I-III - субстратные циклы: в рамках - регуляторные ферменты гликолиза и глюконеогенеза
03 Ферменты.ppt