скор. хим. р..ppt
- Количество слайдов: 85
 СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ
 Основные подходы: 1. Термодинамический G<0 принцип. возм. G>0 принцип. невозм. 2 NO + O 2 2 NO 2 200 C 2 H 2 + O 2 2 H 2 O 7000 C; Kat
Основные подходы: 1. Термодинамический G<0 принцип. возм. G>0 принцип. невозм. 2 NO + O 2 2 NO 2 200 C 2 H 2 + O 2 2 H 2 O 7000 C; Kat
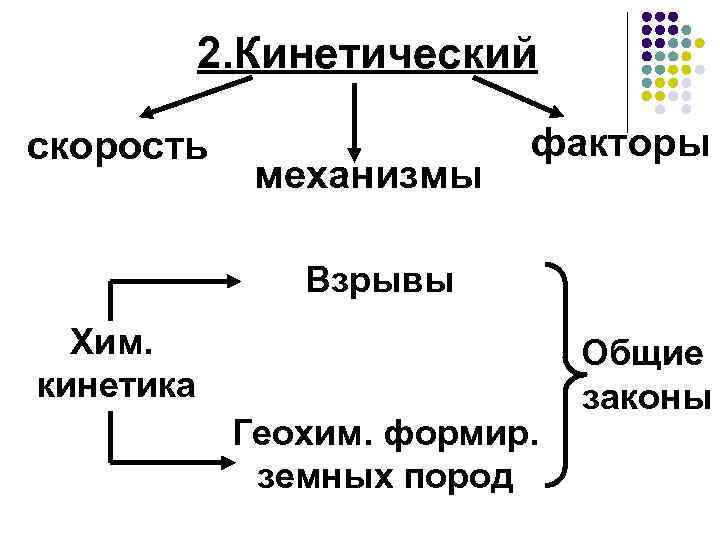 2. Кинетический факторы скорость механизмы Взрывы Хим. кинетика Геохим. формир. земных пород Общие законы
2. Кинетический факторы скорость механизмы Взрывы Хим. кинетика Геохим. формир. земных пород Общие законы
 Хим. кинетика - Основные понятия химической кинетики Химическая реакция (х. р. ) - А В ·Простые реакции - одна стадия; стехиом. ур-ие отраж. реальн. ход процесса NO 2 + NO 2 N 2 O 4
Хим. кинетика - Основные понятия химической кинетики Химическая реакция (х. р. ) - А В ·Простые реакции - одна стадия; стехиом. ур-ие отраж. реальн. ход процесса NO 2 + NO 2 N 2 O 4
 ·Сложные реакции – несколько стадий; стехиом. ур-ие не отраж. реальн. ход процесса 2 HI + H 2 O 2 I 2 + 2 H 2 O а) HI + H 2 O 2 HIО + H 2 O б) HI + HIО I 2 + H 2 O 2 HI + H 2 O 2 I 2 + 2 H 2 O HIО – промежуточное соединение 2 H 2 + O 2 2 H 2 O - 32 стадии
·Сложные реакции – несколько стадий; стехиом. ур-ие не отраж. реальн. ход процесса 2 HI + H 2 O 2 I 2 + 2 H 2 O а) HI + H 2 O 2 HIО + H 2 O б) HI + HIО I 2 + H 2 O 2 HI + H 2 O 2 I 2 + 2 H 2 O HIО – промежуточное соединение 2 H 2 + O 2 2 H 2 O - 32 стадии
 Механизм х. р. – совокупность стадий… Каждая отд. стадия - элементарный акт х. р. Реакции: гомогенные гетерогенные Фаза -
Механизм х. р. – совокупность стадий… Каждая отд. стадия - элементарный акт х. р. Реакции: гомогенные гетерогенные Фаза -
 Гомо 2 СО(г) + О 2(г) 2 СО 2(г) 1 ф 2 Н 2(г) + О 2 (г) 2 Н 2 О(г) 1 ф Гетеро 2 KCl. O 3(к) 2 KCl(к) + 3 O 2(г) Н 2 О(к) Н 2 О(ж) 3 ф 2 ф Гомо – во всём объёме; Гетеро – на границе раздела фаз
Гомо 2 СО(г) + О 2(г) 2 СО 2(г) 1 ф 2 Н 2(г) + О 2 (г) 2 Н 2 О(г) 1 ф Гетеро 2 KCl. O 3(к) 2 KCl(к) + 3 O 2(г) Н 2 О(к) Н 2 О(ж) 3 ф 2 ф Гомо – во всём объёме; Гетеро – на границе раздела фаз
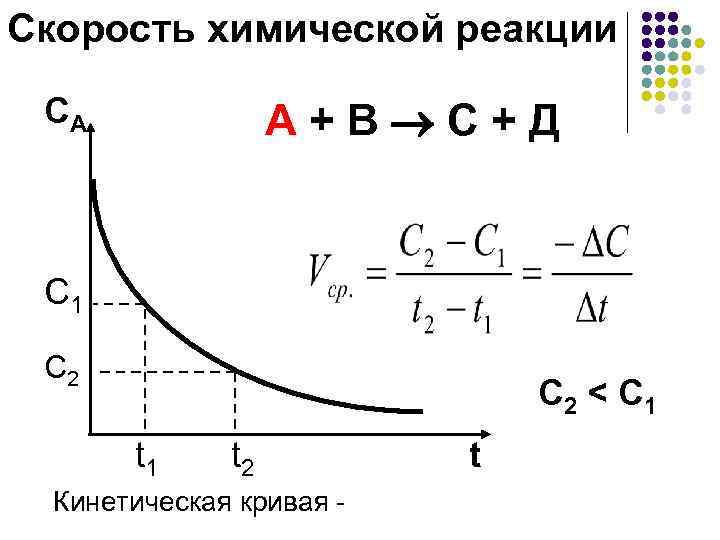 Скорость химической реакции CA А + В С + Д C 1 C 2 < C 1 t 2 Кинетическая кривая - t
Скорость химической реакции CA А + В С + Д C 1 C 2 < C 1 t 2 Кинетическая кривая - t
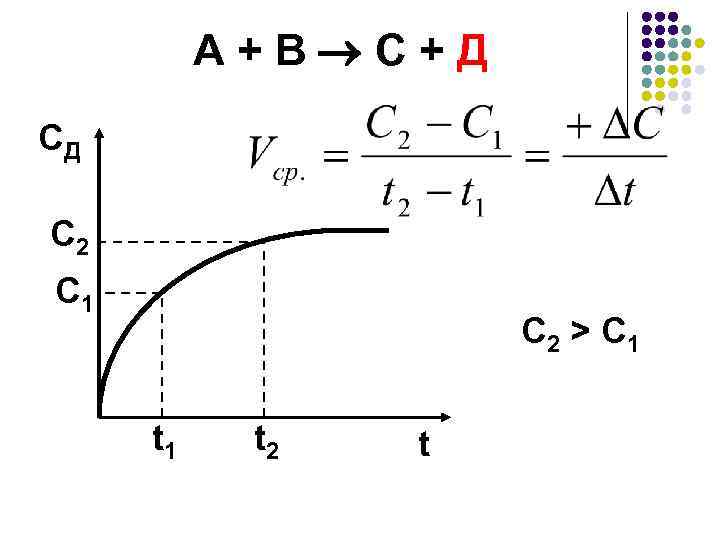 А + В С + Д CД C 2 C 1 C 2 > C 1 t 2 t
А + В С + Д CД C 2 C 1 C 2 > C 1 t 2 t
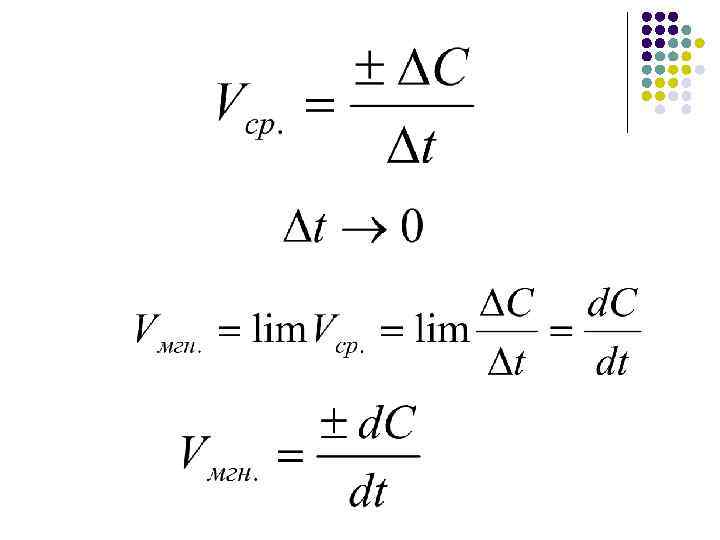
 Измеренные по разным веществам скорости не равны N 2+3 H 2 ⇄ 2 NH 3 1 моль N 2 : 3 моль Н 2 : 2 моль NH 3
Измеренные по разным веществам скорости не равны N 2+3 H 2 ⇄ 2 NH 3 1 моль N 2 : 3 моль Н 2 : 2 моль NH 3
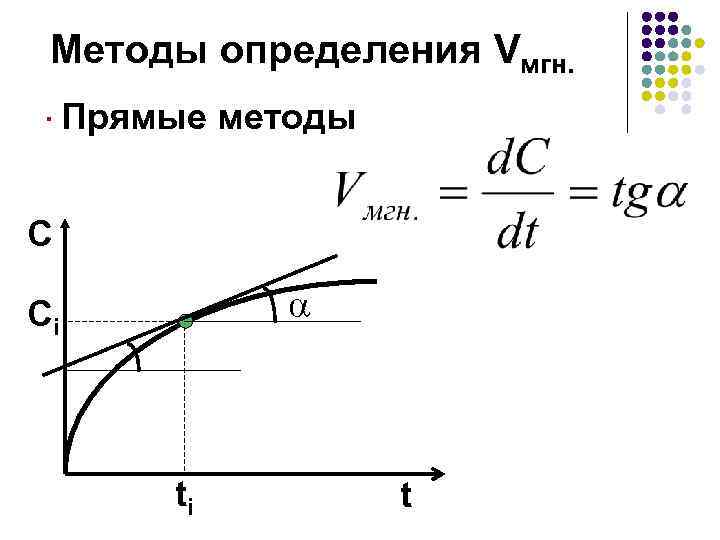 Методы определения Vмгн. ·Прямые методы C Ci ti t
Методы определения Vмгн. ·Прямые методы C Ci ti t
 ·Косвенные методы Изменение параметров системы: ·Вязкости раствора ·Электропроводности раствора ·Оптической плотности раствора ·р. Н раствора и др.
·Косвенные методы Изменение параметров системы: ·Вязкости раствора ·Электропроводности раствора ·Оптической плотности раствора ·р. Н раствора и др.
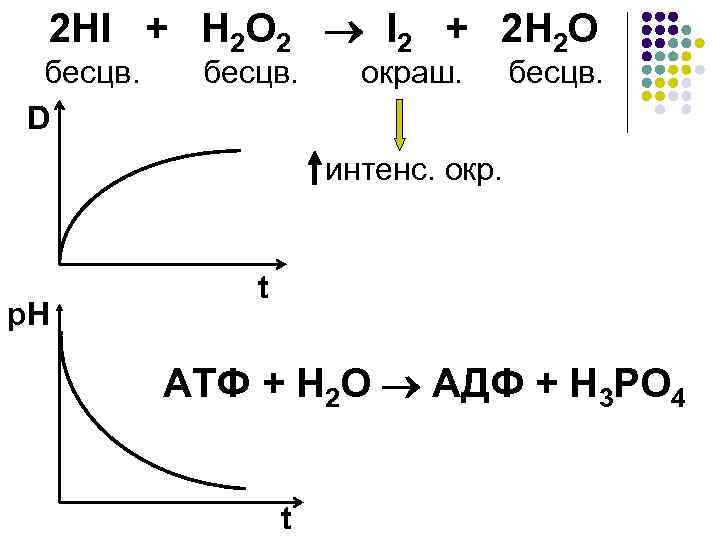 2 HI + H 2 O 2 I 2 + 2 H 2 O бесцв. окраш. бесцв. D интенс. окр. p. H t АТФ + Н 2 О АДФ + Н 3 РО 4 t
2 HI + H 2 O 2 I 2 + 2 H 2 O бесцв. окраш. бесцв. D интенс. окр. p. H t АТФ + Н 2 О АДФ + Н 3 РО 4 t
 Факторы, влияющие на скорость химической реакции • природа реагирующих веществ ·температура ·концентрация реагирующих веществ • давление • степень измельчения реагирующих веществ · Kat
Факторы, влияющие на скорость химической реакции • природа реагирующих веществ ·температура ·концентрация реагирующих веществ • давление • степень измельчения реагирующих веществ · Kat
 Зависимость скорости реакции от концентрации реагирующих веществ Основной постулат химической кинетики - А + В С + Д - кинетическое уравнение - малые числа
Зависимость скорости реакции от концентрации реагирующих веществ Основной постулат химической кинетики - А + В С + Д - кинетическое уравнение - малые числа
![Анализ кинетического уравнения коэффициент пропорциональности; константа скорости реакции ·Физический смысл k при [A] = Анализ кинетического уравнения коэффициент пропорциональности; константа скорости реакции ·Физический смысл k при [A] =](https://present5.com/presentation/-29906771_15817115/image-17.jpg) Анализ кинетического уравнения коэффициент пропорциональности; константа скорости реакции ·Физический смысл k при [A] = [B] = 1 K – удельная скорость реакции
Анализ кинетического уравнения коэффициент пропорциональности; константа скорости реакции ·Физический смысл k при [A] = [B] = 1 K – удельная скорость реакции
 ·Химический смысл K К не зав. от конц. и хар. влияние на скор. х. р. природы реаг. в-в K – количественная мера реакционной способности молекул Чем ↑K, тем↑ эффективность взаимодействия молекул m - порядок реакции по веществу А; n - порядок реакции по веществу В. m + n – общий порядок реакции
·Химический смысл K К не зав. от конц. и хар. влияние на скор. х. р. природы реаг. в-в K – количественная мера реакционной способности молекул Чем ↑K, тем↑ эффективность взаимодействия молекул m - порядок реакции по веществу А; n - порядок реакции по веществу В. m + n – общий порядок реакции
 Для простых реакций показатели степеней в кинетическом уравнении предст. собой стехиом. коэфф. NO 2 + NO 2 N 2 O 4 Закон действующих масс, норв. уч. К. Гульдберг и П. Вааге, 1867 год (частн. сл. осн. постулата)
Для простых реакций показатели степеней в кинетическом уравнении предст. собой стехиом. коэфф. NO 2 + NO 2 N 2 O 4 Закон действующих масс, норв. уч. К. Гульдберг и П. Вааге, 1867 год (частн. сл. осн. постулата)
![Определение порядка сложных реакций А + В С + Д Большой избыток [A] V Определение порядка сложных реакций А + В С + Д Большой избыток [A] V](https://present5.com/presentation/-29906771_15817115/image-20.jpg) Определение порядка сложных реакций А + В С + Д Большой избыток [A] V 2[A] 4 V m = 2 3[A] 9 V 4[A] 16 V
Определение порядка сложных реакций А + В С + Д Большой избыток [A] V 2[A] 4 V m = 2 3[A] 9 V 4[A] 16 V
![А + В С + Д [В] V 2[В] 2 V n = 1 А + В С + Д [В] V 2[В] 2 V n = 1](https://present5.com/presentation/-29906771_15817115/image-21.jpg) А + В С + Д [В] V 2[В] 2 V n = 1 3[В] 3 V 4[В] 4 V Общий порядок реакции равен 3
А + В С + Д [В] V 2[В] 2 V n = 1 3[В] 3 V 4[В] 4 V Общий порядок реакции равен 3
 Классификация реакций по порядку нулевой порядок: V = const Примеры: . Р-ции разложения некоторых в-в на тв. пов-сти . Фотохимические р-ции
Классификация реакций по порядку нулевой порядок: V = const Примеры: . Р-ции разложения некоторых в-в на тв. пов-сти . Фотохимические р-ции
 первый порядок: V зав. от конц. одного комп. Примеры: . 2 N 2 O 5 4 NO 2 + O 2 1 стадия: N 2 O 5 N 2 O 3 + O 2 V 1 ст. << V 2 ст. Лимитирующая стадия 2 стадия: N 2 O 5 + N 2 O 3 4 NO 2
первый порядок: V зав. от конц. одного комп. Примеры: . 2 N 2 O 5 4 NO 2 + O 2 1 стадия: N 2 O 5 N 2 O 3 + O 2 V 1 ст. << V 2 ст. Лимитирующая стадия 2 стадия: N 2 O 5 + N 2 O 3 4 NO 2
 . Гидролиз сахарозы С 12 Н 22 О 11 + Н 2 Оизбыток С 6 Н 12 О 6 + С 6 Н 12 О 6 Тростниковый сахар глюкоза фруктоза [Н 2 О] = const . Радиоактивный распад ядер атомов
. Гидролиз сахарозы С 12 Н 22 О 11 + Н 2 Оизбыток С 6 Н 12 О 6 + С 6 Н 12 О 6 Тростниковый сахар глюкоза фруктоза [Н 2 О] = const . Радиоактивный распад ядер атомов
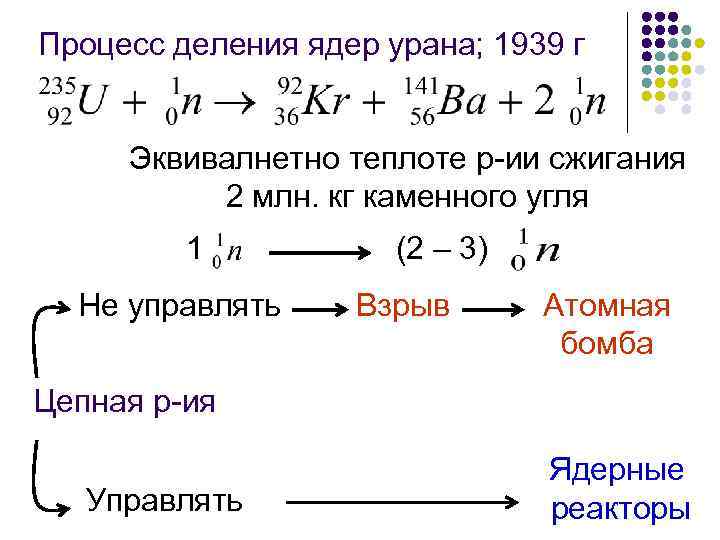 Процесс деления ядер урана; 1939 г Эквивалнетно теплоте р-ии сжигания 2 млн. кг каменного угля 1 Не управлять (2 – 3) Взрыв Атомная бомба Цепная р-ия Управлять Ядерные реакторы
Процесс деления ядер урана; 1939 г Эквивалнетно теплоте р-ии сжигания 2 млн. кг каменного угля 1 Не управлять (2 – 3) Взрыв Атомная бомба Цепная р-ия Управлять Ядерные реакторы
 второй порядок: Примеры: . 2 NO 2 N 2 O 4 . 2 NOCl 2 NO + Cl 2
второй порядок: Примеры: . 2 NO 2 N 2 O 4 . 2 NOCl 2 NO + Cl 2
 Сравнивать между собой реакции разного порядка можно по скорости (одинаковая размерность). Сравнивать между собой k можно для реакций одинакового порядка.
Сравнивать между собой реакции разного порядка можно по скорости (одинаковая размерность). Сравнивать между собой k можно для реакций одинакового порядка.
 Период полупревращения (τ1/2) Для реакций нулевого порядка: Для реакций первого порядка: Для реакций второго порядка :
Период полупревращения (τ1/2) Для реакций нулевого порядка: Для реакций первого порядка: Для реакций второго порядка :
 Нулевой порядок:
Нулевой порядок:
 Молекулярность реакции Молекулярность – min… Классификация реакций: 1. Мономолекулярные: I 2 = 2 I CH 3 NH 2 HCN + 2 H 2 2. Бимолекулярные: NO 2 + NO 2 N 2 O 4 СН 3 СООН+С 2 Н 5 ОН СН 3 СООС 2 Н 5+Н 2 О 3. Тримолекулярные: 2 NO + H 2 N 2 O + Н 2 О
Молекулярность реакции Молекулярность – min… Классификация реакций: 1. Мономолекулярные: I 2 = 2 I CH 3 NH 2 HCN + 2 H 2 2. Бимолекулярные: NO 2 + NO 2 N 2 O 4 СН 3 СООН+С 2 Н 5 ОН СН 3 СООС 2 Н 5+Н 2 О 3. Тримолекулярные: 2 NO + H 2 N 2 O + Н 2 О
 Mn. O 4 + - + 8 H + 5 e 2+ + Mn 4 H 2 O Cr 2 O 72 - +14 H+ + 6 e 2 Cr 3+ +2 H 2 O
Mn. O 4 + - + 8 H + 5 e 2+ + Mn 4 H 2 O Cr 2 O 72 - +14 H+ + 6 e 2 Cr 3+ +2 H 2 O
 Для простых реакций: порядок = молекулярности 2 NO 2 N 2 O 4 Молекулярность – 2 Порядок - 2 Для сложных реакций: порядок ≠ молекулярности
Для простых реакций: порядок = молекулярности 2 NO 2 N 2 O 4 Молекулярность – 2 Порядок - 2 Для сложных реакций: порядок ≠ молекулярности
 2 HI + H 2 O 2 I 2 + 2 H 2 O Кажущаяся молекулярность - 3; порядок (экспер. ) - 2 а) HI + H 2 O 2 HIО + H 2 O медленно молекулярность 2; порядок 2 лимитирующая стадия б) HI + HIО I 2 + H 2 O быстро Порядок сложной реакции определяется порядком лимитирующей стадии
2 HI + H 2 O 2 I 2 + 2 H 2 O Кажущаяся молекулярность - 3; порядок (экспер. ) - 2 а) HI + H 2 O 2 HIО + H 2 O медленно молекулярность 2; порядок 2 лимитирующая стадия б) HI + HIО I 2 + H 2 O быстро Порядок сложной реакции определяется порядком лимитирующей стадии
 Порядок реакции ·величина формальная ·принимает любые значения ·для любых реакций как сложных, так и простых
Порядок реакции ·величина формальная ·принимает любые значения ·для любых реакций как сложных, так и простых
 Молекулярность реакции ·имеет определенный физический смысл ·значения молекулярности ограничены цифрами – 1, 2, 3 ·это понятие применимо к элементарным актам химических превращений
Молекулярность реакции ·имеет определенный физический смысл ·значения молекулярности ограничены цифрами – 1, 2, 3 ·это понятие применимо к элементарным актам химических превращений
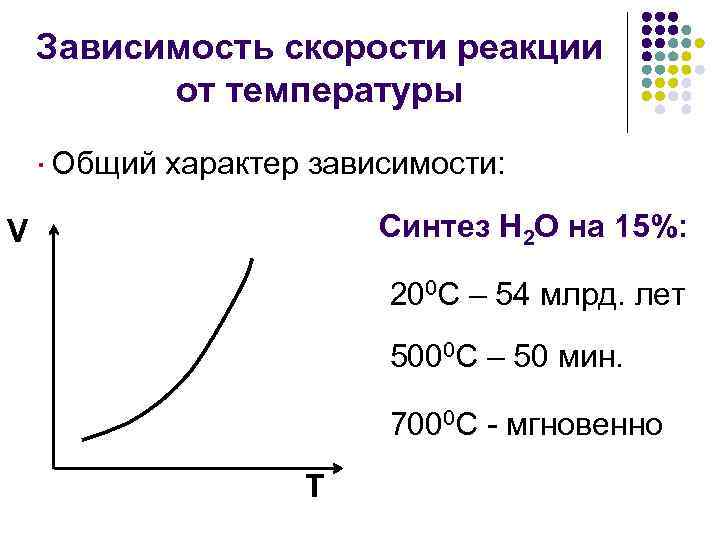 Зависимость скорости реакции от температуры ·Общий характер зависимости: Синтез Н 2 О на 15%: V 200 С – 54 млрд. лет 5000 С – 50 мин. 7000 С - мгновенно Т
Зависимость скорости реакции от температуры ·Общий характер зависимости: Синтез Н 2 О на 15%: V 200 С – 54 млрд. лет 5000 С – 50 мин. 7000 С - мгновенно Т
 ·Количественный характер зависимости, Вант–Гофф, голл. 1884 год Правило Вант–Гоффа: = 2 4
·Количественный характер зависимости, Вант–Гофф, голл. 1884 год Правило Вант–Гоффа: = 2 4
 Т ↑ на ∆Т Пример: ∆Т = 50; = 2 V в 32 раза
Т ↑ на ∆Т Пример: ∆Т = 50; = 2 V в 32 раза
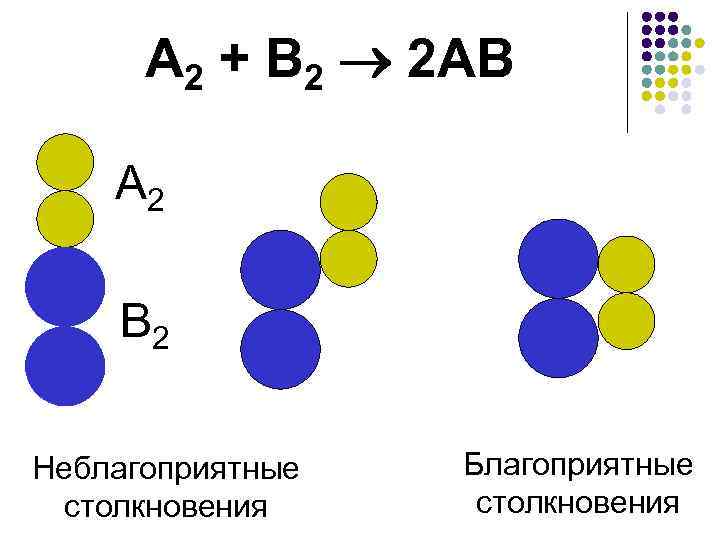
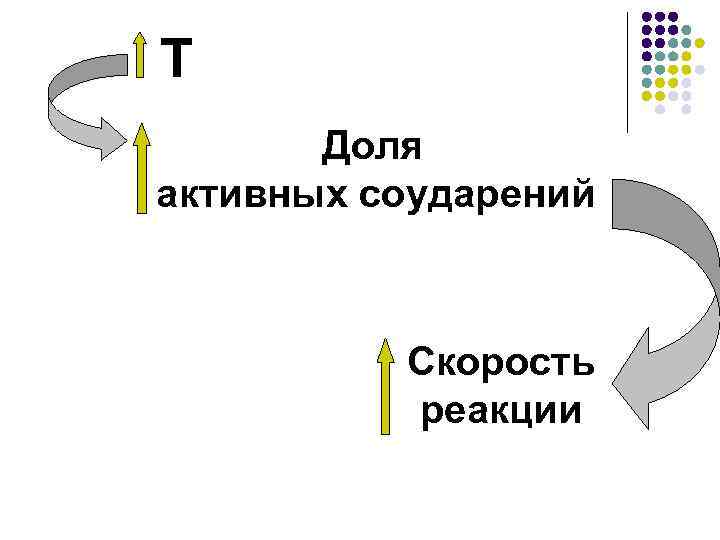
 Теория активных соударений (ТАС), С. Аррениус, 1889 год Основные положения теории: ·соударение молекул исходных веществ; ·активное соударение; ·энергетический барьер; Воздух: 78% N 2; 21% О 2 • стерический фактор N 2 + O 2 ≠
Теория активных соударений (ТАС), С. Аррениус, 1889 год Основные положения теории: ·соударение молекул исходных веществ; ·активное соударение; ·энергетический барьер; Воздух: 78% N 2; 21% О 2 • стерический фактор N 2 + O 2 ≠
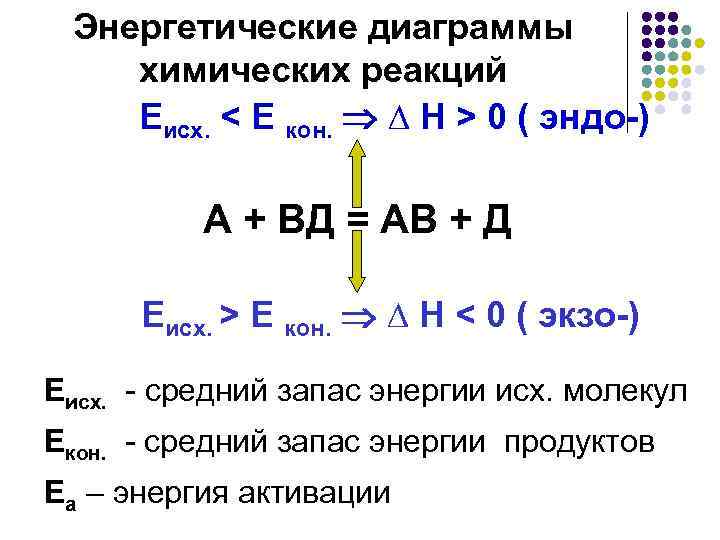 Энергетические диаграммы химических реакций Еисх. < Е кон. ∆ H > 0 ( эндо-) А + ВД = АВ + Д Еисх. > Е кон. ∆ H < 0 ( экзо-) Еисх. - средний запас энергии исх. молекул Екон. - средний запас энергии продуктов Еа – энергия активации
Энергетические диаграммы химических реакций Еисх. < Е кон. ∆ H > 0 ( эндо-) А + ВД = АВ + Д Еисх. > Е кон. ∆ H < 0 ( экзо-) Еисх. - средний запас энергии исх. молекул Екон. - средний запас энергии продуктов Еа – энергия активации
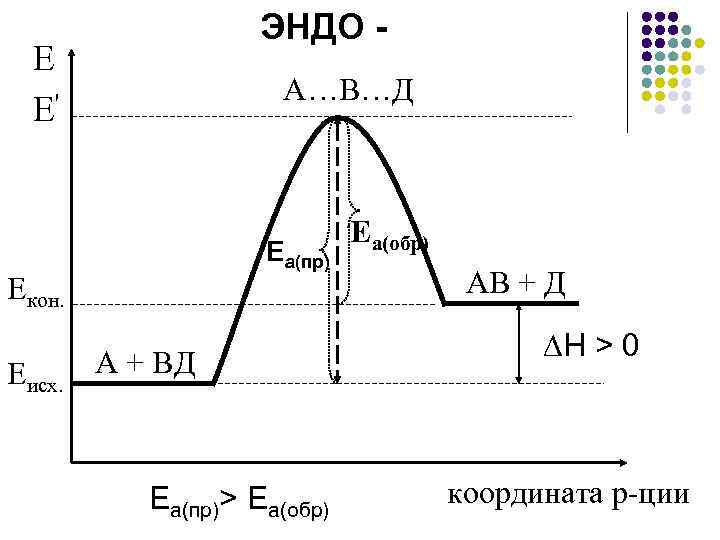 ЭНДО - Е Е' А…В…Д Еа(пр) Eкон. Еисх. А + ВД Еа(пр)> Еа(обр) Ea(обр) АВ + Д ∆Н > 0 координата р-ции
ЭНДО - Е Е' А…В…Д Еа(пр) Eкон. Еисх. А + ВД Еа(пр)> Еа(обр) Ea(обр) АВ + Д ∆Н > 0 координата р-ции
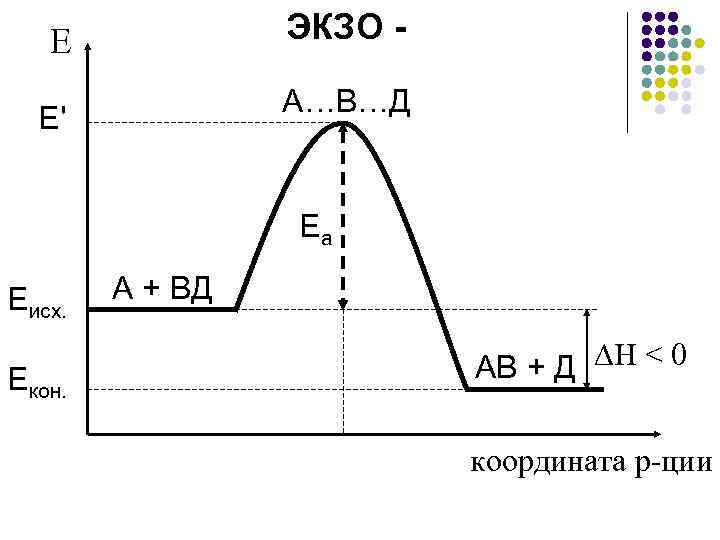 ЭКЗО - Е А…В…Д Е' Еа Еисх. Екон. А + ВД АВ + Д ∆H < 0 координата р-ции
ЭКЗО - Е А…В…Д Е' Еа Еисх. Екон. А + ВД АВ + Д ∆H < 0 координата р-ции
 По Аррениусу: – доля активных соударений ℯТ – R -
По Аррениусу: – доля активных соударений ℯТ – R -
 Согласно ТАС: А – предэкспоненциальный множитель… - экспоненциальный множитель… Например, А = 100000; =0, 1, тогда к = 10000 k – число активных соударений; количественная мера реакционной способности молекул Еа ↓, α↑, V↑ T↑, α↑, V↑
Согласно ТАС: А – предэкспоненциальный множитель… - экспоненциальный множитель… Например, А = 100000; =0, 1, тогда к = 10000 k – число активных соударений; количественная мера реакционной способности молекул Еа ↓, α↑, V↑ T↑, α↑, V↑
 А 2 + В 2 2 АВ А 2 В 2 Неблагоприятные столкновения Благоприятные столкновения
А 2 + В 2 2 АВ А 2 В 2 Неблагоприятные столкновения Благоприятные столкновения
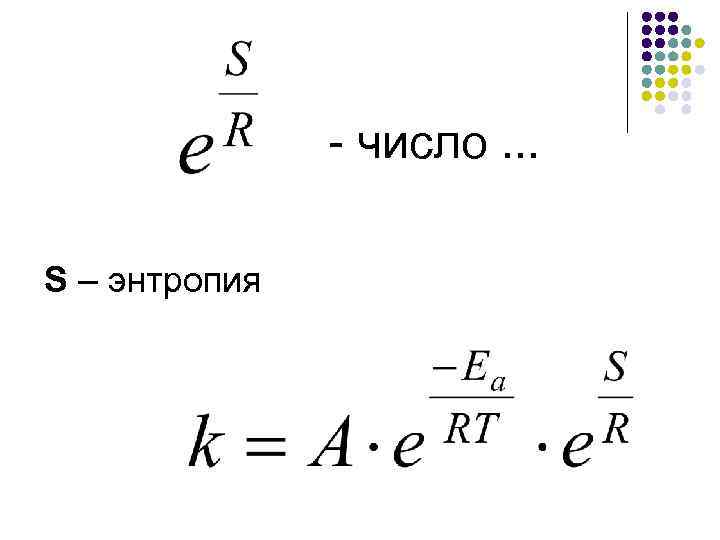 - число. . . S – энтропия
- число. . . S – энтропия
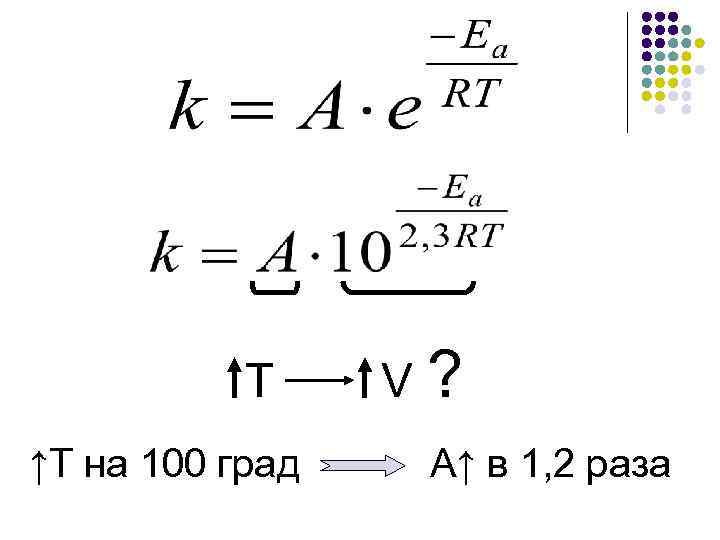 T V ? ↑T на 100 град А↑ в 1, 2 раза
T V ? ↑T на 100 град А↑ в 1, 2 раза
 Влияние Т на экспоненциальный множитель: Еа =100 к. Дж/моль, Т= 300 К Еа =100 к. Дж/моль, Т= 400 К
Влияние Т на экспоненциальный множитель: Еа =100 к. Дж/моль, Т= 300 К Еа =100 к. Дж/моль, Т= 400 К
 Т Доля активных соударений Скорость реакции
Т Доля активных соударений Скорость реакции
 Еа =200 к. Дж/моль, Т= 300 К Еа =200 к. Дж/моль Т= 400 К Вывод: чем > Еа, тем > влияние Т на V
Еа =200 к. Дж/моль, Т= 300 К Еа =200 к. Дж/моль Т= 400 К Вывод: чем > Еа, тем > влияние Т на V
 Графический метод определения энергии активации
Графический метод определения энергии активации
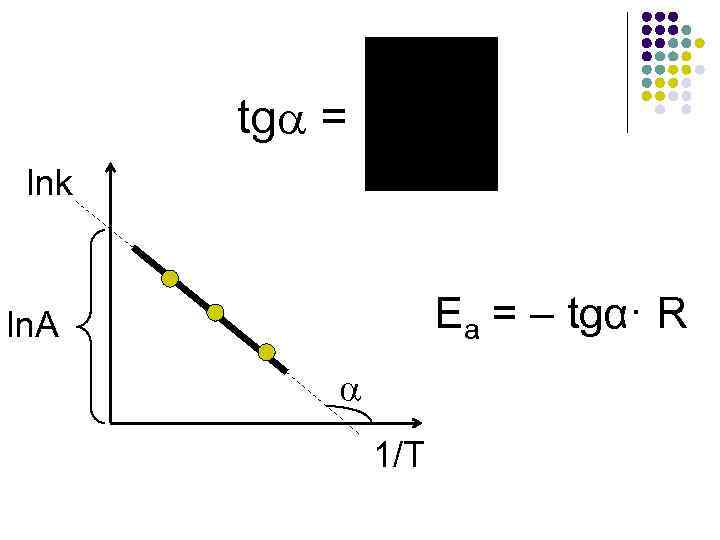 tg = lnk Ea = – tgα· R ln. A 1/T
tg = lnk Ea = – tgα· R ln. A 1/T
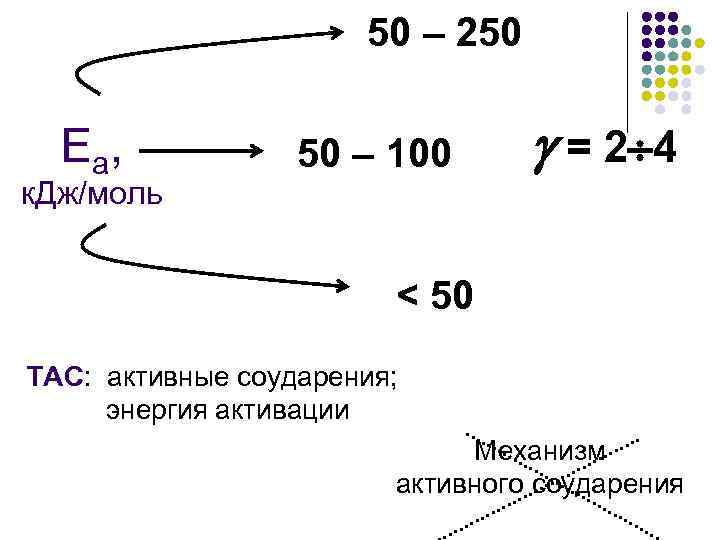 50 – 250 Е а, к. Дж/моль 50 – 100 = 2 4 < 50 ТАС: активные соударения; энергия активации Механизм активного соударения
50 – 250 Е а, к. Дж/моль 50 – 100 = 2 4 < 50 ТАС: активные соударения; энергия активации Механизм активного соударения
 Теория переходного комплекса (активированного состояния) ТПК Г. Эйринг, М. Поляни и др. 1935 г. А + В ↔ С + Д * С + Д А + В ↔ Х Х* – переходный комплекс (ПК)
Теория переходного комплекса (активированного состояния) ТПК Г. Эйринг, М. Поляни и др. 1935 г. А + В ↔ С + Д * С + Д А + В ↔ Х Х* – переходный комплекс (ПК)
 ПК: • перераспределение связей • утрата индивидуальности • изменение расстояний между атомами • физически регистрируемое состояние • время жизни 10 -12 с Не путать ПК и ПС! ПС устойчиво; способно к самост. существ.
ПК: • перераспределение связей • утрата индивидуальности • изменение расстояний между атомами • физически регистрируемое состояние • время жизни 10 -12 с Не путать ПК и ПС! ПС устойчиво; способно к самост. существ.
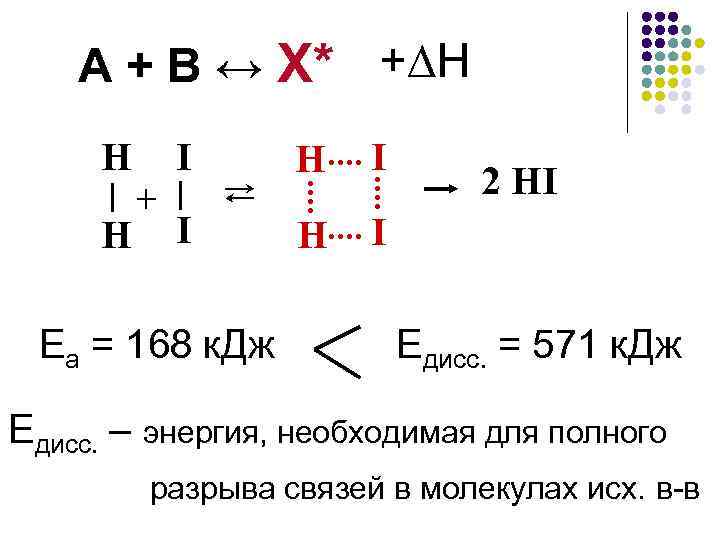 А + В ↔ Х* + H Н Н + I I ⇄ Еа = 168 к. Дж Н I 2 HI Едисс. = 571 к. Дж Едисс. – энергия, необходимая для полного разрыва связей в молекулах исх. в-в
А + В ↔ Х* + H Н Н + I I ⇄ Еа = 168 к. Дж Н I 2 HI Едисс. = 571 к. Дж Едисс. – энергия, необходимая для полного разрыва связей в молекулах исх. в-в
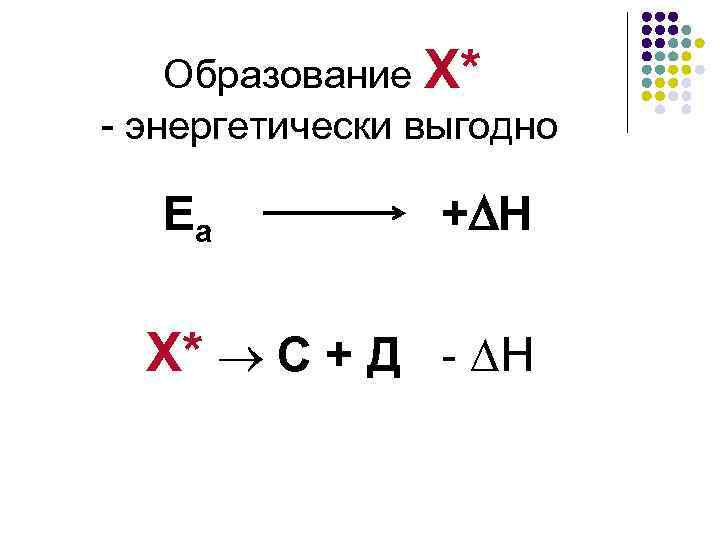 Образование Х* - энергетически выгодно Е а + H Х* С + Д - H
Образование Х* - энергетически выгодно Е а + H Х* С + Д - H
 Основной постулат: А + В ↔ Х* С + Д Распад ПК Р - частота распада
Основной постулат: А + В ↔ Х* С + Д Распад ПК Р - частота распада
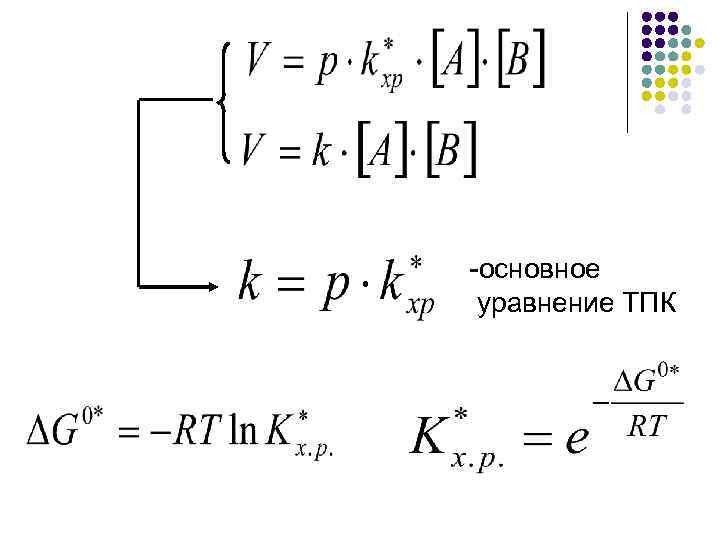 -основное уравнение ТПК
-основное уравнение ТПК
 ТПК ТАС и ТПК – основа химической кинетики
ТПК ТАС и ТПК – основа химической кинетики
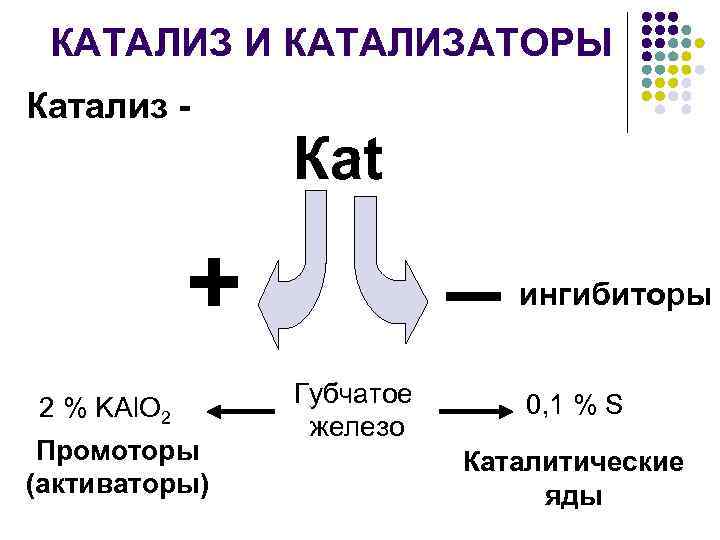 КАТАЛИЗ И КАТАЛИЗАТОРЫ Катализ - Каt _ + 2 % KAl. O 2 Промоторы (активаторы) Губчатое железо ингибиторы 0, 1 % S Каталитические яды
КАТАЛИЗ И КАТАЛИЗАТОРЫ Катализ - Каt _ + 2 % KAl. O 2 Промоторы (активаторы) Губчатое железо ингибиторы 0, 1 % S Каталитические яды
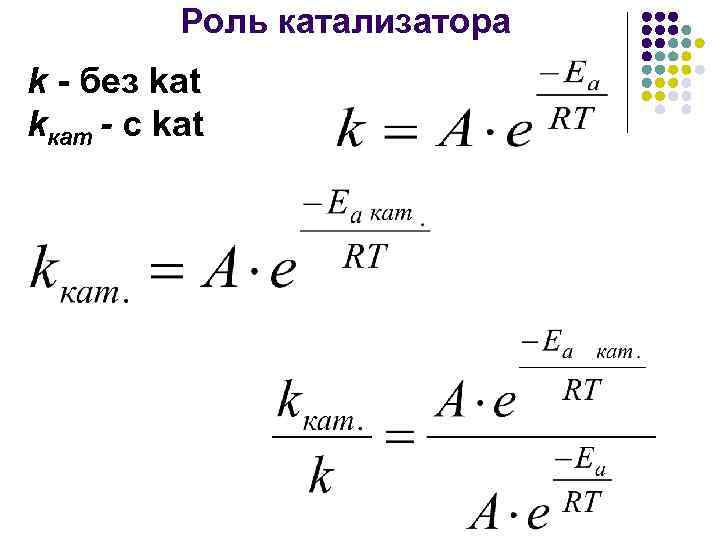 Роль катализатора k - без kat kкaт - с kat
Роль катализатора k - без kat kкaт - с kat
 + Каt Е а ↓ - Каt Еа ↑
+ Каt Е а ↓ - Каt Еа ↑
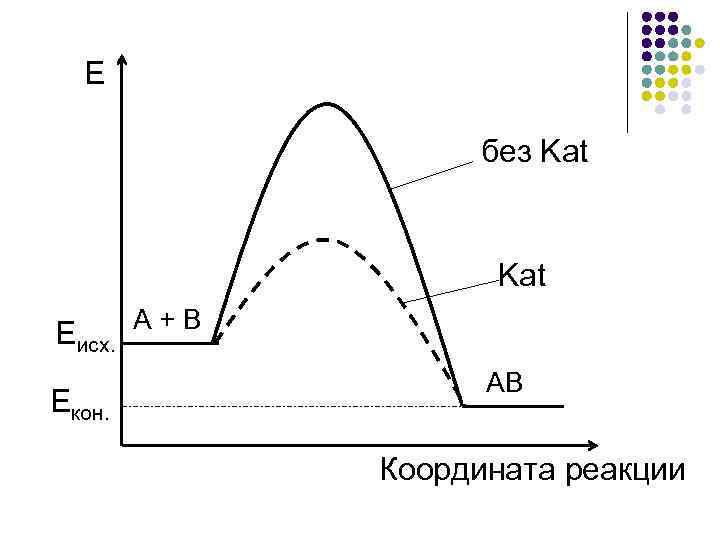 Е без Kat Еисх. Екон. А + В АВ Координата реакции
Е без Kat Еисх. Екон. А + В АВ Координата реакции
 Энергетическая диаграмма действия катализатора А + В АВ ∆Н < 0 + Каt 1 стадия А + К АК 2 стадия АК + В АВ + К АК – промежуточное (устойчивое) соединение, в отличие от ПК
Энергетическая диаграмма действия катализатора А + В АВ ∆Н < 0 + Каt 1 стадия А + К АК 2 стадия АК + В АВ + К АК – промежуточное (устойчивое) соединение, в отличие от ПК
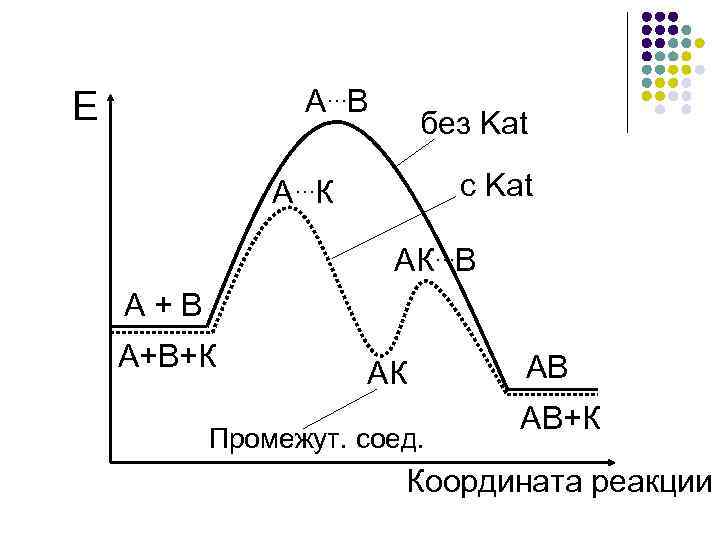 А…В Е без Kat с Kat А…К АК…В А + В А+В+К АК Промежут. соед. АВ АВ+К Координата реакции
А…В Е без Kat с Kat А…К АК…В А + В А+В+К АК Промежут. соед. АВ АВ+К Координата реакции
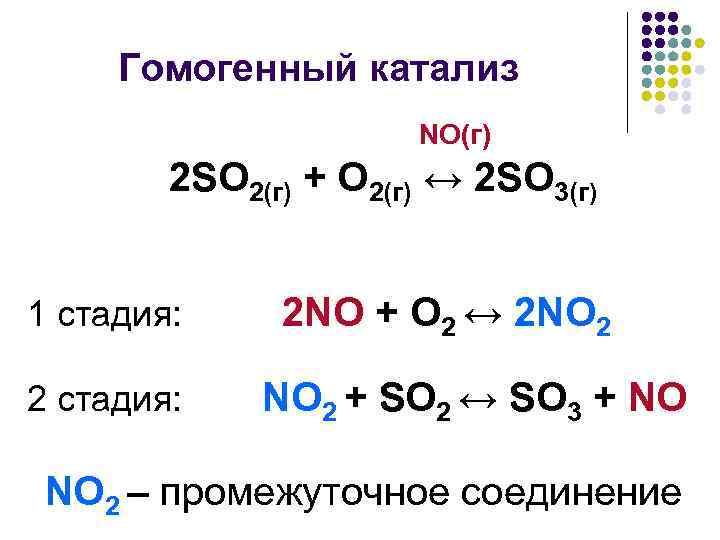 Гомогенный катализ NO(г) 2 SO 2(г) + O 2(г) ↔ 2 SO 3(г) 1 стадия: 2 NO + O 2 ↔ 2 NO 2 2 стадия: NO 2 + SO 2 ↔ SO 3 + NO NO 2 – промежуточное соединение
Гомогенный катализ NO(г) 2 SO 2(г) + O 2(г) ↔ 2 SO 3(г) 1 стадия: 2 NO + O 2 ↔ 2 NO 2 2 стадия: NO 2 + SO 2 ↔ SO 3 + NO NO 2 – промежуточное соединение
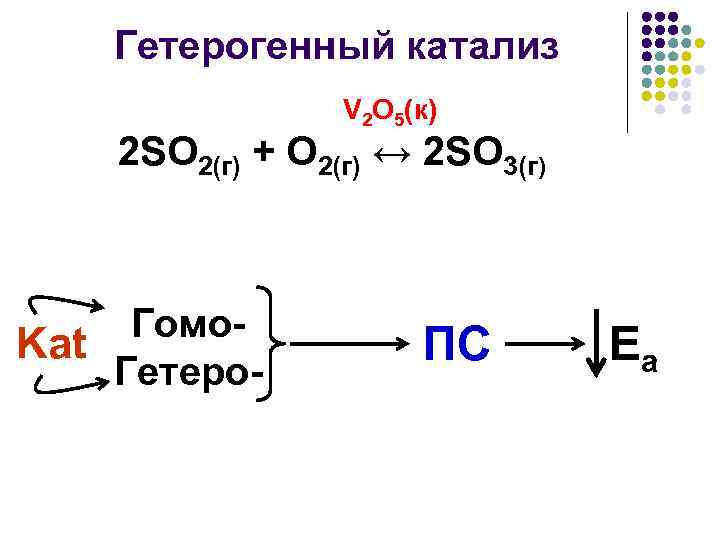 Гетерогенный катализ V 2 O 5(к) 2 SO 2(г) + O 2(г) ↔ 2 SO 3(г) Гомо. Kat Гетеро- ПС Еа
Гетерогенный катализ V 2 O 5(к) 2 SO 2(г) + O 2(г) ↔ 2 SO 3(г) Гомо. Kat Гетеро- ПС Еа
 Теория активных центров (АЦ) Тейлор Г. , 1925 г. 1. Адсорбция мол. исх. в-в и образов. ПС на АЦ (~0, 1% пов-сти) 2. Ослабл. связей между атомами адс. молекул 3. Число и характер распол. АЦ и их соответствие стр-ре исх. молекул.
Теория активных центров (АЦ) Тейлор Г. , 1925 г. 1. Адсорбция мол. исх. в-в и образов. ПС на АЦ (~0, 1% пов-сти) 2. Ослабл. связей между атомами адс. молекул 3. Число и характер распол. АЦ и их соответствие стр-ре исх. молекул.
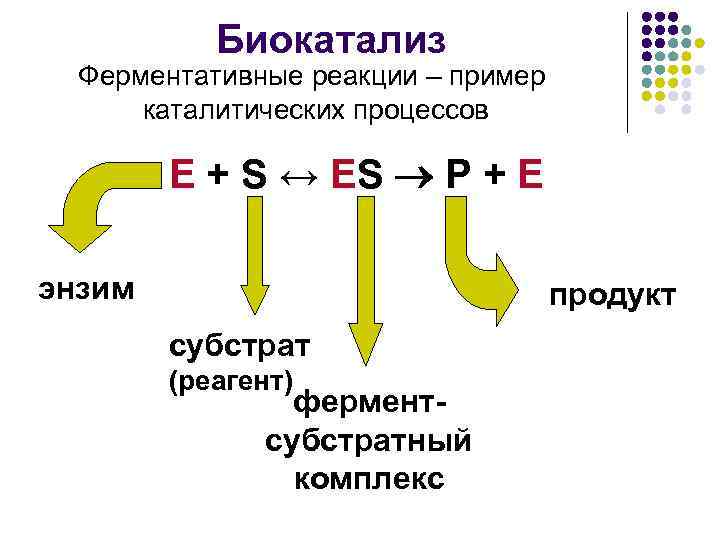 Биокатализ Ферментативные реакции – пример каталитических процессов E + S ↔ ES P + E энзим продукт субстрат (реагент) ферментсубстратный комплекс
Биокатализ Ферментативные реакции – пример каталитических процессов E + S ↔ ES P + E энзим продукт субстрат (реагент) ферментсубстратный комплекс
 V f(Cферм. ; Ссубстр. ) Сферм. ↑; V ↑ Cсубстр. ↑; кинетич. кр. с 3 -мя уч. V I -1 пор. III II II - опр. экспер. III - нулевой пор. I S
V f(Cферм. ; Ссубстр. ) Сферм. ↑; V ↑ Cсубстр. ↑; кинетич. кр. с 3 -мя уч. V I -1 пор. III II II - опр. экспер. III - нулевой пор. I S
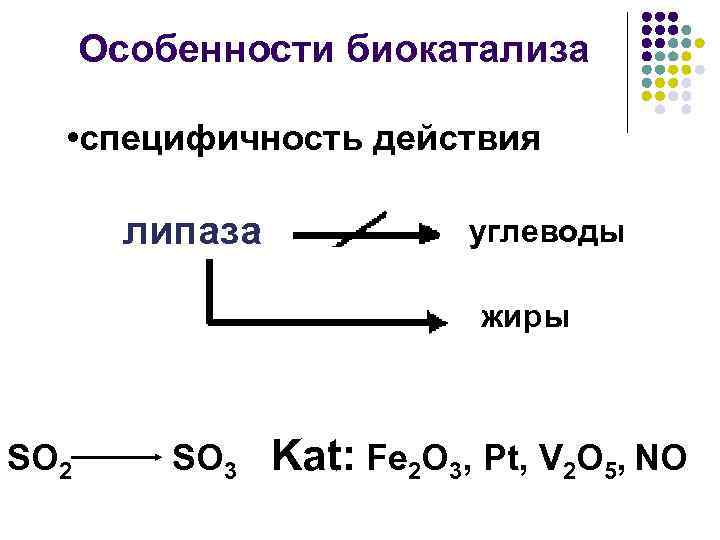 Особенности биокатализа • специфичность действия липаза углеводы жиры SO 2 SO 3 Kat: Fe 2 O 3, Pt, V 2 O 5, NO
Особенности биокатализа • специфичность действия липаза углеводы жиры SO 2 SO 3 Kat: Fe 2 O 3, Pt, V 2 O 5, NO
 • высокая каталитическая активность 1 – ый пример Гидролиз мочевины ∆G < 0 Вода К = 7, 4 · 10 -7 Еа = 100 к. Дж/моль Уреаза К = 5 · 106 Еа = 30 к. Дж/моль n = 1013 раз
• высокая каталитическая активность 1 – ый пример Гидролиз мочевины ∆G < 0 Вода К = 7, 4 · 10 -7 Еа = 100 к. Дж/моль Уреаза К = 5 · 106 Еа = 30 к. Дж/моль n = 1013 раз
 2 – й пример 2 Н 2 О 2 2 Н 2 О + О 2 Еа = 75 к. Дж/моль Каt - Pt Ea = 48 к. Дж/моль V ↑ в 20 000 раз Фермент каталаза Ea = 23 к. Дж/моль V ↑ в 3· 1011 раз 1 молекула фермента каталазы в течение 1 с способна расщеплять 100 тыс. молекул Н 2 О 2 Pt в 1000 раз менее эффективна, чем каталаза
2 – й пример 2 Н 2 О 2 2 Н 2 О + О 2 Еа = 75 к. Дж/моль Каt - Pt Ea = 48 к. Дж/моль V ↑ в 20 000 раз Фермент каталаза Ea = 23 к. Дж/моль V ↑ в 3· 1011 раз 1 молекула фермента каталазы в течение 1 с способна расщеплять 100 тыс. молекул Н 2 О 2 Pt в 1000 раз менее эффективна, чем каталаза
 • условия работы: Т = 37 – 400 С Р ≈ 1 атм узкий интервал зн-ий р. Н Примеры: Фермент субстрат р. Н Уреаза мочевина 6, 7 Пепсин белок 1. 5 – 2. 0
• условия работы: Т = 37 – 400 С Р ≈ 1 атм узкий интервал зн-ий р. Н Примеры: Фермент субстрат р. Н Уреаза мочевина 6, 7 Пепсин белок 1. 5 – 2. 0
 Особенности кинетики гетерогенных реакций СО 2(г) + С(к) 2 СО(г) . V = k′ [CO 2][C] = const = k″ V = k′ k″[CO 2] = k [CO 2] . Степень дисперсности Пирофорные свойства металлов: Fe, Co, Ni; диаметром около 5 мкм . Скорость диффузии
Особенности кинетики гетерогенных реакций СО 2(г) + С(к) 2 СО(г) . V = k′ [CO 2][C] = const = k″ V = k′ k″[CO 2] = k [CO 2] . Степень дисперсности Пирофорные свойства металлов: Fe, Co, Ni; диаметром около 5 мкм . Скорость диффузии
 Сложные реакции Параллельные Последовательные Сопряжённые Обратимые Свободнорадикальные (цепные) Фотохимические
Сложные реакции Параллельные Последовательные Сопряжённые Обратимые Свободнорадикальные (цепные) Фотохимические
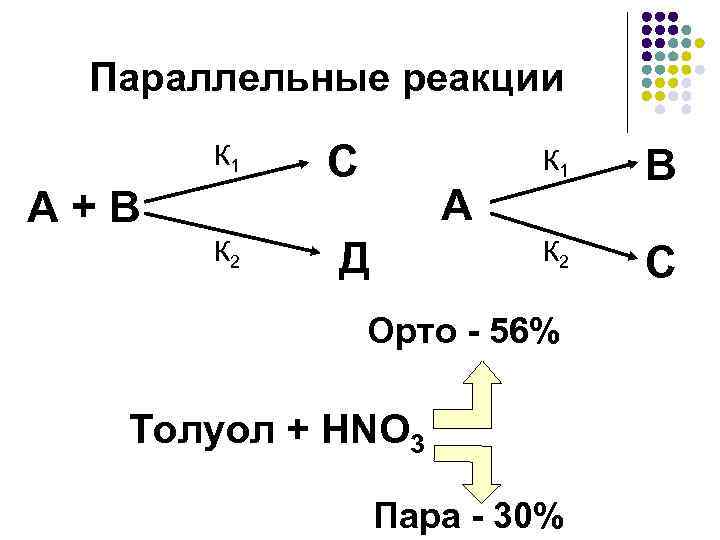 Параллельные реакции К 1 А + В К 2 С Д В К 2 А К 1 С Орто - 56% Толуол + HNO 3 Пара - 30%
Параллельные реакции К 1 А + В К 2 С Д В К 2 А К 1 С Орто - 56% Толуол + HNO 3 Пара - 30%
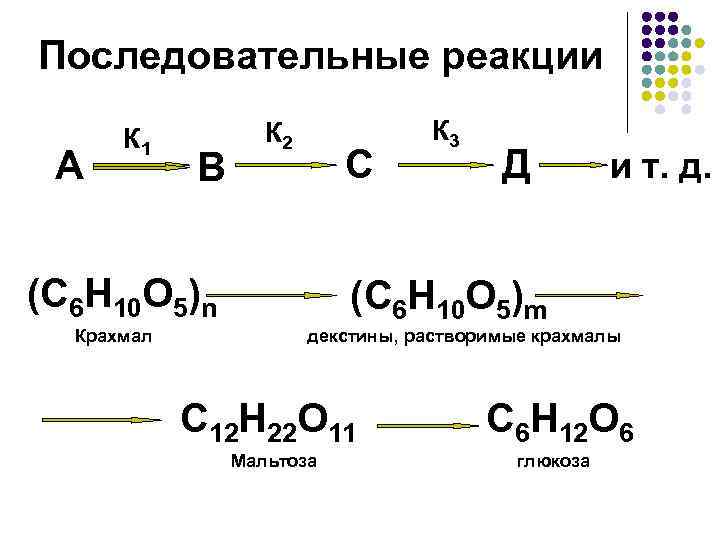 Последовательные реакции А К 1 В (С 6 Н 10 О 5)n К 2 С К 3 Д и т. д. (С 6 Н 10 О 5)m Крахмал декстины, растворимые крахмалы C 12 H 22 O 11 C 6 H 12 O 6 Мальтоза глюкоза
Последовательные реакции А К 1 В (С 6 Н 10 О 5)n К 2 С К 3 Д и т. д. (С 6 Н 10 О 5)m Крахмал декстины, растворимые крахмалы C 12 H 22 O 11 C 6 H 12 O 6 Мальтоза глюкоза
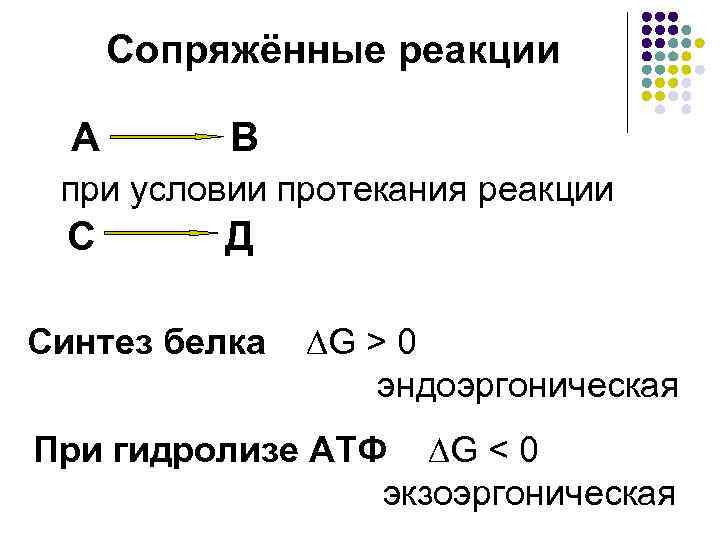 Сопряжённые реакции А В при условии протекания реакции С Д Синтез белка ∆G > 0 эндоэргоническая При гидролизе АТФ ∆G < 0 экзоэргоническая
Сопряжённые реакции А В при условии протекания реакции С Д Синтез белка ∆G > 0 эндоэргоническая При гидролизе АТФ ∆G < 0 экзоэргоническая
 Обратимые реакции К 1 А К 2 В
Обратимые реакции К 1 А К 2 В
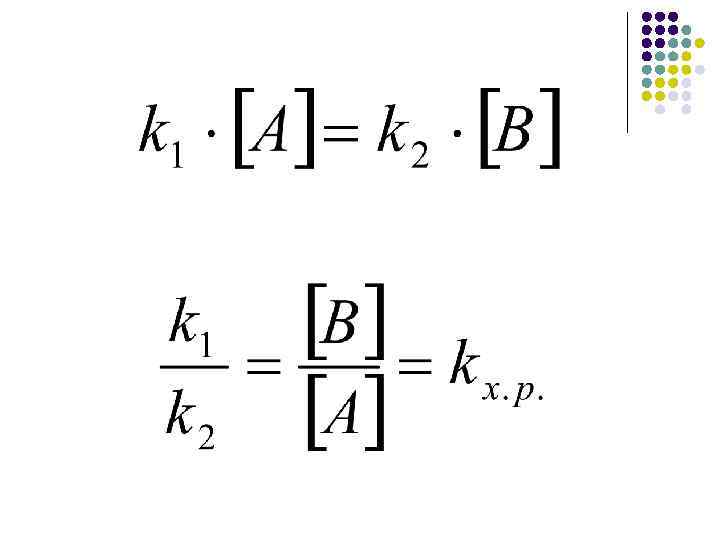
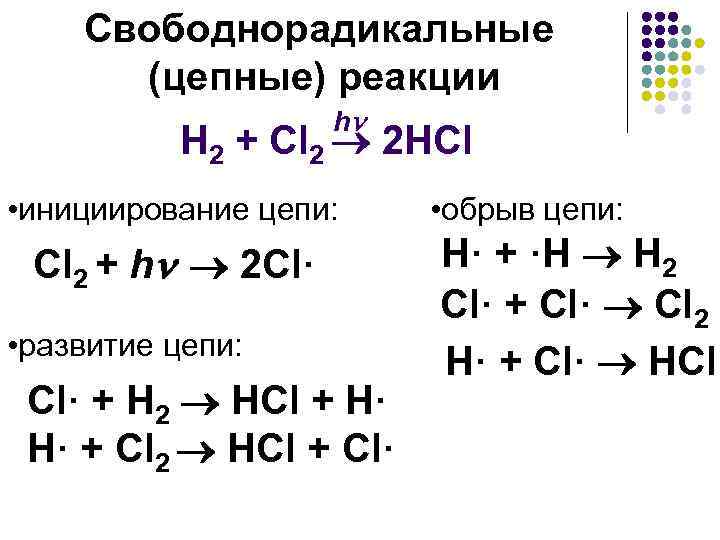 Свободнорадикальные (цепные) реакции h H 2 + Cl 2 2 HCl • инициирование цепи: Cl 2 + h 2 Сl· • развитие цепи: Сl· + Н 2 HCl + H· H· + Cl 2 HCl + Cl· • обрыв цепи: Н· + ·Н Н 2 Cl· + Cl· Cl 2 H· + Cl· HCl
Свободнорадикальные (цепные) реакции h H 2 + Cl 2 2 HCl • инициирование цепи: Cl 2 + h 2 Сl· • развитие цепи: Сl· + Н 2 HCl + H· H· + Cl 2 HCl + Cl· • обрыв цепи: Н· + ·Н Н 2 Cl· + Cl· Cl 2 H· + Cl· HCl
 Фотохимические реакции Kat хлорофилл 6 СО 2 + 6 Н 2 О + n h С 6 Н 12 О 6 + 6 О 2 - квантовый выход >> 1 цепной механизм H 2 + Cl 2 = 2 HCl = 105
Фотохимические реакции Kat хлорофилл 6 СО 2 + 6 Н 2 О + n h С 6 Н 12 О 6 + 6 О 2 - квантовый выход >> 1 цепной механизм H 2 + Cl 2 = 2 HCl = 105



