0452f2db215ca399a015d6fb939f9ba8.ppt
- Количество слайдов: 17

Системный подход к стандартизации при переходе на работу по правилам GMP, GDP, GCP, GLP Ляпунов Н. А. , Гризодуб А. И. , Безуглая Е. П. ГП «ГНЦЛС» , ГП «НЭФЦ»

Кабінет Міністрів України РОЗПОРЯДЖЕННЯ від 10 вересня 2008 р. № 1247 -р “Про затвердження плану заходів щодо удосконалення державного контролю за обігом лікарських засобів і виробів медичного призначення” • 17. . забезпечити внесення відповідних змін до ліцензійних умов на право провадження господарської діяльності в виробництві лікарських засобів, їх оптової та роздрібної торгівлі. МОЗ, Держкомпідприємництво. До 1 січня 2009 року.

Постанова КМУ України від 28. 10. 2004 № 1419 “Деякі заходи щодо забезпечення якості лікарських засобів” Заходи: • Зміни до державного контролю ЛЗ • Вступ Державної служби до PIC/S • Стимулювання вітчизняних виробників

Протокольне рішення від 07. 09. 2006 № 32286/0/1 -06 • 15. МОЗ разом з Держпоживстандартом опрацювати питання щодо делегування МОЗ функції державної реєстрації стандартів у сфері обігу лікарських засобів і виробів медичного призначення, включаючи процедури сертифікації. Надати пропозиції щодо створення програми та поетапного впровадження стандартів GMP, GLP, GCP, GDP в Україні. Строк – до 1 грудня 2006 р.

Система сертификации • лицензирование (регистрация) лекарственных средств; • лицензирование производства и импорта на основании результатов инспектирования на соответствие GMP и регистрационной документации; • лицензирование дистрибуции на основании результатов инспектирования на соответствие правилам надлежащей дистрибьюторской практики (GDP); • независимый контроль качества, который связывают с независимостью контроля качества от производства, институтом Уполномоченных лиц, а также государственным контролем качества на этапах регистрации и реализации; • фармакологический надзор (фармаконадзор); • сертификация субстанций Европейской Фармакопеей.

Цель доклада рассмотреть системный подход к стандартизации, который необходим для внедрения GMP, GLP, GCP, GDP

ОСНОВНЫЕ ЗАДАЧИ СТАНДАРТИЗАЦИИ Создание системы стандартизации МЗ Создание службы стандартизации с инфраструктурой Разработка основополагающих стандартов системы стандартизации МЗ Установление правил разработки, согласования, утверждения, пересмотра и отмены НД Внедрение международных и европейских нормативных документов. Создание Информационной сети Разработка, принятие и внедрение гармонизированных нормативных документов МЗ (орган по стандартизации) Совет по стандартизации Технические комитеты (базовые организации), группы разработчиков Принятие технических регламентоа и законодательных положений
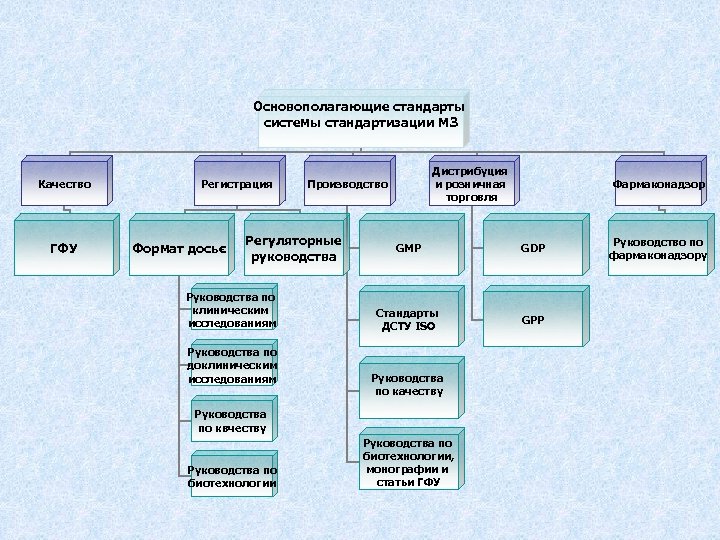
Основополагающие стандарты системы стандартизации МЗ Качество ГФУ Регистрация Формат досьє Регуляторные руководства Руководства по клиническим исследованиям Руководства по доклиническим исследованиям Дистрибуция и розничная торговля Производство GMP GDP Стандарты ДСТУ ISO GPP Руководства по качеству Руководства по квчеству Руководства по биотехнологии Фармаконадзор Руководства по биотехнологии, монографии и статьи ГФУ Руководство по фармаконадзору

Государственная Фармакопея Украины. – 1 изд. – 2001 Приложение 1 к Государственной Фармакопее Украины 1 изд. – 2004 Приложение 2 к Государственной Фармакопее Украины 1 изд. – 2008

РЕГИСТРАЦИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ Порядок проведения экспертизы материалов на лекарственные средства, которые подаются на государственную регистрацию (перерегистрацию), а также внесения изменений в регистрационные материалы Приказ от 26. 08. 2005 № 426 Приказ от 01. 03. 2006 № 95

Руководства, введенные МЗ Украины: • • Фармацевтическая разработка Спецификации Испытания стабильности Производство ГЛС Валидация процессов Вспомогательные вещества Биодоступность и биоэквивалентность Надлежащая клиническая практика (GCP)

Производство и дистрибуция лекарственных средств • Руководство по надлежащей производственной практике активных фармацевтических ингредиентов • Руководство по надлежащей практике дистрибуции • Руководство по технологической документации • 11 стандартов ДСТУ ISO по чистым помещениям и стерилизации

Необходимо: • Ввести актуализированные руководства по GMP и GDP. • 12 документов PIC/S, включая документ РЕ 008 -3 по составлению Site Master File. • Руководство по GLP. • 16 руководств по качеству. • 121 документ по биологическим препаратам. • 34 стандарта ДСТУ ISO. • 54 руководства по доклиническим исследованиям. • 176 руководств по клиническим испытаниям. • Руководство по фармаконадзору. • Руководство по GPP. • 3 -е приложение к ГФУ. • Принять новый Закон «Про лікарські засоби» .

Кабінет Міністрів України РОЗПОРЯДЖЕННЯ від 10 вересня 2008 р. № 1247 -р • 15. Забезпечити участь в обговоренні у Верховній Раді України проекту Закону України „Про лікарські засоби” (нова редакція) з метою його доопрацювання. МОЗ. До 1 жовтня 2008 року.

Кабінет Міністрів України РОЗПОРЯДЖЕННЯ від 10 вересня 2008 р. № 1247 -р • 16. Розробити і затвердити стандарти забезпечення якості лікарських засобів, гармонізовані з директивами ЄС, зокрема щодо належної виробничої практики, належної дистриб’юторської практики, належної лабораторної практики, належної клінічної практики. МОЗ. До 1 жовтня 2008 року.

Внедрение GMP, GDP, GCP, GLP 1. Обязанности государства: - законы, регламенты, стандарты - инспекционные службы - обучение инспекторов - вступление в PIC/S - льготы и бюджетное финансирование 2. Обязанности субъектов рынка: - соответствие установленным законам, правилам GMP, GDP, GCP, GLP и др.

Благодарю за внимание.
0452f2db215ca399a015d6fb939f9ba8.ppt