lektsia3.pptx
- Количество слайдов: 27
 Систематизация химических элементов Изотопная геохимия 1 Лекция № 3 14 сентября 2015 г.
Систематизация химических элементов Изотопная геохимия 1 Лекция № 3 14 сентября 2015 г.
 2 Тема для доклада «Методы изотопного датирования (K-Ar, Ar-Ar, Rb-Sr»
2 Тема для доклада «Методы изотопного датирования (K-Ar, Ar-Ar, Rb-Sr»
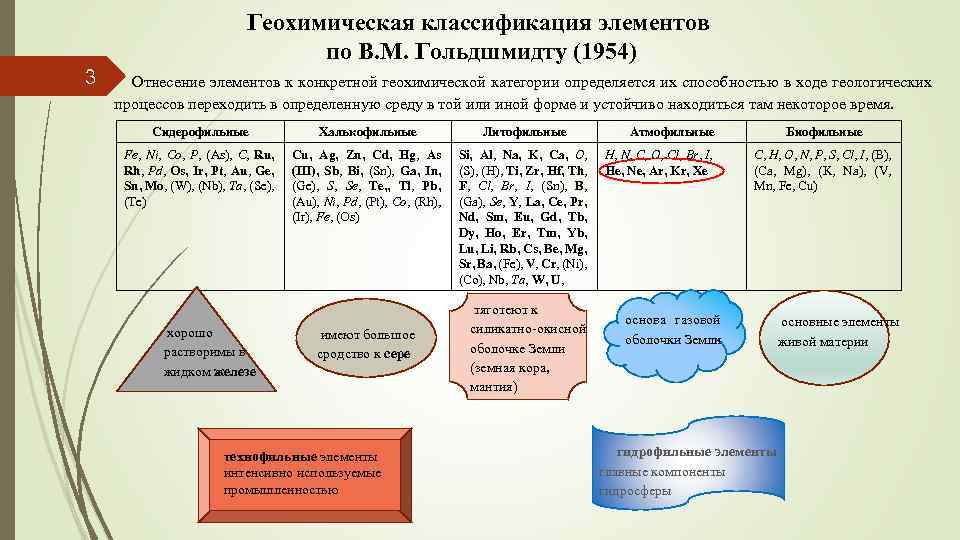 Геохимическая классификация элементов по В. М. Гольдшмидту (1954) 3 Отнесение элементов к конкретной геохимической категории определяется их способностью в ходе геологических процессов переходить в определенную среду в той или иной форме и устойчиво находиться там некоторое время. Сидерофильные Халькофильные Литофильные Fe, Ni, Co, P, (As), C, Ru, Rh, Pd, Os, Ir, Pt, Au, Ge, Sn, Mo, (W), (Nb), Ta, (Se), (Te) Cu, Ag, Zn, Cd, Hg, As (III), Sb, Bi, (Sn), Ga, In, (Ge), S, Se, Te, , Tl, Pb, (Au), Ni, Pd, (Pt), Co, (Rh), (Ir), Fe, (Os) Si, Al, Na, K, Ca, O, (S), (H), Ti, Zr, Hf, Th, F, Cl, Br, I, (Sn), B, (Ga), Se, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Li, Rb, Cs, Be, Mg, Sr, Ba, (Fe), V, Cr, (Ni), (Co), Nb, Ta, W, U, хорошо растворимы в жидком железе имеют большое сродство к сере технофильные элементы интенсивно используемые промышленностью тяготеют к силикатно-окисной оболочке Земли (земная кора, мантия) Атмофильные H, N, C, O, Cl, Br, I, He, Ne, Ar, Kr, Xe Биофильные C, H, O, N, P, S, Cl, I, (B), (Ca, Mg), (K, Na), (V, Mn, Fe, Cu) основа газовой оболочки Земли гидрофильные элементы главные компоненты гидросферы основные элементы живой материи
Геохимическая классификация элементов по В. М. Гольдшмидту (1954) 3 Отнесение элементов к конкретной геохимической категории определяется их способностью в ходе геологических процессов переходить в определенную среду в той или иной форме и устойчиво находиться там некоторое время. Сидерофильные Халькофильные Литофильные Fe, Ni, Co, P, (As), C, Ru, Rh, Pd, Os, Ir, Pt, Au, Ge, Sn, Mo, (W), (Nb), Ta, (Se), (Te) Cu, Ag, Zn, Cd, Hg, As (III), Sb, Bi, (Sn), Ga, In, (Ge), S, Se, Te, , Tl, Pb, (Au), Ni, Pd, (Pt), Co, (Rh), (Ir), Fe, (Os) Si, Al, Na, K, Ca, O, (S), (H), Ti, Zr, Hf, Th, F, Cl, Br, I, (Sn), B, (Ga), Se, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Li, Rb, Cs, Be, Mg, Sr, Ba, (Fe), V, Cr, (Ni), (Co), Nb, Ta, W, U, хорошо растворимы в жидком железе имеют большое сродство к сере технофильные элементы интенсивно используемые промышленностью тяготеют к силикатно-окисной оболочке Земли (земная кора, мантия) Атмофильные H, N, C, O, Cl, Br, I, He, Ne, Ar, Kr, Xe Биофильные C, H, O, N, P, S, Cl, I, (B), (Ca, Mg), (K, Na), (V, Mn, Fe, Cu) основа газовой оболочки Земли гидрофильные элементы главные компоненты гидросферы основные элементы живой материи
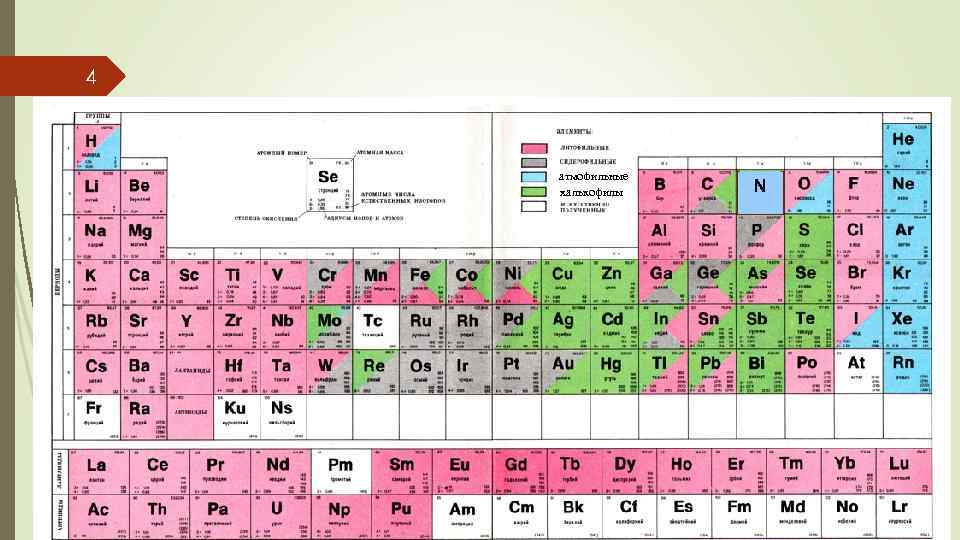 4 атмофильные халькофилы N
4 атмофильные халькофилы N
 5 Атмофильные элементы – это элементы, способные устойчиво существовать в газовой фазе при низких температурах и давлениях. Сюда относятся: инертные газы, азот N, водород Н (в виде H 2 O), углерод С (в виде CO 2). Определенной степенью атмофильности обладает также ртуть Hg, суммарное содержание которой в атмосфере характеризуется весьма внушительной цифрой. Говоря об атмофильных элементах, нельзя не упомянуть серу, которая легко переходит в газовую фазу в виде SO 2 при вулканических извержениях и в процессе металлургической переработки сульфидных руд. Вследствие техногенеза атмофильные свойства приобретаются (или усиливаются) и у ряда других элементов. Литофильные – это элементы, которые в ходе дифференциации вещества Земли сосредотачиваются в ее силикатно-окисной (земная кора, мантия) оболочке. Это в первую очередь: кремний Si, алюминий Al, натрий Na, калий K, в какой-то степени кальций Ca– главные компоненты кислых дифференциатов горных пород. Эти же элементы являются оксифильными, т. е. склонными к образованию кислородных соединений, их ионы имеют 8 -электронную оболочку. К ним относятся всего 54 элемента.
5 Атмофильные элементы – это элементы, способные устойчиво существовать в газовой фазе при низких температурах и давлениях. Сюда относятся: инертные газы, азот N, водород Н (в виде H 2 O), углерод С (в виде CO 2). Определенной степенью атмофильности обладает также ртуть Hg, суммарное содержание которой в атмосфере характеризуется весьма внушительной цифрой. Говоря об атмофильных элементах, нельзя не упомянуть серу, которая легко переходит в газовую фазу в виде SO 2 при вулканических извержениях и в процессе металлургической переработки сульфидных руд. Вследствие техногенеза атмофильные свойства приобретаются (или усиливаются) и у ряда других элементов. Литофильные – это элементы, которые в ходе дифференциации вещества Земли сосредотачиваются в ее силикатно-окисной (земная кора, мантия) оболочке. Это в первую очередь: кремний Si, алюминий Al, натрий Na, калий K, в какой-то степени кальций Ca– главные компоненты кислых дифференциатов горных пород. Эти же элементы являются оксифильными, т. е. склонными к образованию кислородных соединений, их ионы имеют 8 -электронную оболочку. К ним относятся всего 54 элемента.
 6 Халькофильные элементы обладают ярко выраженным сродством к сере (селену и теллуру). Внешняя оболочка катионов имеет 18 -электронную конфигурацию (Сu, Zn, Pb, Cd, Fe, Co и др. ). Природные соединения образуют сульфиды. Это, главным образом, элементы, образующие соединения с ковалентной связью и располагающиеся в побочных подгруппах I – V групп: медь, серебро, цинк, кадмий, ртуть, свинец, мышьяк (III), сурьма, висмут. Проявляет халькофильные свойства и двухвалентное олово. В зависимости от условий халькофильные свойства могут проявлять переходные элементы: Mn, Fe, Co, Ni. Некоторые редкие элементы, такие как Ge, In, Ga ведут себя как халькофилы, хотя присутствуют обычно в виде изоморфных примесей в минералах других более распространенных элементов. Способность металлов окисляться и соответственно проявлять свою окси- или халькофильность связана с величиной нормального электродного потенциала, в зависимости от которого они располагаются в ряд напряжений: Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, H, Bi, Sb, As, Cu, Hg, Ag, Pt, Au склонны к существованию в самородном состоянии Сидерофилы (Ni, Mo, Ni, Со, Os, Pd, Ir, Pt, Au Та и 90 др. ) в расплавах соединяются с железом. Они представлены атомами, которые образуют переходные ионы с внешней оболочкой 9– 17 -электронной конфигурации.
6 Халькофильные элементы обладают ярко выраженным сродством к сере (селену и теллуру). Внешняя оболочка катионов имеет 18 -электронную конфигурацию (Сu, Zn, Pb, Cd, Fe, Co и др. ). Природные соединения образуют сульфиды. Это, главным образом, элементы, образующие соединения с ковалентной связью и располагающиеся в побочных подгруппах I – V групп: медь, серебро, цинк, кадмий, ртуть, свинец, мышьяк (III), сурьма, висмут. Проявляет халькофильные свойства и двухвалентное олово. В зависимости от условий халькофильные свойства могут проявлять переходные элементы: Mn, Fe, Co, Ni. Некоторые редкие элементы, такие как Ge, In, Ga ведут себя как халькофилы, хотя присутствуют обычно в виде изоморфных примесей в минералах других более распространенных элементов. Способность металлов окисляться и соответственно проявлять свою окси- или халькофильность связана с величиной нормального электродного потенциала, в зависимости от которого они располагаются в ряд напряжений: Li, K, Ca, Na, Mg, Al, Mn, Zn, Cr, Fe, Co, Ni, Sn, Pb, H, Bi, Sb, As, Cu, Hg, Ag, Pt, Au склонны к существованию в самородном состоянии Сидерофилы (Ni, Mo, Ni, Со, Os, Pd, Ir, Pt, Au Та и 90 др. ) в расплавах соединяются с железом. Они представлены атомами, которые образуют переходные ионы с внешней оболочкой 9– 17 -электронной конфигурации.
 Гидрофильные элементы – это элементы, которые способны длительное время удерживаться в водных растворах, благодаря либо высокой растворимости их соединений, либо за счет процессов 7 комплексообразования, либо вследствие низких концентраций. Технофильные элементы – категория в определенной мере искусственная, зависящая от экономической конъюнктуры. Относить их к этой категории можно на основании введенного А. Е. Ферсманом показателя, обозначаемого термином «технофильность» и рассчитываемого как отношение величины ежегодной добычи элемента (в тоннах) к его кларку. Если же мы расположим элементы в ряд по величине их абсолютной добычи, то на первом место окажется углерод (миллиарды тонн в год), на втором – железо (сотни миллионов) и так далее вплоть до редких элементов, некоторые из которых добываются в количествах всего несколько граммов в год. Однако ни первый, ни второй подход не является универсальным. Элементы, для которых характерно несколько валентных состояний, в зависимости от внешних условий, определяющих степень их окисления, попадают в разные группы геохимической классификации. Так, уран в высшей степени окисления образует уранил-ион, который в химических процессах ведет себя подобно щелочным металлам, а четырехвалентный уран по геохимическим свойствам аналогичен торию и в воде практически не растворяется. Трехвалентный мышьяк – типичный халькофил, а пятивалентный, соединяясь с кислородом, участвует в образовании мышьяковистой кислоты и ее солей. Олово в четырехвалентном состоянии типичный литофильный элемент, а в двухвалентном – имеет устойчивое сродство к сере.
Гидрофильные элементы – это элементы, которые способны длительное время удерживаться в водных растворах, благодаря либо высокой растворимости их соединений, либо за счет процессов 7 комплексообразования, либо вследствие низких концентраций. Технофильные элементы – категория в определенной мере искусственная, зависящая от экономической конъюнктуры. Относить их к этой категории можно на основании введенного А. Е. Ферсманом показателя, обозначаемого термином «технофильность» и рассчитываемого как отношение величины ежегодной добычи элемента (в тоннах) к его кларку. Если же мы расположим элементы в ряд по величине их абсолютной добычи, то на первом место окажется углерод (миллиарды тонн в год), на втором – железо (сотни миллионов) и так далее вплоть до редких элементов, некоторые из которых добываются в количествах всего несколько граммов в год. Однако ни первый, ни второй подход не является универсальным. Элементы, для которых характерно несколько валентных состояний, в зависимости от внешних условий, определяющих степень их окисления, попадают в разные группы геохимической классификации. Так, уран в высшей степени окисления образует уранил-ион, который в химических процессах ведет себя подобно щелочным металлам, а четырехвалентный уран по геохимическим свойствам аналогичен торию и в воде практически не растворяется. Трехвалентный мышьяк – типичный халькофил, а пятивалентный, соединяясь с кислородом, участвует в образовании мышьяковистой кислоты и ее солей. Олово в четырехвалентном состоянии типичный литофильный элемент, а в двухвалентном – имеет устойчивое сродство к сере.
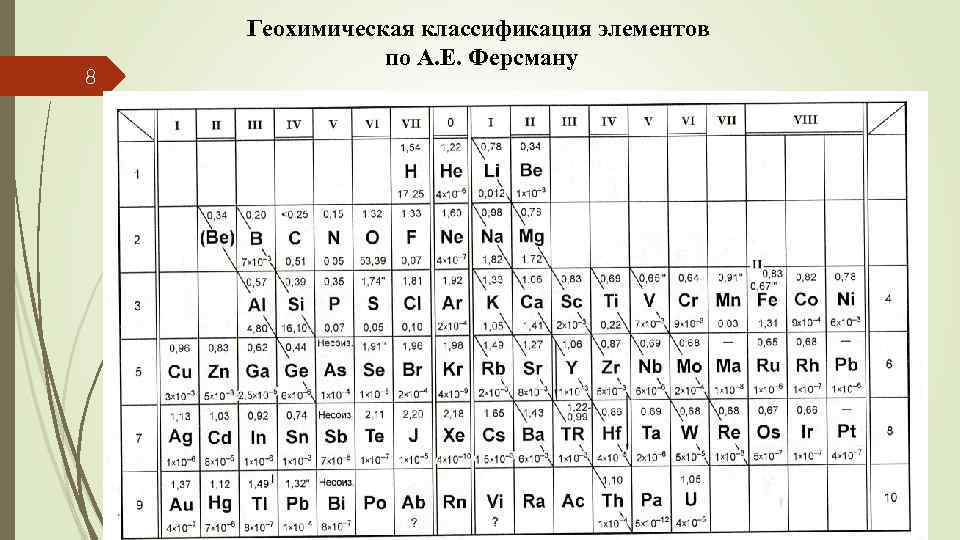 8 Геохимическая классификация элементов по А. Е. Ферсману
8 Геохимическая классификация элементов по А. Е. Ферсману
 Нельзя не отметить большие заслуги А. Е. Ферсмана в разработке геохимических классификаций. Сопоставляя геохимические свойства химических элементов с их положением в Менделеевской таблице, представленной в развернутом виде, А. Е. Ферсман выявил некоторые закономерности изменения кларков как в пределах групп, так и в пределах больших периодов таблицы; выделил диагональные ряды элементов, имеющих близкие ионные радиусы и, следовательно, склонных к изоморфизму. А. Е. Ферсман заключает, что «для геохимии эти ряды намечают и совместное нахождение этих элементов в природе» (Ферсман, 1959, с. 469). По общности химических и геохимических свойств А. Е. Ферсман выделил пять семейств: 9 - железа: Ti, V, Cr, Mn, Fe, Co, Ni, молибдена: Y, Zr, Nb, Mo, Ru, Rh, Pd, рения: Ta, W, Re, Os, Ir, Pt, урана: Rn, Ra, Ac, Tr, Pa, U, редких земель. А. Е. Ферсман выделил на развернутой Менделеевской таблице области, соответствующие определенным геохимическим ассоциациям, которые хорошо коррелируют с вышеприведенной классификацией В. М. Гольдшмидта.
Нельзя не отметить большие заслуги А. Е. Ферсмана в разработке геохимических классификаций. Сопоставляя геохимические свойства химических элементов с их положением в Менделеевской таблице, представленной в развернутом виде, А. Е. Ферсман выявил некоторые закономерности изменения кларков как в пределах групп, так и в пределах больших периодов таблицы; выделил диагональные ряды элементов, имеющих близкие ионные радиусы и, следовательно, склонных к изоморфизму. А. Е. Ферсман заключает, что «для геохимии эти ряды намечают и совместное нахождение этих элементов в природе» (Ферсман, 1959, с. 469). По общности химических и геохимических свойств А. Е. Ферсман выделил пять семейств: 9 - железа: Ti, V, Cr, Mn, Fe, Co, Ni, молибдена: Y, Zr, Nb, Mo, Ru, Rh, Pd, рения: Ta, W, Re, Os, Ir, Pt, урана: Rn, Ra, Ac, Tr, Pa, U, редких земель. А. Е. Ферсман выделил на развернутой Менделеевской таблице области, соответствующие определенным геохимическим ассоциациям, которые хорошо коррелируют с вышеприведенной классификацией В. М. Гольдшмидта.
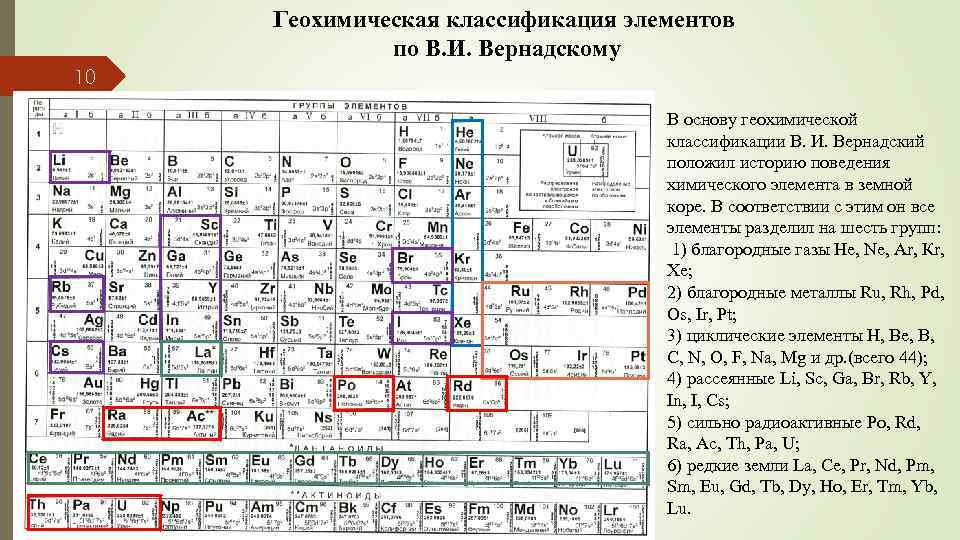 Геохимическая классификация элементов по В. И. Вернадскому 10 В основу геохимической классификации В. И. Вернадский положил историю поведения химического элемента в земной коре. В соответствии с этим он все элементы разделил на шесть групп: 1) благородные газы Не, Ne, Ar, Кr, Хе; 2) благородные металлы Ru, Rh, Pd, Os, Ir, Pt; 3) циклические элементы Н, Be, В, С, N, О, F, Na, Mg и др. (всего 44); 4) рассеянные Li, Sc, Ga, Br, Rb, Y, In, I, Cs; 5) сильно радиоактивные Ро, Rd, Ra, Ac, Th, Pa, U; 6) редкие земли La, Се, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
Геохимическая классификация элементов по В. И. Вернадскому 10 В основу геохимической классификации В. И. Вернадский положил историю поведения химического элемента в земной коре. В соответствии с этим он все элементы разделил на шесть групп: 1) благородные газы Не, Ne, Ar, Кr, Хе; 2) благородные металлы Ru, Rh, Pd, Os, Ir, Pt; 3) циклические элементы Н, Be, В, С, N, О, F, Na, Mg и др. (всего 44); 4) рассеянные Li, Sc, Ga, Br, Rb, Y, In, I, Cs; 5) сильно радиоактивные Ро, Rd, Ra, Ac, Th, Pa, U; 6) редкие земли La, Се, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu.
 11 Инертные газы – продукт радиохимических процессов - химически инертны, однако их геохимическая роль еще далеко не ясна. Благородные металлы также химически устойчивы и потому слабо изменяются в ходе геологических процессов. Циклические элементы составляют основную массу земной коры и всей Земли в целом. По первой классификации это избыточные и системообразующие элементы (кремний, алюминий, железо, кислород, кальций, натрий, магний, сера, углерод и др. ). Они формируют основные круговороты вещества в Земле, переходя из одного состояния в другое. Рассеянные элементы (Li, Sc, Ga, Br, J, Rb, Cs, In, Nb, Ta), как правило, не дают высоких концентраций и не образуют самостоятельных минералов. Они входят в состав других минеральных фаз в виде изоморфных примесей и являются по мнению В. И. Вернадского компонентами «волосных» растворов. Сильно радиоактивные элементы – это по существу естественные радионуклиды (Po, Rn, Ra, Ac, Th, U). Их выделение в самостоятельную группу оправдано их важнейшей ролью в энергетике Земли. Наконец, редкоземельные элементы, занимающие в периодической таблице особое положение, имеют специфические химические и геохимические свойства. Их минералы, имеющие, как правило, эндогенное происхождение, весьма устойчивы и в приповерхностных условиях.
11 Инертные газы – продукт радиохимических процессов - химически инертны, однако их геохимическая роль еще далеко не ясна. Благородные металлы также химически устойчивы и потому слабо изменяются в ходе геологических процессов. Циклические элементы составляют основную массу земной коры и всей Земли в целом. По первой классификации это избыточные и системообразующие элементы (кремний, алюминий, железо, кислород, кальций, натрий, магний, сера, углерод и др. ). Они формируют основные круговороты вещества в Земле, переходя из одного состояния в другое. Рассеянные элементы (Li, Sc, Ga, Br, J, Rb, Cs, In, Nb, Ta), как правило, не дают высоких концентраций и не образуют самостоятельных минералов. Они входят в состав других минеральных фаз в виде изоморфных примесей и являются по мнению В. И. Вернадского компонентами «волосных» растворов. Сильно радиоактивные элементы – это по существу естественные радионуклиды (Po, Rn, Ra, Ac, Th, U). Их выделение в самостоятельную группу оправдано их важнейшей ролью в энергетике Земли. Наконец, редкоземельные элементы, занимающие в периодической таблице особое положение, имеют специфические химические и геохимические свойства. Их минералы, имеющие, как правило, эндогенное происхождение, весьма устойчивы и в приповерхностных условиях.
 12 Обилие геохимических классификаций уже само по себе является свидетельством их несовершенства. Каждый из авторов, причем - что следует особенно подчеркнуть - ведущих геохимиков мира, хотя и привязывает разработанную им классификацию к Периодическому закону элементов, все же отдает предпочтение определенной группе геологических факторов. В результате, например, золото по В. М. Гольдшмидту, В. И. Вернадскому и Г. Бергу - благородный металл, а по А. Е. Ферсману и А. Н. Заварицкому попадает в группу халькофильных. Г. Берг в отличие от других авторов относит серебро к благородным металлам, а не к халькофильным. Молибден по В. М. Гольдшмидту и Г. Бергу относится к группе железа, по А. Н. Заварицкому – к редким элементам, а по А. Е. Ферсману оказывается в одной группе с платиноидами и радиоактивными элементами. Все это свидетельствует о том, что геохимический закон поведения химических элементов в земной коре еще не открыт. Вместе с тем, он должен существовать, поскольку совершенно очевидно, что Периодического закона Д. И. Менделеева здесь недостаточно. Логически рассуждая, можно предположить, что геохимическая классификация химических элементов должна представлять собой некий синтетический продукт Периодического закона, теории фазового анализа, разработанного Н. С. Курнаковым, и основанной Ф. Кларком системы средних содержаний элементов (кларков) в земной коре и отдельных ее частях. Тогда в единой системе, по-видимому, можно будет учесть внутренние и внешние факторы миграции химических элементов, т. е. их геохимическое поведение. В качестве примера действия геохимического закона (или законов) элементов можно привести разное поведение редких и рассеянных элементов. Рассеянные элементы, по В. И. Вернадскому, - это такие элементы, которые не дают в земной коре высоких концентраций (т. е. обладают слабой способностью к концентрированию), хотя могут присутствовать в значительных количествах (имеют относительно высокие кларки). К ним относятся, например, Rb, Ga, Re, Cd, Sc. Редкие элементы, несмотря на меньшие средние содержания в земной коре, способны образовывать собственные минералы и давать рудные скопления. В чем причина такого разного поведения элементов? Вряд ли это можно объяснить только свойствами самих элементов. Видимо существенную роль играет то, что мы называем внешними факторами миграции.
12 Обилие геохимических классификаций уже само по себе является свидетельством их несовершенства. Каждый из авторов, причем - что следует особенно подчеркнуть - ведущих геохимиков мира, хотя и привязывает разработанную им классификацию к Периодическому закону элементов, все же отдает предпочтение определенной группе геологических факторов. В результате, например, золото по В. М. Гольдшмидту, В. И. Вернадскому и Г. Бергу - благородный металл, а по А. Е. Ферсману и А. Н. Заварицкому попадает в группу халькофильных. Г. Берг в отличие от других авторов относит серебро к благородным металлам, а не к халькофильным. Молибден по В. М. Гольдшмидту и Г. Бергу относится к группе железа, по А. Н. Заварицкому – к редким элементам, а по А. Е. Ферсману оказывается в одной группе с платиноидами и радиоактивными элементами. Все это свидетельствует о том, что геохимический закон поведения химических элементов в земной коре еще не открыт. Вместе с тем, он должен существовать, поскольку совершенно очевидно, что Периодического закона Д. И. Менделеева здесь недостаточно. Логически рассуждая, можно предположить, что геохимическая классификация химических элементов должна представлять собой некий синтетический продукт Периодического закона, теории фазового анализа, разработанного Н. С. Курнаковым, и основанной Ф. Кларком системы средних содержаний элементов (кларков) в земной коре и отдельных ее частях. Тогда в единой системе, по-видимому, можно будет учесть внутренние и внешние факторы миграции химических элементов, т. е. их геохимическое поведение. В качестве примера действия геохимического закона (или законов) элементов можно привести разное поведение редких и рассеянных элементов. Рассеянные элементы, по В. И. Вернадскому, - это такие элементы, которые не дают в земной коре высоких концентраций (т. е. обладают слабой способностью к концентрированию), хотя могут присутствовать в значительных количествах (имеют относительно высокие кларки). К ним относятся, например, Rb, Ga, Re, Cd, Sc. Редкие элементы, несмотря на меньшие средние содержания в земной коре, способны образовывать собственные минералы и давать рудные скопления. В чем причина такого разного поведения элементов? Вряд ли это можно объяснить только свойствами самих элементов. Видимо существенную роль играет то, что мы называем внешними факторами миграции.
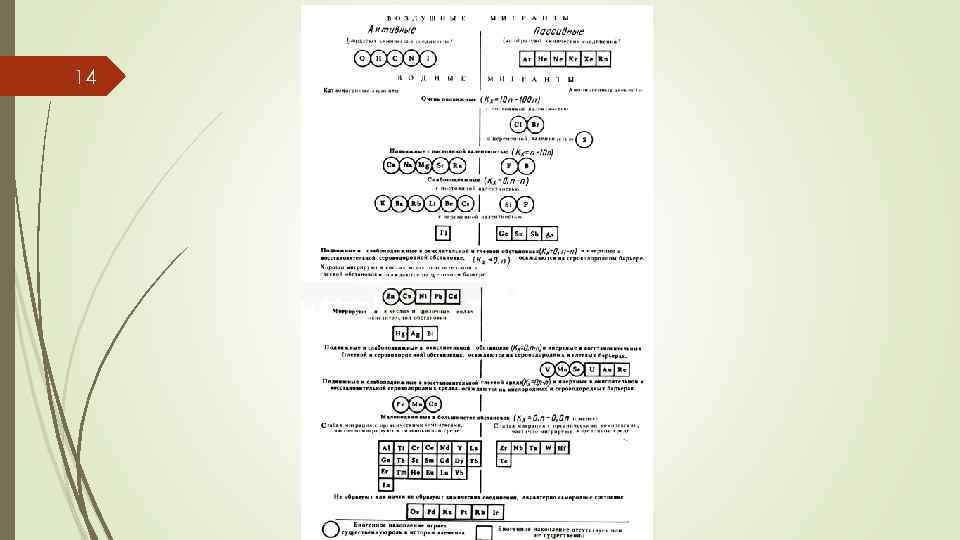
 13 Геохимическая классификация элементов по А. И. Перельману Классификация элементов, составленная А. И. Перельманом, соответствует их поведению в условиях зоны гипергенеза. В классификации учитывалась интенсивность, контрастность, виды миграции элементов в различных геохимических обстановках, а также их свойства и кларки. Химические элементы разделены по форме миграции на две основные группы: воздушные и водные. Из активных воздушных мигрантов в основном состоят живое вещество, природные воды. Воздушные мигранты в значительной степени определяют р. Н и Eh природных вод. Пассивные воздушные мигранты не играют существенной роли в ландшафте. Водные мигранты делятся на анионогенные и катионогенные, поведение которых в ландшафте определяется свойствами самих элементов и геохимическими условиями среды (Eh и p. H). Каждая выделенная группа представляет собой парагенную ассоциацию элементов, осаждающихся на геохимических барьерах. В пределах групп химические элементы расположены по убыванию кларка. При сходных химических свойствах чем выше кларк, тем больше геохимическая роль элемента.
13 Геохимическая классификация элементов по А. И. Перельману Классификация элементов, составленная А. И. Перельманом, соответствует их поведению в условиях зоны гипергенеза. В классификации учитывалась интенсивность, контрастность, виды миграции элементов в различных геохимических обстановках, а также их свойства и кларки. Химические элементы разделены по форме миграции на две основные группы: воздушные и водные. Из активных воздушных мигрантов в основном состоят живое вещество, природные воды. Воздушные мигранты в значительной степени определяют р. Н и Eh природных вод. Пассивные воздушные мигранты не играют существенной роли в ландшафте. Водные мигранты делятся на анионогенные и катионогенные, поведение которых в ландшафте определяется свойствами самих элементов и геохимическими условиями среды (Eh и p. H). Каждая выделенная группа представляет собой парагенную ассоциацию элементов, осаждающихся на геохимических барьерах. В пределах групп химические элементы расположены по убыванию кларка. При сходных химических свойствах чем выше кларк, тем больше геохимическая роль элемента.
 14
14
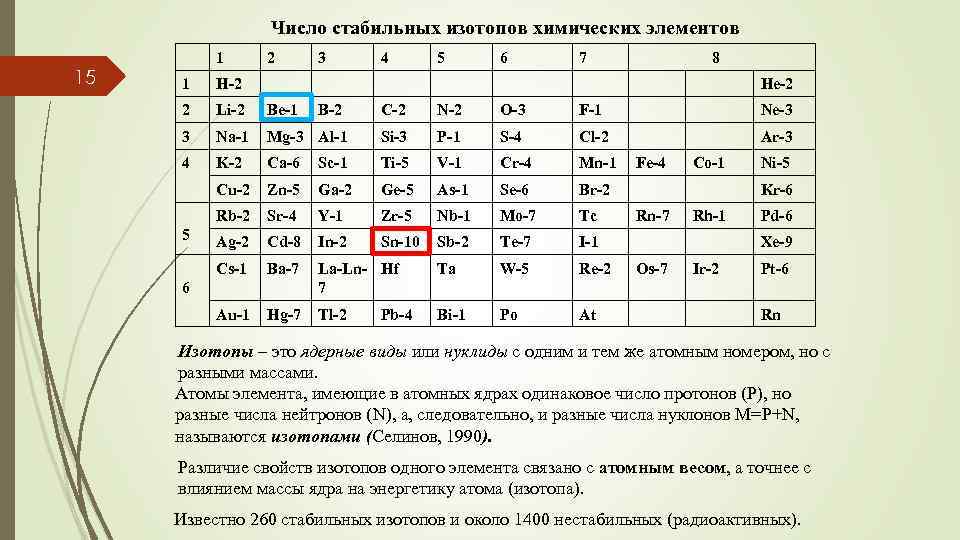 Число стабильных изотопов химических элементов 15 1 2 1 Li-2 Be-1 3 Na-1 4 4 5 6 7 8 H-2 2 3 He-2 C-2 N-2 O-3 F-1 Ne-3 Mg-3 Al-1 Si-3 P-1 S-4 Cl-2 Ar-3 K-2 Ca-6 Sc-1 Ti-5 V-1 Cr-4 Mn-1 Cu-2 Zn-5 Ga-2 Ge-5 As-1 Se-6 Br-2 Rb-2 Sr-4 Y-1 Zr-5 Nb-1 Mo-7 Tc Ag-2 Cd-8 In-2 Sn-10 Sb-2 Te-7 I-1 Cs-1 Ba-7 La-Ln- Hf 7 Ta W-5 Re-2 Au-1 5 Hg-7 Tl-2 Bi-1 Po At 6 B-2 Pb-4 Fe-4 Co-1 Ni-5 Kr-6 Rn-7 Rh-1 Pd-6 Xe-9 Os-7 Ir-2 Pt-6 Rn Изотопы – это ядерные виды или нуклиды с одним и тем же атомным номером, но с разными массами. Атомы элемента, имеющие в атомных ядрах одинаковое число протонов (Р), но разные числа нейтронов (N), а, следовательно, и разные числа нуклонов M=Р+N, называются изотопами (Селинов, 1990). Различие свойств изотопов одного элемента связано с атомным весом, а точнее с влиянием массы ядра на энергетику атома (изотопа). Известно 260 стабильных изотопов и около 1400 нестабильных (радиоактивных).
Число стабильных изотопов химических элементов 15 1 2 1 Li-2 Be-1 3 Na-1 4 4 5 6 7 8 H-2 2 3 He-2 C-2 N-2 O-3 F-1 Ne-3 Mg-3 Al-1 Si-3 P-1 S-4 Cl-2 Ar-3 K-2 Ca-6 Sc-1 Ti-5 V-1 Cr-4 Mn-1 Cu-2 Zn-5 Ga-2 Ge-5 As-1 Se-6 Br-2 Rb-2 Sr-4 Y-1 Zr-5 Nb-1 Mo-7 Tc Ag-2 Cd-8 In-2 Sn-10 Sb-2 Te-7 I-1 Cs-1 Ba-7 La-Ln- Hf 7 Ta W-5 Re-2 Au-1 5 Hg-7 Tl-2 Bi-1 Po At 6 B-2 Pb-4 Fe-4 Co-1 Ni-5 Kr-6 Rn-7 Rh-1 Pd-6 Xe-9 Os-7 Ir-2 Pt-6 Rn Изотопы – это ядерные виды или нуклиды с одним и тем же атомным номером, но с разными массами. Атомы элемента, имеющие в атомных ядрах одинаковое число протонов (Р), но разные числа нейтронов (N), а, следовательно, и разные числа нуклонов M=Р+N, называются изотопами (Селинов, 1990). Различие свойств изотопов одного элемента связано с атомным весом, а точнее с влиянием массы ядра на энергетику атома (изотопа). Известно 260 стабильных изотопов и около 1400 нестабильных (радиоактивных).
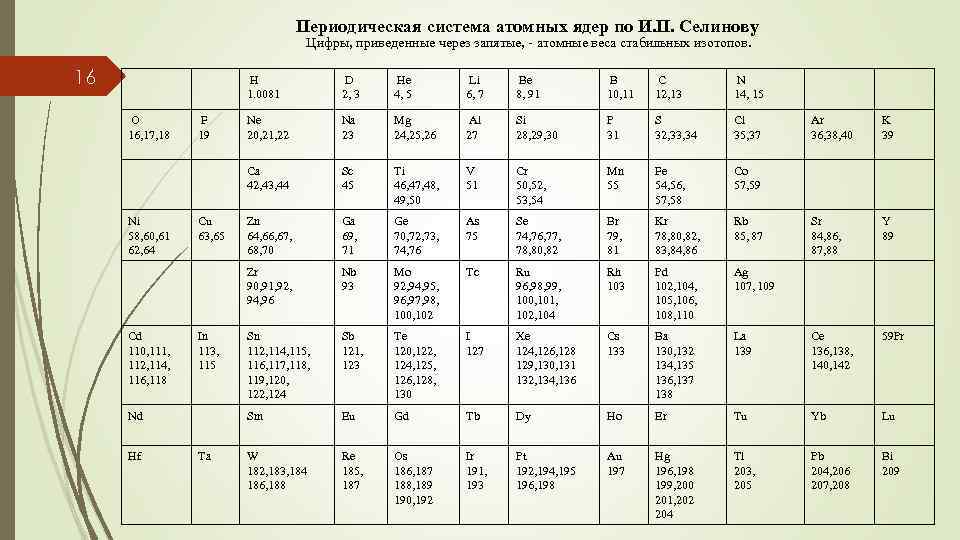 Периодическая система атомных ядер по И. П. Селинову Цифры, приведенные через запятые, - атомные веса стабильных изотопов. 16 H 1. 0081 Cd 110, 111, 112, 114, 116, 118 In 113, 115 Nd Hf Ta Be 8, 91 B 10, 11 C 12, 13 N 14, 15 Ne 20, 21, 22 Na 23 Mg 24, 25, 26 Al 27 Si 28, 29, 30 P 31 S 32, 33, 34 Cl 35, 37 Sc 45 Ti 46, 47, 48, 49, 50 V 51 Cr 50, 52, 53, 54 Mn 55 Fe 54, 56, 57, 58 Co 57, 59 Zn 64, 66, 67, 68, 70 Ga 69, 71 Ge 70, 72, 73, 74, 76 As 75 Se 74, 76, 77, 78, 80, 82 Br 79, 81 Kr 78, 80, 82, 83, 84, 86 Rb 85, 87 Nb 93 Mo 92, 94, 95, 96, 97, 98, 100, 102 Tc Ru 96, 98, 99, 100, 101, 102, 104 Rh 103 Pd 102, 104, 105, 106, 108, 110 Ag 107, 109 Sn 112, 114, 115, 116, 117, 118, 119, 120, 122, 124 Sb 121, 123 Te 120, 122, 124, 125, 126, 128, 130 I 127 Xe 124, 126, 128 129, 130, 131 132, 134, 136 Cs 133 Ba 130, 132 134, 135 136, 137 138 Sm Cu 63, 65 Li 6, 7 Zr 90, 91, 92, 94, 96 Ni 58, 60, 61 62, 64 F 19 He 4, 5 Ca 42, 43, 44 O 16, 17, 18 D 2, 3 Eu Gd Tb Dy Ho W 182, 183, 184 186, 188 Re 185, 187 Os 186, 187 188, 189 190, 192 Ir 191, 193 Pt 192, 194, 195 196, 198 Au 197 Ar 36, 38, 40 K 39 Sr 84, 86, 87, 88 Y 89 La 139 Ce 136, 138, 140, 142 59 Pr Er Tu Yb Lu Hg 196, 198 199, 200 201, 202 204 Tl 203, 205 Pb 204, 206 207, 208 Bi 209
Периодическая система атомных ядер по И. П. Селинову Цифры, приведенные через запятые, - атомные веса стабильных изотопов. 16 H 1. 0081 Cd 110, 111, 112, 114, 116, 118 In 113, 115 Nd Hf Ta Be 8, 91 B 10, 11 C 12, 13 N 14, 15 Ne 20, 21, 22 Na 23 Mg 24, 25, 26 Al 27 Si 28, 29, 30 P 31 S 32, 33, 34 Cl 35, 37 Sc 45 Ti 46, 47, 48, 49, 50 V 51 Cr 50, 52, 53, 54 Mn 55 Fe 54, 56, 57, 58 Co 57, 59 Zn 64, 66, 67, 68, 70 Ga 69, 71 Ge 70, 72, 73, 74, 76 As 75 Se 74, 76, 77, 78, 80, 82 Br 79, 81 Kr 78, 80, 82, 83, 84, 86 Rb 85, 87 Nb 93 Mo 92, 94, 95, 96, 97, 98, 100, 102 Tc Ru 96, 98, 99, 100, 101, 102, 104 Rh 103 Pd 102, 104, 105, 106, 108, 110 Ag 107, 109 Sn 112, 114, 115, 116, 117, 118, 119, 120, 122, 124 Sb 121, 123 Te 120, 122, 124, 125, 126, 128, 130 I 127 Xe 124, 126, 128 129, 130, 131 132, 134, 136 Cs 133 Ba 130, 132 134, 135 136, 137 138 Sm Cu 63, 65 Li 6, 7 Zr 90, 91, 92, 94, 96 Ni 58, 60, 61 62, 64 F 19 He 4, 5 Ca 42, 43, 44 O 16, 17, 18 D 2, 3 Eu Gd Tb Dy Ho W 182, 183, 184 186, 188 Re 185, 187 Os 186, 187 188, 189 190, 192 Ir 191, 193 Pt 192, 194, 195 196, 198 Au 197 Ar 36, 38, 40 K 39 Sr 84, 86, 87, 88 Y 89 La 139 Ce 136, 138, 140, 142 59 Pr Er Tu Yb Lu Hg 196, 198 199, 200 201, 202 204 Tl 203, 205 Pb 204, 206 207, 208 Bi 209
 17 Относительное содержание количества природных изотопов одного химического элемента выражается в процентах. Например, если содержание изотопа 8537 Rb составляет 72, 15 %, то из 10 000 атомов рубидия в каком-либо образце на долю этого нуклида приходится 7 215 атомов. Все известные изотопы делятся на четыре типа в зависимости от четного (Ч) или нечетного (Н) числа протонов (Р) и нейтронов (N) в их составе соответственно: N P Тип изотопов Ч Ч Н Н Ч Н I II IV Изотопы IV типа четный-четный наиболее распространены в природе и стабильны. Некоторые из них имеют массовое число кратное четырем (16 О, 24 Мg, 28 Si, 40 Ca, 56 Fe) и входят в состав главных химических элементов литосферы. Под действием космического облучения в атмосфере протекают реакции: 14 N + no → 12 C + 3 H → → 3 He, M=14, P=7, N=7 N=1 14 N M=12, P=6, N=6 M=3, P=1, N=2 + no → 14 C + 1 Н. Они являются источником 14 С, 3 Т, 3 Не. В течение геологических отрезков времени атомы разрушаются и образуются, превращаются в другие и распадаются.
17 Относительное содержание количества природных изотопов одного химического элемента выражается в процентах. Например, если содержание изотопа 8537 Rb составляет 72, 15 %, то из 10 000 атомов рубидия в каком-либо образце на долю этого нуклида приходится 7 215 атомов. Все известные изотопы делятся на четыре типа в зависимости от четного (Ч) или нечетного (Н) числа протонов (Р) и нейтронов (N) в их составе соответственно: N P Тип изотопов Ч Ч Н Н Ч Н I II IV Изотопы IV типа четный-четный наиболее распространены в природе и стабильны. Некоторые из них имеют массовое число кратное четырем (16 О, 24 Мg, 28 Si, 40 Ca, 56 Fe) и входят в состав главных химических элементов литосферы. Под действием космического облучения в атмосфере протекают реакции: 14 N + no → 12 C + 3 H → → 3 He, M=14, P=7, N=7 N=1 14 N M=12, P=6, N=6 M=3, P=1, N=2 + no → 14 C + 1 Н. Они являются источником 14 С, 3 Т, 3 Не. В течение геологических отрезков времени атомы разрушаются и образуются, превращаются в другие и распадаются.
 18 Все тяжелые изотопы начиная с порядкового номера Z > 82 (cсвинец) радиоактивны. Радиоактивные свойства атомов определяются строением ядер, а не структурой электронных оболочек! Ядра неустойчивых атомов распадаются самопроизвольно, сопровождаясь эмиссией частиц (α, β) или излучением энергии (γ). Этот процесс называется радиоактивностью. Альфа-лучи представляют собой потоки высокоскоростных частиц – ионов гелия 4 Не, бета-лучи – потоки электронов е, гамма-лучи – электромагнитные волны с большой энергией. Некоторые атомы распадаются двумя или тремя способами, большинство – одним, что приводит к превращению атома одного элемента в атом другого, чаще стабильного. Массовое число этих изотопов уменьшается на четыре после каждого акта α-распада. Основной характеристикой радиоактивных изотопов является константа распада – период полураспада (Т 1/2) – время, в течение которого распадается половина атомов любого радиоактивного изотопа. Период полураспада определяется внутренними свойствами радиоактивных изотопов. Изотопы одного элемента имеют различные энергии химической связи и активации в химических реакциях. Это влияет на скорость химических реакций, в которых участвуют молекулы с разными изотопами и определяет разную подвижность изотопно-разных атомов или молекул, что является причиной их разделения в процессе миграции. Такое разделение называется изотопным фракционированием и несет важную информацию о геохимических процессах. Перераспределение изотопов между разными фазами, различное их поведение в геологических и биологических процессах убедительно свидетельствует о различии именно физико-химических свойств.
18 Все тяжелые изотопы начиная с порядкового номера Z > 82 (cсвинец) радиоактивны. Радиоактивные свойства атомов определяются строением ядер, а не структурой электронных оболочек! Ядра неустойчивых атомов распадаются самопроизвольно, сопровождаясь эмиссией частиц (α, β) или излучением энергии (γ). Этот процесс называется радиоактивностью. Альфа-лучи представляют собой потоки высокоскоростных частиц – ионов гелия 4 Не, бета-лучи – потоки электронов е, гамма-лучи – электромагнитные волны с большой энергией. Некоторые атомы распадаются двумя или тремя способами, большинство – одним, что приводит к превращению атома одного элемента в атом другого, чаще стабильного. Массовое число этих изотопов уменьшается на четыре после каждого акта α-распада. Основной характеристикой радиоактивных изотопов является константа распада – период полураспада (Т 1/2) – время, в течение которого распадается половина атомов любого радиоактивного изотопа. Период полураспада определяется внутренними свойствами радиоактивных изотопов. Изотопы одного элемента имеют различные энергии химической связи и активации в химических реакциях. Это влияет на скорость химических реакций, в которых участвуют молекулы с разными изотопами и определяет разную подвижность изотопно-разных атомов или молекул, что является причиной их разделения в процессе миграции. Такое разделение называется изотопным фракционированием и несет важную информацию о геохимических процессах. Перераспределение изотопов между разными фазами, различное их поведение в геологических и биологических процессах убедительно свидетельствует о различии именно физико-химических свойств.
 19 В. Ф. Барабанов (1985) со ссылкой на Й. Хефса отмечает следующие закономерности геохимического поведения стабильных изотопов: -более ощутимая склонность к фракционированию у элементов с атомным номером меньше 40, Наибольшее фракционирование присуще для легких элементов, так как у них значительная разница между массами изотопов. Например, изотоп водорода протий (1 Н) и дейтерий (2 Н или D) различаются по массам в два раза или на 100 %, тогда как разница масс изотопов тяжелых химических элементов не существенна. Для урана (238 и 235) она составляет 1. 28 %. -предпочтительное вхождение тяжелых изотопов в твердую фазу в ходе гетерофазных реакций, -увеличение доли тяжелых изотопов у элементов в высших степенях окисления, -увеличение доли легких изотопов в некоторых биологических процессах, например, фотосинтеза.
19 В. Ф. Барабанов (1985) со ссылкой на Й. Хефса отмечает следующие закономерности геохимического поведения стабильных изотопов: -более ощутимая склонность к фракционированию у элементов с атомным номером меньше 40, Наибольшее фракционирование присуще для легких элементов, так как у них значительная разница между массами изотопов. Например, изотоп водорода протий (1 Н) и дейтерий (2 Н или D) различаются по массам в два раза или на 100 %, тогда как разница масс изотопов тяжелых химических элементов не существенна. Для урана (238 и 235) она составляет 1. 28 %. -предпочтительное вхождение тяжелых изотопов в твердую фазу в ходе гетерофазных реакций, -увеличение доли тяжелых изотопов у элементов в высших степенях окисления, -увеличение доли легких изотопов в некоторых биологических процессах, например, фотосинтеза.
 На различии свойств изотопов основаны методы их разделения различная скорость диффузии в газах, различная скорость термодиффузии, разная подвижность в электролите, различная скорость перемещения в электрическом поле, различная упругость пара соединений, различия в скоростях химических реакций,
На различии свойств изотопов основаны методы их разделения различная скорость диффузии в газах, различная скорость термодиффузии, разная подвижность в электролите, различная скорость перемещения в электрическом поле, различная упругость пара соединений, различия в скоростях химических реакций,
 21 Правильная интерпретация результатов изотопного фракционирования должна учитывать многофакторность этого процесса. Например, фракционирование может быть результатом испарения, физической абсорбции, растворения, плавления, кристаллизации, различных химических реакций, включая биогеохимические и катализируемые ферменты. Наибольшее фракционирование присуще для легких элементов, так как у них значительная разница между массами изотопов. Например, изотоп водорода протий (1 Н) и дейтерий (2 Н или D) различаются по массам в два раза или на 100 %, тогда как разница масс изотопов тяжелых химических элементов не существенна. Для урана (238 и 235) она составляет 1. 28 %.
21 Правильная интерпретация результатов изотопного фракционирования должна учитывать многофакторность этого процесса. Например, фракционирование может быть результатом испарения, физической абсорбции, растворения, плавления, кристаллизации, различных химических реакций, включая биогеохимические и катализируемые ферменты. Наибольшее фракционирование присуще для легких элементов, так как у них значительная разница между массами изотопов. Например, изотоп водорода протий (1 Н) и дейтерий (2 Н или D) различаются по массам в два раза или на 100 %, тогда как разница масс изотопов тяжелых химических элементов не существенна. Для урана (238 и 235) она составляет 1. 28 %.
 Геохимия некоторых изотопов и их использование в геологии Главной задачей изучения геохимии изотопов является установление условий их фракционирования, изменения их отношений при различных физико-химических, биохимических и радиохимических процессах в земной коре (Г. Фор, 1989). Фракционирование и установление отношений стабильных изотопов используется для выявления генезиса, физико -химических условий, а нестабильных (радиоактивных) – для определения возраста отложений, формирования геологической системы. Отношение изотопов измеряется по отношению к стандарту и выражается в частях на 1000 (промилле, 0/00). Это отношение обозначается величиной δ. где No – изотопное отношение в образце, а Ns – изотопное отношение в стандарте. δ 18 О 0/ Для кислорода это отношение определяется следующим образом: 18 16 00 = {[ О/ О(образец) – О/ О(стандарт)] / О/ О(стандарт)} · 1000. Значение δ, равное +10 0/00, означает, что образец обогащен изотопом 18 О по отношению к стандарту на 1 %. Аналогично вычисляются отношения изотопов для других элементов. Средние изотопные отношения кислорода и серы в геологических объектах (Браунлоу, 1984) Объекты (промилле) для 18 O/16 O (промилле) для 34 S/32 S Изверженные породы +5 +9 +10 -2 Осадочные породы +12 +30 +42 -45 Морская вода -0, 5 +0, 5 +21 +19 Гидротермы -24 +7 +35 -6 Правильная интерпретация результатов изотопного фракционирования должна учитывать многофакторность этого процесса. Например, фракционирование может быть результатом испарения, физической абсорбции, растворения, плавления, кристаллизации, различных химических реакций, включая биогеохимические и катализируемые ферменты.
Геохимия некоторых изотопов и их использование в геологии Главной задачей изучения геохимии изотопов является установление условий их фракционирования, изменения их отношений при различных физико-химических, биохимических и радиохимических процессах в земной коре (Г. Фор, 1989). Фракционирование и установление отношений стабильных изотопов используется для выявления генезиса, физико -химических условий, а нестабильных (радиоактивных) – для определения возраста отложений, формирования геологической системы. Отношение изотопов измеряется по отношению к стандарту и выражается в частях на 1000 (промилле, 0/00). Это отношение обозначается величиной δ. где No – изотопное отношение в образце, а Ns – изотопное отношение в стандарте. δ 18 О 0/ Для кислорода это отношение определяется следующим образом: 18 16 00 = {[ О/ О(образец) – О/ О(стандарт)] / О/ О(стандарт)} · 1000. Значение δ, равное +10 0/00, означает, что образец обогащен изотопом 18 О по отношению к стандарту на 1 %. Аналогично вычисляются отношения изотопов для других элементов. Средние изотопные отношения кислорода и серы в геологических объектах (Браунлоу, 1984) Объекты (промилле) для 18 O/16 O (промилле) для 34 S/32 S Изверженные породы +5 +9 +10 -2 Осадочные породы +12 +30 +42 -45 Морская вода -0, 5 +0, 5 +21 +19 Гидротермы -24 +7 +35 -6 Правильная интерпретация результатов изотопного фракционирования должна учитывать многофакторность этого процесса. Например, фракционирование может быть результатом испарения, физической абсорбции, растворения, плавления, кристаллизации, различных химических реакций, включая биогеохимические и катализируемые ферменты.
 23 Физиологические и биохимические процессы в живых организмах способны изменять изотопный состав (отношение) в первую очередь биофильных элементов (Н, C, O, S). Он отличается от изотопного состава в битумах, угле, графите, нефти. Водород имеет три изотопа: 1 Н 99, 985 %, 2 Н (D) 0, 015 %, 3 Н (Т). Трития очень мало. Он образуется в верхних слоях атмосферы при взаимодействии азота с нейтронами космических лучей. Его отношение к водороду (Т / Н) составляет 1 · 10. При повышении в воде содержания дейтерия замедляются реакции в организме в 13 раз. В природной воде комбинации изотопов водорода могут создавать 18 разновидностей молекул. Однако состав воды представлен преимущественно Н 2 О 16 (1, 4 · 1018 т) и D 2 O 16 (2 · 1014 т). На стакан воды приходится лишь несколько тысяч молекул Т 2 О 16. Дейтерием богаты воды гейзеров, фумарол и горячие подземные. – 18 Углерод в природе представлен тремя изотопами: 12 С 98, 90 %, 13 С 1, 10 %, 14 С (следы) – с периодом полураспада 5730 лет. Радионуклид образуется при взаимодействии атмосферного азота с нейтронами, а при реакции β-распада вновь переходит в азот. Изотоп 13 С накапливается в карбонатах, а 12 С концентрируется в органических соединениях в процессе фотосинтеза. Поэтому отношения 12 С/13 С позволяют установить генезис карбонатных пород.
23 Физиологические и биохимические процессы в живых организмах способны изменять изотопный состав (отношение) в первую очередь биофильных элементов (Н, C, O, S). Он отличается от изотопного состава в битумах, угле, графите, нефти. Водород имеет три изотопа: 1 Н 99, 985 %, 2 Н (D) 0, 015 %, 3 Н (Т). Трития очень мало. Он образуется в верхних слоях атмосферы при взаимодействии азота с нейтронами космических лучей. Его отношение к водороду (Т / Н) составляет 1 · 10. При повышении в воде содержания дейтерия замедляются реакции в организме в 13 раз. В природной воде комбинации изотопов водорода могут создавать 18 разновидностей молекул. Однако состав воды представлен преимущественно Н 2 О 16 (1, 4 · 1018 т) и D 2 O 16 (2 · 1014 т). На стакан воды приходится лишь несколько тысяч молекул Т 2 О 16. Дейтерием богаты воды гейзеров, фумарол и горячие подземные. – 18 Углерод в природе представлен тремя изотопами: 12 С 98, 90 %, 13 С 1, 10 %, 14 С (следы) – с периодом полураспада 5730 лет. Радионуклид образуется при взаимодействии атмосферного азота с нейтронами, а при реакции β-распада вновь переходит в азот. Изотоп 13 С накапливается в карбонатах, а 12 С концентрируется в органических соединениях в процессе фотосинтеза. Поэтому отношения 12 С/13 С позволяют установить генезис карбонатных пород.
 24 Кислород имеет в природе три стабильных изотопа: 16 О 99, 76 %, 17 О 0, 048, 18 О 0, 20 %. Генетическое значение имеет соотношение 16 О /18 О, колебания для которых составляют до 5 %. В воде больше 16 О, в атмосфере 18 О. Морские воды более тяжелые по кислороду (18 О). Магматические воды содержат меньше 18 О, чем осадочные. Зависимость от температуры констант равновесия реакций фракционирования изотопов позволяет считать их как основу при установлении палеотемператур древних морей. Сера представлена в природе следующими стабильными изотопами; 32 S 95, 02 %, 33 S 0, 75, 34 S 4, 21, 36 S 0, 02 %. Изотопный состав серы позволяет правильно определить генезис природных соединений. За стандарт, относительно которого рассматривается изотопный состав серы, принята сера троилита метеоритов с постоянным отношением 32 S / 34 S 22. Изотопы серы заметно разделяются в геохимических и биохимических процессах окисления и восстановления, причем легкий изотоп-32 обогащает сульфиды и накапливается в биологических структурах, а более тяжелый-34 – в сульфатах морской воды (гипс). В природной среде соотношения изменяются у 32 S / 33 S до 2, 5 %, 32 S / 34 S до 5, 32 S / 36 S до 10 %.
24 Кислород имеет в природе три стабильных изотопа: 16 О 99, 76 %, 17 О 0, 048, 18 О 0, 20 %. Генетическое значение имеет соотношение 16 О /18 О, колебания для которых составляют до 5 %. В воде больше 16 О, в атмосфере 18 О. Морские воды более тяжелые по кислороду (18 О). Магматические воды содержат меньше 18 О, чем осадочные. Зависимость от температуры констант равновесия реакций фракционирования изотопов позволяет считать их как основу при установлении палеотемператур древних морей. Сера представлена в природе следующими стабильными изотопами; 32 S 95, 02 %, 33 S 0, 75, 34 S 4, 21, 36 S 0, 02 %. Изотопный состав серы позволяет правильно определить генезис природных соединений. За стандарт, относительно которого рассматривается изотопный состав серы, принята сера троилита метеоритов с постоянным отношением 32 S / 34 S 22. Изотопы серы заметно разделяются в геохимических и биохимических процессах окисления и восстановления, причем легкий изотоп-32 обогащает сульфиды и накапливается в биологических структурах, а более тяжелый-34 – в сульфатах морской воды (гипс). В природной среде соотношения изменяются у 32 S / 33 S до 2, 5 %, 32 S / 34 S до 5, 32 S / 36 S до 10 %.
 Применение методов изотопной геохимии: 25 1. Выяснение предыстории химического элемента в месторождении, которую не представляется возможным восстановить на основании только геолого-минералогических наблюдений или данных химического анализа. 2. Определение «абсолютного» геологического возраста минералов и горных пород с помощью «изотопных» часов – методов изотопной геохронологии, которые базируются на природных радиоактивных преобразованиях и накоплении стабильных радиогенных изотопов в минералах. Они позволяют датировать геологическое событие от сотен или тысяч лет до миллиардов лет назад с точностью в десятые доли процента. 3. Использование изотопов как естественных «меченых атомов» при исследовании природных процессов. В основе этого лежит геохимическое поведение радиоактивных изотопов. В одних породах они концентрируются, в других – выносятся. Соответственно изменяются концентрации продуктов их распада – от радиогенных добавок до химических элементов. Например, породы земной коры, которые обогащены рубидием, в сравнении с глубинными мантийными породами содержат значительно больше радиогенного стронция-87 – продукта распада рубидия. Таким образом, изотопный состав стронция пород указывает на происхождение их первоначального вещества, и необходимо только знать, как пользоваться этими обстоятельствами в геологических исследованиях.
Применение методов изотопной геохимии: 25 1. Выяснение предыстории химического элемента в месторождении, которую не представляется возможным восстановить на основании только геолого-минералогических наблюдений или данных химического анализа. 2. Определение «абсолютного» геологического возраста минералов и горных пород с помощью «изотопных» часов – методов изотопной геохронологии, которые базируются на природных радиоактивных преобразованиях и накоплении стабильных радиогенных изотопов в минералах. Они позволяют датировать геологическое событие от сотен или тысяч лет до миллиардов лет назад с точностью в десятые доли процента. 3. Использование изотопов как естественных «меченых атомов» при исследовании природных процессов. В основе этого лежит геохимическое поведение радиоактивных изотопов. В одних породах они концентрируются, в других – выносятся. Соответственно изменяются концентрации продуктов их распада – от радиогенных добавок до химических элементов. Например, породы земной коры, которые обогащены рубидием, в сравнении с глубинными мантийными породами содержат значительно больше радиогенного стронция-87 – продукта распада рубидия. Таким образом, изотопный состав стронция пород указывает на происхождение их первоначального вещества, и необходимо только знать, как пользоваться этими обстоятельствами в геологических исследованиях.
 26 4. При условии термодинамического изотопного равновесия распределение стабильных изотопов (например, кислорода) между минеральными фазами определенным образом зависит от температуры, окислительно-восстановительных условий, кислотности растворов, их концентрации и т. д. Это позволяет по изотопному составу объекта исследования, «меченого» стабильными изотопами, судить об источниках вещества, которое принимало участие, например, в процессах рудообразования. 5. Проведение по изотопному составу химических элементов реконструкции физикохимических параметров геологических процессов, протекавших миллионы лет назад, например: установление температуры древних морей и ее колебания на протяжении времен года по изотопам кислорода. 6. Изучение механизма химических реакций минералообразования и других природных процессов. Установлено, что гидрат закиси железа окисляется до гидрата окиси не за счет свободного кислорода воздуха, а гидроксилом воды с более легким кислородом. 7. Использование в органической геохимии распределения стабильных изотопов H, O, C, S в качестве генетических индикаторов. 8. Эффективность изотопного анализа гелия как индикатора мантийного источника газов. 9. Широкое применение в геологоразведочном деле радиоактивного каротажа скважин для установления литологического состава пород без подъема керна, а также для распределения зон пористых и трещиноватых пород. Введение в скважину радиоактивных изотопов (метод меченых 37 атомов) используют для контроля состояния скважин, наблюдения за циркуляцией вод и т. д.
26 4. При условии термодинамического изотопного равновесия распределение стабильных изотопов (например, кислорода) между минеральными фазами определенным образом зависит от температуры, окислительно-восстановительных условий, кислотности растворов, их концентрации и т. д. Это позволяет по изотопному составу объекта исследования, «меченого» стабильными изотопами, судить об источниках вещества, которое принимало участие, например, в процессах рудообразования. 5. Проведение по изотопному составу химических элементов реконструкции физикохимических параметров геологических процессов, протекавших миллионы лет назад, например: установление температуры древних морей и ее колебания на протяжении времен года по изотопам кислорода. 6. Изучение механизма химических реакций минералообразования и других природных процессов. Установлено, что гидрат закиси железа окисляется до гидрата окиси не за счет свободного кислорода воздуха, а гидроксилом воды с более легким кислородом. 7. Использование в органической геохимии распределения стабильных изотопов H, O, C, S в качестве генетических индикаторов. 8. Эффективность изотопного анализа гелия как индикатора мантийного источника газов. 9. Широкое применение в геологоразведочном деле радиоактивного каротажа скважин для установления литологического состава пород без подъема керна, а также для распределения зон пористых и трещиноватых пород. Введение в скважину радиоактивных изотопов (метод меченых 37 атомов) используют для контроля состояния скважин, наблюдения за циркуляцией вод и т. д.
 27
27


