Система производственной документации Общие требования Система производственной документации


Система производственной документации

Общие требования Система производственной документации должна быть описана в стандарте предприятия Документирование – разработка, согласование и утверждение; Систематизация – порядок оформления, распределения и отзыва; Контроль обращения документов; Поддержание жизнеспособности – систематический анализ эффективности составляющих системы и соответствия её вновь вводимым НД и вводимым на предприятии новым технологическим решениям

На предприятии должна быть разработана система создания и ведения документации, позволяющая: описать систему управления качеством; обеспечить персонал, связанный с производством и контролем качества, необходимой ему информацией; уменьшить опасность появления ошибок при устной передаче информации; обеспечить наличие записей постоянного характера по истории каждой выпущенной серии;

обеспечить Уполномоченное лицо (лиц) информацией, необходимой для принятия решения о выдачи решения на реализацию серии продукции; создать возможности для изучения несоответствий при выпуске продукции; обеспечить информацией органы инспекции и регистрации для проведения проверки условий производства и контроля качества продукции на предприятии; обеспечить информацией органы инспекции для проведения проверки условий выпуска серии продукции, качество которой вызывает сомнения.

Ответственность за организацию и поддержание системы производственной документации возлагается на: Заместителя руководителя предприятия, курирующего вопросы качества (Директор по качеству) – обеспечивает общее руководство и контроль. Начальника отдела обеспечения качества – согласование вновь создаваемых документов, обеспечение своевременности пересмотра действующих документов и поддержание жизнеспособности системы. Контролера документов – текущая работа по соблюдению порядка обращения с документами. Руководителей подразделений - актуализация и адекватность положений о подразделении, должностных и рабочих инструкций

Необходимо обеспечить, чтобы документы были доступны всем исполнителям, а устаревшая документация своевременно изымалась. Это означает: Регулярную проверку документации (кем разработана, проверена, утверждена, срок ее действия и соответствует ли она действующим НД). Распределение документации, т.е. ее рассылка, учет и своевременное внесение изменений во все копии. Устранение устаревшей версии документации.

Документы должны: Утверждаться, подписываться и датироваться правомочными сотрудниками. Иметь однозначное содержание. Иметь ясный порядок и легко проверяться. Регулярно анализироваться и обновляться. Необходимо принять меры по недопущению использования устаревшей версии документов. Все документы должны иметь срок и место хранения, быть доступными для использования, но иметь ограничения по пользователям. Копии с документов должны быть четкими. Способ снятия копий с документов должен исключать возникновение ошибок.

Любые изменения в документах должны утверждаться в установленном на предприятии порядке. При внесении в документы любых изменений небольшого объема, необходимо указать причину, проставить дату внесения изменений и подпись внесшего изменения. При необходимости внесения данных в документы (протоколы), следует это делать четко, разборчиво и так, чтобы внесенные сведения нельзя было стереть.

Полнота, аккуратность заполнения документов, а также точность внесения и регистрации данных должны контролироваться. Документы о совершении любых действий, позволяющие отслеживать все операции по производству продукции, должны храниться в установленном месте в течение, как минимум, одного года со дня окончания срока годности готовой продукции. Данные могут регистрироваться электронным, фотографическим или другим надежным способом.

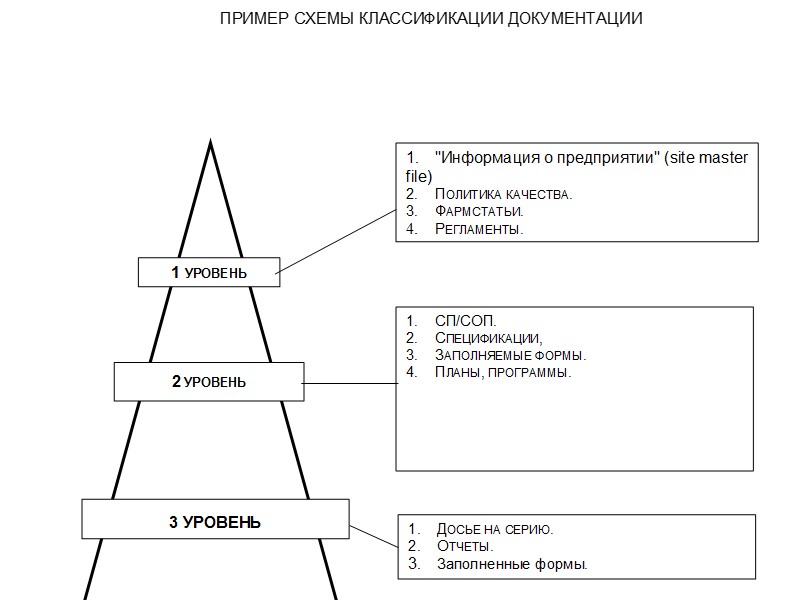
Документацию можно классифицировать по детализации, по степени общности, по степени влияния на качество (прямое или опосредствованное), по категориям пользователей, по степени доступа персонала.

НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ ГОСТ Р 52249-2009 ПРАВИЛА ПРОИЗВОДСТВА И КОНТРОЛЯ КАЧЕСТВА ЛЕКАРСТВЕННЫХ СРЕДСТВ Москва

Виды документов спецификация, промышленный регламент, технологическая инструкция, инструкция по упаковке, инструкция, методика, процедура, протокол на серию.

Спецификация (specification) - документ, содержащий требования к материалам и продуктам, используемым или получаемым при производстве, являющийся основой для оценки качества лекарственных средств.

Промышленный регламент (manufacturing formulae), Технологическая инструкция (processing instruction), Инструкция по упаковке (packaging instruction) – документы, определяющие все используемые исходные материалы и операции по производству и упаковке продукции.

Инструкция, методика, процедура (procedure) – документ, содержащий указания по выполнению отдельных видов операций (например, по очистке, переодеванию, контролю окружающей среды, отбору проб, проведению испытаний, эксплуатации оборудования).

Протокол на серию (record) – документ, отражающий ход производства каждой серии продукции, в т. ч. разрешение на ее реализацию, и все факторы, влияющие на качество готовой продукции.

Спецификации на исходные и упаковочные материалы 1. описание материалов, в т. ч.: наименование и внутризаводской код; ссылку на фармакопейную статью (при ее наличии); наименование утвержденных поставщиков и, по возможности, первичного производителя материалов; образец печатных материалов; 2.методики отбора проб и проведения испытаний или ссылки на соответствующие методики; 3.количественные и качественные характеристики с указанием допустимых пределов; 4.условия хранения и меры предосторожности; 5.максимальный срок хранения до повторного контроля.

Спецификации на готовую продукцию 1. наименование продукции и код (при необходимости); 2. состав препарата или ссылку на соответствующий документ; 3. описание лекарственной формы и данные об упаковке; 4. методики отбора проб и проведения испытаний (или ссылки на них); 5. количественные и качественные характеристики с указанием допустимых пределов; 6. условия хранения и особые меры предосторожности при обращении с препаратом (при необходимости); 7. срок годности.

Технологические инструкции 1. данные о месте нахождения производства и основном оборудовании; 2. инструкции по подготовке основного оборудования (например, по очистке, сборке, калибровке (поверке), стерилизации) или ссылки на них; 3. подробное постадийное описание технологического процесса (например, по контролю материалов, предварительной обработке, последовательности внесения материалов, времени перемешивания, температуре и т.д.); 4. описание всех видов внутрипроизводственного контроля с указанием допустимых пределов; 5. условия хранения нерасфасованной продукции (в т. ч. требования к упаковке, маркировке) и специальные условия хранения (при необходимости); 6. специальные меры предосторожности.
Инструкции по упаковке 1. наименование продукции; 2. описание ее лекарственной формы и дозировки (при необходимости); 3. количество продукта в окончательной упаковке, выраженное в единицах измерения (штуках, массе или объеме); 4. перечень всех упаковочных материалов, необходимых для серии продукции стандартного размера, в т. ч. количество, размер и тип упаковочного материала с указанием кода или номера в соответствии с их спецификацией;

Инструкции по упаковке 5. образец или копию соответствующего печатного упаковочного материала (при необходимости) и образцы с указанием места нанесения номера серии и срока годности продукта; 6. специальные меры предосторожности, в т. ч. тщательную проверку оборудования и зоны упаковки, гарантирующие чистоту упаковочной линии перед началом работы; 7. описание процесса упаковки со всеми основными вспомогательными операциями и используемым оборудованием; 8. подробное описание проведения внутрипроизводственного контроля, в т. ч. порядок отбора проб и указание допустимых пределов.

Протокол на серию продукции 1. наименование продукта; 2. дату и время начала и окончания основных промежуточных этапов и полного технологического процесса; 3. фамилию и инициалы сотрудника, ответственного за выполнение каждой производственной стадии; 4. фамилию(и) и инициалы оператора(ов), ответственного(ых) за основные стадии производства, а также фамилии и инициалы лиц, проверявших выполнение каждой из этих операций; 5. номер серии и/или номер анализа, а также фактическое количество взвешенных исходных материалов, в т. ч. номер серии и количество добавленных регенерированных или переработанных материалов;

Протокол на серию продукции 6. основные технологические операции или действия, а также основное оборудование; 7. протоколы внутрипроизводственного контроля с указанием исполнителей и полученных результатов; 8. выход продукции, полученной на основных производственных стадиях; 9. подробное описание любых отклонений от промышленного регламента и технологических инструкций, подписанное ответственным лицом.

Протоколы на упаковку серии продукции наименование продукта 1. дату (ы) и время операций по упаковке; 2. фамилии и инициалы лица, ответственного за упаковку; 3. фамилии и инициалы упаковщиков для различных стадий упаковки; 4. протоколы проверки соответствия упаковки требованиям инструкций по упаковке, в т. ч. результаты внутрипроизводственного контроля; 5. подробные данные о выполнении операций по упаковке, в т. ч. ссылки на используемое обору дование и упаковочные линии;

Протоколы на упаковку серии продукции наименование продукта 6. образцы печатных материалов, в т. ч. образцы с обозначением номера серии, срока годности и любой дополнительной информации; 7. подробное описание любых отклонений от инструкций по упаковке, подписанное ответственным лицом; 8. количество и наименование выданных, использованных, уничтоженных или возвращенных на склад печатных материалов и нерасфасованной продукции и количество полученной готовой продукции для составления общего баланса.

МИНИСТЕРСТВО ПРОМЫШЛЕННОСТИ, НАУКИ И ТЕХНОЛОГИЙ РОССИЙСКОЙ ФЕДЕРАЦИИ МЕТОДИЧЕСКИЕ УКАЗАНИЯ ПРОИЗВОДСТВО ЛЕКАРСТВЕННЫХ СРЕДСТВ. СИСТЕМА ДОКУМЕНТАЦИИ. ОСНОВНЫЕ ПОЛОЖЕНИЯ МУ 64-04-003-2002


"ИНФОРМАЦИЯ О ПРЕДПРИЯТИИ" (SITE MASTER FILE). СОДЕРЖАНИЕ ДОКУМЕНТА. 1. Общая информация I.I. Краткая информация о фирме (включая название и адрес), отношение к другим участкам и особенно любая информация, относящаяся к пониманию производственных операций. 1.2. Деятельность по производству фармацевтической продукции, лицензированная национальным уполномоченным органом. 1.3. Любая другая производственная деятельность, осуществляемая на участке. 1.4. Название и точный адрес участка, включая телефон, факс и номера телефонов, работающих круглосуточно. 1.5. Виды продукции, фактически производимой на участке (приложение ), и информация о любых особо токсичных или опасных веществах, используемых в работе, со ссылкой на способ их производства (с использованием специально предназначенных технических средств или на основании принципа проведения кампаний).

1.6. Краткое описание участка (размер, расположение, непосредственно окружающая его среда и другая производственная деятельность на участке). 1.7. Количество сотрудников, занятых в производстве, контроле качества, хранении и распределении (оптовой реализации). 1.8. Использование посторонней научной, аналитической или другой технической помощи, относящейся к производству и анализу (более подробно см. часть 7). 1.9. Краткое описание системы управления качеством фирмы, ответственной за производство.

2. Персонал 2.1. Организационная схема, в которой перечислены мероприятия по обеспечению качества, включая производство и контроль качества. 2.2. Квалификация, опыт и обязанности руководящего персонала. 2.3. Описание в общих чертах мероприятий по основному обучению и обучению на местах, по ведению протоколов. 2.4. Требования к здоровью персонала, занятого в производстве. 2.5. Гигиенические требования к персоналу, в частности к одежде.

3. Помещения и оборудование. 3.1. Простой план или описание производственных зон с указанием масштаба (архитектурные или инженерные чертежи не требуются). 3.2. Тип конструкции и отделки. 3.3. Краткое описание вентиляционных систем. Более подробное описание должно быть дано для критических зон с потенциальным риском контаминации с потоком воздуха (желательно приложить схематические чертежи систем). Должна быть указана классификация комнат для производства стерильных препаратов. 3.4. Специальные зоны для работы с высокотоксичными, опасными и сенсибилизирующими веществами. 3.5. Краткое описание систем водоснабжения (желательно приложить схематические чертежи систем), включая санитарную обработку.

3.6. Техническое обслуживание (описание программ планируемого профилактического обслуживания и системы его протоколирования). 3.7. Краткое описание основного технологического оборудования и оборудования контрольных лабораторий (перечень оборудования не требуется). 3.8. Техническое обслуживание (описание программ планируемого профилактического обслуживания и системы его протоколирования). 3.9. Квалификация и калибровка, включая систему протоколирования. Мероприятия по валидации компьютеризированных систем. 3.10. Наличие письменных спецификаций и методик по очистке производственных зон и оборудования.

4. Документация 4.1. Мероприятия по подготовке, пересмотру и распределению необходимой для производства документации. 4.2. Любая другая документация, относящаяся к качеству препарата, которая больше нигде не упоминается (например, микробиологический контроль воздуха и воды).

5. Технологический процесс 5.1. Краткое описание технологических процессов, прилагая, по возможности, технологические схемы, таблицы, в которых указаны важные параметры (приложение - перечень производимой продукции). 5.2. Мероприятия по работе с исходным сырьем, упаковочными материалами, нерасфасованной и готовой продукцией, включая отбор проб, карантин, выдачу разрешения на реализацию и хранение. 5.3. Мероприятия по работе с забракованным сырьем или продукцией. 5.4. Краткое описание общей политики относительно валидации процессов.

6. Контроль качества 6.1. Описание системы контроля качества и деятельности отдела контроля качества. Методики по выдаче разрешения на реализацию готовой продукции. 7. Производство и анализ по контракту 7.1. Описание способа оценки исполнителя на соответствие GMP. 8. Оптовая реализация, рекламации и отзыв продукции 8.1. Мероприятия по оптовой реализации и система протоколирования. 8.2. Мероприятия по работе с рекламациями (жалобами) и отзыву продукции. 9. Самоинспекция 9.1. Краткое описание системы самоинспекции.

Предприятие должно иметь следующие обязательные документы: “Информация о предприятии” (site master file). “Политика в области качества”. Фармакопейные статьи и/или нормативная документация (НД). Регламенты на все наименования лекарственных средств (ЛС), указанные в приложении к лицензии. Спецификации на все наименования лекарственных средств (ЛС), указанные в приложении к лицензии. Досье на продукты, включенные в Лицензию на производство. Стандарты предприятия (СП) и/или Стандартные операционные процедуры (СОП) . Досье на производство и/или упаковку серии. Заполняемые формы (протоколы, маршрутные карты, операционные листы, аналитические листы и др.). Программы (Планы). Отчеты. Паспорта.

Стандартные операционные процедуры (СОПы) Стандартная операционная процедура – это подробная письменная инструкция, касающаяся стандартных действий и/или операций, выполняемых на предприятии, и составленная по унифицированной форме (МУ 64-01-001-2002). Инструкция по отдельному виду деятельности – организационно-правовой документ, устанавливающий порядок действий сотрудника (категории сотрудников) при выполнении определенного вида работы (на каком-либо приборе, агрегате и т.п.). Стандартная рабочая методика - это детальные письменные инструкции, определяющие как надо проводить испытание или административную процедуру, или как пользоваться данным прибором или оборудованием.

Форма СОП (инструкции, методики) Обязательно наличие верхних и нижних колонтитулов Обязательная информация: наименование СОП, кол. страниц, версия, кем разработана, выдана, дата введения в действие, утверждающая подпись; цель издания СОП (почему эта инструкция написана, зачем ее необходимо выполнять); толкование терминов и определений, используемых в инструкции; область применения (когда и где необходимо выполнять инструкцию); ответственность (кому по должности инструкция относится и кто обязан контролировать выполнение);

Обязательная информация: материалы и оборудование (применяемое оснащение и оборудование полный перечень того, что необходимо для проведения испытания); методика (подробное описание процедуры: предварительные операции, последовательные операции, завершающие процедуры, техника безопасности, проведение вычислений); порядок отчета (куда заносить результаты, все отклонения от методики должны быть разрешены и запротоколированы, указать лицо, которому должны быть переданы окончательные результаты); ссылки (на источник информации, на другие СОПы, которые непосредственно связаны с этим документом); подписи (исполнитель, контролер).

Форма заполняемого бланка к СОП Должна содержать описание: подготовки к выполнению операции (перечень материалов; оборудования, включая специфические номера, если имеется выбор; сред; моющих растворов и др.); последовательные инструкции (представляются в том порядке в котором выполняется работа): краткие инструкции относительно мест, в которые необходимо вносить все данные; даты и время для всех операций, особенно для процедур выполняемых в течение нескольких дней; место для утверждающей подписи (для критических операций);

место для вычислений (если требуется); описание последовательности передачи проб промежуточной продукции для испытаний (при необходимости); правила хранения во время любого периода ожидания; критерии для повторного проведения испытания или процедуры; правила сообщений о любых проблемах или отклонениях; правила исправления ошибок (перечеркнуть, добавить правильную запись, подпись, стирание запрещается); подписи (исполнителя и контролера) и дата; правила подшивки и хранения заполненного бланка (где используется, копируется, хранится)

СОП должна отвечать следующим требованиям: Должна быть написана простым языком, быть немногословной; Быть содержательной; Должна быть учебным пособием для операторов, а также руководством по эксплуатации; Должно быть поэтапное описание методики (могут называться Основные рабочие методики, Общие рабочие методики, Стандартные методики проверки/тестирования); Общепринято, что СОП из-за общей направленности не предназначены для описания отдельных специфических для данного продукта операций (но есть исключения).

Типовая инструкция по отдельному виду деятельности (СОП) включает: Общие положения Действия сотрудника при подготовке к работе (к определенному виду работы или при подготовке прибора, агрегата к работе) Действия сотрудника при выполнении работы (определенного вида работы или при эксплуатации прибора, агрегата) Действия сотрудника по окончании работы Действия сотрудника в особых (чрезвычайных) ситуациях Заключительные положения

1. Общие положения Содержит краткую характеристику регламентированного вида деятельности (вида работы или процедуры работы на приборе, агрегате) с указанием цели данной деятельности и формы ее конечного результата (например готовая или промежуточная продукция)

2. Действия сотрудника при подготовке к работе Содержит перечень операций, которые сотрудник обязан выполнить до начала работы. При необходимости указывается также порядок регистрации результатов выполнения подготовительных операций. Особо оговариваются ситуации, при возникновении которых сотрудник не должен приступать к работе.

3. Действия сотрудника при выполнении работы Содержит перечень операций, которые сотрудник обязан выполнить в процессе работы. Особое внимание акцентируется на: Выполнении контрольных операций Обеспечении пригодности результатов работы к дальнейшему использованию Выполнении техники безопасности

4. Действия сотрудника по окончании работы Содержит перечень операций, которые сотрудник должен выполнить по окончании работы (запись данных в журнал или заполняемую форму, освобождение рабочего места от использованных материалов). Особо оговаривается порядок передачи рабочего места следующей смене.

5. Действия сотрудника в особых (чрезвычайных ситуациях) Содержит порядок действий сотрудника при возникновении в процессе работы нестандартных ситуаций. Особым образом оговариваются: Перечень мер безопасности и оборудования, которое может представлять опасность во время проведения технологической операции или во время нахождения в производственной зоне. Обеспечение безопасности сотрудника при возникновении (при действиях по предотвращению или устранению) чрезвычайных ситуаций Кого, в течение какого времени и каким образом сотрудник обязан проинформировать о случившемся Содержание действий, которые при возникновении чрезвычайной ситуации сотруднику выполнять запрещается

6. Заключительные положения Определяется спецификой вида деятельности и может включать в себя, например, порядок передачи готовой или промежуточной продукции в смежные подразделения. Также может быть предусмотрен порядок действия и времени пересмотра СОП

Требования, обязательные для СОПов инструкции должны быть тщательно разработаны, утверждены и распределены; должны утверждаться компетентными лицами; любое исправление должно быть завизировано ответственным лицом (утверждавшим документ ранее), а причина исправления должна быть отражена в досье на препарат;

содержание СОП не должно иметь двойного толкования; распределенные копии должны быть четкими и иметь цветную маркировку; оригинал инструкции должен иметь специальную маркировку, отличную от копий; СОПы должны регулярно пересматриваться с указанием даты пересмотра; должны быть меры для предотвращения применения устаревшей версии. Требования, обязательные для СОПов

СОП должны всегда отвечать на вопросы: Что должно быть сделано? Кто ответственный? Какие материалы (на каком оборудовании)? Когда? Как? Где?

Порядок разработки СОПов Первичный проект пишет руководитель или специалист, который хорошо знает данную работу. К составлению СОП рекомендуется (по возможности) привлекать конкретных исполнителей этих работ под руководством своего начальника. Т.о. решаются две задачи: Составляя инструкцию, исполнитель работ досконально осмысливает процесс производства на своем участке, что станет залогом вполне осознанного выполнения работы в процессе производства. Не менее значимо и то, что подготовка инструкции и обсуждение вопросов, связанных с этим - важнейший элемент системы обучения Обучение по СОПам проводится в период между их утверждением и вступлением в силу.

Перечень СОПов Для составления перечня СОПов следует проанализировать нормативные документы предприятия и документы, регламентирующие работу конкретного производственного подразделения. В первую очередь это технологические регламенты и ФСП.Составить перечень всех предусмотренных в них видов работ и контрольных процедур. Обязательный перечень стандартных операционных процедур - инструкций по отдельному виду деятельности включается в технологический регламент производства. Все СОПы могут подразделяться на Общие СОПы и Практические СОПы.

Протокол введения в действие СОП После согласования и утверждения инструкции составляется «Протокол введения в действие СОП», который передается в ООК контролеру документов. Он входит в систему документации и является обязательным. В Протоколе указывается: название предприятия название СОП код, номер версии наличие/отсутствие изменений дата введения в действие дата следующего пересмотра адреса распределения Ф.И.О. составителя, согласующего и утвердившего документ

Оформление листа распределения СОП Держателем «Листа распределения СОП» является Контролер документов отдела обеспечения качества. В нем регистрируется получение документа и его возврат при необходимости замены или внесения изменений В разделе регистрации распределения СОП указывают: порядковый номер копии; дату; подразделение; должность; Ф.И.О. и подпись получателя В разделе регистрации возврата СОП указывают: номер копии; дату возврата; должность; Ф.И.О. и подпись лица, сдавшего СОП.

Порядок внесения изменений в СОП Исполнитель работ или лицо, ответственное за исполнение работ на производственном участке составляет мотивированное предложение по внесению изменений. Предложение рассматривается с участием лиц, которые согласовывали и утверждали действующую версию инструкции Если принято решение о внесении в нее дополнений или изменений, составляется соответствующий протокол, который передается Контролеру документов.

Требования к документам на методики испытаний перечень параметров продукции, подвергаемой испытаниям, и характеристик условий испытаний с указанием номинальных значений и диапазонов измерений; значения характеристик погрешности результатов измерений и испытаний параметров продукции и характеристик условий испытаний, прописанных в данной методике; нормативы и процедуры оценивания воспроизводимости результатов испытаний; методики выполнения измерений параметров продукции и характеристик условий испытаний, если они включены в качестве составной части в методику испытаний;

требования к эталонам, средствам измерений, испытательному и вспомогательному оборудованию (либо указание их типов и характеристик), материалам и реактивам; операции подготовки, проведения испытаний, включая порядок отбора, подготовки и хранения образцов (проб) для испытаний, алгоритмы обработки данных испытаний и вычислений результатов измерений при испытаниях; требования к обеспечению безопасности выполняемых работ; требования к обеспечению экологической безопасности (при необходимости); требования к оформлению результатов испытаний; требования к квалификации персонала, проводящего испытания.

Требования к документам, регламентирующим программу испытаний перечень параметров продукции, подвергаемой испытаниям, и характеристик условий испытаний с указанием номинальных значений и диапазонов изменений; перечень документов на соответствие требованиям которых проводятся испытания; перечень документов, регламентирующих методики испытаний, последовательность и объем проводимых экспериментов; порядок, условия, место и сроки проведения испытаний; требования к характеристикам погрешности и воспроизводимости результатов измерений и испытаний;

перечень эталонов, средств измерений, испытательного и вспомогательного оборудования с указанием их типов и характеристик, материалов и реактивов; методику и порядок отбора, подготовки и хранения образцов (проб) для испытаний или ссылки на НД, регламентирующие методику и порядок обора, подготовки и хранения образцов (проб) для испытаний; алгоритмы обработки данных испытаний и вычислений результатов измерений при испытаниях; требования к оформлению результатов испытаний.

Результаты испытаний фиксируются в бланке/протоколе: наименование объекта испытаний, контролируемые при испытаниях характеристики свойств и параметров объекта; наименование и обозначение документа, регламентирующего методику испытаний; характеристики условий испытаний и внешних воздействующих факторов; результаты испытаний характеристик свойств и/или параметров объекта, характеристики погрешности полученных результатов, воспроизводимость результатов испытаний; наименования, основные характеристики эталонов и средств измерений, использованных при испытаниях; сведения о подразделении, где проводились испытания (реквизиты).

Заполняемые формы Заполняемая форма – это неотъемлемая часть всей документации, существующей на предприятии и принятой для обеспечения гарантии качества выпускаемой продукции. Заполняемая форма получается в результате унификации форм документов и выявления постоянной (повторяющейся) информации. Это форма представления текста в виде постоянных данных и пробелов, служащих для внесения переменной информации, характеризующей конкретную ситуацию.

Заполняемые формы Заполнение форм следует осуществлять в режиме реального времени, непосредственно в момент выполнения производственной процедуры. При ведении записей в заполняемых формах не следует допускать пропуска пунктов и строк. Рядом со всеми подписями должны быть проставлены даты. Заполняемыми формами могут быть следующие документы предприятия: протоколы, маршрутные карты, спецификации, аналитические листы, журналы, отчеты и др.

Протоколы Перед началом любого технологического процесса/процесса упаковки необходимо проверить и оформить протоколом, что оборудование и рабочее место очищены от предыдущего продукта, документации и материалов, не относящихся к планируемому процессу и, что само оборудование чистое и готово к использованию. При совершении любого действия во время проведения технологического процесса/процесса упаковки необходимо немедленно регистрировать всю информацию, которая после завершения процесса подписывается с указанием даты лицом, ответственным за выполнение данного процесса.

Протоколы технологического процесса/процесса упаковки наименование продукта/продукции; дата, время начала, завершения основных промежуточных этапов и окончания процесса; ФИО сотрудника, ответственного за проведение операций/стадий; ФИО операторов, выполнявших заключительные этапы изготовления/упаковки продукции; номер серии и/или номер анализа, количество взвешенных исходных материалов (включая номер серии и количество любых переработанных или регенерированных материалов) - для технол. процесса; проверка идентичности и соответствия инструкциям по упаковке, включая результаты технологического контроля - для упаковки;

подробности выполнения технологических операций/ операций по упаковке, включая ссылки на используемое оборудование и упаковочные линии; подробности выполнения всех операций по технологическому контролю (ФИО проводивших его лиц и полученные результаты) - для технол. процесса; по возможности образцы печатных упаковочных материалов, включая образцы простановки номера серии, даты изготовления и др. информации - для упаковки; количество продукции, полученное на разных этапах процесса - для технол. процесса; подробности любых отклонений с разрешением уполномоченного лица; количество и номера всех печатных упаковочных материалов и готовой продукции, которые были использованы, забракованы или возвращены на склад, для подведения баланса - для упаковки.

Протоколы лабораторного контроля описание образцов, полученных для проведения испытания, включая название материала, номер серии или код, дата отбора пробы, количество образца, дата его получения; описание каждого используемого метода испытаний или ссылку; указание количества образца, используемого для каждого испытания, в соответствии с описанным методом; данные о приготовлении и испытании СО, реактивов и стандартных растворов или ссылки; полные записи всех необработанных данных, получаемых в ходе каждого испытания, в дополнение к графикам, таблицам и спектрам, полученным с помощью лабораторных приборов;

все расчеты, выполненные в связи с проведением испытания, включая единицы измерения, коэффициенты пересчета, коэффициенты эквивалентности; изложения результатов испытаний и их соответствие установленным критериям приемлемости; подпись лица, проводившего каждое испытание, даты их проведения; дату и подпись второго лица, свидетельствующую, что подлинные протоколы были проверены в отношении точности, полноты и соответствия установленным стандартам.

Протоколы приемки наименование материала в накладной и обозначенное на упаковке; дату приемки; наименование поставщика и, по возможности производителя; номер серии производителя; общее количество полученных упаковок/контейнеров и их номера (если есть); номер серии или код, присвоенные после приемки; комментарии (например состояние упаковок/контейнеров).

Должны быть протоколы: валидации; сборке и калибровке оборудования; очистки и уборки оборудования; обслуживанию, уборке и санитарной обработке; работе с персоналом, включая его обучение, обеспечение одеждой и соблюдение правил личной гигиены; контролю окружающей среды; контролю на наличие паразитов; рекламациям; отзыву продукции; возврату продукции; и т.д.

Досье на продукт Должно содержать сведения о разработке, производстве, судьбе на рынке и усовершенствовании каждого конкретного продукта и включать в себя следующие документы или сведения об их местонахождении: Перечень прилагаемых документов Отчеты о разработке, доклинических и клинических испытаниях, пусковой регламент, опытно-промышленный регламент и т.д. Отчет о проблемах, возникавших при разработке и в процессе освоения производства Фармакопейная статья предприятия, спецификация на готовый продукт на момент выпуска

Спецификации на исходное сырье, вспомогательные, упаковочные и печатные материалы, инструкции (процедуры) на основные и вспомогательные операции технологического процесса, ссылка на местонахождение Досье на серию Спецификации на помещения, оборудование, инженерные системы, персонал и др. Отчеты о валидации Отчеты о проблемах текущего производства Протоколы регистрации рекламаций, отчеты о рекламациях и отзыве с рынка Годовой отчет по качеству

Досье на серию Досье на серию является основным документом, в котором регистрируется производство каждой серии каждого лекарственного средства. В качестве заполненных форм, формирующих досье на серию могут использоваться маршрутные карты. Маршрутная карта – документ, заполняемый при производстве каждой серии продукта и включающий в себя всю информацию для получения объективного доказательства о проделанной работе и достигнутых результатах на каждой производственной операции.

Досье на серию На каждую изготовленную серию д.б. собрано Досье. Оно д.б. основано на соответствующих частях действующих технологических инструкций и технологического регламента. В ходе технологического процесса во время каждого предпринимаемого действия вся информация д.б. запротоколирована. По завершении операций протокол д.б. согласован, датирован и подписан лицом, ответственным за технологический процесс.

Досье на серию обязательно при выдаче разрешения на передачу готовой продукции на склад для реализации Оно состоит из: Заполненных форм Документов, разрешающих использование сырья, вспомогательных, упаковочных и печатных материалов в производство Образцов этикеток, которые использовались для маркировки продуктов данной серии Плана (протокола) отбора проб Распечаток электронных весов и КИП, графиков автоматической регистрации контрольных параметров и т.п. Паспорта аналитического контроля на готовую продукцию Разрешения Уполномоченного лица на передачу готовой продукции на склад для реализации

Досье на серию включает: Наименование продукции; Даты и время начала процесса, основных промежуточных стадий и завершения производства; Ф.И.О. лица, ответственного за каждую стадию производства; Ф.И.О. операторов, ответственных за особо важные участки производства; Номер серии; Фактически отвешенное количество каждого исходного сырья (включая номер серии и количество любого добавленного регенерированного или переработанного сырья);

Любые относящиеся к делу производственные операции, а также использованное оборудование; Протокол контроля в процессе производства и Ф.И.О. лица, выполнившего его, а также полученные результаты; Выход продукции на различных стадиях производства; Подробные сведения об особых проблемах; Санкционированное подписью разрешение на любое отклонение от регламента и технологических инструкций. Досье на серию включает:

Досье на серию включает: Протоколы операций (стадий) процесса производства Протоколы операций (стадий) процесса упаковки серии продукта Протоколы приемки сырья и материалов Протоколы по отбору проб Протоколы контроля качества

Досье на производство или упаковку серии должны Составляться, заполняться и храниться для каждой серии Основываться на соответствующих инструкциях по производству и/или упаковке Иметь номер серии продукции, с которой были проведены какие-либо действия Содержать запись о том, что оборудование и рабочее место очищены от предыдущей продукции или серии продукции, документации и материалов, не относящихся к планируемому процессу, что оборудование чистое и готово к использованию

Позволять отслеживать все операции, влияющие на качество выпускаемой продукции Заполняться непосредственно при совершении любого действия, а после завершения процесса подписываться с указанием даты, лицом, ответственным за контроль выполнения данного процесса Храниться в течении, как минимум, одного года после окончания срока годности готового продукта

Программы (Планы) составляются на: валидацию/квалификацию; производство продукции; обучение персонала; проведение самоинспекции; корректирующие и предупреждающие действия; планово-предупредительные ремонты и профилактические мероприятия оборудования, инженерных систем, помещений и др.; поверку / калибровку средств измерений

Отчеты составляются по результатам: самоинспекции; валидации; разбора рекламаций; отзыва продукции; анализа изменений, отклонений, корректирующих и предупреждающих действий; годового отчета (обзора) по качеству.
122-6_dokumentaciya.ppt
- Количество слайдов: 89

