 Система оценок 1 Ответ на вопрос в начале лекции – 1 балл Придумать вопрос – 1 балл Доклад на заданную тему – 5 баллов Контрольная работа – 10 баллов Премия за лучший доклад по итогам голосования – 5 баллов Допуск к экзамену – 17 баллов Автомат « 5» - 32
Система оценок 1 Ответ на вопрос в начале лекции – 1 балл Придумать вопрос – 1 балл Доклад на заданную тему – 5 баллов Контрольная работа – 10 баллов Премия за лучший доклад по итогам голосования – 5 баллов Допуск к экзамену – 17 баллов Автомат « 5» - 32
 Тема для доклада: «Происхождение Земли» . 2 Вопросы по пройденному материалу: 1. Определение геохимии. 2. Зачем геофизику нужна геохимия? 3. Сколько лет геохимии?
Тема для доклада: «Происхождение Земли» . 2 Вопросы по пройденному материалу: 1. Определение геохимии. 2. Зачем геофизику нужна геохимия? 3. Сколько лет геохимии?
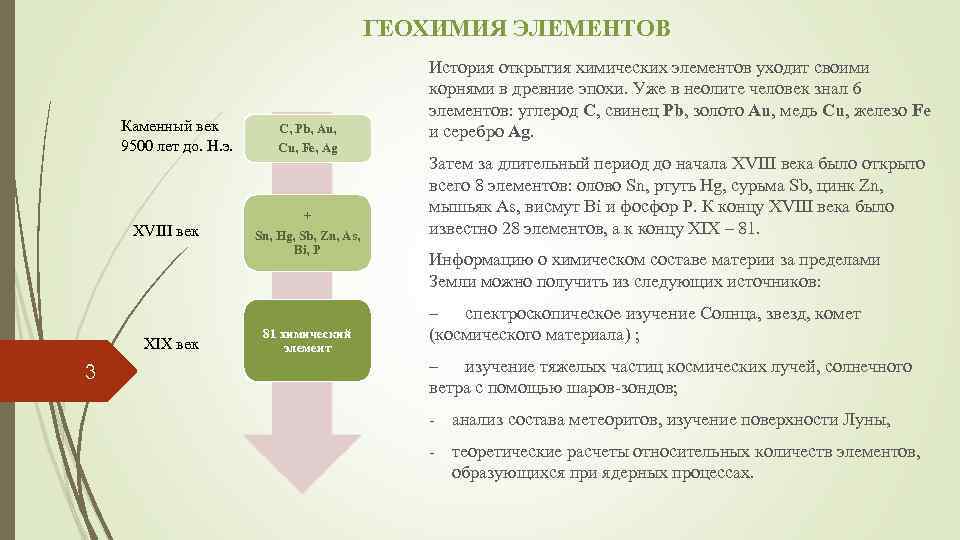 ГЕОХИМИЯ ЭЛЕМЕНТОВ Каменный век 9500 лет до. Н. э. XVIII век XIX век 3 С, Pb, Au, Cu, Fe, Ag + Sn, Hg, Sb, Zn, As, Bi, P 81 химический элемент История открытия химических элементов уходит своими корнями в древние эпохи. Уже в неолите человек знал 6 элементов: углерод С, свинец Pb, золото Au, медь Cu, железо Fe и серебро Ag. Затем за длительный период до начала XVIII века было открыто всего 8 элементов: олово Sn, ртуть Hg, сурьма Sb, цинк Zn, мышьяк As, висмут Bi и фосфор P. К концу XVIII века было известно 28 элементов, а к концу XIX – 81. Информацию о химическом составе материи за пределами Земли можно получить из следующих источников: – спектроскопическое изучение Солнца, звезд, комет (космического материала) ; – изучение тяжелых частиц космических лучей, солнечного ветра с помощью шаров-зондов; - анализ состава метеоритов, изучение поверхности Луны, - теоретические расчеты относительных количеств элементов, образующихся при ядерных процессах.
ГЕОХИМИЯ ЭЛЕМЕНТОВ Каменный век 9500 лет до. Н. э. XVIII век XIX век 3 С, Pb, Au, Cu, Fe, Ag + Sn, Hg, Sb, Zn, As, Bi, P 81 химический элемент История открытия химических элементов уходит своими корнями в древние эпохи. Уже в неолите человек знал 6 элементов: углерод С, свинец Pb, золото Au, медь Cu, железо Fe и серебро Ag. Затем за длительный период до начала XVIII века было открыто всего 8 элементов: олово Sn, ртуть Hg, сурьма Sb, цинк Zn, мышьяк As, висмут Bi и фосфор P. К концу XVIII века было известно 28 элементов, а к концу XIX – 81. Информацию о химическом составе материи за пределами Земли можно получить из следующих источников: – спектроскопическое изучение Солнца, звезд, комет (космического материала) ; – изучение тяжелых частиц космических лучей, солнечного ветра с помощью шаров-зондов; - анализ состава метеоритов, изучение поверхности Луны, - теоретические расчеты относительных количеств элементов, образующихся при ядерных процессах.
 4 Физики связывают эволюцию элементов с определенными реакциями, в которых из более простых ядер рождаются сложные. Эволюция элементов – результат определенной последовательности ядерных реакций, протекающих во Вселенной, где есть подходящие условия. Гипотезы образования химических элементов можно разделить на две группы. 1. Согласно первой группе гипотез все химические элементы образовались в течение нескольких минут из сверхплотной материи при расширении Вселенной путем ядерных реакций между элементарными частицами: протонами, нейтронами, электронами, позитронами, мезонами. 2. По другой группе гипотез образование химических элементов происходило в массивных звездах, в которых высокие температура и давление создали условия для ядерных реакций и превращения одних элементов в другие. Эта группа гипотез в настоящее время общепризнанна. Исходным материалом для построения всех элементов считается водород – господствующий элемент Вселенной. Для рождения атомных ядер необходим исходный материал и достаточное количество энергии. Гравитационные силы, сжимая вещество, могли разогреть водородный газ до температуры в несколько миллионов градусов. В ходе ядерных реакций он превращался в гелий. В дальнейшем природе предстояло создать из них элементы Периодической системы Д. И. Менделеева.
4 Физики связывают эволюцию элементов с определенными реакциями, в которых из более простых ядер рождаются сложные. Эволюция элементов – результат определенной последовательности ядерных реакций, протекающих во Вселенной, где есть подходящие условия. Гипотезы образования химических элементов можно разделить на две группы. 1. Согласно первой группе гипотез все химические элементы образовались в течение нескольких минут из сверхплотной материи при расширении Вселенной путем ядерных реакций между элементарными частицами: протонами, нейтронами, электронами, позитронами, мезонами. 2. По другой группе гипотез образование химических элементов происходило в массивных звездах, в которых высокие температура и давление создали условия для ядерных реакций и превращения одних элементов в другие. Эта группа гипотез в настоящее время общепризнанна. Исходным материалом для построения всех элементов считается водород – господствующий элемент Вселенной. Для рождения атомных ядер необходим исходный материал и достаточное количество энергии. Гравитационные силы, сжимая вещество, могли разогреть водородный газ до температуры в несколько миллионов градусов. В ходе ядерных реакций он превращался в гелий. В дальнейшем природе предстояло создать из них элементы Периодической системы Д. И. Менделеева.
 5 После начала синтеза элементов его продолжили гравитационные и ядерные силы. В сердцевине звезды выгорает водород (N-Процесс), падает давление, новое гравитационное сжатие поднимает температуру еще выше – до 100 млн °С (Н-Процесс). При такой температуре роль топлива продолжил вновь образованный из водорода гелий. Ядра гелия приобретали энергию, достаточную для преодоления более высокого, чем у протона водорода, электростатического барьера – α-частицы (Не-Процесс): 3 4 Не → 12 С + γ. Ядра элементов, захватывая α-частицы, создавали новые химические элементы (С-, ОПроцессы) до железа включительно: 12 С + 4 Не → 16 О, 16 О + 4 Не → 2 Ne, 20 Ne + 4 Нe → 24 Mg.
5 После начала синтеза элементов его продолжили гравитационные и ядерные силы. В сердцевине звезды выгорает водород (N-Процесс), падает давление, новое гравитационное сжатие поднимает температуру еще выше – до 100 млн °С (Н-Процесс). При такой температуре роль топлива продолжил вновь образованный из водорода гелий. Ядра гелия приобретали энергию, достаточную для преодоления более высокого, чем у протона водорода, электростатического барьера – α-частицы (Не-Процесс): 3 4 Не → 12 С + γ. Ядра элементов, захватывая α-частицы, создавали новые химические элементы (С-, ОПроцессы) до железа включительно: 12 С + 4 Не → 16 О, 16 О + 4 Не → 2 Ne, 20 Ne + 4 Нe → 24 Mg.
 6 В итоге можно заключить, что в синтезе химических элементов участвуют следующие космические процессы, которые обозначаются буквами латинского алфавита. 1. N – горение водорода при высоких температурах. 2. Н – сгорание водорода с образованием Не. 3. Не – горение Не с образованием 12 С, 16 О, 20 Nе. Процессы с αчастицами, при которых образуются 24 Mg, 28 Si, 32 S, 36 Ar, 40 Ca, в результате последовательного захвата α-частиц ядрами 16 O и 20 Ne. 4. С – взрывное горение углерода. 5. О – взрывное горение кислорода. 6. Si – взрывное горение кремния. 7. n – обогащение нейтронами продуктов горения кремния. 8. е-Процесс равновесный – статическое равновесие между ядрами, протонами и нейтронами при высокой температуре, объясняющее пик распространенности для Fe. 9. s-Процесс медленного захвата нейтронов с образованием элементов до 209 Вi включительно. 10. r-Процесс быстрого захвата нейтронов с образованием элементов до 254 Cf. 11. р-Процесс образования богатых протонами ядер. 12. х-Процесс с образованием Li, Вe и В путем взаимодействия космических лучей с атомными ядрами межзвездной среды. 13. U-Процесс космологического нуклеосинтеза до образования звезд.
6 В итоге можно заключить, что в синтезе химических элементов участвуют следующие космические процессы, которые обозначаются буквами латинского алфавита. 1. N – горение водорода при высоких температурах. 2. Н – сгорание водорода с образованием Не. 3. Не – горение Не с образованием 12 С, 16 О, 20 Nе. Процессы с αчастицами, при которых образуются 24 Mg, 28 Si, 32 S, 36 Ar, 40 Ca, в результате последовательного захвата α-частиц ядрами 16 O и 20 Ne. 4. С – взрывное горение углерода. 5. О – взрывное горение кислорода. 6. Si – взрывное горение кремния. 7. n – обогащение нейтронами продуктов горения кремния. 8. е-Процесс равновесный – статическое равновесие между ядрами, протонами и нейтронами при высокой температуре, объясняющее пик распространенности для Fe. 9. s-Процесс медленного захвата нейтронов с образованием элементов до 209 Вi включительно. 10. r-Процесс быстрого захвата нейтронов с образованием элементов до 254 Cf. 11. р-Процесс образования богатых протонами ядер. 12. х-Процесс с образованием Li, Вe и В путем взаимодействия космических лучей с атомными ядрами межзвездной среды. 13. U-Процесс космологического нуклеосинтеза до образования звезд.
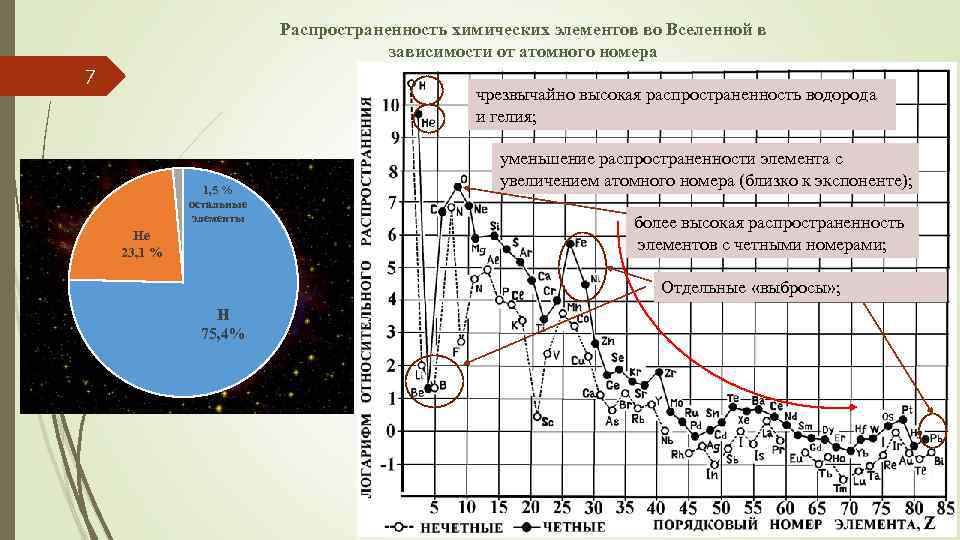 Распространенность химических элементов во Вселенной в зависимости от атомного номера 7 чрезвычайно высокая распространенность водорода и гелия; 1, 5 % остальные элементы He 23, 1 % уменьшение распространенности элемента с увеличением атомного номера (близко к экспоненте); более высокая распространенность элементов с четными номерами; Отдельные «выбросы» ; H 75, 4%
Распространенность химических элементов во Вселенной в зависимости от атомного номера 7 чрезвычайно высокая распространенность водорода и гелия; 1, 5 % остальные элементы He 23, 1 % уменьшение распространенности элемента с увеличением атомного номера (близко к экспоненте); более высокая распространенность элементов с четными номерами; Отдельные «выбросы» ; H 75, 4%
 8 Особенности распределения химических элементов во Вселенной чрезвычайно высокая распространенность водорода и гелия; тенденция уменьшения распространенности элемента с увеличением атомного номера; более высокая распространенность элементов с четными номерами; отдельные резкие “выбросы”, например, относительно низкую распространенность лития, бериллия и бора и относительно высокую – железа, никеля и свинца.
8 Особенности распределения химических элементов во Вселенной чрезвычайно высокая распространенность водорода и гелия; тенденция уменьшения распространенности элемента с увеличением атомного номера; более высокая распространенность элементов с четными номерами; отдельные резкие “выбросы”, например, относительно низкую распространенность лития, бериллия и бора и относительно высокую – железа, никеля и свинца.
 Состав планет земной группы 9 Планета Среднее расстояние от Солнца, млн. км Масса относит. Земли Доля массы ядра планеты, % Главные элементы (в порядке убывания) Меркурий 57, 91 0, 054 91 Fe, Ni Венера 108, 21 0, 915 35 Fe, O, Si, Mg, Al Земля 149, 60 1, 0 32, 5 O, Fe, Si, Mg, Al Марс 227, 94 0, 107 15 O, Si, Mg, Fe
Состав планет земной группы 9 Планета Среднее расстояние от Солнца, млн. км Масса относит. Земли Доля массы ядра планеты, % Главные элементы (в порядке убывания) Меркурий 57, 91 0, 054 91 Fe, Ni Венера 108, 21 0, 915 35 Fe, O, Si, Mg, Al Земля 149, 60 1, 0 32, 5 O, Fe, Si, Mg, Al Марс 227, 94 0, 107 15 O, Si, Mg, Fe
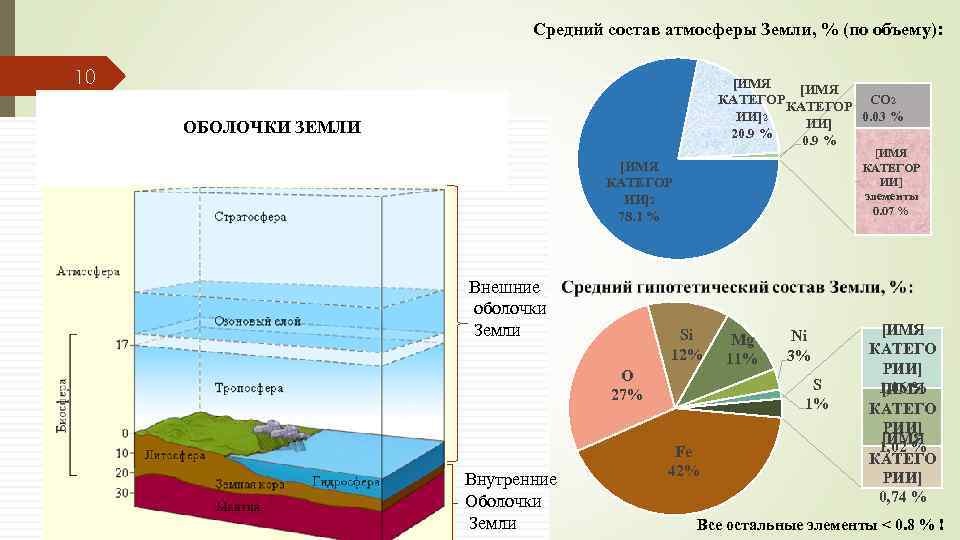 Средний состав атмосферы Земли, % (по объему): 10 [ИМЯ КАТЕГОР СО 2 0. 03 % ИИ]2 ИИ] 20. 9 % ОБОЛОЧКИ ЗЕМЛИ [ИМЯ КАТЕГОР ИИ] элементы 0. 07 % [ИМЯ КАТЕГОР ИИ]2 78. 1 % Внешние оболочки Земли Si 12% O 27% Внутренние Оболочки Земли Mg 11% Ni 3% S 1% Fe 42% [ИМЯ КАТЕГО РИИ] 1, 06 % [ИМЯ КАТЕГО РИИ] [ИМЯ 1, 02 % КАТЕГО РИИ] 0, 74 % Все остальные элементы < 0. 8 % !
Средний состав атмосферы Земли, % (по объему): 10 [ИМЯ КАТЕГОР СО 2 0. 03 % ИИ]2 ИИ] 20. 9 % ОБОЛОЧКИ ЗЕМЛИ [ИМЯ КАТЕГОР ИИ] элементы 0. 07 % [ИМЯ КАТЕГОР ИИ]2 78. 1 % Внешние оболочки Земли Si 12% O 27% Внутренние Оболочки Земли Mg 11% Ni 3% S 1% Fe 42% [ИМЯ КАТЕГО РИИ] 1, 06 % [ИМЯ КАТЕГО РИИ] [ИМЯ 1, 02 % КАТЕГО РИИ] 0, 74 % Все остальные элементы < 0. 8 % !
 Строение Земли 11 Плотность вещества Земли (г/см 3) Глубина, км Плотность (Птицын, 2006) до 60 60 1200 2400 до 2900 ниже 2900 6370 2, 7 3, 3 4, 7 5, 7 9, 7 12, 2
Строение Земли 11 Плотность вещества Земли (г/см 3) Глубина, км Плотность (Птицын, 2006) до 60 60 1200 2400 до 2900 ниже 2900 6370 2, 7 3, 3 4, 7 5, 7 9, 7 12, 2
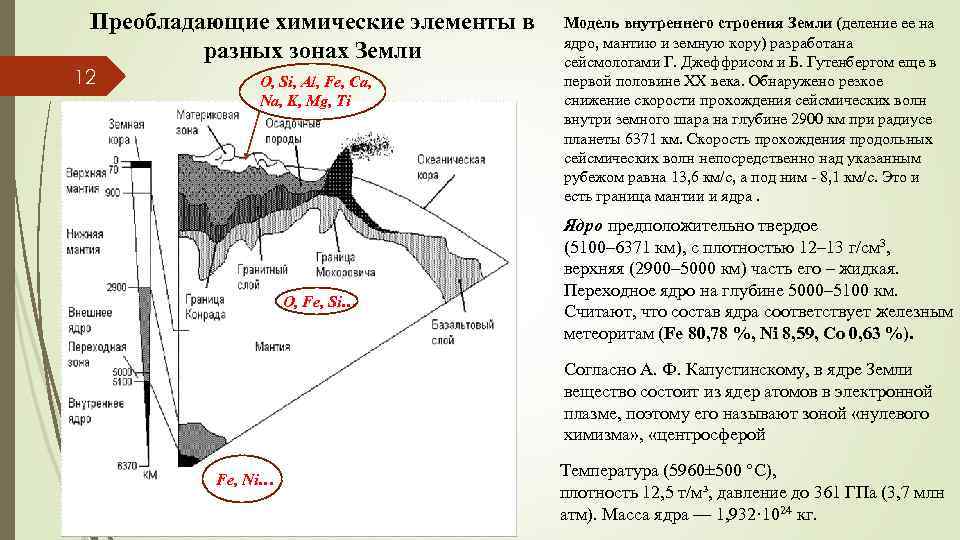 Преобладающие химические элементы в разных зонах Земли 12 O, Si, Al, Fe, Ca, Na, K, Mg, Ti O, Fe, Si… Модель внутреннего строения Земли (деление ее на ядро, мантию и земную кору) разработана сейсмологами Г. Джеффрисом и Б. Гутенбергом еще в первой половине XX века. Обнаружено резкое снижение скорости прохождения сейсмических волн внутри земного шара на глубине 2900 км при радиусе планеты 6371 км. Скорость прохождения продольных сейсмических волн непосредственно над указанным рубежом равна 13, 6 км/с, а под ним - 8, 1 км/с. Это и есть граница мантии и ядра. Ядро предположительно твердое (5100– 6371 км), с плотностью 12– 13 г/см 3, верхняя (2900– 5000 км) часть его – жидкая. Переходное ядро на глубине 5000– 5100 км. Считают, что состав ядра соответствует железным метеоритам (Fe 80, 78 %, Ni 8, 59, Co 0, 63 %). Согласно А. Ф. Капустинскому, в ядре Земли вещество состоит из ядер атомов в электронной плазме, поэтому его называют зоной «нулевого химизма» , «центросферой Fe, Ni… Температура (5960± 500 °C), плотность 12, 5 т/м³, давление до 361 ГПа (3, 7 млн атм). Масса ядра — 1, 932· 1024 кг.
Преобладающие химические элементы в разных зонах Земли 12 O, Si, Al, Fe, Ca, Na, K, Mg, Ti O, Fe, Si… Модель внутреннего строения Земли (деление ее на ядро, мантию и земную кору) разработана сейсмологами Г. Джеффрисом и Б. Гутенбергом еще в первой половине XX века. Обнаружено резкое снижение скорости прохождения сейсмических волн внутри земного шара на глубине 2900 км при радиусе планеты 6371 км. Скорость прохождения продольных сейсмических волн непосредственно над указанным рубежом равна 13, 6 км/с, а под ним - 8, 1 км/с. Это и есть граница мантии и ядра. Ядро предположительно твердое (5100– 6371 км), с плотностью 12– 13 г/см 3, верхняя (2900– 5000 км) часть его – жидкая. Переходное ядро на глубине 5000– 5100 км. Считают, что состав ядра соответствует железным метеоритам (Fe 80, 78 %, Ni 8, 59, Co 0, 63 %). Согласно А. Ф. Капустинскому, в ядре Земли вещество состоит из ядер атомов в электронной плазме, поэтому его называют зоной «нулевого химизма» , «центросферой Fe, Ni… Температура (5960± 500 °C), плотность 12, 5 т/м³, давление до 361 ГПа (3, 7 млн атм). Масса ядра — 1, 932· 1024 кг.
 13 Нижняя мантия (слой 1000– 2900 км) считается силикатно-сульфидной. Ее химический состав соответствует каменным метеоритам: О – 35 %, Fe – 25, Si – 18, Mg – 14, S – 2, Ca – 1, 4, Al – 1, 3, Ni – 1, 35, Na – 0, 7, Cr – 0, 25, Mn – 0, 20 %. Переходная зона (слой С 400– 1000 км) имеет, возможно, силикатно-магнезиальный состав. Ее большую плотность объясняют формированием минералов с более плотной упаковкой (стишовит, шпинель, периклаз и др. ). Основным компонентом допускается оливин Mg 2 Si. O 4. Верхняя мантия (слой В от 30 до 400 км) считается неоднородной по элементарному и изотопному составу. Ряд авторов приравниают ее состав к хондритам. На глубине до 200 км расположен мягкий пластичный слой с пониженной скоростью распространения сейсмических волн, получивший название астеносферы. Она выражена в складчатых областях (осадочные отложения) и практически отсутствует на платформах. Считается, что перемещение вещества в астеносфере – причина вулканизма и тектонических подвижек. Масса мантии составляет 67, 8 % от общей массы Земли.
13 Нижняя мантия (слой 1000– 2900 км) считается силикатно-сульфидной. Ее химический состав соответствует каменным метеоритам: О – 35 %, Fe – 25, Si – 18, Mg – 14, S – 2, Ca – 1, 4, Al – 1, 3, Ni – 1, 35, Na – 0, 7, Cr – 0, 25, Mn – 0, 20 %. Переходная зона (слой С 400– 1000 км) имеет, возможно, силикатно-магнезиальный состав. Ее большую плотность объясняют формированием минералов с более плотной упаковкой (стишовит, шпинель, периклаз и др. ). Основным компонентом допускается оливин Mg 2 Si. O 4. Верхняя мантия (слой В от 30 до 400 км) считается неоднородной по элементарному и изотопному составу. Ряд авторов приравниают ее состав к хондритам. На глубине до 200 км расположен мягкий пластичный слой с пониженной скоростью распространения сейсмических волн, получивший название астеносферы. Она выражена в складчатых областях (осадочные отложения) и практически отсутствует на платформах. Считается, что перемещение вещества в астеносфере – причина вулканизма и тектонических подвижек. Масса мантии составляет 67, 8 % от общей массы Земли.
 14 Граница Мохоровичича – граница между корой и мантией - по одной гипотезе разделяет химически разные слои, по другой – это поверхность фазового перехода, но она не исключает наличия химической границы. На ней происходит резкое увеличение сейсмических скоростей — от 7 до 8— 8, 2 км/с. Литосфера (слой А от 0 до 30– 70 км) залегает выше астеносферы и у поверхности в зоне окисления называется корой выветривания. По изменению скорости сейсмических волн литосферу делят на верхнюючасть (гранитный слой) и нижнюю часть более тяжелую (базальтовый слой). Их разделяет поверхность Конрада. Причины, вызвавшие разделение литосферы и мантии, пока неясны. Считается, что часть мантии, сформировавшейся в результате низкотемпературной аккреции космической пыли, претерпела вторичное расплавление под воздействием тепла, генерируемого радиоактивными элементами. В результате этого вещество с малым удельным весом постепенно переместилось к внешней поверхности Земли. Эти породы имеют менее плотную упаковку и обогащены U, Th и 40 К. Дифференциация вещества Земли привела к концентрации относительно легких и легкоплавких алюмосиликатов щелочных металлов на поверхности.
14 Граница Мохоровичича – граница между корой и мантией - по одной гипотезе разделяет химически разные слои, по другой – это поверхность фазового перехода, но она не исключает наличия химической границы. На ней происходит резкое увеличение сейсмических скоростей — от 7 до 8— 8, 2 км/с. Литосфера (слой А от 0 до 30– 70 км) залегает выше астеносферы и у поверхности в зоне окисления называется корой выветривания. По изменению скорости сейсмических волн литосферу делят на верхнюючасть (гранитный слой) и нижнюю часть более тяжелую (базальтовый слой). Их разделяет поверхность Конрада. Причины, вызвавшие разделение литосферы и мантии, пока неясны. Считается, что часть мантии, сформировавшейся в результате низкотемпературной аккреции космической пыли, претерпела вторичное расплавление под воздействием тепла, генерируемого радиоактивными элементами. В результате этого вещество с малым удельным весом постепенно переместилось к внешней поверхности Земли. Эти породы имеют менее плотную упаковку и обогащены U, Th и 40 К. Дифференциация вещества Земли привела к концентрации относительно легких и легкоплавких алюмосиликатов щелочных металлов на поверхности.
 Распространенность химических элементов в земной коре (Барабанов, 1985) 15 Содержание, г/т Химические элементы 0, 001 – 0, 01 Re, Os, Ir, Ru, Rh, Te, Pt, He, Au, Pd 0, 01 – 0, 1 Ar, Se, Ag, Hg 0, 1 – 1, 0 Cd, Bi, In, I, Sb, Lu 1, 0 – 10, 0 Eu, Dy, Ho, Er, Yb, Hf, Ta, W, Tl, U, Ge, As, Br, Mo, Sn, Cs, Pr, Sm, Be 10, 0 – 100, 0 Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc, V, Cr, Co, Ni, Cu, Zn, Ga 100, 0 – 1000, 0 C, F, P, S, Cl, Rb, Sr, Zr, Ba 1000, 0 10000, 0 – Mn, Ti O, Si, Al, Fe, Ca, Mg, Na, K = 1 ppm (part per million) = 10 -4 % 10000 г/т = 10000 * 10 -4 % = 1 %
Распространенность химических элементов в земной коре (Барабанов, 1985) 15 Содержание, г/т Химические элементы 0, 001 – 0, 01 Re, Os, Ir, Ru, Rh, Te, Pt, He, Au, Pd 0, 01 – 0, 1 Ar, Se, Ag, Hg 0, 1 – 1, 0 Cd, Bi, In, I, Sb, Lu 1, 0 – 10, 0 Eu, Dy, Ho, Er, Yb, Hf, Ta, W, Tl, U, Ge, As, Br, Mo, Sn, Cs, Pr, Sm, Be 10, 0 – 100, 0 Pb, Th, Y, Nb, La, Ce, Nd, Li, B, N, Sc, V, Cr, Co, Ni, Cu, Zn, Ga 100, 0 – 1000, 0 C, F, P, S, Cl, Rb, Sr, Zr, Ba 1000, 0 10000, 0 – Mn, Ti O, Si, Al, Fe, Ca, Mg, Na, K = 1 ppm (part per million) = 10 -4 % 10000 г/т = 10000 * 10 -4 % = 1 %
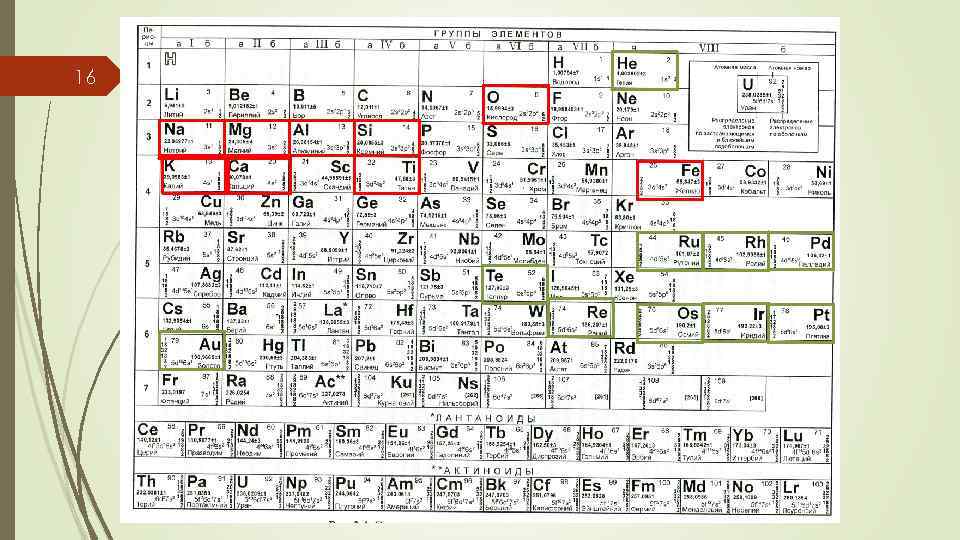 16
16
 17
17
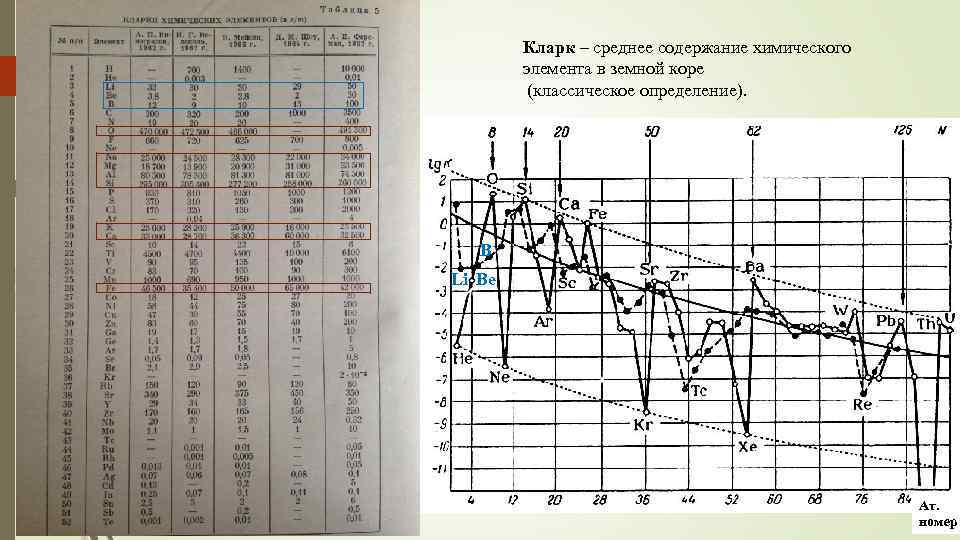 Кларк – среднее содержание химического элемента в земной коре (классическое определение). 18 B Li Be Ат. номер
Кларк – среднее содержание химического элемента в земной коре (классическое определение). 18 B Li Be Ат. номер
 19 1. Содержание O (самого распространенного) в 1. 5 *1015 раз больше содержания Po (менее распр. ). Cодержание химических элементов в з. к. очень неодинаково! 2. Наиболее распространены элементы с небольшими порядковыми номерами (малыми атомными весами). Распространенность убывает с увеличением порядкового номера. Первые 26 элементов – 99, 74 % всей земной коры. 3. Очень легкие элементы – Li, Be, B и отчасти С обладают очень малой распространенностью, так как в космическую стадию послужили ядерным горючим. Из тяжелых элементов повышенную распространенность имеют Ba, La, Ce, Nd, Gd, Pb. Высокое содержание свинца, например, связано с тем, что он состоит не толькоо из первозданного свинца, но и из атомов, образовавшихся в результате радиоактивного распада урана и тория. 4. Элементы с четными порядковыми номерами более распространены (86 % по весу), чем с нечетными (закон Оддо и Харкинса). Есть исключения (К(As 33) > К Ge 32). 5. Среди четных элементов наибольшим кларком обладает каждый шестой: № 8 – О; № 14 – Si; № 20 – Ca; № 26 – Fe; № 32 – Ge; № 38 –Sr и т. д. Аналогичное правило среди нечетных элементов, начиная с № 13 – Al; № 19 – K; № 25 – Mg и т. д
19 1. Содержание O (самого распространенного) в 1. 5 *1015 раз больше содержания Po (менее распр. ). Cодержание химических элементов в з. к. очень неодинаково! 2. Наиболее распространены элементы с небольшими порядковыми номерами (малыми атомными весами). Распространенность убывает с увеличением порядкового номера. Первые 26 элементов – 99, 74 % всей земной коры. 3. Очень легкие элементы – Li, Be, B и отчасти С обладают очень малой распространенностью, так как в космическую стадию послужили ядерным горючим. Из тяжелых элементов повышенную распространенность имеют Ba, La, Ce, Nd, Gd, Pb. Высокое содержание свинца, например, связано с тем, что он состоит не толькоо из первозданного свинца, но и из атомов, образовавшихся в результате радиоактивного распада урана и тория. 4. Элементы с четными порядковыми номерами более распространены (86 % по весу), чем с нечетными (закон Оддо и Харкинса). Есть исключения (К(As 33) > К Ge 32). 5. Среди четных элементов наибольшим кларком обладает каждый шестой: № 8 – О; № 14 – Si; № 20 – Ca; № 26 – Fe; № 32 – Ge; № 38 –Sr и т. д. Аналогичное правило среди нечетных элементов, начиная с № 13 – Al; № 19 – K; № 25 – Mg и т. д
 20 6. Ведущие элементы определяют геохимические особенности системы и выступают в роли типоморфных элементов или геохимических диктаторов. 7. Редкие элементы мигрируют интенсивнее, чем близкие им по химическим свойствам более распространенные. Поэтому редкие анионы (Cr. O 42–, Se. O 42–) соединяются с распространенными катионами (Ca, Mg, Fe) и наоборот. 8. Число минеральных видов элемента уменьшается с уменьшением его кларка. При величине кларка от 1 до 10 % элемент может образовывать до 239 соединений, при кларке 10– 5– 10– 6 % – всего до 23 минеральных видов. Способность элементов к минералообразованию (М) определяются отношением числа минералов (n) данного элемента к его кларку (К) в земной коре: 1. М = n / К. По Е. М. Квятковскому, элементы с большой способностью к минералообразованию называются минералофильными (Si, C, Fe, Bi, Te, Se, U, S), с малой – минералофобными (Mg, Ba, Ga, Rb, Sr, In, Tl, TR).
20 6. Ведущие элементы определяют геохимические особенности системы и выступают в роли типоморфных элементов или геохимических диктаторов. 7. Редкие элементы мигрируют интенсивнее, чем близкие им по химическим свойствам более распространенные. Поэтому редкие анионы (Cr. O 42–, Se. O 42–) соединяются с распространенными катионами (Ca, Mg, Fe) и наоборот. 8. Число минеральных видов элемента уменьшается с уменьшением его кларка. При величине кларка от 1 до 10 % элемент может образовывать до 239 соединений, при кларке 10– 5– 10– 6 % – всего до 23 минеральных видов. Способность элементов к минералообразованию (М) определяются отношением числа минералов (n) данного элемента к его кларку (К) в земной коре: 1. М = n / К. По Е. М. Квятковскому, элементы с большой способностью к минералообразованию называются минералофильными (Si, C, Fe, Bi, Te, Se, U, S), с малой – минералофобными (Mg, Ba, Ga, Rb, Sr, In, Tl, TR).
 21 Распространенность химических элементов в Земле обусловлена устойчивостью их ядер. Вопрос этот достаточно подробно рассмотрен В. Ф. Барабановым в его учебнике «Геохимия» (1985). Соотношение протонов и нейтронов для устойчивых ядер с относительно небольшим атомным числом (до 40) равно 1. Далее с увеличением атомного числа происходит рост сил кулоновского отталкивания и для сохранения устойчивости ядра требуется вовлечение дополнительного числа нейтронов. Например, у свинца их уже 44. Элементы с атомным номером более 83 становятся неустойчивыми, радиоактивными, несмотря на увеличение числа нейтронов. При прочих равных условиях наиболее устойчивыми оказываются ядра с четным числом протонов и нейтронов. Это подтверждается распределением по этому признаку числа стабильных изотопов (Барабанов, 1985). В этой группе выделяются элементы с особо устойчивыми ядрами, которые характеризуются так называемыми «магическими числами» : 2, 8, 20, 28, 50, 82 и 126. Это может быть число протонов или нейтронов. Ряд магических ядер выглядит так Элементы, имеющие магические числа и протонов, и нейтронов, называются дважды магическими (He, O, Ca, Pb). АТОМ Атомная масса А = число нейтронов N + число протонов Р Число протонов Р = атомному номеру Z = число электронов)
21 Распространенность химических элементов в Земле обусловлена устойчивостью их ядер. Вопрос этот достаточно подробно рассмотрен В. Ф. Барабановым в его учебнике «Геохимия» (1985). Соотношение протонов и нейтронов для устойчивых ядер с относительно небольшим атомным числом (до 40) равно 1. Далее с увеличением атомного числа происходит рост сил кулоновского отталкивания и для сохранения устойчивости ядра требуется вовлечение дополнительного числа нейтронов. Например, у свинца их уже 44. Элементы с атомным номером более 83 становятся неустойчивыми, радиоактивными, несмотря на увеличение числа нейтронов. При прочих равных условиях наиболее устойчивыми оказываются ядра с четным числом протонов и нейтронов. Это подтверждается распределением по этому признаку числа стабильных изотопов (Барабанов, 1985). В этой группе выделяются элементы с особо устойчивыми ядрами, которые характеризуются так называемыми «магическими числами» : 2, 8, 20, 28, 50, 82 и 126. Это может быть число протонов или нейтронов. Ряд магических ядер выглядит так Элементы, имеющие магические числа и протонов, и нейтронов, называются дважды магическими (He, O, Ca, Pb). АТОМ Атомная масса А = число нейтронов N + число протонов Р Число протонов Р = атомному номеру Z = число электронов)
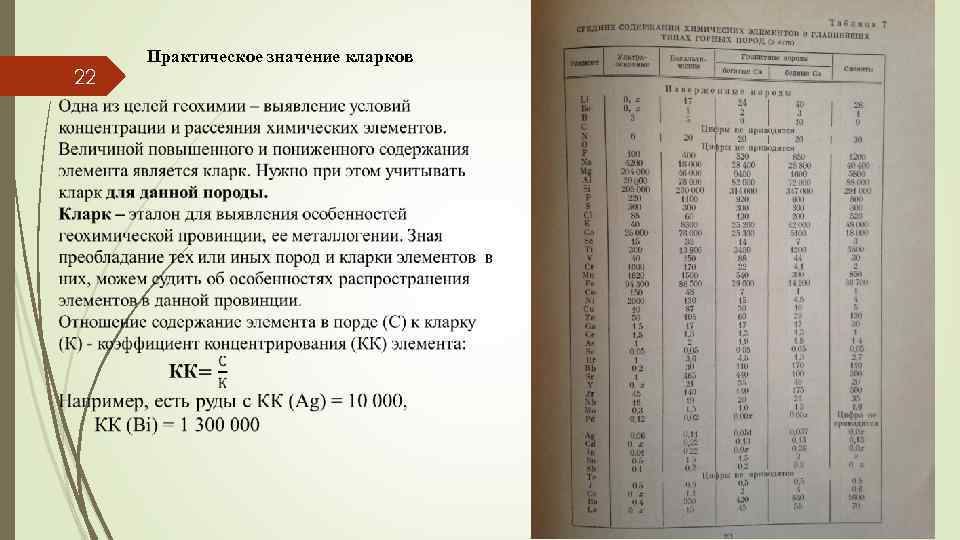 22 Практическое значение кларков
22 Практическое значение кларков
 23 Подвижность химических элементов в геохимических системах определяется конкретным сочетанием внутренних и внешних факторов миграции.
23 Подвижность химических элементов в геохимических системах определяется конкретным сочетанием внутренних и внешних факторов миграции.
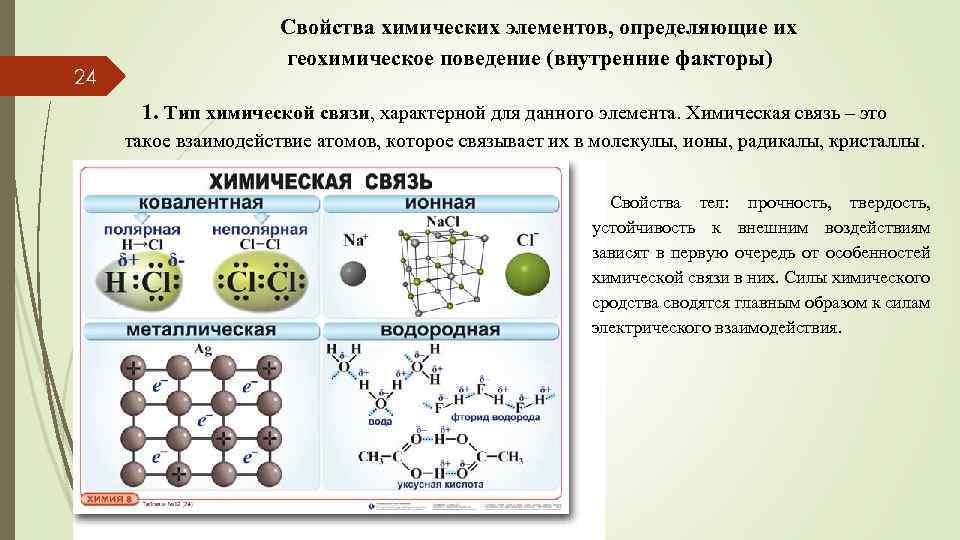 24 Свойства химических элементов, определяющие их геохимическое поведение (внутренние факторы) 1. Тип химической связи, характерной для данного элемента. Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Свойства тел: прочность, твердость, устойчивость к внешним воздействиям зависят в первую очередь от особенностей химической связи в них. Силы химического сродства сводятся главным образом к силам электрического взаимодействия.
24 Свойства химических элементов, определяющие их геохимическое поведение (внутренние факторы) 1. Тип химической связи, характерной для данного элемента. Химическая связь – это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы. Свойства тел: прочность, твердость, устойчивость к внешним воздействиям зависят в первую очередь от особенностей химической связи в них. Силы химического сродства сводятся главным образом к силам электрического взаимодействия.
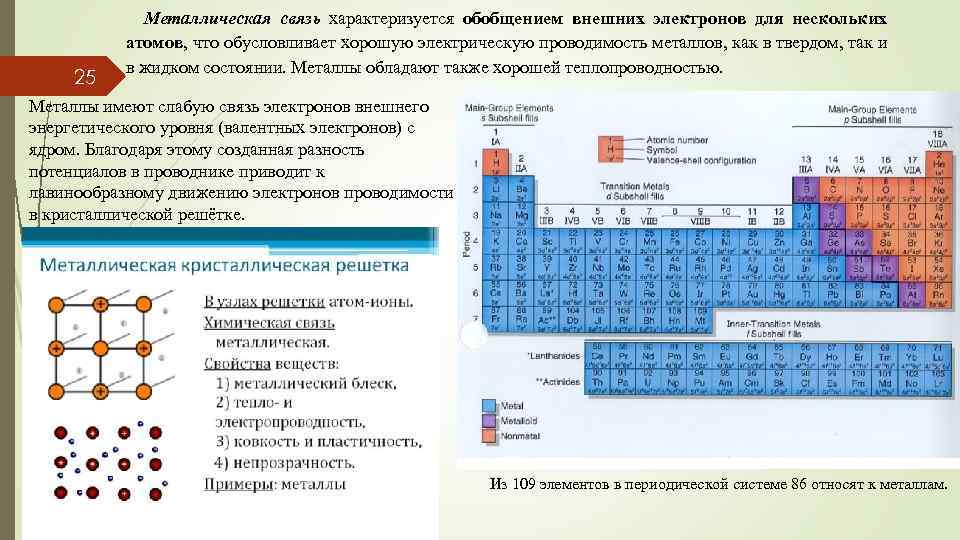 25 Металлическая связь характеризуется обобщением внешних электронов для нескольких атомов, что обусловливает хорошую электрическую проводимость металлов, как в твердом, так и в жидком состоянии. Металлы обладают также хорошей теплопроводностью. Металлы имеют слабую связь электронов внешнего энергетического уровня (валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов проводимости в кристаллической решётке. Из 109 элементов в периодической системе 86 относят к металлам.
25 Металлическая связь характеризуется обобщением внешних электронов для нескольких атомов, что обусловливает хорошую электрическую проводимость металлов, как в твердом, так и в жидком состоянии. Металлы обладают также хорошей теплопроводностью. Металлы имеют слабую связь электронов внешнего энергетического уровня (валентных электронов) с ядром. Благодаря этому созданная разность потенциалов в проводнике приводит к лавинообразному движению электронов проводимости в кристаллической решётке. Из 109 элементов в периодической системе 86 относят к металлам.
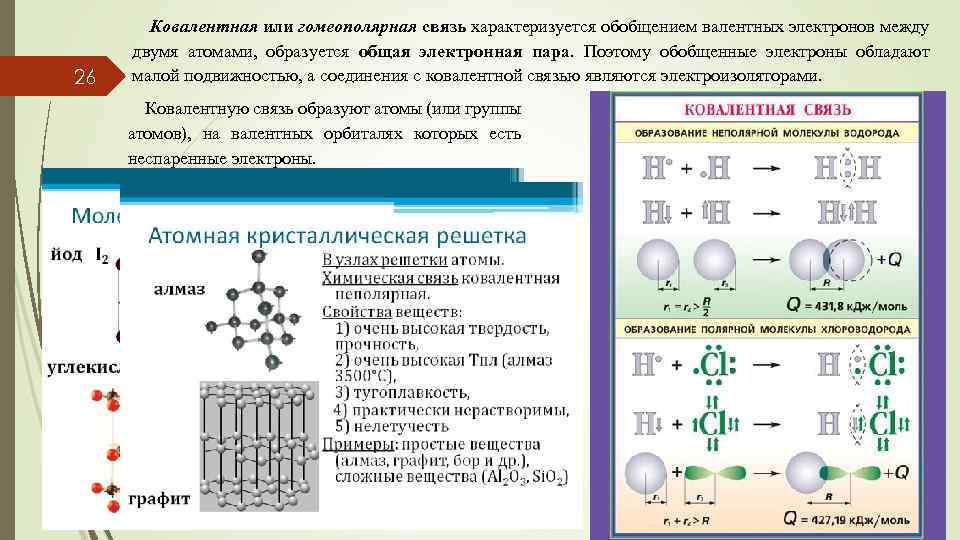 26 Ковалентная или гомеополярная связь характеризуется обобщением валентных электронов между двумя атомами, образуется общая электронная пара. Поэтому обобщенные электроны обладают малой подвижностью, а соединения с ковалентной связью являются электроизоляторами. Ковалентную связь образуют атомы (или группы атомов), на валентных орбиталях которых есть неспаренные электроны.
26 Ковалентная или гомеополярная связь характеризуется обобщением валентных электронов между двумя атомами, образуется общая электронная пара. Поэтому обобщенные электроны обладают малой подвижностью, а соединения с ковалентной связью являются электроизоляторами. Ковалентную связь образуют атомы (или группы атомов), на валентных орбиталях которых есть неспаренные электроны.
 27 Ионная (полярная) связь характерна для элементов с 8 электронами на предвалентной орбитали. В этом случае валентные электроны одного элемента (донора) переходят в окружение другого (акцептора). В полярных жидкостях (например, в воде) ионные соединения диссоциируют и становятся подвижными.
27 Ионная (полярная) связь характерна для элементов с 8 электронами на предвалентной орбитали. В этом случае валентные электроны одного элемента (донора) переходят в окружение другого (акцептора). В полярных жидкостях (например, в воде) ионные соединения диссоциируют и становятся подвижными.
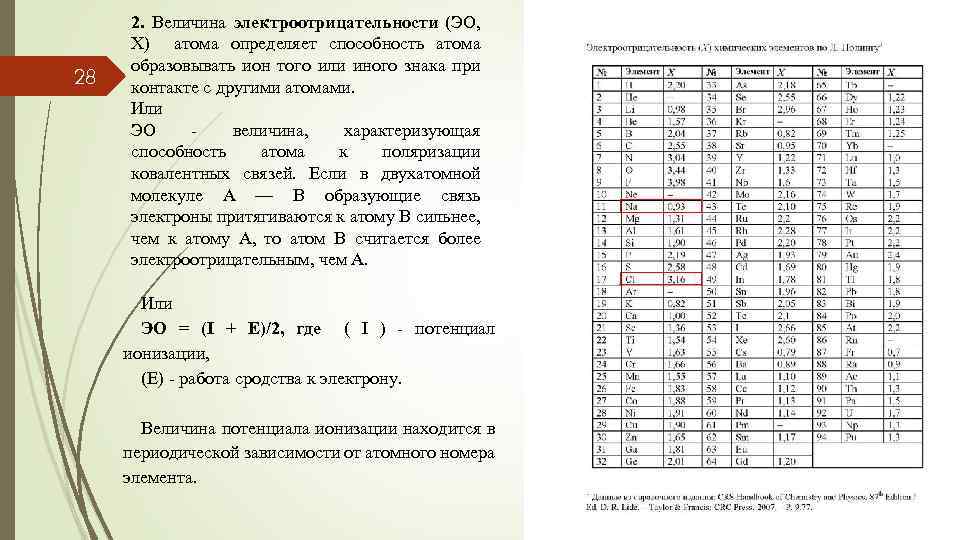 28 2. Величина электроотрицательности (ЭО, Х) атома определяет способность атома образовывать ион того или иного знака при контакте с другими атомами. Или ЭО - величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А. Или ЭО = (I + E)/2, где ( I ) - потенциал ионизации, (Е) - работа сродства к электрону. Величина потенциала ионизации находится в периодической зависимости от атомного номера элемента.
28 2. Величина электроотрицательности (ЭО, Х) атома определяет способность атома образовывать ион того или иного знака при контакте с другими атомами. Или ЭО - величина, характеризующая способность атома к поляризации ковалентных связей. Если в двухатомной молекуле А — В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным, чем А. Или ЭО = (I + E)/2, где ( I ) - потенциал ионизации, (Е) - работа сродства к электрону. Величина потенциала ионизации находится в периодической зависимости от атомного номера элемента.
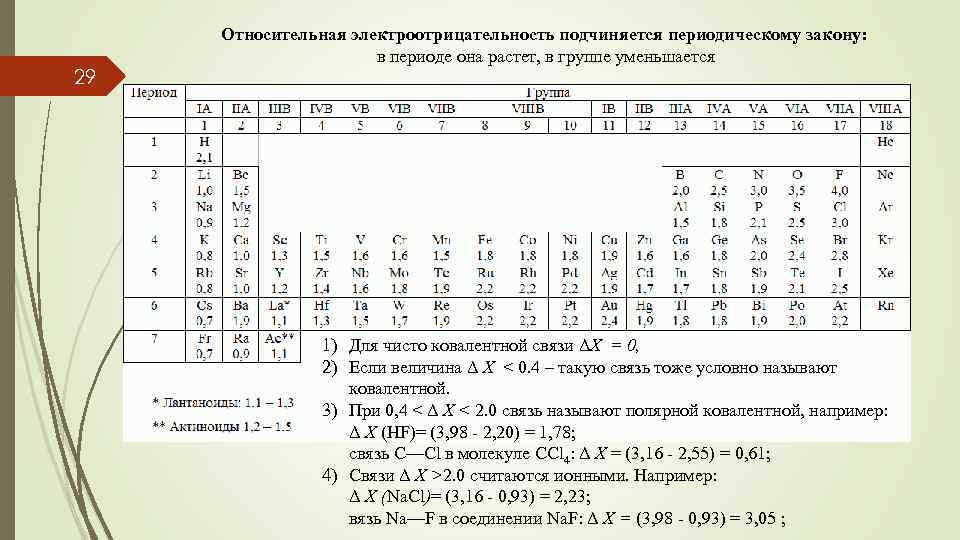 29 Относительная электроотрицательность подчиняется периодическому закону: в периоде она растет, в группе уменьшается 1) Для чисто ковалентной связи ΔX = 0, 2) Если величина Δ X < 0. 4 – такую связь тоже условно называют ковалентной. 3) При 0, 4 < Δ X < 2. 0 cвязь называют полярной ковалентной, например: Δ X (HF)= (3, 98 - 2, 20) = 1, 78; связь C—Cl в молекуле CСl 4: Δ X = (3, 16 - 2, 55) = 0, 61; 4) Cвязи Δ X >2. 0 считаются ионными. Например: Δ X (Na. Cl)= (3, 16 - 0, 93) = 2, 23; вязь Na—F в соединении Na. F: Δ X = (3, 98 - 0, 93) = 3, 05 ;
29 Относительная электроотрицательность подчиняется периодическому закону: в периоде она растет, в группе уменьшается 1) Для чисто ковалентной связи ΔX = 0, 2) Если величина Δ X < 0. 4 – такую связь тоже условно называют ковалентной. 3) При 0, 4 < Δ X < 2. 0 cвязь называют полярной ковалентной, например: Δ X (HF)= (3, 98 - 2, 20) = 1, 78; связь C—Cl в молекуле CСl 4: Δ X = (3, 16 - 2, 55) = 0, 61; 4) Cвязи Δ X >2. 0 считаются ионными. Например: Δ X (Na. Cl)= (3, 16 - 0, 93) = 2, 23; вязь Na—F в соединении Na. F: Δ X = (3, 98 - 0, 93) = 3, 05 ;
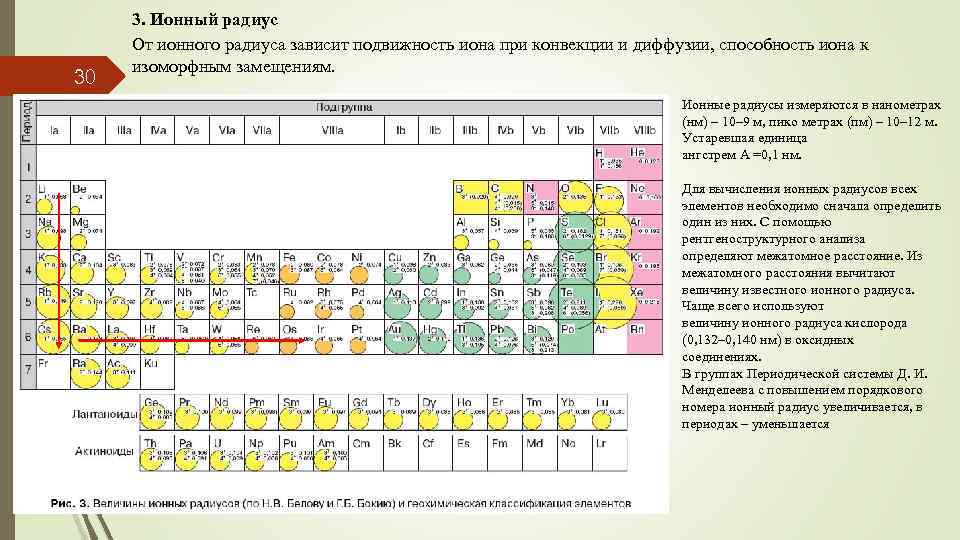 30 3. Ионный радиус От ионного радиуса зависит подвижность иона при конвекции и диффузии, способность иона к изоморфным замещениям. Ионные радиусы измеряются в нанометрах (нм) – 10– 9 м, пико метрах (пм) – 10– 12 м. Устаревшая единица ангстрем А =0, 1 нм. Для вычисления ионных радиусов всех элементов необходимо сначала определить один из них. С помощью рентгеноструктурного анализа определяют межатомное расстояние. Из межатомного расстояния вычитают величину известного ионного радиуса. Чаще всего используют величину ионного радиуса кислорода (0, 132– 0, 140 нм) в оксидных соединениях. В группах Периодической системы Д. И. Менделеева с повышением порядкового номера ионный радиус увеличивается, в периодах – уменьшается
30 3. Ионный радиус От ионного радиуса зависит подвижность иона при конвекции и диффузии, способность иона к изоморфным замещениям. Ионные радиусы измеряются в нанометрах (нм) – 10– 9 м, пико метрах (пм) – 10– 12 м. Устаревшая единица ангстрем А =0, 1 нм. Для вычисления ионных радиусов всех элементов необходимо сначала определить один из них. С помощью рентгеноструктурного анализа определяют межатомное расстояние. Из межатомного расстояния вычитают величину известного ионного радиуса. Чаще всего используют величину ионного радиуса кислорода (0, 132– 0, 140 нм) в оксидных соединениях. В группах Периодической системы Д. И. Менделеева с повышением порядкового номера ионный радиус увеличивается, в периодах – уменьшается
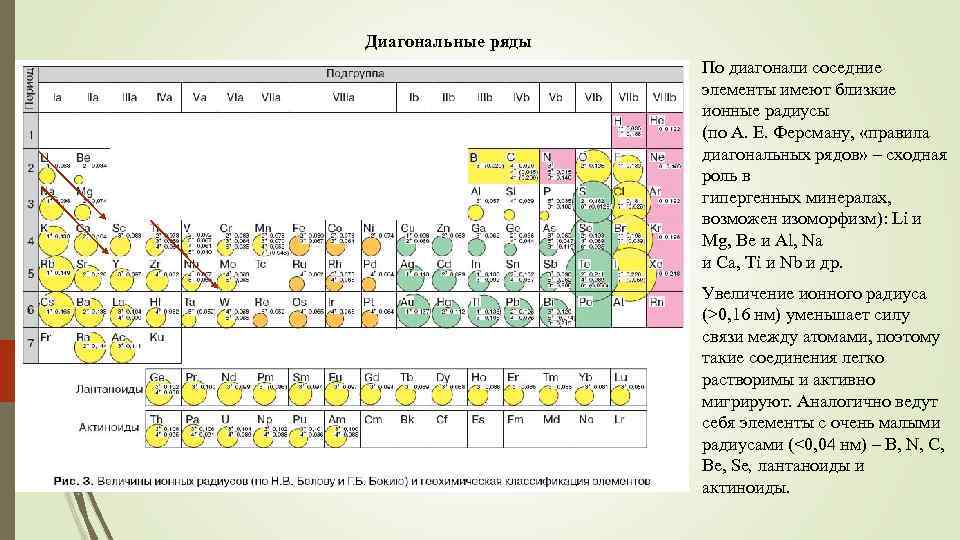 Диагональные ряды По диагонали соседние элементы имеют близкие ионные радиусы (по А. Е. Ферсману, «правила диагональных рядов» – сходная роль в гипергенных минералах, возможен изоморфизм): Li и Мg, Be и Al, Na и Ca, Ti и Nb и др. 31 Увеличение ионного радиуса (>0, 16 нм) уменьшает силу связи между атомами, поэтому такие соединения легко растворимы и активно мигрируют. Аналогично ведут себя элементы с очень малыми радиусами (<0, 04 нм) – B, N, C, Be, Se, лантаноиды и актиноиды.
Диагональные ряды По диагонали соседние элементы имеют близкие ионные радиусы (по А. Е. Ферсману, «правила диагональных рядов» – сходная роль в гипергенных минералах, возможен изоморфизм): Li и Мg, Be и Al, Na и Ca, Ti и Nb и др. 31 Увеличение ионного радиуса (>0, 16 нм) уменьшает силу связи между атомами, поэтому такие соединения легко растворимы и активно мигрируют. Аналогично ведут себя элементы с очень малыми радиусами (<0, 04 нм) – B, N, C, Be, Se, лантаноиды и актиноиды.
 4. Валентность 32 Валентность определяется числом электронов на последней (валентной) оболочке, а также числом электронов на предвалентной оболочке. Элементы, имеющие на предвалентной оболочке 2 или 8 электронов, как правило, проявляют в химических процессах одну единственную валентность. Типичным представителем этой группы являются щелочные металлы. Способность химических элементов проявлять разную валентность в различных физико-химических обстановках существенно влияет на их подвижность (или инертность) в геохимических процессах. Например, в восстановительной обстановке уран проявляет валентность +4, по геохимическому поведению аналогичен четырехвалентному торию, инертен по отношению к водным растворам и, соответственно, малоподвижен. В окислительной обстановке уран шестивалентен, в водной среде образует уранил-ион UO 22+, который по свойствам аналогичен щелочным металлам, т. е. активно мигрирует. Напротив, двухвалентное железо хорошо мигрирует в близнейтральном или слабощелочном водном растворе, а трехвалентное Fe (III) выпадает в осадок в виде гидроокиси Fe(OH)3 уже при р. Н>3 (при нормальной температуре).
4. Валентность 32 Валентность определяется числом электронов на последней (валентной) оболочке, а также числом электронов на предвалентной оболочке. Элементы, имеющие на предвалентной оболочке 2 или 8 электронов, как правило, проявляют в химических процессах одну единственную валентность. Типичным представителем этой группы являются щелочные металлы. Способность химических элементов проявлять разную валентность в различных физико-химических обстановках существенно влияет на их подвижность (или инертность) в геохимических процессах. Например, в восстановительной обстановке уран проявляет валентность +4, по геохимическому поведению аналогичен четырехвалентному торию, инертен по отношению к водным растворам и, соответственно, малоподвижен. В окислительной обстановке уран шестивалентен, в водной среде образует уранил-ион UO 22+, который по свойствам аналогичен щелочным металлам, т. е. активно мигрирует. Напротив, двухвалентное железо хорошо мигрирует в близнейтральном или слабощелочном водном растворе, а трехвалентное Fe (III) выпадает в осадок в виде гидроокиси Fe(OH)3 уже при р. Н>3 (при нормальной температуре).
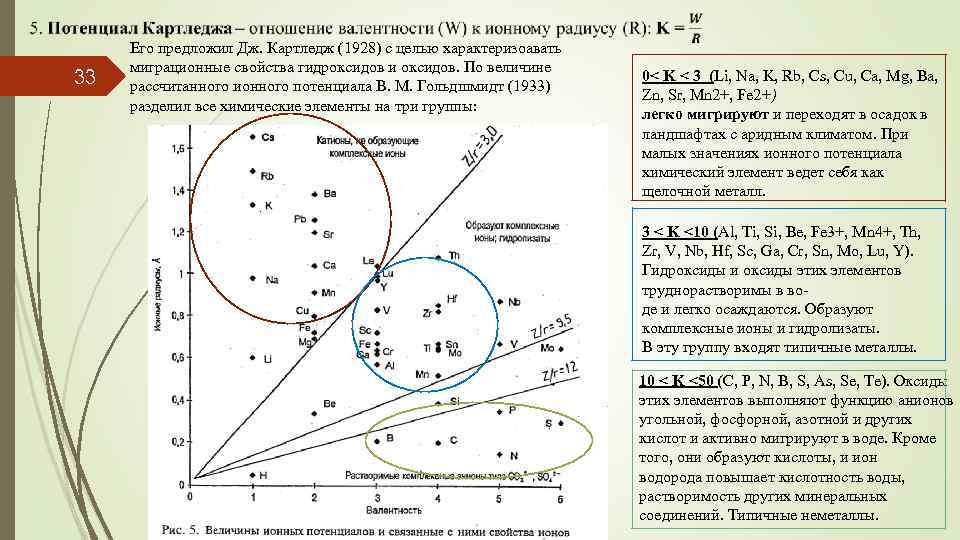 33 Его предложил Дж. Картледж (1928) с целью характеризоавать миграционные свойства гидроксидов и оксидов. По величине рассчитанного ионного потенциала В. М. Гольдшмидт (1933) разделил все химические элементы на три группы: 0< K < 3 (Li, Na, K, Rb, Cs, Cu, Ca, Mg, Ba, Zn, Sr, Mn 2+, Fe 2+) легко мигрируют и переходят в осадок в ландшафтах с аридным климатом. При малых значениях ионного потенциала химический элемент ведет себя как щелочной металл. 3 < K <10 (Al, Ti, Si, Be, Fe 3+, Mn 4+, Th, Zr, V, Nb, Hf, Sc, Ga, Cr, Sn, Mo, Lu, Y). Гидроксиды и оксиды этих элементов труднорастворимы в воде и легко осаждаются. Образуют комплексные ионы и гидролизаты. В эту группу входят типичные металлы. 10 < K <50 (C, P, N, B, S, As, Se, Te). Оксиды этих элементов выполняют функцию анионов угольной, фосфорной, азотной и других кислот и активно мигрируют в воде. Кроме того, они образуют кислоты, и ион водорода повышает кислотность воды, растворимость других минеральных соединений. Типичные неметаллы.
33 Его предложил Дж. Картледж (1928) с целью характеризоавать миграционные свойства гидроксидов и оксидов. По величине рассчитанного ионного потенциала В. М. Гольдшмидт (1933) разделил все химические элементы на три группы: 0< K < 3 (Li, Na, K, Rb, Cs, Cu, Ca, Mg, Ba, Zn, Sr, Mn 2+, Fe 2+) легко мигрируют и переходят в осадок в ландшафтах с аридным климатом. При малых значениях ионного потенциала химический элемент ведет себя как щелочной металл. 3 < K <10 (Al, Ti, Si, Be, Fe 3+, Mn 4+, Th, Zr, V, Nb, Hf, Sc, Ga, Cr, Sn, Mo, Lu, Y). Гидроксиды и оксиды этих элементов труднорастворимы в воде и легко осаждаются. Образуют комплексные ионы и гидролизаты. В эту группу входят типичные металлы. 10 < K <50 (C, P, N, B, S, As, Se, Te). Оксиды этих элементов выполняют функцию анионов угольной, фосфорной, азотной и других кислот и активно мигрируют в воде. Кроме того, они образуют кислоты, и ион водорода повышает кислотность воды, растворимость других минеральных соединений. Типичные неметаллы.
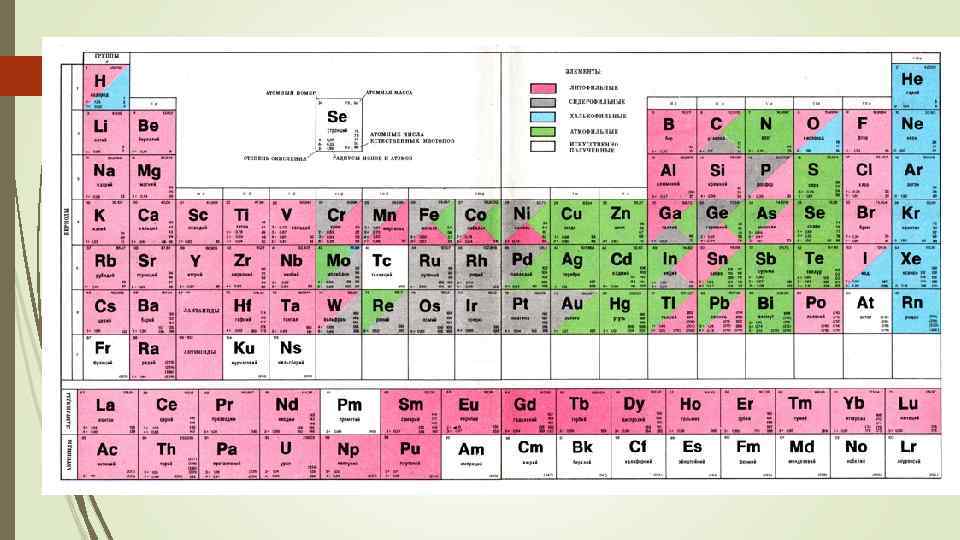
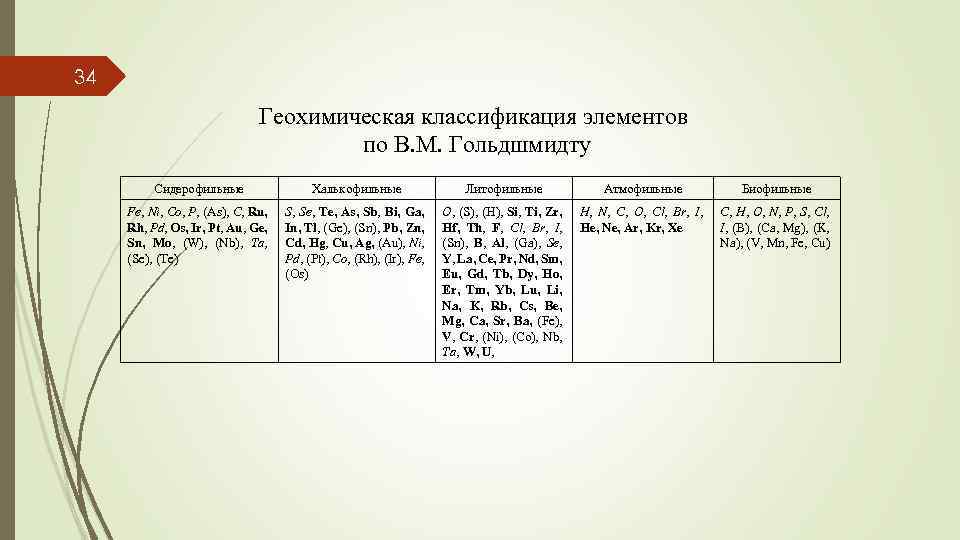 34 Геохимическая классификация элементов по В. М. Гольдшмидту Сидерофильные Халькофильные Литофильные Атмофильные Биофильные Fe, Ni, Co, P, (As), C, Ru, Rh, Pd, Os, Ir, Pt, Au, Ge, Sn, Mo, (W), (Nb), Ta, (Se), (Te) S, Se, Te, As, Sb, Bi, Ga, In, Tl, (Ge), (Sn), Pb, Zn, Cd, Hg, Cu, Ag, (Au), Ni, Pd, (Pt), Co, (Rh), (Ir), Fe, (Os) O, (S), (H), Si, Ti, Zr, Hf, Th, F, Cl, Br, I, (Sn), B, Al, (Ga), Se, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Li, Na, K, Rb, Cs, Be, Mg, Ca, Sr, Ba, (Fe), V, Cr, (Ni), (Co), Nb, Ta, W, U, H, N, C, O, Cl, Br, I, He, Ne, Ar, Kr, Xe C, H, O, N, P, S, Cl, I, (B), (Ca, Mg), (K, Na), (V, Mn, Fe, Cu)
34 Геохимическая классификация элементов по В. М. Гольдшмидту Сидерофильные Халькофильные Литофильные Атмофильные Биофильные Fe, Ni, Co, P, (As), C, Ru, Rh, Pd, Os, Ir, Pt, Au, Ge, Sn, Mo, (W), (Nb), Ta, (Se), (Te) S, Se, Te, As, Sb, Bi, Ga, In, Tl, (Ge), (Sn), Pb, Zn, Cd, Hg, Cu, Ag, (Au), Ni, Pd, (Pt), Co, (Rh), (Ir), Fe, (Os) O, (S), (H), Si, Ti, Zr, Hf, Th, F, Cl, Br, I, (Sn), B, Al, (Ga), Se, Y, La, Ce, Pr, Nd, Sm, Eu, Gd, Tb, Dy, Ho, Er, Tm, Yb, Lu, Li, Na, K, Rb, Cs, Be, Mg, Ca, Sr, Ba, (Fe), V, Cr, (Ni), (Co), Nb, Ta, W, U, H, N, C, O, Cl, Br, I, He, Ne, Ar, Kr, Xe C, H, O, N, P, S, Cl, I, (B), (Ca, Mg), (K, Na), (V, Mn, Fe, Cu)
 35
35


