Система комплемента n Система комплемента –это









































Королева.ppt
- Количество слайдов: 46
 Система комплемента
Система комплемента
 n Система комплемента –это система белков, каскадно активируемых при внедрении в организм чужеродных агентов. Белки системы комплемента присутствуют в неактивной форме в виде проферментов и активируются по принципу ограниченного протеолиза.
n Система комплемента –это система белков, каскадно активируемых при внедрении в организм чужеродных агентов. Белки системы комплемента присутствуют в неактивной форме в виде проферментов и активируются по принципу ограниченного протеолиза.
 Состав системы комплемента n белки, участвующие в активации системы n Ингибиторы, ограничивающие активацию. n Рецепторы на поверхности клеток.
Состав системы комплемента n белки, участвующие в активации системы n Ингибиторы, ограничивающие активацию. n Рецепторы на поверхности клеток.
 Пути активации системы комплемента n Классический n Альтернативный n Лектиновый
Пути активации системы комплемента n Классический n Альтернативный n Лектиновый
 История открытия n В конце XIX столетия было установлено, что сыворотка крови содержит некий «фактор» , обладающий бактерицидными свойствами n В 1896 году молодой бельгийский ученый Жюль Борде показал, что в сыворотке имеются 2 вещества, совместное действие которых приводит к лизису бактерий: термостабильный фактор и термолабильный (теряющий свои свойства при нагревании сыворотки) фактор. Термостабильный фактор действует только против определенных микроорганизмов, термолабильный фактор имеет неспецифическую антибактериальную активность. Термолабильный фактор позднее был назван комплементом.
История открытия n В конце XIX столетия было установлено, что сыворотка крови содержит некий «фактор» , обладающий бактерицидными свойствами n В 1896 году молодой бельгийский ученый Жюль Борде показал, что в сыворотке имеются 2 вещества, совместное действие которых приводит к лизису бактерий: термостабильный фактор и термолабильный (теряющий свои свойства при нагревании сыворотки) фактор. Термостабильный фактор действует только против определенных микроорганизмов, термолабильный фактор имеет неспецифическую антибактериальную активность. Термолабильный фактор позднее был назван комплементом.
 n Термин «комплемент» ввел Пауль Эрлих в конце 1890 -х годов. Согласно его теории клетки, ответственные за иммунные реакции, имеют на поверхности рецепторы для распознавания антигенов. Эти рецепторы мы сейчас называем «антителами» Рецепторы связываются с определенным антигеном, а также с термолабильным антибактериальным компонентом сыворотки крови. Эрлих назвал термолабильный фактор «комплементом» потому, что этот компонент крови «служит дополнением» к клеткам иммунной системы. n Эрлих полагал, что имеется множество комплементов, каждый из которых связывается со своим рецептором, подобно тому, как рецептор связывается со специфическим антигеном. В противоположность этому Борде утверждал, что существует «дополнение» только одного типа. В начале XX века спор был разрешен в пользу Борде; выяснилось, что комплемент может активироваться с участием специфических антител или самостоятельно, неспецифическим способом.
n Термин «комплемент» ввел Пауль Эрлих в конце 1890 -х годов. Согласно его теории клетки, ответственные за иммунные реакции, имеют на поверхности рецепторы для распознавания антигенов. Эти рецепторы мы сейчас называем «антителами» Рецепторы связываются с определенным антигеном, а также с термолабильным антибактериальным компонентом сыворотки крови. Эрлих назвал термолабильный фактор «комплементом» потому, что этот компонент крови «служит дополнением» к клеткам иммунной системы. n Эрлих полагал, что имеется множество комплементов, каждый из которых связывается со своим рецептором, подобно тому, как рецептор связывается со специфическим антигеном. В противоположность этому Борде утверждал, что существует «дополнение» только одного типа. В начале XX века спор был разрешен в пользу Борде; выяснилось, что комплемент может активироваться с участием специфических антител или самостоятельно, неспецифическим способом.
 Классический путь активации n Запускается при взаимодействии антигена и антитела. Включает следующие компоненты: n 1) Ранние С 1 С 2 С 4 n 2) Центральный С 3 n 3) Поздние С 5 С 6 С 7 С 8 С 9
Классический путь активации n Запускается при взаимодействии антигена и антитела. Включает следующие компоненты: n 1) Ранние С 1 С 2 С 4 n 2) Центральный С 3 n 3) Поздние С 5 С 6 С 7 С 8 С 9
 Активация комплемента n антитело фиксируется к антигену n С 1 q(компонент комплемента) прикрепляется к антителу и начинает активироваться. С 1 q+r+s n активированный C 1 qrs расщепляет C 2 и C 4 n С 4=>C 4 b+C 4 a n С 2=>C 2 b+C 2 a n C 4 b и C 2 b соединяются, образуя конвертазу С 3, которая расщепляет С 3 на С 3 а и С 3 b n образуется комплекс C 4 b. C 2 b. С 3 b (конвертаза С 5) n конвертаза С 5 расщепляет комплемент С 5 на С 5 а и С 5 b n С 5 b встраивается в мембрану клетки-мишени. К нему присоединяется С 6, С 7, С 8 и несколько молекул С 9.
Активация комплемента n антитело фиксируется к антигену n С 1 q(компонент комплемента) прикрепляется к антителу и начинает активироваться. С 1 q+r+s n активированный C 1 qrs расщепляет C 2 и C 4 n С 4=>C 4 b+C 4 a n С 2=>C 2 b+C 2 a n C 4 b и C 2 b соединяются, образуя конвертазу С 3, которая расщепляет С 3 на С 3 а и С 3 b n образуется комплекс C 4 b. C 2 b. С 3 b (конвертаза С 5) n конвертаза С 5 расщепляет комплемент С 5 на С 5 а и С 5 b n С 5 b встраивается в мембрану клетки-мишени. К нему присоединяется С 6, С 7, С 8 и несколько молекул С 9.
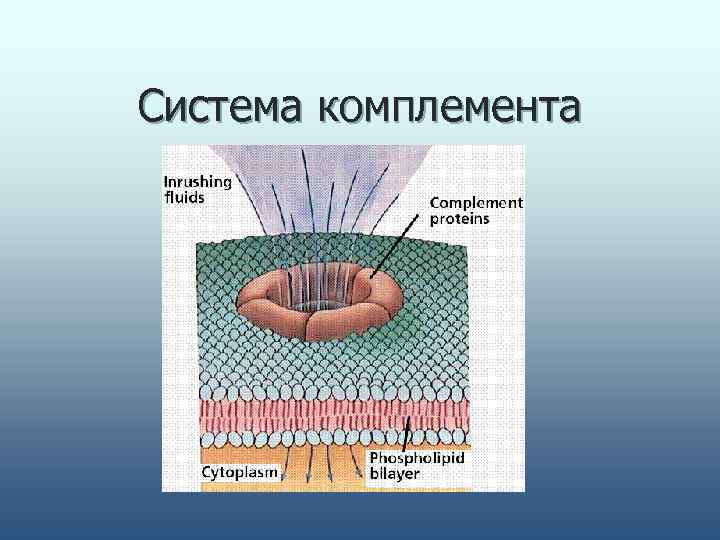
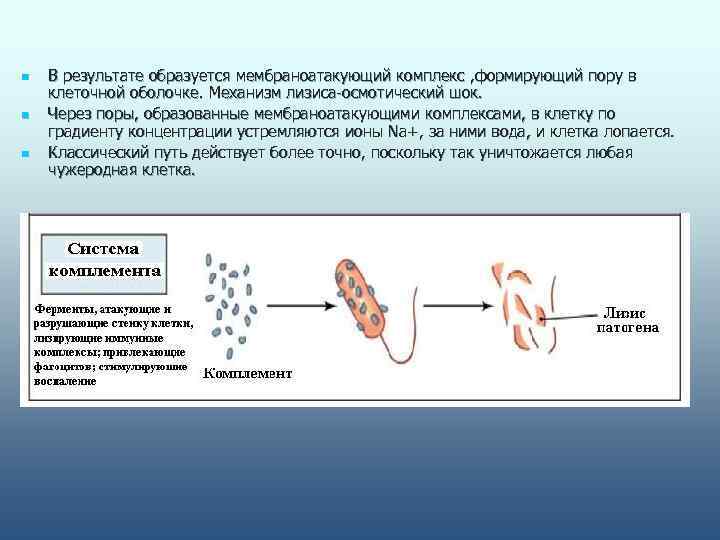
 n В результате образуется мембраноатакующий комплекс , формирующий пору в клеточной оболочке. Механизм лизиса-осмотический шок. n Через поры, образованные мембраноатакующими комплексами, в клетку по градиенту концентрации устремляются ионы Na+, за ними вода, и клетка лопается. n Классический путь действует более точно, поскольку так уничтожается любая чужеродная клетка.
n В результате образуется мембраноатакующий комплекс , формирующий пору в клеточной оболочке. Механизм лизиса-осмотический шок. n Через поры, образованные мембраноатакующими комплексами, в клетку по градиенту концентрации устремляются ионы Na+, за ними вода, и клетка лопается. n Классический путь действует более точно, поскольку так уничтожается любая чужеродная клетка.
 Альтернативный путь n Не требует взаимодействия антигена с антителом n Активирует компоненты оболочки патогенов (ЛПС) n Включает ряд белков, неиспользуемых в других путях активации фактор B, D, P
Альтернативный путь n Не требует взаимодействия антигена с антителом n Активирует компоненты оболочки патогенов (ЛПС) n Включает ряд белков, неиспользуемых в других путях активации фактор B, D, P
 Активация комплимента n С 3 компонент расщепляется на С 3 b и С 3 a и снова собирается n При появлении рядом бактерии компонент С 3 b прикрепляется к ЛПС на её поверхности n С 3 b соединяется с фактором В, который в присутствии фактора D расщепляется на Ва и Вb n Фактор Р стабилизирует образование комплемента (С 3 b. Вbb) конвертаза С 3 а и С 3 b n Образуется конвертаза С 5!(С 3 b. Вb. Р), которая расщепляет С 5 на С 5 b и С 5 а
Активация комплимента n С 3 компонент расщепляется на С 3 b и С 3 a и снова собирается n При появлении рядом бактерии компонент С 3 b прикрепляется к ЛПС на её поверхности n С 3 b соединяется с фактором В, который в присутствии фактора D расщепляется на Ва и Вb n Фактор Р стабилизирует образование комплемента (С 3 b. Вbb) конвертаза С 3 а и С 3 b n Образуется конвертаза С 5!(С 3 b. Вb. Р), которая расщепляет С 5 на С 5 b и С 5 а
 n Образуется мембраноатакующий комплекс, формирующий пору в клеточной оболочке. Механизм лизиса-осмотический шок. n Через в клетку по градиаенту концентрации устремляются ионы Na+, за ними вода, и клетка лопается.
n Образуется мембраноатакующий комплекс, формирующий пору в клеточной оболочке. Механизм лизиса-осмотический шок. n Через в клетку по градиаенту концентрации устремляются ионы Na+, за ними вода, и клетка лопается.
 Манноза-зависимый путь (лектиновый путь) n Не требует взаимодействия антигена с антителом n Активным компонентом оболочки патогена является манноза n Включает ряд белков, которые не используются в других путях активации
Манноза-зависимый путь (лектиновый путь) n Не требует взаимодействия антигена с антителом n Активным компонентом оболочки патогена является манноза n Включает ряд белков, которые не используются в других путях активации
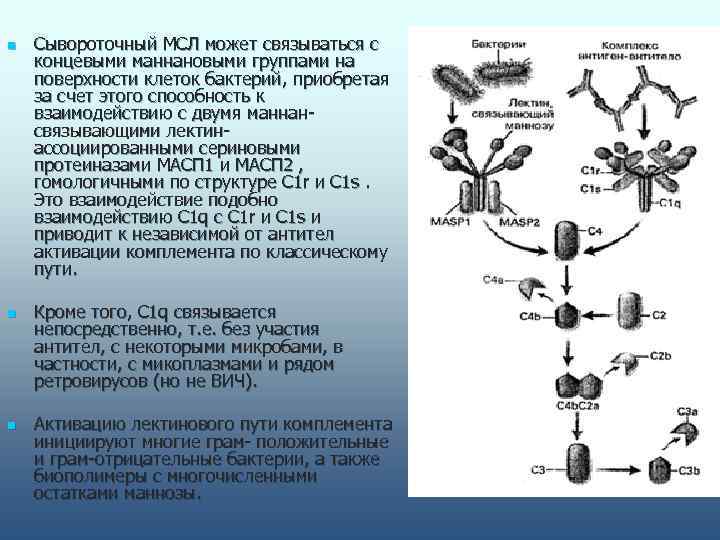
 n Сывороточный МСЛ может связываться с концевыми маннановыми группами на поверхности клеток бактерий, приобретая за счет этого способность к взаимодействию с двумя маннан- связывающими лектин- ассоциированными сериновыми протеиназами МАСП 1 и МАСП 2 , гомологичными по структуре C 1 r и C 1 s. Это взаимодействие подобно взаимодействию C 1 q с C 1 r и C 1 s и приводит к независимой от антител активации комплемента по классическому пути. n Кроме того, C 1 q связывается непосредственно, т. е. без участия антител, с некоторыми микробами, в частности, с микоплазмами и рядом ретровирусов (но не ВИЧ). n Активацию лектинового пути комплемента инициируют многие грам- положительные и грам-отрицательные бактерии, а также биополимеры с многочисленными остатками маннозы.
n Сывороточный МСЛ может связываться с концевыми маннановыми группами на поверхности клеток бактерий, приобретая за счет этого способность к взаимодействию с двумя маннан- связывающими лектин- ассоциированными сериновыми протеиназами МАСП 1 и МАСП 2 , гомологичными по структуре C 1 r и C 1 s. Это взаимодействие подобно взаимодействию C 1 q с C 1 r и C 1 s и приводит к независимой от антител активации комплемента по классическому пути. n Кроме того, C 1 q связывается непосредственно, т. е. без участия антител, с некоторыми микробами, в частности, с микоплазмами и рядом ретровирусов (но не ВИЧ). n Активацию лектинового пути комплемента инициируют многие грам- положительные и грам-отрицательные бактерии, а также биополимеры с многочисленными остатками маннозы.
 Ингибиторы СК n Предотвращают неконтролируемую активация СК n Существует 2 вида ингибиторов: -растворимые (C 1 inh) -мембранные (протеин-блокирующий сборку мембраноатакующего комплекса)
Ингибиторы СК n Предотвращают неконтролируемую активация СК n Существует 2 вида ингибиторов: -растворимые (C 1 inh) -мембранные (протеин-блокирующий сборку мембраноатакующего комплекса)
 Функции СК n Лизис – разрушение клетки мишени n Опсонизация мишени – усиление фагоцитирования (С 3) n Запуск воспаления –С 3 а, С 4 а, С 5 а -Хемоатрактантное действие -Анафилактическое действие n Участие в удалении циркулирующего иммунного комплекса (ЦИК)
Функции СК n Лизис – разрушение клетки мишени n Опсонизация мишени – усиление фагоцитирования (С 3) n Запуск воспаления –С 3 а, С 4 а, С 5 а -Хемоатрактантное действие -Анафилактическое действие n Участие в удалении циркулирующего иммунного комплекса (ЦИК)
 Опсонизация n С 3 b компонент комплемента прикрепляется к поверхности бактерии (метит как чужеродный объект) n У фагоцитов есть рецепторы к С 3 b n Фагоциты легко распознают бактерии, помеченные С 3 b и поглащают её
Опсонизация n С 3 b компонент комплемента прикрепляется к поверхности бактерии (метит как чужеродный объект) n У фагоцитов есть рецепторы к С 3 b n Фагоциты легко распознают бактерии, помеченные С 3 b и поглащают её
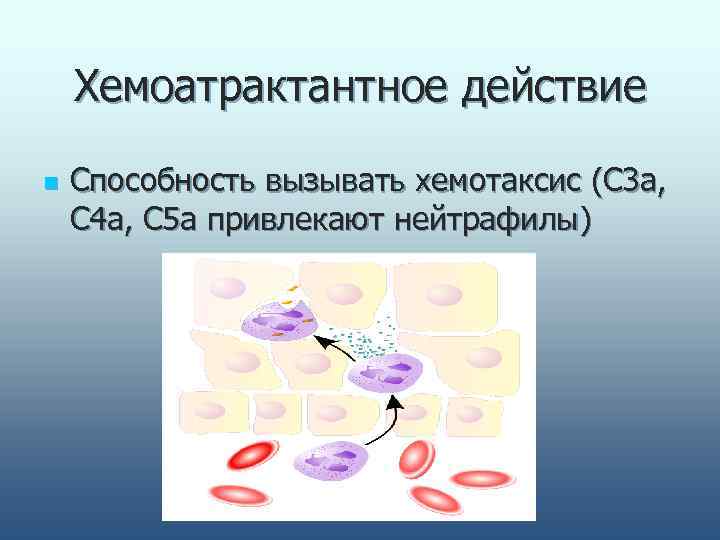
 Хемоатрактантное действие n Способность вызывать хемотаксис (С 3 а, С 4 а, С 5 а привлекают нейтрафилы)
Хемоатрактантное действие n Способность вызывать хемотаксис (С 3 а, С 4 а, С 5 а привлекают нейтрафилы)
 Анафилактическое действие n Способность вызывать дегрануляцию тучных клеток
Анафилактическое действие n Способность вызывать дегрануляцию тучных клеток
 Белки острой фазы
Белки острой фазы
 Белки острой фазы – большая группа белков сыворотки крови (в основном α глобулинов) с молекулярной массой от 12 к. Да до 340 к. Да и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях. Синтез белков острой фазы осуществляется печенью, моноцитами, лимфоцитами, нейтрофилами. Их концентрация зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и глюкокортикоиды.
Белки острой фазы – большая группа белков сыворотки крови (в основном α глобулинов) с молекулярной массой от 12 к. Да до 340 к. Да и различными функциями, объединенных по общему признаку – быстрое и значительное увеличение концентрации при бактериальной, вирусной, паразитарной инфекции, физической или химической травме, токсической или аутоиммунной реакции, злокачественных новообразованиях. Синтез белков острой фазы осуществляется печенью, моноцитами, лимфоцитами, нейтрофилами. Их концентрация зависят от стадии заболевания и/или от масштабов повреждений. Синтез белков включается и регулируется рядом медиаторов, среди которых цитокины, анафилотоксины и глюкокортикоиды.
 Белки острой фазы К белкам острой фазы относят С реактивный белок, сывороточный амилоид А, гаптоглобин, α 2 макроглобулин, церулоплазмин, α 1 гликопротеин, α 1 антитрипсин, орозомукоид, компоненты комплемента С 1 С 4, С 9. Трансферрин также относят к белкам острой фазы, но его концентрация при воспалениях снижается – его называют негативным белком острой фазы.
Белки острой фазы К белкам острой фазы относят С реактивный белок, сывороточный амилоид А, гаптоглобин, α 2 макроглобулин, церулоплазмин, α 1 гликопротеин, α 1 антитрипсин, орозомукоид, компоненты комплемента С 1 С 4, С 9. Трансферрин также относят к белкам острой фазы, но его концентрация при воспалениях снижается – его называют негативным белком острой фазы.
 n С-реактивный белок
n С-реактивный белок
 n В 1930 г. в крови больных с инфекцией, вызванной Streptococcus pneumoniae , был обнаружен белок, способный вызывать преципитацию полисахарида “С” клеточной стенки пневмококков. За эту способность его назвали С-реактивным белком (СРБ). n СРБ - филогенетически очень консервативный по аминокислотной последовательности белок, гомологи которого встречаются у позвоночных и безпозвоночных и участвуют в развитии системной воспалительной реакции.
n В 1930 г. в крови больных с инфекцией, вызванной Streptococcus pneumoniae , был обнаружен белок, способный вызывать преципитацию полисахарида “С” клеточной стенки пневмококков. За эту способность его назвали С-реактивным белком (СРБ). n СРБ - филогенетически очень консервативный по аминокислотной последовательности белок, гомологи которого встречаются у позвоночных и безпозвоночных и участвуют в развитии системной воспалительной реакции.
 n Концентрация СРБ белка в плазме крови, не превышающая у здоровых взрослых людей 3 -5 мг / л, резко возрастает при появлении в организме очага воспаления (в 1000 раз и более) в результате синтеза этого белка клетками печени. n Состояния, сопровождающиеся увеличением СРБ в плазме крови: n воспаление n бактериальная инфекция n некроз ткани n опухолевый рост n хирургическое вмешательство n ожоги n другие причины n
n Концентрация СРБ белка в плазме крови, не превышающая у здоровых взрослых людей 3 -5 мг / л, резко возрастает при появлении в организме очага воспаления (в 1000 раз и более) в результате синтеза этого белка клетками печени. n Состояния, сопровождающиеся увеличением СРБ в плазме крови: n воспаление n бактериальная инфекция n некроз ткани n опухолевый рост n хирургическое вмешательство n ожоги n другие причины n
 n Индукция синтеза СРБ является частью общей реакции печени на воспаление ( «ответ острой фазы» ), заключающейся в экспрессии генов многих белков плазмы крови и сопровождающейся увеличением содержания в плазме крови белков острой фазы.
n Индукция синтеза СРБ является частью общей реакции печени на воспаление ( «ответ острой фазы» ), заключающейся в экспрессии генов многих белков плазмы крови и сопровождающейся увеличением содержания в плазме крови белков острой фазы.
 Диагностическая значимость определения белков острой фазы Особенностью большинства белков ОФ является их неспецифичность и высокая корреляция концентраций в крови с активностью заболевания, стадией процесса. Это выгодно отличает белки ОФ от других широко используемых маркеров воспаления, таких как СОЭ, количество лейкоцитов и сдвиг лейкоцитарной формулы. В связи с этим ценность тестов на белки ОФ для мониторинга течения заболеваний и контроля эффективности лечения весьма велика. В то же время диагностическая значимость этих тестов, в силу их неспецифичности, может быть ограниченной.
Диагностическая значимость определения белков острой фазы Особенностью большинства белков ОФ является их неспецифичность и высокая корреляция концентраций в крови с активностью заболевания, стадией процесса. Это выгодно отличает белки ОФ от других широко используемых маркеров воспаления, таких как СОЭ, количество лейкоцитов и сдвиг лейкоцитарной формулы. В связи с этим ценность тестов на белки ОФ для мониторинга течения заболеваний и контроля эффективности лечения весьма велика. В то же время диагностическая значимость этих тестов, в силу их неспецифичности, может быть ограниченной.
 n К «главным» белкам острой фазы у человека относят С-реактивный белок и сывороточный амилоид А. Уровень этих белков возрастает при повреждении очень быстро (в первые 6 -8 часов) и значительно (в 20 -100 раз, в отдельных случаях - в 1000 и более раз). n Изменение концентрации различных белков в условиях повреждения и воспаления варьирует в широких пределах. По степени увеличения в плазме крови при физической травме белки острой фазы можно классифицировать на несколько групп.
n К «главным» белкам острой фазы у человека относят С-реактивный белок и сывороточный амилоид А. Уровень этих белков возрастает при повреждении очень быстро (в первые 6 -8 часов) и значительно (в 20 -100 раз, в отдельных случаях - в 1000 и более раз). n Изменение концентрации различных белков в условиях повреждения и воспаления варьирует в широких пределах. По степени увеличения в плазме крови при физической травме белки острой фазы можно классифицировать на несколько групп.
 Эффекты СРБ in vitro Понимание биологических функций основывается на выявлении молекул лигандов и эффекторов, с которыми СРБ взаимодействует. n Лиганды СРБ: n Эффекторы СРБ: n Фосфохолин n Комплемент (С 1 q белок); n Иммуноглобулиновые n (фосфатидилхолин и n рецепторы n сфингомиелин); фагоцитирующих n Фросфатидилэтаноламин n клеток (Fc. RI и Fc. RII) ; n Хроматин; n гистоны, n фибронектин; n рибонуклеопротеиды
Эффекты СРБ in vitro Понимание биологических функций основывается на выявлении молекул лигандов и эффекторов, с которыми СРБ взаимодействует. n Лиганды СРБ: n Эффекторы СРБ: n Фосфохолин n Комплемент (С 1 q белок); n Иммуноглобулиновые n (фосфатидилхолин и n рецепторы n сфингомиелин); фагоцитирующих n Фросфатидилэтаноламин n клеток (Fc. RI и Fc. RII) ; n Хроматин; n гистоны, n фибронектин; n рибонуклеопротеиды
 Роль в системе комплемента: Связанный с лигандами или агрегированный СРБ активирует систему комплемента посредством прямого взаимодействия с C 1 q белком. Результаты ряда исследований свидетельствуют, что СРБ может взаимодействовать с иммуноглобулиновыми рецепторами, расположенными на поверхности фагоцитирующих клеток и вызывать ответ со стороны этих клеток. Способность СРБ узнавать патогены и активировать вслед за этим систему комплемента и фагоцитирующие клетки составляет важное звено в первой линии защиты организма от повреждающих факторов.
Роль в системе комплемента: Связанный с лигандами или агрегированный СРБ активирует систему комплемента посредством прямого взаимодействия с C 1 q белком. Результаты ряда исследований свидетельствуют, что СРБ может взаимодействовать с иммуноглобулиновыми рецепторами, расположенными на поверхности фагоцитирующих клеток и вызывать ответ со стороны этих клеток. Способность СРБ узнавать патогены и активировать вслед за этим систему комплемента и фагоцитирующие клетки составляет важное звено в первой линии защиты организма от повреждающих факторов.
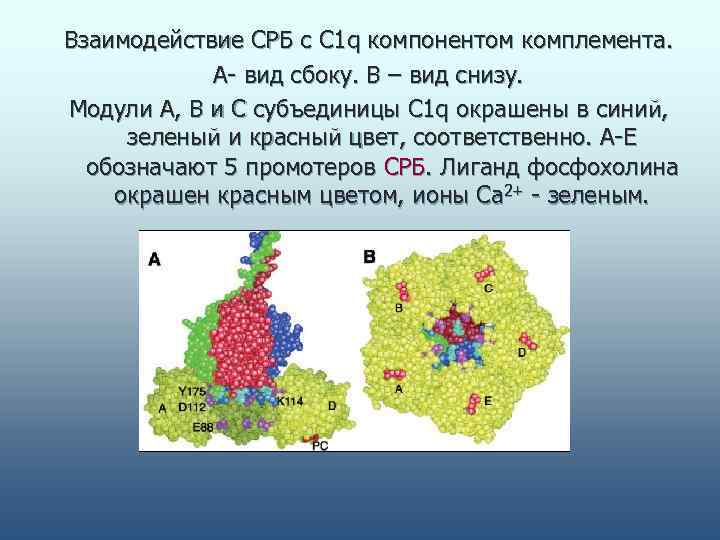
 Взаимодействие СРБ с С 1 q компонентом комплемента. А- вид сбоку. В – вид снизу. Модули А, В и С субъединицы С 1 q окрашены в синий, зеленый и красный цвет, соответственно. А-Е обозначают 5 промотеров СРБ. Лиганд фосфохолина окрашен красным цветом, ионы Са 2+ - зеленым.
Взаимодействие СРБ с С 1 q компонентом комплемента. А- вид сбоку. В – вид снизу. Модули А, В и С субъединицы С 1 q окрашены в синий, зеленый и красный цвет, соответственно. А-Е обозначают 5 промотеров СРБ. Лиганд фосфохолина окрашен красным цветом, ионы Са 2+ - зеленым.
 Рецепторы СРБ связывается на поверхности фагоцитирующих клеток рецепторами Ig. G , Fc γ RI и Fc γ RII. Два класса Fc стимулирующие рецепторы, их АМК последовательность включае т ITAM ( cytoplasmic immunoreceptor tyrosine-based activation motif и ингибируюший рецептор, АМК последовательность ) которого включает ITIM ( immunoreceptor tyrosine-based inhibition motif). Биологические эффекты, опосредуемые ITAM-содержащими Fc γ Rs , включают фагоцитоз, «респираторный взрыв» и секрецию цитокинов. Связывание лиганда с ITIM- содержащими Fc γ Rs блокирует, проведение сигнала ITAM- содержащими Fc γ Rs. СРБ связывается как с ITAM- так и с ITIM-содержащими рецепторами, включая рецепторы к FcγRI, Fc γ RII и возможно Fc γ Rs. Фагацитоз опсонизированных частиц и апоптозных клеток опосредован FcγRI. СРБ проводит сигнал в в гранулоциты через Fc γ RIIa - ITAM-содержащий рецептор. Активация комплемента сопровождается усилением фагоцитарной активности лейкоцитов, но и в отсутствие комплемента СРБ в условиях in vitro усиливает захват лейкоцитами нескольких видом микроорганизмов, включая Staphylococcus aureus , Escherichia coli и Klebsiella aerogenes. Стимуляция фагоцитоза СРБ предположительно опосредована взаимодействием СРБ с FcγRs.
Рецепторы СРБ связывается на поверхности фагоцитирующих клеток рецепторами Ig. G , Fc γ RI и Fc γ RII. Два класса Fc стимулирующие рецепторы, их АМК последовательность включае т ITAM ( cytoplasmic immunoreceptor tyrosine-based activation motif и ингибируюший рецептор, АМК последовательность ) которого включает ITIM ( immunoreceptor tyrosine-based inhibition motif). Биологические эффекты, опосредуемые ITAM-содержащими Fc γ Rs , включают фагоцитоз, «респираторный взрыв» и секрецию цитокинов. Связывание лиганда с ITIM- содержащими Fc γ Rs блокирует, проведение сигнала ITAM- содержащими Fc γ Rs. СРБ связывается как с ITAM- так и с ITIM-содержащими рецепторами, включая рецепторы к FcγRI, Fc γ RII и возможно Fc γ Rs. Фагацитоз опсонизированных частиц и апоптозных клеток опосредован FcγRI. СРБ проводит сигнал в в гранулоциты через Fc γ RIIa - ITAM-содержащий рецептор. Активация комплемента сопровождается усилением фагоцитарной активности лейкоцитов, но и в отсутствие комплемента СРБ в условиях in vitro усиливает захват лейкоцитами нескольких видом микроорганизмов, включая Staphylococcus aureus , Escherichia coli и Klebsiella aerogenes. Стимуляция фагоцитоза СРБ предположительно опосредована взаимодействием СРБ с FcγRs.
 Эффекты СРБ in vivo В опытах на мышах установлено противовоспалительное действие СРБ защищает мышей от: n бактериальной инфекции; n воспалительной реакции, вызываемой бактериальным липополисахаридом (эндоткоксином) и различными провоспалительными цитокинами; n предотвращает или замедляет развитие у мышей экспериментального аллергического энцефаломиелита (экспериментальная модель рассеянного склероза) и альвеолита, вызываемого хемотаксическим фактором; n оказывает защитное действие при экспериментальной системной красной волчанке. У людей с генетически предрасположенной сниженной способность к экспрессии СРБ значительно чаще встречаются аутоиммунные заболевания, включая системную красную волчанку. n СРБ , присутствующий в составе некротических масс, апоптозных клеток, различных отложений узнается фагоцитами и тем самым способствует очищению клеток от ненужного
Эффекты СРБ in vivo В опытах на мышах установлено противовоспалительное действие СРБ защищает мышей от: n бактериальной инфекции; n воспалительной реакции, вызываемой бактериальным липополисахаридом (эндоткоксином) и различными провоспалительными цитокинами; n предотвращает или замедляет развитие у мышей экспериментального аллергического энцефаломиелита (экспериментальная модель рассеянного склероза) и альвеолита, вызываемого хемотаксическим фактором; n оказывает защитное действие при экспериментальной системной красной волчанке. У людей с генетически предрасположенной сниженной способность к экспрессии СРБ значительно чаще встречаются аутоиммунные заболевания, включая системную красную волчанку. n СРБ , присутствующий в составе некротических масс, апоптозных клеток, различных отложений узнается фагоцитами и тем самым способствует очищению клеток от ненужного
 Модифицированный СРБ Денатурированный или агрегированный СРБ (нео- СРБ или модифицированный СРБ ) обладает мощным провоспалительным действием. Модифицированный СРБ образуется локально и разительно отличается по своим свойствам от нативного СРБ. Модифицированный СРБ вызывает высвобождение провоспалительных медиаторов моноцитов – хемоатрактантного белка-1, ИЛ-8 и способствует экспрессии ICAM- 1 в эндотелиальных клетках.
Модифицированный СРБ Денатурированный или агрегированный СРБ (нео- СРБ или модифицированный СРБ ) обладает мощным провоспалительным действием. Модифицированный СРБ образуется локально и разительно отличается по своим свойствам от нативного СРБ. Модифицированный СРБ вызывает высвобождение провоспалительных медиаторов моноцитов – хемоатрактантного белка-1, ИЛ-8 и способствует экспрессии ICAM- 1 в эндотелиальных клетках.
 Острофазовая реакция и сердечно-сосудистые заболевания Острофазовая реакция предшествует развитию иммунной защитной реакции и развивается в ответ на нарушение гомеостаза при повреждениях, травме, злокачественном росте и нарушениях в иммунной системе. Местная реакция приводит к активации цитокинов (ИЛ-1, TNF-α, ИЛ-6 и интерферонов), опосредующих системный ответ, проявляющитйся лейкоцитозом, секрецией глюкокортикоидов , возрастанием СОЭ, повышением температуры, активацией системы комплемента и свертывания крови, увеличением содержания в крови белков острой фазы. СРБ - один наиболее значимых реактантов острой фазы у человека. Уровень СРБ в плазме крови быстро нарастает при травмах и инфекции. Синтезируемый в печени и откладывающийся в поврежденной ткани СРБ обнаруживается в больших количествах в биологических жидкостях рядом с очагом воспаления, а также в интиме пораженных атеросклеротическим процессом артерий и в пенистых клетках. СРБ является ключевым медиатором многих проявлений воспалительного ответа, усиливающего прогрессирование атеросклероза. СРБ стимулирует высвобождение мононуклеарными клетками тканевого фактора, которому принадлежит центральная роль в активации свертывания крови, системы комплемента и ФАТа. Взятые вместе, перечисленный реакции вызывают реакцию со стороны тромбоцитов.
Острофазовая реакция и сердечно-сосудистые заболевания Острофазовая реакция предшествует развитию иммунной защитной реакции и развивается в ответ на нарушение гомеостаза при повреждениях, травме, злокачественном росте и нарушениях в иммунной системе. Местная реакция приводит к активации цитокинов (ИЛ-1, TNF-α, ИЛ-6 и интерферонов), опосредующих системный ответ, проявляющитйся лейкоцитозом, секрецией глюкокортикоидов , возрастанием СОЭ, повышением температуры, активацией системы комплемента и свертывания крови, увеличением содержания в крови белков острой фазы. СРБ - один наиболее значимых реактантов острой фазы у человека. Уровень СРБ в плазме крови быстро нарастает при травмах и инфекции. Синтезируемый в печени и откладывающийся в поврежденной ткани СРБ обнаруживается в больших количествах в биологических жидкостях рядом с очагом воспаления, а также в интиме пораженных атеросклеротическим процессом артерий и в пенистых клетках. СРБ является ключевым медиатором многих проявлений воспалительного ответа, усиливающего прогрессирование атеросклероза. СРБ стимулирует высвобождение мононуклеарными клетками тканевого фактора, которому принадлежит центральная роль в активации свертывания крови, системы комплемента и ФАТа. Взятые вместе, перечисленный реакции вызывают реакцию со стороны тромбоцитов.
 СРБ как маркер воспаления и сердечно-сосудистых заболеваний Увеличение содержания в крови провоспалительных цитокинов TNF-α, ИЛ-1, ИЛ-6 и фибриногена выявляется у больных с нестабильной стенокардией и коррелирует с риском развития первичного и возвратного инфаркта миокарда и летального исхода. В случае воспалительных или инфекционных заболеваний эти медиаторы обычно повышены лишь в острый период. У больных ИБС их уровень в крови сохраняется стабильно высоким на протяжении многих лет, свидетельствуя о повышенном риске развития осложнений ИБС. Наиболее убедительно связь между воспалительным ответом и изменениями в кровеносных сосудах демонстрируется при сопоставлении результатов определения содержания в крови СРБ с характером течения сердечно- сосудистых заболеваний. Повышенный уровень СРБ является индикатором высокой степени риска смертельных исходов от инфаркта миокарда у больных со стенокардией, в 2 раза увеличивает риск развития инсульта у больных с гипертонической болезнью и заболеваний периферических артерий, в раза увеличивает риск развития в будущем 3 возрастной катаракты. Уровень СРБ повышен у курильщиков, лиц с увеличенным индексом массы тела, хроническими асимпотоматическими инфекциями, у пожилых людей.
СРБ как маркер воспаления и сердечно-сосудистых заболеваний Увеличение содержания в крови провоспалительных цитокинов TNF-α, ИЛ-1, ИЛ-6 и фибриногена выявляется у больных с нестабильной стенокардией и коррелирует с риском развития первичного и возвратного инфаркта миокарда и летального исхода. В случае воспалительных или инфекционных заболеваний эти медиаторы обычно повышены лишь в острый период. У больных ИБС их уровень в крови сохраняется стабильно высоким на протяжении многих лет, свидетельствуя о повышенном риске развития осложнений ИБС. Наиболее убедительно связь между воспалительным ответом и изменениями в кровеносных сосудах демонстрируется при сопоставлении результатов определения содержания в крови СРБ с характером течения сердечно- сосудистых заболеваний. Повышенный уровень СРБ является индикатором высокой степени риска смертельных исходов от инфаркта миокарда у больных со стенокардией, в 2 раза увеличивает риск развития инсульта у больных с гипертонической болезнью и заболеваний периферических артерий, в раза увеличивает риск развития в будущем 3 возрастной катаракты. Уровень СРБ повышен у курильщиков, лиц с увеличенным индексом массы тела, хроническими асимпотоматическими инфекциями, у пожилых людей.
 В большом эпидемиологическом исследовании, выполненном на протяжении 2, 5 лет на пожилых людях, установлено, что у лиц с повышенным уровнем СРБ увеличен риск развития осложнений (инфаркт миокарда, летальный исход), причем риск среди женщин в два раза выше чем среди мужчин – в 4, 5 и 2, 7 раза, соответственно. При исследовании эффективности применения аспирина и бета-каротина в лечении ИБС выявлено, что у лиц с наиболее высоким уровнем СРБ в 2 раза увеличен риск инсульта, в 3 раза инфаркта миокарда и в 2 -4 раза болезней периферических артерий. Из различных показателей только отношение общий ХС: ЛПВП-ХС было сопоставимо с повышенным СРБ в отношении способности предсказывать характер течения ИБС. В обоих случаях курение не влияло на значимость увеличенного СРБ, как маркера осложнений ИБС.
В большом эпидемиологическом исследовании, выполненном на протяжении 2, 5 лет на пожилых людях, установлено, что у лиц с повышенным уровнем СРБ увеличен риск развития осложнений (инфаркт миокарда, летальный исход), причем риск среди женщин в два раза выше чем среди мужчин – в 4, 5 и 2, 7 раза, соответственно. При исследовании эффективности применения аспирина и бета-каротина в лечении ИБС выявлено, что у лиц с наиболее высоким уровнем СРБ в 2 раза увеличен риск инсульта, в 3 раза инфаркта миокарда и в 2 -4 раза болезней периферических артерий. Из различных показателей только отношение общий ХС: ЛПВП-ХС было сопоставимо с повышенным СРБ в отношении способности предсказывать характер течения ИБС. В обоих случаях курение не влияло на значимость увеличенного СРБ, как маркера осложнений ИБС.
 Наше понимание этиологии и патогенеза атеросклероза и сердечно-сосудистых заболеваний, методов их лечения и профилактики претерпевает решительные изменения. Простота проведения скрининга широких слоев населения с использованием стандартизованного ВОЗ высокочувствительно метода определения СРБ позволяет использовать уровень СРБ в плазме крови как один из важнейших критериев риска атеросклероза ИБС, наряду с традиционными липидными показателями. Проведение широкомасштабных исследований эффективности антибиотиков в профилактике осложнений ИБС позволит ответить на вопрос о возможной инфекционной этиологии. Выяснение противовоспалительных свойств статинов позволит более широко использовать эти препараты в терапии ИБС, не только как средства гиполипидемического действия. Перспективным представляется использование в диетотерапии и диетопрофилактике ИБС и ее осложнений пищевых продуктов, содержащих природные ингибиторы ОМГ-Ко. А редуктазы , токоферолы и полифенольные соединения.
Наше понимание этиологии и патогенеза атеросклероза и сердечно-сосудистых заболеваний, методов их лечения и профилактики претерпевает решительные изменения. Простота проведения скрининга широких слоев населения с использованием стандартизованного ВОЗ высокочувствительно метода определения СРБ позволяет использовать уровень СРБ в плазме крови как один из важнейших критериев риска атеросклероза ИБС, наряду с традиционными липидными показателями. Проведение широкомасштабных исследований эффективности антибиотиков в профилактике осложнений ИБС позволит ответить на вопрос о возможной инфекционной этиологии. Выяснение противовоспалительных свойств статинов позволит более широко использовать эти препараты в терапии ИБС, не только как средства гиполипидемического действия. Перспективным представляется использование в диетотерапии и диетопрофилактике ИБС и ее осложнений пищевых продуктов, содержащих природные ингибиторы ОМГ-Ко. А редуктазы , токоферолы и полифенольные соединения.
 Амилоид А Содержание сывороточного белка амилоида А у взрослых в норме составляет менее 0, 4 мг/л. Амилоидоз — диспротеиноз, сопровождающийся глубоким нарушением белкового обмена, появлением аномального фибриллярного белка в межуточной ткани и стенках сосудов сложного вещества — амилоида. Высокая концентрация САА в сыворотке крови является маркером АА-амилоидоза, который может быть первичным (периодическая болезнь, болезнь Маккла и Уэлса) и вторичным. Вторичный амилоидоз развивается как осложнение ряда заболеваний: n хронических инфекций (особенно туберкулеза) n болезней, характеризующихся гнойно-деструктивными процессами (хронические неспецифические заболевания легких, остеомиелит) n злокачественных заболеваний (парапротеинемии, лимфогранулематоз, рак) n ревматических болезней (особенно ревматоидного артрита) n При воспалительных процессах концентрация САА в сыворотке крови может увеличиваться очень значительно, особенно когда сопутствует вторичный амилоидоз. n Концентрация САА в сыворотке крови повышается уже через несколько часов после инсульта, реагируя аналогично С-реактивному белку, но в большей степени.
Амилоид А Содержание сывороточного белка амилоида А у взрослых в норме составляет менее 0, 4 мг/л. Амилоидоз — диспротеиноз, сопровождающийся глубоким нарушением белкового обмена, появлением аномального фибриллярного белка в межуточной ткани и стенках сосудов сложного вещества — амилоида. Высокая концентрация САА в сыворотке крови является маркером АА-амилоидоза, который может быть первичным (периодическая болезнь, болезнь Маккла и Уэлса) и вторичным. Вторичный амилоидоз развивается как осложнение ряда заболеваний: n хронических инфекций (особенно туберкулеза) n болезней, характеризующихся гнойно-деструктивными процессами (хронические неспецифические заболевания легких, остеомиелит) n злокачественных заболеваний (парапротеинемии, лимфогранулематоз, рак) n ревматических болезней (особенно ревматоидного артрита) n При воспалительных процессах концентрация САА в сыворотке крови может увеличиваться очень значительно, особенно когда сопутствует вторичный амилоидоз. n Концентрация САА в сыворотке крови повышается уже через несколько часов после инсульта, реагируя аналогично С-реактивному белку, но в большей степени.
 Гаптоглобин n Гаптоглобин (Нр) — гликопротеин плазмы крови, специфически связывающий гемо глобин. Содержание его в различных возрастных группах колеблется в достаточно широких пределах. 50 480 мг/л у новорождённых. Более 60 лет 350 1750 мг/л. Основной физиологической функцией гаптоглобина является сохранение железа в организме, кроме того, комплекс гемоглобин гаптоглобин обладает высокой пероксидазной активностью, оказывая тормозящий эффект на процессы перекисного окисления липидов. Снижение уровня гаптоглобина выявляется при всех видах гемолиза in vivo — аутоиммунном, изоиммунном (при переливании крови, для диагностики необходимо провести исследование до и после переливания), механическом (искусственные клапаны сердца, бактериальный эндокардит, травмы); при острых и хронических заболеваниях печени; может встречаться при неэффективном эритропоэзе (дефицит фолиевой кислоты, гемоглобинопатии); дефектах мембраны эритроцитов или метаболизма (дефицит глюкозо 6 фосфатдегидрогеназы); увеличении селезенки. Содержание гаптоглобина в сыворотке крови повышается при злокачественных новообразованиях некоторых локализаций (рак молочной железы, желудочно кишечного тракта, гениталий, легкого и др. ). Обнаруживаются также изменения представительства типов гаптоглобина в сыворотке крови больных раком гениталий и молочной железы, заключающиеся в преобладании Нр 1 — 1 при злокачественных опухолях молочной железы и в достоверном снижении содержания Нр 2— 2 при раке шейки матки.
Гаптоглобин n Гаптоглобин (Нр) — гликопротеин плазмы крови, специфически связывающий гемо глобин. Содержание его в различных возрастных группах колеблется в достаточно широких пределах. 50 480 мг/л у новорождённых. Более 60 лет 350 1750 мг/л. Основной физиологической функцией гаптоглобина является сохранение железа в организме, кроме того, комплекс гемоглобин гаптоглобин обладает высокой пероксидазной активностью, оказывая тормозящий эффект на процессы перекисного окисления липидов. Снижение уровня гаптоглобина выявляется при всех видах гемолиза in vivo — аутоиммунном, изоиммунном (при переливании крови, для диагностики необходимо провести исследование до и после переливания), механическом (искусственные клапаны сердца, бактериальный эндокардит, травмы); при острых и хронических заболеваниях печени; может встречаться при неэффективном эритропоэзе (дефицит фолиевой кислоты, гемоглобинопатии); дефектах мембраны эритроцитов или метаболизма (дефицит глюкозо 6 фосфатдегидрогеназы); увеличении селезенки. Содержание гаптоглобина в сыворотке крови повышается при злокачественных новообразованиях некоторых локализаций (рак молочной железы, желудочно кишечного тракта, гениталий, легкого и др. ). Обнаруживаются также изменения представительства типов гаптоглобина в сыворотке крови больных раком гениталий и молочной железы, заключающиеся в преобладании Нр 1 — 1 при злокачественных опухолях молочной железы и в достоверном снижении содержания Нр 2— 2 при раке шейки матки.
 α 2 макроглобулин n α 2 макроглобулин - белок острой фазы и маркер гломерулонефропатии (проницаемости клеточных мембран). Это высокомолекулярный гликопротеид. Благодаря высокой молекулярной массе (725 к. Д), этот белок содержится в основном только в плазме. Он является основным компонентом альфа-2 -глобулиновой фракции. n Альфа-2 -макроглобулин один из наиболее многофункциональных белков крови, который синтезируется в печени и поджелудочной железе. В нативном состоянии он способен присоединять и транспортировать многие цитокины (интерлейкины, интерфероны, факторы некроза опухоли, факторы роста). n α 2 макроглобулин – участвует в физиологической регуляции свёртывающей системы крови, лизиса сгустка и комплемента, а также в контроле за протеолитическим эффектом коллагеназ лейкоцитов, панкреатического трипсина и химотрипсина. Он быстро инактивирует протеазы, блокируя их протеолитическую активность по отношению к белкам и другим большим пептидам, так каждая его субъединица содержит «ловушку» для любого из протеолитических ферментов. При этом протеины сообщают возможность трансформировать молекулы альфа-2 -макроглобулина и способность присоединиться к различным рецепторам клеток, образуя комплекс альфа 2 макроглобулин протеаза, который выводится из крови через печень.
α 2 макроглобулин n α 2 макроглобулин - белок острой фазы и маркер гломерулонефропатии (проницаемости клеточных мембран). Это высокомолекулярный гликопротеид. Благодаря высокой молекулярной массе (725 к. Д), этот белок содержится в основном только в плазме. Он является основным компонентом альфа-2 -глобулиновой фракции. n Альфа-2 -макроглобулин один из наиболее многофункциональных белков крови, который синтезируется в печени и поджелудочной железе. В нативном состоянии он способен присоединять и транспортировать многие цитокины (интерлейкины, интерфероны, факторы некроза опухоли, факторы роста). n α 2 макроглобулин – участвует в физиологической регуляции свёртывающей системы крови, лизиса сгустка и комплемента, а также в контроле за протеолитическим эффектом коллагеназ лейкоцитов, панкреатического трипсина и химотрипсина. Он быстро инактивирует протеазы, блокируя их протеолитическую активность по отношению к белкам и другим большим пептидам, так каждая его субъединица содержит «ловушку» для любого из протеолитических ферментов. При этом протеины сообщают возможность трансформировать молекулы альфа-2 -макроглобулина и способность присоединиться к различным рецепторам клеток, образуя комплекс альфа 2 макроглобулин протеаза, который выводится из крови через печень.
 Церулоплазмин n Церулоплазмин. В этом белке содержится около 95% общего количества меди сыворотки крови: на одну молекулу церулоплазмина приходится 6 - 8 атомов меди. Основная физиологическая роль церулоплазмина определяется его участием в окислительно-восстановительных реакциях. Действуя как ферроксидаза, церулоплазмин выполняет важнейшую роль в регуляции ионного состояния железа - окислении Fe 2+ в Fe 3+. Это делает возможным включение железа в трансферрин без образования токсических продуктов железа. Поддержание нормального транспорта и метаболизма железа — жизненно важная функция церулоплазмина. При дефиците железа происходит активация транскрипции гена церулоплазмина гипоксия-индуцибельным фактором-1 (HIF- 1), который также активирует гены эритропоэтина, трансферрина и его рецептора. n Церулоплазмин может действовать как прооксидант или как антиоксидант в зависимости от наличия других факторов. В присутствии супероксида (например, в воспаленном сосудистом эндотелии), он выступает катализатором окисления липопротеидов низкой плотности. На основании результатов эпидемиологических исследований, церулоплазмин рассматривается как независимый фактор риска сердечно-сосудистых заболеваний.
Церулоплазмин n Церулоплазмин. В этом белке содержится около 95% общего количества меди сыворотки крови: на одну молекулу церулоплазмина приходится 6 - 8 атомов меди. Основная физиологическая роль церулоплазмина определяется его участием в окислительно-восстановительных реакциях. Действуя как ферроксидаза, церулоплазмин выполняет важнейшую роль в регуляции ионного состояния железа - окислении Fe 2+ в Fe 3+. Это делает возможным включение железа в трансферрин без образования токсических продуктов железа. Поддержание нормального транспорта и метаболизма железа — жизненно важная функция церулоплазмина. При дефиците железа происходит активация транскрипции гена церулоплазмина гипоксия-индуцибельным фактором-1 (HIF- 1), который также активирует гены эритропоэтина, трансферрина и его рецептора. n Церулоплазмин может действовать как прооксидант или как антиоксидант в зависимости от наличия других факторов. В присутствии супероксида (например, в воспаленном сосудистом эндотелии), он выступает катализатором окисления липопротеидов низкой плотности. На основании результатов эпидемиологических исследований, церулоплазмин рассматривается как независимый фактор риска сердечно-сосудистых заболеваний.
 Альфа 1 антитрипсин n Альфа-1 -aнтитрипсин – это белок, синтезируемый в печени, основная функция которого заключается в ингибировании протеаз биологических жидкостей организма в реакциях апоптоза. n Альфа-1 -aнтитрипсин является «активатором острой фазы» его высокий уровень регистрируется при бактериальных инфекциях, ревматоидном артрите, васкулите, неоплазиях. n Довольно часто встречаются стертые формы врожденной антитрипсиновой недостаточности. Выраженный дефицит альфа-1 -антитрипсина часто сочетается с ювенильной базальной эмфиземой легких, муковисцидозом. Приобретенный дефицит альфа-1 -антитрипсина встречается при нефротическом синдроме, гастроэнтеропатии с потерей белка, острой фазе термических ожогов. Снижение альфа-1 -антитрипсина в крови может быть у больных вирусным гепатитом вследствие нарушения его синтеза в печени. Повышенное расходование этого гликопротеида при респираторном ди-стресс синдроме, остром панкреатите, коагулопатиях также приводит к снижению его содержания в крови
Альфа 1 антитрипсин n Альфа-1 -aнтитрипсин – это белок, синтезируемый в печени, основная функция которого заключается в ингибировании протеаз биологических жидкостей организма в реакциях апоптоза. n Альфа-1 -aнтитрипсин является «активатором острой фазы» его высокий уровень регистрируется при бактериальных инфекциях, ревматоидном артрите, васкулите, неоплазиях. n Довольно часто встречаются стертые формы врожденной антитрипсиновой недостаточности. Выраженный дефицит альфа-1 -антитрипсина часто сочетается с ювенильной базальной эмфиземой легких, муковисцидозом. Приобретенный дефицит альфа-1 -антитрипсина встречается при нефротическом синдроме, гастроэнтеропатии с потерей белка, острой фазе термических ожогов. Снижение альфа-1 -антитрипсина в крови может быть у больных вирусным гепатитом вследствие нарушения его синтеза в печени. Повышенное расходование этого гликопротеида при респираторном ди-стресс синдроме, остром панкреатите, коагулопатиях также приводит к снижению его содержания в крови
 Альфа 1 кислый гликопротеин n Альфа 1 кислый гликопротеин (орозомукоид) – основной показатель развития воспаления. n Содержание орозомукоида возрастает при различных инфекциях, опухолевом процессе, хирургических вмешательствах. Он является одним из белков острой фазы воспаления. Обнаружена корреляция в содержании орозомукоида, креатинфосфокиназы, лактатдегидрогеназы с размерами инфаркта миокарда, а также определена высокая степень корреляции с содержанием миоглобина при инфаркте. Считается, что повышение концентрации орозомукоида в крови больных на 14 -й день после инфаркта является прогностическим признаком развития недостаточсности кровообращения в течение года.
Альфа 1 кислый гликопротеин n Альфа 1 кислый гликопротеин (орозомукоид) – основной показатель развития воспаления. n Содержание орозомукоида возрастает при различных инфекциях, опухолевом процессе, хирургических вмешательствах. Он является одним из белков острой фазы воспаления. Обнаружена корреляция в содержании орозомукоида, креатинфосфокиназы, лактатдегидрогеназы с размерами инфаркта миокарда, а также определена высокая степень корреляции с содержанием миоглобина при инфаркте. Считается, что повышение концентрации орозомукоида в крови больных на 14 -й день после инфаркта является прогностическим признаком развития недостаточсности кровообращения в течение года.
 Компоненты комплемента n Комплемент С 1 — компонент комплемента, состоящий из трех белков, при фиксации которых комплексом антиген — антитело образуется фермент с эстеразной активностью. n Комплемент СЗ — центральный компонент системы комплемента, белок острой фазы воспаления. Это важнейшая часть защитной системы против инфекций. Он образуется в печени, макрофагах, фибробластах, лимфоидной ткани и коже. Поэтому нарушение их нормального состояния существенно влияет на этот комплемент. C 3 составляет около 70% всех белков системы комплемента. n С 4 компонент - один из белков системы комплемента, синтезируется в печени. Его определение важно для диагностики иммунных заболеваний, при которых он адсорбируется на иммунных комплексах. С 4 - компонент классического пути активации системы комплемента. Его присутствие необходимо для реакций фагоцитоза. Повышение концентрации может наблюдаться при злокачественных новообразованиях, снижение характерно для болезни иммунных комплексов, при гломерулонефрите, системной красной волчанке. n Комплемент С 9 — компоненты комплемента, после фиксации которых на поверхности клетки наступают необратимые повреждения цитоплазматической мембраны.
Компоненты комплемента n Комплемент С 1 — компонент комплемента, состоящий из трех белков, при фиксации которых комплексом антиген — антитело образуется фермент с эстеразной активностью. n Комплемент СЗ — центральный компонент системы комплемента, белок острой фазы воспаления. Это важнейшая часть защитной системы против инфекций. Он образуется в печени, макрофагах, фибробластах, лимфоидной ткани и коже. Поэтому нарушение их нормального состояния существенно влияет на этот комплемент. C 3 составляет около 70% всех белков системы комплемента. n С 4 компонент - один из белков системы комплемента, синтезируется в печени. Его определение важно для диагностики иммунных заболеваний, при которых он адсорбируется на иммунных комплексах. С 4 - компонент классического пути активации системы комплемента. Его присутствие необходимо для реакций фагоцитоза. Повышение концентрации может наблюдаться при злокачественных новообразованиях, снижение характерно для болезни иммунных комплексов, при гломерулонефрите, системной красной волчанке. n Комплемент С 9 — компоненты комплемента, после фиксации которых на поверхности клетки наступают необратимые повреждения цитоплазматической мембраны.
 The End
The End

