система ИНФ и ВИЧ.2003ppt.ppt
- Количество слайдов: 15
 Система інтерферону при ВІЛінфекції ОЛЕКСАНДРІВНА ВИКОНАЛА: МАГІСТР ІІ РОКУ НАВЧАННЯ КАФЕДРИ ВІРУСОЛОГІЇ ННЦ «ІНСТИТУТ БІОЛОГІЇ» КНУ ІМ. Т. Г. ШЕВЧЕНКА ЧАЙКА ДАР'Я
Система інтерферону при ВІЛінфекції ОЛЕКСАНДРІВНА ВИКОНАЛА: МАГІСТР ІІ РОКУ НАВЧАННЯ КАФЕДРИ ВІРУСОЛОГІЇ ННЦ «ІНСТИТУТ БІОЛОГІЇ» КНУ ІМ. Т. Г. ШЕВЧЕНКА ЧАЙКА ДАР'Я
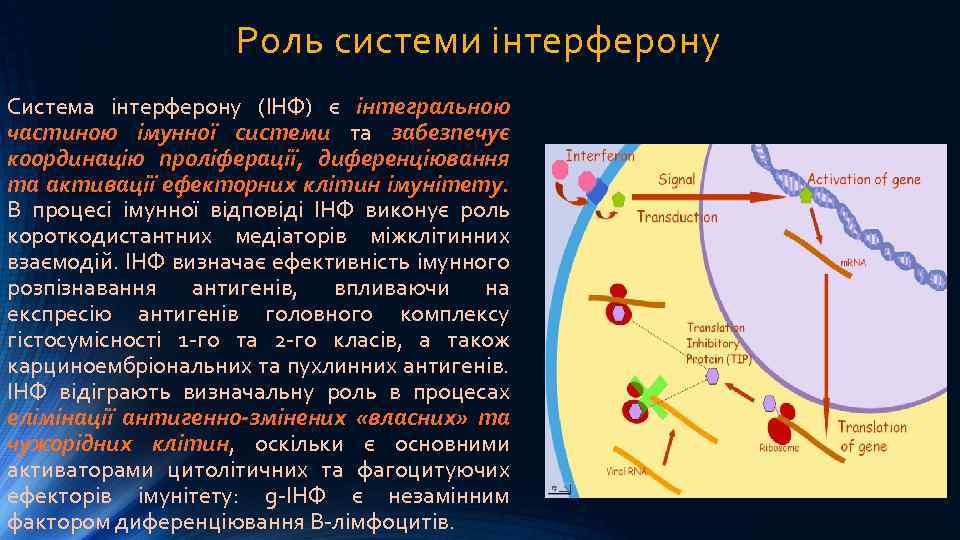 Роль системи інтерферону Система інтерферону (ІНФ) є інтегральною частиною імунної системи та забезпечує координацію проліферації, диференціювання та активації ефекторних клітин імунітету. В процесі імунної відповіді ІНФ виконує роль короткодистантних медіаторів міжклітинних взаємодій. ІНФ визначає ефективність імунного розпізнавання антигенів, впливаючи на експресію антигенів головного комплексу гістосумісності 1 -го та 2 -го класів, а також карциноембріональних та пухлинних антигенів. ІНФ відіграють визначальну роль в процесах елімінації антигенно-змінених «власних» та чужорідних клітин, оскільки є основними активаторами цитолітичних та фагоцитуючих ефекторів імунітету: g-ІНФ є незамінним фактором диференціювання В-лімфоцитів.
Роль системи інтерферону Система інтерферону (ІНФ) є інтегральною частиною імунної системи та забезпечує координацію проліферації, диференціювання та активації ефекторних клітин імунітету. В процесі імунної відповіді ІНФ виконує роль короткодистантних медіаторів міжклітинних взаємодій. ІНФ визначає ефективність імунного розпізнавання антигенів, впливаючи на експресію антигенів головного комплексу гістосумісності 1 -го та 2 -го класів, а також карциноембріональних та пухлинних антигенів. ІНФ відіграють визначальну роль в процесах елімінації антигенно-змінених «власних» та чужорідних клітин, оскільки є основними активаторами цитолітичних та фагоцитуючих ефекторів імунітету: g-ІНФ є незамінним фактором диференціювання В-лімфоцитів.
 Стадії перебігу ВІЛ-інфекції ВІЛ-інфекція характеризується прогресуючою дисфункцією імунної системи, яка виражається глибокими порушеннями в системі ІНФ у тому числі. Для зручності викладу ВІЛ-інфекція розділена на 3 традиційних стадії: 1. ВІЛ-сероконверсія, коли в сироватці періодично виявляються антитіла до ВІЛ, проте інші клінічні ознаки відсутні; 2. Стадію генералізованої неспецифічної лімфоаденопатії; 3. Клінічно виражений СНІД. Дефекти в системі ІНФ простежуються на кожній із стадій, але їх характер та глибина відрізняються.
Стадії перебігу ВІЛ-інфекції ВІЛ-інфекція характеризується прогресуючою дисфункцією імунної системи, яка виражається глибокими порушеннями в системі ІНФ у тому числі. Для зручності викладу ВІЛ-інфекція розділена на 3 традиційних стадії: 1. ВІЛ-сероконверсія, коли в сироватці періодично виявляються антитіла до ВІЛ, проте інші клінічні ознаки відсутні; 2. Стадію генералізованої неспецифічної лімфоаденопатії; 3. Клінічно виражений СНІД. Дефекти в системі ІНФ простежуються на кожній із стадій, але їх характер та глибина відрізняються.
 Пригнічення ІНФ репродукції ВІЛ володіє інтерфероногенними властивостями, обумовленими наявністю в лідуючій послідовності РНК 3`-LTR до промотора SP-6 подвійної спіралі, що складається із 40 пар нуклеотидів. Ця особливість геному ВІЛ вказує також на потенційну чутливість вірусу до індукованих ІНФ класичних противірусних механізмів - дс. РНК-залежних 2`, 5`оліго(А)синтетазі та протеїнкіназі фактору ініціації синтезу білка ei. F 2. Проте під дією ІНФ не відбувається повного пригнічення репродукції ВІЛ. В цьому відношенні ретровіруси принципово відрізняються від літичних вірусів. За впливу ІНФ активність зворотньої транскриптази та синтез вірусних білків знижуються лише на 70%. Повного пригічення репродукції ВІЛ вдалося досягнути на експериментальній моделі при постійній продукції ІНФ ендогенно. В клітини нирок зелених мавп ввели плазміду, що містить ВІЛ-промотор (3`-LTR), інтегрований із геном людського а 2 -ІНФ, експресія якого регулюється трансактивуючим фактором – продуктом гену tat. Експресія плазмідного гена а 2 -ІНФ в трасфектних клітинах призводила до активації внутрішньоклітинної 2`, 5`оліго(А)синтетази. В цілому, можливість повної елімінації ВІЛ із культури постійній експресії ІНФ ендогенно становить значний інтерес. Хоча механізм цього явища поки не встановлений, все одно не викликає сумнімів необхідність вивчення індукторів ІНФ щонайменш на 1ій стадії ВІЛ-інфекції.
Пригнічення ІНФ репродукції ВІЛ володіє інтерфероногенними властивостями, обумовленими наявністю в лідуючій послідовності РНК 3`-LTR до промотора SP-6 подвійної спіралі, що складається із 40 пар нуклеотидів. Ця особливість геному ВІЛ вказує також на потенційну чутливість вірусу до індукованих ІНФ класичних противірусних механізмів - дс. РНК-залежних 2`, 5`оліго(А)синтетазі та протеїнкіназі фактору ініціації синтезу білка ei. F 2. Проте під дією ІНФ не відбувається повного пригнічення репродукції ВІЛ. В цьому відношенні ретровіруси принципово відрізняються від літичних вірусів. За впливу ІНФ активність зворотньої транскриптази та синтез вірусних білків знижуються лише на 70%. Повного пригічення репродукції ВІЛ вдалося досягнути на експериментальній моделі при постійній продукції ІНФ ендогенно. В клітини нирок зелених мавп ввели плазміду, що містить ВІЛ-промотор (3`-LTR), інтегрований із геном людського а 2 -ІНФ, експресія якого регулюється трансактивуючим фактором – продуктом гену tat. Експресія плазмідного гена а 2 -ІНФ в трасфектних клітинах призводила до активації внутрішньоклітинної 2`, 5`оліго(А)синтетази. В цілому, можливість повної елімінації ВІЛ із культури постійній експресії ІНФ ендогенно становить значний інтерес. Хоча механізм цього явища поки не встановлений, все одно не викликає сумнімів необхідність вивчення індукторів ІНФ щонайменш на 1ій стадії ВІЛ-інфекції.
 ІНФ як маркер вірусних інфекцій В клінічних спостереженнях були, в основному, підтверджені експериментальні дані стосовно неповного пригнічення ВІЛ при лікуванні екзогенним ІНФ. При щоденному підшкірному введенні 35. 000 МЕ рекомбінантного а-ІНФ протягом 8 -12 тижнів хворим на СНІД, у них відмічено значне, а у деяких навіть повне пригнічення вірусних антигенів в циркуляції. Однак впливу ІНФ-терапії на динаміку циркулюючих антитіл до кору ВІЛ не було виявлено, що підтверджує персистенцію інфекції. У здорових осіб ІНФ у сироватці, як правило, не виявляється або циркулює у дуже низьких титрах. При різних вірусних іфнекціях, а також онкологічних та аутоімунних захворюваннях ІНФ у сироватках з’являється постійно, при цьому його титр наростає паралельно тяжкості захворювання. На сьогоднішній день накопичено пул інформації, який дозволяє зробити заключення, що поява ІНФ в сироватці може слугувати в якості біологічного маркера вірусної інфекції, а в багатьох випадках і онкологічних захворювань. Також варто відзначити, що циркулюючий ІНФ, як правило, відноситься до виду а, проте частина циркулюючого ІНФ відрізняється незвичайною властивістюкислотолабільністю.
ІНФ як маркер вірусних інфекцій В клінічних спостереженнях були, в основному, підтверджені експериментальні дані стосовно неповного пригнічення ВІЛ при лікуванні екзогенним ІНФ. При щоденному підшкірному введенні 35. 000 МЕ рекомбінантного а-ІНФ протягом 8 -12 тижнів хворим на СНІД, у них відмічено значне, а у деяких навіть повне пригнічення вірусних антигенів в циркуляції. Однак впливу ІНФ-терапії на динаміку циркулюючих антитіл до кору ВІЛ не було виявлено, що підтверджує персистенцію інфекції. У здорових осіб ІНФ у сироватці, як правило, не виявляється або циркулює у дуже низьких титрах. При різних вірусних іфнекціях, а також онкологічних та аутоімунних захворюваннях ІНФ у сироватках з’являється постійно, при цьому його титр наростає паралельно тяжкості захворювання. На сьогоднішній день накопичено пул інформації, який дозволяє зробити заключення, що поява ІНФ в сироватці може слугувати в якості біологічного маркера вірусної інфекції, а в багатьох випадках і онкологічних захворювань. Також варто відзначити, що циркулюючий ІНФ, як правило, відноситься до виду а, проте частина циркулюючого ІНФ відрізняється незвичайною властивістюкислотолабільністю.
 Циркуляція кислотолабільного а-ІНФ як прогностична ознака Присутність кислотолабільного а-ІНФ в циркуляції у хворих на СНІД було встановлено вже на ранніх етапах дослідження інфекції: він виявлявся у 60 -80% хворих із генералізованою лімфоаденопатією та клінічно вираженим СНІДом. Титр циркулюючого кислотолабільного а-ІНФ наростав по мірі збільшення клінічної тяжкості інфекції: на стадії генералізованої лімфоаденопатії титр в середньому дорівнював 7, 7 МЕ/мл, а при прояві клінічних симптомів СНІД— 28, 7 МЕ/мл. В інших спостереженнях було показано, що збільшення титру циркулюючого ІНФ корелювало із гематологічними симптомами імунодефіциту. Зворотня кореляція простежувалася із загальною кількістю лімфоцитів та із субпопуляцією Т-хелперів, та пряма-із концентрацією Ig. A в сироватці. За даними багатьох досліджень поява циркулюючого в крові кислотолабільного а-ІНФ виявляється в середньому за 6, 5 місяців до прояву клінічних симптомів СНІДу та може слугувати найбільш раннім прогностичним показником. Однак, кислотолабільний а-ІНФ виявлявся лише у 65 -70% хворих. Інші серопозитивні хворі не мали цієї діагностичної ознаки. Цей факт до теперішнього часу не отримав пояснення та заслуговує спеціального дослідження. наявність циркулюючого кислотолабільного а-ІНФ у постійних титрах >16 МЕ/мл в групі ризику є прогностичною ознакою та вказує на високу вірогідність (60 — 80%) розвитку клінічних симптомів СНІДу напротязі кількох місяців. Таким чином,
Циркуляція кислотолабільного а-ІНФ як прогностична ознака Присутність кислотолабільного а-ІНФ в циркуляції у хворих на СНІД було встановлено вже на ранніх етапах дослідження інфекції: він виявлявся у 60 -80% хворих із генералізованою лімфоаденопатією та клінічно вираженим СНІДом. Титр циркулюючого кислотолабільного а-ІНФ наростав по мірі збільшення клінічної тяжкості інфекції: на стадії генералізованої лімфоаденопатії титр в середньому дорівнював 7, 7 МЕ/мл, а при прояві клінічних симптомів СНІД— 28, 7 МЕ/мл. В інших спостереженнях було показано, що збільшення титру циркулюючого ІНФ корелювало із гематологічними симптомами імунодефіциту. Зворотня кореляція простежувалася із загальною кількістю лімфоцитів та із субпопуляцією Т-хелперів, та пряма-із концентрацією Ig. A в сироватці. За даними багатьох досліджень поява циркулюючого в крові кислотолабільного а-ІНФ виявляється в середньому за 6, 5 місяців до прояву клінічних симптомів СНІДу та може слугувати найбільш раннім прогностичним показником. Однак, кислотолабільний а-ІНФ виявлявся лише у 65 -70% хворих. Інші серопозитивні хворі не мали цієї діагностичної ознаки. Цей факт до теперішнього часу не отримав пояснення та заслуговує спеціального дослідження. наявність циркулюючого кислотолабільного а-ІНФ у постійних титрах >16 МЕ/мл в групі ризику є прогностичною ознакою та вказує на високу вірогідність (60 — 80%) розвитку клінічних симптомів СНІДу напротязі кількох місяців. Таким чином,
 Циркуляція інгібітора ІНФ при ВІЛ-інфекції та СНІДі Другою особливістю ВІЛ-інфекції, яка також має діагностичне значення, є наявність в циркуляції інгібітора (або інактиватора ІНФ). Відомо, що у фізіологічній нормі в сироватці периферійної крові можуть виявлятися інгібітори ІНФ типу 1 ( a та b). При вірусній інфекції частота їх виявлення істотно зростає. При вивченні сироватки хворих СНІДом, ускладненим саркомою Капоші, інгібітор виявлений у 80%, при цьому у 2/3 із них титр був достатній для інактивації більш ніж 50 МЕ/мл a-ІНФ. Проте, в друній групі хворих із саркомою Капоші, які не мали діагностичних ознак СНІДу, у жодного хворого інгібітора у сироватці не було. Не виявлявся інгібітор і у неускладнених хворих із лімфоаденопатією. Таким чином, циркулюючий інгібітор ІНФ типу 1 є діагностичною ознакою, яка проявляється на ІІІ стадії ВІЛ-інфекції, одночасно із клінічними ознаками СНІДу. Хімічна природа інгібітора ІНФ типу 1 вивчена ще недостатньо. За деякими даними його структура нагадує структуру g-ІНФ. Взаємодія ІНФ із клітиною здійснюється через специфічні рецептори із виключно високою афінністю. Імунобіологічні ефекти ІНФ реалізуються лише через рецептори. ІНФ типу 1 мають загальний рецептор із молекулярною масою 110 к. Д, розпізнаюча частина є гангліозидом. Рецептор g-ІНФ складається із 2 х білкових компонентів із молекулярною масою 50 × 90 к. Д. Експресія рецепторів на клітині підлягає функціональним змінам та пригнічується під впливом ІНФ. Постійна присутність кислотолабільного а-ІНФ в циркуляції при ВІЛ-інфекції призводить до пригнічення експресії клітинних рецепторів до ІНФ типу 1, в той час як експресія рецепторів до ІНФ типу 2 на всіх клінічних стадіях не змінюється.
Циркуляція інгібітора ІНФ при ВІЛ-інфекції та СНІДі Другою особливістю ВІЛ-інфекції, яка також має діагностичне значення, є наявність в циркуляції інгібітора (або інактиватора ІНФ). Відомо, що у фізіологічній нормі в сироватці периферійної крові можуть виявлятися інгібітори ІНФ типу 1 ( a та b). При вірусній інфекції частота їх виявлення істотно зростає. При вивченні сироватки хворих СНІДом, ускладненим саркомою Капоші, інгібітор виявлений у 80%, при цьому у 2/3 із них титр був достатній для інактивації більш ніж 50 МЕ/мл a-ІНФ. Проте, в друній групі хворих із саркомою Капоші, які не мали діагностичних ознак СНІДу, у жодного хворого інгібітора у сироватці не було. Не виявлявся інгібітор і у неускладнених хворих із лімфоаденопатією. Таким чином, циркулюючий інгібітор ІНФ типу 1 є діагностичною ознакою, яка проявляється на ІІІ стадії ВІЛ-інфекції, одночасно із клінічними ознаками СНІДу. Хімічна природа інгібітора ІНФ типу 1 вивчена ще недостатньо. За деякими даними його структура нагадує структуру g-ІНФ. Взаємодія ІНФ із клітиною здійснюється через специфічні рецептори із виключно високою афінністю. Імунобіологічні ефекти ІНФ реалізуються лише через рецептори. ІНФ типу 1 мають загальний рецептор із молекулярною масою 110 к. Д, розпізнаюча частина є гангліозидом. Рецептор g-ІНФ складається із 2 х білкових компонентів із молекулярною масою 50 × 90 к. Д. Експресія рецепторів на клітині підлягає функціональним змінам та пригнічується під впливом ІНФ. Постійна присутність кислотолабільного а-ІНФ в циркуляції при ВІЛ-інфекції призводить до пригнічення експресії клітинних рецепторів до ІНФ типу 1, в той час як експресія рецепторів до ІНФ типу 2 на всіх клінічних стадіях не змінюється.
 Деформації в системі 2’, 5’-оліго(А)синтетази при ВІЛ-інфекції та СНІДі Біологічні ефекти ІНФ обумовлені специфічними змінами в метаболізмі клітини. Відомо, що під дією ІНФ в цитоплазмі з’являється більш ніж 20 нових білків. Найбільш вивченим ІНФ-залежним ферментом є 2`, 5`-оліго(А)синтетаза, яка активується всіма трьома видами ІНФ (a, b та g) в присутності двохспіральної РНК, що складається з щонайменш 20 нуклеотидів. Під дією цього ферменту на основі АТФ синтезується ряд коротких поліаденілатів, з’єднаних незвичайним 2`-5`-фосфодіефірним зв’язком. 2`, 5`олігоаденілати є сильними активаторами клітинних ендонуклеаз, зокрема, РНКази L. Активація ендонуклеаз попереджує зчитування вірусної інформації. При ВІЛ-інфекції відмічені деформації в системі 2`, 5`-оліго(А)синтетази. У хворих на стадії генералізованої лімфоаденопатії активність цього фермента значно зростає, а при ускладненні СНІДу опортуністичними інфекціями або саркомою Капоші досягає максимальних значень. При цьому підвищений фон активності 2`, 5`-оліго(А)синтетази у хворих на СНІД супроводжується зниженням чутливості фермента до активуючої дії ІНФ. У хворих на СНІД описаний дефект і в другій ланці 2`, 5`-оліго(А)синтетази — на рівні РНКази L. Вже на стадії генералізованої лімфоаденопатії активність цього фермента була в середньому на 55% нижча, ніж у здорових донорів.
Деформації в системі 2’, 5’-оліго(А)синтетази при ВІЛ-інфекції та СНІДі Біологічні ефекти ІНФ обумовлені специфічними змінами в метаболізмі клітини. Відомо, що під дією ІНФ в цитоплазмі з’являється більш ніж 20 нових білків. Найбільш вивченим ІНФ-залежним ферментом є 2`, 5`-оліго(А)синтетаза, яка активується всіма трьома видами ІНФ (a, b та g) в присутності двохспіральної РНК, що складається з щонайменш 20 нуклеотидів. Під дією цього ферменту на основі АТФ синтезується ряд коротких поліаденілатів, з’єднаних незвичайним 2`-5`-фосфодіефірним зв’язком. 2`, 5`олігоаденілати є сильними активаторами клітинних ендонуклеаз, зокрема, РНКази L. Активація ендонуклеаз попереджує зчитування вірусної інформації. При ВІЛ-інфекції відмічені деформації в системі 2`, 5`-оліго(А)синтетази. У хворих на стадії генералізованої лімфоаденопатії активність цього фермента значно зростає, а при ускладненні СНІДу опортуністичними інфекціями або саркомою Капоші досягає максимальних значень. При цьому підвищений фон активності 2`, 5`-оліго(А)синтетази у хворих на СНІД супроводжується зниженням чутливості фермента до активуючої дії ІНФ. У хворих на СНІД описаний дефект і в другій ланці 2`, 5`-оліго(А)синтетази — на рівні РНКази L. Вже на стадії генералізованої лімфоаденопатії активність цього фермента була в середньому на 55% нижча, ніж у здорових донорів.
 Порушення функціонування природних кілерів при ВІЛ-інфекції та СНІДі Цитоліз антигенно змінених клітин природними кілерами (ПК) є важливим механізмом противірусного імунітету. Детермінантами для імунного розпізнавання мішеней для ПК слугують антигени головного комплексу гістосумісності, тому їх активність не залежить від сенсибілізації, присутності антитіл або комплементу. ВІЛ-інфіковані лімфоцити виявляються високочутливими до дії ПК. Моноцити та макрофаги, інфіковані ВІЛ, також інтенсивно підлягають цитолізу ПК, виділеними із крові ВІЛ-серонегативних людей. Однак, ПК, виділені від ВІЛ-серопозитивних людей із давністю сероконверсії 15 місяців, володіли вже в 2 -2, 5 рази меншою активністю. Ще більш глибока депресія ПК відмічена у 90% хворих із клінічно вираженим СНІДом. Відомо, що цитолітична функція знаходиться під аутокринним-паракринним контролем ІНФ. При взаємодії із антигенно зміненою клітиною-мішенню ПК продукують a- або g-ІНФ, забезпечуючи рекрутування ефекторних клітин із попередників та їх активацію. ПК, виділені від ВІЛ-серопозитивних донорів або хворих СНІДом при взаємодії із клітинами-мішенями продукували лише незначну кількість ІНФ. Це вказує на глибоку депресію ПК у хворих із клінічно вираженим СНІДом. В той же час,
Порушення функціонування природних кілерів при ВІЛ-інфекції та СНІДі Цитоліз антигенно змінених клітин природними кілерами (ПК) є важливим механізмом противірусного імунітету. Детермінантами для імунного розпізнавання мішеней для ПК слугують антигени головного комплексу гістосумісності, тому їх активність не залежить від сенсибілізації, присутності антитіл або комплементу. ВІЛ-інфіковані лімфоцити виявляються високочутливими до дії ПК. Моноцити та макрофаги, інфіковані ВІЛ, також інтенсивно підлягають цитолізу ПК, виділеними із крові ВІЛ-серонегативних людей. Однак, ПК, виділені від ВІЛ-серопозитивних людей із давністю сероконверсії 15 місяців, володіли вже в 2 -2, 5 рази меншою активністю. Ще більш глибока депресія ПК відмічена у 90% хворих із клінічно вираженим СНІДом. Відомо, що цитолітична функція знаходиться під аутокринним-паракринним контролем ІНФ. При взаємодії із антигенно зміненою клітиною-мішенню ПК продукують a- або g-ІНФ, забезпечуючи рекрутування ефекторних клітин із попередників та їх активацію. ПК, виділені від ВІЛ-серопозитивних донорів або хворих СНІДом при взаємодії із клітинами-мішенями продукували лише незначну кількість ІНФ. Це вказує на глибоку депресію ПК у хворих із клінічно вираженим СНІДом. В той же час,
 Висновки Отже, із всього вищевказаного стає зрозумілим, що система ІНФ задіяна у патогенезі ВІЛ-інфекції. Глибина деформацій системи ІНФ зростає паралельно із ускладненням клінічних проявів інфекції. На стадії сероконверсії основним дефектом, який має прогностичне значення, є поява в сироватці периферійної крові хворого кислотолабільного а-ІНФ. Циркулюючий ІНФ призводить до пригнічення експресії клітинних рецепторів до ІНФ типу 1 та постійного підвищення рівня активності 2`, 5`оліго(А)синтетази. На стадії генералізованої лімфоаденопатії вказані дефекти продовжують поглиблюватися та починає проявлятися рефрактерність клітин крові до продукції і-ІНФ у відповідь на вірусну або антигенну індукцію. Одночасно (а можливо і внаслідок цього) знижується цитолітична активність ПК у відношенні ВІЛ-інфікованих клітин. Знижується активність РНКазы L. На стадії клінічно вираженого СНІДу депресія системи ІНФ ще більше наростає, в сироватці зявляється інгібітор/інактиватор а-ІНФ. При аналізі стану системи ІНФ при ВІЛ-інфекції необхідно враховувати, що всі описані вище явища імунодепресії проявляються лише у відношенні ІНФ типу 1, головним чином аІНФ. Система g-ІНФ на усіх стадіях ВІЛ-інфекції не зазнає певних істотних деформацій на всіх стадіях ВІЛ-інфекції.
Висновки Отже, із всього вищевказаного стає зрозумілим, що система ІНФ задіяна у патогенезі ВІЛ-інфекції. Глибина деформацій системи ІНФ зростає паралельно із ускладненням клінічних проявів інфекції. На стадії сероконверсії основним дефектом, який має прогностичне значення, є поява в сироватці периферійної крові хворого кислотолабільного а-ІНФ. Циркулюючий ІНФ призводить до пригнічення експресії клітинних рецепторів до ІНФ типу 1 та постійного підвищення рівня активності 2`, 5`оліго(А)синтетази. На стадії генералізованої лімфоаденопатії вказані дефекти продовжують поглиблюватися та починає проявлятися рефрактерність клітин крові до продукції і-ІНФ у відповідь на вірусну або антигенну індукцію. Одночасно (а можливо і внаслідок цього) знижується цитолітична активність ПК у відношенні ВІЛ-інфікованих клітин. Знижується активність РНКазы L. На стадії клінічно вираженого СНІДу депресія системи ІНФ ще більше наростає, в сироватці зявляється інгібітор/інактиватор а-ІНФ. При аналізі стану системи ІНФ при ВІЛ-інфекції необхідно враховувати, що всі описані вище явища імунодепресії проявляються лише у відношенні ІНФ типу 1, головним чином аІНФ. Система g-ІНФ на усіх стадіях ВІЛ-інфекції не зазнає певних істотних деформацій на всіх стадіях ВІЛ-інфекції.
 Вчені пояснили механізм дії інтерферону на ВІЛ (01. 03. 2012 р. ) Механізм боротьби ІНФ із ВІЛ став відомий завдяки сумісній праці швейцарських та американських вчених (Proceedings of the National Academy of Sciences). Професор Сатіш Пілай (Satish K. Pilai) із колегами із Каліфорнійського Уіверситету в Сан-Франциско провів дослідження на пацієнтах, одночасно хворих гепатитом С та ВІЛ-інфекцією. ІНФ достатньо давно був відомий в якості засобу, який покращує стан пацієнтів із ВІЛінфекцією. Результати лабораторних досліджень попередніх років показали, що in vitro (в пробірці) ІНФ напряму пригнічує ВІЛ, проте в організмі механізм виявився абсолютно іншим. Групою Пілая встановлено, що при введенні ІНФ у пацієнта посилювалося вироблення двох білків-елементів імунної системи - АPOBEC 3 та тетерину, які відносяться до так званих факторів рестрикції. APOBEC 3 проникає у вірусні частки на стадії формування та порушує їх генетичний матеріал таким чином, що вони вже не здатні відтворюватися. Тетерин діє по-іншому: він прикріплюється до вірусу, який виходить із клітини, та буквально затягує його назад. Тим самим білок перешкоджає передачі вірусу іншим клітинам.
Вчені пояснили механізм дії інтерферону на ВІЛ (01. 03. 2012 р. ) Механізм боротьби ІНФ із ВІЛ став відомий завдяки сумісній праці швейцарських та американських вчених (Proceedings of the National Academy of Sciences). Професор Сатіш Пілай (Satish K. Pilai) із колегами із Каліфорнійського Уіверситету в Сан-Франциско провів дослідження на пацієнтах, одночасно хворих гепатитом С та ВІЛ-інфекцією. ІНФ достатньо давно був відомий в якості засобу, який покращує стан пацієнтів із ВІЛінфекцією. Результати лабораторних досліджень попередніх років показали, що in vitro (в пробірці) ІНФ напряму пригнічує ВІЛ, проте в організмі механізм виявився абсолютно іншим. Групою Пілая встановлено, що при введенні ІНФ у пацієнта посилювалося вироблення двох білків-елементів імунної системи - АPOBEC 3 та тетерину, які відносяться до так званих факторів рестрикції. APOBEC 3 проникає у вірусні частки на стадії формування та порушує їх генетичний матеріал таким чином, що вони вже не здатні відтворюватися. Тетерин діє по-іншому: він прикріплюється до вірусу, який виходить із клітини, та буквально затягує його назад. Тим самим білок перешкоджає передачі вірусу іншим клітинам.
 Вчені пояснили механізм дії інтерферону на ВІЛ (01. 03. 2012 р. ) Тим не менш, ВІЛ здатний протистояти дії як тетерину, так і APOBEC 3 за допомогою своїх власних білків Vpu та Vif, відповідно. Дослідники відібрали пацієнтів, задіяних в розпочатому у 1998 році Швейцарському когортному дослідженні ВІЛ (Swiss HIV Cohort Study). Ці хворі отримували ІНФ в якості ліків проти гепатиту та не приймали антиретровірусних засобів для пригнічення ВІЛ. Вчені брали аналізи у 20 хворих до, під час та після ін’єкції дози ІНФ. Виявилося, що найбільш високий рівень факторів рестрикції спостерігається після потрапляння ліків до кровотоку. У хворих із підвищеним рівнем вмісту APOBEC 3 та тетерину спостерігалася і найнижча активність вірусу імунодефіциту. Пілай закликав вчених якнайшвидше взяти на озброєння нове знання, застосування якого на практиці може швидко підвищити рівень факторів рестрикції в крові пацієнтів та підвищити опірність організму ВІЛ-інфекції.
Вчені пояснили механізм дії інтерферону на ВІЛ (01. 03. 2012 р. ) Тим не менш, ВІЛ здатний протистояти дії як тетерину, так і APOBEC 3 за допомогою своїх власних білків Vpu та Vif, відповідно. Дослідники відібрали пацієнтів, задіяних в розпочатому у 1998 році Швейцарському когортному дослідженні ВІЛ (Swiss HIV Cohort Study). Ці хворі отримували ІНФ в якості ліків проти гепатиту та не приймали антиретровірусних засобів для пригнічення ВІЛ. Вчені брали аналізи у 20 хворих до, під час та після ін’єкції дози ІНФ. Виявилося, що найбільш високий рівень факторів рестрикції спостерігається після потрапляння ліків до кровотоку. У хворих із підвищеним рівнем вмісту APOBEC 3 та тетерину спостерігалася і найнижча активність вірусу імунодефіциту. Пілай закликав вчених якнайшвидше взяти на озброєння нове знання, застосування якого на практиці може швидко підвищити рівень факторів рестрикції в крові пацієнтів та підвищити опірність організму ВІЛ-інфекції.
 Один з білків імунної системи допомагає ВІЛ заражати клітини – вчені (12. 04. 2013) Американські вчені з'ясували, що Інтерферон-1, який захищає організм людини від багатьох бактерій та вірусів, є своєрідним "троянським конем", який знищує ключові клітини імунної системи у випадку зараження організму вірусами, у тому числі ВІЛ або гепатитом. За словами керівника групи вчених Майкла Олдстоуна з інституту Скріппса у Ла-Хойї, нейтралізація молекул інтерферону-1 не посилювала інфекцію, а навпаки, допомагала організму боротися з нею. Як з'ясували вчені, IFN-1 у випадку тривалого зараження організму вірусами перетворюється на своєрідного "троянського коня". Експеримент проводився на мишах, що хворіли на лімфоцитарний хоріоменінгіт, який здатний викликати хронічну інфекцію, позбутися якої організм не може без медичної допомоги.
Один з білків імунної системи допомагає ВІЛ заражати клітини – вчені (12. 04. 2013) Американські вчені з'ясували, що Інтерферон-1, який захищає організм людини від багатьох бактерій та вірусів, є своєрідним "троянським конем", який знищує ключові клітини імунної системи у випадку зараження організму вірусами, у тому числі ВІЛ або гепатитом. За словами керівника групи вчених Майкла Олдстоуна з інституту Скріппса у Ла-Хойї, нейтралізація молекул інтерферону-1 не посилювала інфекцію, а навпаки, допомагала організму боротися з нею. Як з'ясували вчені, IFN-1 у випадку тривалого зараження організму вірусами перетворюється на своєрідного "троянського коня". Експеримент проводився на мишах, що хворіли на лімфоцитарний хоріоменінгіт, який здатний викликати хронічну інфекцію, позбутися якої організм не може без медичної допомоги.
 Один з білків імунної системи допомагає ВІЛ заражати клітини – вчені (12. 04. 2013) Під час експерименту вчені виявили, що імунна система мишей починала виробляти безліч молекул інтерферону через кілька днів після зараження. Під час спроби посилити менінгіт, придушивши роботу дендритних клітин, що виробляють молекули цього білка, вірусологи виявили, що концентрація вірусних частинок у мозку та крові спочатку збільшилася, а потім почала різко знижуватися. Виявилося, що постійно високі концентрації IFN-1 призводили до руйнування Т-клітин, що беруть участь у підготовці антитіл. Аналогічні процеси відбуваються й у випадку зараження ВІЛ та іншими ретровірусами. Вчені припускають, що віруси можуть використовувати інтерферони для придушення імунної системи.
Один з білків імунної системи допомагає ВІЛ заражати клітини – вчені (12. 04. 2013) Під час експерименту вчені виявили, що імунна система мишей починала виробляти безліч молекул інтерферону через кілька днів після зараження. Під час спроби посилити менінгіт, придушивши роботу дендритних клітин, що виробляють молекули цього білка, вірусологи виявили, що концентрація вірусних частинок у мозку та крові спочатку збільшилася, а потім почала різко знижуватися. Виявилося, що постійно високі концентрації IFN-1 призводили до руйнування Т-клітин, що беруть участь у підготовці антитіл. Аналогічні процеси відбуваються й у випадку зараження ВІЛ та іншими ретровірусами. Вчені припускають, що віруси можуть використовувати інтерферони для придушення імунної системи.
 Дякую за увагу!
Дякую за увагу!


