лекция амины.ppt
- Количество слайдов: 27
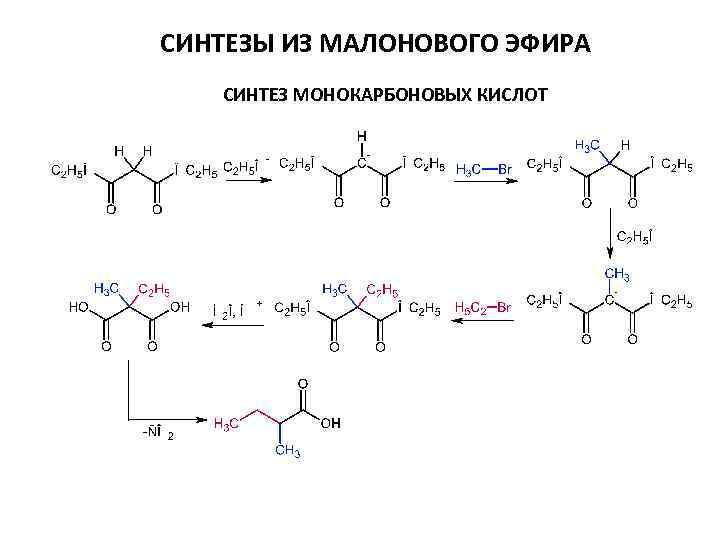
СИНТЕЗЫ ИЗ МАЛОНОВОГО ЭФИРА СИНТЕЗ МОНОКАРБОНОВЫХ КИСЛОТ
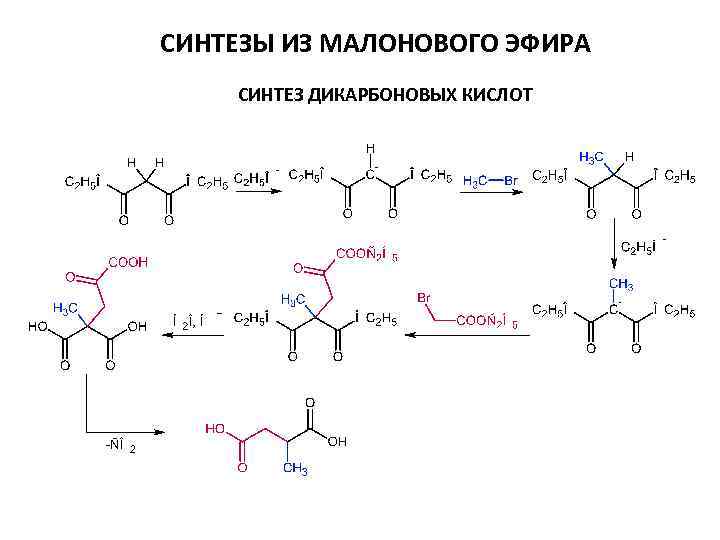
СИНТЕЗЫ ИЗ МАЛОНОВОГО ЭФИРА СИНТЕЗ ДИКАРБОНОВЫХ КИСЛОТ
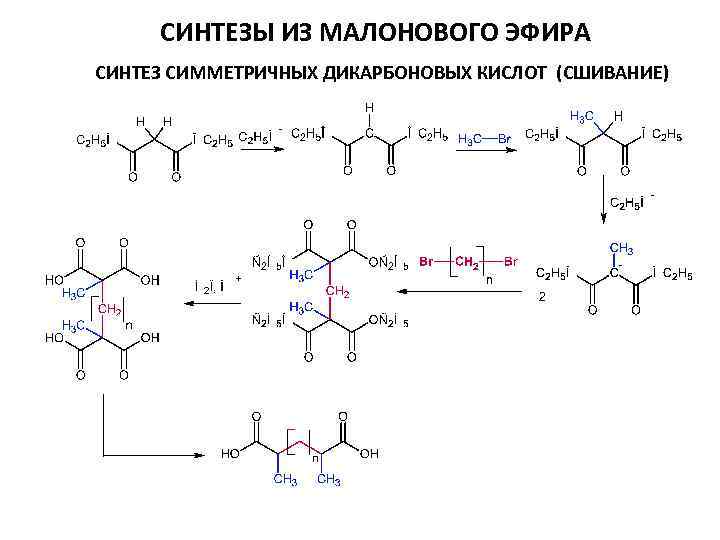
СИНТЕЗЫ ИЗ МАЛОНОВОГО ЭФИРА СИНТЕЗ СИММЕТРИЧНЫХ ДИКАРБОНОВЫХ КИСЛОТ (СШИВАНИЕ)
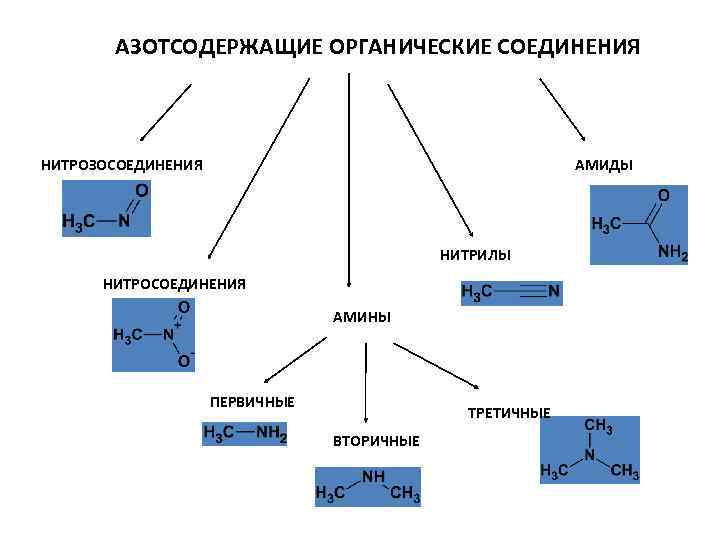
АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ НИТРОЗОСОЕДИНЕНИЯ АМИДЫ НИТРИЛЫ НИТРОСОЕДИНЕНИЯ АМИНЫ ПЕРВИЧНЫЕ ТРЕТИЧНЫЕ ВТОРИЧНЫЕ
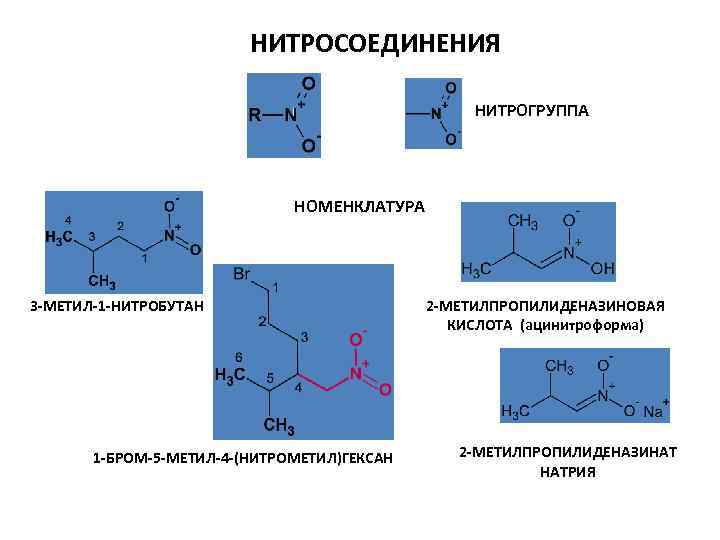
НИТРОСОЕДИНЕНИЯ НИТРОГРУППА НОМЕНКЛАТУРА 3 -МЕТИЛ-1 -НИТРОБУТАН 1 -БРОМ-5 -МЕТИЛ-4 -(НИТРОМЕТИЛ)ГЕКСАН 2 -МЕТИЛПРОПИЛИДЕНАЗИНОВАЯ КИСЛОТА (ацинитроформа) 2 -МЕТИЛПРОПИЛИДЕНАЗИНАТ НАТРИЯ
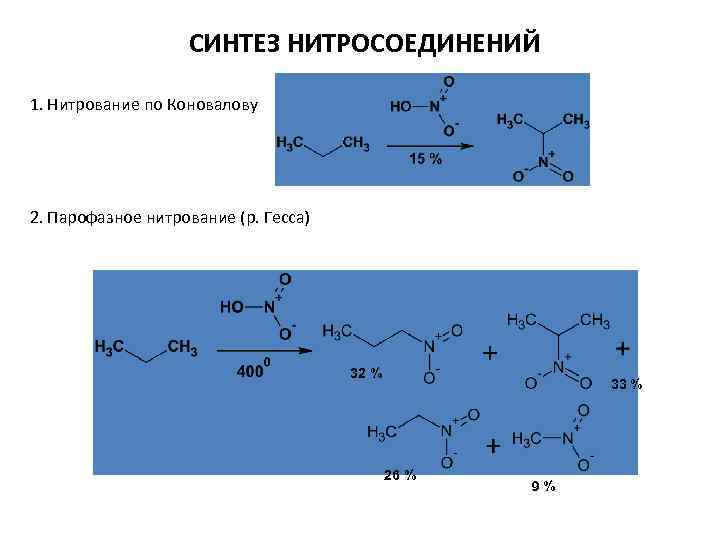
СИНТЕЗ НИТРОСОЕДИНЕНИЙ 1. Нитрование по Коновалову 2. Парофазное нитрование (р. Гесса) 32 % 33 % 26 % 9%
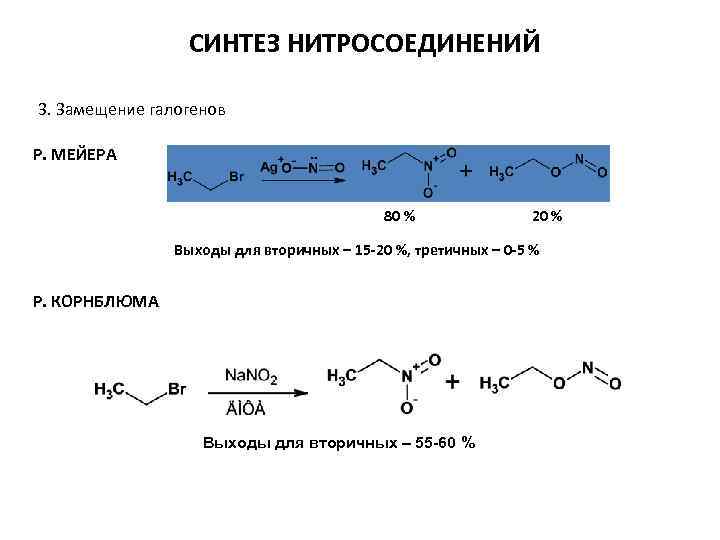
СИНТЕЗ НИТРОСОЕДИНЕНИЙ 3. Замещение галогенов Р. МЕЙЕРА 80 % 20 % Выходы для вторичных – 15 -20 %, третичных – 0 -5 % Р. КОРНБЛЮМА Выходы для вторичных – 55 -60 %
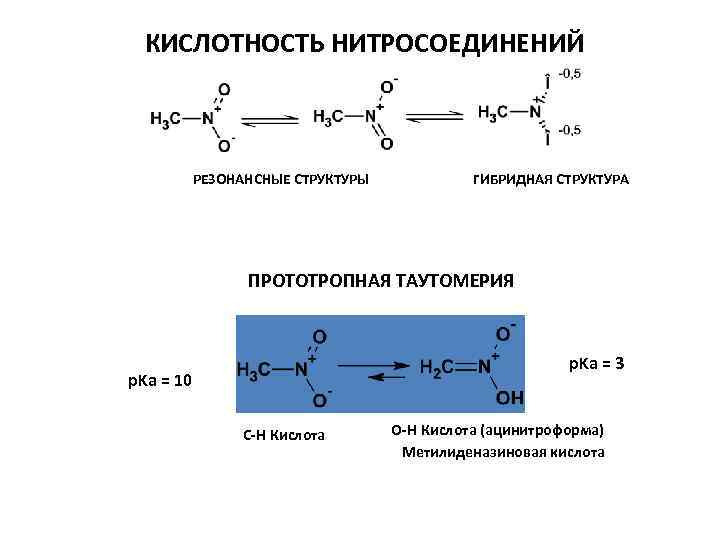
КИСЛОТНОСТЬ НИТРОСОЕДИНЕНИЙ РЕЗОНАНСНЫЕ СТРУКТУРЫ ГИБРИДНАЯ СТРУКТУРА ПРОТОТРОПНАЯ ТАУТОМЕРИЯ p. Ka = 3 p. Ka = 10 С-Н Кислота О-Н Кислота (ацинитроформа) Метилиденазиновая кислота
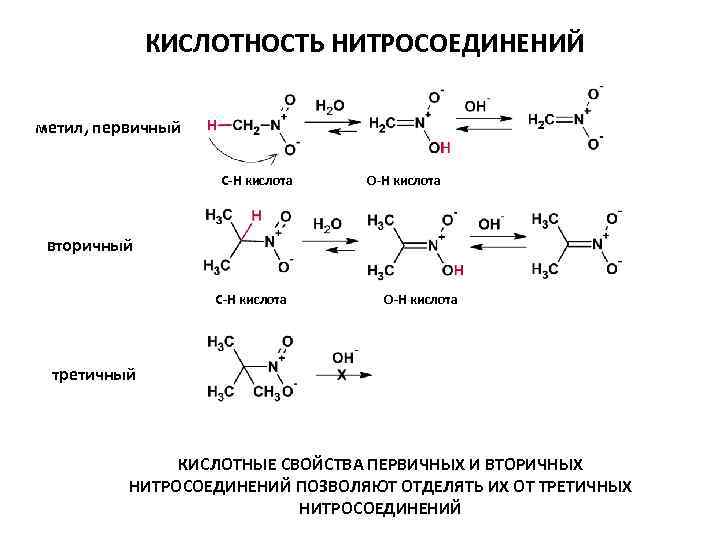
КИСЛОТНОСТЬ НИТРОСОЕДИНЕНИЙ метил, первичный C-H кислота О-H кислота вторичный C-H кислота О-H кислота третичный КИСЛОТНЫЕ СВОЙСТВА ПЕРВИЧНЫХ И ВТОРИЧНЫХ НИТРОСОЕДИНЕНИЙ ПОЗВОЛЯЮТ ОТДЕЛЯТЬ ИХ ОТ ТРЕТИЧНЫХ НИТРОСОЕДИНЕНИЙ
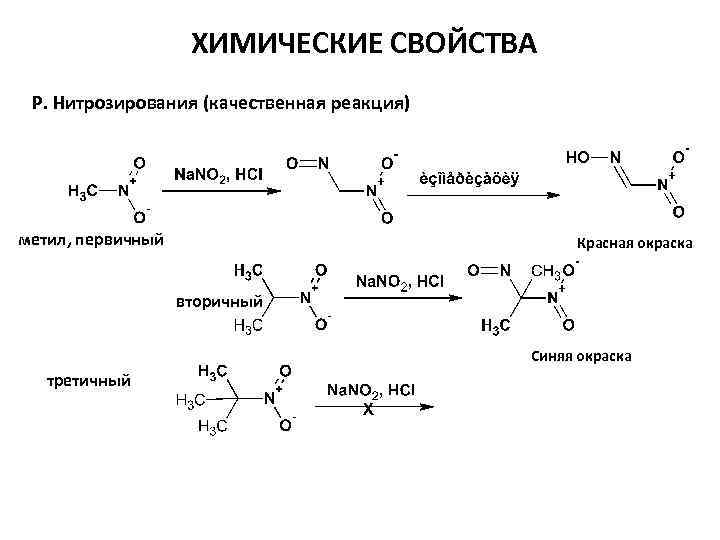
ХИМИЧЕСКИЕ СВОЙСТВА Р. Нитрозирования (качественная реакция) метил, первичный Красная окраска вторичный Синяя окраска третичный
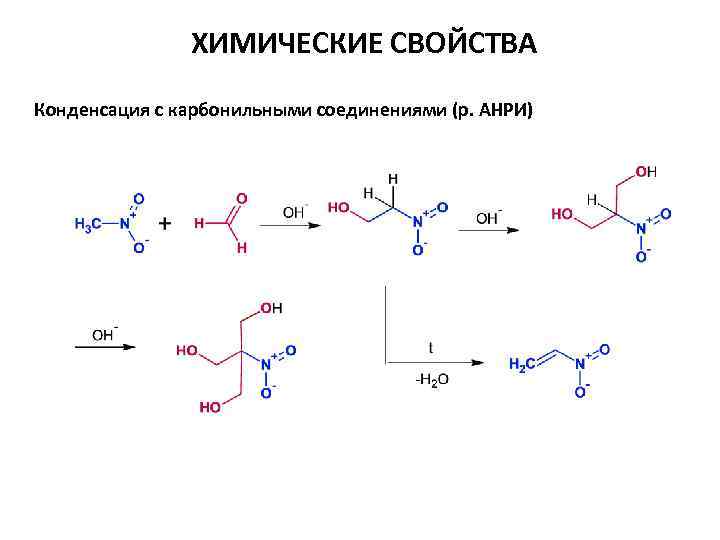
ХИМИЧЕСКИЕ СВОЙСТВА Конденсация с карбонильными соединениями (р. АНРИ)
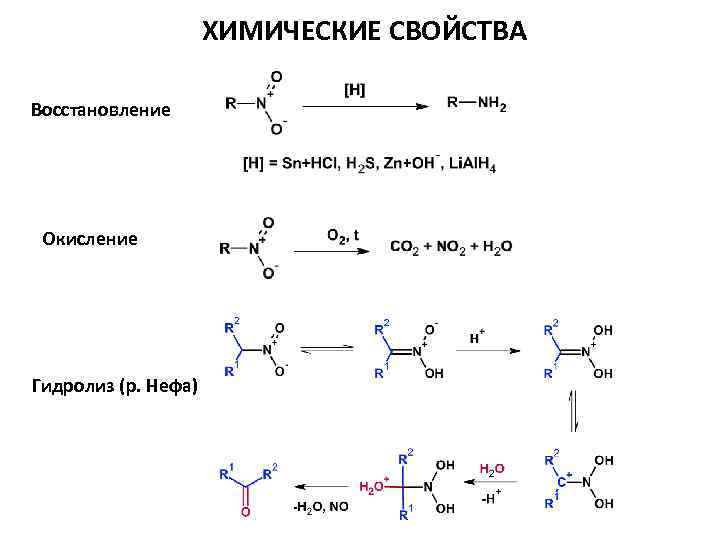
ХИМИЧЕСКИЕ СВОЙСТВА Восстановление Окисление Гидролиз (р. Нефа)
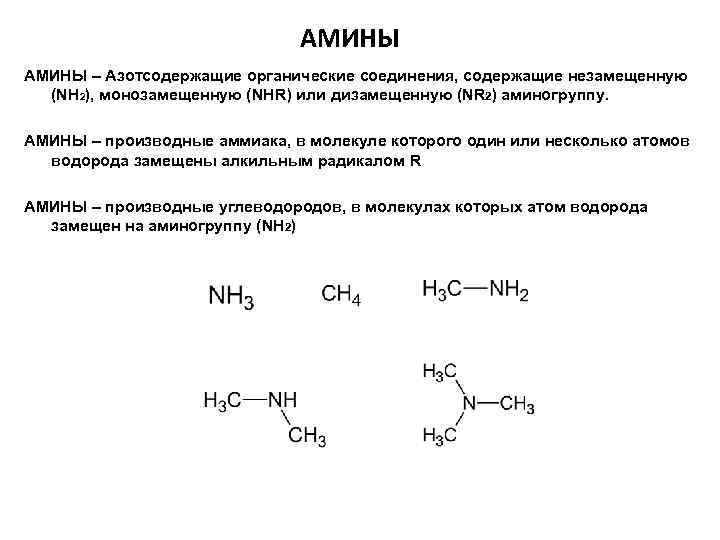
АМИНЫ – Азотсодержащие органические соединения, содержащие незамещенную (NH 2), монозамещенную (NHR) или дизамещенную (NR 2) аминогруппу. АМИНЫ – производные аммиака, в молекуле которого один или несколько атомов водорода замещены алкильным радикалом R АМИНЫ – производные углеводородов, в молекулах которых атом водорода замещен на аминогруппу (NH 2)
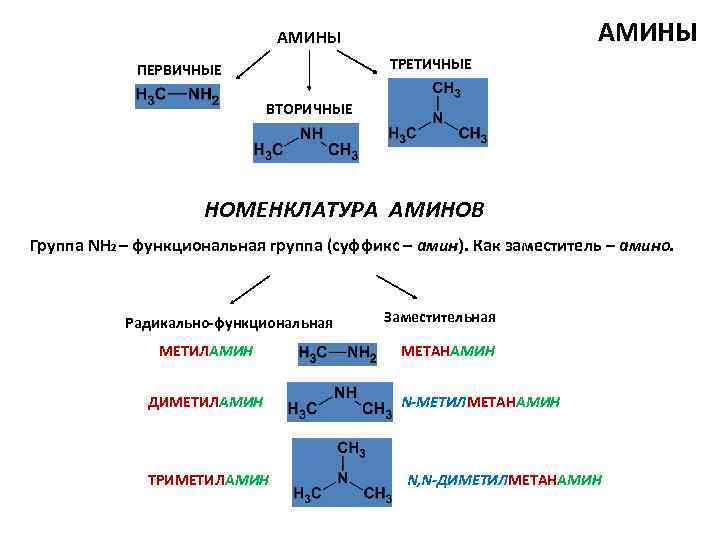
АМИНЫ ТРЕТИЧНЫЕ ПЕРВИЧНЫЕ ВТОРИЧНЫЕ НОМЕНКЛАТУРА АМИНОВ Группа NH 2 – функциональная группа (суффикс – амин). Как заместитель – амино. Радикально-функциональная МЕТИЛАМИН ДИМЕТИЛАМИН ТРИМЕТИЛАМИН Заместительная МЕТАНАМИН N-МЕТИЛМЕТАНАМИН N, N-ДИМЕТИЛМЕТАНАМИН
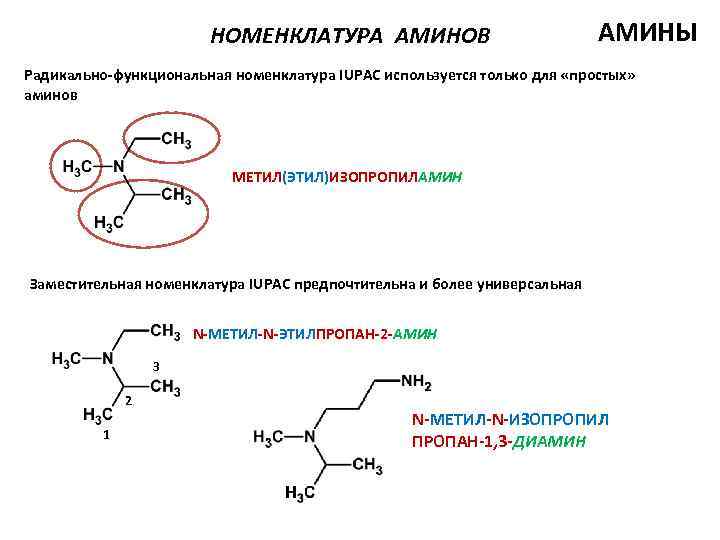
НОМЕНКЛАТУРА АМИНОВ АМИНЫ Радикально-функциональная номенклатура IUPAC используется только для «простых» аминов МЕТИЛ(ЭТИЛ)ИЗОПРОПИЛАМИН Заместительная номенклатура IUPAC предпочтительна и более универсальная N-МЕТИЛ-N-ЭТИЛПРОПАН-2 -АМИН 3 2 1 N-МЕТИЛ-N-ИЗОПРОПИЛ ПРОПАН-1, 3 -ДИАМИН
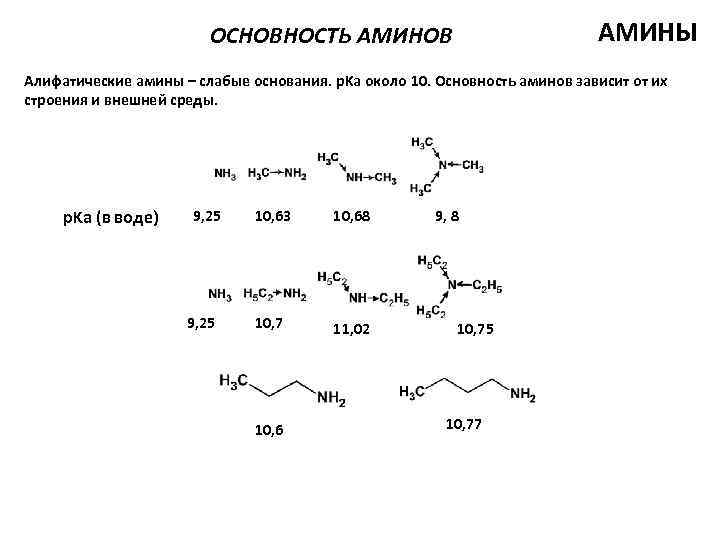
АМИНЫ ОСНОВНОСТЬ АМИНОВ Алифатические амины – слабые основания. p. Ka около 10. Основность аминов зависит от их строения и внешней среды. p. Ka (в воде) 9, 25 10, 63 10, 68 10, 7 11, 02 10, 6 9, 8 10, 75 10, 77
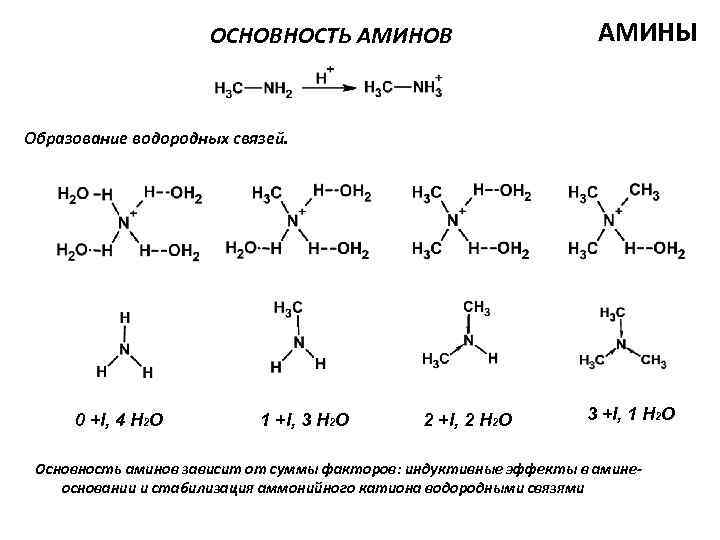
ОСНОВНОСТЬ АМИНОВ АМИНЫ Образование водородных связей. 0 +I, 4 H 2 O 1 +I, 3 H 2 O 2 +I, 2 H 2 O 3 +I, 1 H 2 O Основность аминов зависит от суммы факторов: индуктивные эффекты в аминеосновании и стабилизация аммонийного катиона водородными связями
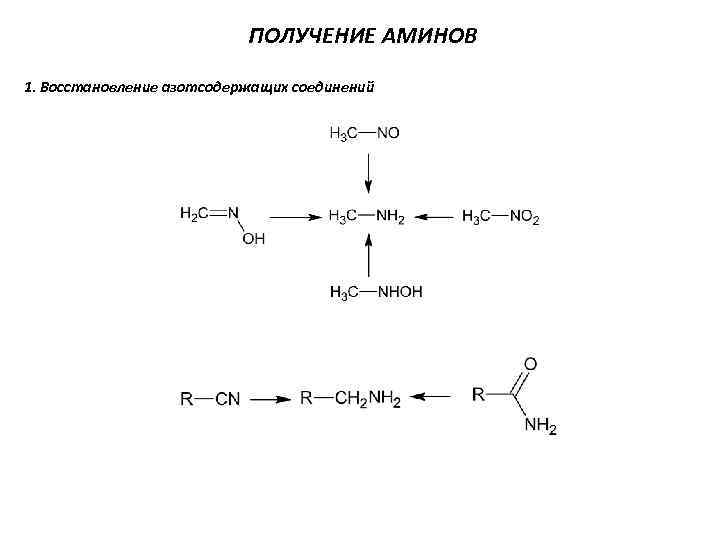
ПОЛУЧЕНИЕ АМИНОВ 1. Восстановление азотсодержащих соединений
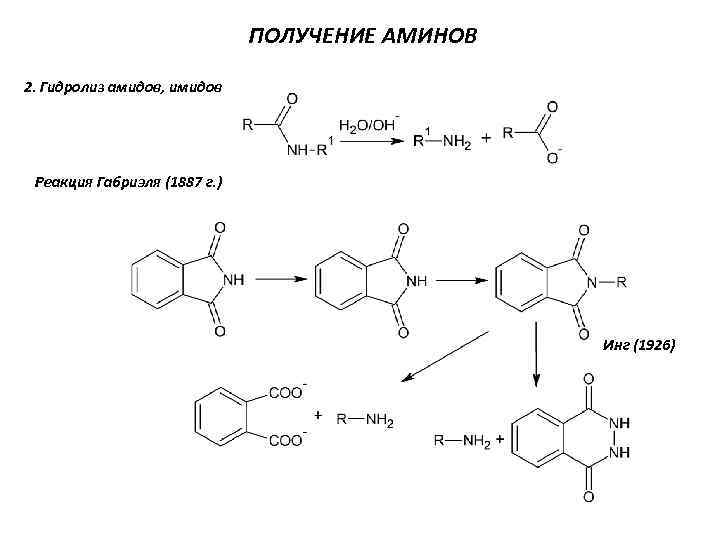
ПОЛУЧЕНИЕ АМИНОВ 2. Гидролиз амидов, имидов Реакция Габриэля (1887 г. ) Инг (1926)
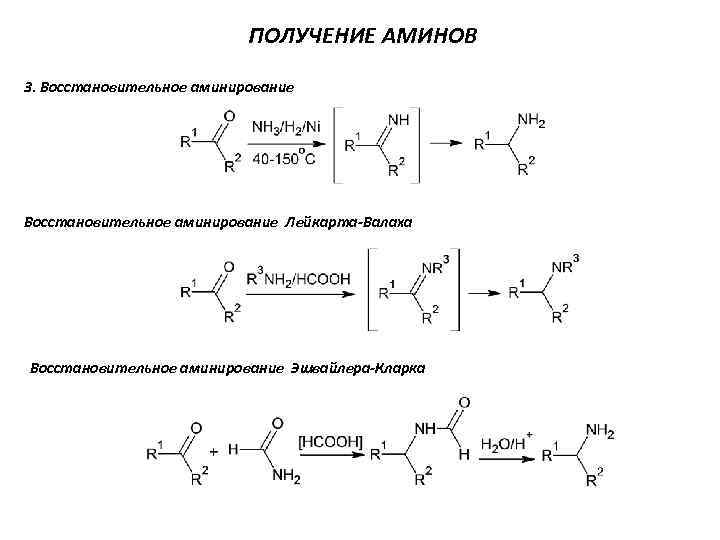
ПОЛУЧЕНИЕ АМИНОВ 3. Восстановительное аминирование Лейкарта-Валаха Восстановительное аминирование Эшвайлера-Кларка
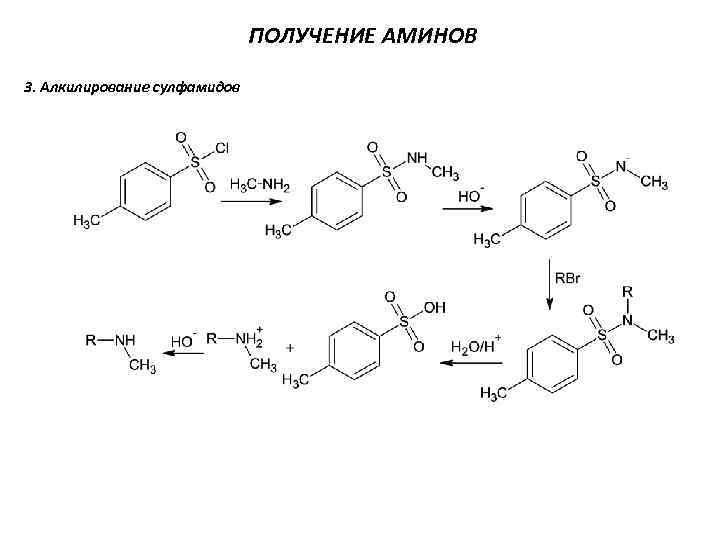
ПОЛУЧЕНИЕ АМИНОВ 3. Алкилирование сулфамидов
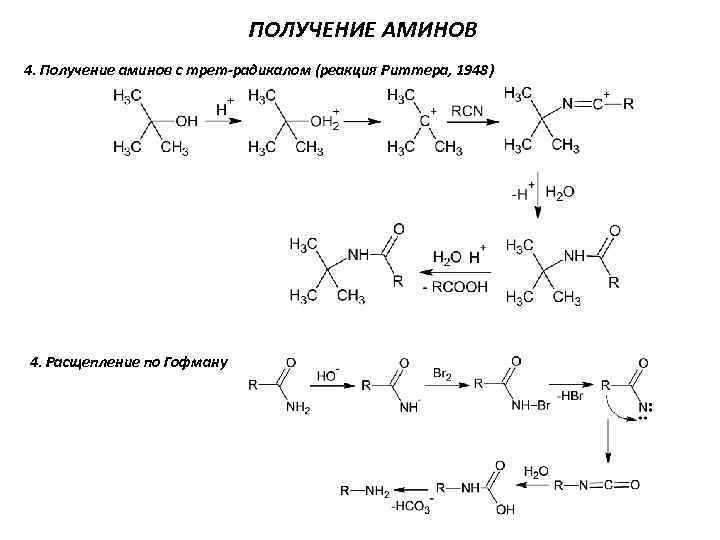
ПОЛУЧЕНИЕ АМИНОВ 4. Получение аминов с трет-радикалом (реакция Риттера, 1948) 4. Расщепление по Гофману
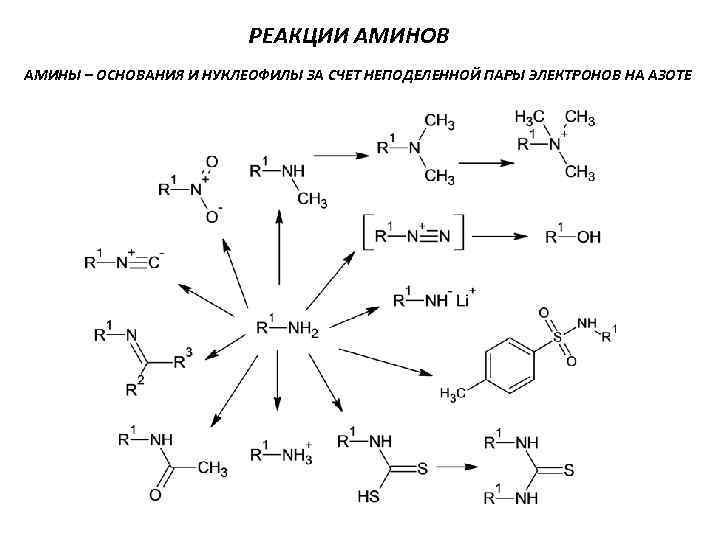
РЕАКЦИИ АМИНОВ АМИНЫ – ОСНОВАНИЯ И НУКЛЕОФИЛЫ ЗА СЧЕТ НЕПОДЕЛЕННОЙ ПАРЫ ЭЛЕКТРОНОВ НА АЗОТЕ
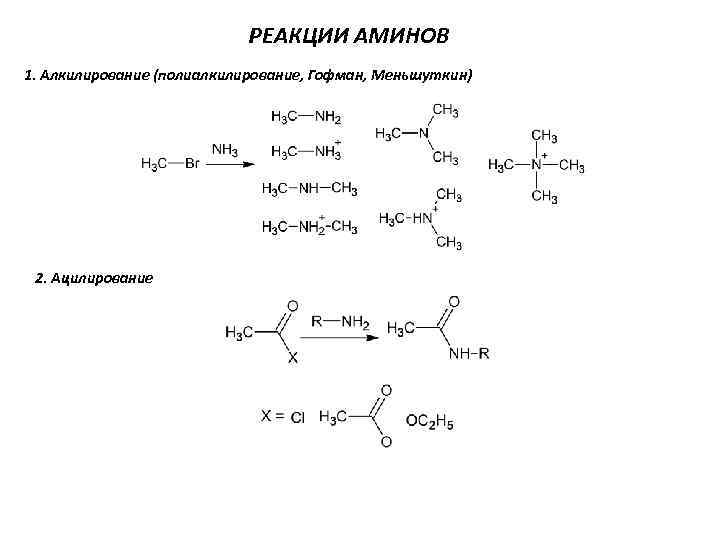
РЕАКЦИИ АМИНОВ 1. Алкилирование (полиалкилирование, Гофман, Меньшуткин) 2. Ацилирование
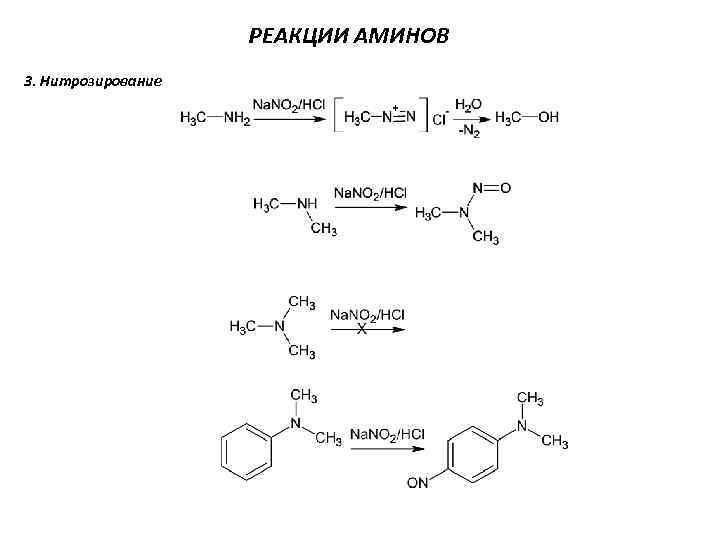
РЕАКЦИИ АМИНОВ 3. Нитрозирование
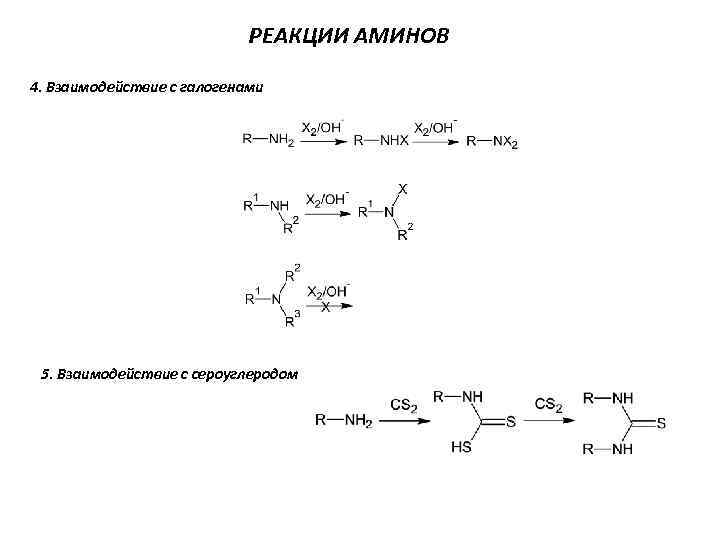
РЕАКЦИИ АМИНОВ 4. Взаимодействие с галогенами 5. Взаимодействие с сероуглеродом
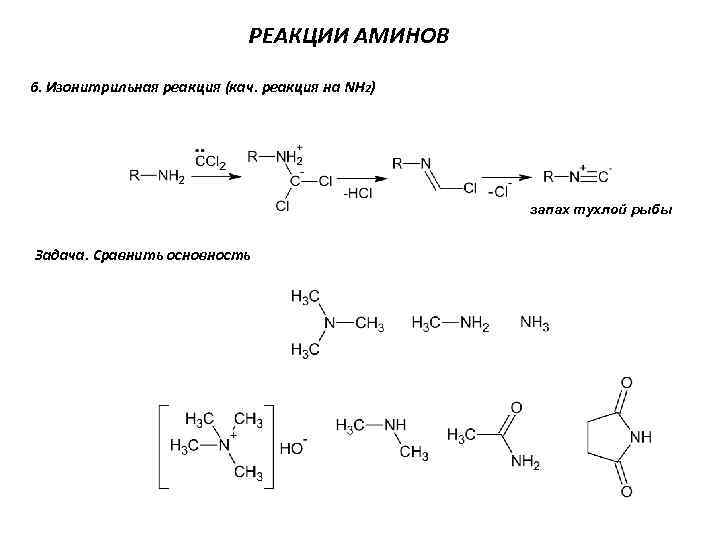
РЕАКЦИИ АМИНОВ 6. Изонитрильная реакция (кач. реакция на NH 2) запах тухлой рыбы Задача. Сравнить основность
лекция амины.ppt