внутриклеточная сигнализация 10-2014.ppt
- Количество слайдов: 39
 СИГНАЛЬНЫЕ СИСТЕМЫ МЕЖКЛЕТОЧНАЯ И ВНУТРИКЛЕТОЧНАЯ СИГНАЛИЗАЦИЯ (Ч 1)
СИГНАЛЬНЫЕ СИСТЕМЫ МЕЖКЛЕТОЧНАЯ И ВНУТРИКЛЕТОЧНАЯ СИГНАЛИЗАЦИЯ (Ч 1)
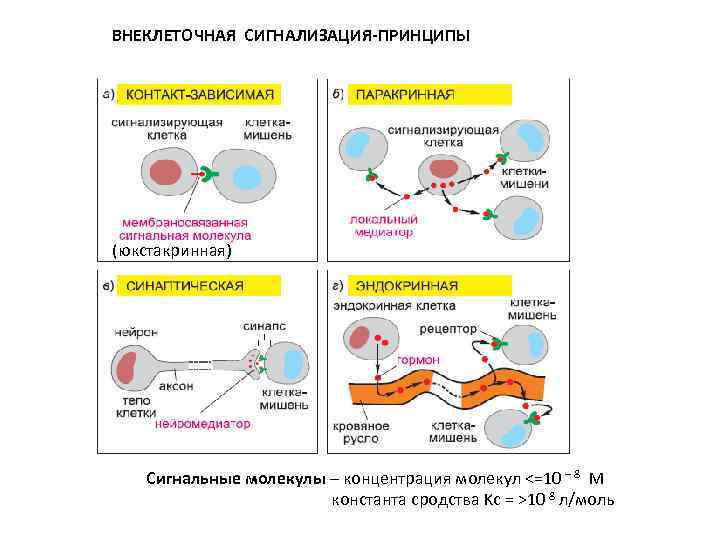 ВНЕКЛЕТОЧНАЯ СИГНАЛИЗАЦИЯ-ПРИНЦИПЫ (юкстакринная) Сигнальные молекулы – концентрация молекул <=10 – 8 М константа сродства Kc = >10 8 л/моль
ВНЕКЛЕТОЧНАЯ СИГНАЛИЗАЦИЯ-ПРИНЦИПЫ (юкстакринная) Сигнальные молекулы – концентрация молекул <=10 – 8 М константа сродства Kc = >10 8 л/моль
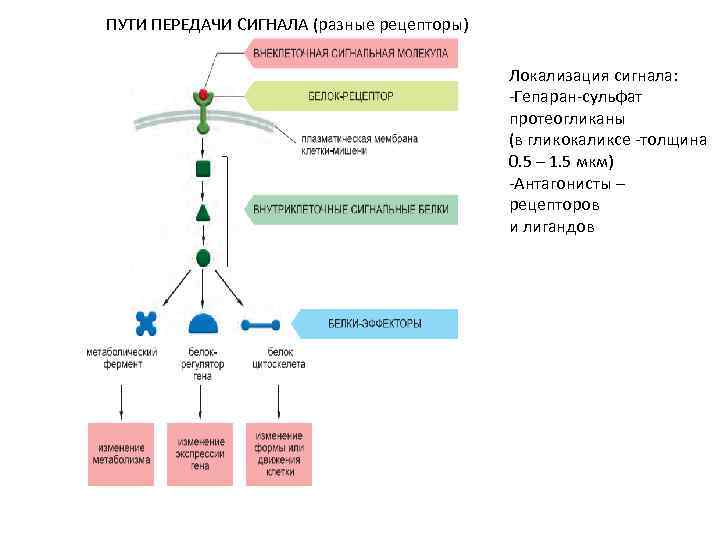 ПУТИ ПЕРЕДАЧИ СИГНАЛА (разные рецепторы) Локализация сигнала: -Гепаран-сульфат протеогликаны (в гликокаликсе -толщина 0. 5 – 1. 5 мкм) -Антагонисты – рецепторов и лигандов
ПУТИ ПЕРЕДАЧИ СИГНАЛА (разные рецепторы) Локализация сигнала: -Гепаран-сульфат протеогликаны (в гликокаликсе -толщина 0. 5 – 1. 5 мкм) -Антагонисты – рецепторов и лигандов
 Различия между эндокринной и нервной стратегиями дальнодействующей сигнализации. Эндокринные клетки секретируют в кровяное русло гормоны, которые действуют только на клетки, несущие соответствующие рецепторы. Рецепторы специфически связывают гормон, таким образом удаляя его из внеклеточной жидкости. Эндокринная сигнализация основана на диффузии и токе крови, она происходит относительно медленно. При синаптической сигнализации специфичность — это результат синаптического контакта между нервной клеткой и определенной клеткоймишенью. Синаптическая сигнализация, действует значительно быстрее и точнее. Нервные клетки способны передавать информацию на большие расстояния посредством электрических импульсов, скорость которых может достигать 70 -120 м/с. Концентрация лиганда выше (ACh - 5 × 10– 4 М в щели) - сродство рецепторов нейромедиаторов к лиганду относительно мало + инактивация лиганда - синаптическая сигнализация точнее, чем эндокринная, как во времени, так и в пространстве.
Различия между эндокринной и нервной стратегиями дальнодействующей сигнализации. Эндокринные клетки секретируют в кровяное русло гормоны, которые действуют только на клетки, несущие соответствующие рецепторы. Рецепторы специфически связывают гормон, таким образом удаляя его из внеклеточной жидкости. Эндокринная сигнализация основана на диффузии и токе крови, она происходит относительно медленно. При синаптической сигнализации специфичность — это результат синаптического контакта между нервной клеткой и определенной клеткоймишенью. Синаптическая сигнализация, действует значительно быстрее и точнее. Нервные клетки способны передавать информацию на большие расстояния посредством электрических импульсов, скорость которых может достигать 70 -120 м/с. Концентрация лиганда выше (ACh - 5 × 10– 4 М в щели) - сродство рецепторов нейромедиаторов к лиганду относительно мало + инактивация лиганда - синаптическая сигнализация точнее, чем эндокринная, как во времени, так и в пространстве.
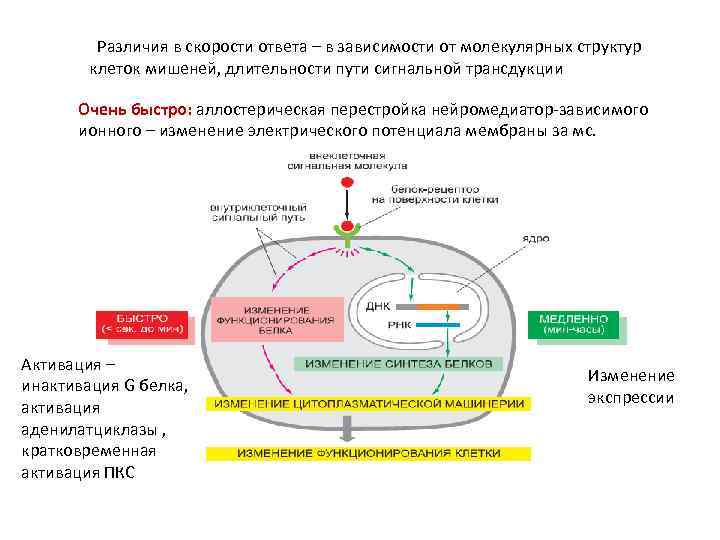 Различия в скорости ответа – в зависимости от молекулярных структур клеток мишеней, длительности пути сигнальной трансдукции Очень быстро: аллостерическая перестройка нейромедиатор-зависимого ионного – изменение электрического потенциала мембраны за мс. Активация – инактивация G белка, активация аденилатциклазы , кратковременная активация ПКС Изменение экспрессии
Различия в скорости ответа – в зависимости от молекулярных структур клеток мишеней, длительности пути сигнальной трансдукции Очень быстро: аллостерическая перестройка нейромедиатор-зависимого ионного – изменение электрического потенциала мембраны за мс. Активация – инактивация G белка, активация аденилатциклазы , кратковременная активация ПКС Изменение экспрессии
 Обмен информацией через щелевые контакты между возбудимыми и невозбудимыми клетками. В печени, например, снижение концентрации глюкозы в крови высвобождает норадреналин из симпатических нервных окончаний. Норадреналин вызывает расщепление гликогена гепатоцитами печени и высвобождение глюкозы в кровь. Такой ответ основывается на увеличении внутриклеточной концентрации циклического AMP. Однако не все гепатоциты иннервируются симпатическими нервами. Благодаря соединяющим гепатоциты щелевым контактам иннервируемые клетки передают сигнал неиннервируемым, пропуская через контакты ц. AMP - активация ПКА – активация киназы фосфорилазы - фосфорилирует и активирует гликогенфосфорилазу. У мышей с мутацией основного гена щелевых контактов в печени нарушена мобилизация гликогена при падении уровня глюкозы в крови.
Обмен информацией через щелевые контакты между возбудимыми и невозбудимыми клетками. В печени, например, снижение концентрации глюкозы в крови высвобождает норадреналин из симпатических нервных окончаний. Норадреналин вызывает расщепление гликогена гепатоцитами печени и высвобождение глюкозы в кровь. Такой ответ основывается на увеличении внутриклеточной концентрации циклического AMP. Однако не все гепатоциты иннервируются симпатическими нервами. Благодаря соединяющим гепатоциты щелевым контактам иннервируемые клетки передают сигнал неиннервируемым, пропуская через контакты ц. AMP - активация ПКА – активация киназы фосфорилазы - фосфорилирует и активирует гликогенфосфорилазу. У мышей с мутацией основного гена щелевых контактов в печени нарушена мобилизация гликогена при падении уровня глюкозы в крови.
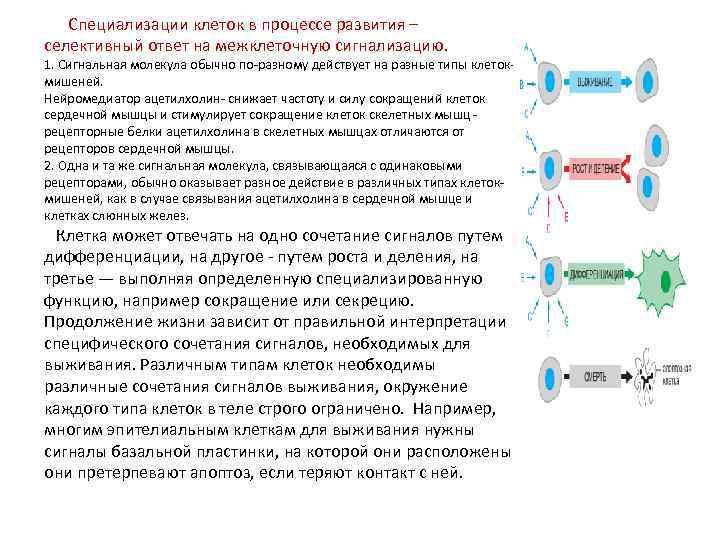 Специализации клеток в процессе развития – селективный ответ на межклеточную сигнализацию. 1. Сигнальная молекула обычно по-разному действует на разные типы клетокмишеней. Нейромедиатор ацетилхолин- снижает частоту и силу сокращений клеток сердечной мышцы и стимулирует сокращение клеток скелетных мышц - рецепторные белки ацетилхолина в скелетных мышцах отличаются от рецепторов сердечной мышцы. 2. Одна и та же сигнальная молекула, связывающаяся с одинаковыми рецепторами, обычно оказывает разное действие в различных типах клетокмишеней, как в случае связывания ацетилхолина в сердечной мышце и клетках слюнных желез. Клетка может отвечать на одно сочетание сигналов путем дифференциации, на другое - путем роста и деления, на третье — выполняя определенную специализированную функцию, например сокращение или секрецию. Продолжение жизни зависит от правильной интерпретации специфического сочетания сигналов, необходимых для выживания. Различным типам клеток необходимы различные сочетания сигналов выживания, окружение каждого типа клеток в теле строго ограничено. Например, многим эпителиальным клеткам для выживания нужны сигналы базальной пластинки, на которой они расположены они претерпевают апоптоз, если теряют контакт с ней.
Специализации клеток в процессе развития – селективный ответ на межклеточную сигнализацию. 1. Сигнальная молекула обычно по-разному действует на разные типы клетокмишеней. Нейромедиатор ацетилхолин- снижает частоту и силу сокращений клеток сердечной мышцы и стимулирует сокращение клеток скелетных мышц - рецепторные белки ацетилхолина в скелетных мышцах отличаются от рецепторов сердечной мышцы. 2. Одна и та же сигнальная молекула, связывающаяся с одинаковыми рецепторами, обычно оказывает разное действие в различных типах клетокмишеней, как в случае связывания ацетилхолина в сердечной мышце и клетках слюнных желез. Клетка может отвечать на одно сочетание сигналов путем дифференциации, на другое - путем роста и деления, на третье — выполняя определенную специализированную функцию, например сокращение или секрецию. Продолжение жизни зависит от правильной интерпретации специфического сочетания сигналов, необходимых для выживания. Различным типам клеток необходимы различные сочетания сигналов выживания, окружение каждого типа клеток в теле строго ограничено. Например, многим эпителиальным клеткам для выживания нужны сигналы базальной пластинки, на которой они расположены они претерпевают апоптоз, если теряют контакт с ней.
 Зависимость ответа клетки от концентрации сигнальной молекулы Морфоген – сигнальная молекула , ответ на которую у клеток в процессе эмбриогенеза зависти от ее концентрации. - Развитие клеток зависит от их положения в градиенте морфогена. Расположение клеток в градиенте концентрации определяет их судьбу: у клеток, расположенных ближе всего к сигнальному центру и оказывающихся под действием наибольшей концентрации сигнала, активируется наибольшее число рецепторов, в результате чего они идут по одному пути развития. Другие же клетки, расположенные чуть дальше от источника сигнала, пойдут по другому пути. Локальные градиенты есть в кровеносном русле: бтш 70, АТФ, рибонуклеопротеиды и т. д.
Зависимость ответа клетки от концентрации сигнальной молекулы Морфоген – сигнальная молекула , ответ на которую у клеток в процессе эмбриогенеза зависти от ее концентрации. - Развитие клеток зависит от их положения в градиенте морфогена. Расположение клеток в градиенте концентрации определяет их судьбу: у клеток, расположенных ближе всего к сигнальному центру и оказывающихся под действием наибольшей концентрации сигнала, активируется наибольшее число рецепторов, в результате чего они идут по одному пути развития. Другие же клетки, расположенные чуть дальше от источника сигнала, пойдут по другому пути. Локальные градиенты есть в кровеносном русле: бтш 70, АТФ, рибонуклеопротеиды и т. д.
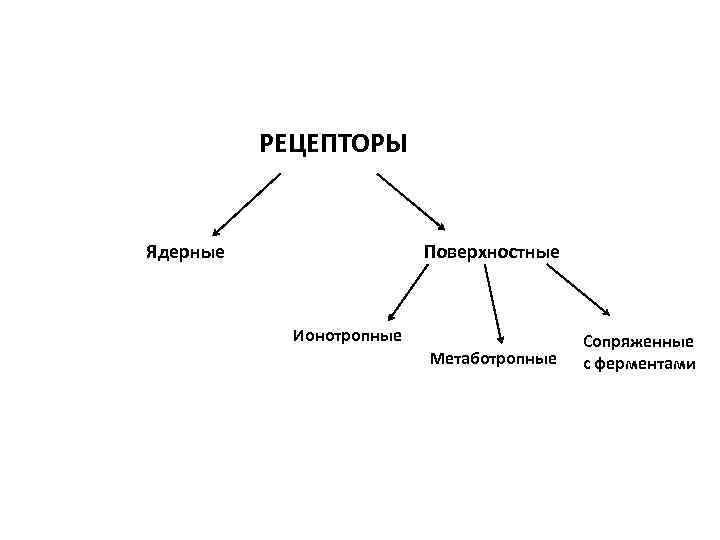 РЕЦЕПТОРЫ Ядерные Поверхностные Ионотропные Метаботропные Сопряженные с ферментами
РЕЦЕПТОРЫ Ядерные Поверхностные Ионотропные Метаботропные Сопряженные с ферментами
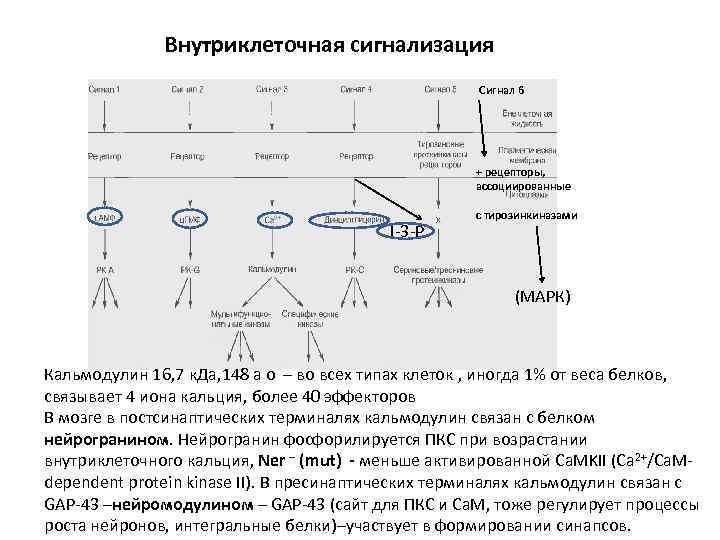 Внутриклеточная сигнализация Сигнал 6 + рецепторы, ассоциированные I-3 -P с тирозинкиназами (МАРК) Кальмодулин 16, 7 к. Да, 148 а о – во всех типах клеток , иногда 1% от веса белков, связывает 4 иона кальция, более 40 эффекторов В мозге в постсинаптических терминалях кальмодулин связан с белком нейрогранином. Нейрогранин фосфорилируется ПКС при возрастании внутриклеточного кальция, Ner – (mut) - меньше активированной Ca. MKII (Ca 2+/Ca. Mdependent protein kinase II). В пресинаптических терминалях кальмодулин связан с GAP-43 –нейромодулином – GAP-43 (сайт для ПКС и Ca. M, тоже регулирует процессы роста нейронов, интегральные белки)–участвует в формировании синапсов.
Внутриклеточная сигнализация Сигнал 6 + рецепторы, ассоциированные I-3 -P с тирозинкиназами (МАРК) Кальмодулин 16, 7 к. Да, 148 а о – во всех типах клеток , иногда 1% от веса белков, связывает 4 иона кальция, более 40 эффекторов В мозге в постсинаптических терминалях кальмодулин связан с белком нейрогранином. Нейрогранин фосфорилируется ПКС при возрастании внутриклеточного кальция, Ner – (mut) - меньше активированной Ca. MKII (Ca 2+/Ca. Mdependent protein kinase II). В пресинаптических терминалях кальмодулин связан с GAP-43 –нейромодулином – GAP-43 (сайт для ПКС и Ca. M, тоже регулирует процессы роста нейронов, интегральные белки)–участвует в формировании синапсов.
 Поверхностные рецепторы Ионотропные рецепторы – сопряженные с ионными каналами, которые открываются при связывании лиганда с субъединицами белка канала -Никотиновые рецепторы– NAch , активируется ацетилхолином, канал проводит Na +, К + - P 2 X рецепторы (P 2 X 1 R–P 2 X 7 ) –активация АТP, UTP каналы проводят : Na +, (К + ), Са 2+ ; - Глутаматные -NMDA (связывается с N-метил –D аспартатом), -AMPA ( α –амино-3 -гидрокси-5 -метил-4 -изоксазолпропионовой к-ой) – каинатные рецепторы (каиновая кислота) - GABA a , GABA c -связывают γ-аминомаслянную кислоту, канал проводит Сl – - 5 -НТ - серотониновый , Na +, К + проводимость 3 Метаботропные рецепторы – сигнализация через активацию G белков, и для многих – специфичность клеточного ответа зависит от активации протеинкиназ, с участием вторичных мессенджеров -M 1, М 2, М 3, М 4, M 5 - холинорецепторы -- β 1, β 2, β 3, α 1, α 2 – адренорецепторы -серотониновые рецепторы - (cвязывают 5 - гидрокситриптамин) - 6 типов -- гистаминовые рецепторы --глутаматные рецепторы m. Glu. R I-III - P 1 YA, P 1 YB (активируется аденозином ), P 2 Y рецепторы (активируются АТP, ADP, UTP )- регулируют вход Са 2+ , канал проводит Na +, К + - GABA b - Дофаминовые рецепторы (I и II функциональные группы, 5 рецепторов)
Поверхностные рецепторы Ионотропные рецепторы – сопряженные с ионными каналами, которые открываются при связывании лиганда с субъединицами белка канала -Никотиновые рецепторы– NAch , активируется ацетилхолином, канал проводит Na +, К + - P 2 X рецепторы (P 2 X 1 R–P 2 X 7 ) –активация АТP, UTP каналы проводят : Na +, (К + ), Са 2+ ; - Глутаматные -NMDA (связывается с N-метил –D аспартатом), -AMPA ( α –амино-3 -гидрокси-5 -метил-4 -изоксазолпропионовой к-ой) – каинатные рецепторы (каиновая кислота) - GABA a , GABA c -связывают γ-аминомаслянную кислоту, канал проводит Сl – - 5 -НТ - серотониновый , Na +, К + проводимость 3 Метаботропные рецепторы – сигнализация через активацию G белков, и для многих – специфичность клеточного ответа зависит от активации протеинкиназ, с участием вторичных мессенджеров -M 1, М 2, М 3, М 4, M 5 - холинорецепторы -- β 1, β 2, β 3, α 1, α 2 – адренорецепторы -серотониновые рецепторы - (cвязывают 5 - гидрокситриптамин) - 6 типов -- гистаминовые рецепторы --глутаматные рецепторы m. Glu. R I-III - P 1 YA, P 1 YB (активируется аденозином ), P 2 Y рецепторы (активируются АТP, ADP, UTP )- регулируют вход Са 2+ , канал проводит Na +, К + - GABA b - Дофаминовые рецепторы (I и II функциональные группы, 5 рецепторов)
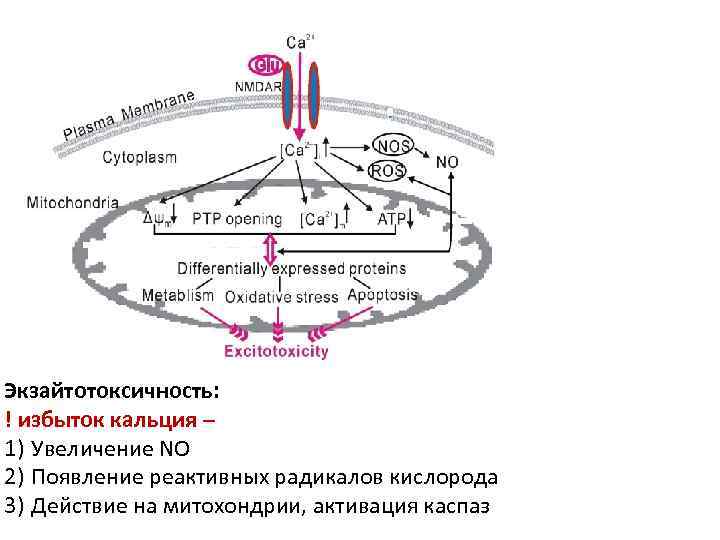 Экзайтотоксичность: ! избыток кальция – 1) Увеличение NO 2) Появление реактивных радикалов кислорода 3) Действие на митохондрии, активация каспаз
Экзайтотоксичность: ! избыток кальция – 1) Увеличение NO 2) Появление реактивных радикалов кислорода 3) Действие на митохондрии, активация каспаз
 Глутаматная эксайтотоксичность (от англ. excitotoxicity – токсичность, развивающаяся при возбуждении) – пусковой механизм некротической и апоптотической гибели при многих неврологических нарушениях. Рецептор Увеличение поступления Са 2+ Ингибирование поступления Са 2+ NMDA деполяризация до -40 м. В , связывание ко-агониста – глицина – 0, 1 мк. М Перекрытие канала Mg 2+ , глицин при больших концентрациях 100 мк. М – вызывает десенсибилизацию. Интернализация рецептора при Са 2+ внутрикл. дефосфорилировании его NR 1 субъединицы, связ. с кальмодулином/Са 2+ - нарушение связывания рецептора с α-актином. АМРА Вход Са 2+ – (высокоамплитудный подъем) активация протеинкиназы С, Са 2+ / кальмодулинзависимой киназы II - фосфорилирование белков – встраивание новых рецепторов. Низкоамплитудный подъем Са 2+ - дефосфорилирование примебранных белков, активация протеин фосфатазы (BII или кальциневрина ) – связывание ее с динамином – интернализация рецепторов эндоцитозом m. Glu. R 1 Активация Gq- увеличение внутриклеточного Са 2+ , - активация киназ - встраивание АМРА Каскады: 1)повышение концентрации Са 2+ в цитозоле (в т. ч. вход через каналы ионотропных рецепторов)активация протеинкиназы С – цитоплазматической фосфолипазы А 2 ( высвобождение арахидоновой кислота ); фосфорилирование НАДФН оксидазы - субъединиц p 67 phox, p 47 phox - перемещение их к мембране и сборка цитоплазматических p 67 phox, p 47 phox p 40 phox и субъединиц p 22 phox и gp 91 phox мембранного- Cytb 558 - (каталитические субъединицы ) – активация НАДФН оксидазы – генерация ROS - H 2 O 2 и (·ОН) некроз 2) при ОКД синтез NO при активации NO- синтетазы - комплекс NO с супероксид-анионом О- – пероксинитрит -ONOO- – способен блокировать тирозинкиназу, входящую в активный центр нейротрофических факторов, - нитролизирует гуанин – разрыв ДНК
Глутаматная эксайтотоксичность (от англ. excitotoxicity – токсичность, развивающаяся при возбуждении) – пусковой механизм некротической и апоптотической гибели при многих неврологических нарушениях. Рецептор Увеличение поступления Са 2+ Ингибирование поступления Са 2+ NMDA деполяризация до -40 м. В , связывание ко-агониста – глицина – 0, 1 мк. М Перекрытие канала Mg 2+ , глицин при больших концентрациях 100 мк. М – вызывает десенсибилизацию. Интернализация рецептора при Са 2+ внутрикл. дефосфорилировании его NR 1 субъединицы, связ. с кальмодулином/Са 2+ - нарушение связывания рецептора с α-актином. АМРА Вход Са 2+ – (высокоамплитудный подъем) активация протеинкиназы С, Са 2+ / кальмодулинзависимой киназы II - фосфорилирование белков – встраивание новых рецепторов. Низкоамплитудный подъем Са 2+ - дефосфорилирование примебранных белков, активация протеин фосфатазы (BII или кальциневрина ) – связывание ее с динамином – интернализация рецепторов эндоцитозом m. Glu. R 1 Активация Gq- увеличение внутриклеточного Са 2+ , - активация киназ - встраивание АМРА Каскады: 1)повышение концентрации Са 2+ в цитозоле (в т. ч. вход через каналы ионотропных рецепторов)активация протеинкиназы С – цитоплазматической фосфолипазы А 2 ( высвобождение арахидоновой кислота ); фосфорилирование НАДФН оксидазы - субъединиц p 67 phox, p 47 phox - перемещение их к мембране и сборка цитоплазматических p 67 phox, p 47 phox p 40 phox и субъединиц p 22 phox и gp 91 phox мембранного- Cytb 558 - (каталитические субъединицы ) – активация НАДФН оксидазы – генерация ROS - H 2 O 2 и (·ОН) некроз 2) при ОКД синтез NO при активации NO- синтетазы - комплекс NO с супероксид-анионом О- – пероксинитрит -ONOO- – способен блокировать тирозинкиназу, входящую в активный центр нейротрофических факторов, - нитролизирует гуанин – разрыв ДНК
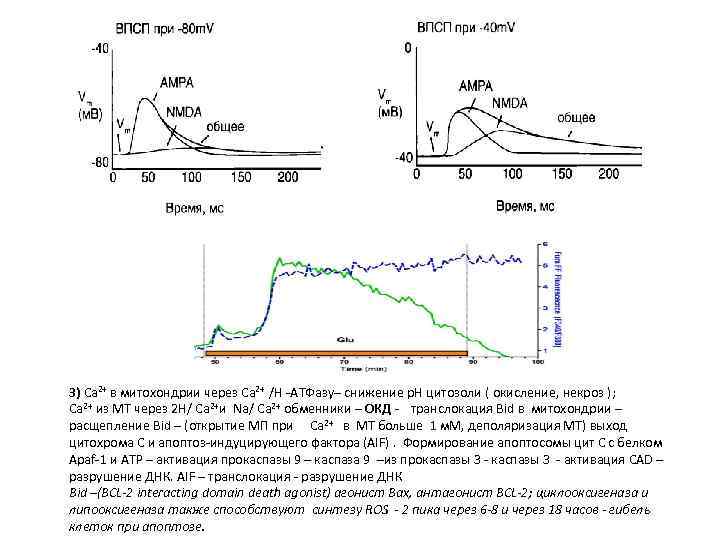 3) Са 2+ в митохондрии через Са 2+ /H -АТФазу– снижение р. Н цитозоли ( окисление, некроз ); Са 2+ из МТ через 2 H/ Са 2+и Na/ Са 2+ обменники – ОКД - транслокация Bid в митохондрии – расщепление Bid – (открытие МП при Са 2+ в МТ больше 1 м. М, деполяризация МТ) выход цитохрома С и апоптоз-индуцирующего фактора (AIF). Формирование апоптосомы цит С с белком Apaf-1 и ATP – активация прокаспазы 9 – каспаза 9 –из прокаспазы 3 - активация CAD – разрушение ДНК. AIF – транслокация - разрушение ДНК Bid –(BCL-2 interacting domain death agonist) агонист Bax, антагонист BCL-2; циклооксигеназа и липооксигеназа также способствуют cинтезу ROS - 2 пика через 6 -8 и через 18 часов - гибель клеток при апоптозе.
3) Са 2+ в митохондрии через Са 2+ /H -АТФазу– снижение р. Н цитозоли ( окисление, некроз ); Са 2+ из МТ через 2 H/ Са 2+и Na/ Са 2+ обменники – ОКД - транслокация Bid в митохондрии – расщепление Bid – (открытие МП при Са 2+ в МТ больше 1 м. М, деполяризация МТ) выход цитохрома С и апоптоз-индуцирующего фактора (AIF). Формирование апоптосомы цит С с белком Apaf-1 и ATP – активация прокаспазы 9 – каспаза 9 –из прокаспазы 3 - активация CAD – разрушение ДНК. AIF – транслокация - разрушение ДНК Bid –(BCL-2 interacting domain death agonist) агонист Bax, антагонист BCL-2; циклооксигеназа и липооксигеназа также способствуют cинтезу ROS - 2 пика через 6 -8 и через 18 часов - гибель клеток при апоптозе.
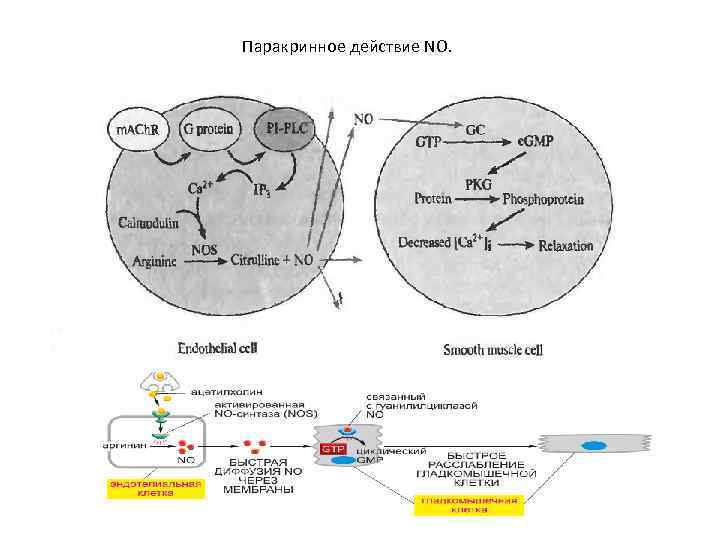 Паракринное действие NO.
Паракринное действие NO.
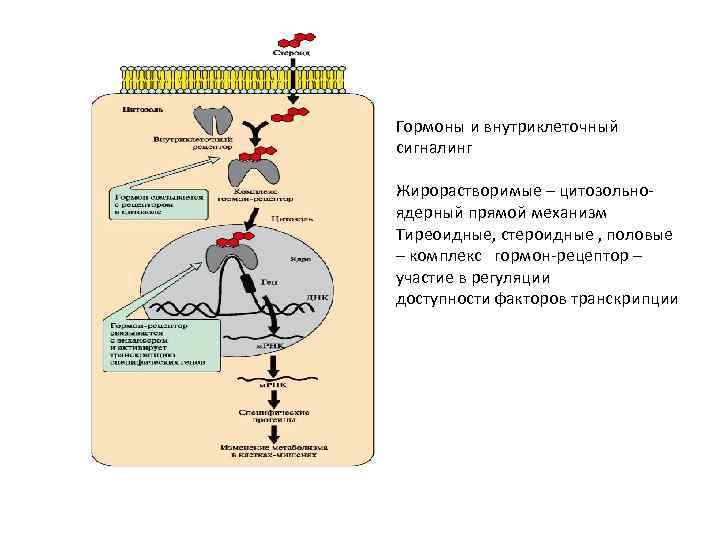 Гормоны и внутриклеточный сигналинг Жирорастворимые – цитозольноядерный прямой механизм Тиреоидные, стероидные , половые – комплекс гормон-рецептор – участие в регуляции доступности факторов транскрипции
Гормоны и внутриклеточный сигналинг Жирорастворимые – цитозольноядерный прямой механизм Тиреоидные, стероидные , половые – комплекс гормон-рецептор – участие в регуляции доступности факторов транскрипции
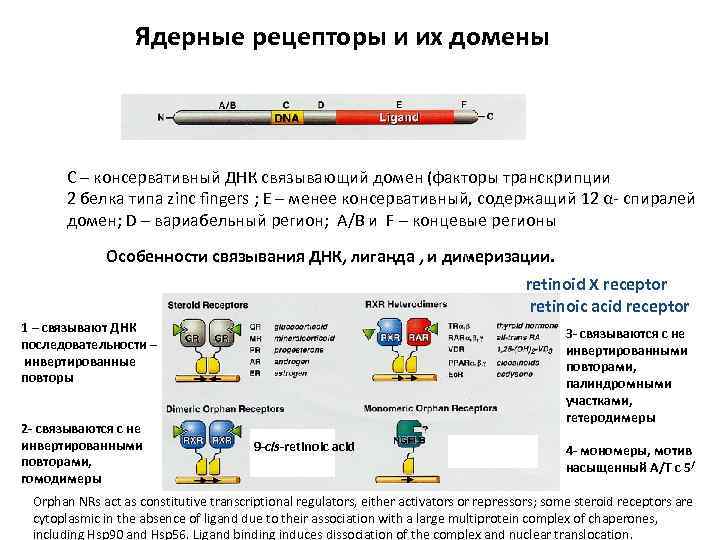 Ядерные рецепторы и их домены С – консервативный ДНК связывающий домен (факторы транскрипции 2 белка типа zinc fingers ; E – менее консервативный, содержащий 12 α- спиралей домен; D – вариабельный регион; А/В и F – концевые регионы Особенности связывания ДНК, лиганда , и димеризации. retinoid X receptor retinoic acid receptor 1 – связывают ДНК последовательности – инвертированные повторы 2 - связываются с не инвертированными повторами, гомодимеры 3 - связываются с не инвертированными повторами, палиндромными участками, гетеродимеры 9 -cis-retinoic acid 4 - мономеры, мотив насыщенный А/Т с 5/ Orphan NRs act as constitutive transcriptional regulators, either activators or repressors; some steroid receptors are cytoplasmic in the absence of ligand due to their association with a large multiprotein complex of chaperones, including Hsp 90 and Hsp 56. Ligand binding induces dissociation of the complex and nuclear translocation.
Ядерные рецепторы и их домены С – консервативный ДНК связывающий домен (факторы транскрипции 2 белка типа zinc fingers ; E – менее консервативный, содержащий 12 α- спиралей домен; D – вариабельный регион; А/В и F – концевые регионы Особенности связывания ДНК, лиганда , и димеризации. retinoid X receptor retinoic acid receptor 1 – связывают ДНК последовательности – инвертированные повторы 2 - связываются с не инвертированными повторами, гомодимеры 3 - связываются с не инвертированными повторами, палиндромными участками, гетеродимеры 9 -cis-retinoic acid 4 - мономеры, мотив насыщенный А/Т с 5/ Orphan NRs act as constitutive transcriptional regulators, either activators or repressors; some steroid receptors are cytoplasmic in the absence of ligand due to their association with a large multiprotein complex of chaperones, including Hsp 90 and Hsp 56. Ligand binding induces dissociation of the complex and nuclear translocation.
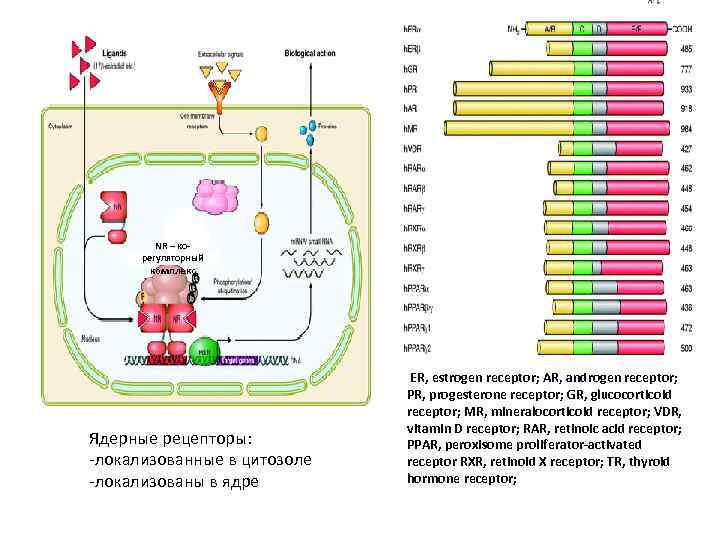 NR – корегуляторный комплекс Ядерные рецепторы: -локализованные в цитозоле -локализованы в ядре ER, estrogen receptor; AR, androgen receptor; PR, progesterone receptor; GR, glucocorticoid receptor; MR, mineralocorticoid receptor; VDR, vitamin D receptor; RAR, retinoic acid receptor; PPAR, peroxisome proliferator-activated receptor RXR, retinoid X receptor; TR, thyroid hormone receptor;
NR – корегуляторный комплекс Ядерные рецепторы: -локализованные в цитозоле -локализованы в ядре ER, estrogen receptor; AR, androgen receptor; PR, progesterone receptor; GR, glucocorticoid receptor; MR, mineralocorticoid receptor; VDR, vitamin D receptor; RAR, retinoic acid receptor; PPAR, peroxisome proliferator-activated receptor RXR, retinoid X receptor; TR, thyroid hormone receptor;
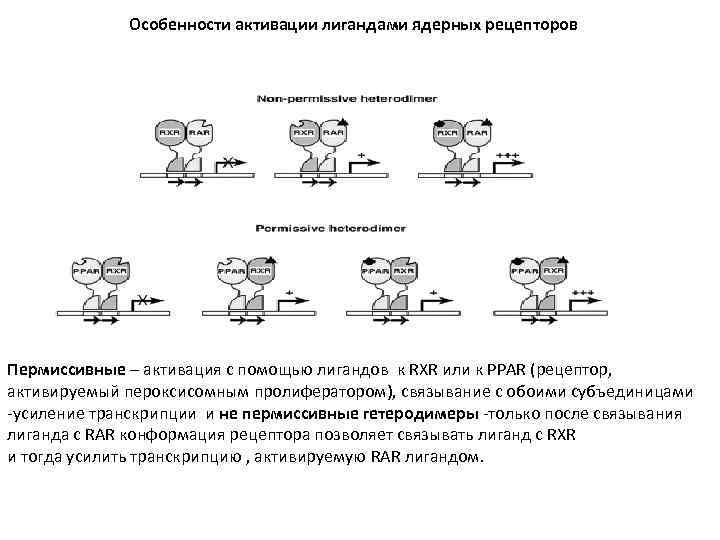 Особенности активации лигандами ядерных рецепторов Пермиссивные – активация с помощью лигандов к RXR или к PPAR (рецептор, активируемый пероксисомным пролифератором), связывание с обоими субъединицами -усиление транскрипции и не пермиссивные гетеродимеры -только после связывания лиганда с RAR конформация рецептора позволяет связывать лиганд с RXR и тогда усилить транскрипцию , активируемую RAR лигандом.
Особенности активации лигандами ядерных рецепторов Пермиссивные – активация с помощью лигандов к RXR или к PPAR (рецептор, активируемый пероксисомным пролифератором), связывание с обоими субъединицами -усиление транскрипции и не пермиссивные гетеродимеры -только после связывания лиганда с RAR конформация рецептора позволяет связывать лиганд с RXR и тогда усилить транскрипцию , активируемую RAR лигандом.
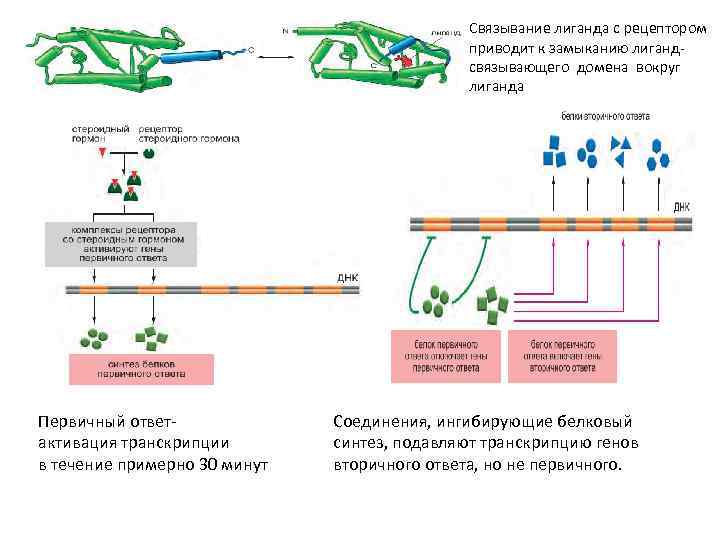 Связывание лиганда с рецептором приводит к замыканию лигандсвязывающего домена вокруг лиганда Первичный ответактивация транскрипции в течение примерно 30 минут Соединения, ингибирующие белковый синтез, подавляют транскрипцию генов вторичного ответа, но не первичного.
Связывание лиганда с рецептором приводит к замыканию лигандсвязывающего домена вокруг лиганда Первичный ответактивация транскрипции в течение примерно 30 минут Соединения, ингибирующие белковый синтез, подавляют транскрипцию генов вторичного ответа, но не первичного.
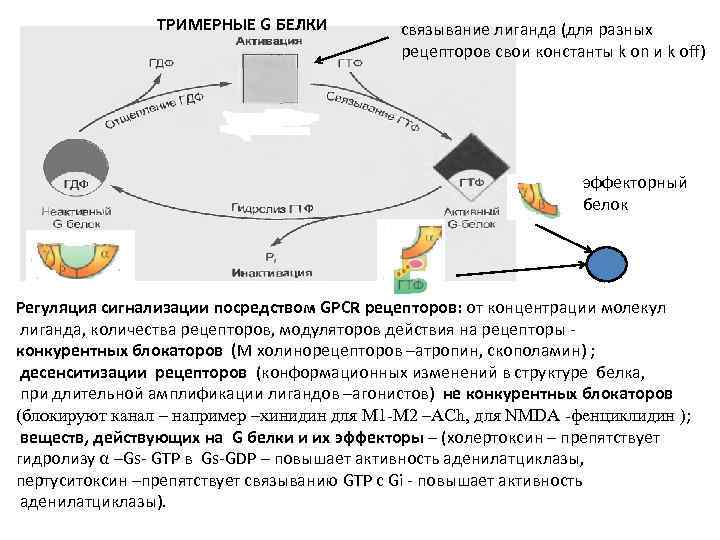 ТРИМЕРНЫЕ G БЕЛКИ связывание лиганда (для разных рецепторов свои константы k on и k off) эффекторный белок Регуляция сигнализации посредством GPCR рецепторов: от концентрации молекул лиганда, количества рецепторов, модуляторов действия на рецепторы - конкурентных блокаторов (M холинорецепторов –атропин, скополамин) ; десенситизации рецепторов (конформационных изменений в структуре белка, при длительной амплификации лигандов –агонистов) не конкурентных блокаторов (блокируют канал – например –хинидин для М 1 -М 2 –AСh, для NMDA -фенциклидин ); веществ, действующих на G белки и их эффекторы – (холертоксин – препятствует гидролизу α –Gs- GTP в Gs-GDP – повышает активность аденилатциклазы, пертуситоксин –препятствует связыванию GTP c Gi - повышает активность аденилатциклазы).
ТРИМЕРНЫЕ G БЕЛКИ связывание лиганда (для разных рецепторов свои константы k on и k off) эффекторный белок Регуляция сигнализации посредством GPCR рецепторов: от концентрации молекул лиганда, количества рецепторов, модуляторов действия на рецепторы - конкурентных блокаторов (M холинорецепторов –атропин, скополамин) ; десенситизации рецепторов (конформационных изменений в структуре белка, при длительной амплификации лигандов –агонистов) не конкурентных блокаторов (блокируют канал – например –хинидин для М 1 -М 2 –AСh, для NMDA -фенциклидин ); веществ, действующих на G белки и их эффекторы – (холертоксин – препятствует гидролизу α –Gs- GTP в Gs-GDP – повышает активность аденилатциклазы, пертуситоксин –препятствует связыванию GTP c Gi - повышает активность аденилатциклазы).
 Рецепторы, сопряженные с G белками У человека более 700 GPCR - рецепторов связанных с G белками (G белки – серпентиновые из 7 трансмембранных α доменов , открыты в 1972 г как активаторы аденилатциклазы, карбоксильный конец G белков может фосфорилироваться ). α – 4045 к. Да, β – 37 к. Да, γ – 8 -10 к. Да. Обнаружено: 20 α , 6β , 12 γ Принципы: 1 - усиление сигнала – 1 рецептор с рядом G белков, активация или ингибирование синтеза 100 ц. АМФ , ц. ГМФ молекул , активация еще большего количества протеинкиназ: (РК –А – ц. АМФ зависимая, РК-G – ц. GМФ зависимая , РК-С ( не менее 9 изоформ). Фосфолипазы: А 2 через Gi белок, фосфолипаза D (расщепляет фосфатидилхолин на фосфатидную кислоту и холин, фосфатидная кислота может быть превращена в диацилглицирол) 2 - поливалентность - один рецептор может быть связан с несколькими типами G белков : G s (активирует аденилатциклазу), Gi (ингибирует аденилатциклазу), Gq (активирует фосфолипазу), Gt 1 (трансдуцин в палочках), Gt 2 (трансдуцин в колбочках ) – активируют фосфодиэстеразу ц. GMP в GMP – закрытие Na + каналов на свету. Golf – в обонятельных рецепторах , активируют аденилатциклазу увеличивает вход Na +. 3 - каскадность реакций -усиление зависит от числа этапов передачи сигнала. Эффект может длиться от десятков миллисекунд до дней или месяцев (изменения экспрессии)
Рецепторы, сопряженные с G белками У человека более 700 GPCR - рецепторов связанных с G белками (G белки – серпентиновые из 7 трансмембранных α доменов , открыты в 1972 г как активаторы аденилатциклазы, карбоксильный конец G белков может фосфорилироваться ). α – 4045 к. Да, β – 37 к. Да, γ – 8 -10 к. Да. Обнаружено: 20 α , 6β , 12 γ Принципы: 1 - усиление сигнала – 1 рецептор с рядом G белков, активация или ингибирование синтеза 100 ц. АМФ , ц. ГМФ молекул , активация еще большего количества протеинкиназ: (РК –А – ц. АМФ зависимая, РК-G – ц. GМФ зависимая , РК-С ( не менее 9 изоформ). Фосфолипазы: А 2 через Gi белок, фосфолипаза D (расщепляет фосфатидилхолин на фосфатидную кислоту и холин, фосфатидная кислота может быть превращена в диацилглицирол) 2 - поливалентность - один рецептор может быть связан с несколькими типами G белков : G s (активирует аденилатциклазу), Gi (ингибирует аденилатциклазу), Gq (активирует фосфолипазу), Gt 1 (трансдуцин в палочках), Gt 2 (трансдуцин в колбочках ) – активируют фосфодиэстеразу ц. GMP в GMP – закрытие Na + каналов на свету. Golf – в обонятельных рецепторах , активируют аденилатциклазу увеличивает вход Na +. 3 - каскадность реакций -усиление зависит от числа этапов передачи сигнала. Эффект может длиться от десятков миллисекунд до дней или месяцев (изменения экспрессии)
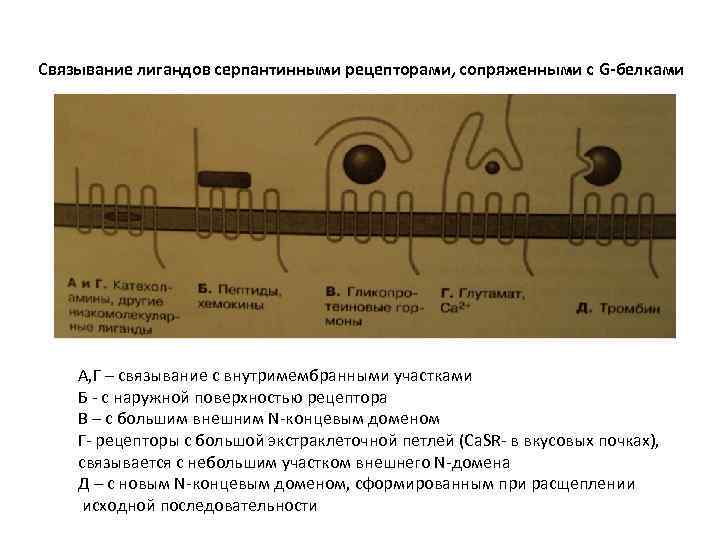 Связывание лигандов серпантинными рецепторами, сопряженными с G-белками А, Г – связывание с внутримембранными участками Б - с наружной поверхностью рецептора В – с большим внешним N-концевым доменом Г- рецепторы с большой экстраклеточной петлей (Сa. SR- в вкусовых почках), связывается с небольшим участком внешнего N-домена Д – с новым N-концевым доменом, сформированным при расщеплении исходной последовательности
Связывание лигандов серпантинными рецепторами, сопряженными с G-белками А, Г – связывание с внутримембранными участками Б - с наружной поверхностью рецептора В – с большим внешним N-концевым доменом Г- рецепторы с большой экстраклеточной петлей (Сa. SR- в вкусовых почках), связывается с небольшим участком внешнего N-домена Д – с новым N-концевым доменом, сформированным при расщеплении исходной последовательности
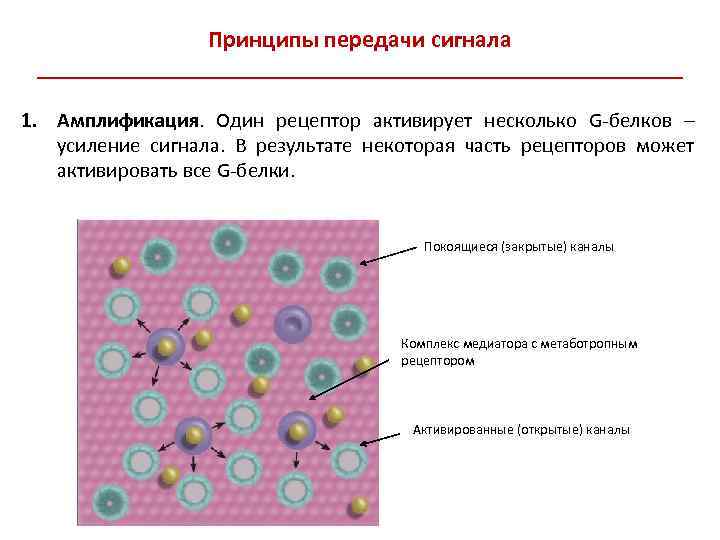 Принципы передачи сигнала ___________________________ 1. Амплификация. Один рецептор активирует несколько G-белков – усиление сигнала. В результате некоторая часть рецепторов может активировать все G-белки. Покоящиеся (закрытые) каналы Комплекс медиатора с метаботропным рецептором Активированные (открытые) каналы
Принципы передачи сигнала ___________________________ 1. Амплификация. Один рецептор активирует несколько G-белков – усиление сигнала. В результате некоторая часть рецепторов может активировать все G-белки. Покоящиеся (закрытые) каналы Комплекс медиатора с метаботропным рецептором Активированные (открытые) каналы
 НЕКОТОРЫЕ КЛЕТОЧНЫЕ ОТВЕТЫ НА ГОРМОНЫ , ОПОСРЕДОВАННЫЕ ц. АМФ ПРИ АКТИВАЦИИ Gs -БЕЛКА
НЕКОТОРЫЕ КЛЕТОЧНЫЕ ОТВЕТЫ НА ГОРМОНЫ , ОПОСРЕДОВАННЫЕ ц. АМФ ПРИ АКТИВАЦИИ Gs -БЕЛКА
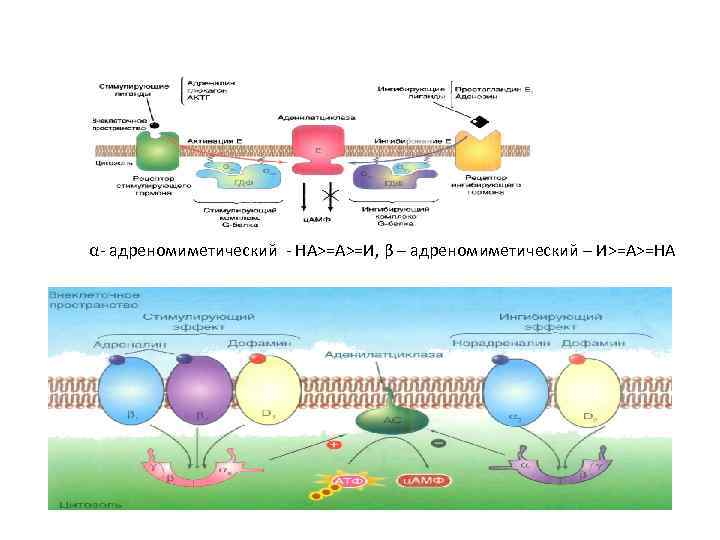 α- адреномиметический - НА>=A>=И, β – адреномиметический – И>=А>=НА
α- адреномиметический - НА>=A>=И, β – адреномиметический – И>=А>=НА
 Дофаминовые рецепторы D 1, D 5 – Gs/olf , гены не содержат интронов, антагонисты R-сульпирид , слабый агонист - апоморфин , на постсинаптических мембранах D 2, D 3, D 4 – Gi, гены содержат интроны – от 3 до 5, на пре- (D 2, D 3) и постсинаптических мембранах, апоморфин — их сильный агонист, сильные антагонисты — (S)-сульпирид и домперидон D 1 – в мезолимбическом, мезокортикальном и нигростриальном нервных путях в лобных долях, полосатом теле, в черной субстации, обонятельных долях, и миндалине, ингибирует N-кальциевые каналы в префронтальной коре. D 2 –ингибирует L, N-кальциевые каналов; полосатом теле, обонятельных долях, черной субстации, гипоталамусе, гипофиз, миндалине, в мезолимбическом, мезокортикальном и нигростриальном нервных путях, деградация – болезнь Паркинсона; D 3 – обонятельные доли, черная субстанция , мозжечок D 4 - в коре, гиппокампе, полосатом теле, миндалине мутации приводят к дисфункции в. н. с. , шизофрении ; обнаружен в лимфоцитах D 5 -в пирамидальных нейронах префронтальной коры, зубчатой извилине, чёрной субстанции, гиппокампе , гипоталамусе D 1, D 2 – важны для функционирования долговременной памяти, D 1 - секрецию ренина в почках, D 2 в надпочечниках регулирует секрецию альдостерона.
Дофаминовые рецепторы D 1, D 5 – Gs/olf , гены не содержат интронов, антагонисты R-сульпирид , слабый агонист - апоморфин , на постсинаптических мембранах D 2, D 3, D 4 – Gi, гены содержат интроны – от 3 до 5, на пре- (D 2, D 3) и постсинаптических мембранах, апоморфин — их сильный агонист, сильные антагонисты — (S)-сульпирид и домперидон D 1 – в мезолимбическом, мезокортикальном и нигростриальном нервных путях в лобных долях, полосатом теле, в черной субстации, обонятельных долях, и миндалине, ингибирует N-кальциевые каналы в префронтальной коре. D 2 –ингибирует L, N-кальциевые каналов; полосатом теле, обонятельных долях, черной субстации, гипоталамусе, гипофиз, миндалине, в мезолимбическом, мезокортикальном и нигростриальном нервных путях, деградация – болезнь Паркинсона; D 3 – обонятельные доли, черная субстанция , мозжечок D 4 - в коре, гиппокампе, полосатом теле, миндалине мутации приводят к дисфункции в. н. с. , шизофрении ; обнаружен в лимфоцитах D 5 -в пирамидальных нейронах префронтальной коры, зубчатой извилине, чёрной субстанции, гиппокампе , гипоталамусе D 1, D 2 – важны для функционирования долговременной памяти, D 1 - секрецию ренина в почках, D 2 в надпочечниках регулирует секрецию альдостерона.
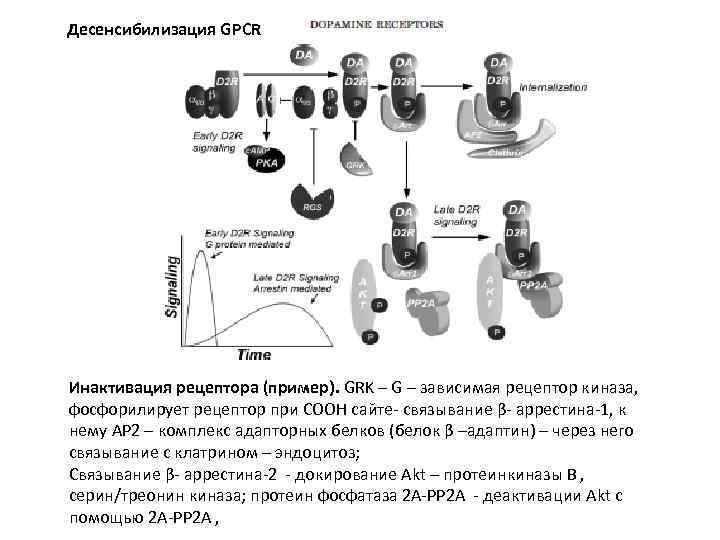 Десенсибилизация GPCR Инактивация рецептора (пример). GRK – G – зависимая рецептор киназа, фосфорилирует рецептор при COOH cайте- связывание β- аррестина-1, к нему АР 2 – комплекс адапторных белков (белок β –адаптин) – через него связывание с клатрином – эндоцитоз; Связывание β- аррестина-2 - докирование Akt – протеинкиназы В , серин/треонин киназа; протеин фосфатаза 2 А-PP 2 A - деактивации Аkt c помощью 2 А-PP 2 A ,
Десенсибилизация GPCR Инактивация рецептора (пример). GRK – G – зависимая рецептор киназа, фосфорилирует рецептор при COOH cайте- связывание β- аррестина-1, к нему АР 2 – комплекс адапторных белков (белок β –адаптин) – через него связывание с клатрином – эндоцитоз; Связывание β- аррестина-2 - докирование Akt – протеинкиназы В , серин/треонин киназа; протеин фосфатаза 2 А-PP 2 A - деактивации Аkt c помощью 2 А-PP 2 A ,
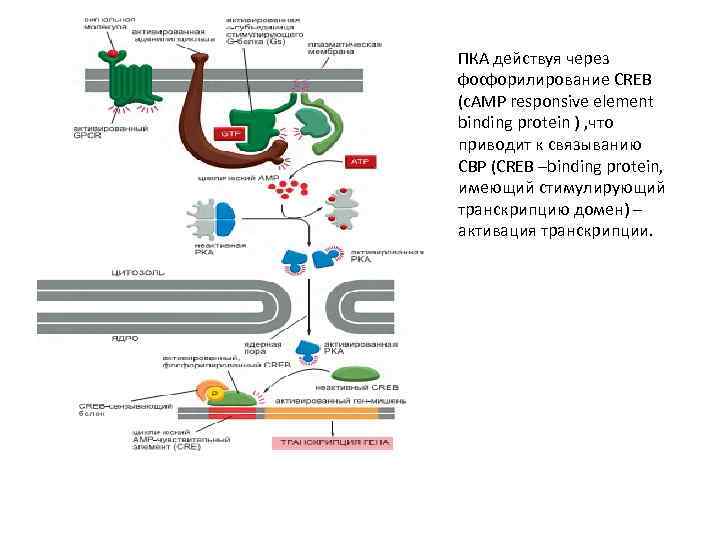 ПКА действуя через фосфорилирование CREB (c. AMP responsive element binding protein ) , что приводит к связыванию CBP (CREB –binding protein, имеющий стимулирующий транскрипцию домен) – активация транскрипции.
ПКА действуя через фосфорилирование CREB (c. AMP responsive element binding protein ) , что приводит к связыванию CBP (CREB –binding protein, имеющий стимулирующий транскрипцию домен) – активация транскрипции.
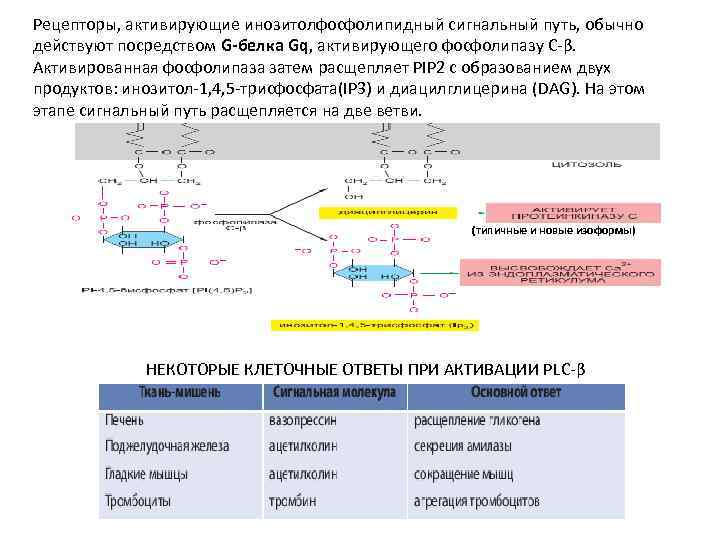 Рецепторы, активирующие инозитолфосфолипидный сигнальный путь, обычно действуют посредством G-белка Gq, активирующего фосфолипазу C-β. Активированная фосфолипаза затем расщепляет PIP 2 с образованием двух продуктов: инозитол-1, 4, 5 -трисфосфата(IP 3) и диацилглицерина (DAG). На этом этапе сигнальный путь расщепляется на две ветви. (типичные и новые изоформы) НЕКОТОРЫЕ КЛЕТОЧНЫЕ ОТВЕТЫ ПРИ АКТИВАЦИИ РLC-β
Рецепторы, активирующие инозитолфосфолипидный сигнальный путь, обычно действуют посредством G-белка Gq, активирующего фосфолипазу C-β. Активированная фосфолипаза затем расщепляет PIP 2 с образованием двух продуктов: инозитол-1, 4, 5 -трисфосфата(IP 3) и диацилглицерина (DAG). На этом этапе сигнальный путь расщепляется на две ветви. (типичные и новые изоформы) НЕКОТОРЫЕ КЛЕТОЧНЫЕ ОТВЕТЫ ПРИ АКТИВАЦИИ РLC-β
 Регуляция содержания внутриклеточного Ca 2+ Кальций снаружи клетки входит в цитозоль через различные Ca 2+ -каналы плазматической мембраны, которые открываются в ответ на связывание лиганда, растяжение или деполяризацию мембраны. Ca 2+ ЭР/CР высвобождается в цитозоль через IP 3 -рецепторы и рианодиновые рецепторы (название связано с тем, что они чувствительны к растительному алкалоиду рианодину). Кальций транспортируется из цитозоля первично-активным транспортом и через 3 Na/ Ca 2+ обменник. Са 2+ в митохондрии через Са 2+ /H -АТФазу– снижение р. Н цитозоли ( окисление, некроз ) Са 2+ из МТ через 2 H/ Са 2+и 3 Na/ Са 2+ обменники. Оплодотворение яйцеклетки сперматозоидом приводит к повышению концентрации цитоплазматического Ca 2+. В яйцеклетку морской звезды до оплодотворения ввели Ca 2+-чувствительный флуоресцентный краситель. Волна цитоплазматического Ca 2+(красная), высвобождаемого из ЭР, распространяется по яйцеклетке от места входа сперматозоида (стрелка). Эта волна Ca 2+изменяет поверхность яйцеклетки, препятствуя входу другого сперматозоида, а также инициирует эмбриональное развитие. Считают, что начальное увеличение концентрации Ca 2+вызывается сперматозоид-специфической PLC (PLCζ), которая вносится в цитоплазму яйцеклетки сперматозоидом при слиянии; PLCζ расщепляет PI(4, 5)P с образованием IP 3.
Регуляция содержания внутриклеточного Ca 2+ Кальций снаружи клетки входит в цитозоль через различные Ca 2+ -каналы плазматической мембраны, которые открываются в ответ на связывание лиганда, растяжение или деполяризацию мембраны. Ca 2+ ЭР/CР высвобождается в цитозоль через IP 3 -рецепторы и рианодиновые рецепторы (название связано с тем, что они чувствительны к растительному алкалоиду рианодину). Кальций транспортируется из цитозоля первично-активным транспортом и через 3 Na/ Ca 2+ обменник. Са 2+ в митохондрии через Са 2+ /H -АТФазу– снижение р. Н цитозоли ( окисление, некроз ) Са 2+ из МТ через 2 H/ Са 2+и 3 Na/ Са 2+ обменники. Оплодотворение яйцеклетки сперматозоидом приводит к повышению концентрации цитоплазматического Ca 2+. В яйцеклетку морской звезды до оплодотворения ввели Ca 2+-чувствительный флуоресцентный краситель. Волна цитоплазматического Ca 2+(красная), высвобождаемого из ЭР, распространяется по яйцеклетке от места входа сперматозоида (стрелка). Эта волна Ca 2+изменяет поверхность яйцеклетки, препятствуя входу другого сперматозоида, а также инициирует эмбриональное развитие. Считают, что начальное увеличение концентрации Ca 2+вызывается сперматозоид-специфической PLC (PLCζ), которая вносится в цитоплазму яйцеклетки сперматозоидом при слиянии; PLCζ расщепляет PI(4, 5)P с образованием IP 3.
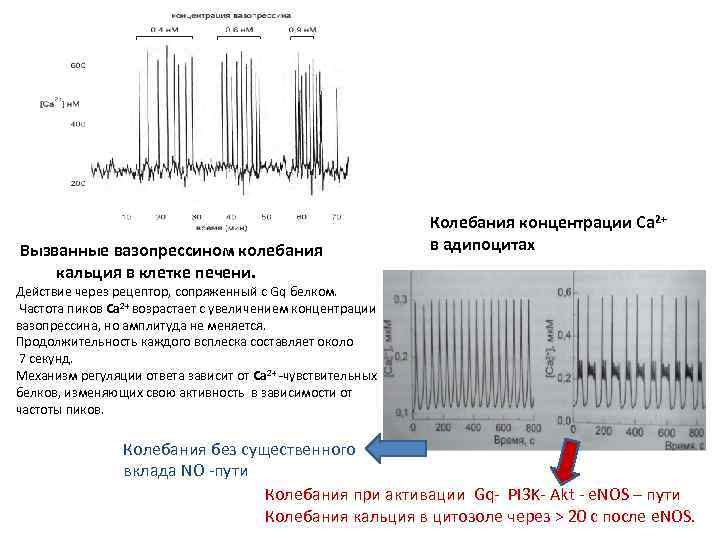 Вызванные вазопрессином колебания кальция в клетке печени. Колебания концентрации Са 2+ в адипоцитах Действие через рецептор, сопряженный с Gq белком. Частота пиков Са 2+ возрастает с увеличением концентрации вазопрессина, но амплитуда не меняется. Продолжительность каждого всплеска составляет около 7 секунд. Механизм регуляции ответа зависит от Са 2+ -чувствительных белков, изменяющих свою активность в зависимости от частоты пиков. Колебания без существенного вклада NO -пути Колебания при активации Gq- PI 3 K- Akt - e. NOS – пути Колебания кальция в цитозоле через > 20 с после e. NOS.
Вызванные вазопрессином колебания кальция в клетке печени. Колебания концентрации Са 2+ в адипоцитах Действие через рецептор, сопряженный с Gq белком. Частота пиков Са 2+ возрастает с увеличением концентрации вазопрессина, но амплитуда не меняется. Продолжительность каждого всплеска составляет около 7 секунд. Механизм регуляции ответа зависит от Са 2+ -чувствительных белков, изменяющих свою активность в зависимости от частоты пиков. Колебания без существенного вклада NO -пути Колебания при активации Gq- PI 3 K- Akt - e. NOS – пути Колебания кальция в цитозоле через > 20 с после e. NOS.
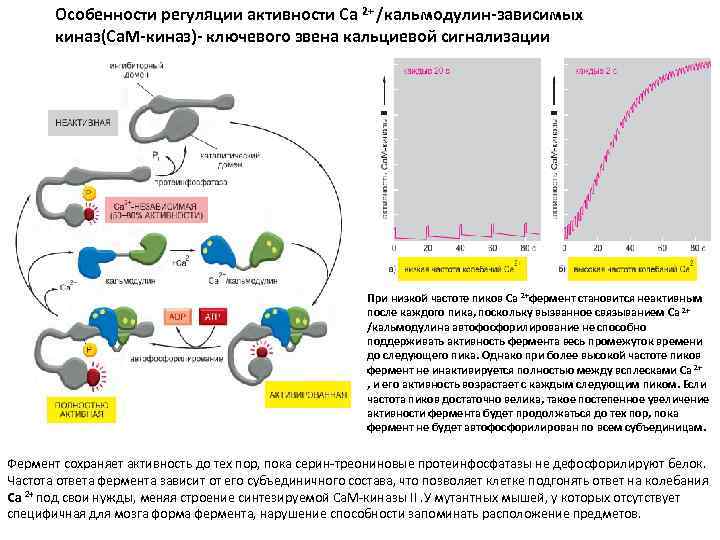 Особенности регуляции активности Са 2+ /кальмодулин-зависимых киназ(Ca. M-киназ)- ключевого звена кальциевой сигнализации При низкой частоте пиков Са 2+фермент становится неактивным после каждого пика, поскольку вызванное связыванием Са 2+ /кальмодулина автофосфорилирование не способно поддерживать активность фермента весь промежуток времени до следующего пика. Однако при более высокой частоте пиков фермент не инактивируется полностью между всплесками Са 2+ , и его активность возрастает с каждым следующим пиком. Если частота пиков достаточно велика, такое постепенное увеличение активности фермента будет продолжаться до тех пор, пока фермент не будет автофосфорилирован по всем субъединицам. Фермент сохраняет активность до тех пор, пока серин-треониновые протеинфосфатазы не дефосфорилируют белок. Частота ответа фермента зависит от его субъединичного состава, что позволяет клетке подгонять ответ на колебания Са 2+ под свои нужды, меняя строение синтезируемой Ca. M-киназы II. У мутантных мышей, у которых отсутствует специфичная для мозга форма фермента, нарушение способности запоминать расположение предметов.
Особенности регуляции активности Са 2+ /кальмодулин-зависимых киназ(Ca. M-киназ)- ключевого звена кальциевой сигнализации При низкой частоте пиков Са 2+фермент становится неактивным после каждого пика, поскольку вызванное связыванием Са 2+ /кальмодулина автофосфорилирование не способно поддерживать активность фермента весь промежуток времени до следующего пика. Однако при более высокой частоте пиков фермент не инактивируется полностью между всплесками Са 2+ , и его активность возрастает с каждым следующим пиком. Если частота пиков достаточно велика, такое постепенное увеличение активности фермента будет продолжаться до тех пор, пока фермент не будет автофосфорилирован по всем субъединицам. Фермент сохраняет активность до тех пор, пока серин-треониновые протеинфосфатазы не дефосфорилируют белок. Частота ответа фермента зависит от его субъединичного состава, что позволяет клетке подгонять ответ на колебания Са 2+ под свои нужды, меняя строение синтезируемой Ca. M-киназы II. У мутантных мышей, у которых отсутствует специфичная для мозга форма фермента, нарушение способности запоминать расположение предметов.
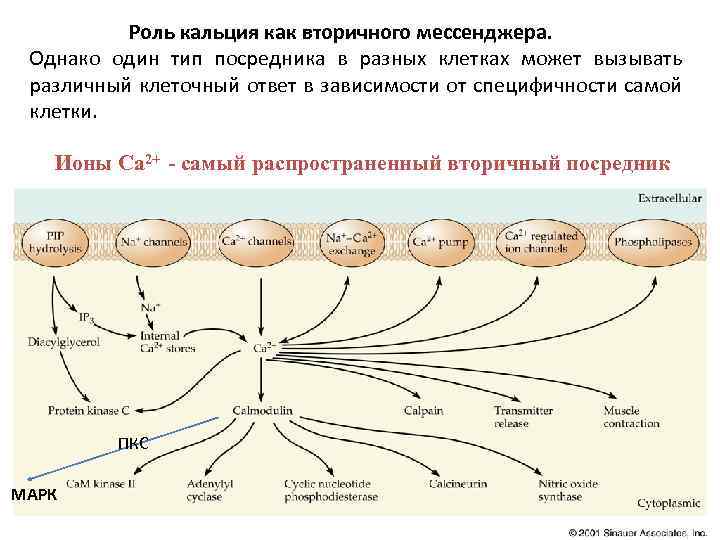 Роль кальция как вторичного мессенджера. Однако один тип посредника в разных клетках может вызывать различный клеточный ответ в зависимости от специфичности самой клетки. Ионы Са 2+ - самый распространенный вторичный посредник ПКС МАРК
Роль кальция как вторичного мессенджера. Однако один тип посредника в разных клетках может вызывать различный клеточный ответ в зависимости от специфичности самой клетки. Ионы Са 2+ - самый распространенный вторичный посредник ПКС МАРК
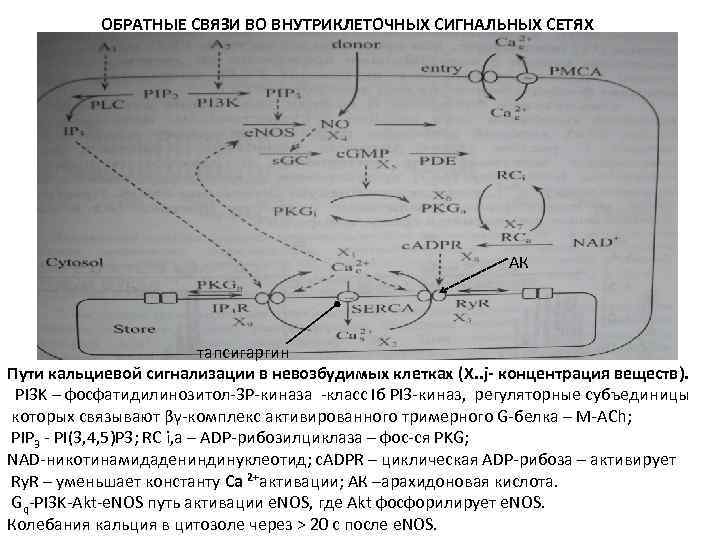 ОБРАТНЫЕ СВЯЗИ ВО ВНУТРИКЛЕТОЧНЫХ СИГНАЛЬНЫХ СЕТЯХ АК тапсигаргин Пути кальциевой сигнализации в невозбудимых клетках (X. . j- концентрация веществ). РI 3 K – фосфатидилинозитол-3 P-киназа -класс Iб PI 3 -киназ, регуляторные субъединицы которых связывают βγ-комплекс активированного тримерного G-белка – М-ACh; PIP 3 - PI(3, 4, 5)P 3; RC i, a – ADP-рибозилциклаза – фос-ся PKG; NAD-никотинамидадениндинуклеотид; с. ADPR – циклическая ADP-рибоза – активирует Ry. R – уменьшает константу Са 2+активации; АК –арахидоновая кислота. Gq-PI 3 K-Akt-e. NOS путь активации e. NOS, где Akt фосфорилирует e. NOS. Колебания кальция в цитозоле через > 20 с после e. NOS.
ОБРАТНЫЕ СВЯЗИ ВО ВНУТРИКЛЕТОЧНЫХ СИГНАЛЬНЫХ СЕТЯХ АК тапсигаргин Пути кальциевой сигнализации в невозбудимых клетках (X. . j- концентрация веществ). РI 3 K – фосфатидилинозитол-3 P-киназа -класс Iб PI 3 -киназ, регуляторные субъединицы которых связывают βγ-комплекс активированного тримерного G-белка – М-ACh; PIP 3 - PI(3, 4, 5)P 3; RC i, a – ADP-рибозилциклаза – фос-ся PKG; NAD-никотинамидадениндинуклеотид; с. ADPR – циклическая ADP-рибоза – активирует Ry. R – уменьшает константу Са 2+активации; АК –арахидоновая кислота. Gq-PI 3 K-Akt-e. NOS путь активации e. NOS, где Akt фосфорилирует e. NOS. Колебания кальция в цитозоле через > 20 с после e. NOS.
 Классификация протеинкиназ Кальмодулин-зависимые (активируются с помощью кальмодулина + кальций -поступивший в клетку и внутриклеточный из ЭР) Специфические: киназа легких цепей миозина, киназа фосфорилазы Мультифункциональные : (РКС, РКА, РКG , Cа. МКIII , Са. МКIV, Cа. МКII - много эффекторов) По данным : Камкин, Киселева, 2008; Камкин, Киселева, 2010
Классификация протеинкиназ Кальмодулин-зависимые (активируются с помощью кальмодулина + кальций -поступивший в клетку и внутриклеточный из ЭР) Специфические: киназа легких цепей миозина, киназа фосфорилазы Мультифункциональные : (РКС, РКА, РКG , Cа. МКIII , Са. МКIV, Cа. МКII - много эффекторов) По данным : Камкин, Киселева, 2008; Камкин, Киселева, 2010
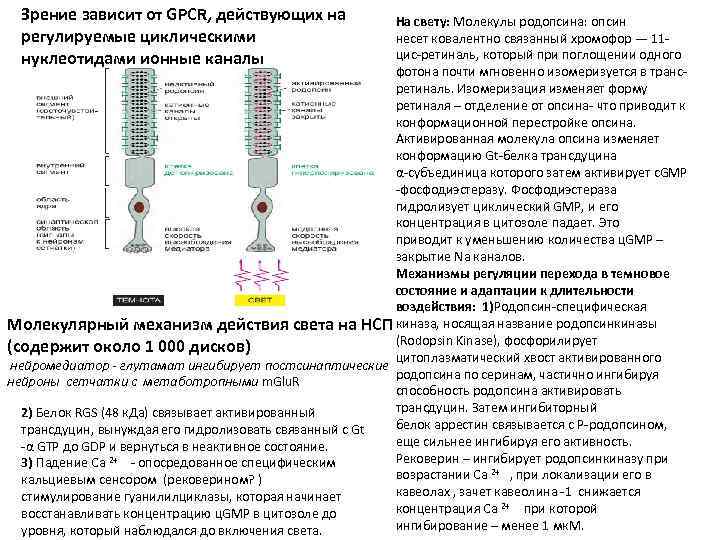 Зрение зависит от GPCR, действующих на регулируемые циклическими нуклеотидами ионные каналы На свету: Молекулы родопсина: опсин несет ковалентно связанный хромофор — 11 цис-ретиналь, который при поглощении одного фотона почти мгновенно изомеризуется в трансретиналь. Изомеризация изменяет форму ретиналя – отделение от опсина- что приводит к конформационной перестройке опсина. Активированная молекула опсина изменяет конформацию Gt-белка трансдуцина α-субъединица которого затем активирует с. GMP -фосфодиэстеразу. Фосфодиэстераза гидролизует циклический GMP, и его концентрация в цитозоле падает. Это приводит к уменьшению количества ц. GMP – закрытие Na каналов. Механизмы регуляции перехода в темновое состояние и адаптации к длительности воздействия: 1)Родопсин-специфическая Молекулярный механизм действия света на НСП киназа, носящая название родопсинкиназы (Rodopsin Kinase), фосфорилирует (содержит около 1 000 дисков) цитоплазматический хвост активированного нейромедиатор - глутамат ингибирует постсинаптические родопсина по серинам, частично ингибируя нейроны сетчатки с метаботропными m. Glu. R способность родопсина активировать трансдуцин. Затем ингибиторный 2) Белок RGS (48 к. Да) связывает активированный белок аррестин связывается с P-родопсином, трансдуцин, вынуждая его гидролизовать связанный с Gt еще сильнее ингибируя его активность. -α GTP до GDP и вернуться в неактивное состояние. Рековерин – ингибирует родопсинкиназу при 3) Падение Са 2+ - опосредованное специфическим возрастании Са 2+ , при локализации его в кальциевым сенсором (рековерином? ) кавеолах , зачет кавеолина -1 снижается стимулирование гуанилилциклазы, которая начинает концентрация Са 2+ при которой восстанавливать концентрацию ц. GMP в цитозоле до ингибирование – менее 1 мк. М. уровня, который наблюдался до включения света.
Зрение зависит от GPCR, действующих на регулируемые циклическими нуклеотидами ионные каналы На свету: Молекулы родопсина: опсин несет ковалентно связанный хромофор — 11 цис-ретиналь, который при поглощении одного фотона почти мгновенно изомеризуется в трансретиналь. Изомеризация изменяет форму ретиналя – отделение от опсина- что приводит к конформационной перестройке опсина. Активированная молекула опсина изменяет конформацию Gt-белка трансдуцина α-субъединица которого затем активирует с. GMP -фосфодиэстеразу. Фосфодиэстераза гидролизует циклический GMP, и его концентрация в цитозоле падает. Это приводит к уменьшению количества ц. GMP – закрытие Na каналов. Механизмы регуляции перехода в темновое состояние и адаптации к длительности воздействия: 1)Родопсин-специфическая Молекулярный механизм действия света на НСП киназа, носящая название родопсинкиназы (Rodopsin Kinase), фосфорилирует (содержит около 1 000 дисков) цитоплазматический хвост активированного нейромедиатор - глутамат ингибирует постсинаптические родопсина по серинам, частично ингибируя нейроны сетчатки с метаботропными m. Glu. R способность родопсина активировать трансдуцин. Затем ингибиторный 2) Белок RGS (48 к. Да) связывает активированный белок аррестин связывается с P-родопсином, трансдуцин, вынуждая его гидролизовать связанный с Gt еще сильнее ингибируя его активность. -α GTP до GDP и вернуться в неактивное состояние. Рековерин – ингибирует родопсинкиназу при 3) Падение Са 2+ - опосредованное специфическим возрастании Са 2+ , при локализации его в кальциевым сенсором (рековерином? ) кавеолах , зачет кавеолина -1 снижается стимулирование гуанилилциклазы, которая начинает концентрация Са 2+ при которой восстанавливать концентрацию ц. GMP в цитозоле до ингибирование – менее 1 мк. М. уровня, который наблюдался до включения света.
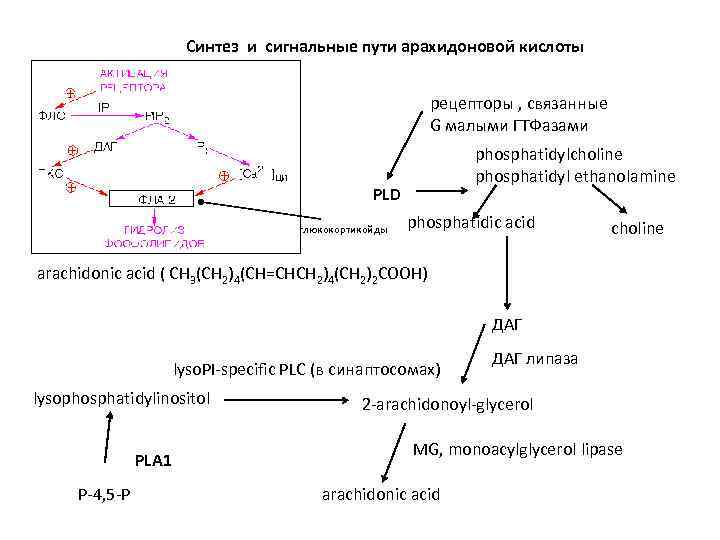 Синтез и сигнальные пути арахидоновой кислоты рецепторы , связанные G малыми ГТФазами phosphatidylcholine phosphatidyl ethanolamine РLD глюкокортикойды phosphatidic acid choline arachidonic acid ( CH 3(CH 2)4(CH=CHCH 2)4(CH 2)2 COOH) ДАГ lyso. PI-specific PLC (в синаптосомах) lysophosphatidylinositol РLA 1 P-4, 5 -P ДАГ липаза 2 -arachidonoyl-glycerol MG, monoacylglycerol lipase arachidonic acid
Синтез и сигнальные пути арахидоновой кислоты рецепторы , связанные G малыми ГТФазами phosphatidylcholine phosphatidyl ethanolamine РLD глюкокортикойды phosphatidic acid choline arachidonic acid ( CH 3(CH 2)4(CH=CHCH 2)4(CH 2)2 COOH) ДАГ lyso. PI-specific PLC (в синаптосомах) lysophosphatidylinositol РLA 1 P-4, 5 -P ДАГ липаза 2 -arachidonoyl-glycerol MG, monoacylglycerol lipase arachidonic acid
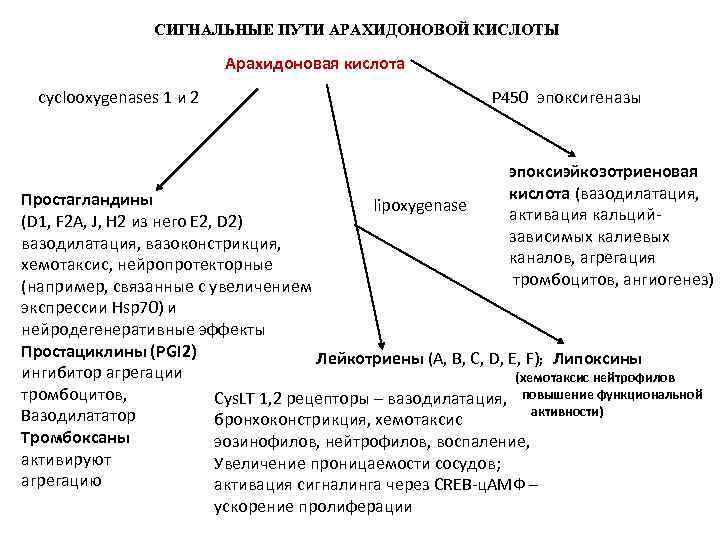 СИГНАЛЬНЫЕ ПУТИ АРАХИДОНОВОЙ КИСЛОТЫ Арахидоновая кислота сyclooxygenases 1 и 2 P 450 эпоксигеназы эпоксиэйкозотриеновая кислота (вазодилатация, активация кальцийзависимых калиевых каналов, агрегация тромбоцитов, ангиогенез) Простагландины lipoxygenase (D 1, F 2 A, J, H 2 из него E 2, D 2) вазодилатация, вазоконстрикция, хемотаксис, нейропротекторные (например, связанные с увеличением экспрессии Hsp 70) и нейродегенеративные эффекты Простациклины (PGI 2) Лейкотриены (А, В, С, D, Е, F); Липоксины ингибитор агрегации (хемотаксис нейтрофилов повышение функциональной тромбоцитов, Cys. LT 1, 2 рецепторы – вазодилатация, активности) Вазодилататор бронхоконстрикция, хемотаксис Тромбоксаны эозинофилов, нейтрофилов, воспаление, активируют Увеличение проницаемости сосудов; агрегацию активация сигналинга через CREB-ц. АМФ – ускорение пролиферации
СИГНАЛЬНЫЕ ПУТИ АРАХИДОНОВОЙ КИСЛОТЫ Арахидоновая кислота сyclooxygenases 1 и 2 P 450 эпоксигеназы эпоксиэйкозотриеновая кислота (вазодилатация, активация кальцийзависимых калиевых каналов, агрегация тромбоцитов, ангиогенез) Простагландины lipoxygenase (D 1, F 2 A, J, H 2 из него E 2, D 2) вазодилатация, вазоконстрикция, хемотаксис, нейропротекторные (например, связанные с увеличением экспрессии Hsp 70) и нейродегенеративные эффекты Простациклины (PGI 2) Лейкотриены (А, В, С, D, Е, F); Липоксины ингибитор агрегации (хемотаксис нейтрофилов повышение функциональной тромбоцитов, Cys. LT 1, 2 рецепторы – вазодилатация, активности) Вазодилататор бронхоконстрикция, хемотаксис Тромбоксаны эозинофилов, нейтрофилов, воспаление, активируют Увеличение проницаемости сосудов; агрегацию активация сигналинга через CREB-ц. АМФ – ускорение пролиферации


