Сигнальные пептидны (гормоны? ) растений 1. Системины :






10_gormony_i_ikh_retseptory.ppt
- Размер: 16.9 Мб
- Автор: Эля Алиева
- Количество слайдов: 52
Описание презентации Сигнальные пептидны (гормоны? ) растений 1. Системины : по слайдам
 Сигнальные пептидны (гормоны? ) растений 1. Системины : олигопептиды из 18 аминокислот, центральная роль в системной устойчивости. Образуются из просистемина ~ 200 а-к. «Табачные» системины содержат гидроксипролин и гликозилированы. Tom Sys: + AVQSKPPSKRDPPKMQTD – Tob Sys I : + RGANLPOOSOASSOOSKE — Tob Sys II: + NRKPLSOOSOKPADGQRP — 2. RALF ( RAPID ALKALINIZATION FACTOR ) – белок из 49 а-к, запускает МАР-киназный каскад. 3. ФИТОСУЛЬФОКИНЫ ( Phytosulfokines). Регулируют пролиферацию. Синтез из пропептида в 89 а-к с лидером. PSK-α: Tyr(SO 3 H)-Ile-Tyr(SO 3 H)-Thr-Gln — PSK- β : Tyr(SO 3 H)-Ile-Tyr(SO 3 H)-Thr — 4. CLAVATA 3. Экстрацеллюлярный сигнальный пептид, 79 а-к. Регулирует размер апикальной меристемы (вместе с КАРР). 5. S-LOCUS PROTEINS 11 (SP 11) Семейство белков от 47 до 60 а-к. Центральная роль в само-несовместимости пыльцы у Brassicaceae
Сигнальные пептидны (гормоны? ) растений 1. Системины : олигопептиды из 18 аминокислот, центральная роль в системной устойчивости. Образуются из просистемина ~ 200 а-к. «Табачные» системины содержат гидроксипролин и гликозилированы. Tom Sys: + AVQSKPPSKRDPPKMQTD – Tob Sys I : + RGANLPOOSOASSOOSKE — Tob Sys II: + NRKPLSOOSOKPADGQRP — 2. RALF ( RAPID ALKALINIZATION FACTOR ) – белок из 49 а-к, запускает МАР-киназный каскад. 3. ФИТОСУЛЬФОКИНЫ ( Phytosulfokines). Регулируют пролиферацию. Синтез из пропептида в 89 а-к с лидером. PSK-α: Tyr(SO 3 H)-Ile-Tyr(SO 3 H)-Thr-Gln — PSK- β : Tyr(SO 3 H)-Ile-Tyr(SO 3 H)-Thr — 4. CLAVATA 3. Экстрацеллюлярный сигнальный пептид, 79 а-к. Регулирует размер апикальной меристемы (вместе с КАРР). 5. S-LOCUS PROTEINS 11 (SP 11) Семейство белков от 47 до 60 а-к. Центральная роль в само-несовместимости пыльцы у Brassicaceae
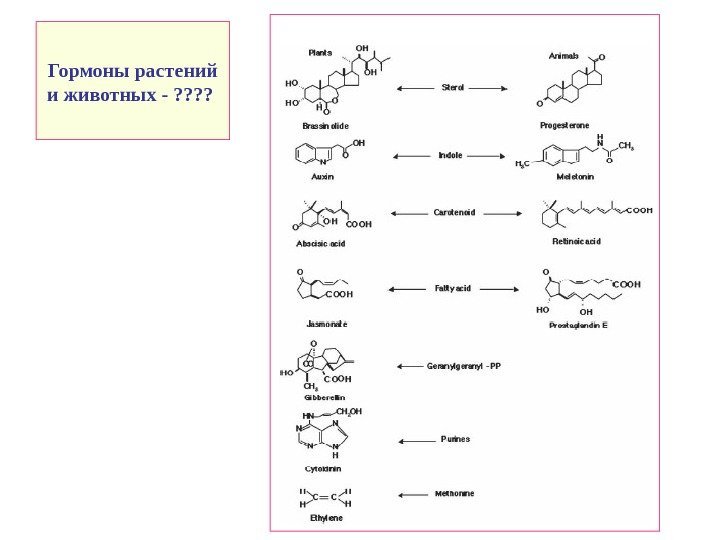
 Гормоны растений и животных — ? ?
Гормоны растений и животных — ? ?
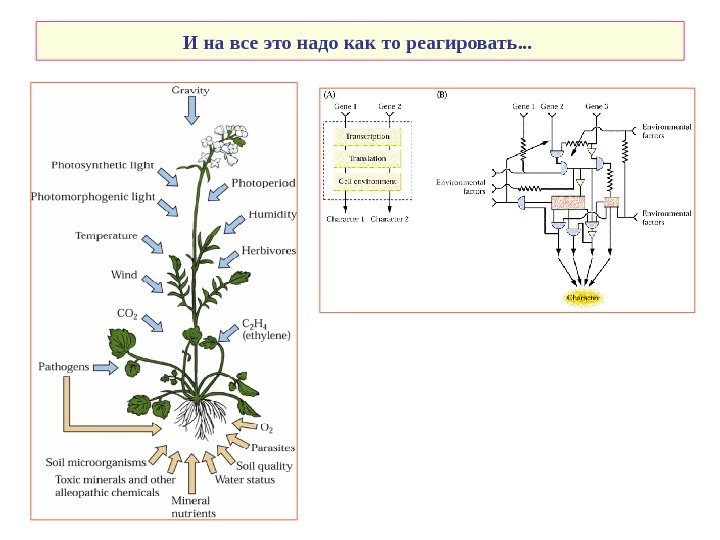
 И на все это надо как то реагировать. . .
И на все это надо как то реагировать. . .
 Схема восприятия и трансдукции сигнала в изображении Бидструпа. . .
Схема восприятия и трансдукции сигнала в изображении Бидструпа. . .
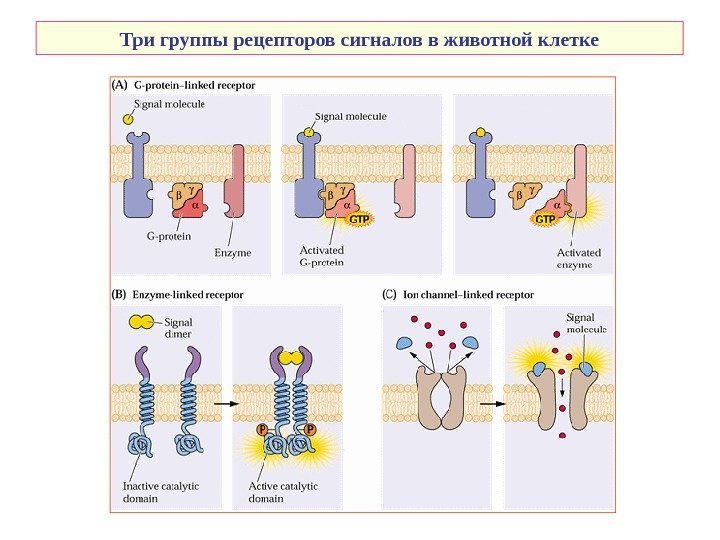
 Три группы рецепторов сигналов в животной клетке
Три группы рецепторов сигналов в животной клетке
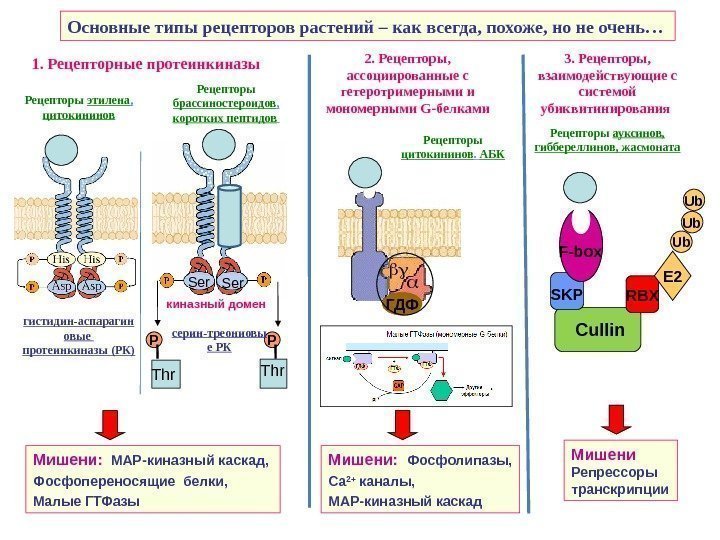
 Основные типы рецепторов растений – как всегда, похоже, но не очень… 1. Рецепторные протеинкиназы 2. Рецепторы, ассоциированные с гетеротримерными и мономерными G -белками 3. Рецепторы, взаимодействующие с системой убиквитинирования Рецепторы ауксинов, гиббереллинов, жасмоната ГДФ RBX Cullin E 2 SKP Ub Ub Ub Мишени: МАР-киназный каскад, Фосфопереносящие белки, Малые ГТФазы Мишени: Фосфолипазы, Са 2+ каналы, МАР-киназный каскад Мишени Репрессоры транскрипции. F-box Ser киназный домен Thr Thr. P PРецепторы брассиностероидов , коротких пептидов Рецепторы этилена , цитокининов Рецепторы цитокининов. АБК гистидин-аспарагин овые протеинкиназы (РК) серин-треониовы е РК
Основные типы рецепторов растений – как всегда, похоже, но не очень… 1. Рецепторные протеинкиназы 2. Рецепторы, ассоциированные с гетеротримерными и мономерными G -белками 3. Рецепторы, взаимодействующие с системой убиквитинирования Рецепторы ауксинов, гиббереллинов, жасмоната ГДФ RBX Cullin E 2 SKP Ub Ub Ub Мишени: МАР-киназный каскад, Фосфопереносящие белки, Малые ГТФазы Мишени: Фосфолипазы, Са 2+ каналы, МАР-киназный каскад Мишени Репрессоры транскрипции. F-box Ser киназный домен Thr Thr. P PРецепторы брассиностероидов , коротких пептидов Рецепторы этилена , цитокининов Рецепторы цитокининов. АБК гистидин-аспарагин овые протеинкиназы (РК) серин-треониовы е РК
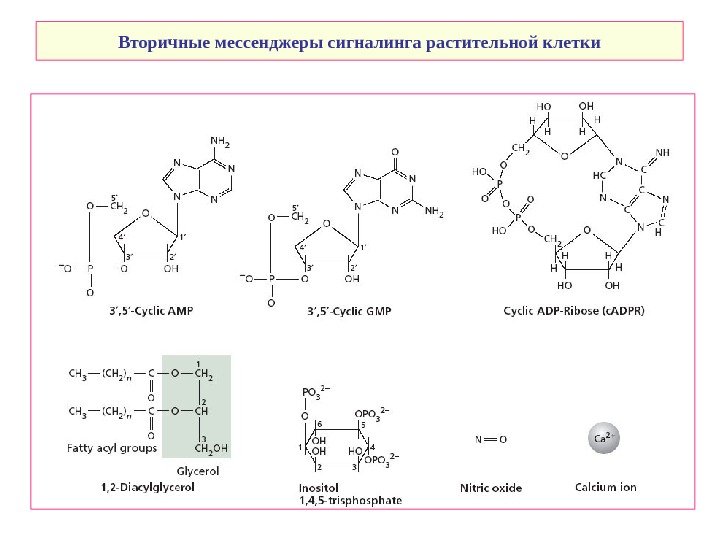
 Вторичные мессенджеры сигналинга растительной клетки
Вторичные мессенджеры сигналинга растительной клетки
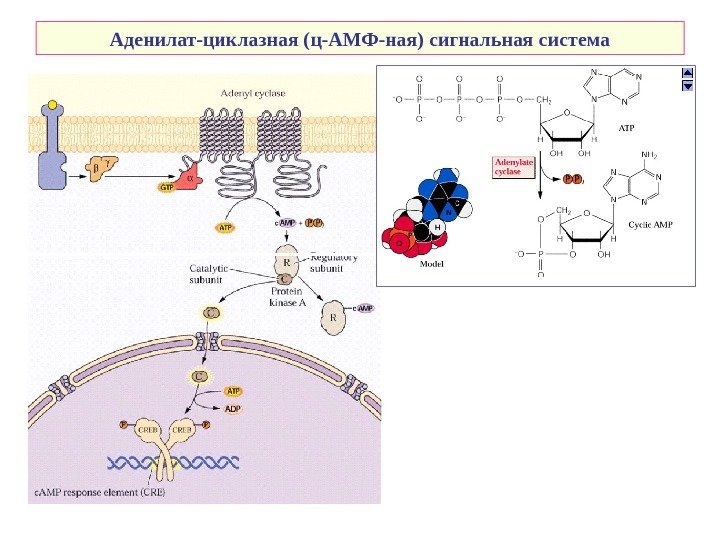
 Аденилат-циклазная (ц-АМФ-ная) сигнальная система
Аденилат-циклазная (ц-АМФ-ная) сигнальная система
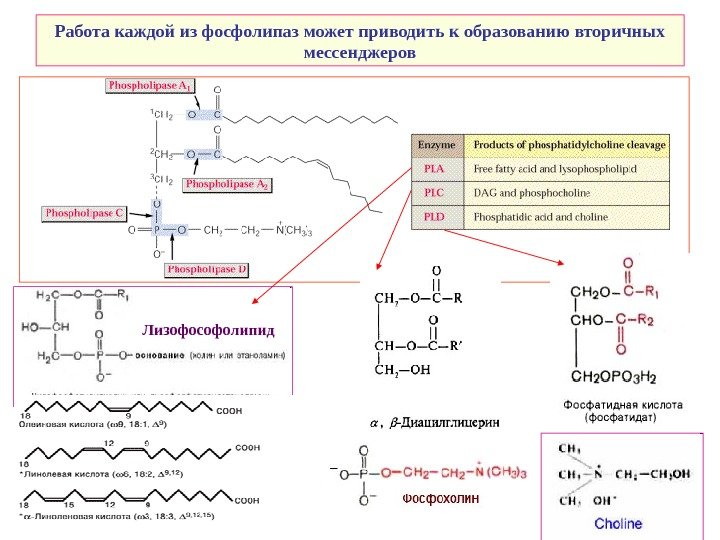
 Работа каждой из фосфолипаз может приводить к образованию вторичных мессенджеров Лизофософолипид
Работа каждой из фосфолипаз может приводить к образованию вторичных мессенджеров Лизофософолипид
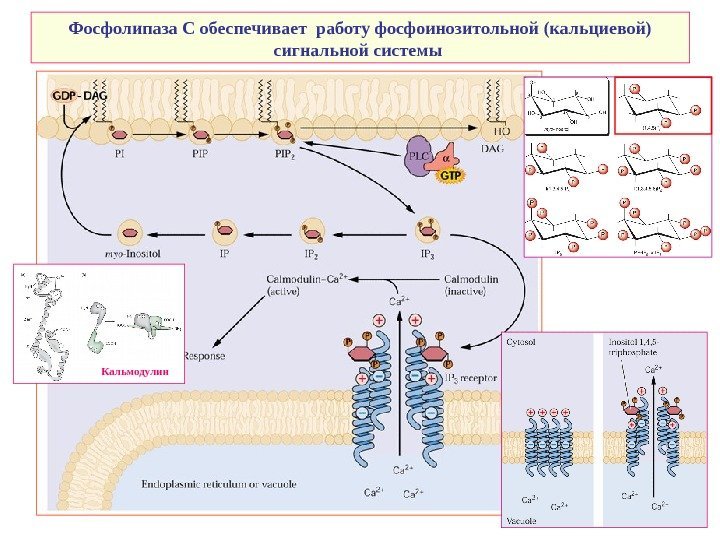
 Фосфолипаза С обеспечивает работу фосфоинозитольной (кальциевой) сигнальной системы Кальмодулин
Фосфолипаза С обеспечивает работу фосфоинозитольной (кальциевой) сигнальной системы Кальмодулин
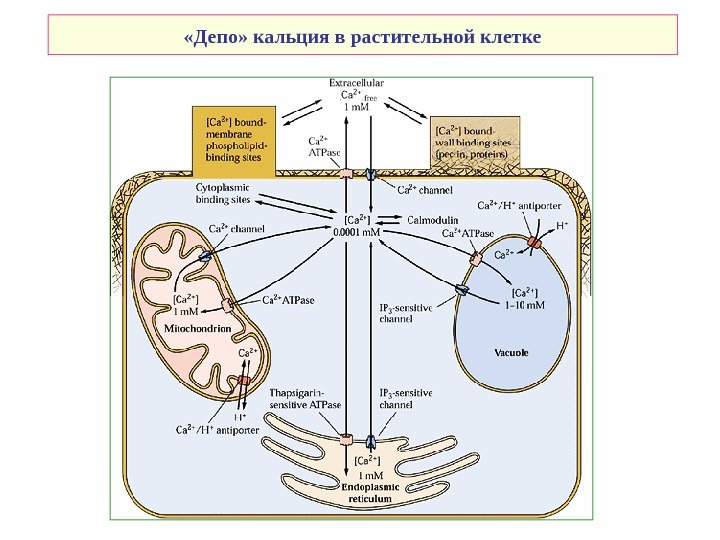
 «Депо» кальция в растительной клетке
«Депо» кальция в растительной клетке
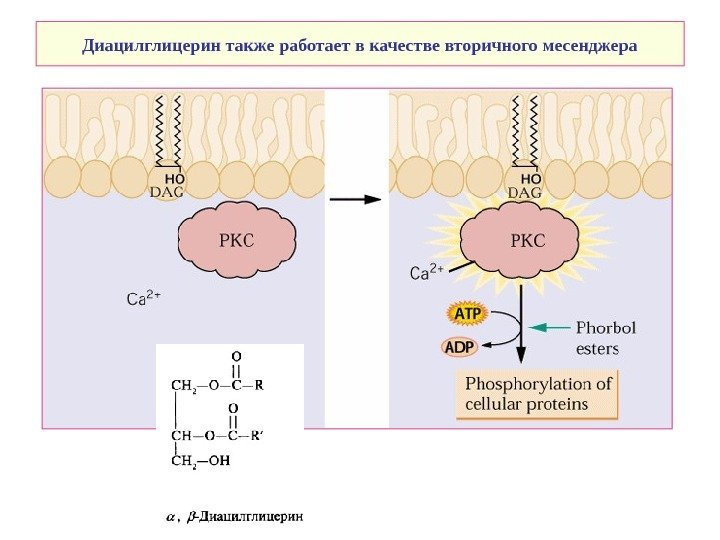
 Диацилглицерин также работает в качестве вторичного месенджера
Диацилглицерин также работает в качестве вторичного месенджера
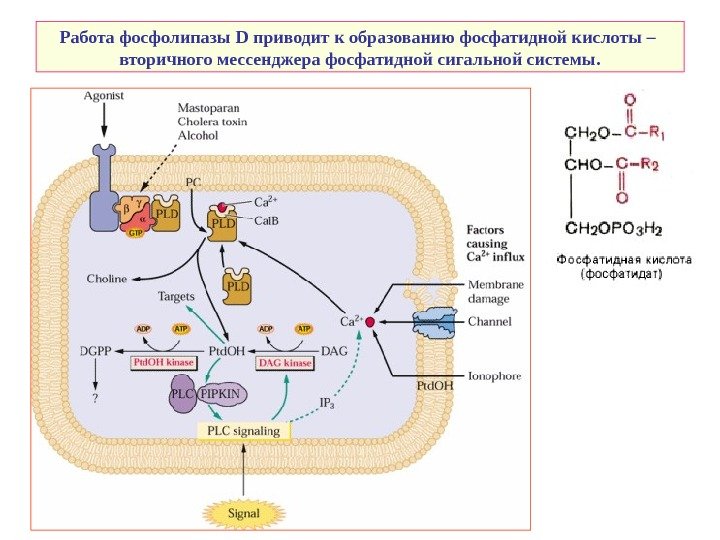
 Работа фосфолипазы D приводит к образованию фосфатидной кислоты – вторичного мессенджера фосфатидной сигальной системы.
Работа фосфолипазы D приводит к образованию фосфатидной кислоты – вторичного мессенджера фосфатидной сигальной системы.
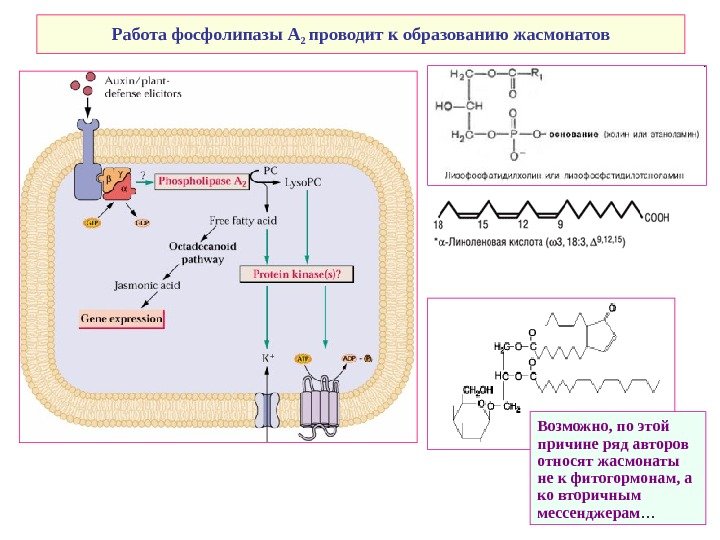
 Работа фосфолипазы А 2 проводит к образованию жасмонатов Возможно, по этой причине ряд авторов относят жасмонаты не к фитогормонам, а ко вторичным мессенджерам …
Работа фосфолипазы А 2 проводит к образованию жасмонатов Возможно, по этой причине ряд авторов относят жасмонаты не к фитогормонам, а ко вторичным мессенджерам …
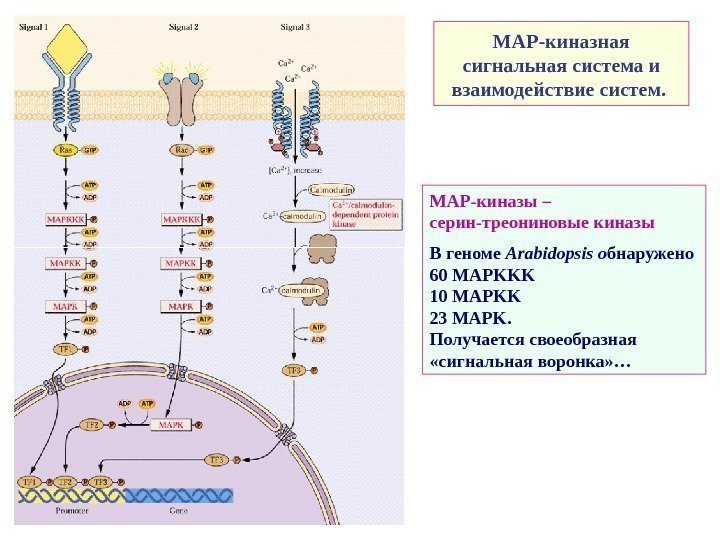
 МАР-киназная сигнальная система и взаимодействие систем. МАР-киназы – серин-треониновые киназы В геноме Arabidopsis о бнаружено 60 MAPKKK 10 MAPKK 23 MAPK. Получается своеобразная «сигнальная воронка» …
МАР-киназная сигнальная система и взаимодействие систем. МАР-киназы – серин-треониновые киназы В геноме Arabidopsis о бнаружено 60 MAPKKK 10 MAPKK 23 MAPK. Получается своеобразная «сигнальная воронка» …
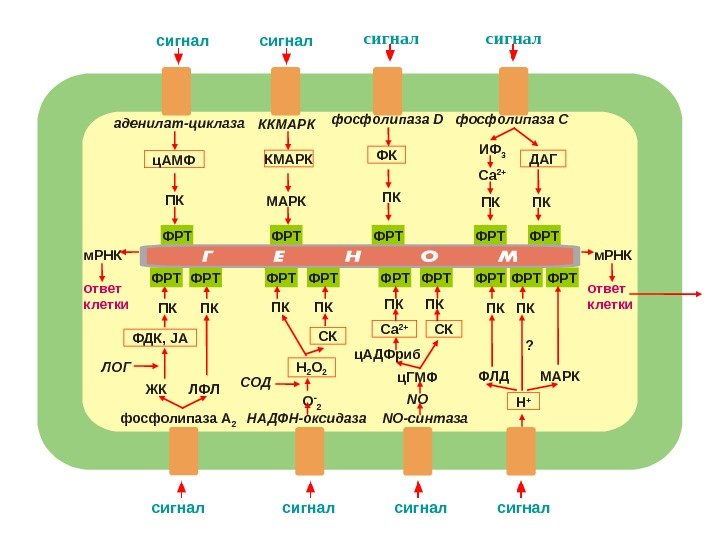
 сигнал аденилат-циклаза ПКц. АМФ сигнал ККМАРК сигнал фосфолипаза D ФК ПК сигнал фосфолипаза С ИФ 3 Са 2+ ПК ПКДАГ сигнал ПК ПК ЖК ЛФЛЛОГ ФДК, JA фосфолипаза А 2 ФРТ ФРТ ФРТ ФРТ сигнал. ПК ПК МАРК Н +ФЛД ? сигнал О — 2 — СОД Н 2 О 2 ПК ПК СК НАДФН-оксидаза сигнал. ПК ПК СК NO-синтаза. Са 2+ NOц. ГМФц. АДФрибм. РНК ответ клетки
сигнал аденилат-циклаза ПКц. АМФ сигнал ККМАРК сигнал фосфолипаза D ФК ПК сигнал фосфолипаза С ИФ 3 Са 2+ ПК ПКДАГ сигнал ПК ПК ЖК ЛФЛЛОГ ФДК, JA фосфолипаза А 2 ФРТ ФРТ ФРТ ФРТ сигнал. ПК ПК МАРК Н +ФЛД ? сигнал О — 2 — СОД Н 2 О 2 ПК ПК СК НАДФН-оксидаза сигнал. ПК ПК СК NO-синтаза. Са 2+ NOц. ГМФц. АДФрибм. РНК ответ клетки
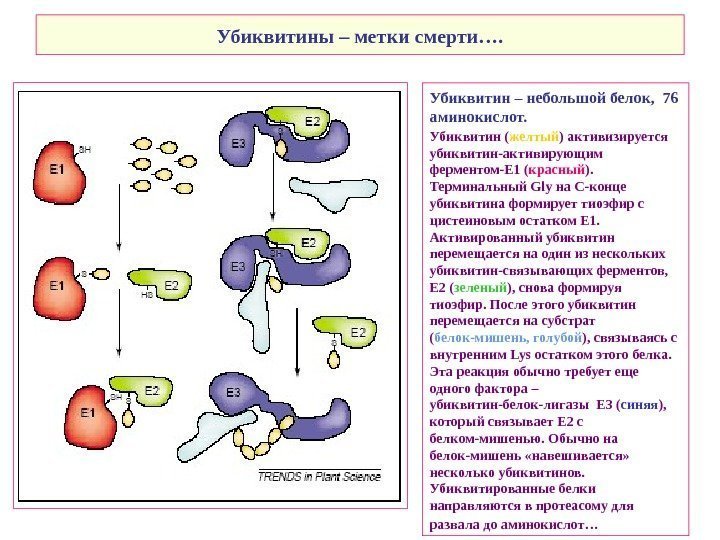
 Убиквитины – метки смерти…. Убиквитин – небольшой белок, 76 аминокислот. Убиквитин ( желтый ) активизируется убиквитин-активирующим ферментом-E 1 ( красный ). Терминальный Gly на С-конце убиквитина формирует тиоэфир с цистеиновым остатком E 1. Активированный убиквитин перемещается на один из нескольких убиквитин-связывающих ферментов, E 2 ( зеленый ), снова формируя тиоэфир. После этого убиквитин перемещается на субстрат ( белок-мишень, голубой ), связываясь с внутренним Lys остатком этого белка. Эта реакция обычно требует еще одного фактора – убиквитин-белок-лигазы E 3 ( синяя ), который связывает E 2 с белком-мишенью. Обычно на белок-мишень «навешивается» несколько убиквитинов. Убиквитированные белки направляются в протеасому для развала до аминокислот…
Убиквитины – метки смерти…. Убиквитин – небольшой белок, 76 аминокислот. Убиквитин ( желтый ) активизируется убиквитин-активирующим ферментом-E 1 ( красный ). Терминальный Gly на С-конце убиквитина формирует тиоэфир с цистеиновым остатком E 1. Активированный убиквитин перемещается на один из нескольких убиквитин-связывающих ферментов, E 2 ( зеленый ), снова формируя тиоэфир. После этого убиквитин перемещается на субстрат ( белок-мишень, голубой ), связываясь с внутренним Lys остатком этого белка. Эта реакция обычно требует еще одного фактора – убиквитин-белок-лигазы E 3 ( синяя ), который связывает E 2 с белком-мишенью. Обычно на белок-мишень «навешивается» несколько убиквитинов. Убиквитированные белки направляются в протеасому для развала до аминокислот…
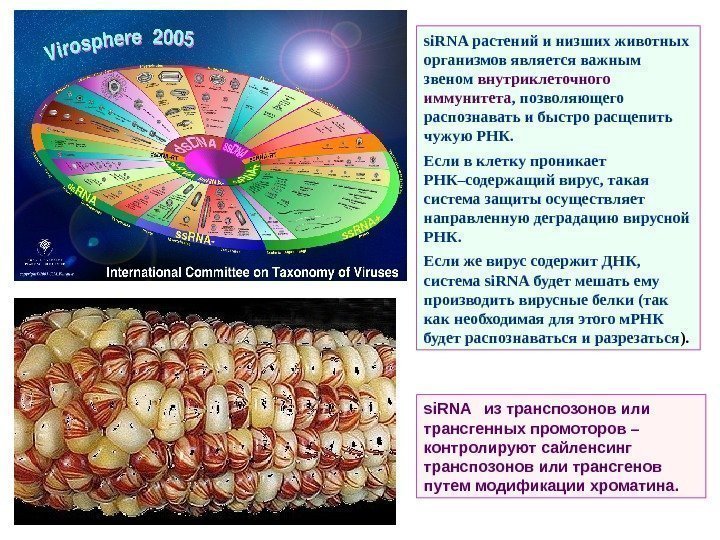
 Малые РНК делятся на: малые интерферирующие РНК ( si. RNA ) — small (short) interferiе RNA и микро. РНК ( mi. RNA ). Открытие целого мира малых РНК (s mall RNAs , s. RNAs ), регулирующих экспрессию генов, — конец 1990 -х годов, в 2006 г. авторам этого открытия Andrew Fire ( Фаер ) и К raig Mello ( Мелло ) была присуждена Нобелевская премия. Малые РНК растений Малые интерферирующие РНК растений ( si. RNA ) РНК-интерференция – процесс подавления экспрессии гена на стадии транскрипции, трансляции, дезаденилирования или деградации м. РНК при помощи малых молекул РНК. Малые интерферирующие РНК способны осуществлять направленную деградацию или блокировать трансляцию РНК определенной последовательности и участвовать, таким образом, в защите клетки от вирусов , репрессии трансгенов и подавлении экспрессии мобильных генетических элементов. Непосредственными предшественниками si. RNAs (в отличие от m i. РНК ) являются двухцепочечные молекулы РНК, которые образуются в результате активности РНК-зависимых РНК-полимераз, собирающих вторую цепь на одноцепочечной вирусной РНК и на продуктах транскрипции ДНК транспозонов и трансгенов.
Малые РНК делятся на: малые интерферирующие РНК ( si. RNA ) — small (short) interferiе RNA и микро. РНК ( mi. RNA ). Открытие целого мира малых РНК (s mall RNAs , s. RNAs ), регулирующих экспрессию генов, — конец 1990 -х годов, в 2006 г. авторам этого открытия Andrew Fire ( Фаер ) и К raig Mello ( Мелло ) была присуждена Нобелевская премия. Малые РНК растений Малые интерферирующие РНК растений ( si. RNA ) РНК-интерференция – процесс подавления экспрессии гена на стадии транскрипции, трансляции, дезаденилирования или деградации м. РНК при помощи малых молекул РНК. Малые интерферирующие РНК способны осуществлять направленную деградацию или блокировать трансляцию РНК определенной последовательности и участвовать, таким образом, в защите клетки от вирусов , репрессии трансгенов и подавлении экспрессии мобильных генетических элементов. Непосредственными предшественниками si. RNAs (в отличие от m i. РНК ) являются двухцепочечные молекулы РНК, которые образуются в результате активности РНК-зависимых РНК-полимераз, собирающих вторую цепь на одноцепочечной вирусной РНК и на продуктах транскрипции ДНК транспозонов и трансгенов.
 si. RNA из транспозонов или трансгенных промоторов – контролируют сайленсинг транспозонов или трансгенов путем модификации хроматина. si. RNA растений и низших животных организмов является важным звеном внутриклеточного иммунитета , позволяющего распознавать и быстро расщепить чужую РНК. Если в клетку проникает РНК–содержащий вирус, такая система защиты осуществляет направленную деградацию вирусной РНК. Если же вирус содержит ДНК, система si. RNA будет мешать ему производить вирусные белки (так как необходимая для этого м. РНК будет распознаваться и разрезаться ).
si. RNA из транспозонов или трансгенных промоторов – контролируют сайленсинг транспозонов или трансгенов путем модификации хроматина. si. RNA растений и низших животных организмов является важным звеном внутриклеточного иммунитета , позволяющего распознавать и быстро расщепить чужую РНК. Если в клетку проникает РНК–содержащий вирус, такая система защиты осуществляет направленную деградацию вирусной РНК. Если же вирус содержит ДНК, система si. RNA будет мешать ему производить вирусные белки (так как необходимая для этого м. РНК будет распознаваться и разрезаться ).
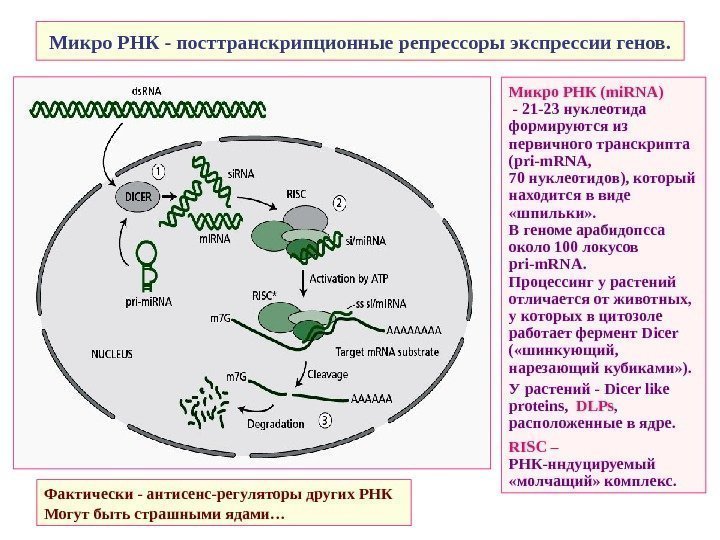
 Микро РНК — посттранскрипционные репрессоры экспрессии генов. Микро РНК ( mi. RNA ) — 21 -23 нуклеотида формируются из первичного транскрипта ( pri-m. RNA, 70 нуклеотидов ) , который находится в виде «шпильки» . В геноме арабидопсса около 100 локусов pri-m. RNA. Процессинг у растений отличается от животных, у которых в цитозоле работает фермент Dicer ( «шинкующий, нарезающий кубиками» ). У растений — Dicer like proteins, DLPs , расположенные в ядре. RISC – РНК-нндуцируемый «молчащий» комплекс. Фактически — антисенс-регуляторы других РНК Могут быть страшными ядами…
Микро РНК — посттранскрипционные репрессоры экспрессии генов. Микро РНК ( mi. RNA ) — 21 -23 нуклеотида формируются из первичного транскрипта ( pri-m. RNA, 70 нуклеотидов ) , который находится в виде «шпильки» . В геноме арабидопсса около 100 локусов pri-m. RNA. Процессинг у растений отличается от животных, у которых в цитозоле работает фермент Dicer ( «шинкующий, нарезающий кубиками» ). У растений — Dicer like proteins, DLPs , расположенные в ядре. RISC – РНК-нндуцируемый «молчащий» комплекс. Фактически — антисенс-регуляторы других РНК Могут быть страшными ядами…
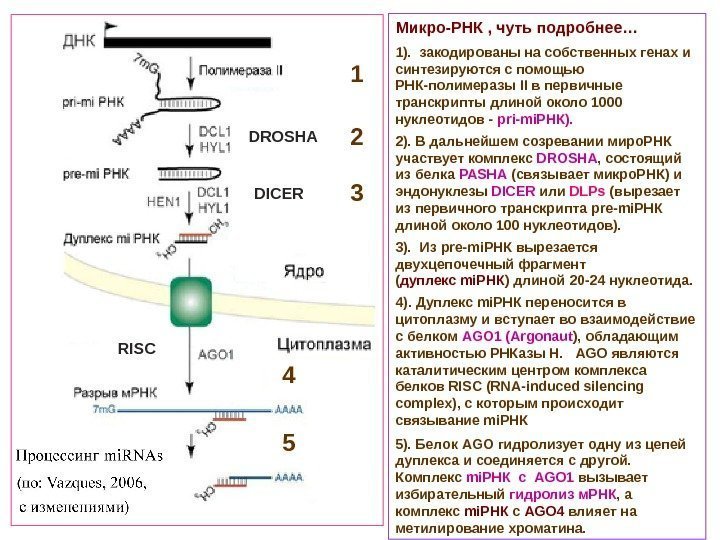
 Микро-РНК , чуть подробнее… 1). закодированы на собственных генах и синтезируются с помощью РНК-полимеразы II в первичные транскрипты длиной около 1000 нуклеотидов — pri-mi. РНК). 2). В дальнейшем созревании миро. РНК участвует комплекс DROSHA , состоящий из белка PASHA (связывает микро. РНК) и эндонуклезы DICER или DLPs (вырезает из первичного транскрипта pre-mi РНК длиной около 100 нуклеотидов). 3). Из pre-mi РНК вырезается двухцепочечный фрагмент ( дуплекс mi РНК ) длиной 20 -24 нуклеотида. 4). Дуплекс mi РНК переносится в цитоплазму и вступает во взаимодействие с белком AGO 1 (Argonaut ) , обладающим активностью РНКазы Н. AGO являются каталитическим центром комплекса белков RISC (RNA-induced silencing complex), с которым происходит связывание mi. РНК 5). Белок AGO гидролизует одну из цепей дуплекса и соединяется с другой. Комплекс mi РНК с AGO 1 вызывает избирательный гидролиз м. РНК , а комплекс mi РНК с AGO 4 влияет на метилирование хроматина. 1 2 3 4 5 DROSHA DICER RIS
Микро-РНК , чуть подробнее… 1). закодированы на собственных генах и синтезируются с помощью РНК-полимеразы II в первичные транскрипты длиной около 1000 нуклеотидов — pri-mi. РНК). 2). В дальнейшем созревании миро. РНК участвует комплекс DROSHA , состоящий из белка PASHA (связывает микро. РНК) и эндонуклезы DICER или DLPs (вырезает из первичного транскрипта pre-mi РНК длиной около 100 нуклеотидов). 3). Из pre-mi РНК вырезается двухцепочечный фрагмент ( дуплекс mi РНК ) длиной 20 -24 нуклеотида. 4). Дуплекс mi РНК переносится в цитоплазму и вступает во взаимодействие с белком AGO 1 (Argonaut ) , обладающим активностью РНКазы Н. AGO являются каталитическим центром комплекса белков RISC (RNA-induced silencing complex), с которым происходит связывание mi. РНК 5). Белок AGO гидролизует одну из цепей дуплекса и соединяется с другой. Комплекс mi РНК с AGO 1 вызывает избирательный гидролиз м. РНК , а комплекс mi РНК с AGO 4 влияет на метилирование хроматина. 1 2 3 4 5 DROSHA DICER RIS
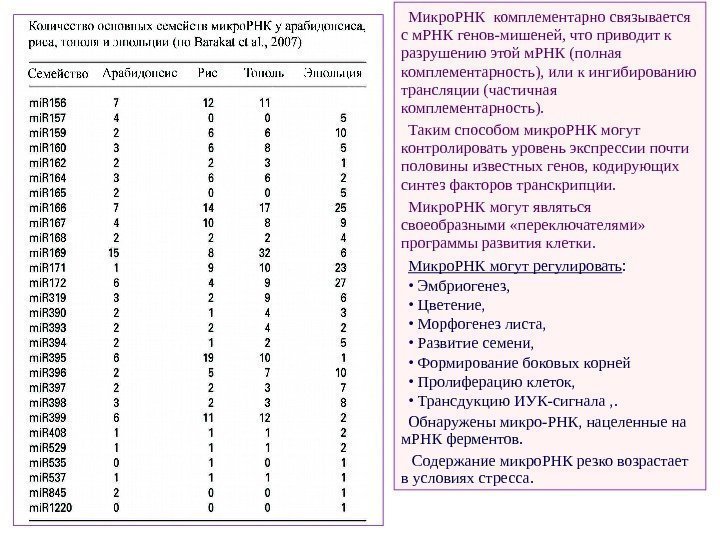
 Микро. РНК комплементарно связывается с м. РНК генов-мишеней, что приводит к разрушению этой м. РНК (полная комплементарность), или к ингибированию трансляции (частичная комплементарность). Таким способом микро. РНК могут контролировать уровень экспрессии почти половины известных генов, кодирующих синтез факторов транскрипции. Микро. РНК могут являться своеобразными «переключателями» программы развития клетки. Микро. РНК могут регулировать : • Эмбриогенез, • Цветение, • Морфогенез листа, • Развитие семени, • Формирование боковых корней • Пролиферацию клеток, • Трансдукцию ИУК-сигнала , . Обнаружены микро-РНК, нацеленные на м. РНК ферментов. Содержание микро. РНК резко возрастает в условиях стресса.
Микро. РНК комплементарно связывается с м. РНК генов-мишеней, что приводит к разрушению этой м. РНК (полная комплементарность), или к ингибированию трансляции (частичная комплементарность). Таким способом микро. РНК могут контролировать уровень экспрессии почти половины известных генов, кодирующих синтез факторов транскрипции. Микро. РНК могут являться своеобразными «переключателями» программы развития клетки. Микро. РНК могут регулировать : • Эмбриогенез, • Цветение, • Морфогенез листа, • Развитие семени, • Формирование боковых корней • Пролиферацию клеток, • Трансдукцию ИУК-сигнала , . Обнаружены микро-РНК, нацеленные на м. РНК ферментов. Содержание микро. РНК резко возрастает в условиях стресса.
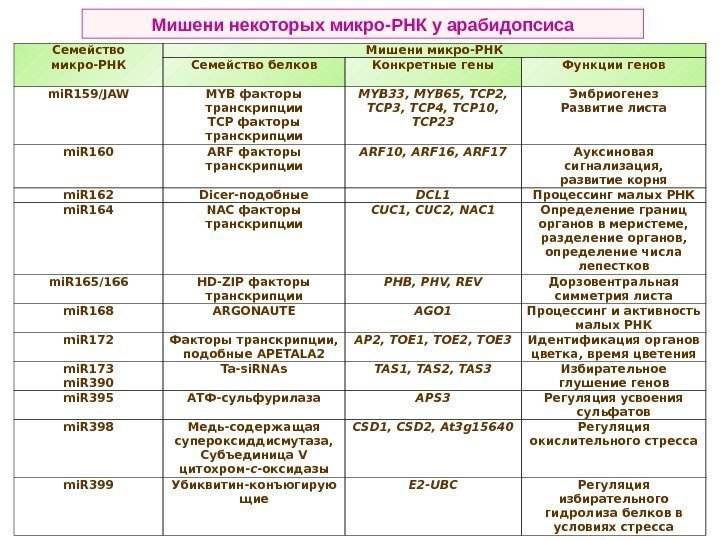
 Семейство микро-РНК Мишени микро-РНК Семейство белков Конкретные гены Функции генов mi. R 159/JAW MYB факторы транскрипции TCP факторы транскрипции MYB 33, MYB 65, TCP 2, TCP 3, TCP 4, TCP 10, TCP 23 Эмбриогенез Развитие листа mi. R 160 ARF факторы транскрипции ARF 10, ARF 16, ARF 17 Ауксиновая сигнализация, развитие корня mi. R 162 Dicer -подобные DCL 1 Процессинг малых РНК mi. R 164 NAC факторы транскрипции CUC 1, CUC 2, NAC 1 Определение границ органов в меристеме, разделение органов, определение числа лепестков mi. R 165/166 HD-ZIP факторы тран скрипции PHB, PHV, REV Дорзовентральная симметрия листа mi. R 168 ARGONAUTE AGO 1 Процессинг и активность малых РНК mi. R 172 Факторы транскрипции, подобные APETALA 2 AP 2, TOE 1, TOE 2, TOE 3 Идентификация органов цветка, время цветения mi. R 173 mi. R 390 Ta-si. RNAs TAS 1, TAS 2, TAS 3 Избирательное глушение генов mi. R 395 АТФ-сульфурилаза APS 3 Регуляция усвоения сульфатов mi. R 398 Медь-содержащая супероксиддисмутаза, Субъединица V цитохром- с -оксидазы CSD 1, CSD 2, At 3 g 15640 Регуляция окислительного стресса mi. R 399 Убиквитин-конъюгирую щие E 2 -UBC Регуляция избирательного гидролиза белков в условиях стресса. Мишени некоторых микро-РНК у арабидопсиса
Семейство микро-РНК Мишени микро-РНК Семейство белков Конкретные гены Функции генов mi. R 159/JAW MYB факторы транскрипции TCP факторы транскрипции MYB 33, MYB 65, TCP 2, TCP 3, TCP 4, TCP 10, TCP 23 Эмбриогенез Развитие листа mi. R 160 ARF факторы транскрипции ARF 10, ARF 16, ARF 17 Ауксиновая сигнализация, развитие корня mi. R 162 Dicer -подобные DCL 1 Процессинг малых РНК mi. R 164 NAC факторы транскрипции CUC 1, CUC 2, NAC 1 Определение границ органов в меристеме, разделение органов, определение числа лепестков mi. R 165/166 HD-ZIP факторы тран скрипции PHB, PHV, REV Дорзовентральная симметрия листа mi. R 168 ARGONAUTE AGO 1 Процессинг и активность малых РНК mi. R 172 Факторы транскрипции, подобные APETALA 2 AP 2, TOE 1, TOE 2, TOE 3 Идентификация органов цветка, время цветения mi. R 173 mi. R 390 Ta-si. RNAs TAS 1, TAS 2, TAS 3 Избирательное глушение генов mi. R 395 АТФ-сульфурилаза APS 3 Регуляция усвоения сульфатов mi. R 398 Медь-содержащая супероксиддисмутаза, Субъединица V цитохром- с -оксидазы CSD 1, CSD 2, At 3 g 15640 Регуляция окислительного стресса mi. R 399 Убиквитин-конъюгирую щие E 2 -UBC Регуляция избирательного гидролиза белков в условиях стресса. Мишени некоторых микро-РНК у арабидопсиса
 Рецепторы ауксинов – экстра- или внутриклеточные? 1. ABP 1 ? Белок семейства GPCR (G-Proteins Coupled Receptors) Около 22 к Da. У кукурузы – 5 генов. На N- конце — сигнал для транспорта в ЭР (38 а-к), на С-конце – К DEL , на N — конце – сайт связывания с ИУК: His-Arg-His-Ser-Cys-Glu. Сайт гликозилирования ( Asp 33 -Thr), До 90% белка — в ЭР. 2. Транспортеры ИУК? Транспортеры ИУК в клетку (4 гена — AUX 1 и др. ) из клетки (8 генов – PIN 1, PIN 2 и др). 3. ABP 60 k. Da ? Гликозидаза цитокининовых конъюгатов. Взаимодействие фитогормонов? 4. ABP 24 -25 k. Da ? Глютатион-5 -трансфераза (GST). GST контролирует уровень глютатиона, влияет на уровень жасмонатов, перекиси водорода. Множественность рецепторов? ИУК – особый гормон: специфичный полярный транспорт (от клетки к клетке), эндогенный ритм образования и транспорта.
Рецепторы ауксинов – экстра- или внутриклеточные? 1. ABP 1 ? Белок семейства GPCR (G-Proteins Coupled Receptors) Около 22 к Da. У кукурузы – 5 генов. На N- конце — сигнал для транспорта в ЭР (38 а-к), на С-конце – К DEL , на N — конце – сайт связывания с ИУК: His-Arg-His-Ser-Cys-Glu. Сайт гликозилирования ( Asp 33 -Thr), До 90% белка — в ЭР. 2. Транспортеры ИУК? Транспортеры ИУК в клетку (4 гена — AUX 1 и др. ) из клетки (8 генов – PIN 1, PIN 2 и др). 3. ABP 60 k. Da ? Гликозидаза цитокининовых конъюгатов. Взаимодействие фитогормонов? 4. ABP 24 -25 k. Da ? Глютатион-5 -трансфераза (GST). GST контролирует уровень глютатиона, влияет на уровень жасмонатов, перекиси водорода. Множественность рецепторов? ИУК – особый гормон: специфичный полярный транспорт (от клетки к клетке), эндогенный ритм образования и транспорта.
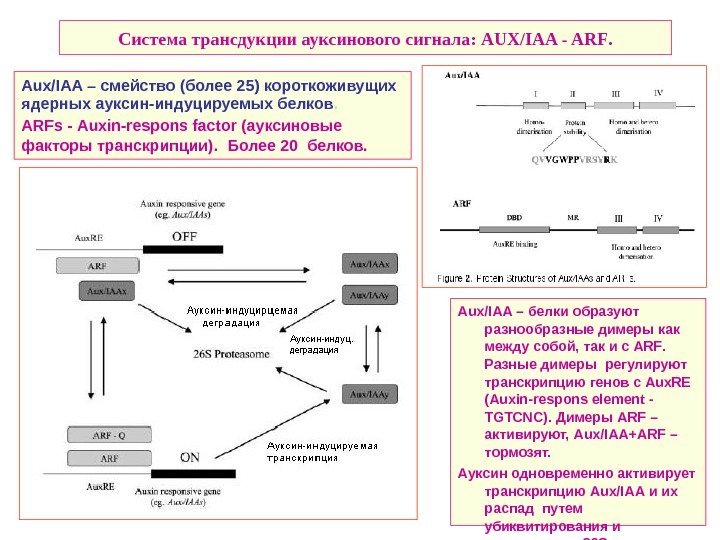
 Система трансдукции ауксинового сигнала: AUX/IAA — ARF. Aux / IAA – белки образуют разнообразные димеры как между собой, так и с ARF. Разные димеры регулируют транскрипцию генов с Aux. RE ( Auxin — respons element — TGTCNC). Димеры ARF – активируют, Aux / IAA + ARF – тормозят. Ауксин одновременно активирует транскрипцию Aux / IAA и их распад путем убиквитирования и деградации в 26 S протеосоме. Aux / IAA – смейство (более 25) короткоживущих ядерных ауксин-индуцируемых белков. ARFs — Auxin — respons factor ( ауксиновые факторы транскрипции). Более 20 белков.
Система трансдукции ауксинового сигнала: AUX/IAA — ARF. Aux / IAA – белки образуют разнообразные димеры как между собой, так и с ARF. Разные димеры регулируют транскрипцию генов с Aux. RE ( Auxin — respons element — TGTCNC). Димеры ARF – активируют, Aux / IAA + ARF – тормозят. Ауксин одновременно активирует транскрипцию Aux / IAA и их распад путем убиквитирования и деградации в 26 S протеосоме. Aux / IAA – смейство (более 25) короткоживущих ядерных ауксин-индуцируемых белков. ARFs — Auxin — respons factor ( ауксиновые факторы транскрипции). Более 20 белков.
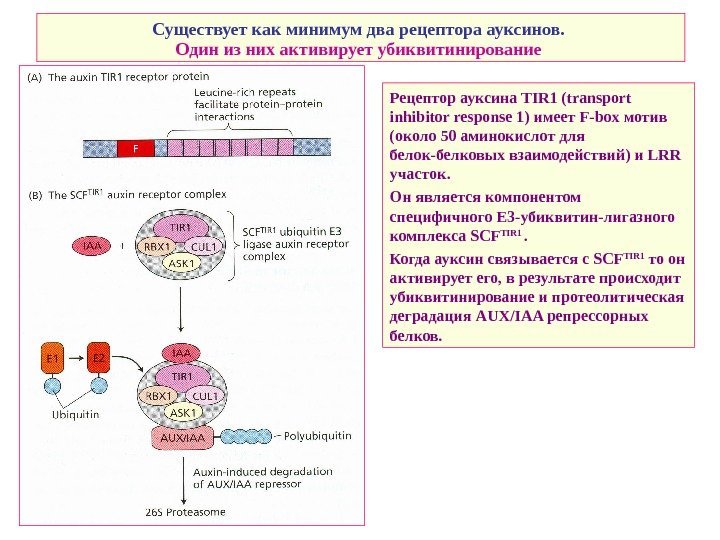
 Существует как минимум два рецептора ауксинов. Один из них активирует убиквитинирование Рецептор ауксина TIR 1 ( transport inhibitor response 1) имеет F-box мотив (около 50 аминокислот для белок-белковых взаимодействий) и LRR участок. Он является компонентом специфичного E 3 — убиквитин-лигазного комплекса SCF TIR 1 . Когда ауксин связывается с SCF TIR 1 то он активирует его, в результате происходит убиквитинирование и протеолитическая деградация AUX/IAA репрессорных белков.
Существует как минимум два рецептора ауксинов. Один из них активирует убиквитинирование Рецептор ауксина TIR 1 ( transport inhibitor response 1) имеет F-box мотив (около 50 аминокислот для белок-белковых взаимодействий) и LRR участок. Он является компонентом специфичного E 3 — убиквитин-лигазного комплекса SCF TIR 1 . Когда ауксин связывается с SCF TIR 1 то он активирует его, в результате происходит убиквитинирование и протеолитическая деградация AUX/IAA репрессорных белков.
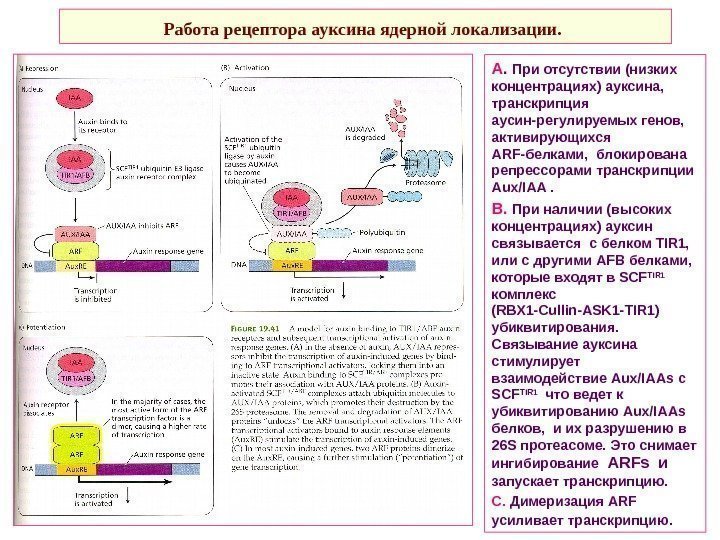
 Работа рецептора ауксина ядерной локализации. А. При отсутствии (низких концентрациях) ауксина, транскрипция аусин-регулируемых генов, активирующихся ARF -белками, блокирована репрессорами транскрипции Aux / IAA . В. При наличии (высоких концентрациях) ауксин связывается с белком TIR 1, или с другими AFB белками, которые входят в SCF TIR 1 комплекс ( RBX 1 — Cullin — ASK 1 — TIR 1) убиквитирования. Связывание ауксина стимулирует взаимодействие Aux / IAAs с SCF TIR 1 что ведет к убиквитированию Aux / IAAs белков, и их разрушению в 26 S протеасоме. Это снимает ингибирование ARFs и запускает транскрипцию. С. Димеризация ARF усиливает транскрипцию.
Работа рецептора ауксина ядерной локализации. А. При отсутствии (низких концентрациях) ауксина, транскрипция аусин-регулируемых генов, активирующихся ARF -белками, блокирована репрессорами транскрипции Aux / IAA . В. При наличии (высоких концентрациях) ауксин связывается с белком TIR 1, или с другими AFB белками, которые входят в SCF TIR 1 комплекс ( RBX 1 — Cullin — ASK 1 — TIR 1) убиквитирования. Связывание ауксина стимулирует взаимодействие Aux / IAAs с SCF TIR 1 что ведет к убиквитированию Aux / IAAs белков, и их разрушению в 26 S протеасоме. Это снимает ингибирование ARFs и запускает транскрипцию. С. Димеризация ARF усиливает транскрипцию.
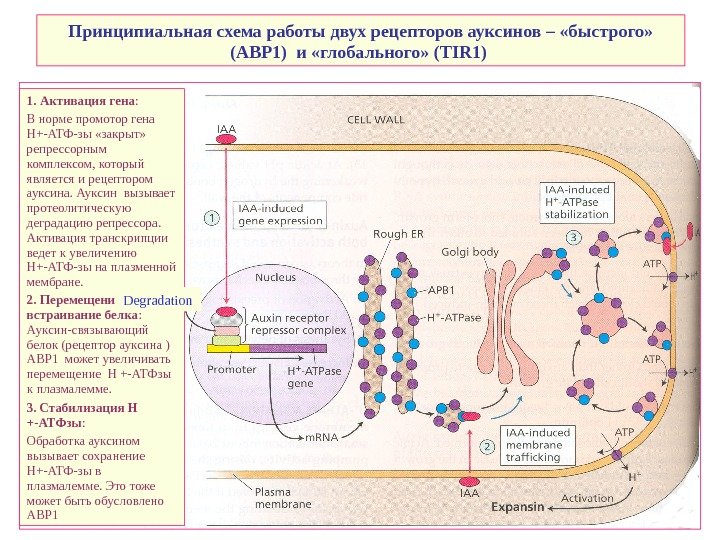
 Принципиальная схема работы двух рецепторов ауксинов – «быстрого» (АВР 1) и «глобального» ( TIR 1) 1. Активация гена : В норме промотор гена Н+-АТФ-зы «закрыт» репрессорным комплексом, который является и рецептором ауксина. Ауксин вызывает протеолитическую деградацию репрессора. Активация транскрипции ведет к увеличению Н+-АТФ-зы на плазменной мембране. 2. Перемещение и встраивание белка : Ауксин-связывающий белок (рецептор ауксина ) ABP 1 может увеличивать перемещение H +-ATФзы к плазмалемме. 3. Стабилизация H +-ATФзы : Обработка ауксином вызывает сохранение Н+-АТФ-зы в плазмалемме. Это тоже может быть обусловлено ABP 1 Degradation
Принципиальная схема работы двух рецепторов ауксинов – «быстрого» (АВР 1) и «глобального» ( TIR 1) 1. Активация гена : В норме промотор гена Н+-АТФ-зы «закрыт» репрессорным комплексом, который является и рецептором ауксина. Ауксин вызывает протеолитическую деградацию репрессора. Активация транскрипции ведет к увеличению Н+-АТФ-зы на плазменной мембране. 2. Перемещение и встраивание белка : Ауксин-связывающий белок (рецептор ауксина ) ABP 1 может увеличивать перемещение H +-ATФзы к плазмалемме. 3. Стабилизация H +-ATФзы : Обработка ауксином вызывает сохранение Н+-АТФ-зы в плазмалемме. Это тоже может быть обусловлено ABP 1 Degradation
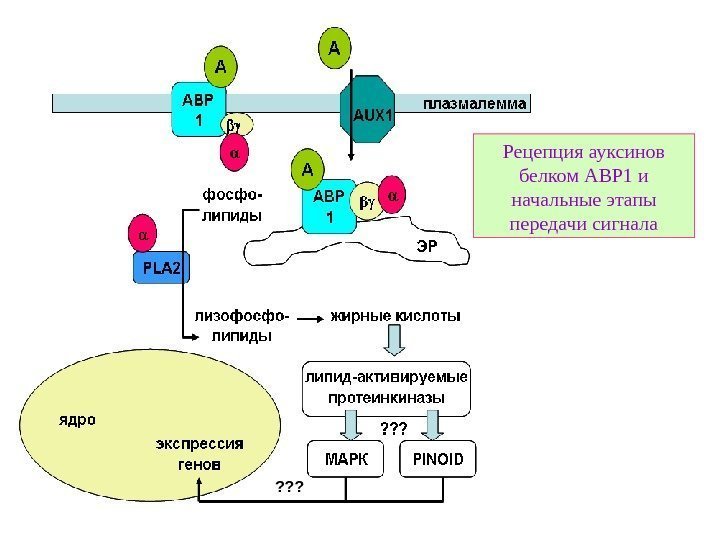
 Рецепция ауксинов белком ABP 1 и начальные этапы передачи сигнала ? ? ?
Рецепция ауксинов белком ABP 1 и начальные этапы передачи сигнала ? ? ?
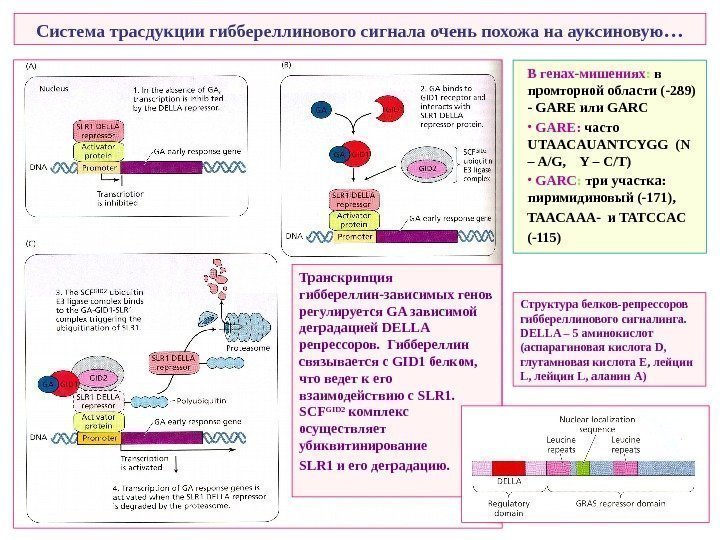
 Система трасдукции гиббереллинового сигнала очень похожа на ауксиновую … В генах-мишениях : в промторной области (-289) — GARE или GARC • GARE: часто UTAACAUANTCYGG ( N – A/G, Y – C/T) • GARC : три участка: пиримидиновый (-171), TAACAAA- и TATCCAC (-115) Транскрипция гиббереллин-зависимых генов регулируется GA зависимой деградацией DELLA репрессоров. Гиббереллин связывается с GID 1 белком, что ведет к его взаимодействию с SLR 1. SCF GID 2 комплекс осуществляет убиквитинирование SLR 1 и его деградацию. Структура белков-репрессоров гиббереллинового сигналинга. DELLA – 5 аминокислот ( аспарагиновая кислота D , глутамновая кислота E , лейцин L , лейцин L , аланин A)
Система трасдукции гиббереллинового сигнала очень похожа на ауксиновую … В генах-мишениях : в промторной области (-289) — GARE или GARC • GARE: часто UTAACAUANTCYGG ( N – A/G, Y – C/T) • GARC : три участка: пиримидиновый (-171), TAACAAA- и TATCCAC (-115) Транскрипция гиббереллин-зависимых генов регулируется GA зависимой деградацией DELLA репрессоров. Гиббереллин связывается с GID 1 белком, что ведет к его взаимодействию с SLR 1. SCF GID 2 комплекс осуществляет убиквитинирование SLR 1 и его деградацию. Структура белков-репрессоров гиббереллинового сигналинга. DELLA – 5 аминокислот ( аспарагиновая кислота D , глутамновая кислота E , лейцин L , лейцин L , аланин A)
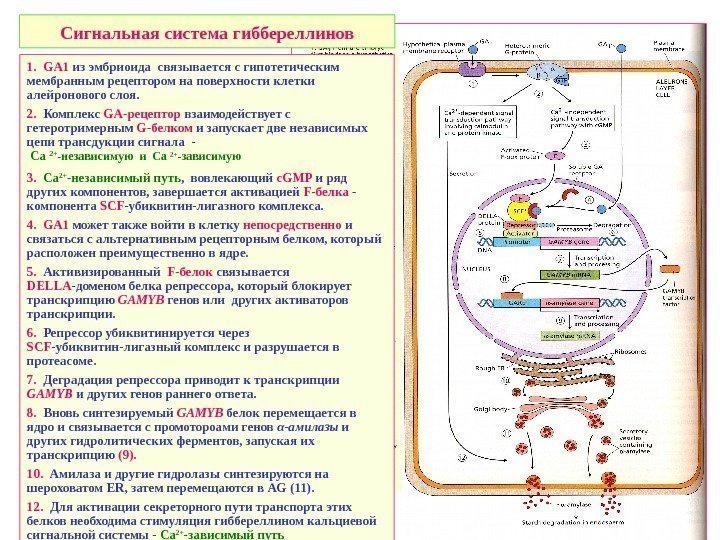
 Сигнальная система гиббереллинов 1. GA 1 из эмбриоида связывается с гипотетическим мембранным рецептором на поверхности клетки алейронового слоя. 2. Комплекс GA-рецептор взаимодействует с гетеротримерным G -белком и запускает две независимых цепи трансдукции сигнала — Са 2+ -независимую и Са 2+ -зависимую 3. Ca 2+ -независимый путь , вовлекающий c. GMP и ряд других компонентов, завершается активацией F-белка — компонента SCF -убиквитин-лигазного комплекса. 4. GA 1 может также войти в клетку непосредственно и связаться с альтернативным рецепторным белком, который расположен преимущественно в ядре. 5. Активизированный F-белок связывается DELLA -доменом белка репрессора, который блокирует транскрипцию GAMYB генов или других активаторов транскрипции. 6. Репрессор убиквитинируется через SCF -убиквитин-лигазный комплекс и разрушается в протеасоме. 7. Деградация репрессора приводит к транскрипции GAMYB и других генов раннего ответа. 8. Вновь синтезируемый GAMYB белок перемещается в ядро и связывается с промотороами генов α-амилазы и других гидролитических ферментов, запуская их транскрипцию (9). 10. Амилаза и другие гидролазы синтезируются на шероховатом ER , затем перемещаются в AG (11). 12. Для активации секреторного пути транспорта этих белков необходима стимуляция гиббереллином кальциевой сигнальной системы — Са 2+ -зависимый путь
Сигнальная система гиббереллинов 1. GA 1 из эмбриоида связывается с гипотетическим мембранным рецептором на поверхности клетки алейронового слоя. 2. Комплекс GA-рецептор взаимодействует с гетеротримерным G -белком и запускает две независимых цепи трансдукции сигнала — Са 2+ -независимую и Са 2+ -зависимую 3. Ca 2+ -независимый путь , вовлекающий c. GMP и ряд других компонентов, завершается активацией F-белка — компонента SCF -убиквитин-лигазного комплекса. 4. GA 1 может также войти в клетку непосредственно и связаться с альтернативным рецепторным белком, который расположен преимущественно в ядре. 5. Активизированный F-белок связывается DELLA -доменом белка репрессора, который блокирует транскрипцию GAMYB генов или других активаторов транскрипции. 6. Репрессор убиквитинируется через SCF -убиквитин-лигазный комплекс и разрушается в протеасоме. 7. Деградация репрессора приводит к транскрипции GAMYB и других генов раннего ответа. 8. Вновь синтезируемый GAMYB белок перемещается в ядро и связывается с промотороами генов α-амилазы и других гидролитических ферментов, запуская их транскрипцию (9). 10. Амилаза и другие гидролазы синтезируются на шероховатом ER , затем перемещаются в AG (11). 12. Для активации секреторного пути транспорта этих белков необходима стимуляция гиббереллином кальциевой сигнальной системы — Са 2+ -зависимый путь
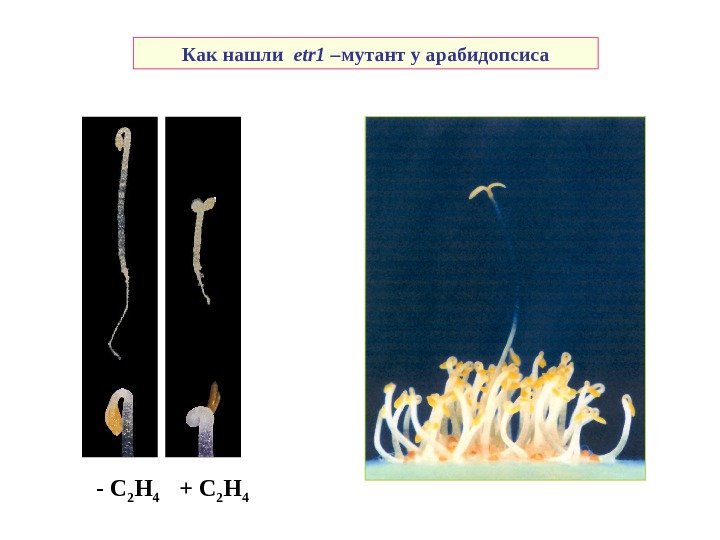
 — C 2 H 4 + C 2 H 4 Как нашли е tr 1 – мутант у арабидопсиса
— C 2 H 4 + C 2 H 4 Как нашли е tr 1 – мутант у арабидопсиса
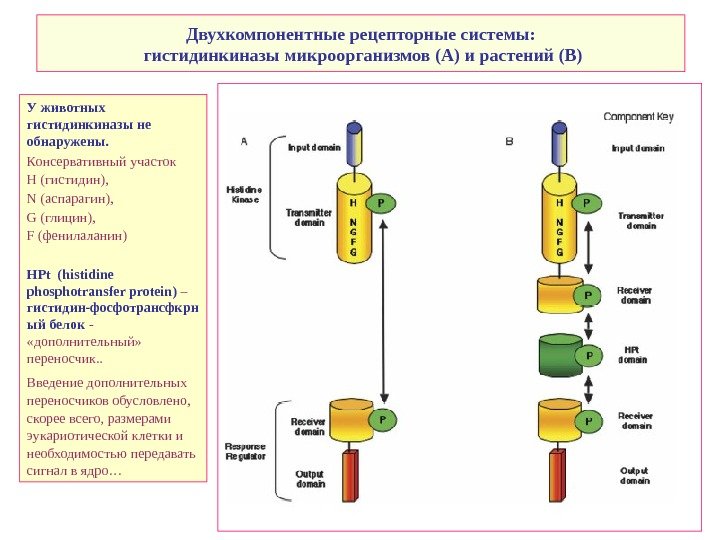
 Двухкомпонентные рецепторные системы: гистидинкиназы микроорганизмов (A) и растений ( B) У животных гистидинкиназы не обнаружены. Консервативный участок H (гистидин), N (аспарагин), G (глицин), F (фенилаланин) HPt (histidine phosphotransfer protein) – гистидин-фосфотрансфкрн ый белок — «дополнительный» переносчик. . Введение дополнительных переносчиков обусловлено, скорее всего, размерами эукариотической клетки и необходимостью передавать сигнал в ядро…
Двухкомпонентные рецепторные системы: гистидинкиназы микроорганизмов (A) и растений ( B) У животных гистидинкиназы не обнаружены. Консервативный участок H (гистидин), N (аспарагин), G (глицин), F (фенилаланин) HPt (histidine phosphotransfer protein) – гистидин-фосфотрансфкрн ый белок — «дополнительный» переносчик. . Введение дополнительных переносчиков обусловлено, скорее всего, размерами эукариотической клетки и необходимостью передавать сигнал в ядро…
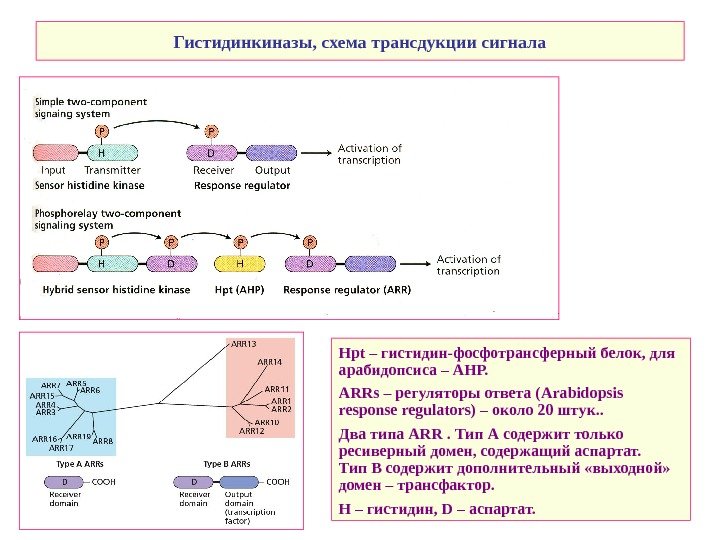
 Гистидинкиназы, схема трансдукции сигнала Н pt – гистидин-фосфотрансферный белок, для арабидопсиса – АНР. ARRs – регуляторы ответа (Arabidopsis response regulators) – около 20 штук. . Два типа ARR . Тип А содержит только ресиверный домен, содержащий аспартат. Тип В содержит дополнительный «выходной» домен – трансфактор. H – гистидин, D – аспартат.
Гистидинкиназы, схема трансдукции сигнала Н pt – гистидин-фосфотрансферный белок, для арабидопсиса – АНР. ARRs – регуляторы ответа (Arabidopsis response regulators) – около 20 штук. . Два типа ARR . Тип А содержит только ресиверный домен, содержащий аспартат. Тип В содержит дополнительный «выходной» домен – трансфактор. H – гистидин, D – аспартат.
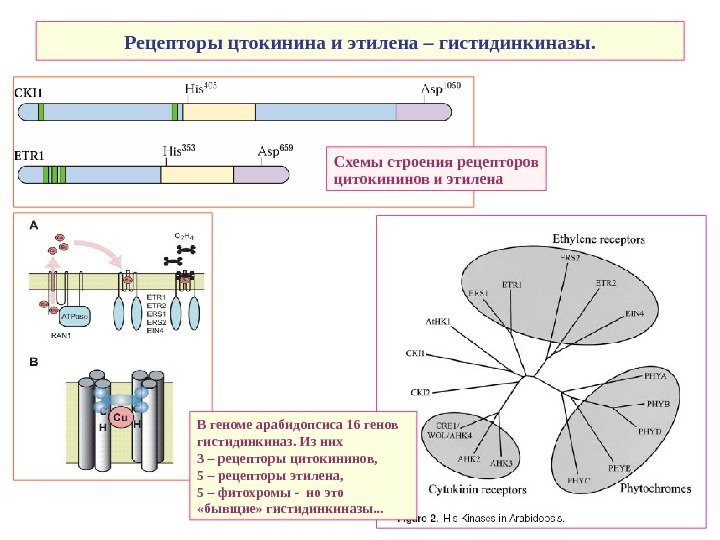
 Рецепторы цтокинина и этилена – гистидинкиназы. В геноме арабидопсиса 16 генов гистидинкиназ. Из них 3 – рецепторы цитокининов, 5 – рецепторы этилена, 5 – фитохромы — но это «бывщие» гистидинкиназы. . . Схемы строения рецепторов цитокининов и этилена
Рецепторы цтокинина и этилена – гистидинкиназы. В геноме арабидопсиса 16 генов гистидинкиназ. Из них 3 – рецепторы цитокининов, 5 – рецепторы этилена, 5 – фитохромы — но это «бывщие» гистидинкиназы. . . Схемы строения рецепторов цитокининов и этилена
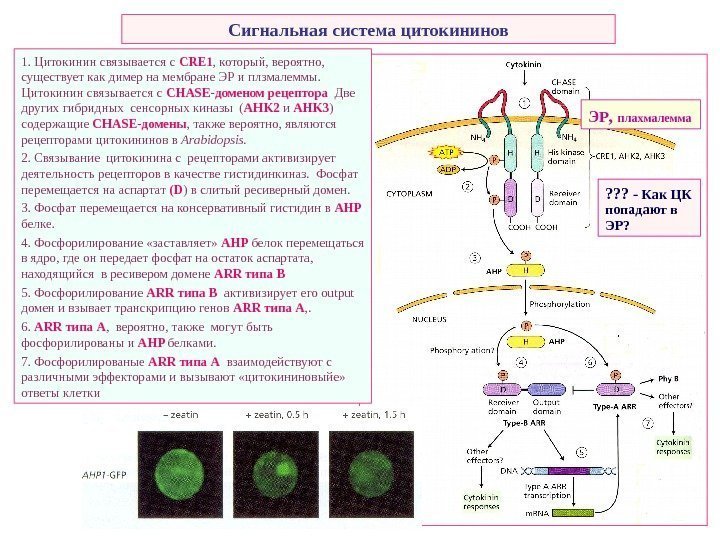
 Сигнальная система цитокининов 1. Цитокинин связывается с CRE 1 , который, вероятно, существует как димер на мембране ЭР и плзмалеммы. Цитокинин связывается с CHASE -доменом рецептора Две других гибридных сенсорных киназы ( AHK 2 и AHK 3 ) содержащие CHASE -домены , также вероятно, являются рецепторами цитокининов в Arabidopsis. 2. Связывание цитокинина с рецепторами активизирует деятельность рецепторов в качестве гистидинкиназ. Фосфат перемещается на аспартат (D ) в слитый ресиверный домен. 3. Фосфат перемещается на консервативный гистидин в AHP белке. 4. Фосфорилирование «заставляет» AHP белок перемещаться в ядро, где он передает фосфат на остаток аспартата, находящийся в ресивером домене ARR типа В 5. Фосфорилирование ARR типа В активизирует его output домен и взывает транскрипцию генов ARR типа А , . 6. ARR типа А , вероятно, также могут быть фосфорилированы и AHP белками. 7. Фосфорилированые ARR типа А взаимодействуют с различными эффекторами и вызывают «цитокининовыйе» ответы клетки ЭР , плахмалемма ? ? ? — Как ЦК попадают в ЭР?
Сигнальная система цитокининов 1. Цитокинин связывается с CRE 1 , который, вероятно, существует как димер на мембране ЭР и плзмалеммы. Цитокинин связывается с CHASE -доменом рецептора Две других гибридных сенсорных киназы ( AHK 2 и AHK 3 ) содержащие CHASE -домены , также вероятно, являются рецепторами цитокининов в Arabidopsis. 2. Связывание цитокинина с рецепторами активизирует деятельность рецепторов в качестве гистидинкиназ. Фосфат перемещается на аспартат (D ) в слитый ресиверный домен. 3. Фосфат перемещается на консервативный гистидин в AHP белке. 4. Фосфорилирование «заставляет» AHP белок перемещаться в ядро, где он передает фосфат на остаток аспартата, находящийся в ресивером домене ARR типа В 5. Фосфорилирование ARR типа В активизирует его output домен и взывает транскрипцию генов ARR типа А , . 6. ARR типа А , вероятно, также могут быть фосфорилированы и AHP белками. 7. Фосфорилированые ARR типа А взаимодействуют с различными эффекторами и вызывают «цитокининовыйе» ответы клетки ЭР , плахмалемма ? ? ? — Как ЦК попадают в ЭР?
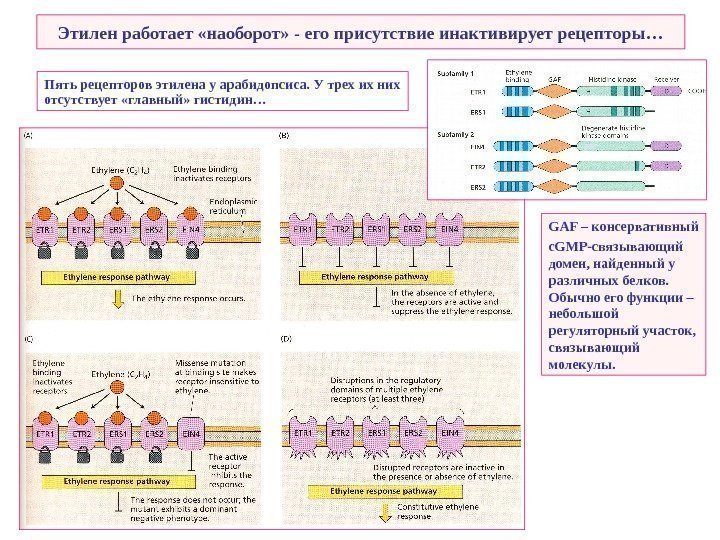
 Этилен работает «наоборот» — его присутствие инактивирует рецепторы… Пять рецепторов этилена у арабидопсиса. У трех их них отсутствует «главный» гистидин… GAF – консервативный c. GMP -связывающий домен, найденный у различных белков. Обычно его функции – небольшой регуляторный участок, связывающий молекулы.
Этилен работает «наоборот» — его присутствие инактивирует рецепторы… Пять рецепторов этилена у арабидопсиса. У трех их них отсутствует «главный» гистидин… GAF – консервативный c. GMP -связывающий домен, найденный у различных белков. Обычно его функции – небольшой регуляторный участок, связывающий молекулы.
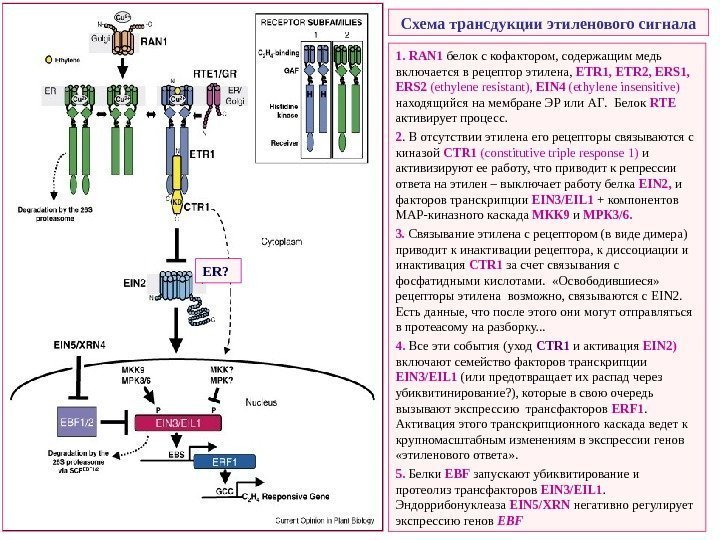
 Схема трансдукции этиленового сигнала ETR CTR 1 EIN 2 EIN 3, EIL 1, 2 Ответ на стресс ERF 1 EBF 1, 2 EIN 5/XRN 4 MAPK Контроль развития. CTR 1 — Ser\Thr протеинкиназа, негативный регулятор этиленового сигналлинга Протеинкиназа, MAPKKK , гомолог Raf протеинкиназ млекопитающих. «Анитпод» обычных MAPKKK – киназы «нижних» уровней она не активирует, а ингибирует и фосфатидные кислоты ее не стимулируют, а выключают. В отсутствии этилена связана с его рецепторами, активна и ответа на этилен нет. При связывании этилена CTR 1 «уходит» из комплекса с рецепторами, связывается с фостфатидными кислотами, деградирует — происходит запуск ответа на этилен EIN 2 — позитивный регулятор этиленового сигналлинга. Похоже, что локализуется также в мембране ЭР. После «ухода» CTR 1 , вероятно связывается с рецепторами этилена. . Как работает – неясно, у арабидопсиса кодируется одним геном. N- концевой трансмембранный домен гомологичен металлотранспортерам Nramp , но ничего не транспортирует. . С-концевой цитоплазматический домен – важен для функции, но неясно как… EIN 3 , EIL 1 и EIL 2 — этилен-зависимые транскрипционные факторы Позитивные регуляторы этиленового сигналинга, локализуются в ядре, короткоживущие белки (время полужизни – 30 мин), ответ на этилен регулируется стабильностью EIN 3 белков, но не уровнем их экспрессии. Индуцируют экспрессию гена ERF 1 (Ethylene Response Factor) EIN 5/XRN 4 – рибонуклеаза, регулирует уровень транскриптов EBF 1/2 — компонентов убиквитин-лигазного комплекса
Схема трансдукции этиленового сигнала ETR CTR 1 EIN 2 EIN 3, EIL 1, 2 Ответ на стресс ERF 1 EBF 1, 2 EIN 5/XRN 4 MAPK Контроль развития. CTR 1 — Ser\Thr протеинкиназа, негативный регулятор этиленового сигналлинга Протеинкиназа, MAPKKK , гомолог Raf протеинкиназ млекопитающих. «Анитпод» обычных MAPKKK – киназы «нижних» уровней она не активирует, а ингибирует и фосфатидные кислоты ее не стимулируют, а выключают. В отсутствии этилена связана с его рецепторами, активна и ответа на этилен нет. При связывании этилена CTR 1 «уходит» из комплекса с рецепторами, связывается с фостфатидными кислотами, деградирует — происходит запуск ответа на этилен EIN 2 — позитивный регулятор этиленового сигналлинга. Похоже, что локализуется также в мембране ЭР. После «ухода» CTR 1 , вероятно связывается с рецепторами этилена. . Как работает – неясно, у арабидопсиса кодируется одним геном. N- концевой трансмембранный домен гомологичен металлотранспортерам Nramp , но ничего не транспортирует. . С-концевой цитоплазматический домен – важен для функции, но неясно как… EIN 3 , EIL 1 и EIL 2 — этилен-зависимые транскрипционные факторы Позитивные регуляторы этиленового сигналинга, локализуются в ядре, короткоживущие белки (время полужизни – 30 мин), ответ на этилен регулируется стабильностью EIN 3 белков, но не уровнем их экспрессии. Индуцируют экспрессию гена ERF 1 (Ethylene Response Factor) EIN 5/XRN 4 – рибонуклеаза, регулирует уровень транскриптов EBF 1/2 — компонентов убиквитин-лигазного комплекса
 Схема трансдукции этиленового сигнала 1. RAN 1 белок с кофактором , содержащим медь включается в рецептор этилена , ETR 1, ETR 2, ERS 1, ERS 2 (ethylene resistant), EIN 4 (ethylene insensitive) находящийся на мембране ЭР или АГ. Белок RTE активирует процесс. 2. В отсутствии этилена его рецепторы связываются с киназой CTR 1 ( constitutive triple response 1) и активизируют ее работу, что приводит к репрессии ответа на этилен – выключает работу белка EIN 2, и факторов транскрипции EIN 3/ EIL 1 + компонентов МАР-киназного каскада МКК 9 и МРК 3/6. 3. Связывание этилена с рецептором (в виде димера) приводит к инактивации рецептора, к диссоциации и инактивация CTR 1 за счет связывания с фосфатидными кислотами. «Освободившиеся» рецепторы этилена возможно, связываются с EIN 2. Есть данные, что после этого они могут отправляться в протеасому на разборку. . . 4. Все эти события (уход CTR 1 и активация EIN 2) включают семейство факторов транскрипции EIN 3/ EIL 1 (или предотвращает их распад через убиквитинирование? ), которые в свою очередь вызывают экспрессию трансфакторов ERF 1. Активация этого транскрипционного каскада ведет к крупномасштабным изменениям в экспрессии генов «этиленового ответа» . 5. Белки EBF запускают убиквитирование и протеолиз трансфакторов EIN 3/ EIL 1. Эндоррибонуклеаза EIN 5/ XRN негативно регулирует экспрессию генов EBFER ?
Схема трансдукции этиленового сигнала 1. RAN 1 белок с кофактором , содержащим медь включается в рецептор этилена , ETR 1, ETR 2, ERS 1, ERS 2 (ethylene resistant), EIN 4 (ethylene insensitive) находящийся на мембране ЭР или АГ. Белок RTE активирует процесс. 2. В отсутствии этилена его рецепторы связываются с киназой CTR 1 ( constitutive triple response 1) и активизируют ее работу, что приводит к репрессии ответа на этилен – выключает работу белка EIN 2, и факторов транскрипции EIN 3/ EIL 1 + компонентов МАР-киназного каскада МКК 9 и МРК 3/6. 3. Связывание этилена с рецептором (в виде димера) приводит к инактивации рецептора, к диссоциации и инактивация CTR 1 за счет связывания с фосфатидными кислотами. «Освободившиеся» рецепторы этилена возможно, связываются с EIN 2. Есть данные, что после этого они могут отправляться в протеасому на разборку. . . 4. Все эти события (уход CTR 1 и активация EIN 2) включают семейство факторов транскрипции EIN 3/ EIL 1 (или предотвращает их распад через убиквитинирование? ), которые в свою очередь вызывают экспрессию трансфакторов ERF 1. Активация этого транскрипционного каскада ведет к крупномасштабным изменениям в экспрессии генов «этиленового ответа» . 5. Белки EBF запускают убиквитирование и протеолиз трансфакторов EIN 3/ EIL 1. Эндоррибонуклеаза EIN 5/ XRN негативно регулирует экспрессию генов EBFER ?
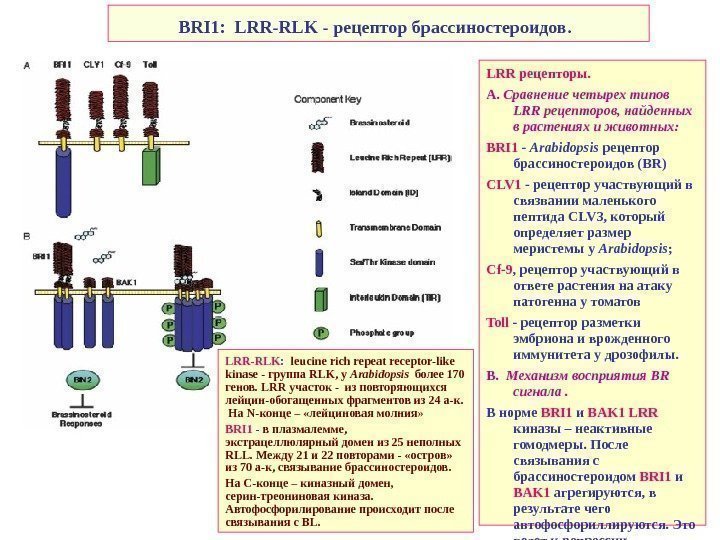
 BRI 1: LRR-RLK — рецептор брассиностероидов. LRR рецепторы. А. Сравнение четырех типов LRR рецепторов, найденных в растениях и животных: BRI 1 — Arabidopsis рецептор брассиностероидов ( BR ) CLV 1 — рецептор участвующий в связвании маленького пептида CLV 3, который определяет размер меристемы у Arabidopsis ; Cf -9 , рецептор участвующий в ответе растения на атаку патогенна у томатов Toll — рецептор разметки эмбриона и врожденного иммунитета у дрозофилы. B. Механизм восприятия BR сигнала. В норме BRI 1 и BAK 1 LRR киназы – неактивные гомодмеры. После связывания с брассиностероидом BRI 1 и BAK 1 агрегируются, в результате чего автофосфориллируются. Это ведет к репрессии ингибитора BIN 2, и индукции BR -ответа. LRR-RLK : leucine rich repeat receptor-like kinase — группа RLK , у Arabidopsis более 170 генов. LRR участок — из повторяющихся лейцин-обогащенных фрагментов из 24 а-к. На N- конце – «лейциновая молния » BRI 1 — в плазмалемме, экстрацеллюлярный домен из 25 неполных RLL. Между 21 и 22 повторами — «остров» из 70 а-к, связывание брассиностероидов. На С-конце – киназный домен, серин-треониновая киназа. Автофосфорилирование происходит после связывания с BL.
BRI 1: LRR-RLK — рецептор брассиностероидов. LRR рецепторы. А. Сравнение четырех типов LRR рецепторов, найденных в растениях и животных: BRI 1 — Arabidopsis рецептор брассиностероидов ( BR ) CLV 1 — рецептор участвующий в связвании маленького пептида CLV 3, который определяет размер меристемы у Arabidopsis ; Cf -9 , рецептор участвующий в ответе растения на атаку патогенна у томатов Toll — рецептор разметки эмбриона и врожденного иммунитета у дрозофилы. B. Механизм восприятия BR сигнала. В норме BRI 1 и BAK 1 LRR киназы – неактивные гомодмеры. После связывания с брассиностероидом BRI 1 и BAK 1 агрегируются, в результате чего автофосфориллируются. Это ведет к репрессии ингибитора BIN 2, и индукции BR -ответа. LRR-RLK : leucine rich repeat receptor-like kinase — группа RLK , у Arabidopsis более 170 генов. LRR участок — из повторяющихся лейцин-обогащенных фрагментов из 24 а-к. На N- конце – «лейциновая молния » BRI 1 — в плазмалемме, экстрацеллюлярный домен из 25 неполных RLL. Между 21 и 22 повторами — «остров» из 70 а-к, связывание брассиностероидов. На С-конце – киназный домен, серин-треониновая киназа. Автофосфорилирование происходит после связывания с BL.
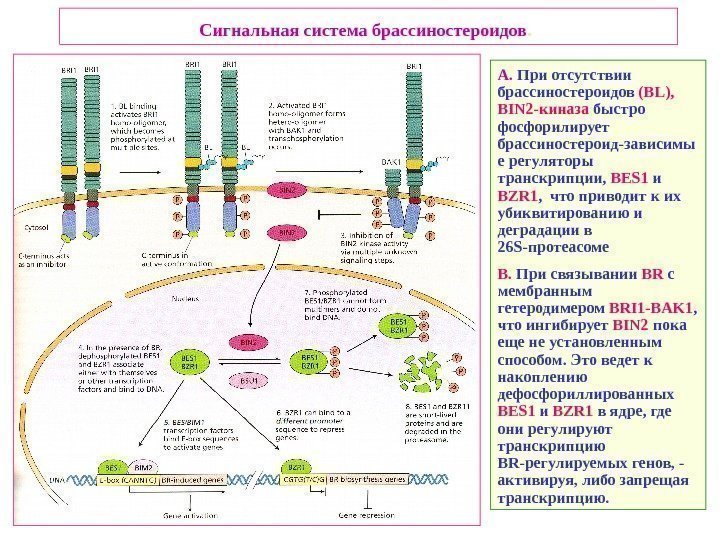
 Сигнальная система брассиностероидов. A. При отсутствии брассиностероидов ( BL ), BIN 2 -киназа быстро фосфорилирует брассиностероид-зависимы е регуляторы транскрипции, BES 1 и BZR 1 , что приводит к их убиквитированию и деградации в 26 S -протеасоме B. При связывании BR c мембранным гетеродимером BRI 1 — BAK 1 , что ингибирует BIN 2 пока еще не установленным способом. Это ведет к накоплению дефосфориллированных BES 1 и BZR 1 в ядре, где они регулируют транскрипцию BR -регулируемых генов, — активируя, либо запрещая транскрипцию.
Сигнальная система брассиностероидов. A. При отсутствии брассиностероидов ( BL ), BIN 2 -киназа быстро фосфорилирует брассиностероид-зависимы е регуляторы транскрипции, BES 1 и BZR 1 , что приводит к их убиквитированию и деградации в 26 S -протеасоме B. При связывании BR c мембранным гетеродимером BRI 1 — BAK 1 , что ингибирует BIN 2 пока еще не установленным способом. Это ведет к накоплению дефосфориллированных BES 1 и BZR 1 в ядре, где они регулируют транскрипцию BR -регулируемых генов, — активируя, либо запрещая транскрипцию.
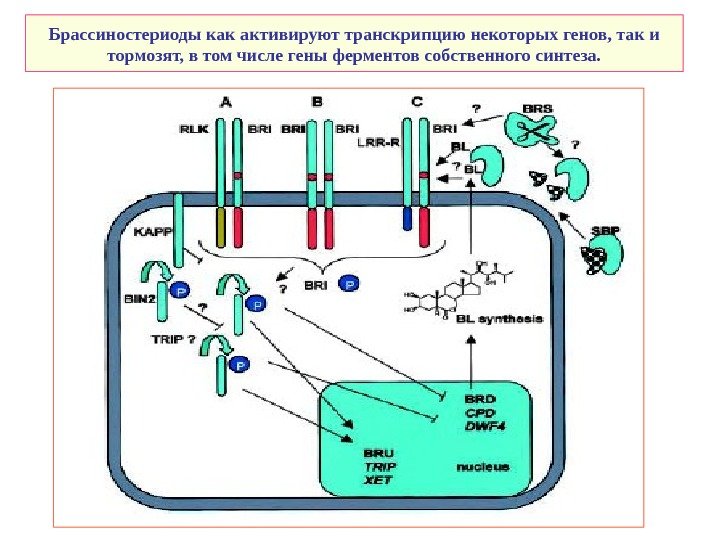
 Брассиностериоды как активируют транскрипцию некоторых генов, так и тормозят, в том числе гены ферментов собственного синтеза.
Брассиностериоды как активируют транскрипцию некоторых генов, так и тормозят, в том числе гены ферментов собственного синтеза.
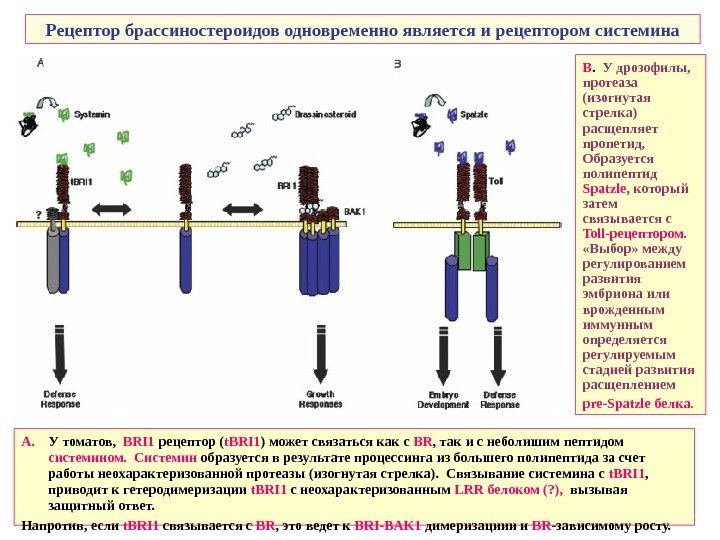
 Рецептор брассиностероидов одновременно является и рецептором системина А. У томатов, BRI 1 рецептор ( t. BRI 1 ) может связаться как с BR , так и с неболишим пептидом системином. Системин образуется в результате процессинга из большего полипептида за счет работы неохарактеризованной протеазы (изогнутая стрелка). Связывание системина c t. BRI 1 , приводит к гетеродимеризации t. BRI 1 с неохарактеризованным LRR белоком (? ), вызывая защитный ответ. Напротив, если t. BRI 1 связывается с BR , это ведет к BRI — BAK 1 димеризациии и BR -зависимому росту. В. У дрозофилы, протеаза (изогнутая стрелка) расщепляет пропетид, Образуется полипептид Spatzle , который затем связывается с Toll -рецептором. «Выбор» между регулированием развития эмбриона или врожденным иммунным определяется регулируемым стадией развития расщеплением pre — Spatzle белка.
Рецептор брассиностероидов одновременно является и рецептором системина А. У томатов, BRI 1 рецептор ( t. BRI 1 ) может связаться как с BR , так и с неболишим пептидом системином. Системин образуется в результате процессинга из большего полипептида за счет работы неохарактеризованной протеазы (изогнутая стрелка). Связывание системина c t. BRI 1 , приводит к гетеродимеризации t. BRI 1 с неохарактеризованным LRR белоком (? ), вызывая защитный ответ. Напротив, если t. BRI 1 связывается с BR , это ведет к BRI — BAK 1 димеризациии и BR -зависимому росту. В. У дрозофилы, протеаза (изогнутая стрелка) расщепляет пропетид, Образуется полипептид Spatzle , который затем связывается с Toll -рецептором. «Выбор» между регулированием развития эмбриона или врожденным иммунным определяется регулируемым стадией развития расщеплением pre — Spatzle белка.
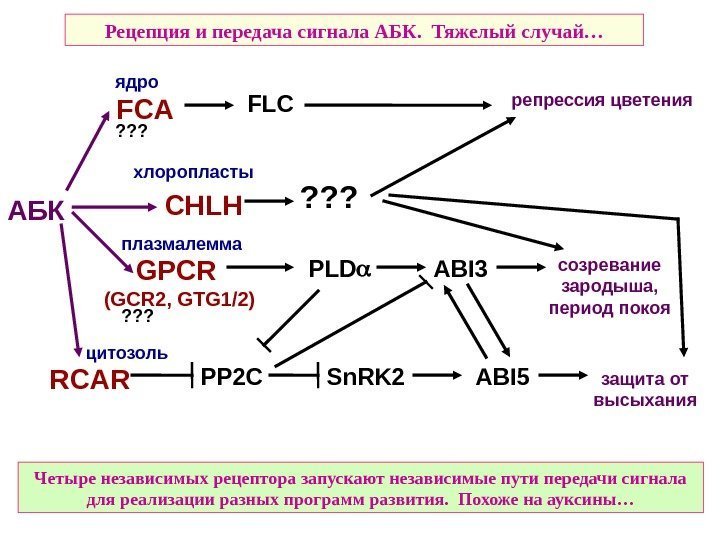
 Рецепция и передача сигнала АБК. Тяжелый случай… защита от высыхания Четыре независимых рецептора запускают независимые пути передачи сигнала для реализации разных программ развития. Похоже на ауксины…АБК FCA FLC CHLH GPCR (GCR 2, GTG 1/2) PLD ABI 3 RCAR PP 2 C Sn. RK 2 ABI 5 репрессия цветения созревание зародыша, период покоя? ? ? ядро хлоропласты плазмалемма цитозоль ? ? ?
Рецепция и передача сигнала АБК. Тяжелый случай… защита от высыхания Четыре независимых рецептора запускают независимые пути передачи сигнала для реализации разных программ развития. Похоже на ауксины…АБК FCA FLC CHLH GPCR (GCR 2, GTG 1/2) PLD ABI 3 RCAR PP 2 C Sn. RK 2 ABI 5 репрессия цветения созревание зародыша, период покоя? ? ? ядро хлоропласты плазмалемма цитозоль ? ? ?
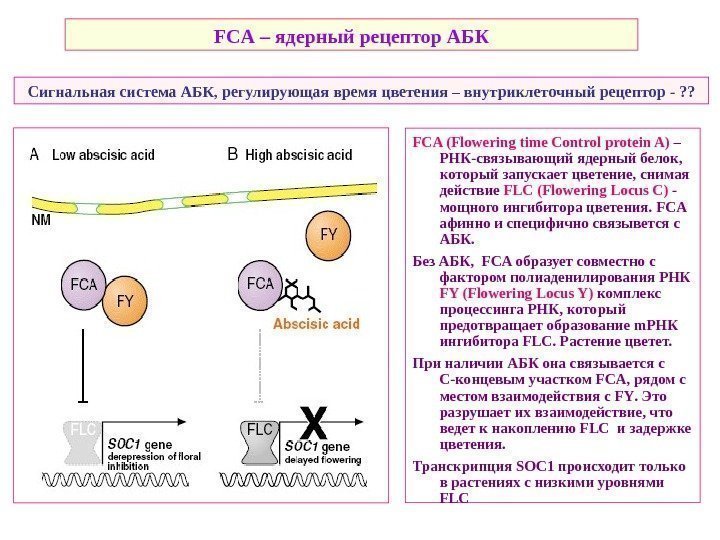
 FCA (Flowering time Control protein A) – РНК-связывающий ядерный белок, который запускает цветение, снимая действие FLC (Flowering Locus C) — мощного ингибитора цветения. FCA афинно и специфично связывется с АБК. Без АБК, FCA образует совместно с фактором полиаденилирования РНК FY ( Flowering Locus Y) комплекс процессинга РНК, который предотвращает образование m РНК ингибитора FLC. Растение цветет. При наличии АБК она связывается c С-концевым участком FCA , рядом с местом взаимодействия с FY. Это разрушает их взаимодействие, что ведет к накоплению FLC и задержке цветения. Транскрипция SOC 1 происходит только в растениях с низкими уровнями FLC Сигнальная система АБК, регулирующая время цветения – внутриклеточный рецептор — ? ? FCA – ядерный рецептор АБК
FCA (Flowering time Control protein A) – РНК-связывающий ядерный белок, который запускает цветение, снимая действие FLC (Flowering Locus C) — мощного ингибитора цветения. FCA афинно и специфично связывется с АБК. Без АБК, FCA образует совместно с фактором полиаденилирования РНК FY ( Flowering Locus Y) комплекс процессинга РНК, который предотвращает образование m РНК ингибитора FLC. Растение цветет. При наличии АБК она связывается c С-концевым участком FCA , рядом с местом взаимодействия с FY. Это разрушает их взаимодействие, что ведет к накоплению FLC и задержке цветения. Транскрипция SOC 1 происходит только в растениях с низкими уровнями FLC Сигнальная система АБК, регулирующая время цветения – внутриклеточный рецептор — ? ? FCA – ядерный рецептор АБК
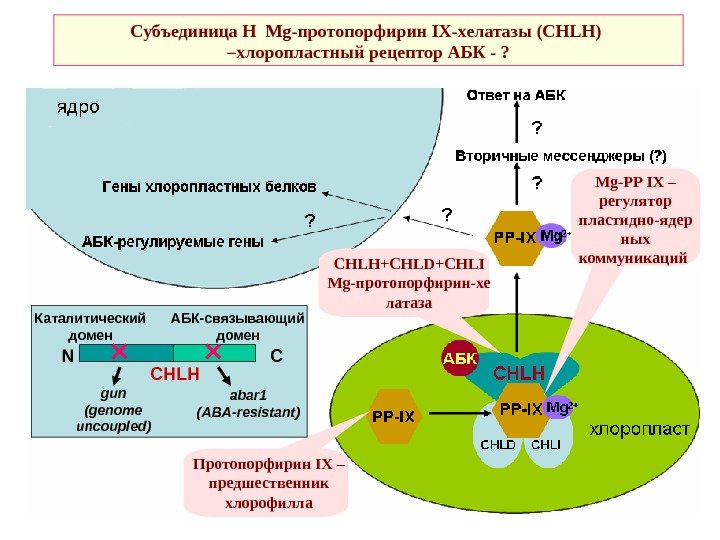
 Субъединица Н Mg -протопорфирин IX -хелатазы ( CHLH ) –хлоропластный рецептор АБК — ? Протопорфирин IX – предшественник хлорофилла Mg-PP IX – регулятор пластидно-ядер ных коммуникаций CHLH+CHLD+CHLI Mg- протопорфирин-хе латаза N C CHLHКаталитический домен АБК-связывающий домен gun (genome uncoupled) abar 1 (ABA-resistant)
Субъединица Н Mg -протопорфирин IX -хелатазы ( CHLH ) –хлоропластный рецептор АБК — ? Протопорфирин IX – предшественник хлорофилла Mg-PP IX – регулятор пластидно-ядер ных коммуникаций CHLH+CHLD+CHLI Mg- протопорфирин-хе латаза N C CHLHКаталитический домен АБК-связывающий домен gun (genome uncoupled) abar 1 (ABA-resistant)
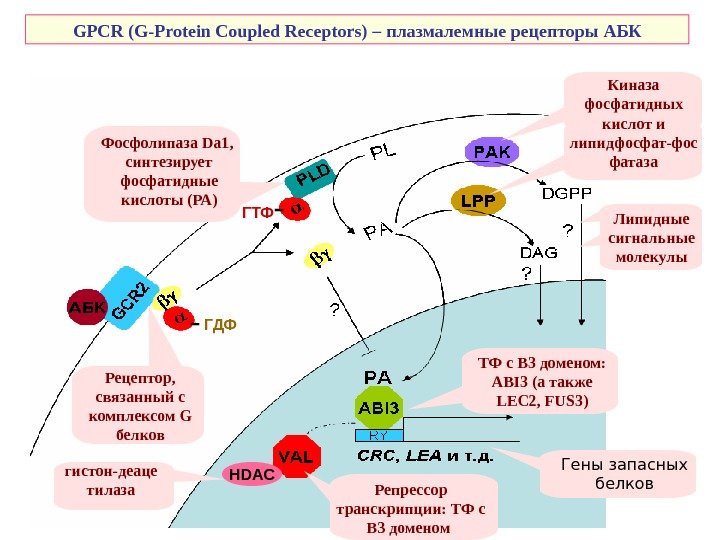
 GPCR (G-Protein Coupled Receptors) – плазмалемные рецепторы АБК ТФ с В 3 доменом: ABI 3 (а также LEC 2, FUS 3 )Рецептор, связанный с комплексом G белков ГДФ ГТФФосфолипаза Da 1 , синтезирует фосфатидные кислоты (РА) Киназа фосфатидных кислот и липидфосфат-фос фатаза Липидные сигнальные молекулы Гены запасных белков. HDAC Репрессор транскрипции: ТФ с В 3 доменом гистон-деаце тилаза
GPCR (G-Protein Coupled Receptors) – плазмалемные рецепторы АБК ТФ с В 3 доменом: ABI 3 (а также LEC 2, FUS 3 )Рецептор, связанный с комплексом G белков ГДФ ГТФФосфолипаза Da 1 , синтезирует фосфатидные кислоты (РА) Киназа фосфатидных кислот и липидфосфат-фос фатаза Липидные сигнальные молекулы Гены запасных белков. HDAC Репрессор транскрипции: ТФ с В 3 доменом гистон-деаце тилаза
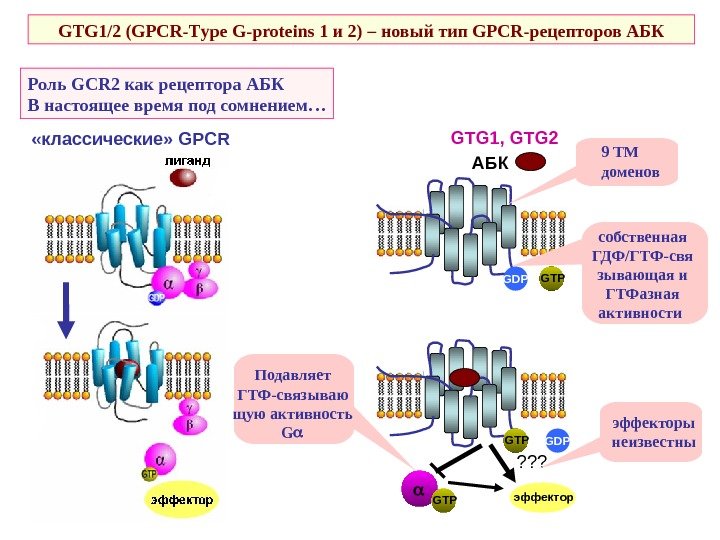
 Роль GCR 2 как рецептора АБК В настоящее время под сомнением… GTG 1/2 ( GPCR- T ype G-proteins 1 и 2 ) – новый тип GPCR -рецепторов АБК «классические» GPCR АБК GTPGDP GTP GTG 1, GTG 2 эффектор ? ? ? 9 ТМ доменов собственная ГДФ/ГТФ-свя зывающая и ГТФазная активности эффекторы неизвестны. Подавляет ГТФ-связываю щую активность G
Роль GCR 2 как рецептора АБК В настоящее время под сомнением… GTG 1/2 ( GPCR- T ype G-proteins 1 и 2 ) – новый тип GPCR -рецепторов АБК «классические» GPCR АБК GTPGDP GTP GTG 1, GTG 2 эффектор ? ? ? 9 ТМ доменов собственная ГДФ/ГТФ-свя зывающая и ГТФазная активности эффекторы неизвестны. Подавляет ГТФ-связываю щую активность G
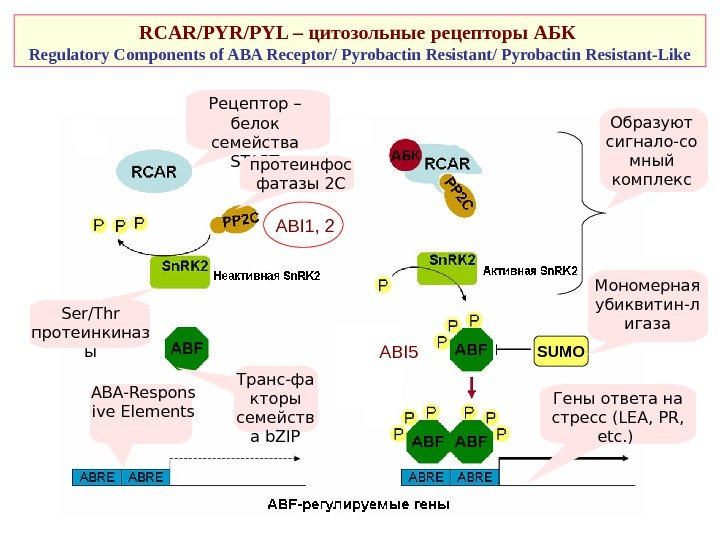
 RCAR/PYL – цитозольные рецепторы АБК Regulatory Components of ABA Receptor/ Pyrobactin Resistant-Like Рецептор – белок семейства START протеинфос фатазы 2 С Ser/Thr протеинкиназ ы ABI 1, 2 Образуют сигнало-со мный комплекс SUMO Транс-фа кторы семейств а b. ZIPABA-Respons ive Elements Мономерная убиквитин-л игаза Гены ответа на стресс ( LEA, PR, etc. ) ABI
RCAR/PYL – цитозольные рецепторы АБК Regulatory Components of ABA Receptor/ Pyrobactin Resistant-Like Рецептор – белок семейства START протеинфос фатазы 2 С Ser/Thr протеинкиназ ы ABI 1, 2 Образуют сигнало-со мный комплекс SUMO Транс-фа кторы семейств а b. ZIPABA-Respons ive Elements Мономерная убиквитин-л игаза Гены ответа на стресс ( LEA, PR, etc. ) ABI
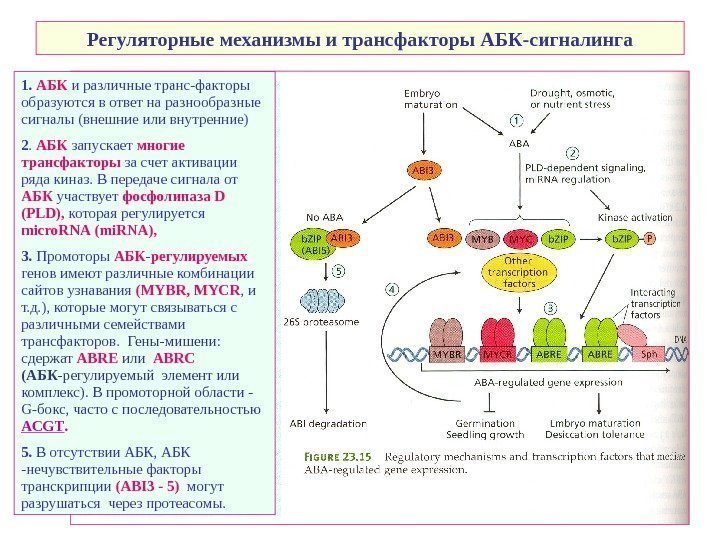
 Регуляторные механизмы и трансфакторы АБК-сигналинга 1. АБК и различные транс-факторы образуются в ответ на разнообразные сигналы (внешние или внутренние) 2. АБК запускает многие трансфакторы за счет активации ряда киназ. В передаче сигнала от АБК участвует фосфолипаза D ( PLD ), которая регулируется micro. RNA ( mi. RNA ), 3. Промоторы АБК — регулируемых генов имеют различные комбинации сайтов узнавания ( MYBR , MYCR , и т. д. ), которые могут связываться с различными семействами трансфакторов. Гены-мишени: сдержат ABRE или ABRC (АБК -регулируемый элемент или комплекс). В промоторной области — G- бокс, часто с последовательностью ACGT. 5. В отсутствии АБК, АБК -нечувствительные факторы транскрипции ( ABI 3 — 5 ) могут разрушаться через протеасомы.
Регуляторные механизмы и трансфакторы АБК-сигналинга 1. АБК и различные транс-факторы образуются в ответ на разнообразные сигналы (внешние или внутренние) 2. АБК запускает многие трансфакторы за счет активации ряда киназ. В передаче сигнала от АБК участвует фосфолипаза D ( PLD ), которая регулируется micro. RNA ( mi. RNA ), 3. Промоторы АБК — регулируемых генов имеют различные комбинации сайтов узнавания ( MYBR , MYCR , и т. д. ), которые могут связываться с различными семействами трансфакторов. Гены-мишени: сдержат ABRE или ABRC (АБК -регулируемый элемент или комплекс). В промоторной области — G- бокс, часто с последовательностью ACGT. 5. В отсутствии АБК, АБК -нечувствительные факторы транскрипции ( ABI 3 — 5 ) могут разрушаться через протеасомы.
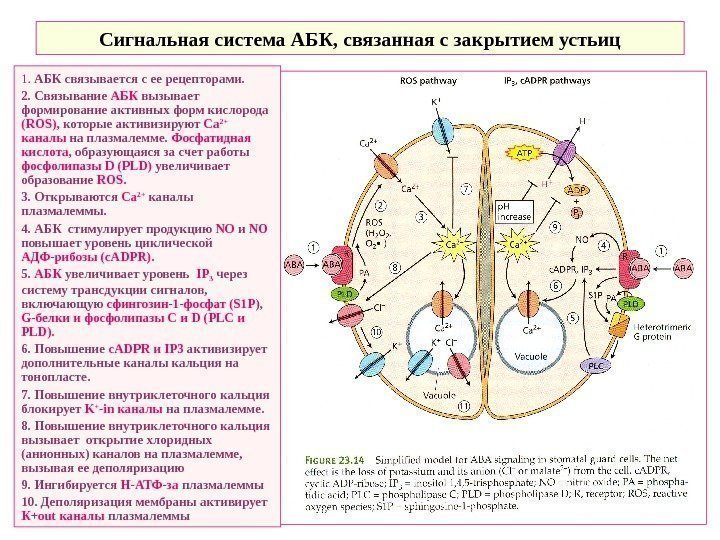
 Сигнальная система АБК, связанная с закрытием устьиц 1. АБК связывается с ее рецепторами. 2. Связывание АБК вызывает формирование активных форм кислорода ( ROS ), которые активизируют Ca 2+ каналы на плазмалемме. Фосфатидная кислота , образующаяся за счет работы фосфолипазы D ( PLD ) увеличивает образование ROS. 3. Открываются Ca 2+ каналы плазмалеммы. 4. АБК стимулирует продукцию NO и NO повышает уровень циклической АДФ-рибозы ( c. ADPR ). 5. АБК увеличивает уровень IP 3 через систему трансдукции сигналов, включающую сфингозин-1 -фосфат (S 1 P ), G -белки и фосфолипазы С и D ( PLC и PLD ). 6. Повышение c. ADPR и IP 3 активизирует дополнительные каналы кальция на тонопласте. 7. Повышение внутриклеточного кальция блокирует K + -in каналы на плазмалемме. 8. Повышение внутриклеточного кальция вызывает открытие хлоридных (анионных) каналов на плазмалемме, вызывая ее деполяризацию 9. Ингибируется Н-АТФ-за плазмалеммы 10. Деполяризация мембраны активирует К+ out каналы плазмалеммы
Сигнальная система АБК, связанная с закрытием устьиц 1. АБК связывается с ее рецепторами. 2. Связывание АБК вызывает формирование активных форм кислорода ( ROS ), которые активизируют Ca 2+ каналы на плазмалемме. Фосфатидная кислота , образующаяся за счет работы фосфолипазы D ( PLD ) увеличивает образование ROS. 3. Открываются Ca 2+ каналы плазмалеммы. 4. АБК стимулирует продукцию NO и NO повышает уровень циклической АДФ-рибозы ( c. ADPR ). 5. АБК увеличивает уровень IP 3 через систему трансдукции сигналов, включающую сфингозин-1 -фосфат (S 1 P ), G -белки и фосфолипазы С и D ( PLC и PLD ). 6. Повышение c. ADPR и IP 3 активизирует дополнительные каналы кальция на тонопласте. 7. Повышение внутриклеточного кальция блокирует K + -in каналы на плазмалемме. 8. Повышение внутриклеточного кальция вызывает открытие хлоридных (анионных) каналов на плазмалемме, вызывая ее деполяризацию 9. Ингибируется Н-АТФ-за плазмалеммы 10. Деполяризация мембраны активирует К+ out каналы плазмалеммы
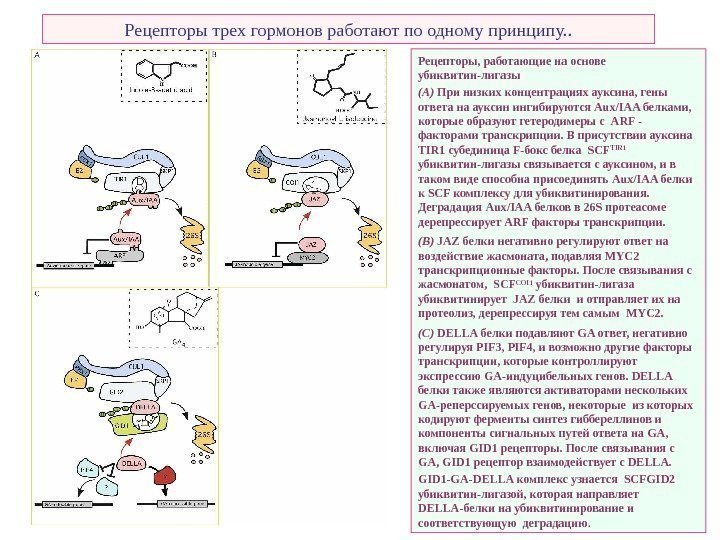
 Рецепторы трех гормонов работают по одному принципу. . Рецепторы, работающие на основе убиквитин-лигазы (A) При низких концентрациях ауксина, гены ответа на ауксин ингибируются Aux / IAA белками, которые образуют гетеродимеры с ARF — факторами транскрипции. В присутствии ауксина TIR 1 субединица F-бокс белка SCF TIR 1 убиквитин-лигазы связывается с ауксином, и в таком виде способна присоединять Aux / IAA белки к SCF комплексу для убиквитинирования. Деградация Aux / IAA белков в 26 S протеасоме дерепрессирует ARF факторы транскрипции. (B) JAZ белки негативно регулируют ответ на воздействие жасмоната, подавляя MYC 2 транскрипционные факторы. После связывания с жасмонатом, SCF COI 1 убиквитин-лигаза убиквитинирует JAZ белки и отправляет их на протеолиз, дерепрессируя тем самым MYC 2. (C) DELLA белки подавляют GA ответ, негативно регулируя PIF 3, PIF 4, и возможно другие факторы транскрипции, которые контроллируют экспрессию GA -индуцибельных генов. DELLA белки также являются активаторами нескольких GA -реперссируемых генов, некоторые из которых кодируют ферменты синтез гиббереллинов и компоненты сигнальных путей ответа на GA , включая GID 1 рецепторы. После связывания с GA , GID 1 рецептор взаимодействует с DELLA. GID 1 — GA — DELLA комплекс узнается SCFGID 2 убиквитин-лигазой, которая направляет DELLA -белки на убиквитинирование и соответствующую деградацию.
Рецепторы трех гормонов работают по одному принципу. . Рецепторы, работающие на основе убиквитин-лигазы (A) При низких концентрациях ауксина, гены ответа на ауксин ингибируются Aux / IAA белками, которые образуют гетеродимеры с ARF — факторами транскрипции. В присутствии ауксина TIR 1 субединица F-бокс белка SCF TIR 1 убиквитин-лигазы связывается с ауксином, и в таком виде способна присоединять Aux / IAA белки к SCF комплексу для убиквитинирования. Деградация Aux / IAA белков в 26 S протеасоме дерепрессирует ARF факторы транскрипции. (B) JAZ белки негативно регулируют ответ на воздействие жасмоната, подавляя MYC 2 транскрипционные факторы. После связывания с жасмонатом, SCF COI 1 убиквитин-лигаза убиквитинирует JAZ белки и отправляет их на протеолиз, дерепрессируя тем самым MYC 2. (C) DELLA белки подавляют GA ответ, негативно регулируя PIF 3, PIF 4, и возможно другие факторы транскрипции, которые контроллируют экспрессию GA -индуцибельных генов. DELLA белки также являются активаторами нескольких GA -реперссируемых генов, некоторые из которых кодируют ферменты синтез гиббереллинов и компоненты сигнальных путей ответа на GA , включая GID 1 рецепторы. После связывания с GA , GID 1 рецептор взаимодействует с DELLA. GID 1 — GA — DELLA комплекс узнается SCFGID 2 убиквитин-лигазой, которая направляет DELLA -белки на убиквитинирование и соответствующую деградацию.

