 Сі рка (S) - хімічний елемент, атомова вага 32, 064; неметал; жовта кристалічна субстанція. Виступає в природі у самородному стані, але частіше у вигляді сполук металів. Застосовують переважно у хімічній промисловості, у ґумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
Сі рка (S) - хімічний елемент, атомова вага 32, 064; неметал; жовта кристалічна субстанція. Виступає в природі у самородному стані, але частіше у вигляді сполук металів. Застосовують переважно у хімічній промисловості, у ґумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
 *Дуже давно сірка стала застосовуватися у складі різних пальних сумішей для військових цілей. Елементарну природу сірки встановив Лавуазье у дослідах по спалюванню. З введенням пороху в Європі почався розвиток добування, а також розробка способів отримання. Точне походження не встановлено, але вважається, що використовувався до Різдва Христового.
*Дуже давно сірка стала застосовуватися у складі різних пальних сумішей для військових цілей. Елементарну природу сірки встановив Лавуазье у дослідах по спалюванню. З введенням пороху в Європі почався розвиток добування, а також розробка способів отримання. Точне походження не встановлено, але вважається, що використовувався до Різдва Христового.
 *Нині сірку отримують головним чином шляхом виплавки самородної сірки безпосередньо в місцях її залягання під землею. Сірчані руди добувають різними способами - залежно від умов залягання. Поклади сірки майже завжди супроводять скупчення отруйних газів - з'єднань сірки. До того ж не можна забувати про можливість її самозаймання. * Добування у вулкані. Індонезія
*Нині сірку отримують головним чином шляхом виплавки самородної сірки безпосередньо в місцях її залягання під землею. Сірчані руди добувають різними способами - залежно від умов залягання. Поклади сірки майже завжди супроводять скупчення отруйних газів - з'єднань сірки. До того ж не можна забувати про можливість її самозаймання. * Добування у вулкані. Індонезія
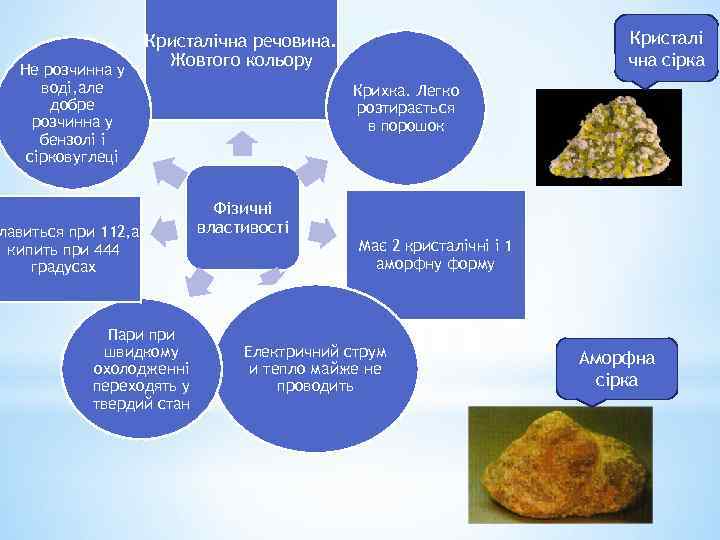 Не розчинна у воді, але добре розчинна у бензолі і сірковуглеці Кристалі чна сірка Кристалічна речовина. Жовтого кольору лавиться при 112, а кипить при 444 градусах Пари при швидкому охолодженні переходять у твердий стан Крихка. Легко розтирається в порошок Фізичні властивості Має 2 кристалічні і 1 аморфну форму Електричний струм и тепло майже не проводить Аморфна сірка
Не розчинна у воді, але добре розчинна у бензолі і сірковуглеці Кристалі чна сірка Кристалічна речовина. Жовтого кольору лавиться при 112, а кипить при 444 градусах Пари при швидкому охолодженні переходять у твердий стан Крихка. Легко розтирається в порошок Фізичні властивості Має 2 кристалічні і 1 аморфну форму Електричний струм и тепло майже не проводить Аморфна сірка
 Хімічні властивості З металами Сірка проявляє окислювальні властивості, в результаті взаємодії утворюються сульфіди: Cu + S = CUS. З воднем Взаємодія з воднем відбувається при 150– 200 °С: H 2 + S = H 2 s. З киснем Сірка горить в кисні при 280 °С, на повітрі при 360 °С, при цьому утворюється суміш оксидів: S + O 2 = So 2; 2 s + 3 O 2 = 2 SO 3. З фосфором і вуглецем При нагріванні без доступу повітря сірка реагує з фосфором, вуглецем, проявляючи окислювальні властивості: 2 p + 3 s = P 2 s 3; 2 s + C = Cs 2. З фтором У присутності сильних окислювачів проявляє відновні властивості: S + 3 F 2 = Sf 6. Зі складними речовинами Сірка поводиться як відновник: S + 2 HNO 3 = 2 no + H 2 so 4. З хлором Розплав сірки реагує з хлором, при цьому можливе утворення двох нижчих хлоридів 2 S + Cl 2 = S 2 Cl 2; S + Cl 2 = SCl 2
Хімічні властивості З металами Сірка проявляє окислювальні властивості, в результаті взаємодії утворюються сульфіди: Cu + S = CUS. З воднем Взаємодія з воднем відбувається при 150– 200 °С: H 2 + S = H 2 s. З киснем Сірка горить в кисні при 280 °С, на повітрі при 360 °С, при цьому утворюється суміш оксидів: S + O 2 = So 2; 2 s + 3 O 2 = 2 SO 3. З фосфором і вуглецем При нагріванні без доступу повітря сірка реагує з фосфором, вуглецем, проявляючи окислювальні властивості: 2 p + 3 s = P 2 s 3; 2 s + C = Cs 2. З фтором У присутності сильних окислювачів проявляє відновні властивості: S + 3 F 2 = Sf 6. Зі складними речовинами Сірка поводиться як відновник: S + 2 HNO 3 = 2 no + H 2 so 4. З хлором Розплав сірки реагує з хлором, при цьому можливе утворення двох нижчих хлоридів 2 S + Cl 2 = S 2 Cl 2; S + Cl 2 = SCl 2
 Досить поширений елемент, на неї припадає близько 0, 1 % маси земної кори. Зустрічається у вільному стані(самородна), але частіше в у вигляді різних сполук. Найважливіші з них —пірит , гіпс, мірабіліт. В невеликих кількостях сірка міститься в кам'яному вугіллі і нафті, а також в усіх рослинних і тваринних організмах, оскільки вона входить до складу білків. Сфарелит Пірит Гіпс Мірабілт
Досить поширений елемент, на неї припадає близько 0, 1 % маси земної кори. Зустрічається у вільному стані(самородна), але частіше в у вигляді різних сполук. Найважливіші з них —пірит , гіпс, мірабіліт. В невеликих кількостях сірка міститься в кам'яному вугіллі і нафті, а також в усіх рослинних і тваринних організмах, оскільки вона входить до складу білків. Сфарелит Пірит Гіпс Мірабілт