Шок (студ).ppt
- Количество слайдов: 89
 ШОК Глумчер Ф. С. Національний медичний університет ім. О. О. Богомольца
ШОК Глумчер Ф. С. Національний медичний університет ім. О. О. Богомольца
 Клінічна фізіологія ССС è Протягом життя людини серце безперервно виконує функцію насоса, перекачуючи до 200 000 л крові. è СВ = ЧСС ∙ УО è Де: СВ – серцевий викид, ЧСС – частота серцевих скорочень, а УО – ударний об’єм. è СВ або хвилинний об'єм серця (ХОС) у людини середньої маси (70 кг) досягає у покої приблизно 5, 0 л крові, бо ЧСС становить в середньому 70 скорочень на 1 хв, а УО – 70 мл. Вимірють ще один показник – серцевий індекс (СІ), який дорівнює 2, 5 – 4, 0 л/хв∙м 2 й залежить вже від площі поверхні тіла. При важкій м'язовій роботі СВ може зростати до 25 л/хв та більше. 2
Клінічна фізіологія ССС è Протягом життя людини серце безперервно виконує функцію насоса, перекачуючи до 200 000 л крові. è СВ = ЧСС ∙ УО è Де: СВ – серцевий викид, ЧСС – частота серцевих скорочень, а УО – ударний об’єм. è СВ або хвилинний об'єм серця (ХОС) у людини середньої маси (70 кг) досягає у покої приблизно 5, 0 л крові, бо ЧСС становить в середньому 70 скорочень на 1 хв, а УО – 70 мл. Вимірють ще один показник – серцевий індекс (СІ), який дорівнює 2, 5 – 4, 0 л/хв∙м 2 й залежить вже від площі поверхні тіла. При важкій м'язовій роботі СВ може зростати до 25 л/хв та більше. 2
 Клінічна фізіологія ССС è УО детермінований трьома факторами: переднавантаженням, післянавантаженням та скоротливою спроможністю шлуночків серця. Переднавантаження є шлуночковий об’єм в кінці діастоли. Збільшення переднавантаження сприяє збільшенню УО. Переднавантаження великою мірою залежить від возврату венозної крові до правого шлуночка, який в свою чергу залежить від положення тіла, внутрішньоторакального тиску, об’єму циркулюючої крові та балансу констрікції та ділатації (тонусу) венозної системи. Зв’язок між шлуночковим кінцево-діастолічним об’ємом та УО підкоряється закону Старлинга, за яким стан сили скорочення міокарду пропорційний початковій довжині міофібрил, але до певної міри. 3
Клінічна фізіологія ССС è УО детермінований трьома факторами: переднавантаженням, післянавантаженням та скоротливою спроможністю шлуночків серця. Переднавантаження є шлуночковий об’єм в кінці діастоли. Збільшення переднавантаження сприяє збільшенню УО. Переднавантаження великою мірою залежить від возврату венозної крові до правого шлуночка, який в свою чергу залежить від положення тіла, внутрішньоторакального тиску, об’єму циркулюючої крові та балансу констрікції та ділатації (тонусу) венозної системи. Зв’язок між шлуночковим кінцево-діастолічним об’ємом та УО підкоряється закону Старлинга, за яким стан сили скорочення міокарду пропорційний початковій довжині міофібрил, але до певної міри. 3
 Закон Франка-Старлінга 4
Закон Франка-Старлінга 4
 Зв’язок між КДО та скоротливістю міокарду è Таким чином, збільшення кінцево-діастолічного об’єму шлуночка сприяє збільшенню скоротливості міокарду шлуночка поки не перебільшує потенціальну можливість міокарду, а потім вже не збільшується (плато на кривих) й швидко починає зменшуватися. В останньому випадку величина переднавантаження стало надмірним для цього шлуночку. У випадках серцевої недостатності та кардіогеного шоку скорочувальна здібність міокарду значно зменшується, й те переднавантаження, яке в нормі сприяло збільшенню УО вже призводить до його зменшення. 5
Зв’язок між КДО та скоротливістю міокарду è Таким чином, збільшення кінцево-діастолічного об’єму шлуночка сприяє збільшенню скоротливості міокарду шлуночка поки не перебільшує потенціальну можливість міокарду, а потім вже не збільшується (плато на кривих) й швидко починає зменшуватися. В останньому випадку величина переднавантаження стало надмірним для цього шлуночку. У випадках серцевої недостатності та кардіогеного шоку скорочувальна здібність міокарду значно зменшується, й те переднавантаження, яке в нормі сприяло збільшенню УО вже призводить до його зменшення. 5
 Післянавантаження è Післянавантаження залежить від судинного опору під час систоли шлуночка серця: для лівого шлуночка – це системний судинний опір (ССО), а для правого – це опір легеневих судин (малого кола кровобігу). Судинний опір детерміновано діаметром артеріол та прекапілярних сфінктерів – чим менше діаметр, тим більше опір. ССО контролюється симпатичною нервовою системою через α 1 -адренорецептори. 6
Післянавантаження è Післянавантаження залежить від судинного опору під час систоли шлуночка серця: для лівого шлуночка – це системний судинний опір (ССО), а для правого – це опір легеневих судин (малого кола кровобігу). Судинний опір детерміновано діаметром артеріол та прекапілярних сфінктерів – чим менше діаметр, тим більше опір. ССО контролюється симпатичною нервовою системою через α 1 -адренорецептори. 6
 Скоротливість міокарду è Скоротливість – це здібність міокарда до скорочення за умови відсутності змін перед- та післянавантаження. Багато в чому скоротливість міокарда залежить від симпатичної регуляції через β 1 -адренорецептори. На скоротливість впливають деякі чинники внутрішнього середовища та лікарські засоби, так адреноміметики (адреналін, норадреналін, дофамін, добутамін, ефедрин), інгібітори фосфодіестерази 5 (амрінон, мілренон), а також кальцієвий синтитезатор левосимендан, збільшують її. Також скоротливість збільшують серцеві глікозиди, препарати кальцію. Від’ємно впливають на скоротливість міокарду β-блокатори, блокатори кальцієвих каналів, антиаритмічні засоби, ішемія міокарду, ацидоз. 7
Скоротливість міокарду è Скоротливість – це здібність міокарда до скорочення за умови відсутності змін перед- та післянавантаження. Багато в чому скоротливість міокарда залежить від симпатичної регуляції через β 1 -адренорецептори. На скоротливість впливають деякі чинники внутрішнього середовища та лікарські засоби, так адреноміметики (адреналін, норадреналін, дофамін, добутамін, ефедрин), інгібітори фосфодіестерази 5 (амрінон, мілренон), а також кальцієвий синтитезатор левосимендан, збільшують її. Також скоротливість збільшують серцеві глікозиди, препарати кальцію. Від’ємно впливають на скоротливість міокарду β-блокатори, блокатори кальцієвих каналів, антиаритмічні засоби, ішемія міокарду, ацидоз. 7
 Скоротливість міокарду è При збільшенні навантаження межа підвищення скорочувальної функції м’яза серця залежить від потужності іонних насосів саркоплазматичного ретикулуму та мітохондрій, у яких здійснюється конкуренція між накопиченням іонів Са 2+ та ресинтезом АТФ. Межове навантаження завжди супроводжується деяким дефіцитом кисню з активацією у тканинах анаеробного гліколізу, що викликає накопичення молочної кислоти та підвищення концентрації іонів Н+. Це приводить до зниження скорочувальної функції м'яза серця у зв'язку з тим, що іони Н+ порушують зв‘язок іонів Са 2+ з тропоніном, а також процес сполучення збудження із скороченням. Споживання кисню міокардом різко підвищується при збільшенні напруження міокарда під час систоли та при підвищенні частоти скорочень серця. 8
Скоротливість міокарду è При збільшенні навантаження межа підвищення скорочувальної функції м’яза серця залежить від потужності іонних насосів саркоплазматичного ретикулуму та мітохондрій, у яких здійснюється конкуренція між накопиченням іонів Са 2+ та ресинтезом АТФ. Межове навантаження завжди супроводжується деяким дефіцитом кисню з активацією у тканинах анаеробного гліколізу, що викликає накопичення молочної кислоти та підвищення концентрації іонів Н+. Це приводить до зниження скорочувальної функції м'яза серця у зв'язку з тим, що іони Н+ порушують зв‘язок іонів Са 2+ з тропоніном, а також процес сполучення збудження із скороченням. Споживання кисню міокардом різко підвищується при збільшенні напруження міокарда під час систоли та при підвищенні частоти скорочень серця. 8
 Системна циркуляція è Системні кровоносні судини поділяються на артерії, артеріоли, капіляри та вени. Через артерії кров досягає тканин та органів, артеріоли мають м’язову оболонку, від їх тонусу залежить кровотік в капілярах, капіляри вистілає один шар ендотеліальних клітин, через який забезпечується транскапілярний обмін між кров’ю та тканинами, через вени кров повертається до серця. Вени містять біля 70% об’єму циркулючої крові (ОЦК), в артеріях всього міститься до 15% ОЦК. Вени є резервуаром крові й від їх тонусу багато в чому залежить переднавантаження. 9
Системна циркуляція è Системні кровоносні судини поділяються на артерії, артеріоли, капіляри та вени. Через артерії кров досягає тканин та органів, артеріоли мають м’язову оболонку, від їх тонусу залежить кровотік в капілярах, капіляри вистілає один шар ендотеліальних клітин, через який забезпечується транскапілярний обмін між кров’ю та тканинами, через вени кров повертається до серця. Вени містять біля 70% об’єму циркулючої крові (ОЦК), в артеріях всього міститься до 15% ОЦК. Вени є резервуаром крові й від їх тонусу багато в чому залежить переднавантаження. 9
 Тонус судин è Найбільший вплив на тонус судин, крім капілярів, має симпатична нервова система, одначе її вплив має органоспецифічний характер, тобто в органах, в яких артерії та артеріоли мають багато α 1 - адренорепторів, якто шкіра, нирки, спланхнічна зона кровотік зменшується в значній мірі, а в органах де мало або взагалі немає α 1 - адренорепторів, якто серце та головний мозок, кровотік взагалі не зменшується, що має важливе значення для збереження кровобігу в цих важливих для життя органах під час великої крововтрати. 10
Тонус судин è Найбільший вплив на тонус судин, крім капілярів, має симпатична нервова система, одначе її вплив має органоспецифічний характер, тобто в органах, в яких артерії та артеріоли мають багато α 1 - адренорепторів, якто шкіра, нирки, спланхнічна зона кровотік зменшується в значній мірі, а в органах де мало або взагалі немає α 1 - адренорепторів, якто серце та головний мозок, кровотік взагалі не зменшується, що має важливе значення для збереження кровобігу в цих важливих для життя органах під час великої крововтрати. 10
 Тонус судин è Разом з цим, β 2 -адренергічна та парасимпатична стимуляція зменшує тонус судин й збільшує кровотік, але головним чином в м’язах. Циркулюючі гормони, такі як адреналін, ангіотензин II, вазопресин сприяють вазоконстрикції, а залежний від ендотелію чинник, який стимулює синтез простацикліну та оксиду азоту, та ендотелін грають важливу роль в регуляції локальної перфузії тканин. Накопичення метаболитів, таких як СО 2, К+, Н+, аденозін та лактат, сприяють вазодилатації. Ауторегуляція кровотоку грає величезну роль в головному мозку та нирках. 11
Тонус судин è Разом з цим, β 2 -адренергічна та парасимпатична стимуляція зменшує тонус судин й збільшує кровотік, але головним чином в м’язах. Циркулюючі гормони, такі як адреналін, ангіотензин II, вазопресин сприяють вазоконстрикції, а залежний від ендотелію чинник, який стимулює синтез простацикліну та оксиду азоту, та ендотелін грають важливу роль в регуляції локальної перфузії тканин. Накопичення метаболитів, таких як СО 2, К+, Н+, аденозін та лактат, сприяють вазодилатації. Ауторегуляція кровотоку грає величезну роль в головному мозку та нирках. 11
 Контроль артеріального тиску (АТ) è Системний АТ підтримує перфузію тканин. è Середній АТ (САТ) = діаст АТ + 1/3 пульсового АТ (сис. АТ – діаст АТ) è САТ є продуктом СВ та ССО: САТ = СВ ∙ ССО. è Якщо СВ знижується, наприклад при гіповолемії, САТ знижується також, але потім може збільшитися за рахунок збільшення ССО. На рівень АТ впливає барорепція, яка запобігає значній артеріальній гіпертензії та гіпотензії (за рахунок стимуляції ренін-ангіотензинової системи в нирках). 12
Контроль артеріального тиску (АТ) è Системний АТ підтримує перфузію тканин. è Середній АТ (САТ) = діаст АТ + 1/3 пульсового АТ (сис. АТ – діаст АТ) è САТ є продуктом СВ та ССО: САТ = СВ ∙ ССО. è Якщо СВ знижується, наприклад при гіповолемії, САТ знижується також, але потім може збільшитися за рахунок збільшення ССО. На рівень АТ впливає барорепція, яка запобігає значній артеріальній гіпертензії та гіпотензії (за рахунок стимуляції ренін-ангіотензинової системи в нирках). 12
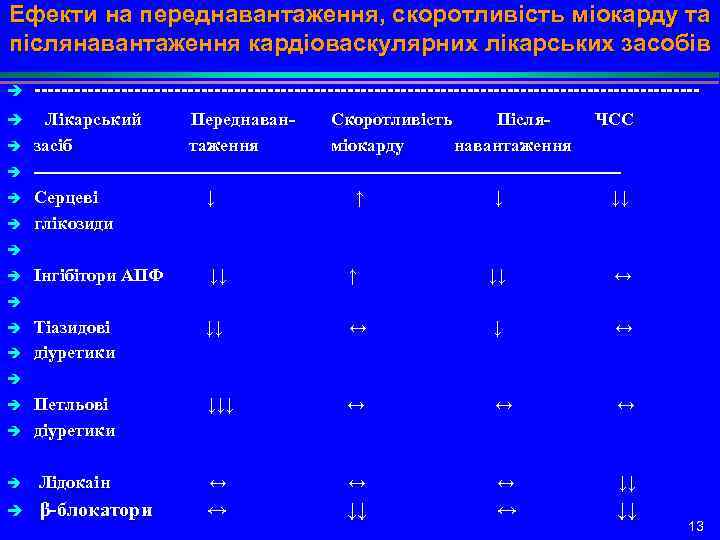 Ефекти на переднавантаження, скоротливість міокарду та післянавантаження кардіоваскулярних лікарських засобів è è -------------------------------------------------- Лікарський Переднаван- Скоротливість Після- ЧСС è засіб таження міокарду навантаження ------------------------------------------------- Серцеві ↓ ↑ ↓↓ глікозиди Інгібітори АПФ ↓↓ ↑ ↓↓ ↔ Тіазидові ↓↓ ↔ ↓ ↔ діуретики Петльові ↓↓↓ ↔ діуретики è Лідокаін ↔ ↓↓ è β-блокатори ↔ ↓↓ ↔ ↓↓ è è è 13
Ефекти на переднавантаження, скоротливість міокарду та післянавантаження кардіоваскулярних лікарських засобів è è -------------------------------------------------- Лікарський Переднаван- Скоротливість Після- ЧСС è засіб таження міокарду навантаження ------------------------------------------------- Серцеві ↓ ↑ ↓↓ глікозиди Інгібітори АПФ ↓↓ ↑ ↓↓ ↔ Тіазидові ↓↓ ↔ ↓ ↔ діуретики Петльові ↓↓↓ ↔ діуретики è Лідокаін ↔ ↓↓ è β-блокатори ↔ ↓↓ ↔ ↓↓ è è è 13
 Ефекти на переднавантаження, скоротливість міокарду та післянавантаження кардіоваскулярних лікарських засобів è ------------------------------------------------- è Лікарський Переднаван- Скоротливість Після- ЧСС засіб таження міокарду навантаження ------------------------------------------------- Аміодарон ↔ -/↓ ↔ ↓↓ Блокатори -/↓ ↓↓ ↓ Са каналів Блокатори ↓↓ ↔ К каналів Прямі ↔ ↓↓ ↔ вазодилататори (гідралазін) Центральні ↓↓ ↔ ↓↓ ↓ 14 вазодилататори è è è è
Ефекти на переднавантаження, скоротливість міокарду та післянавантаження кардіоваскулярних лікарських засобів è ------------------------------------------------- è Лікарський Переднаван- Скоротливість Після- ЧСС засіб таження міокарду навантаження ------------------------------------------------- Аміодарон ↔ -/↓ ↔ ↓↓ Блокатори -/↓ ↓↓ ↓ Са каналів Блокатори ↓↓ ↔ К каналів Прямі ↔ ↓↓ ↔ вазодилататори (гідралазін) Центральні ↓↓ ↔ ↓↓ ↓ 14 вазодилататори è è è è
 Ефекти на переднавантаження, скоротливість міокарду та післянавантаження кардіоваскулярних лікарських засобів è ------------------------------------------------- è Лікарський Переднаван- Скоротливість Після- ЧСС засіб таження міокарду навантаження ------------------------------------------------- Нітрати ↓↓↓ ↑ ↓↓ -/↑ (регіон. перфузія) (великі дози) α-блокатори ↓↓ ↔ α-агоністи ↑↑ ↔ ↑↑↑ /↓ β 1 -агоністи ↔ ↑↑ β 2 -агоністи ↓↓ -/↑ ↓↓ ↑ è è è 15
Ефекти на переднавантаження, скоротливість міокарду та післянавантаження кардіоваскулярних лікарських засобів è ------------------------------------------------- è Лікарський Переднаван- Скоротливість Після- ЧСС засіб таження міокарду навантаження ------------------------------------------------- Нітрати ↓↓↓ ↑ ↓↓ -/↑ (регіон. перфузія) (великі дози) α-блокатори ↓↓ ↔ α-агоністи ↑↑ ↔ ↑↑↑ /↓ β 1 -агоністи ↔ ↑↑ β 2 -агоністи ↓↓ -/↑ ↓↓ ↑ è è è 15
 Основні показники ССС èСАТ = 85 – 90 мм рт. ст. èЦВТ = 60 – 100 мм вод. ст. èСВ (ХОС) = 4 – 6 л/хв èСІ = 2, 6 до 4, 2 л/хв/м 2 èССО = 700 – 1600 дин с см-5 è ТЗЛА = 12 – 15 мм рт. ст. 16
Основні показники ССС èСАТ = 85 – 90 мм рт. ст. èЦВТ = 60 – 100 мм вод. ст. èСВ (ХОС) = 4 – 6 л/хв èСІ = 2, 6 до 4, 2 л/хв/м 2 èССО = 700 – 1600 дин с см-5 è ТЗЛА = 12 – 15 мм рт. ст. 16
 è Шок – одна з найчастіших причин тяжкості стану та летальності у хворих на інфаркт міокарду, сеспсис, політравму, панкреатит, анафілаксію та ін. Незважаючи на успіхи інтенсивної терапії, яких було досягнуто за останні роки, летальність від шоку залишається все ще високою, так від септичного шоку помирає 40 – 60%, а від кардиогенного – 30 – 90% хворих. 17
è Шок – одна з найчастіших причин тяжкості стану та летальності у хворих на інфаркт міокарду, сеспсис, політравму, панкреатит, анафілаксію та ін. Незважаючи на успіхи інтенсивної терапії, яких було досягнуто за останні роки, летальність від шоку залишається все ще високою, так від септичного шоку помирає 40 – 60%, а від кардиогенного – 30 – 90% хворих. 17
 ВИЗНАЧЕННЯ Суть шока – гіпоперфузія тканин, котра призводить до дизоксії клітин з переходом на анаеробний шлях метаболізму й развитком лактатацидозу, поліорганної недостатності 18
ВИЗНАЧЕННЯ Суть шока – гіпоперфузія тканин, котра призводить до дизоксії клітин з переходом на анаеробний шлях метаболізму й развитком лактатацидозу, поліорганної недостатності 18
 è Шок завжди характеризується комбінацією артеріальної гіпотензії та метаболичного ацидозу. Внаслідок зниження перфузії тканин та недостатньої доставки кисню пригнічується окиснювальне фосфорилювання, завдяки якому в организмі генерується до 95% всій енергії, таким чином, в клітині утворюється недостатня кількість макроергичних фосфатів, виникає дефіцит енергії, порушення функції клітин та їх загибель. Таким чином, патологічні процесси під час шоку мають як системний характер, так і реалізуються на рівні клітини. 19
è Шок завжди характеризується комбінацією артеріальної гіпотензії та метаболичного ацидозу. Внаслідок зниження перфузії тканин та недостатньої доставки кисню пригнічується окиснювальне фосфорилювання, завдяки якому в организмі генерується до 95% всій енергії, таким чином, в клітині утворюється недостатня кількість макроергичних фосфатів, виникає дефіцит енергії, порушення функції клітин та їх загибель. Таким чином, патологічні процесси під час шоку мають як системний характер, так і реалізуються на рівні клітини. 19
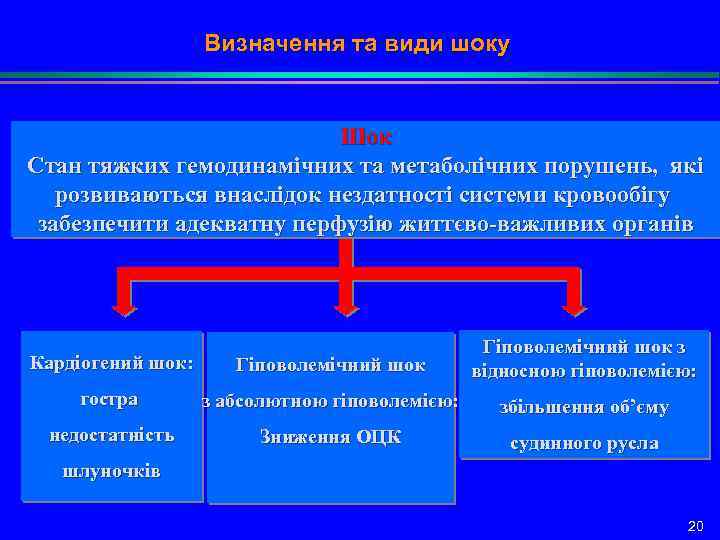 Визначення та види шоку Шок Стан тяжких гемодинамічних та метаболічних порушень, які розвиваються внаслідок нездатності системи кровообігу забезпечити адекватну перфузію життєво-важливих органів Кардіогений шок: Гіповолемічний шок з відносною гіповолемією: гостра з абсолютною гіповолемією: збільшення об’єму недостатність Зниження ОЦК судинного русла шлуночків 20
Визначення та види шоку Шок Стан тяжких гемодинамічних та метаболічних порушень, які розвиваються внаслідок нездатності системи кровообігу забезпечити адекватну перфузію життєво-важливих органів Кардіогений шок: Гіповолемічний шок з відносною гіповолемією: гостра з абсолютною гіповолемією: збільшення об’єму недостатність Зниження ОЦК судинного русла шлуночків 20
 Гіповолемічний шок з абсолютною гіповолемією Геморрагічний Травматичний Опіковий Дегідратаційний шок Втрата плазми Втрата води та електролитів під час діареї, блювоти, норицях Явна Внутрішня крововтрата 21
Гіповолемічний шок з абсолютною гіповолемією Геморрагічний Травматичний Опіковий Дегідратаційний шок Втрата плазми Втрата води та електролитів під час діареї, блювоти, норицях Явна Внутрішня крововтрата 21
 Гіповолемічний шок з відносною гіповолемією Дистрибутивний шок (з відносною гіповолемією) Септичний Анафілактичний шок Вазодилатація, вихід рідини в інтерстицій Неврогений шок Вазодилатація внаслідок порушення регуляції тонуса судин центральної нервової системи після отруєння або церебральної або спинальної травми 22
Гіповолемічний шок з відносною гіповолемією Дистрибутивний шок (з відносною гіповолемією) Септичний Анафілактичний шок Вазодилатація, вихід рідини в інтерстицій Неврогений шок Вазодилатація внаслідок порушення регуляції тонуса судин центральної нервової системи після отруєння або церебральної або спинальної травми 22
 Этіопатогенез шока 23
Этіопатогенез шока 23
 è Незважаючи на поліетіологічність, під час всіх видів шоку є спільні механізми його розвитку: è неадекватна перфузія тканин ішемія клітини зниження продукції АТФ та ц. АМФ порушення функції мембран клітин, насамперед їонних насосів їони калію виходять з клітини, натрій та вода поступають до неї, підвищується концентрація їонів Са в клітині збільшується продукція лактату та внутрішньоклітинний ацидоз пошкодження кліткових органел, насамперед, лізосом самознищення клітини. è Але пошкодження та загибель клітин виникають після відновлення перфузії (реперфузійне враження клітини), насамперед за рахунок неможливості швидкого відновлення функції мітохондрій. 24
è Незважаючи на поліетіологічність, під час всіх видів шоку є спільні механізми його розвитку: è неадекватна перфузія тканин ішемія клітини зниження продукції АТФ та ц. АМФ порушення функції мембран клітин, насамперед їонних насосів їони калію виходять з клітини, натрій та вода поступають до неї, підвищується концентрація їонів Са в клітині збільшується продукція лактату та внутрішньоклітинний ацидоз пошкодження кліткових органел, насамперед, лізосом самознищення клітини. è Але пошкодження та загибель клітин виникають після відновлення перфузії (реперфузійне враження клітини), насамперед за рахунок неможливості швидкого відновлення функції мітохондрій. 24
 Этіопатогенез шоку è Однією з причин прогрессування шоку є ішемія кишок я як наслідок втрата бар’єрної функції кишковим епітелієм. Внаслідок спочатку в брижевий, а потім і в системний кровообіг потрапляють з кишкового вмісту бактерії та їх токсини. Реакція іммунної системи організму на тлі порушення циркуляції, гіпоксії тканин, гіпоергоза, ацидоза не зовсім адекватна й проявляється неконтрольованною системною запальною реакцією. Активуються фактори комплементу, особливо С 3 а та С 5 а, та каскад прозапальних цитокинів (інтерлейкіни – 1, 6, 8; фактор некрозу пухлин та ін. . ), порушується метаболизм арахідонової кислоти з утворенням простагландинів, тромбоксанів, лейкотриєнів. 25
Этіопатогенез шоку è Однією з причин прогрессування шоку є ішемія кишок я як наслідок втрата бар’єрної функції кишковим епітелієм. Внаслідок спочатку в брижевий, а потім і в системний кровообіг потрапляють з кишкового вмісту бактерії та їх токсини. Реакція іммунної системи організму на тлі порушення циркуляції, гіпоксії тканин, гіпоергоза, ацидоза не зовсім адекватна й проявляється неконтрольованною системною запальною реакцією. Активуються фактори комплементу, особливо С 3 а та С 5 а, та каскад прозапальних цитокинів (інтерлейкіни – 1, 6, 8; фактор некрозу пухлин та ін. . ), порушується метаболизм арахідонової кислоти з утворенням простагландинів, тромбоксанів, лейкотриєнів. 25
 РОЛЬ ОКСИДУ АЗОТУ Фізіологічна роль NO: – нейротрансмісія; – регуляція тканевої перфузії, шляхом регулювання судинного тонусу, активності тромбоцитів; – антимікробний захист. è Є основним медіатором артеріальної гіпотензії під час дистрибутивного шоку, грає роль в розвитку депрессії міокарду, збільшує проникність кишок. (Moncada S, Palmer RM, Higgs EA Pharmacol Rev, 1991, 43: 109 -143) 26
РОЛЬ ОКСИДУ АЗОТУ Фізіологічна роль NO: – нейротрансмісія; – регуляція тканевої перфузії, шляхом регулювання судинного тонусу, активності тромбоцитів; – антимікробний захист. è Є основним медіатором артеріальної гіпотензії під час дистрибутивного шоку, грає роль в розвитку депрессії міокарду, збільшує проникність кишок. (Moncada S, Palmer RM, Higgs EA Pharmacol Rev, 1991, 43: 109 -143) 26
 Масивне висвободження NO è NO – важливий медіатор дистрибутивного вазодилатаційного шоку. Утворюється з амінокислоти аргиніна. TNF та IL-6 стимулюють i. NOS, котра на відміну від е. NOS збільшує продукцію NO сприяє продукції гуанилатциклази збільшення ц. ГМФ релаксація гладеньких м’язів судин. (Mosi R, seguin B, et al, Biochem Biophys res Commun, 2002, 29: 519 -529) 27
Масивне висвободження NO è NO – важливий медіатор дистрибутивного вазодилатаційного шоку. Утворюється з амінокислоти аргиніна. TNF та IL-6 стимулюють i. NOS, котра на відміну від е. NOS збільшує продукцію NO сприяє продукції гуанилатциклази збільшення ц. ГМФ релаксація гладеньких м’язів судин. (Mosi R, seguin B, et al, Biochem Biophys res Commun, 2002, 29: 519 -529) 27
 Патологічна роль NO è NO реагує з супероксидом з формуванням потенціально токсичних метаболитів NO, пероксинитриту (ONOO-). Результати досліджень стверджують, що норадреналин окиснюється та дезактивується пероксинитритом. Цей механізм може, частково, пояснювати гіпореактивність судин до норадреналину за умов вазодилатаційного шоку. (Takakura K, Xiaohong W, Takeuchi K, Yasuda Y, Fukuda S. Anesthesiology 2003; 98(4): 928 -34) 28
Патологічна роль NO è NO реагує з супероксидом з формуванням потенціально токсичних метаболитів NO, пероксинитриту (ONOO-). Результати досліджень стверджують, що норадреналин окиснюється та дезактивується пероксинитритом. Цей механізм може, частково, пояснювати гіпореактивність судин до норадреналину за умов вазодилатаційного шоку. (Takakura K, Xiaohong W, Takeuchi K, Yasuda Y, Fukuda S. Anesthesiology 2003; 98(4): 928 -34) 28
 ПОШКОДЖЕННЯ ЕНДОТЕЛІЮ ПІД ЧАС ШОКУ è Пошкодження ендотелію є одним з важливійших компонентів патогенезу шоку. è Потенциальні причини пошкодження ендотелію: è адгезія нейторофилів з эндотеліоцитами з наступною експресією інтегринів, селектинів, внутрішньоклітинних адгезивних молекул. è (Adams DH, Shaw S. Lancet, 1994, 343: 831 -836). 29
ПОШКОДЖЕННЯ ЕНДОТЕЛІЮ ПІД ЧАС ШОКУ è Пошкодження ендотелію є одним з важливійших компонентів патогенезу шоку. è Потенциальні причини пошкодження ендотелію: è адгезія нейторофилів з эндотеліоцитами з наступною експресією інтегринів, селектинів, внутрішньоклітинних адгезивних молекул. è (Adams DH, Shaw S. Lancet, 1994, 343: 831 -836). 29
 ТРАНСМІГРАЦІЯ ЛЕЙКОЦИТІВ èRolling (утворення рулонів) нейтрофилів спочатку викликається селектинами; èstricking (зцеплення) нейтрофи з ендотелієм викликається внутрішньоклітинними адгезивними молекулами ICAM-1, судинними адгезивними молекулами VCAM-1, інтегринами, ліпополісахаридом и TNF 30
ТРАНСМІГРАЦІЯ ЛЕЙКОЦИТІВ èRolling (утворення рулонів) нейтрофилів спочатку викликається селектинами; èstricking (зцеплення) нейтрофи з ендотелієм викликається внутрішньоклітинними адгезивними молекулами ICAM-1, судинними адгезивними молекулами VCAM-1, інтегринами, ліпополісахаридом и TNF 30
 НАБРЯК ЕНДОТЕЛІОЦИТІВ ПІД ЧАС ШОКУ 31
НАБРЯК ЕНДОТЕЛІОЦИТІВ ПІД ЧАС ШОКУ 31
 Эндотелій та коагуляція è Пошкодження ендотелію викликає активацію зовнішнього шляху коагуляції; разом з цитокинами стимулює утворення тканинного фактору згортання нейтрофілами та макрофагами, пригнічує продукцію факторів антигемостазу та фибринолізу: протеїна С, інгибитора тканинного фактору згортання, антитромбину та активатору тканинного плазминогену. Наслідком є набряк ендотелію, що сприяє порушенню перфузії. è Активація коагуляції з утворенням мікротромбів – ДВЗ-синдрому сприяє гіпоперфузії тканин, 32 дизоксії клітин.
Эндотелій та коагуляція è Пошкодження ендотелію викликає активацію зовнішнього шляху коагуляції; разом з цитокинами стимулює утворення тканинного фактору згортання нейтрофілами та макрофагами, пригнічує продукцію факторів антигемостазу та фибринолізу: протеїна С, інгибитора тканинного фактору згортання, антитромбину та активатору тканинного плазминогену. Наслідком є набряк ендотелію, що сприяє порушенню перфузії. è Активація коагуляції з утворенням мікротромбів – ДВЗ-синдрому сприяє гіпоперфузії тканин, 32 дизоксії клітин.
 ЗАПАЛЕННЯ ТА ГЕМОСТАЗ è За останні кілька років вдалося пояснити тісний зв’язок між запаленням та коагуляцією. Додатково до ідентифікації нових регулюючих механизмів системи гемостазу та великої кількості медиаторів запалення, зараз виявлено зв’язок між запаленням та коагуляцією у вигляді зворотньо-поступової активації обох механизмів 33
ЗАПАЛЕННЯ ТА ГЕМОСТАЗ è За останні кілька років вдалося пояснити тісний зв’язок між запаленням та коагуляцією. Додатково до ідентифікації нових регулюючих механизмів системи гемостазу та великої кількості медиаторів запалення, зараз виявлено зв’язок між запаленням та коагуляцією у вигляді зворотньо-поступової активації обох механизмів 33
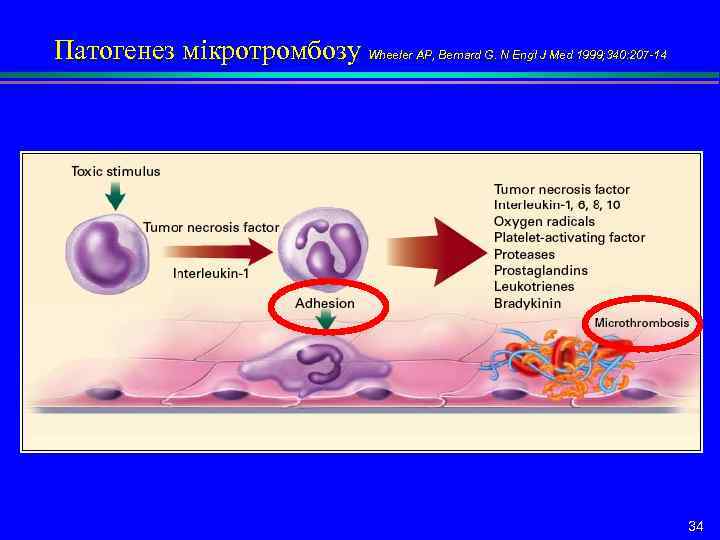 Патогенез мікротромбозу Wheeler AP, Bernard G. N Engl J Med 1999; 340: 207 -14 34
Патогенез мікротромбозу Wheeler AP, Bernard G. N Engl J Med 1999; 340: 207 -14 34
 ЗАПАЛЕННЯ ТА ГЕМОСТАЗ Збільшена експресія тканинного фактору призводить до стимуляції утворення тромбіну в межах капилярного кровообігу. Тромбін є самим важливим фактором зсідання фибрину, але він також грає ключову роль в клетинних механизмах запалення, проліферації кліток та активації природнього антикоагулянта – протеїна C. 35
ЗАПАЛЕННЯ ТА ГЕМОСТАЗ Збільшена експресія тканинного фактору призводить до стимуляції утворення тромбіну в межах капилярного кровообігу. Тромбін є самим важливим фактором зсідання фибрину, але він також грає ключову роль в клетинних механизмах запалення, проліферації кліток та активації природнього антикоагулянта – протеїна C. 35
 ЗАПАЛЕННЯ ТА ГЕМОСТАЗ è Рівні в плазмі білків гострої фази, які приймають участь в процесах коагуляції та фибринолізу, підвищуються в процесі запалення, в то й самий час як природні антикоагулянтні механизми пригнічуються. Прозапальні цитокини "активують" мембрани кліток крові (тромбоцити, моноцити, нейтрофіли) та ендотелію. Структури, які в нормі не впливають на гемостаз чи мають антикоагулянтними властивостями, під час шоку набувають прокогулянтних властивостей. 36
ЗАПАЛЕННЯ ТА ГЕМОСТАЗ è Рівні в плазмі білків гострої фази, які приймають участь в процесах коагуляції та фибринолізу, підвищуються в процесі запалення, в то й самий час як природні антикоагулянтні механизми пригнічуються. Прозапальні цитокини "активують" мембрани кліток крові (тромбоцити, моноцити, нейтрофіли) та ендотелію. Структури, які в нормі не впливають на гемостаз чи мають антикоагулянтними властивостями, під час шоку набувають прокогулянтних властивостей. 36
 ЗАПАЛЕННЯ ТА ГЕМОСТАЗ è Депресія природніх антикоагулянтних механизмів, які виникають під час тяжкого шоку, призводить до неконтрольованного утворення тромбіну з переважанням прозапального ефекту, та запуском зворотнього зв’язку між запаленням та коагуляцією, що в кінцевому підсумку призводить до поліорганної недостатності. Цьому процесу сприяє також пригнічення системи природнього антикоагулянту протеїну С (застосування активованого протеїну С значно зменшує летальність від септичного шоку). 37
ЗАПАЛЕННЯ ТА ГЕМОСТАЗ è Депресія природніх антикоагулянтних механизмів, які виникають під час тяжкого шоку, призводить до неконтрольованного утворення тромбіну з переважанням прозапального ефекту, та запуском зворотнього зв’язку між запаленням та коагуляцією, що в кінцевому підсумку призводить до поліорганної недостатності. Цьому процесу сприяє також пригнічення системи природнього антикоагулянту протеїну С (застосування активованого протеїну С значно зменшує летальність від септичного шоку). 37
 СТАДІЇ ШОКУ Умовно більшість дослідників розподіляють шок на 3 стадії: è Компенсована – за рахунок компенсуючих механизмів зберігаяється перфузія життєво важливих органів; не виникає тяжкої гіпотензії за внаслідок збільшення системного судинного опору; è Декомпенсована – компенсаторні механізми не в змозі підтримувати достатню перфузію, запускаються та прогресують всі патогенетичні механізми шоку; è Незворотня - пошкодження носять незворотній характер, виникає масована загибель клітин та поліорганна недостатність. Підкреслюємо умовність наведеної стадійности патологічного процесу під час шоку, а також тяжкість клінічного дифференціювання 2 -ї та 3 -ї стадії шоку. 3 -я незворотня стадія шоку не завжди призводить до загибелі организму й не є показанням до припинення терапії, в такому разі нам здається не зовсім коректною назва "незворотня". 38
СТАДІЇ ШОКУ Умовно більшість дослідників розподіляють шок на 3 стадії: è Компенсована – за рахунок компенсуючих механизмів зберігаяється перфузія життєво важливих органів; не виникає тяжкої гіпотензії за внаслідок збільшення системного судинного опору; è Декомпенсована – компенсаторні механізми не в змозі підтримувати достатню перфузію, запускаються та прогресують всі патогенетичні механізми шоку; è Незворотня - пошкодження носять незворотній характер, виникає масована загибель клітин та поліорганна недостатність. Підкреслюємо умовність наведеної стадійности патологічного процесу під час шоку, а також тяжкість клінічного дифференціювання 2 -ї та 3 -ї стадії шоку. 3 -я незворотня стадія шоку не завжди призводить до загибелі организму й не є показанням до припинення терапії, в такому разі нам здається не зовсім коректною назва "незворотня". 38
 Симптоматика шоку è Немає одної якої-небудь одної клінічної або лабораторної ознаки, яка б точно відображала перфузію. Артериальна гіпотензия не є раннім маркером гіпоперфузіїі, й тяжкі пошкодження клітин можуть виникнути до її розвитку. Гіповолемія до 30% ОЦК може не супроводжуватися гіпотензією, але викликати тяжку гіпоперфузію тканин. Одним з перших симптомів шоку (крім дистрибутивного) можно вважати зниження пульсового тиску як за рахунок зниження систоличного так і збільшення диастоличного, так і того й іншого. Часто наблюдається тахікардія. 39
Симптоматика шоку è Немає одної якої-небудь одної клінічної або лабораторної ознаки, яка б точно відображала перфузію. Артериальна гіпотензия не є раннім маркером гіпоперфузіїі, й тяжкі пошкодження клітин можуть виникнути до її розвитку. Гіповолемія до 30% ОЦК може не супроводжуватися гіпотензією, але викликати тяжку гіпоперфузію тканин. Одним з перших симптомів шоку (крім дистрибутивного) можно вважати зниження пульсового тиску як за рахунок зниження систоличного так і збільшення диастоличного, так і того й іншого. Часто наблюдається тахікардія. 39
 Симптоматика шока Інші симптоми неадекватної перфузії: холодна бліда шкіра, порушення свідомості, концентрована сеча, олігурія, підвищення рівня креатинину, зниження рівня основ та р. Н (метаболічний ацидоз), Зменшення Scv. O 2 Підвищення лактату Зменшення інтестинального р. Н è 40
Симптоматика шока Інші симптоми неадекватної перфузії: холодна бліда шкіра, порушення свідомості, концентрована сеча, олігурія, підвищення рівня креатинину, зниження рівня основ та р. Н (метаболічний ацидоз), Зменшення Scv. O 2 Підвищення лактату Зменшення інтестинального р. Н è 40
 Симптоматика шока è Scv. O 2 є інтегральним показником адекватності доставки кисню тканинам. При зниженні рівня Scv. O 2 < 70% доставку кисню слід вважати неадекватною. Рівень лактату (>4 ммоль/л) є також маркером дизоксії клітин. Ступінь гіперлактацидемії коррелює з ступенем гіпоперфузії та летальності під час шоку, але може затримуіватися в часі. Для визначення спланхнічної гіпоперфузії інформативним є шлункова тонометрія, однак використання цього методу в кліниці обмежене. 41
Симптоматика шока è Scv. O 2 є інтегральним показником адекватності доставки кисню тканинам. При зниженні рівня Scv. O 2 < 70% доставку кисню слід вважати неадекватною. Рівень лактату (>4 ммоль/л) є також маркером дизоксії клітин. Ступінь гіперлактацидемії коррелює з ступенем гіпоперфузії та летальності під час шоку, але може затримуіватися в часі. Для визначення спланхнічної гіпоперфузії інформативним є шлункова тонометрія, однак використання цього методу в кліниці обмежене. 41
 VO 2 Sv. O 2 Sa. O 2 - Hb. 1. 39. IC
VO 2 Sv. O 2 Sa. O 2 - Hb. 1. 39. IC
 Моніторинг шоку è Інвазивне визначення тиску заклинювання в легеневій артерії залишається золотим стандартом визначення адекватності волемії та об’ємної підтримки, однак все більше росповсюджуються в кліниці нові неінвазивні методи (чрезстравохідна ехокардіографія). Бажано визначати також наступні показники: DO 2, VO 2. Все більше значення набуває визначення об’єму позасудинної води в легенях. è Обов’язковими параметрами моніторинга залишаються: САТ, ЧСС, ЦВТ, діурез, аналізи газів крові, показники КОС, ЕКГ, при 43 необхідності – рентгенологічні методи.
Моніторинг шоку è Інвазивне визначення тиску заклинювання в легеневій артерії залишається золотим стандартом визначення адекватності волемії та об’ємної підтримки, однак все більше росповсюджуються в кліниці нові неінвазивні методи (чрезстравохідна ехокардіографія). Бажано визначати також наступні показники: DO 2, VO 2. Все більше значення набуває визначення об’єму позасудинної води в легенях. è Обов’язковими параметрами моніторинга залишаються: САТ, ЧСС, ЦВТ, діурез, аналізи газів крові, показники КОС, ЕКГ, при 43 необхідності – рентгенологічні методи.
 СОВРЕМЕННЫЙ МОНИТОРИНГ ШОКА 44
СОВРЕМЕННЫЙ МОНИТОРИНГ ШОКА 44
 ГІПОВОЛЕМІЧНИЙ ШОК 45
ГІПОВОЛЕМІЧНИЙ ШОК 45
 Гіповолемічний шок è Характеризується зниженням ОЦК, ЦВТ, ТЗЛА, СІ та підвищенням ССО. Геморагічний шок è Чи всяка крововтрата супроводжується шоком? При крововтраті до 5% ОЦК компенсаторні механізми забезпечують адекватну перфузію тканин, при крововтраті до 10% ОЦК ( 500 мл) можливі прояви шоку, висока вирогідність розвитку шоку при втраті до 20% ОЦК ( 1000 мл), а при втраті крові вище цього об’єму обов’язково розвиваєтьтся шок, хоча крововтрата до 30% ОЦК у пацієнта в стані спокою спочатку може майже не визначатися клінічно. 46 46
Гіповолемічний шок è Характеризується зниженням ОЦК, ЦВТ, ТЗЛА, СІ та підвищенням ССО. Геморагічний шок è Чи всяка крововтрата супроводжується шоком? При крововтраті до 5% ОЦК компенсаторні механізми забезпечують адекватну перфузію тканин, при крововтраті до 10% ОЦК ( 500 мл) можливі прояви шоку, висока вирогідність розвитку шоку при втраті до 20% ОЦК ( 1000 мл), а при втраті крові вище цього об’єму обов’язково розвиваєтьтся шок, хоча крововтрата до 30% ОЦК у пацієнта в стані спокою спочатку може майже не визначатися клінічно. 46 46
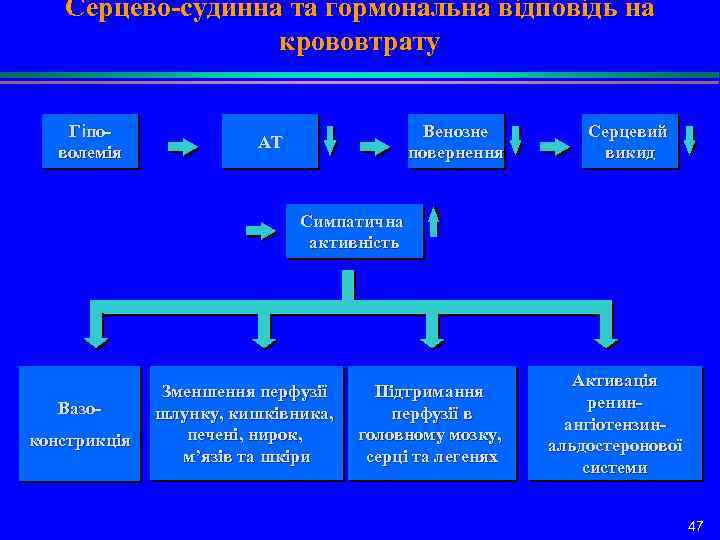 Серцево-судинна та гормональна відповідь на крововтрату Гіповолемія Венозне повернення АТ Серцевий викид Симпатична активність Вазоконстрикція Зменшення перфузії шлунку, кишківника, печені, нирок, м’язів та шкіри Підтримання перфузії в головному мозку, серці та легенях Активація ренинангіотензинальдостеронової системи 47
Серцево-судинна та гормональна відповідь на крововтрату Гіповолемія Венозне повернення АТ Серцевий викид Симпатична активність Вазоконстрикція Зменшення перфузії шлунку, кишківника, печені, нирок, м’язів та шкіри Підтримання перфузії в головному мозку, серці та легенях Активація ренинангіотензинальдостеронової системи 47
 Патологічні наслідки декомпенсованої гіповолемії Декомпенсована гіповолемія Уповільнення кровообігу з «сладж» -синдромом в капилярах Ішемія, особливо в місцях гіпоперфузії Ацидоз та пошкодження ендотелію Активація коагуляції крові Подальше погіршення мікроциркуляції Поліорганна недостатність та смерть 48
Патологічні наслідки декомпенсованої гіповолемії Декомпенсована гіповолемія Уповільнення кровообігу з «сладж» -синдромом в капилярах Ішемія, особливо в місцях гіпоперфузії Ацидоз та пошкодження ендотелію Активація коагуляції крові Подальше погіршення мікроциркуляції Поліорганна недостатність та смерть 48
 ВІДПОВІДЬ НА КРОВОВТРАТУ: Активація симпатичної АНС (реакція централизації, збільшення ЧСС та потреб міокарду в кисні) è Стимуляція системи ренін-ангіотензин-альдостерон (спазм судин, реабсорбция Na в нирках) è Стимуляція продукції вазопресину (спазм судин, реабсорбція води в нирках – зниження діурезу) è Стимуляція осморецепторів гіпоталамуса (спрага) è Стимуляція продукції гликокортикоїдів (підвищення тонусу адренорецепторів, мембранопротекторна дія? ) è Аутогемодилюція è Стимуляція продукції нирками еритропоетину è 49
ВІДПОВІДЬ НА КРОВОВТРАТУ: Активація симпатичної АНС (реакція централизації, збільшення ЧСС та потреб міокарду в кисні) è Стимуляція системи ренін-ангіотензин-альдостерон (спазм судин, реабсорбция Na в нирках) è Стимуляція продукції вазопресину (спазм судин, реабсорбція води в нирках – зниження діурезу) è Стимуляція осморецепторів гіпоталамуса (спрага) è Стимуляція продукції гликокортикоїдів (підвищення тонусу адренорецепторів, мембранопротекторна дія? ) è Аутогемодилюція è Стимуляція продукції нирками еритропоетину è 49
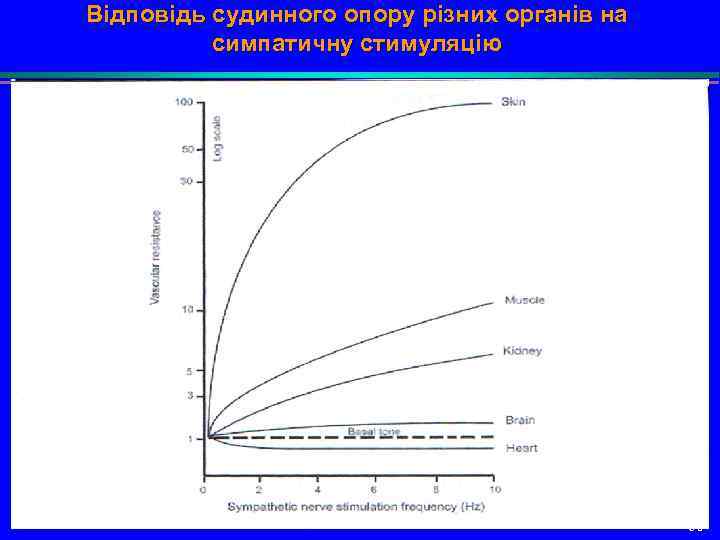 Відповідь судинного опору різних органів на симпатичну стимуляцію 50
Відповідь судинного опору різних органів на симпатичну стимуляцію 50
 Реакція централизації кровообігу è Більша частина крові спрямовується в венечні та церебральні судини – реакція централизації кровообігу. В результаті перфузія мозку та міокарду на протязі певного часу підтримується за рахунок ішемизації інших органів, насамперед, кишок та нирок. Без симпатичної компенсації швидка втрата 25% ОЦК (20 мл/кг) призвела б до зупинки кровообігу, внаслідок порушення венозного повернення крові до серця. 51
Реакція централизації кровообігу è Більша частина крові спрямовується в венечні та церебральні судини – реакція централизації кровообігу. В результаті перфузія мозку та міокарду на протязі певного часу підтримується за рахунок ішемизації інших органів, насамперед, кишок та нирок. Без симпатичної компенсації швидка втрата 25% ОЦК (20 мл/кг) призвела б до зупинки кровообігу, внаслідок порушення венозного повернення крові до серця. 51
 Негативні наслідки симпатичної стимуляції è Стимуляція 1 -адренорецепторів викликає збільшення серцевих скорочень, підвищення скоротливості міокарду, але й збільшення його потреб в кисні, що у хворих з ІХС може посилити ішемію. è Підвищення концентрації катехоламінів в крові може стимулювати ретикулярну формацію стовбуру мозку, тому у хворих з крововтратою швидко можуть виникнути порушення свідомості. è Головна проблема – ішемізація органів (кишки, нирки, печінка, інші тканини) 52
Негативні наслідки симпатичної стимуляції è Стимуляція 1 -адренорецепторів викликає збільшення серцевих скорочень, підвищення скоротливості міокарду, але й збільшення його потреб в кисні, що у хворих з ІХС може посилити ішемію. è Підвищення концентрації катехоламінів в крові може стимулювати ретикулярну формацію стовбуру мозку, тому у хворих з крововтратою швидко можуть виникнути порушення свідомості. è Головна проблема – ішемізація органів (кишки, нирки, печінка, інші тканини) 52
 Реакція на крововтрату è Ішемія нирок призводить до активації юктагломерулярним апаратом продукції реніну, котрий сприяє утворенню з ангітензиногену ангіотензину I, котрий за участю ферменту ангіотензинконвертази в легенях перетворюється на потужний вазоконстриктор ангітензин II. Цей процес сприяє утворенню в корі наднирників альдостерону, котрий активує реабсорбцію натрію нирковими канальцями. 53
Реакція на крововтрату è Ішемія нирок призводить до активації юктагломерулярним апаратом продукції реніну, котрий сприяє утворенню з ангітензиногену ангіотензину I, котрий за участю ферменту ангіотензинконвертази в легенях перетворюється на потужний вазоконстриктор ангітензин II. Цей процес сприяє утворенню в корі наднирників альдостерону, котрий активує реабсорбцію натрію нирковими канальцями. 53
 Реакція на крововтрату è Активується функція задньої частки гіпофізу, що виробляє вазопресин (антидиуретичний гормон). Вазопресин стимулює V 2 -рецептори в нирках з підвищенням реабсорбції води. Стимуляція V 1 рецепторів викликає вазоспазм. è Стимуляція осморецепторів гіпоталамусу викликає у людини спрагу. Однакнавіть у випадках, коли пиття рідини не протипоказано (відсутність поранення шлунку та кишок) цей шлях поповнення ОЦК значно обмежений. Внаслідок швидко виникаючої ішемії шлунку та кишок, останні втрачають здібність абсорбувати 54 рідину.
Реакція на крововтрату è Активується функція задньої частки гіпофізу, що виробляє вазопресин (антидиуретичний гормон). Вазопресин стимулює V 2 -рецептори в нирках з підвищенням реабсорбції води. Стимуляція V 1 рецепторів викликає вазоспазм. è Стимуляція осморецепторів гіпоталамусу викликає у людини спрагу. Однакнавіть у випадках, коли пиття рідини не протипоказано (відсутність поранення шлунку та кишок) цей шлях поповнення ОЦК значно обмежений. Внаслідок швидко виникаючої ішемії шлунку та кишок, останні втрачають здібність абсорбувати 54 рідину.
 Аутогемодилюція è Якщо у хворого визначити Нв та Ht крові безпосередньо після великої крововтрати, то вони залишаться на тому ж рівні. Однак, навіть якщо хворому не переливати рідину, через деякий час (чим вище крововтрата, тим скоріше) буде визначатися прогресуюче зниження показників Нв та Ht, що пояснюється так званою аутогемодилюцією. Для її реалізації велике значення має різниця між гідростатичним та колоїдно-осмотичним тиском (альбумін). 55
Аутогемодилюція è Якщо у хворого визначити Нв та Ht крові безпосередньо після великої крововтрати, то вони залишаться на тому ж рівні. Однак, навіть якщо хворому не переливати рідину, через деякий час (чим вище крововтрата, тим скоріше) буде визначатися прогресуюче зниження показників Нв та Ht, що пояснюється так званою аутогемодилюцією. Для її реалізації велике значення має різниця між гідростатичним та колоїдно-осмотичним тиском (альбумін). 55
 ЛІКУВАННЯ ГЕМОРАГІЧНОГО ШОКУ 56
ЛІКУВАННЯ ГЕМОРАГІЧНОГО ШОКУ 56
 Геморагічний шок 2 основних принципа терапії: è Екстрена зупинка кровотечі (тяжкість стану не є протипоказанням до хірургічного гемостазу) è Масивна інфузійно-трансфузійна терапія (в термінальних випадках до 500 мл/хв, але не менше 100 мл/хв) 57
Геморагічний шок 2 основних принципа терапії: è Екстрена зупинка кровотечі (тяжкість стану не є протипоказанням до хірургічного гемостазу) è Масивна інфузійно-трансфузійна терапія (в термінальних випадках до 500 мл/хв, але не менше 100 мл/хв) 57
 ЛІКУВАННЯ ГЕМОРАГІЧНОГО ШОКУ èСмерть організму при крововтраті наступає внаслідок втрати 40% плазми та 60% еритроцитів. Тому в першу чергу треба відновлювати об’єм циркулюючої плазми. На перший план виходить інфузія плазмозамінників. 58
ЛІКУВАННЯ ГЕМОРАГІЧНОГО ШОКУ èСмерть організму при крововтраті наступає внаслідок втрати 40% плазми та 60% еритроцитів. Тому в першу чергу треба відновлювати об’єм циркулюючої плазми. На перший план виходить інфузія плазмозамінників. 58
 è В основі терапії кожного шоку, крім кардиогеного, лежить інфузійна терапія. Застосування вазопресорів сопроводжується подальшим порушенням мікроциркуляції. Тільки при септичному шоку вже на початковому етапі інфузійна терапія може поєднуватися з норадреналином, а при анафилактичному повинна поєднуватися з адреналином.
è В основі терапії кожного шоку, крім кардиогеного, лежить інфузійна терапія. Застосування вазопресорів сопроводжується подальшим порушенням мікроциркуляції. Тільки при септичному шоку вже на початковому етапі інфузійна терапія може поєднуватися з норадреналином, а при анафилактичному повинна поєднуватися з адреналином.
 Види плазмозамінюючих розчинів Колоїди Кристалоїди Рингер-лактат; 0, 9% та 10%Na. Cl Альбумин Розчини желатина Декстрани Гидроксиетил крохмаль
Види плазмозамінюючих розчинів Колоїди Кристалоїди Рингер-лактат; 0, 9% та 10%Na. Cl Альбумин Розчини желатина Декстрани Гидроксиетил крохмаль
 Ефект нормоволемічної гемодилюції на DO 2 Доставка кисню (DO 2) (%) 120 Нормоволемічна гемодилюція: 100 80 Зменшення гематокриту в умовах нормоволемії з підтртманням доставки кисню 60 40 20 0 0 10 20 30 40 50 60 70 80 (%) Гематокрит Sunder-Plassmann et al. , Anaesthesist (1971) 61
Ефект нормоволемічної гемодилюції на DO 2 Доставка кисню (DO 2) (%) 120 Нормоволемічна гемодилюція: 100 80 Зменшення гематокриту в умовах нормоволемії з підтртманням доставки кисню 60 40 20 0 0 10 20 30 40 50 60 70 80 (%) Гематокрит Sunder-Plassmann et al. , Anaesthesist (1971) 61
 Потреба в кристалоїдах в залежності від об’єму крововтрати Инфузія крист. За умови крововтрати до 30%, об’єм кристалоїдів в 5 раз повинен перевищувати об’єм крововтрати. За умови крововтрати більше 30%, потреба в кристалоїдах збільшується експоненциально. 12 10 8 6 4 10 20 30 40 50 60 крововтрата A. L. Cervera et al. , J. Trauma (1974) 14: 506 -520 70 (%)
Потреба в кристалоїдах в залежності від об’єму крововтрати Инфузія крист. За умови крововтрати до 30%, об’єм кристалоїдів в 5 раз повинен перевищувати об’єм крововтрати. За умови крововтрати більше 30%, потреба в кристалоїдах збільшується експоненциально. 12 10 8 6 4 10 20 30 40 50 60 крововтрата A. L. Cervera et al. , J. Trauma (1974) 14: 506 -520 70 (%)
 Переваги інфузії гіпертонічного розчину (10%) Na. Cl: è малий об’єм; è пролонгований волемічний ефект; è зниження післянавантаження на лівий шлуночок; è збільшення серцевого викиду; è зниження набряку тканин; è збільшення діурезу. Механізм цих ефектів не зовсім зрозумілий. Несприятливий ефект – клітинна дегідратація.
Переваги інфузії гіпертонічного розчину (10%) Na. Cl: è малий об’єм; è пролонгований волемічний ефект; è зниження післянавантаження на лівий шлуночок; è збільшення серцевого викиду; è зниження набряку тканин; è збільшення діурезу. Механізм цих ефектів не зовсім зрозумілий. Несприятливий ефект – клітинна дегідратація.
 Колоїдні розчини Колоїди мають великі молекули та на відміну від кристалоїдів в нормі не проникають крізь ендотелій в інтерстицій, тому колоїди більш ефективно відновлюють об’єм плазми, ніж кристалоїди. Вони підвищують колоїдно-осмотичний (онкотичний) тиск (КОТ) плазми. Чим вище КОТ переливаємого розчину, тим більше збільшується об’єм плазми після його переливання.
Колоїдні розчини Колоїди мають великі молекули та на відміну від кристалоїдів в нормі не проникають крізь ендотелій в інтерстицій, тому колоїди більш ефективно відновлюють об’єм плазми, ніж кристалоїди. Вони підвищують колоїдно-осмотичний (онкотичний) тиск (КОТ) плазми. Чим вище КОТ переливаємого розчину, тим більше збільшується об’єм плазми після його переливання.
 АЛЬБУМИН 25% розчин альбумину, у котрого КОТ 70 мм рт. ст. , збільшує об’єм плазми в 4 – 5 рази більше, ніж перелитий об’єм, так інфузія 100 мл збільшує об’єм плазми на 400 – 500 мл за рахунок поступлення в судинне русло міжклітинної рідини. Його не можна використовувати як єдиний розчин для екстреної ресусцитації гіповолемії, так як може викликати гіперосмолярність плазми та тяжку дегидратацію клітин. При переливанні А немає ризику переносу інфекції; рідко зустрічаються алергичні реакції; коагулопатії можуть зустрічатися, але вони не призводять до тяжкої кровоточивості, однак є данні про несприятливий ефект альбуміна при септичному шоку, небезпечно застосовувати при анафілактичному шоку. Обмежує його застосування велика вартість.
АЛЬБУМИН 25% розчин альбумину, у котрого КОТ 70 мм рт. ст. , збільшує об’єм плазми в 4 – 5 рази більше, ніж перелитий об’єм, так інфузія 100 мл збільшує об’єм плазми на 400 – 500 мл за рахунок поступлення в судинне русло міжклітинної рідини. Його не можна використовувати як єдиний розчин для екстреної ресусцитації гіповолемії, так як може викликати гіперосмолярність плазми та тяжку дегидратацію клітин. При переливанні А немає ризику переносу інфекції; рідко зустрічаються алергичні реакції; коагулопатії можуть зустрічатися, але вони не призводять до тяжкої кровоточивості, однак є данні про несприятливий ефект альбуміна при септичному шоку, небезпечно застосовувати при анафілактичному шоку. Обмежує його застосування велика вартість.
 ДЕКСТРАНИ (реополіглюкин) Мають дозозалежний коагулопатичний ефект, так як пригнічують агрегацію тромбоцитів, знижують активність фактору VIII и активують фібриноліз. Тому максимальна добова доза не повинна перевищувати 20 мл/кг. Кожнодобове введения порівняно великих об’ємів декстрану (500 -1000 мл на добу) створює загрозу підвищення в’язкості плазми та агрегації еритроцитів. Анафілактичні реакції зустрічаються частіше, ніж при застосуванні ГЕК і желатина (приблизно в 5% випадків), однак за останнє десятиріччя частота їх знизилася до 0, 032% за рахунок покращення технології їх виготовлення.
ДЕКСТРАНИ (реополіглюкин) Мають дозозалежний коагулопатичний ефект, так як пригнічують агрегацію тромбоцитів, знижують активність фактору VIII и активують фібриноліз. Тому максимальна добова доза не повинна перевищувати 20 мл/кг. Кожнодобове введения порівняно великих об’ємів декстрану (500 -1000 мл на добу) створює загрозу підвищення в’язкості плазми та агрегації еритроцитів. Анафілактичні реакції зустрічаються частіше, ніж при застосуванні ГЕК і желатина (приблизно в 5% випадків), однак за останнє десятиріччя частота їх знизилася до 0, 032% за рахунок покращення технології їх виготовлення.
 ДЕКСТРАНИ Застовування декстранів затруднює визначення групи крові пацієнта. Вони можуть стати причиною розвитку ГНН, як вважають, за рахунок гіперонкотичного ефекту та зниження клубочкового фільтраційного тиску. Однак цей механізм не доведено й це ускладнення зустрічається в кліниці вкрай рідко.
ДЕКСТРАНИ Застовування декстранів затруднює визначення групи крові пацієнта. Вони можуть стати причиною розвитку ГНН, як вважають, за рахунок гіперонкотичного ефекту та зниження клубочкового фільтраційного тиску. Однак цей механізм не доведено й це ускладнення зустрічається в кліниці вкрай рідко.
 Желатин (гелофузин) Желатин є похідним колагену. Основна перевага розчинів желатину - мінімальний вплив на коагуляцію крові!, але він на протязі меншого терміну утримується в судинному руслі порівняно з розчинами ГЕК.
Желатин (гелофузин) Желатин є похідним колагену. Основна перевага розчинів желатину - мінімальний вплив на коагуляцію крові!, але він на протязі меншого терміну утримується в судинному руслі порівняно з розчинами ГЕК.
 РОЗЧИНИ ГИДРОКСІЕТИЛКРОХМАЛЮ Найбільш широко використовуємі плазмозамінники в світі. Добре підвищують ОЦК, менше ніж декстрани впливають на гемостаз, мають протизапальну дію (покращують функцію ендотелію – потребує додаткових досліджень). Поділяються на 2 -ге (200/0, 5) покоління – рефортан, гекадез, та 3 -є покоління (130/04) – волювен, венофундин.
РОЗЧИНИ ГИДРОКСІЕТИЛКРОХМАЛЮ Найбільш широко використовуємі плазмозамінники в світі. Добре підвищують ОЦК, менше ніж декстрани впливають на гемостаз, мають протизапальну дію (покращують функцію ендотелію – потребує додаткових досліджень). Поділяються на 2 -ге (200/0, 5) покоління – рефортан, гекадез, та 3 -є покоління (130/04) – волювен, венофундин.
 Трансфузійна терапія Переливання еритроцитів спрямовано на відновлення об’єму крові, перфузії тканин і головне - доставку кисню; тромбоцити, плазма та кріопреципитат переливаються з метою забезпечення гемостазу шляхом лікування коагулопатії.
Трансфузійна терапія Переливання еритроцитів спрямовано на відновлення об’єму крові, перфузії тканин і головне - доставку кисню; тромбоцити, плазма та кріопреципитат переливаються з метою забезпечення гемостазу шляхом лікування коагулопатії.
 Інфекційні ускладнення гемотрансфузій èПередача вірусної (ВІЛ, гепатити, цитомегаловірус), бактеріальної та паразитарної інфекції
Інфекційні ускладнення гемотрансфузій èПередача вірусної (ВІЛ, гепатити, цитомегаловірус), бактеріальної та паразитарної інфекції
 Неінфекційні ускладнення гемотрансфузій è è è è è 1. Реакції на переливання крові (гемолитичні при переливанні несумісної крові, лихоманка, септичні та алергичні), 2. TRALI, 3. Циркуляторне перенавантаження, 4. Посттрансфузійна пурпура, 5. Реакція трансплантат проти хозяїна, 6. Мікрохимеризм, 7. Іммуномодуляція, 8. Метаболічні порушення (гіперкаліємія, ацидоз) 9. Коагулопатія, 10. Перенавантаження залізом.
Неінфекційні ускладнення гемотрансфузій è è è è è 1. Реакції на переливання крові (гемолитичні при переливанні несумісної крові, лихоманка, септичні та алергичні), 2. TRALI, 3. Циркуляторне перенавантаження, 4. Посттрансфузійна пурпура, 5. Реакція трансплантат проти хозяїна, 6. Мікрохимеризм, 7. Іммуномодуляція, 8. Метаболічні порушення (гіперкаліємія, ацидоз) 9. Коагулопатія, 10. Перенавантаження залізом.
 Ускладнення трансфузій Переливання крові є незазалежним і значним фактором ризику прогресування рака, викликая 4 -хразове збільшення рецидивів пухлин легень і 2 -хразове показника летальності. (Atzil S, Arad M, Glasner A, et al. Anesthesiology. 2008 Dec; 109(6): 989 -97). Терміни зберігання крові були критичним визначаючим чинником цих ефектів. Цікаво, що термін зберігання еритроцитів (9 діб і більше), а не лейкоцити були відповідальні за ці ефекти. . è Ризик смерти підвищувався на 3, 5% на кожну перелиту дозу СЗП. (Bochicchio GV, Napolitano L, Joshi M. World J Surg. 2008 Oct; 32(10): 2185 -9).
Ускладнення трансфузій Переливання крові є незазалежним і значним фактором ризику прогресування рака, викликая 4 -хразове збільшення рецидивів пухлин легень і 2 -хразове показника летальності. (Atzil S, Arad M, Glasner A, et al. Anesthesiology. 2008 Dec; 109(6): 989 -97). Терміни зберігання крові були критичним визначаючим чинником цих ефектів. Цікаво, що термін зберігання еритроцитів (9 діб і більше), а не лейкоцити були відповідальні за ці ефекти. . è Ризик смерти підвищувався на 3, 5% на кожну перелиту дозу СЗП. (Bochicchio GV, Napolitano L, Joshi M. World J Surg. 2008 Oct; 32(10): 2185 -9).
 Показання до гемотрансфузій Ліберальна стратегія: показання за умови рівня Нв < 100 – 110 г/л; Рестриктивна (обмежувальна): показання - Нв < 70 – 90 г/л Результат: 30 -добова летальність була достовірно нижче в рестриктивній групі (хворі за APACHE II < 20, рік < 55 лет) (Hebert et al. , 1999) У хворих з ІХС, порушеннями церебрального кровобігу оптимальним рівнем Нв буде 90 – 100 г/л У хворих з рівнем Нв > 100 г/л показанням до гемотрансфузій є тільки масивна кровотеча, яку не можна зупинити (або тяжка коагулопатія)
Показання до гемотрансфузій Ліберальна стратегія: показання за умови рівня Нв < 100 – 110 г/л; Рестриктивна (обмежувальна): показання - Нв < 70 – 90 г/л Результат: 30 -добова летальність була достовірно нижче в рестриктивній групі (хворі за APACHE II < 20, рік < 55 лет) (Hebert et al. , 1999) У хворих з ІХС, порушеннями церебрального кровобігу оптимальним рівнем Нв буде 90 – 100 г/л У хворих з рівнем Нв > 100 г/л показанням до гемотрансфузій є тільки масивна кровотеча, яку не можна зупинити (або тяжка коагулопатія)
 Показання до переливання СЗП, тромбоцитів та кріопреципитату До переливання СЗП: коагулопатія зі зниженням вмісту факторів згортання за умови збільшення протромбинового часу, а. ЧТЧ в поєднанні з клінічними ознаками кровоточивості (Б. Р. Гельфанд с соавт. , 2007). До переливання тромбоцитів: тромбоцитопенія < 30 000/мл та < 50 000/мл при ознаках кровоточивості è До переливання кріпреципитату: гіпофібронегенемія
Показання до переливання СЗП, тромбоцитів та кріопреципитату До переливання СЗП: коагулопатія зі зниженням вмісту факторів згортання за умови збільшення протромбинового часу, а. ЧТЧ в поєднанні з клінічними ознаками кровоточивості (Б. Р. Гельфанд с соавт. , 2007). До переливання тромбоцитів: тромбоцитопенія < 30 000/мл та < 50 000/мл при ознаках кровоточивості è До переливання кріпреципитату: гіпофібронегенемія
 Кардиогений шок В основі лежить зниження насосної функції серця. Этіологія: ішемія міокарду; порушення клапаного апарату серця; міокардит; дилатаційна кардіоміопатія; гострі порушення ритму серця. 76
Кардиогений шок В основі лежить зниження насосної функції серця. Этіологія: ішемія міокарду; порушення клапаного апарату серця; міокардит; дилатаційна кардіоміопатія; гострі порушення ритму серця. 76
 Кардиогений шок Похідні гемодинамики: СІ < 2, 2 л/мин/м 2; ТЗЛА > 15 мм рт. ст. ; сис. АТ < 90 мм рт. ст чи САТ на 30 мм рт. ст. нижче вихідного рівня. 77
Кардиогений шок Похідні гемодинамики: СІ < 2, 2 л/мин/м 2; ТЗЛА > 15 мм рт. ст. ; сис. АТ < 90 мм рт. ст чи САТ на 30 мм рт. ст. нижче вихідного рівня. 77
 ХИБНЕ КОЛО ПІД ЧАС КАРДИОГЕНОГО ШОКУ 78
ХИБНЕ КОЛО ПІД ЧАС КАРДИОГЕНОГО ШОКУ 78
 Терапія КШ è ІНОДИЛАТАТОРИ (добутамін, амринон, левосимендан, допексамин) або кардітоники в поєднанні з вазодилататорами (дофамін з нітрогліцерином), на тлі етіотропної терапії: при ГІМ – це тромболізіс, ангіоплатика венечних артерій, стентування; антиаритмічні засоби; хірургичне втручання. è Головна мета – підвищити скоротливість міокарду за умови зменьшення роботи серця. è У звязку з швидким розвитком набряку легень та гіпоксемії, необхідна оксигенотерапія і, часто, ШВЛ. 79
Терапія КШ è ІНОДИЛАТАТОРИ (добутамін, амринон, левосимендан, допексамин) або кардітоники в поєднанні з вазодилататорами (дофамін з нітрогліцерином), на тлі етіотропної терапії: при ГІМ – це тромболізіс, ангіоплатика венечних артерій, стентування; антиаритмічні засоби; хірургичне втручання. è Головна мета – підвищити скоротливість міокарду за умови зменьшення роботи серця. è У звязку з швидким розвитком набряку легень та гіпоксемії, необхідна оксигенотерапія і, часто, ШВЛ. 79
 Терапія КШ è За відсутності ефекту від консервативної терапії показані методи допоміжного кровообігу – інтрааортальна балонна контрпульсація та екстренна операція по покращенню коронарної перфузії. Останнім часом у випадках тяжкого КШ почали використовувати механічну циркуляторну підтримку та трансплантацію серця. 80
Терапія КШ è За відсутності ефекту від консервативної терапії показані методи допоміжного кровообігу – інтрааортальна балонна контрпульсація та екстренна операція по покращенню коронарної перфузії. Останнім часом у випадках тяжкого КШ почали використовувати механічну циркуляторну підтримку та трансплантацію серця. 80
 Дистрибутивний шок (септичний, анафілактичний, нейрогений) è В основі лежить перерозподіл рідини, як у внутришньосудинному секторі, так і вихід внутрішньосудинної рідини в інтерстицій внаслідок порушення функції ендотелію. 81
Дистрибутивний шок (септичний, анафілактичний, нейрогений) è В основі лежить перерозподіл рідини, як у внутришньосудинному секторі, так і вихід внутрішньосудинної рідини в інтерстицій внаслідок порушення функції ендотелію. 81
 Септичний шок » Патогенез è Інфекційні агенти та їх продукти (ЛПС) поєднуються з рецепторами кліток (насамперед макрофагів та лейкоцитів), які починають утворювати велику кількість прозапальних медиаторів: домінують TNF та IL-1) запускається ССЗВ. è Тяжкість патологічного процесу при септичному шоку часто більше залежить від інтенсивності відповіді организму на інфекцію, ніж від прямої дії самого етіологічного чинника. 82
Септичний шок » Патогенез è Інфекційні агенти та їх продукти (ЛПС) поєднуються з рецепторами кліток (насамперед макрофагів та лейкоцитів), які починають утворювати велику кількість прозапальних медиаторів: домінують TNF та IL-1) запускається ССЗВ. è Тяжкість патологічного процесу при септичному шоку часто більше залежить від інтенсивності відповіді организму на інфекцію, ніж від прямої дії самого етіологічного чинника. 82
 Септичний шок. Клініка è Гіпердинамічна фаза: лихоманка; тепла, розова шкіра; зниження судинного опору; нормальний чи збільшений серцевий індекс, завдяки цьому може на нормальному рівні підтримуватися АТ; помірна тахікардія; задишка; нормальний діурез. è Гіподинамічна фаза: порушення свідомості; тяжкі порушення перфузії, блідність та цианоз шкіри; зниження серцевого індексу та збільшення судинного опору; тахікардія, артериальна гіпотензія; задишка, гіпоксемія. 83
Септичний шок. Клініка è Гіпердинамічна фаза: лихоманка; тепла, розова шкіра; зниження судинного опору; нормальний чи збільшений серцевий індекс, завдяки цьому може на нормальному рівні підтримуватися АТ; помірна тахікардія; задишка; нормальний діурез. è Гіподинамічна фаза: порушення свідомості; тяжкі порушення перфузії, блідність та цианоз шкіри; зниження серцевого індексу та збільшення судинного опору; тахікардія, артериальна гіпотензія; задишка, гіпоксемія. 83
 Терапія септичного шоку 1. Санація інфекційного вогнища è 2. Антибіотикотерапія з урахуванням чутливості збудників інфекції è 3. Корекція гіповолемії внутрішньовенними інфузіями рідини. è 4. Модуляція тонуса судин: симпатомиметики; досліджуются вазопресин, інгібитори NO-синтетаз, метиленового синього. è 4. Невеликі дози глюкокортикоїдів (до 300 мг гідрокортизону/добу). è 5. Симптоматична терапія порушень функції інших органів і систем. è 6. Досліджується ефективность экстракорпоральних методів детоксикації (гемофільтрація, ультрафільтрація). è 7. Активований протеїн С, антитромбин. è 84
Терапія септичного шоку 1. Санація інфекційного вогнища è 2. Антибіотикотерапія з урахуванням чутливості збудників інфекції è 3. Корекція гіповолемії внутрішньовенними інфузіями рідини. è 4. Модуляція тонуса судин: симпатомиметики; досліджуются вазопресин, інгібитори NO-синтетаз, метиленового синього. è 4. Невеликі дози глюкокортикоїдів (до 300 мг гідрокортизону/добу). è 5. Симптоматична терапія порушень функції інших органів і систем. è 6. Досліджується ефективность экстракорпоральних методів детоксикації (гемофільтрація, ультрафільтрація). è 7. Активований протеїн С, антитромбин. è 84
 Анафілактичний шок Це вид алергичної реакції негайного типу, яка виникає на повторне попадання в організм алергену та супроводжується розладами функції ЦНС, артеріальною гіпотензією, бронхіолоспазмом, висипаннями на шкірі, можливми диспепсичними явищами. Анафілаксія – це патологічна реакція організму на антиген, до якого раніше цей організм було сенсібілізовано. Антиген поєднується з імуноглобуліном Є на мембранах циркулюючих базофілів та гладких кліток з висвободженням біоактивних речовин (гістамін, серотонін, еозинофільний хемотаксичний фактор анафілаксії, нейтрофильный хемотаксичний фактор, гепарин, фактор, активуючий тромбоцити, эйкосаноїди, котрі стимулюують висвободження вторинних медіаторів анафілаксії (лімфокини, ІЛ-1, лизосомальні энзіми, анафілотоксини (С 3 а та С 5 а). 85
Анафілактичний шок Це вид алергичної реакції негайного типу, яка виникає на повторне попадання в організм алергену та супроводжується розладами функції ЦНС, артеріальною гіпотензією, бронхіолоспазмом, висипаннями на шкірі, можливми диспепсичними явищами. Анафілаксія – це патологічна реакція організму на антиген, до якого раніше цей організм було сенсібілізовано. Антиген поєднується з імуноглобуліном Є на мембранах циркулюючих базофілів та гладких кліток з висвободженням біоактивних речовин (гістамін, серотонін, еозинофільний хемотаксичний фактор анафілаксії, нейтрофильный хемотаксичний фактор, гепарин, фактор, активуючий тромбоцити, эйкосаноїди, котрі стимулюують висвободження вторинних медіаторів анафілаксії (лімфокини, ІЛ-1, лизосомальні энзіми, анафілотоксини (С 3 а та С 5 а). 85
 Анафілактичний шок. Клініка Латентний період з моменту поступлення антигену до початку кліничних проявів дорівнює від кількох до 30 хв, а при миттевій формі АШ може швидко наступити зупинка кровообігу. Чим корочше інкубаційний період, тим, як правило, більш тяжкий АШ. Продромальними симптомами можуть бути свербіж, гіперемія слизових оболонок. Основними кліничними проявами АШ є артеріальна гіпотензія, бронхіолоспазм, порушення свідомості, можливий спастичний біль в животі. При цьому більшість пацієнтів (до 70%) у випадку летального кінця гине від респираторних порушень, і тільки 24% - від кардіоваскулярних ускладнень. 86
Анафілактичний шок. Клініка Латентний період з моменту поступлення антигену до початку кліничних проявів дорівнює від кількох до 30 хв, а при миттевій формі АШ може швидко наступити зупинка кровообігу. Чим корочше інкубаційний період, тим, як правило, більш тяжкий АШ. Продромальними симптомами можуть бути свербіж, гіперемія слизових оболонок. Основними кліничними проявами АШ є артеріальна гіпотензія, бронхіолоспазм, порушення свідомості, можливий спастичний біль в животі. При цьому більшість пацієнтів (до 70%) у випадку летального кінця гине від респираторних порушень, і тільки 24% - від кардіоваскулярних ускладнень. 86
 Анафілактичний шок. Лікування Адреналін : у пацієнтів зі значною артеріальною гіпотензією в/в 0, 3 - 0, 5 мг, попри необхідність інфузія 1 – 4 мкг/хв (САТ ≥ 60 мм рт. ст. ). У разі значної тахікардії - інфузія норадреналіну (1 – 4 мкг/хв) або фенілефрину (мезатон) (20 мкг/хв). При незначній гіпотензії А (0, 5 – 1, 0 мг) можно вводити під шкіру, а у випадку відсутності венозного доступу – інтратрахеально. 2. Массивна інфузійна терапія 3. Кортикостероїди (до 16 – 20 мг дексаметазону) 4. Антишгістамінні 87 1.
Анафілактичний шок. Лікування Адреналін : у пацієнтів зі значною артеріальною гіпотензією в/в 0, 3 - 0, 5 мг, попри необхідність інфузія 1 – 4 мкг/хв (САТ ≥ 60 мм рт. ст. ). У разі значної тахікардії - інфузія норадреналіну (1 – 4 мкг/хв) або фенілефрину (мезатон) (20 мкг/хв). При незначній гіпотензії А (0, 5 – 1, 0 мг) можно вводити під шкіру, а у випадку відсутності венозного доступу – інтратрахеально. 2. Массивна інфузійна терапія 3. Кортикостероїди (до 16 – 20 мг дексаметазону) 4. Антишгістамінні 87 1.
 ОБСТРУКТИВНИЙ ШОК » Патогенез: Неадекватний серцевий викид внаслідок гострої обструкції магистральних судин чи компрессії міокарду. è Этіологія: тампонада сердца, масивна ЕЛА, напружений пневмоторакс, гіпертрофічна обструктивна кардіоміопатія, легенева гіпертензія, міксома передсердя, коарктація аорти. Лікування: етіологічне è 88
ОБСТРУКТИВНИЙ ШОК » Патогенез: Неадекватний серцевий викид внаслідок гострої обструкції магистральних судин чи компрессії міокарду. è Этіологія: тампонада сердца, масивна ЕЛА, напружений пневмоторакс, гіпертрофічна обструктивна кардіоміопатія, легенева гіпертензія, міксома передсердя, коарктація аорти. Лікування: етіологічне è 88
 МАЮ НАДІЮ, ЩО ЛЕКЦІЯ БУЛА КОРИСНОЮ. ДЯКУЮ ЗА УВАГУ! 89
МАЮ НАДІЮ, ЩО ЛЕКЦІЯ БУЛА КОРИСНОЮ. ДЯКУЮ ЗА УВАГУ! 89


