АБ в хирургии для кафедры ЧелГМА 09.2014.pptx
- Количество слайдов: 188

ШКОЛА «АНТИМИКРОБНАЯ ТЕРАПИЯ В ХИРУРГИЧЕСКОМ СТАЦИОНАРЕ В СОВРЕМЕННЫХ УСЛОВИЯХ» Шаповалова Ю. С. , к. м. н. , главный клинический фармаколог ЮУЖД


www. escmid. org ESCMID http: //jac. oxfordjournals. org/ Journal of Antimicrobial Chemotherapy http: //aac. asm. org/ Antimicrobial Agents and Chemotherapy http: //cid. oxfordjournals. org/ Clinical Infectious Diseases

http: //www. elsevier. com/journals/subjects/medicine http: //www. ijidonline. com/home International Journal of Infectious Diseases http: //onlinelibrary. wiley. com/ New microbes and new infections

Часть 1 Проблемы резистентности микроорганизмов к АБ

Микроорганизмы – возбудители инфекций в хирургии Грам (+) аэробы • Staphylococcus • Streptococcus • Enterococcus Анаэробы • Bacteroides • Clostridium Грам (–) аэробы • Enterobacteriaceae • Escherichia Enterobacter • Klebsiella Citrobacter • Proteus Morganella Serracia Неферментирующие грам (-) энтеробактерии • Pseudomonas • Acinetobacter • Burkholderia • Stenotrophomonas

Особенности формирования антибиотикорезистентности в РФ (1) • Избыточное потребление АМП в ОРИТ – США – 0, 8 доз на 1 чел. в сутки – РФ – 1, 5 - 2, 5 дозы на 1 чел. в сутки

Особенности формирования антибиотикорезистентности в РФ (2) • Назначение АБ без учета спектра природной активности (АГ при внебольничной пневмонии) • Назначение АБ без учета данных о приобретенной резистентности • Недостаточные дозы • Недостаточный курс (клиническое/ бактериологическое выздоровление) • Режим дозирования (цефотаксим 2 р/сут)

Факторы риска наличия проблемных/ резистентных возбудителей • Госпитализация в предшествующие 90 дней • Перевод из другого стационара • АБТ в предшествующие 90 дней • Релапаротомии • Иммуносупрессия

Новые антибиотики vs. рост резистентности Bad Bugs, No Drugs: No ESCAPE? Количество новых антибиотиков, шт. Количество новых молекул антибиотиков, одобренных в США 1983– 2007 Boucher at al. Clinical Infectious Diseases 2009; 48: 1– 12

Проблема: инфекционный контроль в стационаре




Терминология • МПК 90 • Механизмы резистентности • Ассоциированная резистентность • Перекрестная R • Инокулюм – эффект

Механизмы устойчивости бактерий к АБ 1. Ферментативная инактивация антибиотика – Бета-лактамазы – Аминогликозид-модифицирующие ферменты 2. Модификация мишени действия – Пенициллинсвязывающие белки (ПСБ) • Устойчивость стафилококков к оксациллину • Устойчивость пневмококков к пенициллину 3. Нарушение проницаемости внешних структур микробной клетки 4. Активное выведение антибиотика из микробной клетки (эффлюкс)

S. aureus – эволюция резистентности Устойчивость к бета-лактамам • 50 -е - продукция плазмидных бета-лактамаз класса А • 60 -е – MRSA (ORSA – oxacillin resistant S. aureus) модифицированный пенициллинсвязывающий белок ПСБ 2 а • • 1941 – нет 1945 – первый штамм, продуцирующий БЛ 1955 – 50% штаммов устойчивы 2000 – 95% штаммов устойчивы

Устойчивость грамположительных бактерий к бензилпенициллину • • Пневмококки (модификация ПСБ) 1960 -е годы – первый штамм 1990 – около 1% 2003 – 20 -60% Пиогенный стрептококк Устойчивость не документирована

Бензилпенициллин (2008 г. ) • Стрептококковые инфекции Ки. МТ – Рожа • Клостридиальная инфекция – Газовая гангрена • Менингит (N. meningitidis)

К этим терминам придется привыкать MRSA Methicillin-Resistant Staphylococcus Aureus Метициллин-резистентный стафилококк VRE Vancomycin-Resistant Enterococcus Ванкомицин-резистентный энтерококк ESBL (БЛРС) Extended-Spectrum Beta-Lactamases Бета-лактамазы расширенного спектра Amp. C Хромосомные бета-лактамазы класса С MBL Metallo-Beta-Lactamases Металло-бета-лактамазы Pan-Resistant Панрезистентность

Распространенность БЛРС среди Enterobacteriaceae PEARLS 2001– 2002* Россия 2002 -04**: Австрия 3. 2% 52. 4% Германия 2. 6% Голландия 2. 0% Бельгия 10. 1% Швейцария 3. 4% Франция 5. 2% 2006 -08***: 70. 1% БЛРС, % Португалия 15. 5% Испания 4. 9% Словения 7. 7% Италия 14. 3% Турция 13. 0% Греция 27. 4% Хорватия 15. 0% 50 -70 27. 4 13. 0 -15. 5 10. 1 4. 9 -7. 7 3. 2 -3. 4 2. 0 -2. 6 * S. K. Bouchillon et al. , Int J Antimicrob Agents 2004 (24): 119– 24 **M. Edelstein et al. , ICAAC, 2004, Washington, P: C 2 -1331; ***Исследование РЕВАНШ, 2006 -08

ЛОЖНАЯ ЧУВСТВИТЕЛЬНОСТЬ ESBL+ ШТАММОВ К ЦС III-IV IN VITRO ESBL+ штаммы (n=720, РЕВАНШ 2006 -07) Критерии CLSI-2007 (Ч 8 мг/л) Как часто Вы получаете подобный результат для E. coli или K. pneumoniae из микробиологической лаборатории? Цефотаксим: Р Цефтазидим: Ч Цефепим: Ч Может ли Ваша микробиологическая лаборатория выявлять ESBL?

Что надо знать о БЛРС ? • Возможны ошибки в детекции БЛРС (в т. ч. автоматическими анализаторами) в присутствии Amp. C • Правило 1: При устойчивости энтеробактерий хотя бы к одному из цефалоспоринов III-IV поколения, считать вероятной продукцию БЛРС и трактовать как устойчивость ко всем цефалоспоринам – Часто выявляется устойчивость к другим классам АБП • Правило 2: Считать вероятными продуцентами БЛРС, наряду с нозокомиальными штаммами E. coli, Klebsiella spp. , P. mirabilis, другие энтеробактерии – Enterobacter spp. , P. vulgaris, Serratia spp


Контроль возникновения и распространения устойчивых штаммов в стационаре • Ограничение использования антибиотиков без обоснованных показаний • Профилактическое назначение антибиотиков оправдано только в качестве предоперационной профилактики (1 -2 дозы) • Не доказана эффективность антибиотикопрофилактики: – – У пациентов в ОРИТ, на ИВЛ После хирургических вмешательств При бессимптомной бактериурии Антифунгальная профилактика применении антибиотиков широкого спектра

Часть 2 Классификация АМП и АБ

Классификация антимикробных препаратов • Антибактериальные препараты (АБ) • Противогрибковые препараты • Противопротозойные препараты • Противотуберкулезные препараты • Противопаразитарные препараты

Классификация антибиотиков (1) 1. Бета-лактамные АБ • Пенициллины • Цефалоспорины (ЦС) • Монобактамы • Карбапенемы 2. Аминогликозиды 3. Макролиды 4. Фторхинолоны 5. Гликопептиды

Классификация антибиотиков (2) 6. Линкозамиды 7. Тетрациклины 8. Оксазолидиноны (линезолид) 9. Липопептиды (даптомицин) 10. Глицилциклины (тигециклин) 11. Сульфаниламиды (ко-тримоксазол) 12. Прочие (фосфомицин)

Отличительные особенности антибиотиков как лекарственных средств • Мишень действия – микроорганизм • Снижение активности и эффективности со временем

Антистафилококковые пенициллины Оксациллин • Эталон определения чувствительности стафилококков к бета-лактамам • Эффективен только против MSSA • MSSE – умеренная активность • Показание – подтвержденные MSSA-инфекции • Дозировка – 8 – 12 г/сут в 4 -6 введений • Всасывание в жкт 20 - 30%, пища биодоступность

Пенициллины расширенного спектра Ампициллин и амоксициллин • Спектр активности – E. coli, P. mirabilis, H. influenzae • Enterococcus faecalis, листерии • Показания -бак. менингит, бак. эндокардит, инфекции ЖВП, ? интраабоминальные послеоперационные • Дозировка: в/в, в/м 8 – 12 г/сут в 4 введения • Всасывание ампициллина в жкт 30 - 40%, пища биодоступность ампициллина в 2 раза

Ингибитор-защищенные бета-лактамы Амоксициллин/клавуланат Амоксициллин/сульбактам Тикарциллин/ клавуланат Пиперациллин/ тазобактам Цефоперазон/сульбактам Внебольничные инфекции Нозокомиальные инфекции Абдоминальные Кожи и мягких тканей Респираторные Абдоминальные Пневмония

АМО/КК • Сильный ингибитор и сильный индуктор БЛРС • Только в/в и per os • 1, 2 г х 3 – 4 р/сут АМО/СБ • Слабый ингибитор и слабый индуктор БЛРС • В/в, в/м и per os • 1, 5 г х 3 р/сут • Acinetobacter spp. ++

Антимикробная активность цефалоспоринов • I поколение – цефазолин • II поколение – цефуроксим, – цефокситин ограниченный спектр преим. Грам(+) • III поколение – цефотаксим, цефтриаксон, цефтазидим, цефоперазон широкий спектр • IV поколение – Цефепим, Цефпиром • V поколение - цефтаролин Грам(-) и Грам(+)

Цефалоспорины I-II поколения • Цефалоспорины I: цефазолин § Staphylococci (MSSA) • Streptococci • Цефалоспорины II: цефуроксим + Haemophilus influenzae Staphylococci: ЦС I = ЦС II Streptococci: ЦС I ≤ ЦС II (< Ампициллин) E. coli, Proteus: ЦС I < ЦС II (< ЦС III-IV)

Цефазолин, применение • Периоперационная антибиотикопрофилактика • Документированные MSSA – инфекции (S. aureus, чувствительный к оксациллину): ИКМТ, сепсис

Цефокситин (Анаэроцеф) • ЦС II с антианаэробной активностью • Стабилен к бета-лактамазам класса А и D (ТЕМ-1, ТЕМ-2, SHV-1) • Активен в гное • Дети с 0 дней

Цефокситин (Анаэроцеф) Показания: • Периоперационная АБ-профилактика в акушерстве, гинекологии, хирургии органов брюшной и грудной полостей • Внебольничные интраабдоминальные и гинекологические инфекции • Монотерапия внебольничных инфекций НДП, плевры, МВП, ИКМП (диабетическая стопа, ишемия)

Цефалоспорины III поколения Группа IIIа «Базовые» Цефотаксим Цефтриаксон Группа IIIb «Антисинегнойные» Цефтазидим Цефоперазон Enterobacteriaceae + Streptococci (= Амп) + P. aeruginosa +/- S. aureus (< Окс, ЦСI-II) +/- Acinetobacter Цефалоспорины III гидролизуются бета-лактамазами Грам(-) бактерий: Класса А – БЛРС Класса С – Амр. С

Цефалоспорины IV поколения Цефепим • Спектр активности сходен с цефалоспоринами III = цефотаксим, цефтриаксон против стрептококков = цефтазидим против P. aeruginosa • В меньшей степени вызывает селекцию БЛРС Цефпиром • эффективен при сниженной чувствительности к цефепиму

Проблема: БЛРС (ESBL) • РФ занимает 1 -е место в мире по продукции БЛРС • 2008 год: устойчивость м/о – продуцентов БЛРС – к цефепиму 60% – к цефтазидиму 70%

Цефоперазон/сульбактам (Сульперазон, Сульперацеф) Клиническое значение комбинации • Расширение клинической активности цефоперазона на штаммы Грам(-) бактерий, продуцирующих БЛРС и устойчивых к незащищенным цефалоспоринам III-IV • Возможность применения при госпитальных в современных условиях часто неуспех при госпитальных инфекциях, –вызванных не только P. aeruginosa • Появление клинической активности против анаэробов – возможность применения в режиме монотерапии при смешанных инфекциях (интраабдоминальные, раневые инфекции)

Активность ЦС в отношении Ps. aeruginosa Цефпиром > цефепим = цефтазидим > цефоперазон = ЦП/СБ

Проникновение цефалоспоринов в желчь Макс. концентрации цефоперазона (2 г ) в желчи >3000 мг/л

Классификация карбапенемов • Группа 1 – антипсевдомонадные – Имипенем (1986) – Меропенем (1995) – Дорипенем (2008) • Группа 2 – без антипсевдомонадной активности – Эртапенем (2002)

Эртапенем (ИНВАНЗ) • Карбапенем без антисинегнойной активности • Тяжелые внебольничные/ ранние госпитальные инфекции • 1 г х 1 р/сут в/в, в/м
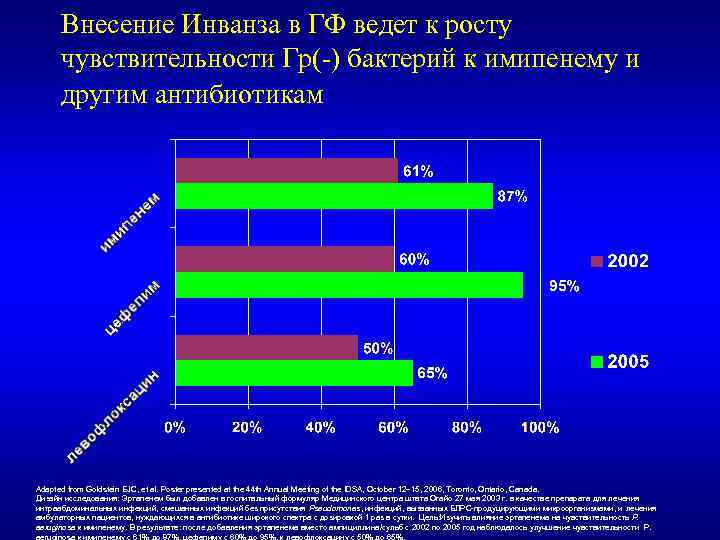
Внесение Инванза в ГФ ведет к росту чувствительности Гр(-) бактерий к имипенему и другим антибиотикам Adapted from Goldstein EJC, et al. Poster presented at the 44 th Annual Meeting of the IDSA, October 12– 15, 2006, Toronto, Ontario, Canada. Дизайн исследования: Эртапенем был добавлен в госпитальный формуляр Медицинского центра штата Огайо 27 мая 2003 г. в качестве препарата для лечения интраабдоминальных инфекций, смешанных инфекций без присутствия Pseudomonas, инфекций, вызванных БЛРС-продуцирующими микроорганизмами, и лечения амбулаторных пациентов, нуждающихся в антибиотике широкого спектра с дозировкой 1 раз в сутки. Цель: Изучить влияние эртапенема на чувствительность P. aeruginosa к имипенему. В результате: после добавления эртапенема вместо ампициллина/сульб с 2002 по 2005 год наблюдалось улучшение чувствительности P. aeruginosa к имипенему с 61% до 87%, цефепиму с 60% до 95%, к левофлоксацину с 50% до 65%.

Карбапенемы: имипенем, меропенем, дорипенем • Наиболее широкий спектр антимикробной активности – Практически 100% чувствительность Enterobacteriaceae – Чувствительность P. aeruginosa и Acinetobacter варьирует • Увеличение использования приводит к: – Элиминации резистентных штаммов Enterobacteriaceae (прежде всего, продуцентов БЛРС и Амр. С бета-лактамаз) – Возможна селекция полирезистентных штаммов P. aeruginosa • Сильные индукторы бета-лактамаз • В РФ зарегистрированы штаммы Klebsiella и P. aeruginosa, продуцирующие металло-энзимы класса В и группы 2 f (VIM) – устойчивость к карбапенемам

Устойчивость к карбапенемам Грам(+) • S. aureus: перекрестная • Streptococci: не документирована Грам(-) • E. coli, P. mirabilis, анаэробы – нет • Acinetobacter - перекрестная • P. aeruginosa: разные механизмы – разный уровень – В среднем к МЕРО и ДОРИ на 5 -10% ниже [Turner P. , 2006] • У дорипенема наиболее высокая природная активность

Развитие резистентности P. aeruginosa к карбапенемам • Имипенем (тиенам) – Утрата Opr. D (пориновый белок - проникновение) • Частота мутаций 10 -7 • МПК увеличивается с 1 -2 до 8 -32 мкг/мл и выше – Клиническая неэффективность • Меропенем (меронем), Дорипенем (дорипрекс) – Активация систем активного выведения (эффлюкс) • МПК увеличивается с 0, 12 -0, 5 до 2 -4 мкг/мл – Клиническая эффективность сохраняется – Потеря Opr. D + активное выведение (эффлюкс) • Вероятность одновременной мутации 10 -14 [Livermore DM. JAC 2001; 47: 247]

Влияние типа мутации на развитие резистентности P. aeruginosa - Для развития устойчивости к Меронему необходимо сочетание двух механизмов мутации (более редкое и сложнодостижимое событие) -Для развития устойчивости к имипинему достаточно только одного механизма (наиболее часто индуцируемое событие) Вывод: Меронем обладает наибольшим потенциалом в преодолении резистентности проблемных патогенов Яковлев С. В. «Фарматека» № 8/9 (2007) P. Turner, Diagnostic Microbilolgy and Inf. Dis 2004; 39; 31 -37

Современное значение антисинегнойных карбапенемов • Эмпирическая терапия – – Госпитальный перитонит Холангит, билиарный сепсис Инфекции pancreas Пациенты с высоким риском смерти • Этиотропная терапия – Инфекции, вызванные БЛРС-продуцентами – Acinetobacter spp. , P. aeruginosa

Фармакодинамически эквивалентные режимы дозирования меропенема и имипенема • Меропенем 1, 5 г/сут = имипенем 2 г/сут • Меропенем 3 г/сут = имипенем 4 г/сут

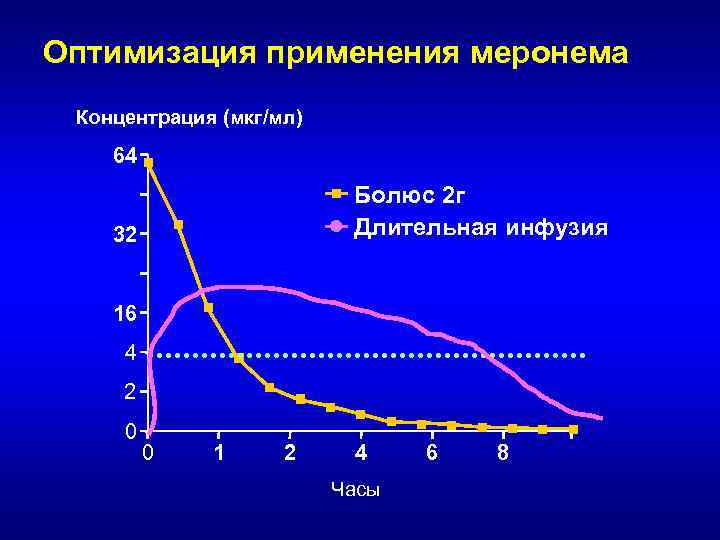
Оптимизация фармакодинамических параметров карбапенемов • Увеличение дозы при сохранении интервалов введения • Сокращение интервалов между введениями (более частое введение) при сохранении суточной дозы • Применение продолжительной внутривенной инфузии

Оптимизация применения меронема • при МПК = 4 мкг/мл : – 30 -минутная инфузия: • 500 мг - %T>МПК ~ 30% • 2000 мг - %T>МПК ~ 58% – 3 -часовая инфузия: • 500 мг - %T>МПК ~ 43% • 2000 мг - %T>МПК ~ 73% • при МПК = 16 мкг/мл: – 30 -минутная инфузия 2000 мг %T>МПК ~ 32% – 3 -часовая инфузия 2000 мг %T>МПК ~ 48% • Вывод: При 3 часовой инфузии 2000 мг препарата бактерицидный эффект достигается в отношении возбудителей, которые рассматриваются как резистентные к меропенему!!!

Обоснование продолжительной инфузии меропенема: стабильность в разных растворителях • Физиологический (0, 9%) раствор при комнатной температуре – 4 -10 часов • Раствор Рингер-лактат - 4 -8 часов • Раствор глюкозы 5% - 1 -3 часа • Термостатирующая система (+4 о. С) – 24 часа

Оптимизация применения бета-лактамных антибиотиков • В отношении P. aeruginosa с МПК 0. 25 -64 мкг/мл высокая доза в сочетании с продолжительной инфузией меропенема приводит к возрастанию вероятности подавления флоры (данных о достоверности нет). Dandekar PK, Maglio D, Sutherland CA, et al. Pharmacokinetics of meropenem 0. 5 and 2 g every 8 hours as a 3 -hour infusion. Pharmacotherapy. 2003; 23: 988 -991.

Оптимизация применения меронема • В отношении P. aeruginosa с МПК 64 мкг/мл высокая доза (2 грамма) болюсом в сочетании с продолжительной инфузией меропенема 6 г/сут приводит к возрастанию вероятности подавления флоры (данных о достоверности нет). Dandekar PK, Maglio D, Sutherland CA, et al. Pharmacokinetics of meropenem 0. 5 and 2 g every 8 hours as a 3 -hour infusion. Pharmacotherapy. 2003; 23: 988 -991.
Оптимизация применения меронема Концентрация (мкг/мл) 64 Болюс 2 г Длительная инфузия 32 16 4 2 0 0 1 2 4 Часы 6 8

Объективные причины повышения потребности в карбапенемах (1) • По распространенности БЛРС в ОРИТ РФ на 1 -м месте • Увеличение доли СТХ-М БЛРС и снижение чувствительности БЛРС-продуцентов к альтернативным АБ • БЛРС R к ЦС + к АГ и ФХ • СТХ-М БЛРС R ко всем альтернативным группам АБ

Объективные причины повышения потребности в карбапенемах (2) • «Выход» БЛРС за пределы ОРИТ • значения ацинетобактерий в этиологии госпитальных инфекций (3 – 4 место) Карбапенемы – средства стартовой эмпирической терапии госпитальных инфекций

БЛРС: возможности лечения • Наиболее надежны карбапенемы – Фармакодинамически обоснован режим дозирования 1. 5 г в сутки § меропенем = дорипенем > имипенем > эртапенем • Альтернатива: ингибиторзащищенные бета-лактамы – Цефоперазон/сульбактам > пиперациллин/тазобактам • Адекватный режим дозирования: • Сульперазон 2 г 3 р/сут или 4 г 2 р/сут • Тазоцин 4, 5 г 3 -4 р/сут • Альтернатива: Тигециклин

Лечение БЛРС-инфекций карбапенемами снижает летальность в несколько раз Пятикратное снижение 14 -дневной летальности на терапии карбапенемами у пациентов с бактериемией, вызванной БЛРС-продуцентом (K. Pneumoniae) D. Paterson et al. , Clin. Infect. Dis 2004; 39; 31 -37

Резюме по антибактериальной активности карбапенемов • Энтеробактерии: E. coli, Klebsiella spp. , Proteus и др. Меропенем = дорипенем > имипенем = эртапенем • Acinetobacter baumannii Меропенем = дорипенем* = имипенем *НО! Для штаммов с МПК > 2 мкг/мл доза дори 1, 5 г/сут может оказаться недостаточной • P. aeruginosa Меропенем = дорипенем* >> имипенем

Сравнительные исследования оригинальных и воспроизведенных антибиотиков Фармакодинамическая/терапевтическая эквивалентность • Имипенем: Тиенам vs генерик – Тиенам = генерик по фармацевтическим показателям – Тиенам = генерик по значениям МПК и МБК – Тиенам достоверно превосходил генерик (P<0. 0001) в эффективности в ДС экспериментальной модели инфекции [Agudelo M, 48 th ICAAC, 2008, Abstr A-031] • Меропенем: Меронем vs генерик – Меронем = генерик по фармацевтическим, микробиологическим и фармацевтическим показателям (биоэквивалентность) – Меронем достоверно (P<0001) превосходил генерик по отношению доза – эффект в экспериментальной модели инфекции • Различия связаны с разной стабильностью к DHP-1 [Agudelo M, 49 th ICAAC, 2009, Poster 3279] 66

Антибиотики генерики – фактор риска летальности в ОРИТ при инфекциях, вызванных ацинетобактериями [Torres J, 49 th ICAAC, 2009, Poster K-312] • Проспективное, многоцентровое исследование • 10 больниц, 114 пациентов с НИ, вызванной Acinetobacter baumanii – >90% штаммов из крови и/или дыхательных путей – APACHE II > 15 баллов • Факторы риска летальности: – Лечение в государственной больнице – Лечение генерическими антибиотиками – Лечение генериками меропенема RR 95% CI 9. 4 5. 2 7. 3 2. 6 -33 2. 1 -12. 9 1. 9 -27. 5 67

Монобактамы /Азтреонам, Азтреабол/ • Узкий спектр – грам(-) аэробы, вкл. Ps. aeruginosa, продуцирующую металло-беталактамазы • Бактерицидный эф-т (нарушает образование клеточной стенки бактерий) • R – Acinetobacter, Stenotrophomonas maltophilia, Burkholderia cepacia, грам(+) кокки, анаэробы • Устойчив ко многим бета-лактамазам флоры грам(-) • Нет перекрестной аллергии с пенициллинами и ЦС

Монобактамы /Азтреабол/, показания • • • Госпитальная пневмония Интраабдоминальные инфекции Инфекции органов малого таза Инфекции МВП ИКМТ, костей и суставов Сепсис • В/м и в/в 1 – 2 г х 3 – 4 р/сут

Аминогликозиды Природная активность • Высокая: грам(-) бактерии • Умеренная: стафилококки • Слабая: энтерококки Природно устойчивы: • Стрептококки, пневмококки, анаэробы НЕ ПРОНИКАЮТ В ГНОЙ!!!

1 -кратное и 3 -кратное введение аминогликозидов Концентрация (мкг/мл) 14 однократное трехкратное 12 10 8 6 4 2 0 0 4 8 12 16 20 24 Часы Nicolau et al. Antimicrob Agents Chemother 1995; 39: 650– 655

Современное значение аминогликозидов в стационаре • Высокий уровень устойчивости Грам(-) возбудителей и низкая тканевая пенетрация лимитируют применение аминогликозидов в монотерапии (кроме инфекций мочевыводящих путей) • Данные клинических исследований и мета-анализов не подтверждают клинический синергизм между АГ и бета -лактамами/фторхинолонами • Комбинация амикацина и бета-лактамов тормозит формирование устойчивости Pseudomonas aeruginosa

Повышение безопасности – ключ к успеху новых аминогликозидов Ототоксичность Aminoglycoside toxicity - a review of clinical studies published between 1975 and 1982. Kahlmeter G, Dahlager JI.
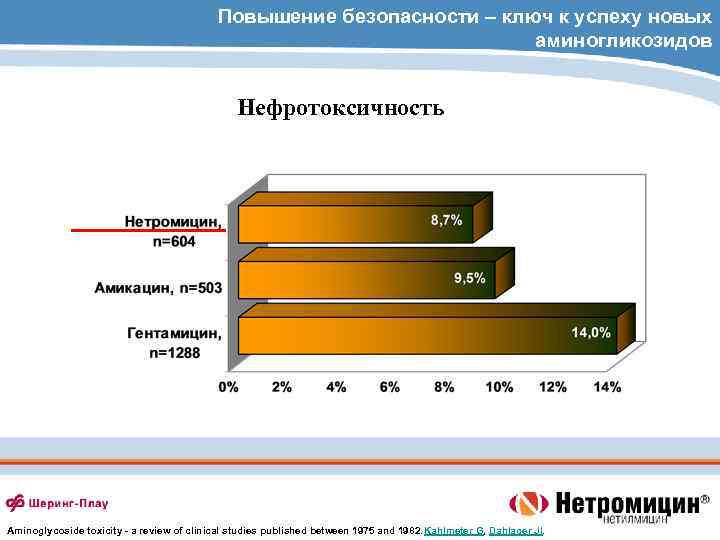
Повышение безопасности – ключ к успеху новых аминогликозидов Нефротоксичность Aminoglycoside toxicity - a review of clinical studies published between 1975 and 1982. Kahlmeter G, Dahlager JI.

Фторхинолоны • Ранние: ципрофлоксацин пефлоксацин • Новые: левофлоксацин против моксифлоксацин гемифлоксацин Преим. Грам(-) Ципро > Офло=Пефло Более высокая Грам(+) Клиническое применение Ранние госпитальные инфекции, осложненные обострения ХОБЛ инфекции МВП

Место новых фторхинолонов в стационаре Левофлоксацин, моксифлоксацинн • Более выраженная активность против пневмококков/стрептококков, стафилококков, энтерококков – Мокси >Лево – Резистентность Грам(+) минимальная • Более высокая эффективность по сравнению с ранними ФХ при инфекциях внебольничного происхождения – Одни из наиболее эффективных средств • Тяжелая внебольничная пневмония – Препараты выбора при потребности ИВЛ • Осложненные инфекции кожи и мягких тканей • Внебольничный перитонит • Неполная перекрестная резистентность Грам(-) возбудителей к ранним и новым фторхинолонам • Значение при госпитальных инфекциях дискутабельно

Левофлоксацин vs моксифлоксацин • Моксифлоксацин – выше активность против Streptococcus pneumoniae • Мокси - клинически эффективнее, чем лево при инфекции Str. pneumoniae с высоким уровнем МПК • Мокси - может быть эффективен при неуспехе терапии левофлоксацином

Авелокс (моксифлоксацин) Возможности использования в стационаре в современных условиях: Внебольничные инфекции • Тяжелая внебольничная пневмония • Внебольничный перитонит • Диабетическая стопа • Инфекционный эндокардит Госпитальные инфекции • Ранний послеоперационный перитонит • Госпитальная пневмония в отделениях • Ранняя ВАП • Медиастенит

Гликопептиды Ванкомицин • Природная активность – Грамположительные бактерии – Стафилококки, включая MRSA – Энтерококки, включая резистентные к пенициллинам • Резистентность – Энтерококки – VRE • В ОРИТ США 20 -30% • В Европе 2 -5% • В России – данные отсутствуют

65%

Доля MRSA штаммов в Европе, 2011 Antimicrobial resistance surveillance in Europe. Annual report of the European Antimicrobial Resistance Surveillance Network (EARS-Net) 2011 (www. ecdc. europa. eu)

Проблема MRSA в России • Доля MRSA штаммов среди S. aureus в последние годы постоянно увеличивается и в среднем составляет 65% (от 5 до 90%). • Инфекции, вызванные MRSA, имеют большое медицинское и социальное значение, так как сопровождаются более высокой летальностью и требуют больших материальных затрат на лечение. • MRSA помимо бета-лактамов, часто характеризуются устойчивостью к другим классам антибактериальных препаратов, в частности к аминогликозидам, макролидам, линкозамидам, фторхинолонам. Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации. Под редакцией академика РАН и РАМН В. С. Савельева. Российское общество хирургов. Российская ассоциация специалистов по хирургическим инфекциям. Альянс клинических химиотерапевтов и микробиологов. Межрегиональная ассоциация по клинической микробиологии и антимикробной химиотерапии. Ассоциация флебологов России. 2009 г. -89 с

Распространенность MRSA в стационарах РФ Проблема MRSA-инфекций наиболее актуальна в отделениях реанимации и интенсивной терапии, травматологии, ожоговой травмы, гнойной хирургии*. Этиология нозокомиальных инфекций в России Доля MRSA в зависимости от отделения (Dekhnich A. et all. , CMAK, 2011, vol. 13, № 4, p. 294 -304) Терапия Хирургия Травма ОРИТ Ожоги * Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации. Под редакцией академика РАН и РАМН В. С. Савельева. 2009 г. -89 с

Распространенность MRSA в стационарах РФ Проблема MRSA-инфекций наиболее актуальна в отделениях реанимации и интенсивной терапии, травматологии, ожоговой травмы, гнойной хирургии*. Этиология нозокомиальных инфекций в России Доля MRSA в зависимости от отделения (Dekhnich A. et all. , CMAK, 2011, vol. 13, № 4, p. 294 -304) Терапия Хирургия Травма ОРИТ Ожоги * Хирургические инфекции кожи и мягких тканей. Российские национальные рекомендации. Под редакцией академика РАН и РАМН В. С. Савельева. 2009 г. -89 с

Ванкомицин • Показания к применению – MRSA инфекции – Энтерококковые инфекции (Амп, Пен – R) • Режим дозирования: – в/в (60 -90 мин инфузия) по 1 г каждые 12 часов • «Проблемные» для ванкомицина локализации инфекций – Дыхательные пути, клапаны сердца, ЦНС • Снижение чувствительности MRSA (VISA) 15 – 20 мг/кг х 2 р/сут

Ванкомицин • «Проблемные» для ванкомицина локализации инфекций – Дыхательные пути, клапаны сердца, ЦНС • Концентрации ванкомицина в % от сывороточных: - легкие 11 – 17% - ликвор 0 – 18% - мышцы, кости 7 – 13%

Ванкомицин • При использовании в теч. 14 дней появляются штаммы со сниженной чувствительностью клинической эффективности в виде замедления улучшения или рецидива симптоматики – при сохранении симптоматики изменить режим дозирования: 500 мг каждые 6 ч

Условия безопасного применения ванкомицина • Использовать хроматографически очищенные препараты – эдицин, ванкомабол, ванкомицин-Тева • Медленная в/в инфузия (не менее 1 часа) • Коррекция гиповолемии, СН • Не комбинировать с ото- и нефротоксичными ЛС • Коррекция режима дозирования по клиренсу креатинина

Оксазолидиноны • Первый представитель класса – линезолид (зивокс) • Антимикробная активность - Грам(+), вкл. MRSA • Сохраняет активность в отношении ванкомицинрезистентных энтерококков (VRE) и стафилококков со сниженной чувствительность к ванкомицину (VISA) • Резистентных к линезолиду штаммов в РФ не выявлено • Возможность парентерального и перорального применения • Режим дозирования: 600 мг с интервалом 12 часов

Линезолид (Зивокс) • Препарат выбора при НПивл, вызванной MRSA – Превосходит ванкомицин по клинической эффективности в 3 раза – Летальность на фоне линезолида в 2, 2 раза ниже по сравнению с ванкомицином [M. Kollef e. a. ICM 2004; 30: 388 -94] • Препарат выбора при MRSA инфекциях кожи и мягких тканей – Клиническая эффективность выше ванкомицина на 10% – Эрадикация MRSA на 22% выше ванкомицина (Р<0. 0001) [Weigelt e. a. , 2003]

Линезолид (Зивокс) • Другие клинические ситуации, при которых назначение линезолида целесообразно: – Инфекционный эндокардит • Всегда сохраняется чувствительность к линезолиду – Бактериемия или тяжелый сепсис, вызванный Enterococcus faecium • Возможен клинический неуспех ванкомицина в случае резистентных штаммов – Предшествующего применения ванкомицина • Риск селекции ванкомицин-резистентных штаммов

Даптомицин (Кубицин) Новый класс антибиотиков – липопептид Новый механизм действия Активен против Грам(+) бактерий: MSSA + MRSA + VISA Enterococci + VRE Регистрация FDA (2003) и ЕС (2006) • осложненные инфекции Ки. МТ • стаф. бактериемия/эндокардит 2009: разрешено 2 -мин в/в введение Применяется 1 раз в сутки в дозе 4 или 6 мг/кг

Антимикробные свойства даптомицина (Кубицина) • Быстрое бактерицидное действие – В течение 1 часа – Дозозависимое – Сохраняется в стационарной фазе роста бактерий – Не сопровождается лизисом бактериальной клетки

Новые анти-MRSA препараты: Тигециклин (Тигацил, Wyeth) • Производное миноциклина • Эффективен при инфекциях кожи и мягких тканей и абдоминальных инфекциях, ВП • Дозирование: 50 мг * в/в каждые 12 часов * Первая доза 100 мг

Тигециклин: первый анти-MRSA антибиотик с широким спектром: возможность монотерапии? Анти-MRSA активность + Грам(+) Грам(-) VRE PRSP Enterobacteriaceae: ESBL, KPC Acinetobacter baumanii Stenothrophomonas maltophilia Анаэробы

Отличительные свойства тицециклина • Широкий спектр: Грам(+), Грам(-), анаэробы + Возможность эмпирической монотерапии • Активность против резистентных возбудителей: MRSA, БЛРС, Acinetobacter, Stenotrophomonas + Возможность эмпирической терапии нозокомиальных инфекций • Природная устойчивость P. aeruginosa – Ограничение для ОРИТ? • Хорошая тканевая и в/клеточная ФК: Тк/Сыв = 5 -10; Нейтрофилы >20 -30; АМ > 80. • Низкие концентрации в крови – Бактериемия? • Проявляет активность против микробов в биопленках

Зинфоро. TM – цефалоспорин с расширенной Грам+ активностью • Цефтаролин – антибиотик класса цефалоспоринов с in vitro активностью в отношении Грам-положительных и Грам-отрицательных микроорганизмов. Бактерицидное действие цефтаролина приводит к ингибированию биосинтеза клеточной стенки бактерий, за счет связывания с пенициллинсвязывающими белками (ПСБ). • Цефтаролин проявляет бактерицидную активность в отношении Staphylococcus aureus (включая MRSA) за счет высокой аффинности к ПСБ 2 a и в отношении Streptococcus pneumoniae (включая PNSP*) из-за высокого сродства к ПСБ 2 x**. * PNSP – пенициллин нечувствительный S. pneumoniae (резистентный + промежуточный) ** ПСБ – пенициллинсвязывающие белки Moisan H, Pruneau M, Malouin F. Binding of ceftaroline to penicillin-binding proteins of Staphylococcus aureus and Streptococcus pneumoniae. J Antimicrob Chemother. 2010; 65: 713 -716. Инструкция по медицинскому применению препарата Зинфоро™. Регистрационное удостоверение ЛП-001912.

Фосфомицин натрия (Урофосфабол) • Бактерицидный АБ • Медленное развитие резистентности • Широкий спектр, вкл. синегнойную палочку • Хорошее проникновение в ткани, биопленки • Синергизм, кроме ципрофлоксацина и цефтазидима в отношении P. aeruginosa • Антагонизм с рифампицином • Синергизм для MRSA и MRSE с оксациллином, ЦС, имипенемом, ванкомицином • Синергизм в отношении энтерококков с ампициллином

Фосфомицин натрия (УРОФОСФАБОЛ) • Активен против БЛРС-продуцентов, ФХрезистентных уропатогенов, Ps. aeruginosa (в комбинации с бета-лактамами, в/в) • Суточная доза 3 – 6 г/сут, при синегнойной инфекции до 12 г/сут

Урофосфабол, показания ¨ Инфекции любой локализации, вкл. • • • Сепсис MRSA-инфекции (+ ванкомицин) Инфекционный эндокардит Бактериальный менингит Нейтропения Полирезистентные штаммы синегнойной палочки

Урофосфабол, неантибактериальные свойства • Способность проникать в биопленки • Стимуляция фагоцитоза • Иммуномодулирующий эффект • Предупреждение ото- и нефротоксичности (АГ, ванкомицин, амфотерицин В)

Метронидазол • Спектр активности – только анаэробы • Не применять вместе с ингибиторзащищенными АМП (амоксиклав, трифамокс, сульперазон, тиментин, тазоцин) анаэроцефом карбапенемами моксифлоксацином (авелокс) ? ? ?

Проблема резистентности анаэробов • Карбапенемы 1 – 2% • Амоксиклав 3 – 7% • Цефокситин (Анаэроцеф) 6% • Метронидазол 5 – 10% • Клиндамицин 10 – 30% (в РФ 25%) • Моксифлоксацин > 10% (госпитальные инфекции – 25%)

Полимиксин В (Вилимиксин) • Эффективен в отношении грам(-) бактерий со множественной лекарственной устойчивостью: P. aeruginosa, Acinetobacter spp. , Klebsiella spp. , E. coli, Citrobacter • 1, 5 – 2, 5 мг/кг в сутки, в 2 приема 104

Полимиксин В (Вилимиксин), лекарственные взаимодействия • • Полимиксин + Имипенем + Рифампицин + Азитромицин • Синергизм в отношении R синегнойной палочки • Азитромицин позволяет снизить дозу полимиксина 105

Макролиды • Бактериостатики • При аллергии на β-лактамы • Постантибиотический, иммуномодулирующий эффекты (14 - и 15 членные макролиды) • Разрушение биопленок

Рекомендуется ограничить использование • Эритромицин - эффективная доза 2 г/сут в 100% тошнота, рвота невозможность продолжения терапии



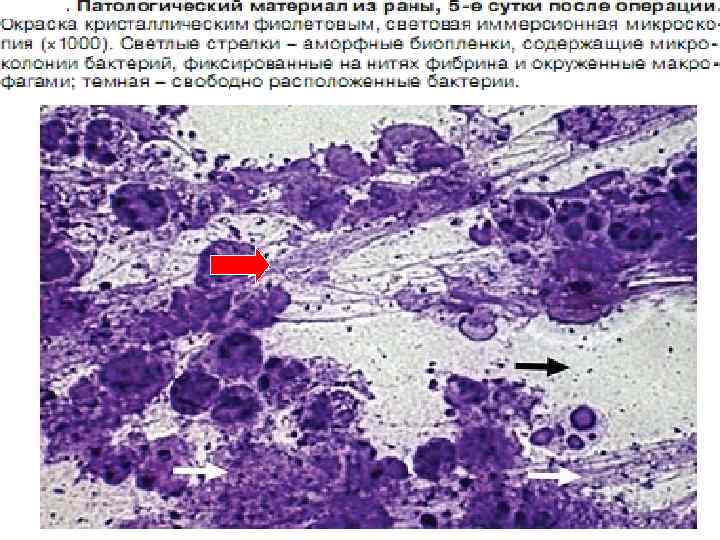

Клацид проникает в биопленки



Часть 3 Интраабдоминальные инфекции

Интраабдоминальные инфекции • Инфекции печени и желчевыводящих путей • Инфекции поджелудочной железы • Абсцесс селезенки • Аппендицит • Перитонит

Характеристика интраабдоминальных инфекций • Полимикробная этиология: аэробы + анаэробы • Сложно выделить ведущего возбудителя • Эмпирическая терапия является определяющей

Что определяет выбор режима эмпирической антибактериальной терапии? • Условие возникновения инфекции – Внебольничная или госпитальная • Локализация инфекции – Превалирующие возбудители • Факторы риска резистентных возбудителей – Предшествующая АБТ/госпитализация • Тяжесть пациента – Эскалация или де-эскалация • Тканевая ФК (+дозирование)

Абсцесс печени Выбор: • Амо/кк 1, 2 г х 3 р/сут • Цефепим, изодепом 1 – 2 г х 2 р/сут + метронидазол в/в 0, 5 г х 3 р/сут • Левофлоксацин 0, 5 г х 1 -2 р/сут в/в + метронидазол в/в Альтернатива: • • • Пип/таз 4, 5 г х 3 -4 р/сут Цп/сб 2 -4 г х 2 р/сут Эртапенем 1 г х 1 р/сут Имипенем 0, 5 г х 4 р/сут Меропенем 1 г х 3 р/сут Моксифлоксацин 0, 4 г х 1 р/сут

Холангит, холецистит, билиарный сепсис Выбор: • Тик/кк 3, 2 г х 3 -4 р/сут • Пип/таз 4, 5 г х 4 р/сут • Эртапенем 1 г х 1 р/сут • Имипенем 0, 5 г х 4 р/сут • Меропенем 1 г х 3 р/сут Альтернатива: • ЦС III-IV 2 г х 3 р/сут + метронидазол 0, 5 г х 3 р/сут • Ципрофлоксацин 400 мг х 2 -3 р/сут + ванко + метронидазол • Моксифлоксацин 0, 4 г х 1 р/сут • Азтреонам 1 -2 г х 2 -4 р/сут + ванко + метро

Абсцесс селезенки Выбор: • Эртапенем 1 г х 1 р/сут в/в • Амо/кк 1, 2 г х 3 р/сут в/в • Амо/сб в/в 1 г (по амоксициллину) х 3 р/сут Альтернатива: • Пип/таз 4, 5 г х 3 -4 р/сут в/в • Цефепим 2 г х 2 р/сут или цефотаксим 2 г х 3 р/сут или левофлоксацин 0, 5 г х 1 -2 р/сут + метронидазол 0, 5 г х 3 р/сут • Моксифлоксацин 0, 4 г х 1 р/сут в/в

Аппендикулярный инфильтрат • Амо/кк 1, 2 г х 3 р/сут • Амо/сб 1, 5 г х 3 р/сут • Цефепим, цефпиром 2 г х 2 р/сут + метронидазол 0, 5 г х 3 р/сут • Эртапенем 1 г х 3 р/сут • Имипенем 0, 5 г х 4 р/сут • Меропенем 1 г х 3 р/сут

Острый панкреатит • У 20% госпитализированный пациентов с острым панкреатитом развивается некроз поджелудочной железы – 30 -70% случаев пакреонекроза осложняется инфекцией • Летальность увеличивается в 3 раза Qamruddin & Chadwick, J Hosp Inf 2000; 44: 245 -53

Что можно считать доказанным • Полное энтеральное питание является более эффективным, чем полное парентеральное питание при тяжелом панкреатите (A). • Неотложная эндоскопическая ретроградная холангиопанкреатография показана пациентам с наличием или риском билиарного сепсиса или обструкции, холангита, нарастающей или персистирующей желтухе (A). • Эндоскопическая ретроградная холангиопанкреатография позволяет выявлять редкие причины панкреатита (дисфункция сфинтера Oddi, разрыв поджелудочной железы, стриктура панкреатического протока) (C). • КТ с контрастированием позволяет диагностировать острый панкреатит (C). • Противоречия в оценке роли АБТ в выживаемости больных панкреонекрозом (B). Am Fam Physician. 2007; 75: 1513 -1520.

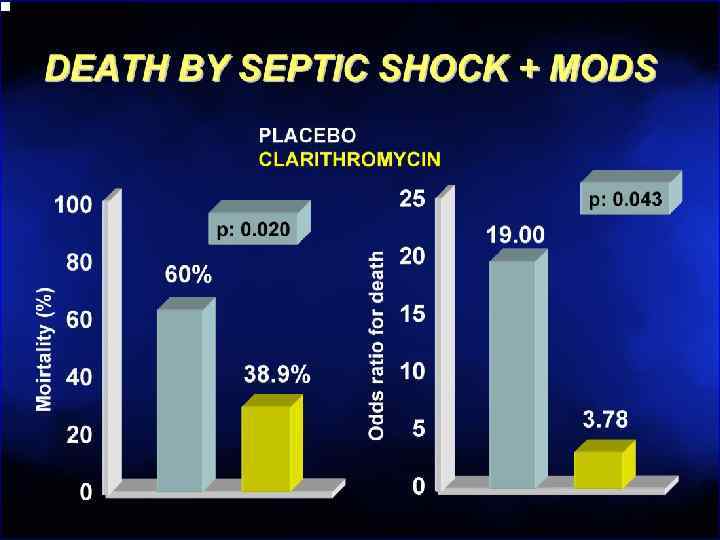
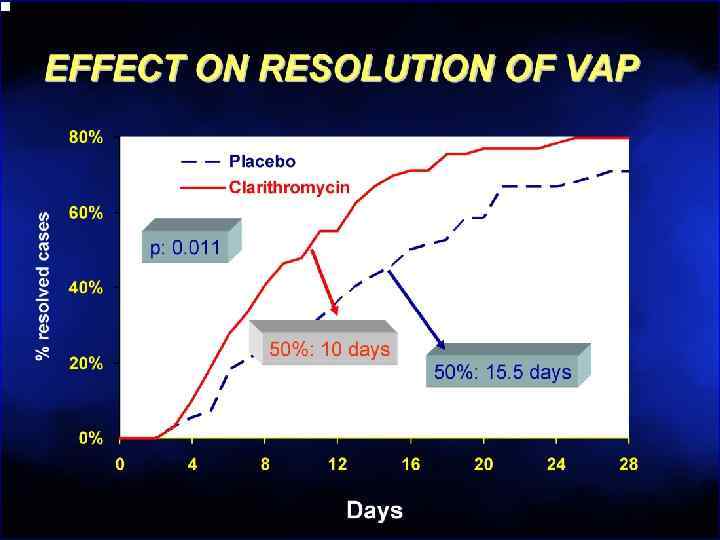
Острый деструктивный панкреатит • Ранняя эмпирическая антибактериальная терапия улучшает выживаемость и снижает частоту инфицирования Bassi C, e. a. Cochrane Database Syst Rev. 2003; (4): CD 002941 Bosscha K, e. a. Ned Tijdschr Geneeskd 2001; 145(41): 1982 -5 • Доказательных данных в пользу рутинного назначения системных антимикотиков не получено De. Waele J, e. a. Clin Infect Dis 2003; 37(2): 208 -13

Инфекции поджелудочной железы Выбор: • Имипенем 0, 5 г х 4 р/сут • Меропенем 1 г х 3 р/сут Альтернатива: • ЦП/СБ 4 г х 2 р/сут • Цефоперазон 2 -4 г х 2 -3 р/сут или цефепим 2 г х 3 р/сут или левофлоксацин 0, 5 г х 2 р/сут или ципрофлоксацин 0, 6 г х 2 р/сут + МЕТРО
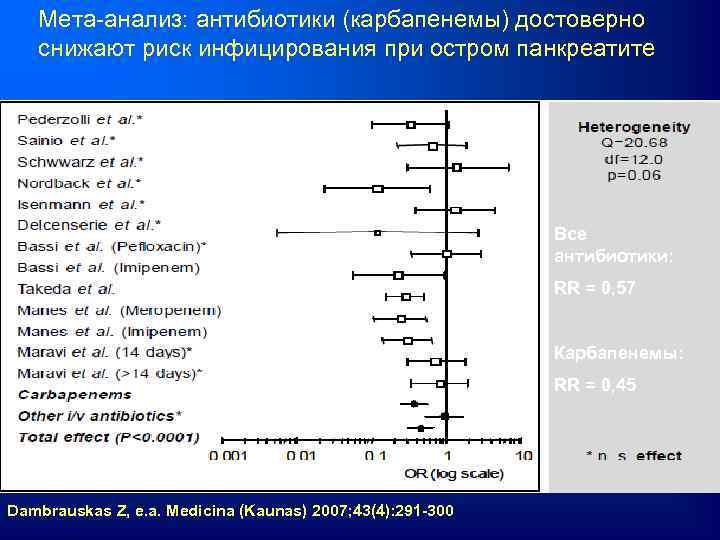
Мета-анализ: антибиотики (карбапенемы) достоверно снижают риск инфицирования при остром панкреатите Все антибиотики: RR = 0, 57 Карбапенемы: RR = 0, 45 Dambrauskas Z, e. a. Medicina (Kaunas) 2007; 43(4): 291 -300
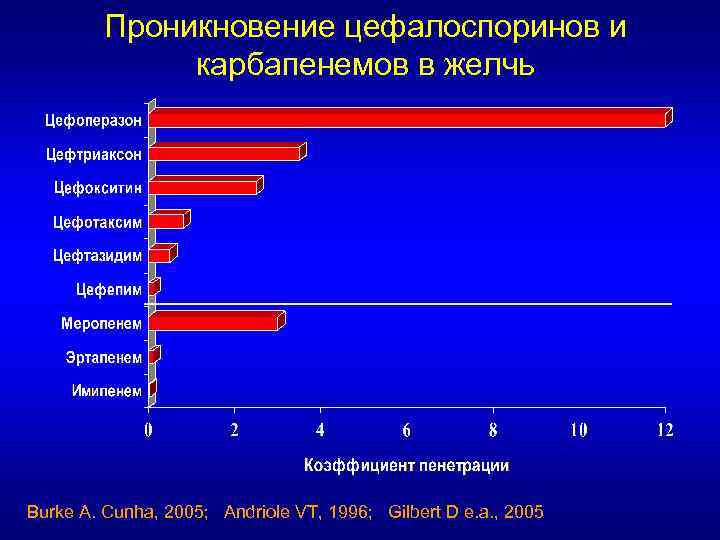
Проникновение цефалоспоринов и карбапенемов в желчь Burke A. Cunha, 2005; Andriole VT, 1996; Gilbert D e. a. , 2005
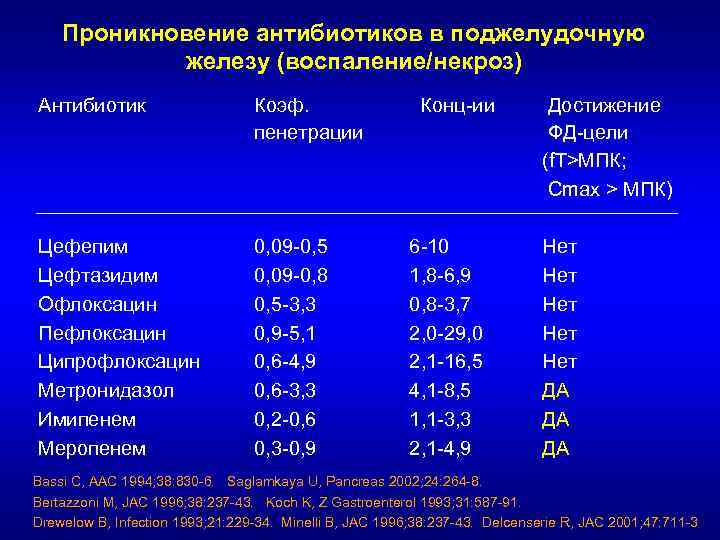
Проникновение антибиотиков в поджелудочную железу (воспаление/некроз) Антибиотик Коэф. пенетрации Цефепим Цефтазидим Офлоксацин Пефлоксацин Ципрофлоксацин Метронидазол Имипенем Меропенем 0, 09 -0, 5 0, 09 -0, 8 0, 5 -3, 3 0, 9 -5, 1 0, 6 -4, 9 0, 6 -3, 3 0, 2 -0, 6 0, 3 -0, 9 Конц-ии 6 -10 1, 8 -6, 9 0, 8 -3, 7 2, 0 -29, 0 2, 1 -16, 5 4, 1 -8, 5 1, 1 -3, 3 2, 1 -4, 9 Достижение ФД-цели (f. T>МПК; Cmax > МПК) Нет Нет Нет ДА ДА ДА Bassi C, AAC 1994; 38: 830 -6. Saglamkaya U, Pancreas 2002; 24: 264 -8. Bertazzoni M, JAC 1996; 38: 237 -43. Koch K, Z Gastroenterol 1993; 31: 587 -91. Drewelow B, Infection 1993; 21: 229 -34. Minelli B, JAC 1996; 38: 237 -43. Delcenserie R, JAC 2001; 47: 711 -3

При остром панкреатите необходимо профилактическое применение АБ, т. к. • смертность на 68% • частота инфекций других локализаций на 53% • необходимость оперативного лечения на 45% • Но! Частота присоединения грибов на 17%

Применение антибиотиков с профилактической целью при панкреонекрозе • Профилактика инфицирования поджелудочной железы при панкреонекрозе – метанализ 4 рандомизированных проспективных плацебо-контролированных исследований – 142 пациента получали АБ, 132 – плацебо – АБ/плацебо – снижение риска: • инфекции на 22% • сепсиса на 35% • смерти на 62% • Заключение: профилактическое применение АБ у пациентов с панкреонекрозом оправдано Mandell et al. Am J Gastroenterol. 2004; 99: S 48.

Основной вопрос, определяющий тактику АБТ, где возникла абдоминальная инфекция? • Внебольничные абдоминальные инфекции – Первичный перитонит – Вторичный перитонит • Нозокомиальный перитонит – Вторичный перитонит (послеоперационный) – Третичный перитонит

Первичный перитонит, этиология • E. coli, streptococci • На диализе определяющие возбудители – стафилококки • Не значимы анаэробы

Вторичный внебольничный перитонит, этиология • E. coli, streptococci + анаэробы

Вторичный послеоперационный перитонит, этиология • Enterobacteriaceae (r – R) + анаэробы - В случае предшествующей антибактериальной терапии: • Enterobacteriaceae R + энтерококки + анаэробы • После релапаротомий присоединяются энтерококки

Третичный перитонит, этиология • Низковирулентные микроорганизмы: КНС + грибы • Enterobacter spp. , Pseudomonas spp.

Первичный перитонит Выбор: • Эртапенем 1 г х 1 р/сут в/в • ПИП/ТАЗ 4, 5 г х 3 -4 р/сут в/в • АМО/КК 1, 2 г х 3 р/сут • АМО/СБ 1 г (по АМО) х 3 р/сут в/в • Моксифлоксацин 0, 4 г х 1 р/сут в/в Альтернатива: • Цефтриаксон 2 г х 1 р/сут или цефотаксим 2 г х 3 р/сут в/в или цефепим 2 г х 2 р/сут или левофлоксацин 0, 5 г х 1 -2 р/сут + МЕТРОНИДАЗОЛ

Вторичный внебольничный перитонит Выбор: • Эртапенем 1 г х 1 р/сут в/в • ПИП/ТАЗ 4, 5 г х 3 -4 р/сут в/в • АМО/КК 1, 2 г х 3 р/сут • АМО/СБ 1 г (по АМО) х 3 р/сут в/в • Моксифлоксацин 0, 4 г х 1 р/сут в/в Альтернатива: • Цефтриаксон 2 г х 1 р/сут или цефотаксим 2 г х 3 р/сут в/в или цефепим 2 г х 2 р/сут или левофлоксацин 0, 5 г х 1 -2 р/сут или ципрофлоксацин 0, 6 г х 2 р/сут в/в + МЕТРОНИДАЗОЛ • Имипенем 0, 5 г х 4 р/сут • Меропенем 1 г х 3 р/сут

Вторичный нозокомиальный перитонит Выбор: • • Имипенем 1 г х 4 р/сут Меропенем 1 г х 3 р/сут Эртапенем 1 г х 1 р/сут в/в ПИП/ТАЗ 4, 5 г х 4 р/сут в/в ЦП/СБ 4 г х 2 р/сут Альтернатива: Цефепим 2 г х 3 р/сут или цефтазидим 2 г х 3 р/сут или левофлоксацин 0, 5 г х 1 -2 р/сут или ципрофлоксацин 0, 6 г х 2 р/сут + МЕТРОНИДАЗОЛ

Обязательно ли «перекрытие» энтерококков?

Исходы внебольничных абдоминальных инфекций не улучшаются при добавлении антиэнтерококковых препаратов – категория доказательности А-1 [IDSA Guidelines, CID 2003; 37: 997]

Факторы риска энтерококков при абдоминальных инфекциях Факторы Послеоперационный перитонит APACHE II >12 [Sitges-Serra A e. a. Br J Surg 2002; 89: 361 -7] Дополнительные факторы: Пожилой возраст Абсцессы Р 0. 006 0. 04

Антибиотики, клинически эффективные против Enterococcus faecalis • Бета-лактамы (при чувствительности к ампициллину) – Ампициллин не менее 8 г/сут, ампициллин/сульбактам, коамоксиклав – пиперациллин/тазобактам, имипенем – NB! При устойчивости к Амп – устойчивость ко всем бета-лактамам • Ванкомицин (+ E. faecium) • Фторхинолоны – левофлоксацин (0, 75 -1 г) – моксифлоксацин • Линезолид • Даптомицин • Тигециклин + E. faecium, + VRE

Часть 4 Инфекции кожи и мягких тканей

Первичные ИКМТ • • • Фурункул, карбункул, гидраденит Паронихия Импетиго Акне (угри) Рожистое воспаление Целлюлит

Вторичные ИКМТ • • • Болезнь кошачьей царапины Диабетическая стопа Мастит Пиомиозит Пролежни Инфицированные раны Инфицированные ожоги Послеоперационные раневые инфекции Укушенные раны Эритразма Столбняк

Некротизирующие ИКМТ • Газовая гангрена и инфекционный мионекроз • Некротизирующий фасциит и синергидная гангрена

Фурункул, карбункул, гидраденит • Возбудитель: S. aureus Местно: мупироцин (Бактробан) Системно: • АМО/КК 1 г х 2 р/сут внутрь • Моксифлоксацин 0, 4 г х 1 р/сут • Оксациллин в/м 1 г х 4 р/сут • Цефазолин в/в 1 г х 3 р/сут

Рожистое воспаление • Возбудители: стрептококки группы А (Str. pyogenes), В (S. agalactiae), С, G • Амоксициллин внутрь 0, 5 – 1 г х 3 р/сут • АМО/КК 1, 2 г х 3 р/сут в/в • АМО/СБ 1, 5 г х 3 р/сут per os, в/в, в/м • Альтернатива: левофлоксацин, моксифлоксацин, макролиды, ванкомицин, линезолид, даптомицин +++

Целлюлит • Возбудители: Str. pyogenes, S, aureus • АМО/КК внутрь 1 г х 2 р/с, в/в 1, 2 г х 3 р/с • АМО/СБ внутрь, в/в, в/м 1, 5 г х 3 р/с • Цефазолин в/в, в/м 1 г х 3 р/с Альтернатива: • Левофлоксацин внутрь, в/в 0, 5 г х 1 – 2 р/с • Моксифлоксацин внутрь, в/в 0, 4 г х 1 р/с

Болезнь кошачьей царапины • Возбудители: различные виды бартонелл • Выздоровление часто без АБ-терапии • Азитромицин 1 -й день 0, 5 г, 2 – 5 -й дни 0, 25 г х 1 р/с

Диабетическая стопа Этиология полимикробная: • S. aureus, в т. ч. MRSA • Str. pyogenes • Enterococcus spp. • P. aeruginosa • Enterobacteriaceae • Анаэробы

Язва без воспаления • Колонизация флорой с кожи • АБ не требуются

Диабетическая стопа, легкое течение: Язва с поверхностным воспалением < 2 см • S. aureus, в т. ч. MRSA • Str. agalactiae (группа В) • Str. pyogenes (группа А) • АМО/КК 1 г х 2 р/с внутрь • Левофлоксацин 0, 5 г х 1 р/с внутрь • Моксифлоксацин 0, 4 г х 1 р/с внутрь • Альтернатива: бисептол 0, 96 г х 2 р/с внутрь

Диабетическая стопа, среднетяжелое течение: Язва с воспалением > 2 см с распространением до фасции • S. aureus, в т. ч. MRSA • Str. agalactiae (группа В) • Str. pyogenes (группа А) • • + энтеробактерии АМО/КК 1 г х 2 р/с внутрь или 1, 2 г х 3 р/с в/в АМО/СБ внутрь, в/в, в/м 1, 5 г х 3 р/с Левофлоксацин 0, 5 г х 1 р/с внутрь Моксифлоксацин 0, 4 г х 1 р/с внутрь Эртапенем 1 г х 1 р/с в/в, в/м Фосфомицин 1 -2 г 3 р/с + азтреонам 1 г 3 р/с Цефотаксим 2 г 3 р/с + метронидазол в/в 0, 5 г 3 р/с Цефтриаксон 2 г 1 р/с + метронидазол в/в 0, 5 г 3 р/с

Диабетическая стопа, тяжелое течение: широкое локальное воспаление + общая интоксикация • • • Имипенем 0, 5 г х 4 р/с в/в Меропенем 1 г х 3 р/с в/в Эртапенем 1 г х 1 р/с в/в Дорипенем 0, 5 г х 3 р/с в/в ПИП/ТАЗ 4, 5 г х 3 – 4 р/с Левофлоксацин 0, 5 г х 2 р/с в/в • ± ванкомицин в/в 15 – 20 мг/кг 2 р/с или • Линезолид в/в, внутрь 0, 6 г х 2 р/с или • Даптомицин в/в 6 мг/кг х 1 р/с

Остеомиелит у больных с диабетической стопой • Чаще полирезистентная флора • АБ-терапия после получения результата бак. посева • Эмпирически: антисинегнойные карбапенемы или азтреонам + ванкомицин

Мастит послеродовый • S. aureus, в т. ч. MRSA • Значительно реже: S. pyogenes, Bacteroides spp. , E. coli, Corinebacterium spp. , CNS • • Оксациллин в/м, в/в 2 г х 4 р/с Цефазолин в/м, в/в 1 -2 г х 3 р/с АМО/КК в/в 1, 2 г х 3 р/с или per os 1 г х 2 р/с АМО/СБ в/в, в/м 1, 5 г х 3 р/с

Мастит послеродовый, альтернативная АБ-терапия В случае резистентных к оксациллину стафилококков: • Ванкомицин в/в 15 мг/кг х 2 р/с • Линезолид в/в, per os 0, 6 г х 2 р/с • Даптомицин в/в 6 мг/кг х 1 р/с или

Мастит, не связанный с родами • S. aureus, бактероиды, пептококки • АМО/КК в/в 1, 2 г х 3 р/с или per os 1 г х 2 р/с • АМО/СБ в/в, в/м 1, 5 г х 3 р/с • Фосфомицин натрия (урофосфабол) 1 -2 г х 3 р/с

Пролежни • Полимикробная этиология: Энтеробактерии + псевдомонады + S. aureus + анаэробы • • Цефепим 1 -2 г х 2 р/с + метронидазол в/в 0, 5 г х 3 р/с Урофосфабол 1 -2 г х 3 р/с + ЦП/СБ 2 г х 2 р/с Левофлоксацин per os, в/в 0, 5 -0, 75 г х 1 р/с + метро. Моксифлоксацин 0, 4 г х 1 р/с + азтреонам 1 г х 3 р/с

Пролежни, альтернативная АБ-терапия • • • АМО/КК в/в 1, 2 г х 3 р/с или per os 1 г х 2 р/c ПИП/ТАЗ в/в 4, 5 г х 3 – 4 р/с Имипенем в/в 0, 5 г х 4 р/с Меропенем в/в 1 г х 3 р/с Эртапенем в/в 1 г х 1 р/с Дорипенем 0, 5 г х 3 р/с

Раны инфицированные, нетяжелое течение • Полимикробная этиология: S. aureus, в т. ч. MRSA, S. pyogenes, энтеробактерии, псевдомонады + анаэробы • При необходимости – специфическая профилактика столбняка • Местно: банеоцин мазь, порошок, повязки с АБ • АМО/КК в/в 1, 2 г х 3 р/с или per os 1 г х 2 р/c • АМО/СБ per os, в/в, в/м 1, 5 г х 3 р/с • Моксифлоксацин per os, в/в 0, 4 г х 1 р/с

Раны инфицированные с лихорадкой, сепсисом • • ПИП/ТАЗ в/в 4, 5 г х 3 – 4 р/с Имипенем в/в 0, 5 г х 4 р/с Меропенем в/в 1 г х 3 р/с Эртапенем в/в 1 г х 1 р/с Дорипенем 0, 5 г х 3 р/с ЦП/СБ 4 г х 2 р/с + урофосфабол 2 г х 3 р/с Левофлоксацин 0, 5 г х 1 -2 р/с или цефепим 2 г х 3 р/с + метронидазол 0, 5 г х 3 р/с + азтреонам 1 -2 г х 3 р/с

Инфицированные ожоги • Полимикробная этиология: S. aureus, в т. ч. MRSA, S. pyogenes, энтеробактерии, псевдомонады • Местно: банеоцин мазь, порошок, повязки с АБ • Цефепим в/в 2 г х 2 -3 р/с ± урофосфабол 1 -2 г х 3 р/с • Цефтазидим в/в 1 -2 г х 3 р/с + цефазолин 2 г х 3 -4 р/с • Левофлоксацин в/в, внутрь 0, 5 г х 1 -2 р/с ± азтреонам 1 -2 г х 3 р/с • Карбапенемы • ПИП/ТАЗ в/в 4, 5 г х 3 – 4 р/с

Послеоперационные раны без сепсиса (кроме операций на ЖКТ и гинекологических) • S. aureus, в т. ч. MRSA, S. pyogenes, энтеробактерии, псевдомонады • • АМО/КК в/в 1, 2 г х 3 р/с или per os 1 г х 2 р/c АМО/СБ в/в, в/м 1, 5 г х 3 р/с Фосфомицин натрия (урофосфабол) 1 -2 г х 3 р/с Левофлоксацин 0, 5 г х 1 -2 р/с

Послеоперационные раны с сепсисом • Имипенем в/в 2 – 4 г/сут • Меропенем 1 г х 3 р/сут • Дорипенем 0, 5 г х 3 р/сут • ПИП/ТАЗ 4, 5 г х 3 – 4 р/сут ± Амикацин в/в 15 -20 мг/кг х 1 р/сут

Раны после операций на ЖКТ и гинекологических • Enterococcus spp. + анаэробы, Enterobacteriaceae, стрептококки • • • ПИП/ТАЗ в/в 4, 5 г х 3 – 4 р/сут АМО/КК в/в 1, 2 г х 3 р/с Эртапенем в/в 1 г х 1 р/с Моксифлоксацин в/в 0, 4 г х 1 р/с ЦП/СБ в/в 2 г х 2 р/с

Укусы человека и животных • Полимикробная этиология: грам (+), грам (-), анаэробы • Укус свиньи – более тяжелое течение • АМО/КК в/в 1, 2 г х 3 р/с или per os 1 г х 2 р/c • АМО/СБ per os, в/в, в/м 1, 5 г х 3 р/с • Моксифлоксацин per os, в/в 0, 4 г х 1 р/с

Укусы змей • Псевдомонады, энтеробактерии, клостридии • Цефепим 1 г х 2 р/с в/в • Азтреонам 1 г х 3 р/с в/в

Газовая гангрена и инфекционный мионекроз • Клостридии (чаще C. perfringes) • АМО/КК в/в 1, 2 г х 3 р/с • ПИП/ТАЗ 4, 5 г х 4 р/с • Эртапенем в/в 1 г х 1 р/с

Фасциит некротизирующий • S. aureus, в т. ч. MRSA, S. pyogenes, Clostridium spp. , другие анаэробы • АМО/КК в/в 1, 2 г х 3 р/с • ПИП/ТАЗ 4, 5 г х 4 р/с • Эртапенем в/в 1 г х 1 р/с

Гангренозный крепитирующий целлюлит • S. pyogenes, анаэробы • АМО/КК в/в 1, 2 г х 3 р/с • ПИП/ТАЗ 4, 5 г х 4 р/с • Эртапенем в/в 1 г х 1 р/с

Синергидный некротизирующий целлюлит • Enterobacteriaceae + анаэробы • АМО/КК в/в 1, 2 г х 3 р/с • ПИП/ТАЗ 4, 5 г х 4 р/с • Эртапенем в/в 1 г х 1 р/с • При отсутствии эффекта – антисинегнойные карбапенемы: имипенем или меропенем или дорипенем

Сепсис у взрослых

Dellinger et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2008. Crit Care Med. 2008; 36(1): 296 -327. • 1. АБТ в/в как можно раньше, в первый час после диагностики СШ (1 B) и тяжелого сепсиса (1 D). Необходимо сделать правильный посев до начала АБТ, однако это не должно задерживать начало АБТ (1 D). • 2 a. Эмпирическая АБТ должна включать один или несколько препаратов активных против предполагаемого возбудителя (бактерии, грибы) и пенетрировать в адекватной концентрации в источник сепсиса (1 B). – Широкий спектр, преодоление основных механизмов резистентности • 2 b. Рекомендуется ежедневно рассматривать возможность оптимизации режима АБТ для повышения активности, профилактики распространения резистентности, снижения токсичности и затрат (grade 1 C).

Dellinger et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2008. Crit Care Med. 2008; 36(1): 296 -327. • 2 c. Комбинированная терапия при наличии или подозрении инфекции Pseudomonas sp. При тяжелом сепсисе (2 D). • 2 d. Комбинированная терапия у нейтропенических больных (2 D). • 2 e. Эмпирическая терапия тяжелого сепсиса должна быть комбинированной не более 35 суток. Деэскалация терапии должна проводиться как можно раньше с учетом чувствительности флоры (2 D).

Dellinger et al. Surviving Sepsis Campaign: International Guidelines for Management of Severe Sepsis and Septic Shock: 2008. Crit Care Med. 2008; 36(1): 296 -327. • 1. рекомендуется продолжительность АБТ 7 -10 суток; более продолжительное лечение требуется при низкой клинической эффективности, невозможности адекватного дренирования источника инфекции, иммунологической недостаточности/нейтропении (1 D). • 2. Если клинические симптомы связаны с неинфекционными причинами АБТ должна быть прекращена для профилактики последующих инфекций, вызванных резистентной флорой или развития побочных реакций (1 D).
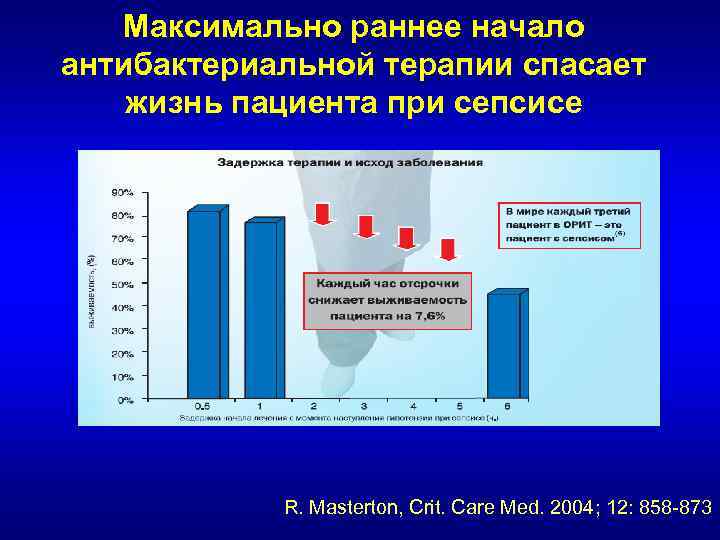
Максимально раннее начало антибактериальной терапии спасает жизнь пациента при сепсисе R. Masterton, Crit. Care Med. 2004; 12: 858 -873

Неизвестный источник, внебольничный характер инфекции • Грам (+) кокки, грам (-) палочки, Bacteroides spp. • Цефепим в/в 2 г х 3 р/с + метронидазол в/в 0, 5 г х 3 р/с • Эртапенем в/в 1 г х 1 р/с • АМО/КК в/в 1, 2 г х 3 р/с • ПИП/ТАЗ 4, 5 г х 4 р/с

Брюшная полость • Лечение как при перитоните • Предпочтительно антисинегнойный карбапенем (меропенем, дорипенем или имипенем) + ванкомицин

В/в катетер • S. epidermidis, S. aureus • Реже – Candida spp. • Ожоги, нейтропения, иммунодефицит вторичный – грам (-) энтеробактерии, вк. синегнойную палочку

Легкие • Антисинегнойный карбапенем или ПИП/ТАЗ • при подозрении на стафилококки + линезолид 0, 6 г х 2 р/с в/в • при подозрении на легионеллез + левофлоксацин 0, 5 г х 2 р/с в/в


АБ в хирургии для кафедры ЧелГМА 09.2014.pptx